Синтез тиазоловых и сульфаниламидных производных с использованием фосфорсодержащих реагентов
УДК 547.(721+861+863.1+789.1+821.2) На правах рукописи
СУЛТАНОВА ЛИЛИЯ МИНУЛЛОВНА
Синтез тиазоловых и сульфаниламидных производных
с использованием фосфорсодержащих реагентов
02.00.03 – Органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
 |
Республика Казахстан
Караганда, 2010
Работа выполнена в ТОО «Институт органического синтеза и углехимии
Республики Казахстан» и Карагандинском государственном университете
имени академика Е.А. Букетова
Научные руководители: доктор химических наук,
профессор Фазылов С.Д.
доктор химических наук,
профессор Салькеева Л.К.
Официальные оппоненты: доктор химических наук,
Калугин С.Н.
кандидат химических наук,
доцент Сиволобова О.А.
Ведущая организация: Алматинский технологический
университет
Защита состоится 2 октября 2010 года в 1400 часов на заседании диссертационного совета ОД 14.07.01 при Карагандинском государственном университете имени Е.А. Букетова по адресу: 100028, г. Караганда, ул. Университетская, 28, химический факультет, актовый зал.
С диссертацией можно ознакомиться в библиотеке Карагандинского государственного университета имени Е.А. Букетова.
Автореферат разослан 28 августа 2010 года
| Ученый секретарь диссертационного совета ОД 14.07.01, доктор химических наук, профессор |  | Байкенов М.И. |
ВВЕДЕНИЕ
Актуальность исследования. Развитие фундаментальных исследований в органической химии является основой создания новых методов тонкого органического синтеза, на которых базируется производство оригинальных конкурентноспособных лекарственных препаратов. Актуальность этой проблемы отражена в выступлении Президента РК Н.А.Назарбаева «Новое десятилетие – новый экономический подъем – новые возможности» (2010), в которой была озвучена программа подъема до конца 2014 г. фармацевтической индустрии страны и доведения рынка продукции собственными лекарственными препаратами до 50% от их общего числа. В достаточной степени надежным путем создания новых биологически активных веществ, приводящим к ценным продуктам с высокой степенью вероятности, является модификация соединений с заведомо обладающих тем или иным видом биологической активности. Изученные в диссертационной работе классы органических соединений представляют огромный научный и практический интерес. Успехи современной медицины в лечении инфекционных заболеваний во многом достигнуты благодаря применению антибиотиков группы тиазола и сульфаниламида.
В настоящее время в связи с появлением новых видов вирусных заболеваний («атипичная пневмония», «птичий грипп», «спид», теперь и «свиной грипп») интерес специалистов к поиску новых антибактериальных соединений в ряду вышеуказанных соединений все более возрастает вследствие их широкого спектра антибактериальных свойств. Несмотря на то, что описанные классы органических соединений широко применяются в течение многих лет, усовершенствование методов их синтеза является одним из проблемных направлений в тонком органическом синтезе. Это связано с имеющимися недостатками в способах их получения: многостадийность, сложное аппаратное оформление, использование токсичных и требующих утилизации растворителей, высокая энергоемкость. По этой причине, большой интерес представляют применение методов микроволновой активации в синтезе этих соединений, который позволит разработать экологически безопасные и экономически эффективные методы их синтеза.
Степень разработанности проблемы. Обширные сведения о синтезе, строении и биологической активности производных тиазолов и сульфаниламидов в разное время освещены в работах отечественных и зарубежных авторов, как: В.В.Негребецкий, Л.В.Разводская, Б.С.Драч, А.Ф.Прокофьева, N.D.Dawson, D.Hoppe, О.Ю.Магидсон, М.В.Рубцов и др. Создание и химическая модификация новых производных тиазола и сульфаниламидов, является оправданным в прикладном и теоретическом плане научным исследованием. Разработка эффективных методов их модификации откроет новые возможности для поиска ранее неизвестных биоактивных соединений.
Первые работы по применению микроволновой активации в органическом синтезе появились в 1986 г., когда были опубликованы работы R.N.Gedue, R.J.Giguere. Общим вопросам применения микроволновой активации в органическом синтезе посвящены монографии Oliver Kappe, Werner Bonrath, Michael J. Collins, A.Loupy, Рахманкулова Д.Л. и др. Выявление общих закономерностей протекания реакций в условиях микроволнового облучения, а также широкие возможности данного метода для интенсификации химических процессов обуславливают перспективность рассмотрения малоизученных аспектов данного научного направления.
Связь работы с планом государственных научных программ. Диссертационная работа является частью исследований, проводимых в Институте органического синтеза и углехимии РК по темам: «Создание научных основ получения новых перспективных материалов на базе химически модифицированных продуктов переработки угольного сырья (комплексные удобрения, мелиоранты, детоксиканты и структурообразователи почв, сорбенты для очистки сточных вод, ингибиторы коррозии металлов, лекарственные средства, электронные материалы и высококачественное синтетическое жидкое топливо)» (гос. рег. № 0106 РК 01031, 2006-2008 гг.), «Синтез биологически активных эфиров амидофосфористой кислоты и фенолтерпеноидов. Разработка полимерных лекарственных форм на основе природных соединений» (№ 224-Х-06) (совместно с КарГУ им. Е.А. Букетова, кафедра органической химии и полимеров).
Цель работы заключается в поиске и разработке методов целенаправленного синтеза новых потенциально биологически активных производных тиазоловых и сульфаниламидных соединений с использованием фосфорсодержащих реагентов, а также в изучении их строения, реакционной способности и механизмов реакций.
Основные задачи исследования определяются целью исследовательской работы:
– синтез и химическая модификация производных тиазола и сульфамидов, содержащих реакционноспособные функциональные группы: фосфорильную, карбонильную, сложноэфирную, амино- и др. фрагменты;
- изучение условий для региоселективного протекания реакций модификации производных тиазола и сульфаниламида в условиях микроволновой активации, установление взаимосвязи «структура – реакционная способность».
Научная новизна работы определяется тем, что впервые:
- разработана методика синтеза 2-амино-4-диэтилфосфонотиазола в классических условиях по схеме реакции Ганча. Изучено влияние конвекционной и микроволновой активации на протекание реакции синтеза 2-амино-4-диэтилфосфонотиазола. Установлено, что применение МВА позволяет сократить время реакции с 24 ч до 3-5 мин;
- изучены и выявлены особенности взаимодействия аминотиазолов с тетраэтилдиамидо-трет-бутилфосфитом по схеме реакции переамидирования. Установлено, что протекание переамидирования тетраэтилдиамидо-трет-бутилфосфита аминотиазолами может сопровождаться реакцией алкоголиза в зависимости от характера среды;
- предложены мягкие условия синтеза 4-(диэтилфосфоно)-2-диазоний хлорида, который был in situ введен в реакцию с различными анилинами и фенолами. В результате проведенных экспериментов были получены соответствующие азопроизводные, обладающие комплексом полезных свойств;
- изучены реакции вторичного фосфорилирования, алкилирования, конденсации 2-амино-4-диэтилфосфонотиазола с различными реагентами; впервые получены тиазолилсодержащие дифосфорилированные эфиры, 2-(2,4-динитрофениламино)-4-диэтилфосфонотиазол, 2-тиоуридо-4-диэтилфосфо-нотиазол, методом спектофотометрического анализа определена их комплексообразующая способность с ионами двухвалентной меди;
- изучены реакции взаимодействия п-аминобензолсульфонамида в условиях микроволнового облучения с ароматическими альдегидами. Установлено, что использование МВ облучения приводит к значительному сокращению времени реакции;
- разработан одностадийный метод осуществления реакций N-ацилирования сульфаниламидов и N-сульфанилбензальиминов в среде растворителя, без растворителя в присутствии каталитической системы (оксида фосфора (V) на подложке из силикагеля) с высокими выходами целевого продукта в условиях микроволновой активации. Показана зависимость выхода конечного продукта от природы субстратов, растворителя и каталитической системы;
- для исходных тиазолов, сульфамидов и продуктов их модификации произведен расчет их геометрических, зарядовых и энергетических характеристик полуэмпирическим методом РМ6 пакета МОРАС-2009.
Практическая значимость работы состоит в получении новых полифункциональных производных тиазоловых и сульфаниламидных соединений, а также оптимизации путей и способов их синтеза в условиях конвекционной и микроволновой активации. Предложенные способы синтеза тиазоловых и сульфамидных соединений позволяют сократить количество стадий, длительность процесса и повысить выход конечных продуктов, за счёт чего достигается экономия реагентов, растворителей и времени. Полученные результаты представляют интерес, как для развития тонкого органического синтеза, так и для изучения влияния МВА на характер протекания химических реакций. Разработанные методики проведения органических реакций в условиях МВА могут быть применены как в лабораторной практике, так и на производстве для синтеза различных классов органических соединений.
На защиту выносятся следующие основные положения:
- результаты исследований по изучению условий синтеза, реакционной способности и механизмов реакций, а также особенностей строения фосфорилированных производных 2-амино-4-диэтилфосфонотиазола;
- результаты исследований нового микроволнового метода синтеза N-сульфонилбензальиминов и N-сульфаниламидов в условиях МВА;
- результаты расчета геометрических, зарядовых и энергетических характеристик тиазоловых и сульфамидных соединений полуэмпирическим методом РМ6 пакета МОРАС-2009.
Апробация работы. Основные результаты диссертационной работы представлены и обсуждены на Международных научно-практических конференциях: по химии соединений фосфора, посвященной 100-летию со дня рождения М.И.Кабачника (Санкт-Петербург, 2008), VI Беремжановском съезде по химии и химической технологии (Караганда, 2008), «Современное состояние и перспективы развития науки, образования в Центральном Казахстане» (Караганда, 2008), «Наука и образование – ведущий фактор стратегии «Казахстан-2030» (Караганда, 2009), «Индустриально-инновационное развитие на современном этапе: Состояние и перспективы» (Павлодар, 2009), «Экологические проблемы Караганды и пути их решения» (Караганда, 2009.), «Инновационное развитие и востребованность науки в современном Казахстане» (Алматы, 2009), VII симпозиуме по фенольным соединениям (Москва, 2009), ХII Молодежной конференции по органической химии (Суздаль, 2009).
Публикации. По теме диссертационной работы опубликованы 14 работ, из них 6 статей в журналах, входящих в список, рекомендованных ККСОН РК и 8 работ в сборниках научных трудов международных конференций.
Структура и объем диссертации. Диссертационная работа изложена на 132 страницах машинописного листа, состоит из введения, основной части, заключения, списка использованных источников из 151 наименования и приложения. Работа содержит 27 рисунков и 15 таблиц.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1 Особенности строения и биологических свойств тиазоловых и сульфаниламидных соединений
В данном разделе приведен литературный обзор по химии и биологической активности тиазоловых и сульфамидных соединений, а также проблемные вопросы органического синтеза в условиях микроволнового облучения.
2 Синтез и реакционная способность производных 2-аминотиазола
В данном разделе представлены результаты исследований по изучению условий синтеза и реакционной способности производных 2-амино-4-диэтилфосфонотиазола.
2.1 Синтез и химическая модификация 2-аминотиазолов
В данном разделе диссертационной работы, руководствуясь синтетической доступностью, в качестве объектов химической модификации выбраны 2-амино-4-фенилтиазол и 4-(диэтилфосфоно-)-2-аминотиазол и их функциональные производные; соединения трех- и пятивалентного атома фосфора, в частности, тетраэтилдиамидо-трет-бутилфосфит, ряд диалкилфосфитов, Р2О5 и др. являются модифицирующими агентами.
2.1.1 Синтез исходных 2-аминотиазоловых субстратов
С целью синтеза тиазоловых соединений, содержащих фосфорную компоненту непосредственно у тиазольного кольца, в качестве исходных объектов исследования был выбран 2-амино-4-диэтилфосфонотиазол (2.2), который синтезирован нами впервые из кетофосфоната (2.1) по классической схеме реакции Ганча в две стадии:
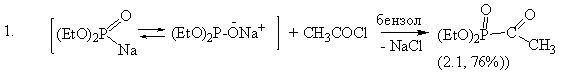
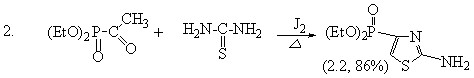
Установлено, что для лучшего выхода следует использовать двойной избыток тиомочевины и длительное нагревание (20-24ч). В связи с этим нами изучена возможность применения метода микроволнового облучения (МО) для синтеза исходных двух 2-аминотиазолов. МО подвергалась реакционная смесь, состоящая из тиомочевины, йода и ацетофенона (и диэтилкетофосфоната) в мольном соотношении 2:1:1. В ходе поиска оптимальных значений мощности излучения и времени реакции (320 мин), установлено, что эффективно воздействует на скорость процесса МО мощностью 350 Вт (микроволновая установка LG-MS2022G) при времени экспозиции 5 минут.

Строение и состав полученных соединений подтверждены данными ИК- и ЯМР-1Н спектроскопии, а также элементного анализа.
2.1.2 Реакция взаимодействия 2-аминотиазолов с тетраэтилдиамидо-трет-бутилфосфитом
С целью получения труднодоступных в прямом синтезе амидофосфитов нами изучено реакция взаимодействия 2-амино-4-диэтилфосфонотиазола (2.2) (в сравнении с 2-амино-4-фенилтиазолом (2.3)) с тетраэтилдиамидо-трет-бутилфосфитом. Образовавшийся диэтиламидо(4-(диэтилфосфоно-2амидо)-трет-бутилфосфит (2.4) (72%) представляет собой белое кристаллическое вещество. При переамидировании тетраэтилдиамидо-трет-бутилфосфита в тех же условиях двумя молями 2-амино-4-диэтилфосфонотиазола (2.2) удалось зафиксировать образование только продукта (2.4).
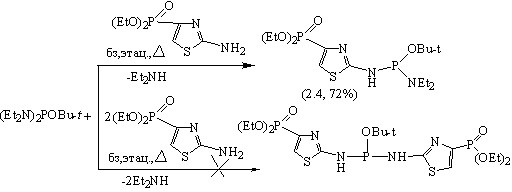
Строение и состав синтезированных соединений подтверждены данными элементного анализа, ИК- и ПМР-спектроскопии.
2.1.3 Реакции 2-диазониумхлорида 4-диэтилфосфонотиазола с аминами
и спиртами
При взаимодействии 2-амино-4-диэтилфосфонотиазола с нитритом натрия в кислой среде синтезирован 4-(диэтилфосфоно)-2-диазоний хлорид (2.5), который был in situ введен в реакцию с различными анилинами и фенолами. В результате проведенных экспериментов были получены соответствующие азопроизводные (2.6-2.10), представляющие определенный интерес в качестве объектов практического применения.
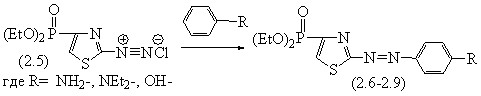

Таблица 2.1 - Физико-химические константы соединений (2.6-2.10)
| № | Брутто-формула | Выход, % | Вычислено, % | Найдено, % | Т.пл., °С | ||||
| С | H | P | С | H | P | ||||
| 2.6 | С17Н13О3PSN2 | 75 | 35.59 | 5.51 | 13.13 | 35.73 | 5.84 | 13.56 | 160 |
| 2.7 | С13Н17О3PSN4 | 90 | 46.15 | 5.03 | 9.17 | 46.84 | 5.08 | 9.81 | 115 |
| 2.8 | С17Н25О3PSN4 | 86 | 51.51 | 6.31 | 7.83 | 52.34 | 6.08 | 7.75 | 162 |
| 2.9 | С13Н16О4PSN3 | 82 | 42.48 | 4.72 | 9.14 | 42.88 | 4.23 | 9.18 | 229 |
| 2.10 | С17Н18О4PSN3 | 79 | 52.17 | 4.60 | 7.93 | 52.19 | 4.99 | 7.26 | 252 |
2.1.4 Реакция взаимодействия 2-амино-4-диэтилфосфонотиазола с диэтилфосфитом по схеме реакции Тодда-Атертона
Нами проведена реакция вторичного фосфорилирования 2-амино-4-диэтилфосфонотиазола с диэтилфосфитом. Процесс протекал в условиях классической реакции Тодда-Атертона.

После перекристаллизации из этилового спирта выход очищенного продукта составил 63%, т.пл. 118°С. Строение и состав синтезированного 2-диэтилфосфоноамино-4-диэтилфосфонотиазола (2.11) установлены данными ИК- и ЯМР-1Н спектроскопии и элементного анализа.
2.1.5 Реакция алкилирования 2-амино-4-диэтилфосфонотиазола 2,4-динитрохлорбензолом
С целью получения новых биоактивных производных нами была проведена реакция 2-амино-4-диэтилфосфонотиазола (2.2) с 2,4-динитрохлорбензолом в присутствии триэтиламина в среде абсолютного бензола. Реакция сопровождалась выделением белого осадка – гидрохлорида триэтиламина. Полученный 2-(2,4-динитрофениламино)-4-диэтилфосфонотиазол (2.12) также является ценным реагентом для дальнейших химических модификаций.
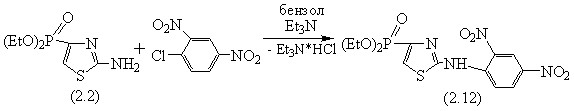
После перекристаллизации из этилового спирта выход целевого продукта составил 71%, т.пл. 251-255°С. В ИК-спектре соединения (2.12) имеются характерные полосы поглощения (, см-1): 1603,83 (C=N), 3103,07 (NH), 1280,87 (P=O), 1107,73 (P-O-Et), 1513,30, 1342,6 (NO2), 845,66 (1,2,4-зам.Ph).
2.1.6 Изучение синтеза и комплексообразующей способности 2-тиоуридо-4-диэтилфосфонотиазола
В продолжение исследования реакционной способности 2-амино-4-диэтилфосфонотиазола (2.2), а также с целью получения веществ, обладающих практическими полезными свойствами, нами была проведена реакция тиазола с роданидом аммония. Данное вещество может являться промежуточным продуктом для синтеза различных классов тиазоловых соединений.
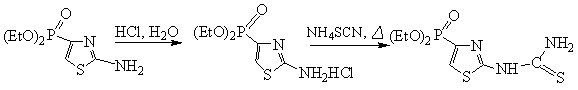
(2.2) (2.13)
Полученный 2-тиоуридо-4-диэтилфосфонотиазол (2.13) представляет собой кристаллическое вещество, растворимое в воде, спирте и других полярных растворителях. Наибольший выход продукта получен при длительном нагревании реакционной смеси в течение 24 ч и составил 71%, т. пл. 1980С. ИК спектр (, см-1): 1445,05 (C=N), 3253,73 (NH2), 1288,45 (P=O), 1096,65 (P-O-Et).
Для оценки комплексообразующей способности 2-тиоуридо-4-диэтилфос-фонотиазола (2.13) осуществлен синтез комплексонатов меди на его основе в различных органических средах и их смесях: спирте, бензоле, ацетоне и диметилформамиде. Установлено, что в гетерофазном спирто-бензольном (1:1) растворе ацетата меди с соединениями (2.13) наблюдается образование кристаллов сине-зелёного цвета.
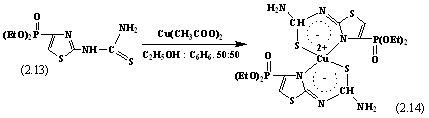
Методом спектрофотометрии нами были выяснены оптимальные условия образования комплекса: содержание этанола 50% по объему, 2,25-2,5 - кратный избыток реагента (2.13), рН среды 7,5-8,0. Применяя основной закон светопоглощения к выражениям оптической плотности А1 и А2, получили уравнения: А1=k1CM/m= tg 1.CM= CM l/m и А2=k2CR/n= tg 2.CR= CR l/n. Отсюда tg 1 =
l/m и tg 2 = l/n. Разделив одно равенство на другое, получили отношение угловых коэффициентов, которое равно отношению стехиометрических коэффициентов в формуле комплекса MmRn: tg 1/tg 2 = n/m. Следовательно, отношение компонентов М:R в составе комплексона (2.14) равно 1:2.
3 Реакции синтеза сульфамидных соединений в условиях микроволновой активации
В данном разделе нами представлены результаты исследования по изучению возможности применения микроволновой активации в синтезе ряда сульфаниламидных препаратов.
3.1 Синтез N-сульфонилбензальиминов в условиях микроволнового облучения
С целью разработки эффективного метода получения сульфонил-азометинов нами были изучены реакции взаимодействия п-аминобензол-сульфонамида (стрептоцида) в условиях микроволнового облучения с ароматическими альдегидами.
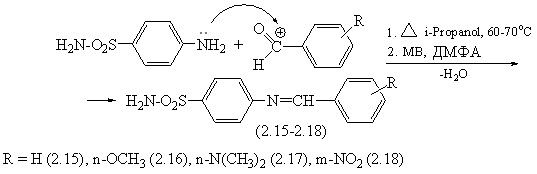
Для получения сравнительных данных реакция конденсации была осуществлена также в условиях конвекционного нагрева в среде изопропанола в течение 8-10 часов (встречный синтез). Целевые продукты - N-сульфонил-бензальимины при этом получены с выходами 67-72%. Реакция конденсации п-аминобензолсульфонамида с альдегидами в условиях микроволновой активации проводилась в среде ДМФА, который имеет более высокую температуру кипения, чем изопропиловый спирт. Подбор наиболее эффективных условий синтеза проводился варьированием времени (от 1 минуты до 30 минут) и мощности излучения (от 90 до 800 Вт). На рисунке 3.1 приведен график зависимости выхода соединения (2.15) от мощности излучения. Как следует из данных диаграммы, при увеличении мощности излучения >400Вт, выход целевого продукта N-4-(бензилиденамино)бензолсульфонамида уменьшается, что связано с выкипанием растворителя и осмолением продуктов. Было установлено, что наиболее оптимальной мощностью для осуществления реакции конденсации п-аминобензолсульфонамида с альдегидами является мощность 350 Вт при времени экспозиции от 15 до 20 мин. Сравнение микроволнового и термического способов активации этих реакций показывает, что использование МВ облучения приводит к значительному ускорению реакции (сокращению времени реакции в 25-30 раз), однако преимуществ в случае МВА, в химических выходах целевых продуктов не обнаруживается. Данный факт подчеркивает отсутствие специфического микроволнового эффекта в изученных реакциях, возможно этот эффект маскируется молекулами растворителя. Состав и строение соединений (2.15-2.18) подтверждены данными элементного анализа, ИК- и ЯМР1Н-спектроскопии и встречным синтезом.
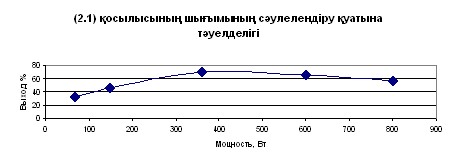
Рисунок 3.1 – График зависимости выхода N-4-(бензилиденамино)-бензолсульфонамида (2.15) от мощности излучения
3.2 Изучение реакции N-ацилирования сульфамидов хлорангидридами карбоновых кислот
Методы N-ацилирования сульфамидов имеют ряд недостатков - протекание побочных реакций образования биацилированных бипродуктов, продолжительность реакции и низкий выход целевых веществ. С целью улучшения условий их синтеза мы изучили возможность использования Р2О5 на подложке из SiO2 в N-ацилировании сульфонамидов. Реакции проводились в различных режимах: в среде растворителя с Р2О5/SiO2; в среде без растворителя с Р2О5/SiO2; в среде растворителя с Р2О5/SiO2. Проведено изучение влияние природы растворителей, соотношения реагирующих веществ, количества катализатора, температуры и времени реакции на выход целевого продукта и характер протекания реакции ацилирования в гетерогенной среде.
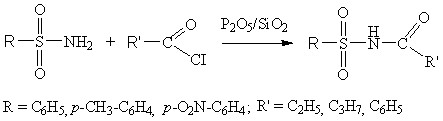
(2.19-2.25)
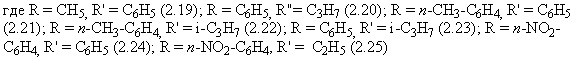
Установлено, что наилучшие результаты реакции N-ацилирования 4-метилбензолсульфамида наблюдаются при следующих условиях в хлористом метилене: количество катализатора - 0.35г, количество бензолсульфонамида и бензоилхлорида - 2 и 3 ммоль соответственно. В этих условиях реакция завершается в течение 20-55 минут с хорошим выходом целевого продукта (85-93%) в обоих случаях: в CH2C12 и в условиях без растворителя при отсутствии катализатора образование целевого продукта не наблюдается. Установлено, что выход целевых продуктов, при использовании комбинации P2O5/SiO2 было во всех случаях больше, чем при применении P2O5 или SiO2 каждого по отдельности. Таким образом, система Р2О5/SiO2 может служит эффективным гетерогенным кислотным катализатором в синтезе N-ацилированных производных сульфамидов. Строение полученных веществ было доказано данными ИК- и ЯМР-спектроскопии.
3.3 Изучение реакции взаимодействия сульфамидов с ангидридами карбоновых кислот
Как известно, активными ацилирующими агентами являются анигидриды карбоновых кислот. Изучение реакций N-ацилирования бензолсульфонамида было проведено с различным количеством P2O5/SiO2 (75% по массе) и ацилирующих агентов.

Установлено, что наилучшие результаты реакции N-ацилирования бензолсульфонамида наблюдаются при следующих условиях осуществления реакции: количество катализатора - 0.30г; количество бензолсульфонамида и уксусного ангидрида - 2 и 3 ммоль соответственно. В этих условиях реакция завершается в течение 20-55 минут с хорошим выходом целевого продукта (85-98%) в обоих случаях: в CH2C12 и в условиях без растворителя. Установлено, что при уменьшении количества гетерогенной каталитической системы Р2О5/SiO2 до 0,1 ммоль, в два раза увеличивается время реакции.
3.4 Изучение реакции ацилирования бензолсульфамидов в условиях микроволнового облучения
В качестве объектов исследования были выбраны: 4-метил-бензолсульфонамид и N-сульфонилимины, а качестве ацилирующих агентов - бензоил хлористый и уксусный ангидрид.
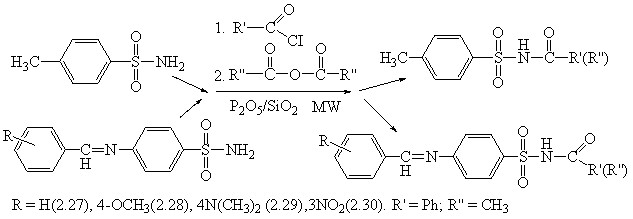
Изучение реакций N-ацилирования бензолсульфамида было проведено с различным количеством P2O5/SiO2 (75% по массе) и ацилирующих агентов, как и в предыдущих исследованиях. Время облучения реакционной смеси составляло от 2 до 15 минут при мощности излучения от 70 до 400 Вт. Установлено, что наиболее эффективным является проведение реакции этерификации при мощности облучения 300 Вт и длительности экспозиции 2-5 минут. В этих условиях реакция завершается с хорошим выходом целевого продукта 80-82 и 89-92 % при ацилировании в среде ДМФА хлористым бензоилом и уксусным ангидридом соответственно. В реакционной среде без растворителя при ацилировании уксусным ангидридом наибольший выход целевого продукта составил 92%. Во всех исследованных реакциях применение микроволновой активации приводит к увеличению скорости реакций в 25-30 раз. Строение полученных веществ было доказано данными ИК- и ЯМР-1Н-спектроскопии и встречным синтезом.
3.5 Квантово-химические аспекты физико-химических свойств тиазоловых и сульфамидных соединений
В данном разделе приведены результаты расчета геометрических, зарядовых и энергетических характеристик тиазоловых и сульфамидных соединений полуэмпирическим методом РМ6 пакета МОРАС-2009. в качестве модельных объектов рассмотрены производные 2-аминотиазола, содержащие в орто-положении по отношению к азоту пятичленного цикла различные заместители (СН3, С6Н5, Р(ОН)(ОС2Н5)2). Установлено, что наименьшей теплотой образования обладает модельная система 2-амино-4-диэтилфосфонотиазола (- 684,22425 кДж), а наибольшей – молекула 2-амино-4-метилтиазола (-107,16501 кДж). Аналогичная зависимость наблюдается и при анализе величины дипольного момента для моделей 2-амино-4-метилтиазола (1,37649 D) и 4-фенил-2-аминотиазола (1,81035 D). Величины межатомных расстояний претерпевают существенные изменения, например R(N2-C1) которое изменяется от 1,28 в 2-аминотиазола до 1,38 в молекуле 2-амино-4-диэтилфосфонотиазола.
Ввод в молекулу сульфаниламида различных заместителей приводит к изменению величины связи S-C от 1,7055 в молекуле п-диметиламино-бензолсульфониламида до 1,7447 для n-нитробензолсульфониламида. Наблюдается различие межатомных расстояний N1-C5 от 1,3866 в молекуле n-аминобензолсульфонамида до 1,4919 в n-нитробензосульфониламиде. По отношению к исходной молекуле величины теплот образования понижаются в рассматриваемом ряду от сульфаниламида (-214,498 кДж) до п-диметиламинобензолсульфониламида (-231,413 кДж). Значения дипольного момента молекул изменяются от 3,48045D для n-нитробензолсульфониламида до 7,38368D у п-диметиламинобензолсульфониламида. Наличие NO2-группы в п-положении (3,48045D) приводит к понижению дипольного момента на более чем 3,41D по сравнению с данной величиной в молекуле сульфаниламида, в то же время в м–положение (5,11853D) данное изменение составляет всего 1,78D. Введение в п-положение фрагмента N(CH3)2 приводит к увеличению дипольного момента на 0,49D и составляет 7,38368 D.
С целью изучения реакционной способности сульфаниламидных азометинов, определяли изменения величины заряда и энергии разрыва связи N-C в зависимости от структуры субстратов. По данным расчетов, наибольший отрицательный заряд сосредоточен на атоме азота азометинового фрагмента. Анализ профиля потенциальной энергии показал, что равновесное значение межатомных расстояний между азотом и углеродом в рассмотренных системах составляет примерно 1,3, что соответствует минимуму на энергетических кривых. При этом наиболее устойчивые конфигурации отвечают значениям -2869,93671 Эв для 4-амино-N-(бензелиден)бензолсульфонамид и -2866,41821 Эв для 4-(бензилиденамино)бензолсульфонамид. В то же время активационный барьер для каждой из систем различен.
3.6 Биопрогнозирование гипотетических соединений с применением компьютерной программы PASS C&T
В данном разделе с целью оптимизации выбора исходных структур и путей их химической модификации проведено биопрогнозирование базовых и гипотетических соединений с использованием программного продукта PASS C&T.
4 Экспериментальная часть
Раздел содержит описание проведенных исследований – методики синтезов, выделения и очистки изученных соединений, определение физико-химических констант.
ЗАКЛЮЧЕНИЕ
По итогам проведенной работы по изучению синтеза производных тиазоловых и сульфаниламидных соединений с использованием фосфорсодержащих реагентов можно сделать следующие выводы:
1. В условиях реакции Ганча на основе диэтилкетофосфоната разработана методика синтеза 2-амино-4-диэтилфосфонотиазола. Изучено влияние конвекционной и микроволновой активации на протекание реакции синтеза2-амино-4-диэтилфосфонотиазола. Установлено, что применение МВА позволяет сократить время реакции с 24 ч до 3-5 мин.
2. Изучены и выявлены особенности реакции взаимодействия аминотиазолов с тетраэтилдиамидо-трет-бутилфосфитом по схеме реакции переамидирования. Установлено, что протекание переамидирования тетраэтилдиамидо-трет-бутилфосфита аминотиазолами может сопровождаться реакцией алкоголиза в зависимости от характера среды.
3. Изучены реакции вторичного фосфорилирования, алкилирования, конденсации 2-амино-4-диэтилфосфонотиазола с различными реагентами; впервые получены тиазолилсодержащие дифосфорилированные эфиры, 2-(2,4-динитрофениламино)-4-диэтилфосфонотиазол, 2-тиоуридо-4-диэтилфосфоно-тиазол, диазосоединения, представляющие определенный практический интерес в качестве синтонов в конструировании биологически активных веществ.
4. Исследована комплексообразующая способность 2-тиоуридо-4-диэтилфосфонотиазола и методом спектрофотометрического анализа впервые определены оптимальные условия образования комплексов фосфорилированного тиазола с ионами двухвалентной меди.
5. Изучены реакции взаимодействия п-аминобензолсульфонамида в условиях микроволнового облучения с ароматическими альдегидами. Установлено, что использование МВ облучения приводит к значительному сокращению времени реакции образования N-сульфонилбензальиминов (в 25-30 раз).
6. Разработан одностадийный метод осуществления реакций N-ацилирования сульфониламидов и N-сульфонилбензальиминов в среде растворителя, без растворителя в присутствии каталитической системы (оксида фосфора (V) на подложке из силикагеля) с высоким выходом целевого продукта в условиях микроволновой активации. Показана зависимость выхода конечного продукта от природы субстратов, растворителя и каталитической системы.
Оценка полноты решения поставленных задач. Цель диссертационной работы заключалась в поиске и разработке методов целенаправленного синтеза новых потенциально биологически активных производных тиазоловых и сульфаниламидных соединений с использованием фосфорсодержащих реагентов, а также в изучении их строения, реакционной способности и механизмов реакций их образования. В результате выполненных научных исследований получены новые полифункциональные производные моно- и дифосфорилированных тиазоловых соединений и разработаны новые методы модификации сульфаниламидных препаратов в условиях конвекционной и микроволновой активации. С применением современных физико-химических методов (ИК-, ЯМР-1Н-спектроскопии) установлена структура синтезированных соединений.
Разработка рекомендаций и исходных данных по конкретному использованию результатов. Разработаны оптимальные условия синтеза многофункциональных производных 2-аминотиазолов и сульфаниламидов с использованием фосфорсодержащих реагентов. Полученные в ходе исследований данные о строении, механизмах образования, биологической активности, физических и химических свойствах полученных соединений представляют как практический, так и теоретический интерес для дальнейших исследований в данной области. Эти сведения также могут быть использованы как вторичные данные при установлении закономерностей взаимосвязи «структура-биоактивность», «структура-реакционная способность». Рассмотренные механизмы реакций и проведенные квантово-химические расчеты вносят определенный вклад в решение ряда общетеоретических вопросов органической химии.
Сравнение с лучшими достижениями в этой области. В работе впервые предложены новые способы химической модификации 2-аминотиазоловых и сульфаниламидных соединений в условиях конвекционной и микроволновой активации. Изучено влияние МВА на характер химической реакции, полноты протекания и скорость исследуемых процессов. Установлено, что использование МВ облучения приводит к значительному сокращению времени реакции образования (в 25-30 раз) целевых продуктов. Разработанные в работе методы характеризуются высокими выходами конечных продуктов и могут быть рекомендованы для синтеза различных соединений.
Список опубликованных работ по теме диссертации
1 Салькеева Л.К., Минаева Е.В., Мантель А.И., Нурмаганбетова М.Т., Султанова Л.М. Синтез новых тиазолилсодержащих фосфорорганических комплексонов // Вестник КарГУ. Серия химия. –2008. – №4(52). – С.43-48.
2 Салькеева Л.К., Нурмаганбетова М.Т., Минаева Е.В., Султанова Л.М., Кокжалова М.З. Химические превращения тиазолилсодержащих эфиров -кетофосфоновых кислот // Тезисы докл. ХV Межд. конф. по химии соединений фосфора. – Санк-Петербург, 2008. – С.86.
3 Минаева Е.В., Салькеева Л.К., Кухленко Н.В., Нурмаганбетова М.Т., Султанова Л.М. Поиск огнезащитных материалов среди фосфорорганических соединений // Труды Межд. научно-практ. конф. «Современное состояние и перспективы развития науки, образования в ЦК». – Караганда, 2008. – С.67-71.
4 Салькеева Л.К., Минаева Е.В., Мантель А.И., Нурмаганбетова М.Т., Султанова Л.М. Синтез и химическая модификация фосфорсодержащих производных 2-аминотиазола // Труды VI Межд. Беремжановского съезда по химии и химической технологии. – Караганда, 2008. – С.365-367.
5 Султанова Л.М. Фазылов С.Д. Сулейменова А.А. Хамзина Г.Т. Изучение реакции алкилирования производных фенола в условиях микроволновой активации // Материалы VII Межд. симпозиума по фенольным соединениям. – Москва, 2009. – С.254-255.
6 Фазылов С.Д., Султанова Л.М., Болдашевский АВ., Хамзина Г.Т. Реакции ацетилирования о-, м-, п-замещенных производных фенола при микроволновом облучении // Материалы VII Межд. симпозиума по фенольным соединениям. – Москва, 2009. – С. 271-272.
7 Хрусталёв Д.П., Султанова Л.М., Фазылов С.Д., Мулдахметов М.З. Синтез сложных эфиров 4-гидроксибензойной кислоты в условиях микроволнового облучения // Известия НАН РК. –2009. – №4. – С.66-68.
8 Фазылов С.Д., Султанова Л.М., Болдашевский АВ., Татеева А.Б. Реакции взаимодействия бензолсульфонамидов с ангидридами карбоновых кислот в гетерогенной среде // Вестник КарГУ. Сер. химия. – 2009. – №4(56). – С.97-101.
9 Фазылов С.Д., Султанова Л.М., Болдашевский АВ., Мулдахметов М.З. Изучение реакции взаимодействия бензолсульфонамидов с ацилхлоридами в гетерогенной среде // Вестник Евразийского универ. – 2009. – №6. – С. 152-156.
10 Хамзина Г.Т., Фазылов С.Д., Султанова Л.М., Аринова А.Е., Василец Е.П. Синтез N-ацилсульфонамидов в условиях микроволнового облучения // Вестник Каз. гос. национ. университета. – 2010. –№1(57). –С.124-128.
11 Фазылов С.Д., Султанова Л.М., Жакупова А.Н., Болдашевский А.В., Мулдахметов М.З. Реакции бензолсульфонамидов с ангидридами карбоновых кислот в гетерогенной среде // Вестник Павл. гос. унив. – 2009. – №3. – С.50-59.
12 Хамзина Г.Т., Фазылов С.Д., Султанова Л.М., Болдашевский А.В., Сатпаева Ж. Изучение реакции N-ацилирования сульфонамидов хлорангидридами карбоновых кислот // Труды Х11 Молодежной конф. по органической химии. – Суздаль, 2009. – С.416-419.
13 Шибаева А.К., Султанова Л.М., Салькеева Л.К., Минаева Е.В., Нурмаганбетова М.Т. Тиомочевины на основе фосфорилированных производных 2-аминотиазола // Труды Х11 Молодежной конф. по органической химии. – Суздаль, 2009. – С.327-329.
14 Тайшибекова Е.К., Султанова Л.М., Салькеева Л.К., Минаева Е.В., Нурмаганбетова М.Т. Синтез и химическая модификация фосфорилированных производных 2-аминотиазолов // Труды Х11 Молодежной конф. по органической химии. – Суздаль, 2009. – С.387-389.
СУЛТАНОВА ЛИЛИЯ МИНУЛЛОВНА
Фосфоррамды реагенттерді олдану арылы тиазолды
жне сульфамидті туындыларды синтездеу
Химия ылымдарыны кандидаты ылыми дрежесін алу шін
02.00.03 - органикалы химия мамандыы бойынша дайындалан
диссертацияны авторефератына
ТЙІНДЕМЕ
Зерттеу объектілері. 2-амино-4-диэтилфосфонотиазол, диэтилкетофос-фонат, тетраэтилдиамидо-трет-бутилфосфит, сульфаниламидтер жне оларды туындылары. N-ацилирленген сульфониламидтер мен N-сульфонил-бензальиминдер, оларды рылымыны ерекшеліктері, реакциялы абілеттіктері мен реакция механизмдері. Тиазолды жне сульфамидті заттарды химиялы трлендіруде ысатолынды сулелендіруді олдану.
Жмысты масаты. Тиазолды жне сульфамидті реакцияа абілетті функциональды фосфорильді, карбонильді, крделі эфирлі, аминді жне т.б.топтары бар туындыларын синтездеу жне химиялы трлендіру. Конвекциялы жне ысатолынды белсендіру жадайында тиазолды жне сульфамидті туындыларын региоселетивті реакция жадайда трлендіруді жолдарын зерттеу, «рылым-реакциялы абілеттілік» арасындаы байланыстарды анытау.
Зерттеу дістемелері. Тиазолды жне сульфамидті туындыларын синтездеуде органикалы синтезді – нуклеофильді алмасу, осылу, ацильдену, конденсациялану дістері олданылды; реакция німдерін бліп алу мен тазартуда – колонкалы хроматография, айта кристалдау мен вакуумда айдау дістері олданылды. Синтезделген осылыстарды рылымы мен рамы азіргі заманы физикалы-химиялы талдау дістерін (ИК-, ЯМР1Н-спектрометрия), спектрофотометрия дісін жне элементті талдау дістерін олдану арылы аныталды. Заттарды геометрикалы, зарядты жне энергетикалы сипаттамаларын анытау МОРАС-2009 кешеніні жартылай эмпирикалы РМ6 дістемесімен зерттелді.
Жмысты негізгі нтижелері. Жргізілген ылыми-зерттеу жмыстары нтижесінде келесі жаа ылыми мліметтер алынды:
- Ганча реакциясы бойынша диэтилкетофосфонат негізінде алаш рет 2-амино-4-диэтилфосфонотиазолды синтездену методикасы жасалынды. 2-амино-4-диэтилфосфонотиазолды синтездеу реакциясына конвекциялы жне ысатолынды белсендіруді сері зерттелді. ысатолынды белсендіруді реакция уаытын 24 сааттан 3-5 мин дейін ысартатыны крсетілді;
- Арбузов реакциясы жадайында аминотиазолдарды тетраэтиламидо-трет-бутилфосфитпен рекеттесу реакциясыны жру ерекшеліктері зерттелді. Аминотиазолдарды тетраэтиламидо-трет-бутилфосфитпен айтаамидтену
реакциясыны жруі реакциялы ортаны сипатына байланысты алкаголиз реакциясымен абаттасы жру ммкіншілігі аныталды;
- 2-амино-4-диэтилфосфонотиазолды р трлі реагенттермен екіншілік фосфорлану, алкилдену, конденсациялану реакциялары зерттелді, тиазолрамды осфосфорленген эфирлер, биологиялы белсенді зарттар ретінде маызды 2-(2,4-динитрофениламино)-4-диэтилфосфонотиазол, 2-тиоуридо-4-диэтилфосфонотиазол, азокрасителдер синтезделініп алынды;
- 2-тиоуридо-4-диэтилфосфонотиазолды комплекстзу абілеттілігі зерттелді, спектрофотометрлік діспен фосфорланан тиазолды екі валентті мыс иондарымен комплекс тзуіні тиімді жадайлары алаш рет аныталды;
- ысатолынды сулелендіру жадайында п-аминобензолсульфонамидті ароматты альдегидтермен рекеттесу реакциялары зерттелді. ысатолынды белсендіруді олдану жадайында N-сульфонилбензальиминдерді тзілу уаыты кп азаятыны (25-30 есе) аныталды;
- сульфониламидтерді жне N-сульфонилбензальиминдерді катализа-торлы жйе (силикагельдік тсеніштегі фосфор оксиді (V)) атысында ерітінділік, ерітіндісіз орталарда жоарышыымды нім тзе N-ацилирленуіні бірсатылы жолы жасалынды. Реакция німі шыымыны субстратты, еріткішті жне каталитикалы жйе табиатынан туелділігі крсетілді.
Зерттеу жмысыны практикалы ндылыы. Жмыста алаш рет 2-аинотиазолды жне сульфамидті осылыстарды конвекциялы жне ысатолынды сулелену жадайында химиялы трлендіруіні жаа жолдары жасалынды. ысатолынды белсендіруді химиялы реакция табиатына, зерттелуші процестерді толыжруі мен жылдамдыына серлері зертеліп, аныталды. ысатолынды белсендіруді олдану зерттелген реакцияларда німтзілу жылдамдытарын кп (25-250 есе) ысартуа ммкіндік жасайтыны крсетілді. арастырылан реакция механизмдері мен квантты-химиялы есептеулер органикалы химияны жалпытеориялы мселелерін шешуде лкен лес осады.
олдану айматары. Жргізілген зерттеу жмыстарыны синтездеу дістемелері, алынан заттарды тзілу механизмдері, биологиялы, физикалы-химиялы асиеттері туралы жаа мліметтеріді осы баыттаы зерттеу жмыстары шін практикалы та, тжірибелік те маызы лкен. Ос ылыми деректер «рылым-реакциялы абілеттілік», «рылым-биобелсенділік» аралытарындаы байланыстарды анытауда ке олданыс табады. Жмыста сынылынан дістемелер масатты німдерді жоары шыымымен сипатталады жне олар осы сияты заттарды алуда препаративті органикалы синтездерде жне фармакологияда ке трде олданыс табуы ммкін.
Sultanova Lily Minullovna
Synthesis of Thiazole and Sulfimide Derivatives
with Usage of Phosphorous Containing Reagents
Candidate of Chemical Sciences Applicant’s Thesis
02.00.03 – Organic Chemistry
SUMMARY
Objects of Research. 2-Amino-4(diethylphosphono)-2-aminothiazole and its derivatives, sulfimide compounds and their derivatives. N-acylation of sulfanylamides and N-sulfanylbenzalimines, structure peculiarities, reactivity and mechanisms of compounds formation reactions. Microwave activation in chemical modification of thiazole and sulphamides compounds.
Purpose of Work. Synthesis and chemical modication of thiazole and sulphamides derivatives containing reactive functional groups such as phosphoryl, carbonyl, ester ones, aminogroup and other fragments. Studying of conditions for regioselective proceeding of thiazole and sulphamides derivatives modification reactions under conditions of convection and microwave activation, establishment of «structure - reactivlity» interrelation.
Methodology of Carrying out of Work. Synthesis and chemical modification of thiazole and sulphamides derivatives were carried out with application of methods of organic synthesis – nucleophilic substitution, addition, acylation, condensation; separation and purification of end-products were carried on by methods of column chromatography, recrystallization and vacuum distillation. Studying and establishment of structure of compounds synthesised were carried on with application of modern physical and chemical methods - IR-, NMR1Н-spectroscopy, spectrophotometry and element analysis. Geometrical, charging and energy characteristics of compounds were studied with application of РМ6 of package МОРАС-2009 semi empirical method.
Results of Work.
- Technique of 4- (diethylphosphono)-2-aminothiazole synthesis was developed under the conditions of Hanch reaction on a basis of diethylketophosphonate. Influence of convection and microwave activation on the reaction route of 4- (diethylphosphono)-2-aminothiazole synthesis was studied. MWA application was established to allow shortening of reaction time from 24 h to 3-5 min.;
- peculiarities of reaction of interaction of aminothiazoles with tetraethyldiamido-tert-butylphosphite under the conditions of Arbuzov’s reaction were studied and revealed. It was established that transamidation of tetraethyldiamido-tert-butylphosphite by aminothiazoles can be accompanied by alcoholysis reaction depending on medium nature;
- reactions of secondary phosphorilation, alkylation and condensation of 2-amino-4-diethylphosphonotiazole with various reagents were studied; for the first time thiazolyl-containing diphosphorilated esters, 2-(2,4-dinitrophenylamino)-4-diethylphosphonothiazole, 2-thiourido-4-diethylphosphonothiazole, azo dyes were obtained. These compounds represent certain interest as syntones and biologically active substances;
- complexing capacity of 2-thiourido-4-diethylphosphonothiazole was investigated and for the first time optimum conditions of formation of complexes of thiazole phosphorilated with bivalent copper ions were determined by the method of spectrophotometric analysis;
- Interaction reactions of p-aminobenzenesulfonamide with aromatic aldehydes in the conditions of microwave irradiation were studied. MV irradiation usage was established to lead to considerable shortening of time of N-sulfonylbenzalimines formation reaction twenty five - thirtyfold;
- Single-stage method of carrying out of reactions N-acylation of sulfanylamides and N-sulfanylbenzalimines in solvent and without solvent in the presence of catalytic system (phosphorus (V) oxide on silica gel substrate) with high yield of a target product under the conditions of microwave activation was worked out. Dependence of the end-product yield on substrate nature, solvent and catalytic systems was shown.
Practical Importance of Work. In work for the first time new ways of chemical modification of 2-aminothiazoles and sulfanylamides compounds under conditions of convection and microwave activation were offered. MWA influence on character of chemical reaction, completeness of course and rate of processes investigated was studied. Usage of micro wave irradiation considerably shortens reaction time of target products formation. The reactions mechanisms considered and the quantum-chemical calculations carried on bring definite contribution to the decision of some general theoretical problems of organic chemistry.
Field of Application. Obtained during researches data about synthesis methods, structure, mechanisms of formation, biological activity, physical and chemical properties of compounds obtained represent both practical and theoretical interest for the further researches in the field of organic chemistry. These data also can be used as secondary ones at an establishment of regularities of “structure-bioactivity” and “structure-reactivity” interrelation when studying properties of various organic compounds. The methods developed in work are characterized by high yields of end-products and can be recommended for compounds synthesis in preparative organic chemistry and pharmacology.

