2-(2-карбоксибензил)фураны в синтезе бензаннелированных гетероциклов
На правах рукописи
Дмитриев Артем Сергеевич
2-(2-КАРБОКСИБЕНЗИЛ)ФУРАНЫ В СИНТЕЗЕ
БЕНЗАННЕЛИРОВАННЫХ ГЕТЕРОЦИКЛОВ
Специальность 02.00.03 – “Органическая химия”
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Краснодар – 2007
Работа выполнена в НИИХГС ГОУВПО
"Кубанского государственного технологического университета"
Научный руководитель: доктор химических наук,
старший научный сотрудник
Бутин Александр Валерианович
Официальные оппоненты: доктор химических наук,
профессор Аксенов Александр Викторович;
кандидат химических наук,
старший научный сотрудник
Журавлёв Сергей Васильевич
Ведущая организация: Московский государственный
университет им. М.В. Ломоносова
Защита состоится “29” мая 2007 г. в 14.40 часов на заседании
диссертационного совета Д 212.100.01 в КубГТУ по адресу: г. Краснодар,
ул. Красная, 135, ауд. 174
С диссертацией можно ознакомиться в библиотеке Кубанского
государственного технологического университета по адресу: г. Краснодар, ул. Московская, 2, корпус А
Автореферат разослан “ 28 ” апреля 2007 г.
Учёный секретарь
диссертационного совета,
кандидат химических наук, доцент Кожина Н.Д.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Благодаря колоссальному разнообразию полезных свойств, которыми обладают гетероциклы, химия гетероциклических соединений неизменно остается важнейшим направлением органической химии. Ранее на основе реакции рециклизации орто-функционализированных бензилфуранов был разработан общий метод построения гетероциклических структур. Тщательное изучение данной реакции позволило предположить, что рециклизации орто-карбокси- и орто-карбамоилпроизводных бензилфуранов могут привести к формированию каркасов изохромона и изохинолона. Интерес к данным классам соединений вызван широким спектром биологического действия их производных. Так, для производных изохромона обнаружена антибактериальная, антиаллергическая, антикаогулянтная активность, а для производных изохинолона - противоопухолевая, жаропонижающая и иммуномодулирующая. Кроме того, изохинолоны образуют большой класс изохинолиновых алкалоидов, а каркас изохромона встречается во многих природных веществах. Таким образом, дальнейшее развитие этого направления путем изучения неописанных ранее рециклизаций производных орто-карбоксибензилфурана представлялось весьма актуальным и перспективным.
Работа выполнена в соответствии с планом НИР кафедры органической химии и НИИХГС Кубанского государственного технологического университета, проводимой по тематическому плану Министерства науки и образования Российской Федерации: «Создание теории и разработка новых методов направленного синтеза O-, N-, S-содержащих полифункциональных соединений, перспективных для химии биологически активных веществ с избирательными свойствами», а также по грантам «Развитие общей методологии построения бензаннелированных гетероциклов на основе реакции рециклизации фуранового кольца» (грант РФФИ 03-03-32759) и «Трансформации фуранов в синтезе гетероциклических систем» (грант фирмы BAYER AG Synthon B006).
Целью работы является разработка методологии построения бензаннелированных гетероциклов на основе реакции рециклизации производных 2-(2-карбоксибензил)фурана со всесторонним изучением влияния условий проведения реакции и заместителей на строение полученных продуктов, их выходы и соотношение.
В связи с этим были сформулированы следующие задачи:
- разработать препаративные методы синтеза различных производных 2-(2-карбоксибензил)фурана;
- изучить реакцию рециклизации производных 2-(2-карбоксибензил)фурана;
- исследовать рециклизацию производных амида 2-(2-карбоксибензил)фурана;
- изучить реакцию рециклизации производных гидразида 2-(2-карбоксибензил)фурана;
- на основе исследованных превращений разработать препаративные методы синтеза новых бензаннелированных гетероциклических соединений.
Научная новизна. В ходе изучения конденсации 2-алкилфуранов с 2-формилбензойными кислотами установлено, что в результате данного превращения образуются 3-(5-алкил-2-фурил)фталиды и орто-карбоксифенилдифурилметаны. Показано, что рециклизация орто-карбоксифенилдифурилметанов приводит к производным 3-(3-оксоалкил)изохромона и фуро[2',3':3,4]циклогепта[1,2-c]изохромона. На примере амидов 2-(2-карбоксибензил)фурана уточнен механизм рециклизации орто-функционализированных бензилфуранов. Установлено, что реакция протекает через раскрытие промежуточного спиро-соединения в цис-аллильный спирт. Таким образом, рециклизация амидов 2-(2-карбоксибензил)фурана приводит к производным [(Z)-3-гидрокси-1-бутенил]изохинолин-1(2H)-она, 3-(3-оксоалкил)изохинолин-1(2H)-она и фуро[2',3':3,4]циклогепта[1,2-c]изохинолинона. Найдено, что производные изохромона при кипячении в формамиде трансформируются в производные изохинолона. Показано, что рециклизации гидразидов 2-(2-карбоксибензил)фурана и внутримолекулярная циклизация 3-(3-гидразоноалкил)изохромонов приводит к новым гетероциклическим структурам - пиридазино[1,6-b]изохинолонам.
Практическая значимость работы. На основе изучения реакции рециклизации производных 2-(2-карбоксибензил)фурана разработаны препаративные методы синтеза широкого ряда производных 3-(3-оксоалкил)изохромона, фуро[2',3':3,4]циклогепта[1,2-c]изохромона, 3-(3-оксоалкил)изохинолин-1(2H)-она, фуро[2',3':3,4]циклогепта[1,2-c]изохинолинона, пиридазино[1,6-b]изохинолона. Методы просты в выполнении и вполне могут быть применены в промышленных масштабах. Полученные соединения перспективны с точки зрения дальнейших модификаций и поиска новых биологически активных веществ.
Апробация работы и публикации. Основные результаты работы доложены на XX-ом европейском коллоквиуме по гетероциклической химии (Швеция, Стокгольм, 2002); 10-ом международном симпозиуме по химии гетероциклов «Голубой Дунай» (Австрия, Вена, 2003); международной конференции по химии гетероциклических соединений, посвященной 90-летию со дня рождения профессора А. Н. Коста (Москва, 2005); международном симпозиуме по успехам науки в органической химии (Крым, Судак, 2006); 4-ой евразийской конференции по гетероциклической химии (Греция, Салоники, 2006).
Публикации. По материалам диссертации получен патент Р.Ф., опубликовано 5 статей и тезисы 9 докладов.
Структура и объём работы. Диссертация состоит из введения, литературного обзора, обсуждения результатов, экспериментальной части, выводов, списка цитируемой литературы и приложения. Работа изложена на 138 страницах машинописного текста, содержит 70 схем, 48 таблиц и 4 рисунка. Список цитируемой литературы включает 193 ссылки.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
- Синтез производных изохромона
- Синтез 2-формилбензойных кислот
Изучаемые 2-(2-карбоксибензил)фураны были получены нами из 2-формилбензойных кислот 2а-н. Последние синтезировали из соответствующих фталидов 1а-н согласно модификации известной методики. Полученные при радикальном бромировании 3-бромфталиды без предварительной очистки гидролизовали до соединений 2а-н (схема 1.1, таблица 1.1).
Схема 1.1
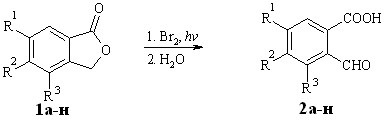
Таблица 1.1 – Выходы 2-формилбензойных кислот 2а-н
| Соединения 1, 2 | R1 | R2 | R3 | Выход, (%) |
| а | H | H | H | 70 |
| б | NO2 | H | H | 73 |
| в | Cl | H | H | 70 |
| г | Br | H | H | 72 |
| д | H | Br | H | 72 |
| е | H | Cl | H | 70 |
| ж | OMe | H | H | 75 |
| з | OMe | OMe | H | 78 |
| и | I | H | H | 73 |
| к | F | H | H | 70 |
| л | H | I | H | 68 |
| м | H | H | Cl | 71 |
| н | H | H | Br | 72 |
- Конденсация 2-формилбензойных кислот с 5-алкилфуранами
С целью всестороннего изучения реакции рециклизации производных орто-карбоксибензилфурана, выявления ограничений и возможностей применения этой реакции в синтезе различных гетероциклов, необходимо было синтезировать широкий ряд арилдифурилметанов с различными заместителями в фенильном и фурановом кольцах. Для этого была осуществлена конденсация 2-формилбензойных кислот 2 с 5-алкилфуранами 3.
Конденсацию проводили при нагревании (60 С, 25 мин.) смеси 1 экв. исходной кислоты 2а-и и 4 экв. 2-алкилфурана 3 в 1,4-диоксане в присутствии хлорной кислоты (условия А). В случае 2-метил- и 2-этилфурана в качестве основных продуктов в условиях А образовывались орто-карбоксиарилдифурилметаны 4а-к (схема 1.2, таблица 1.2).
Неожиданно при использовании 2-трет-бутилфурана помимо метанов 4л-п в значительных количествах были выделены 3-фурилфталиды 5 л-п. Как известно, 3-фурилфталиды служат предшественниками 2-карбоксибензилфуранов, используемых в синтезе веществ нафто[2,3-b]фуран-4,9-дионового ряда. Многие из них могут быть выделены из растений и проявляют различные виды фармакологической активности. На настоящий момент наиболее распространенные пути синтеза этих соединений основаны на методах элементоорганической химии, что требует особых условий и накладывает определенные трудности на проведение эксперимента. Эти обстоятельства побудили нас к дальнейшим исследованиям возможности получения 3-фурилфталидов при конденсации 2-аклилфуранов с 2-формилбензойными кислотами.
Было установлено, что добавление воды к реакционной смеси позволяет увеличивать содержание 3-фурилфталидов 5 от следовых количеств до 50 % и более от общей массы продуктов реакции. Оптимальное количество воды, необходимое для достижения максимального выхода соединений 5а-г,л-п, составляет 12 % от объема 1,4-диоксана, используемого в реакции. Реакционную смесь кипятили с обратным холодильником в течение 1,5 часов, а в качестве катализатора использовали хлорную кислоту (условия Б). Таким образом 3-фурилфталиды 5а-г,л-п могут быть получены простым препаративным методом.
Схема 1.2
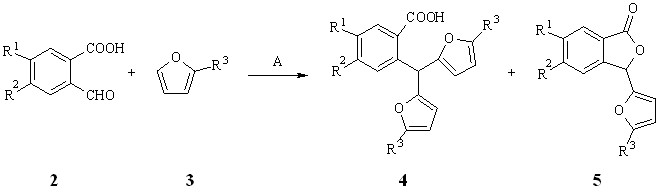
Таблица 1.2 – Выходы метанов 4а-п и 3-фурилфталидов 5а-г,л-п
| 2-5 | R1 | R2 | R3 | Выход 4а-п, условия А, (%) | Выход 5а-п, условия А, (%) | Выход 4а-г, л-п условия Б, (%) | Выход 5а-г, л-п, условия Б, (%) |
| а | H | H | Me | 68 | следы | 15 | 14 |
| б | NO2 | H | Me | 72 | следы | 17 | 19 |
| в | Cl | H | Me | 64 | следы | 17 | 18 |
| г | Br | H | Me | 67 | следы | 19 | 17 |
| д | H | Br | Me | 69 | следы | - | - |
| е | H | Cl | Me | 70 | следы | - | - |
| ж | OMe | H | Me | 60 | следы | - | - |
| з | OMe | OMe | Me | 62 | следы | - | - |
| и | H | H | Et | 68 | следы | - | - |
| к | NO2 | H | Et | 70 | следы | - | - |
| л | H | H | t-Bu | 14 | 21 | 13 | 35 |
| м | NO2 | H | t-Bu | 16 | 29 | 14 | 37 |
| н | Cl | H | t-Bu | 18 | 31 | 15 | 38 |
| о | Br | H | t-Bu | 19 | 32 | 18 | 32 |
| п | I | H | t-Bu | 22 | 36 | 20 | 42 |
"-" опыт не проводили
- Реакция рециклизации орто-карбоксибензилфуранов
Следующим этапом работы стало изучение реакции кислотно-катализируемой рециклизации орто-карбоксибензилфуранов (метанов) 4а-п. Кипячение соединений 4а-к в метанольном растворе хлороводорода (30 % масс.) в течение 30 мин. приводило к образованию тетрациклических изохромонов 7а-к (схема 1.3). Снижение концентрации хлороводорода до 8 % масс. и увеличение продолжительности реакции до 40 мин. позволило получать кетоны 6а-д с выходами 55-75 %. При этом тетрациклы 7а-д образовывались в качестве минорных продуктов (таблица 1.3).
Иначе протекает рециклизация метанов 4л-п, содержащих в положении 5 фуранового кольца трет-бутильную группу. Ее единственными продуктами оказались кетоны 6л-п (75-82 %). По-видимому, вторичной циклизации оксобутильного фрагмента по -положению фурана в данном случае препятствует объемная трет-бутильная группа при карбониле.
Схема 1.3
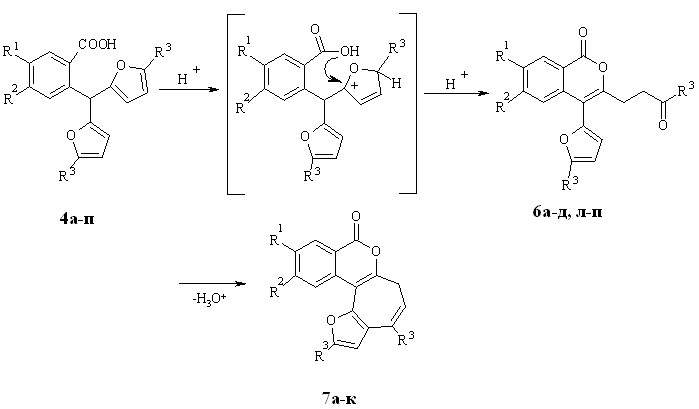
Таблица 1.3 – Выходы кетонов 6а-д,л-п и изохромонов 7а-к
| Вещества 4а-п, 6а-д,л-п, 7а-к | R1 | R2 | R3 | Выход 6а-д,л-п (%) | Выход 7а-к (%) |
| а | H | H | Me | 55 | 66 |
| б | NO2 | H | Me | 72 | 70 |
| в | Cl | H | Me | 68 | 72 |
| г | Br | H | Me | 70 | 75 |
| д | H | Br | Me | 75 | 65 |
| е | H | Cl | Me | - | 63 |
| ж | MeO | H | Me | - | 68 |
| з | MeO | MeO | Me | - | 65 |
| и | H | H | Et | - | 69 |
| к | NO2 | H | Et | - | 71 |
| л | H | H | t-Bu | 80 | |
| м | NO2 | H | t-Bu | 75 | |
| н | Cl | H | t-Bu | 82 | |
| о | Br | H | t-Bu | 81 | |
| п | I | H | t-Bu | 79 |
- Синтез 3-(3-оксоалкил)изохромен-1-онов
Известно, что вещества ряда 3-бутилизохромонов ранее были выделены из природных источников. Некоторые из них обладают полезными биологическими свойствами. Так артемедин (рисунок 1.1), выделенный из полыни (Artemisia capillaries) и его гидрированные и функционализированные по бутильному заместителю производные проявляют антигрибковые свойства.
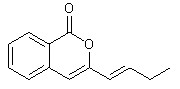
Рисунок 1.1 - Структура артемедина
В свете этого интересно было бы проверить универсальность и практическую значимость разработанной нами методологии построения изохромонового ядра посредством синтеза ряда 3-оксоалкилизохромонов.
Нами предложена следующая цепочка (схема 1.4). На первой стадии 3-фурилфталид 5 восстанавливают кипячением в аммиаке в присутствии цинковой пыли до соответствующего метана 8. Далее соединения 8а,в,л,н подвергают рециклизации в 3-алкилизохромоны 9а,в,л,н в условиях получения кетонов 6л-п (таблица 1.4).
Однако данный метод не позволяет получать соединения 8 с атомами брома и йода в фенильном кольце - в ходе восстановления 3-фурилфталиды 5г,п претерпевают дегалогенирование до 8а,л. Попытки восстановления 5-нитро-3-фурилфталида 5б также привели к неудаче. В ходе реакции неизменно образовывалась неидентифицируемая смесь продуктов.
Схема 1.4
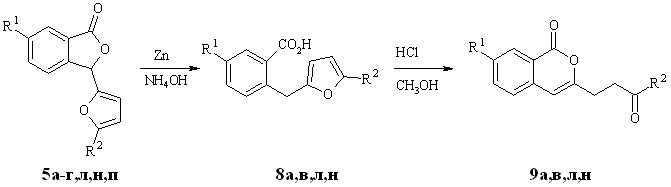
Таблица 1.4 – Выходы метанов 8а,в,л,н и изохромонов 9а,в,л,н
| Вещества 5а-г,л,н,п 8а,в,л,н 9а,в,л,н | R1 | R2 | Выход 8 а,в,л,н (%) | Выход 9 а,в,л,н (%) |
| а | H | Me | 50 | 70 |
| б | NO2 | Me | 0 | |
| в | Cl | Me | 40 | 72 |
| г | Br | Me | -* | |
| л | H | tBu | 55 | 65 |
| н | Cl | tBu | 45 | 68 |
| п | I | tBu | -* |
*образуются продукты одновременного восстановления и дегалогенирования 8а и 8л соответственно
Таким образом, в результате исследования показана возможность применения 2-(2-карбоксибензил)фуранов в синтезе производных изохромона, разработаны препаративные методы синтеза промежуточных и конечных соединений, определены границы применения рециклизации 2-(2-карбоксибензил)фуранов.
- Синтез производных изохинолона
- Синтез амидов 2-(2-карбоксибензил)фуранов
Для всестороннего изучения реакции рециклизации амидов орто-карбоксибензилфуранов было решено получить широкий ряд этих соединений, отличающихся заместителями при атоме азота, в арильном и фурановом фрагменте.
Синтезировать амиды из соответствующих хлорангидридов не удалось из-за ацидофобности фуранового кольца. При использовании оксалил хлорида или,-дихлорметилметилового эфира наблюдалось лишь осмоление реакционной смеси. Оптимальным оказался способ синтеза амидов с использованием дициклогексилкарбодиимида (DCC) (схема 2.1).
Схема 2.5

Характер заместителей в амидах 10а,в-и,л,о показан в таблице 2.1. Получить амид 10б (R1 = NO2) нам не удалось. По-видимому, наличие нитрогруппы в молекуле исходного метана 4б настолько понижает нуклефильные свойства гидроксильной группы, что взаимодействие с DCC не протекает.
- Реакция рециклизации амидов
Синтезированный ряд амидов был использован в изучении реакции рециклизации в производные изохинолона. При кипячении амидов 10а,в-ж,и в течение 25 мин. в 16 % растворе пара-ТСК в бензоле (условия А) в реакционной смеси наблюдался единственный продукт – тетрациклические изохинолоны 13а,в-ж,и, но в ходе реакции в незначительных концентрациях образовывались промежуточные вещества (схема 2.2, таблица 2.1).
Схема 2.6
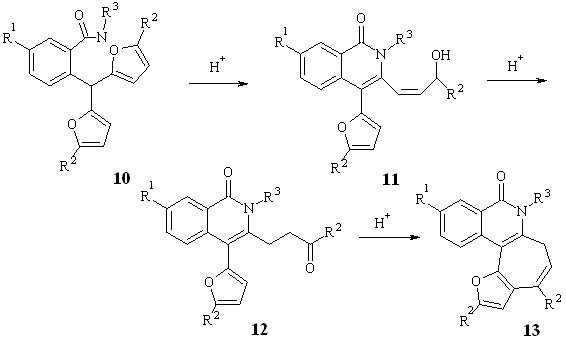
Таблица 2.5 – Выходы веществ 11в-д,л,о 12в-д,л,о, 13а,в-и,л,о
| Соединение 10,11, 12,13 | R1 | R2 | R3 | Выход 11в-д,л,о (%), условия А/Б | Выход 12в-д,л,о (%), условия А/Б | Выход 13а,в-и,л,о (%), условия А/Б | ||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| а | H | Me | H | - | - | 13а | 54/- | |||
| в | Cl | Me | Me | 11в | 0/27 | 12в | 0/29 | 13в | 57/17 | |
| г | Br | Me | Me | 11г | 0/26 | 12г | 0/32 | 13г | 57/14 | |
| д | H | Me | Me | 11д | 0/25 | 12д | 0/31 | 13д | 55/15 | |
| е | H | Me | Et | - | - | 13е | 55/- | |||
| ж | H | Me | i-Pr | - | - | 13ж | 45/- | |||
| з | H | Me | t-Bu | - | - | 13з | 0/0 | |||
| и | H | Me | Bn | - | - | 13и | 55/- | |||
| л | H | t-Bu | Me | 11л | 0/19 | 12л | 50/32 | 13л | 0/0 | |
| о | Br | t-Bu | Me | - | 12о | 52/- | 13о | 0/0 | ||
"-" – опыт не проводили
Уменьшение концентрации пара-ТСК в бензоле до 3 % и увеличение времени реакции до 40 мин. (условия Б) позволило повысить селективность реакции по промежуточным продуктам. Помимо ожидаемых кетонов 12 нам удалось выделить аллильные спирты 11.
Следует отметить, что образования аллильных спиртов в случае рециклизации других орто-замещенных бензилфуранов мы не наблюдали. Изменение условий проведения реакции ни разу не позволило зафиксировать образование какого-либо промежуточного продукта при рециклизации орто-аминофенилдифурилметанов, орто-гидроксифенилдифурилметанов, орто-карбоксифенилдифурилметанов, орто-гидроксиметилфенилдифурилметанов в реакциях синтеза производных индола, бензофурана, изохромона и бензопирана соответственно. Тем не менее, образование аллильных спиртов в результате внутримолекулярных кислотно-катализируемых рециклизаций фурановых соединений описано. Литературные и полученные нами экспериментальные данные побудили нас уточнить возможный механизм данной реакции.
Образующиеся промежуточные аллильные спирты быстро исчезают в ходе реакции и могут быть зафиксированы, пока не израсходованы исходные амиды 10. Предположительно спирты 11 являются промежуточными соединениями превращения амидов 10 в кетоны 12. Для подтверждения нашего предположения спирты 11в,г,д были обработаны кипящим 3% бензольном раствором пара-ТСК (условия Б), однако из реакционной смеси удалось выделить лишь тетрациклические соединения 13в,г,д. Во избежание внутримолекулярной циклизации и для подтверждения предположения об изомеризации 1112 мы попытались синтезировать спирт 15л (схема 2.3).
Кипячение соединения 14л в 16 % бензольным раствором пара-ТСК (условия А), как и предполагалось, гладко с выходом 68 % приводило к кетону 16л. Уменьшение концентрации пара-ТСК до 3 % приводило к увеличению времени конверсии амида 14л. Тем не менее, выделить спирт 15л нам не удалось. В реакционной смеси методом ТСХ в незначительной концентрации был обнаружен промежуточный продукт, который быстро расходовался в процессе реакции. Низкая концентрация и незначительная разница Rf этого промежуточного продукта и кетона 16л не позволила выделить его для установления структуры.
Схема 2.7

Из нашей работы известно, что рециклизация 2-карбоксиарилдифурилметанов 4л-п, замещенных трет-бутильными группами в пятом положении фурановых циклов, останавливается на стадии образования соответствующих кетонов 6л-п, и вторичная внутримолекулярная циклизация с участием 3-оксоалкильного фрагмента этих кетонов невозможна из-за стерических факторов. Учитывая это, мы изучили рециклизацию амидов 10л,о.
Кипячение амидов 10л,о в 16 % бензольном растворе пара-ТСК (условия А) привело к кетонам 12л,о с выходом 50-52 %. Также как и в случае амида 14л, при уменьшении концентрации пара-ТСК в ходе рециклизации амидов 12л,о в реакционной смеси мы наблюдали образование промежуточного продукта, который незначительно отличался по Rf от основного продукта. В небольшом количестве нам все же удалось выделить спирт 11л. Кипячение последнего в бензольном растворе пара-ТСК гладко приводило к кетону 12л.
Таким образом, реакция рециклизации амидов орто-карбоксибензилфуранов действительно протекает через промежуточное образование аллильных спиртов. Вероятно, в случае бензилфуранов, несущих другие орто-заместители, аллильные спирты также образуются, но обнаружить их не удается из-за быстрой изомеризации и, как следствие, низкой концентрации в реакционной смеси, либо за счет совпадения Rf спиртов и соответствующих кетонов.
Структура и пространственное строение соединения 13и исследованы методом рентгеноструктурного анализа (рисунокРисунок 2.1).
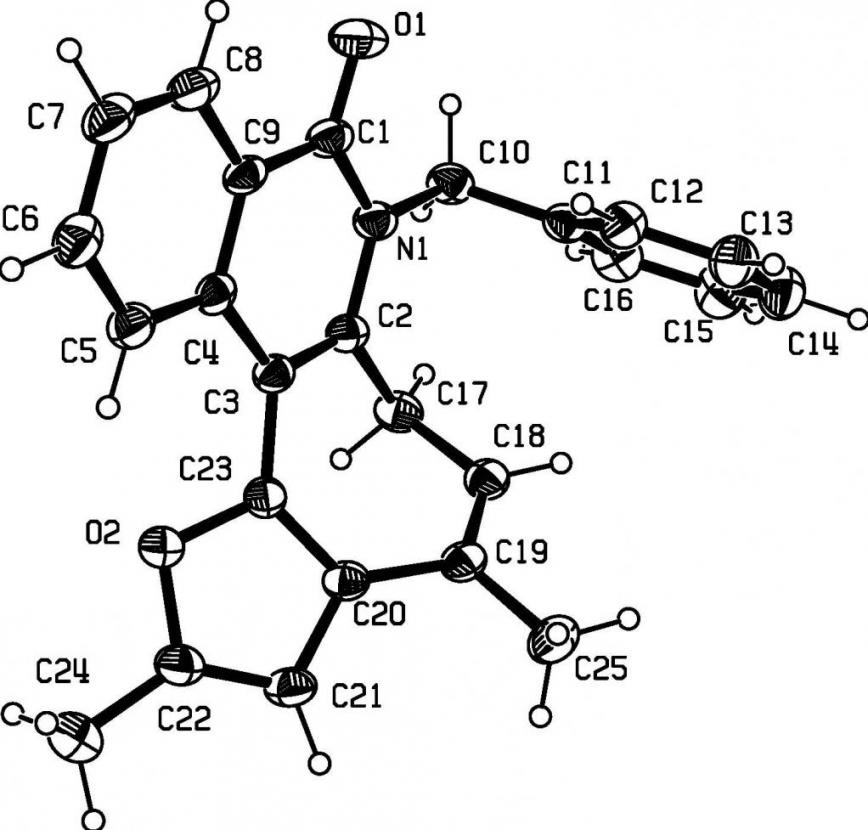
Рисунок 2.2 - Проекция пространственной модели молекулы соединения 13и в монокристалле
- Трансформация изохромонов в изохинолоны
Синтезированная нами тетрациклическая система 17 относится к редкому типу соединений, включающих в себя два фармакафорных фрагмента - изохинолоновое ядро и семичленный карбоцикл, что делает ее желанным объектом органического синтеза. Более того, незамещенные по атому азота изохинолоны, предоставляют большие возможности для их дальнейшей модификации.
Превращения производных изохромона в соответствующие производные изохинолона, незамещенные по атому азота, хорошо известны. Для этого применяют кипячение в водном или этанольном растворе аммиака, а также метоксиэтаноле, насыщенном аммиаком. Однако данные условия превращений оказались непригодны для синтеза изохинолонов 17.
Мы нашли, что кипячение изохромонов 7а,в,г,е-з,п в формамиде в течение 25-60 минут приводит к соответствующим изохинолонам 13a, 17в,г,е-з,п (схема 2.4). Осуществить трансформацию нитроизохромона 7б в нитроизохинолон 17б нам не удалось. В ходе реакции образовывалась неидентифицируемая смесь продуктов.
Схема 2.8
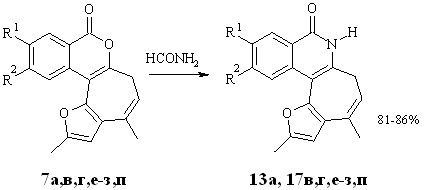
Отметим, что данное превращение дает более высокие выходы изохинолонов 13а и 17в,г,е-з,п, чем рециклизация соответствующих амидов. Применение формамида в реакциях трансформации изохромонового цикла в изохинолоновый ранее описано не было.
Таким образом, всесторонне изучена реакция кислотно-катализируемой рециклизации амидов 2-(2-карбоксибензил)фурана, разработаны методы синтеза амидов и изохинолонов, уточнены детали механизма протекания реакции рециклизации.
- Синтез производных пиридазиноизохинолона
- Рециклизация гидразидов 2-(2-карбоксибензил)фуранов (метод А)
В целях расширения синтетической применимости разработанного метода получения бензаннелированных гетероциклов, мы решили протестировать гидразиды орто-карбоксибензилфуранов в изучаемой реакции рециклизации.
Для этого метаны 4 алкилировали йодистым метилом в ДМСО в присутствии KOH. Кипячение полученных эфиров 18 в 50 % растворе гидразингидрата в н-бутаноле приводило к гидразидам 19, которые без предварительной очистки использовали на следующей стадии - рециклизации. Рециклизацию проводили при кипячении в безводном 16 % растворе пара-ТСК в бензоле, что давало в итоге пиридазиноизохинолоны 20 (схема 3.1, таблица 3.1) - метод А.
Схема 3.9
Таблица 3.6 – Выходы эфиров 18а-е,р, гидразидов 19а,в-е,р, пиридазиноизохинолонов 20а,в-е,р
| Соединения 18,19,20 | R1 | R2 | Выход 18а-е,р, (%) | Выход 19а,в-е,р, (%) | Выход 20а,в-е,р, (%) |
| а | H | H | 86 | 72 | 25 |
| б | NO2 | H | 82 | 0 | - |
| в | Cl | H | 80 | 70 | 30 |
| г | Br | H | 83 | 65 | 32 |
| д | H | Br | 82 | 68 | 33 |
| е | H | Cl | 85 | 60 | 35 |
| р | I | H | 87 | 71 | 31 |
Структура и пространственное строение соединения 20д исследованы методом рентгеноструктурного анализа (рисунокрисунок 3.1).
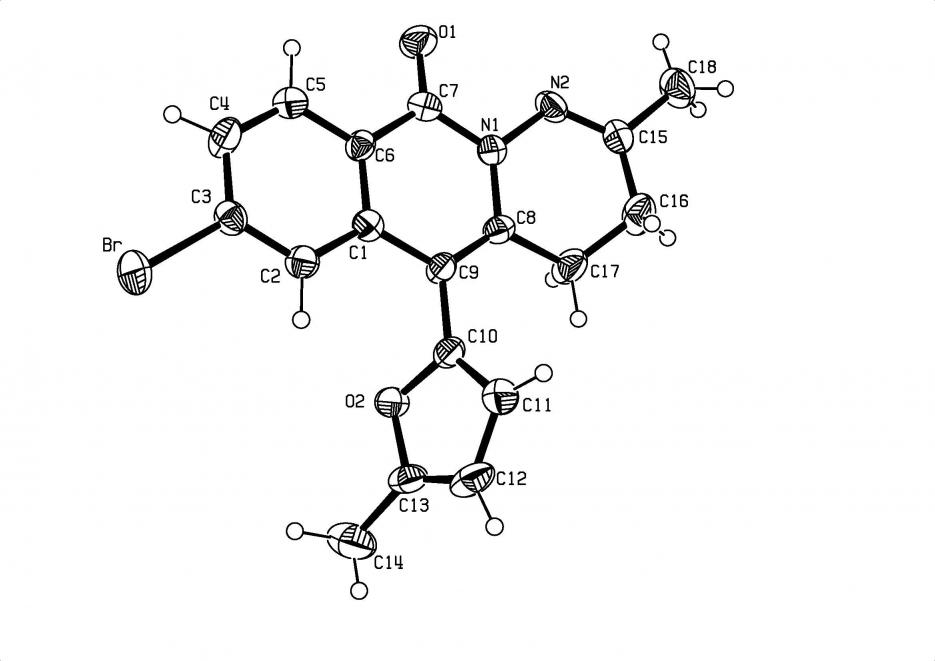
Рисунок 3.3 - Проекция пространственной модели молекулы соединения 20д в монокристалле
- Синтез через циклизацию гидразонов (метод Б)
Синтез пиридазиноизохинолонов в результате рециклизации гидразидов оказался не очень удачным. В ходе рециклизации образовалось большое количество примесей, создававших трудности при выделении продуктов. К тому же, выходы пиридазиноизохинолонов оказались не очень высоки, что побудило нас разработать альтернативный способ синтеза.
Принимая во внимание возможность замены гетероатома в молекуле изохромона на атом азота при его взаимодействии с аминами, гидразином, гидроксиламином с получением соответствующих изохинолонов, решено было осуществить внутримолекулярную циклизацию гидразонов 21.
Гидразоны 21 были получены из кетонов 6 при перемешивании с гидразингидратом в этиленгликоле. Реакция проходила за 20-30 мин. Полученный раствор без выделения гидразонов 21 кипятили в течение 15 мин., что приводило к продуктам циклизации - пиридазиноизохинолонам 20 (метод Б). Реакция проходила быстро и достаточно чисто (схема 3.2). Пиридазиноизохинолоны, полученные из кетонов идентичны соединениям, синтезированным при рециклизации гидразидов.
Схема 3.10
Таблица 3.7 – Выходы пиридазиноизохинолонов 20а,в-д
| Соединения | R1 | R2 | Выход 20а,в-д, Метод А, (%)* | Выход 20а,в-д, Метод Б, (%)* |
| а | H | H | 25 | 38 |
| в | Cl | H | 30 | 35 |
| г | Br | H | 32 | 38 |
| д | H | Br | 33 | 38 |
*в пересчете на исходные метаны 4а,в-д
В таблице 3.2 приведены выходы пиридазиноизохинолонов в пересчете на исходные метаны 4. Очевидно, что встречный синтез (метод Б) дает более высокие выходы продуктов. Более того, с препаративной точки зрения, метод Б намного удобнее, так как требует меньше времени и усилий на очистку продуктов.
Несмотря на кажущуюся простоту, пиридазино[1,6-b]изохинолоновый каркас является совершенно новой гетероциклической структурой. Синтезированы лишь его бензаннелированные аналоги, но последние относят уже к другим классам гетероциклических соединений.
ВЫВОДЫ
- Разработана методология получения производных изохромона и изохинолона на основе кислотно-катализируемой реакции рециклизации 2-(2-карбоксибензил)фуранов и их амидов.
- Установлено, что рециклизация 2-карбоксиарилдифурилметанов и их амидов может сопровождаться внутримолекулярной циклизацией по второму фурановому циклу, приводящей к тетрациклическим производным изохромона и изохинолона соответственно. Исключение составляют 2-карбоксиарилдифурилметаны, содержащие объемную трет-бутильную группу в 5-положении фурановых циклов.
- Найдено, что уменьшение количества кислотного катализатора позволяет выделить кетоны изохромонового и изохинолонового ряда.
- Показано, что вторичная циклизация гидразидов 2-карбоксиарилдифурилметанов протекает не по фурановому циклу, а по аминогруппе и приводит к образованию новой гетероциклической системы – пиридазино[1,6-b]изохинолону. Последняя может быть получена альтернативным методом - внутримолекулярной циклизацией 3-(3-гидразонобутил)изохромонов.
- Уточнен механизм рециклизации орто-замещенных бензилфуранов на примере 2-(2-карбамоилбензил)фуранов; установлено, что реакция протекает через промежуточное образование цис-аллильных спиртов, которые в кислых условиях изомеризуются в соответствующие кетоны.
- Найден новый путь трансформации изохромонов в изохинолоны посредством кипячения в формамиде.
- Показано, что добавление воды при конденсации 2-формилбензойных кислот и 2-алкилфуранов значительно увеличивает долю 3-(5-алкил-2-фурил)фталида в продуктах реакции.
Основное содержание диссертации изложено в следующих работах:
- Gutnov, A. V. Bis(5-alkyl-2-furyl)(2-carboxyphenyl)-methanes for the synthesis of tetracyclic isochromone derivatives / A. V. Gutnov, V. T. Abaev, A. V. Butin, A. S. Dmitriev // J. Org. Chem. – 2001. – Vol. 66. – P. 8685-8686.
- Butin, A.V. Recyclization of Hydrazides of 2-Carboxyphenyldifurylmethanes: Synthesis of Novel 4,10-Dihydro-3H-pyridazino[1,6-b]isoquinolin-10-one System / A. S. Dmitriev, V. T. Abaev, V. E. Zavodnik // Synlett. – 2006. –P. 3431-3434.
- Дмитриев, А. С. Новый синтез 3-(2-фурил)фталидов / А. С. Дмитриев, А. С. Пилипенко, В. Т. Абаев и др. // Химия гетероцикл. соединений. – 2005. – № 9. – С. 1302-1304.
- Дмитриев, А. С. 2-Карбоксиарилдифурилметаны в синтезе кетонов изокумаринового ряда / А. С. Дмитриев, С. А. Поделякин, В. Т. Абаев, А. В. Бутин // Химия гетероцикл. соединений. – 2005. – № 9. – С. 1400-1402.
- Дмитриев, А. С. Новый подход к синтезу тетрациклической конденсированной системы-фуро[2',3':3,4]циклогепта[1,2-с]изохинолин-8(6H)-она / А. С. Дмитриев, В. Т. Абаев, А. В. Бутин // Химия гетероцикл. соединений. – 2005. – № 9. – С. 1402-1404.
- Abaev, V. T. Furan ring opening – isocoumarine ring closure: a recyclization reaction of 2-carboxyaryldifurylmethanes / V. T. Abaev, A. S. Dmitriev, A. V. Gutnov, et al // J. Heterocyclic Chem. – 2006. – Vol. 43. – P. 1195-1204.
- Пат. 2282632 Российская Федерация. Способ получения производных 3,5-дигидро-1,11-диметилфуро[2',3':3,4]циклогепта[с]изохинолин-5-она / А. С. Дмитриев, В. Т. Абаев, А. С. Пилипенко, С. А Поделякин, А. В. Бутин; заявитель и патентообладатель Кубан. гос. технол. ун-т. – № 2005109766/04; заявл. 04.04.05; опубл. 27.08.06.
- Дмитриев, А. С. Синтез новых производных изохромона / А. С. Дмитриев, В. Т. Абаев, А. В. Бутин, А. В Гутнов // V-Молодежная научная школа по органической химии: тез. докл. 22-26 апреля 2002 г. – Екатеринбург, 2002. – С. 161.
- Abaev, V. T. Synthesis of new heterocyclic sistems: 3,5-dihydrofuro[2’,3’:3,4]cyclohepta[c]isochrom-en-5-one and 4,5-dihydro-3H-furo[2’,3’:3,4]cyclohepta[c]isoquinolin-5-one / V. T. Abaev, A. V. Butin, A. S Dmitriev, A. V. Gutnov // XXth European Colloquium on Heterocyclic Chemistry. Book of Abstracts. August 18-21, 2002. – Stockholm, Sweden, 2002. – P. A:14.
- Бутин, А. В. Фуран в синтезе производных изохромона / А. В. Бутин А. С. Дмитриев, А. В Гутнов В. Т. Абаев // В книге “Химия и биологическая активность кислород- и серусодержащих гетероциклов” / Под ред. В. Г. Карцева. – М.: IBS-Press. – 2003. – Т. 1. – С. 189-192.
- Dmitriev, A. S. Isochromone derivatives synthesis via protolytic furan ring opening reaction / A. S. Dmitriev, V. T. Abaev, A. V. Gutnov A. V. Butin // 10th Blue Danube Symposium on Heterocyclic Chemistry. Abstracts of papers. September 3-6, 2003. – Vienna, Austria, 2003. – P. PO-1.
- Дмитриев, А. С. Бензилфураны в синтезе производных изохромона / А. С. Дмитриев, А. С. Пилипенко, С. А Поделякин, А. В. Бутин // Четвертый Всероссийский симпозиум по органической химии: тез. докл. 5-7 июля 2003 г. – Теплоход Москва-Углич-Москва, 2003. – С. 52.
- Дмитриев, А. С. Синтез тетрациклических производных изохинолона / А. С. Дмитриев, С. А Поделякин, А. С. Пилипенко, В. Т. Абаев // Международная конференция по химии гетероциклических соединений, посвященная 90-летию со дня рождения профессора Алексея Николаевича Коста: тез. докл. 17-21 сентября 2005 г. – Москва, 2005. – С. 62.
- Дмитриев, А. С. Амиды орто-карбоксибензилфуранов в синтезе производных изохинолона / А. С. Дмитриев, В. Т. Абаев, А. С. Пилипенко и др. // В книге “Химия и биологическая активность синтетических и природных соединений. Азотсодержащие гетероциклы” / Под ред. В. Г. Карцева. – М.: IBS-Press. – 2006. – Т. 2. – С. 106.
- дмитриев, а. с. Рециклизация гидразидов о-карбоксибензилфуранов / а. с. дмитриев, и. а. байда, в. т. абаев, а. в. бутин // International symposium on advanced science in organic chemistry. Abstracts. June 26-30, 2006. – Sudak, Crimea, 2006. – P. C050.
- Abaev, V. T. Synthesis of novel heterocyclic system of 4,10-dihydro-3H-pyridazino[1,6-b]isoquinolin-10-one / V. T. Abaev, A. S. Dmitriev, A. V. Butin // 4th Eurasian Meeting on Heterocyclic Chemistry. Book of Abstracts. August, 27-31, 2006. –– Thessaloniki, Greece, 2006. – P. 183-184.

