Синтез и физико-химические свойства порфиразинов с азотсодержащими гетероциклами
На правах рукописи
Кокарева
Елена Александровна
Синтез и физико-химические свойства порфиразинов
с азотсодержащими гетероциклами
02.00.03 – органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Иваново 2011
Работа выполнена на кафедре органической химии Федерального Государственного Бюджетного образовательного учреждения высшего профессионального образования «Ивановский государственный химико-технологический университет»
Научный руководитель:
доктор химических наук, профессор Хелевина Ольга Григорьевна
Официальные оппоненты:
доктор химических наук, профессор Плахтинский Владимир Владимирович
доктор химических наук, профессор Исляйкин Михаил Константинович
Ведущая организация:
УРАН «Институт химии растворов им. Г.А. Крестова РАН», г. Иваново
Защита диссертации состоится «28» ноября 2011 г в 10 часов на заседании совета по защите докторских и кандидатских диссертаций Д 212.063.01 в ФГБОУ ВПО «Ивановский государственный химико-технологический университет»
по адресу: 153000, г. Иваново, пр. Ф. Энгельса, д. 7.
Тел. (4932)32-54-33. Факс (4932)32-54-33, e-mail [email protected]
С диссертацией можно ознакомиться в библиотеке
Ивановского государственного химико-технологического университета
по адресу: 153000, г. Иваново, пр. Ф. Энгельса, д. 10.
Автореферат разослан « 26 » октября 2011 г.
Ученый секретарь
совета по защите докторских и
кандидатских диссертаций Кувшинова Е.М.
Д 212.063.01
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Порфиразины являются очень интересными объектами для исследования, т.к. обладают уникальными физико-химическими свойствами и тем самым находят широкое практическое применение в области катализа и электрокатализа, в нелинейной оптике, тонкопленочной электронике, сенсорике, а также используются в качестве фоточувствительных и жидкокристаллических материалов, пигментов и органических красителей, фотосенсибилизаторов для фотодинамической терапии рака.
Изменение строения порфиразина за счет введения ароматических и гетероароматических фрагментов позволяет получить широкий круг новых соединений, кардинальным образом отличающихся по своим свойствам, и находить новые области их практического применения, как например, использование в качестве катализаторов реакций сополимеризации с различными гетероциклическими соединениями (эпоксиды, азиридины, эписульфиды).
Актуальной задачей, стоящей перед исследователями, является установление взаимосвязи между строением порфиразина и его свойствами.
Цель работы. Синтез и физико-химические свойства порфиразинов с азотсодержащими гетероциклами.
Для достижения этой цели были поставлены и решены следующие задачи:
- синтез симметричных и новых несимметричных порфиразинов с аннелированными азотсодержащими гетероциклами и исследование их спектральных свойств;
- изучение состояния синтезированных порфиразинов в протонодонорных и протоноакцепторных средах и выявление влияния строения макроцикла на основные и кислотные свойства соединений;
- синтез новых несимметричных бис(пиридил-3-окси)трис(трет-бутил)фталоциани натов кобальта (III) и хрома (III) и их алкилированных производных; тетра(трет-бутил)фталоцианинатов кобальта (III) и хрома (III); изучение каталитических свойств соединений в реакции сополимеризации пропиленоксида с углекислым газом.
При решении поставленных задач использовались методы электронной абсорбционной, ИК- и 1Н ЯМР-спектроскопии, масс-спектрометрии, спектропотенцио-метрии, элементного анализа, гель-проникающей хроматографии, тонкослойной и колоночной хроматографии и квантово-химических расчетов.
Научная новизна. Впервые синтезированы и охарактеризованы физико-химическими методами анализа несимметричные фенилзамещенные монопиразино- и моноимидазолотрибензопорфиразины; бис(пиридил-3-окси)трис(трет-бутил )фталоцианины и их комплексы с хромом (III) и кобальтом (III), комплекс тетра(трет-бутил)фталоцианина с хромом (III). Разработан новый способ получения комплекса тетра(трет-бутил)фталоцианина с кобальтом (III).
На основании исследований реакций кислотно-основного взаимодействия замещенных тетрапиразинопорфиразинов и их комплексов с эрбием(III) и лютецием(III) с ацетилацетонатным экстралигандом в протонодонорных средах на основе уксусной и трифторуксусной кислот показано, что в случае лигандов сначала протонируются пиразиновые фрагменты, а затем мезо-атомы азота. В случае комплексов, наоборот, на первой стадии протонируются мезо-атомы азота, а далее атомы азота пиразиновых фрагментов. Установлено, что аннелирование макроциклом тетраазапорфирина пиразиновых колец приводит к значительному уменьшению основности соединений.
Впервые проведено исследование кислотных свойств октаэтилтетрапиразино-порфиразина и 5,7–дифенил-1,4-диазепинотрибензопорфиразина полуэмпирическим методом РМ3 с использованием лицензионного программного пакета HyperChem 7.0 и спектропотенциометрическим методом в среде ДМСО – К[2.2.2]ОН. Обнаружены две обратимые ступени депротонирования с близкими значениями констант равновесия. Установлено, что аннелирование макроциклом четырех пиразиновых колец приводит к повышению кислотности соединения по сравнению с порфиразином и фталоцианином. Замена одного бензольного фрагмента в молекуле фталоцианина на диазепиновый фрагмент приводит к понижению кислотности соединения. Высказано предположение, что в среде ДМСО-K[2.2.2]OH дианионы порфиразинов существуют в виде аквакомплексов с двумя молекулами воды.
Научная и практическая значимость. Впервые разработаны методы синтеза несимметричных производных порфиразина с аннелированными N-содержащими гетероциклами (пиразин, имидазол). Впервые получены несимметричные пиридилокси-производные фталоцианина и тетра(трет-бутил)фталоцианинат хрома (III). Синтези-ровано 10 новых порфиразинов, изучены их спектральные и физико-химические свойства.
Полученные в работе данные о состоянии порфиразиновых макроциклов в протонодонорных и протоноакцепторных средах могут быть использованы при выборе оптимальных условий их синтеза и практического применения. Сведения о межмолекулярном переносе протонов NH-групп в макроцикле могут быть полезны при рассмотрении процессов переноса протонов в биосистемах. Результаты исследования процессов кислотно-основных взаимодействий изученных порфиразинов вносят вклад в развитие физической органической химии.
Обнаружена каталитическая активность комплексов алкилированных производных несимметричного фталоцианина с кобальтом (III) в реакции сополимеризации углекислого газа с пропиленоксидом с образованием пропиленкарбоната. Установлена высокая каталитическая активность комплекса тетра(трет-бутил )фталоцианината хрома (III) при образовании полипропиленкарбоната и пропиленкарбоната, а также алкилированного производного бис(пиридил-3-окси)трис(трет-бутил )фталоцианината хрома (III) в образовании пропиленкарбоната.
Личный вклад автора. Непосредственное участие на всех этапах работы: постановка цели и задач работы, планирование эксперимента, обсуждение полученных результатов. Все описанные в работе экспериментальные исследования выполнены лично автором.
Настоящая работа выполнена при поддержке гранта РФФИ 09-03-97504-р_центр_а, в рамках конкурса «Стипендия Президента РФ для поездки за рубеж» и Федеральной Целевой Программы «Исследования и разработки по приоритетным направлениям развития научно-технического комплекса России» № 2008-10-1.3-07-31-105 (2007-2012).
Апробация работы. Результаты работы докладывались и обсуждались на Всероссийской научной конференции «Природные макроциклические соединения и их синтетические аналоги» (г. Сыктывкар, 2007 г.); XXIII Международной Чугаевской конференции по координационной химии (г. Одесса, 2007 г.); VII Школе-конференции молодых ученых стран СНГ по химии порфиринов и родственных соединений (г. Одесса, 2007 г.); V International Conference on Porphyrins and Phthalocyanines (г. Москва, 2008 г.); XXIV Международной Чугаевской конференции по координационной химии (г. Санкт-Петербург, 2009 г.); X Международной конференции по физической и координационной химии порфиринов и их аналогов (ICPC-10) (г. Иваново, 2009 г.); XII Молодежной конференции по органической химии (г. Суздаль, 2009 г.); XIII Школе-конференции молодых ученых стран СНГ по химии порфиринов и родственных соединений (Абхазия, г. Гагра, 2009 г.); III Международной конференции по химии гетероциклических соединений (КОСТ-2010) (г. Москва, 2010 г.); XI Международной конференции по физической и координационной химии порфиринов и их аналогов (ICPC-11) (Украина, г. Одесса, 2011 г.).
Публикации. По материалам диссертационной работы опубликовано 5 статей и 11 тезисов докладов.
Объем и структура диссертации. Диссертация изложена на 163 страницах машинописного текста и состоит из введения, литературного обзора, экспериментальной части, обсуждения полученных результатов, выводов. Работа содержит 14 таблиц, 98 рисунков, 24 схемы и списка цитируемой литературы, включающего 159 работ.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
- Литературный обзор
В литературном обзоре рассмотрены общие подходы к синтезу порфиразинов, методы синтеза производных фталоцианина, пиразинопорфиразинов, диазепино-порфиразинов, также рассмотрено их строение на основе данных электронной абсорбционной, ИК-, 1Н ЯМР-спектроскопии. Рассмотрены вопросы кислотно-основных взаимодействий порфиразинов в протонодонорных и протоноакцепторных средах, а также реакционной способности порфиразинов в реакциях комплексо-образования в растворах.
- Экспериментальная часть
В этой части работы описаны методы очистки использованных в работе растворителей, методы синтеза промежуточных соединений, исследуемых порфиразинов и их комплексов. Приведены данные элементного анализа, масс-спектрометрии, электронной абсорбционной, 1Н ЯМР-, ИК-спектроскопии. Описаны методики исследования кислотно-основных взаимодействий спектрофотометрическим и спектропотенциометрическим методами и реакции комплексообразования октаэтилтетрапиразино- порфиразина в пиридине с ацетатом магния.
- Обсуждение результатов
- Синтез и спектральные характеристики (2,3-дифенил)пиразино-
и (2-фенил)имидазолотрибензопорфиразина [Bz3PyzPzH2], [Bz3ImHPzH2]
Одним из способов изменения строения молекул порфиразинов является введение химически активного диазепинового кольца и его дальнейшие превращения. Диазепиновое кольцо в различных условиях может подвергаться фрагментации и перегруппировкам. Нами впервые методом дробно-вакуумной сублимации[1] 5,7-дифенил-1,4-диазепинотрибензопорфиразина [Bz3DzPzH2] получена смесь двух новых несимметричных порфиразинов [Bz3PyzPzH2] и [Bz3ImHPzH2] (схема 1), которая была разделена методом колоночной хроматографии. Строение порфиразинов установлено по данным элементного анализа и масс-спектрометрии (рис. 1 и 2). Электронные спектры поглощения порфиразинов представлены на рисунках 3,4.
![MALDI-TOF спектр[Bz3PyzPzH2] MALDI-TOF спектр-0](/images1/223830/maldi-tof-spektr-bz3pyzpzh2-maldi.jpg)
 Рис.1. MALDI-TOF спектр[Bz3PyzPzH2] Рис.1. MALDI-TOF спектр[Bz3PyzPzH2] | 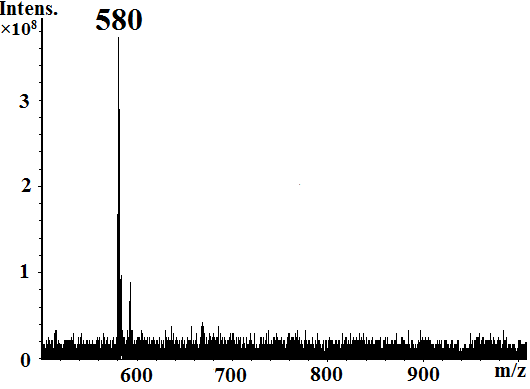 Рис.2. MALDI-TOF спектр [Bz3ImHPzH2] Рис.2. MALDI-TOF спектр [Bz3ImHPzH2] |
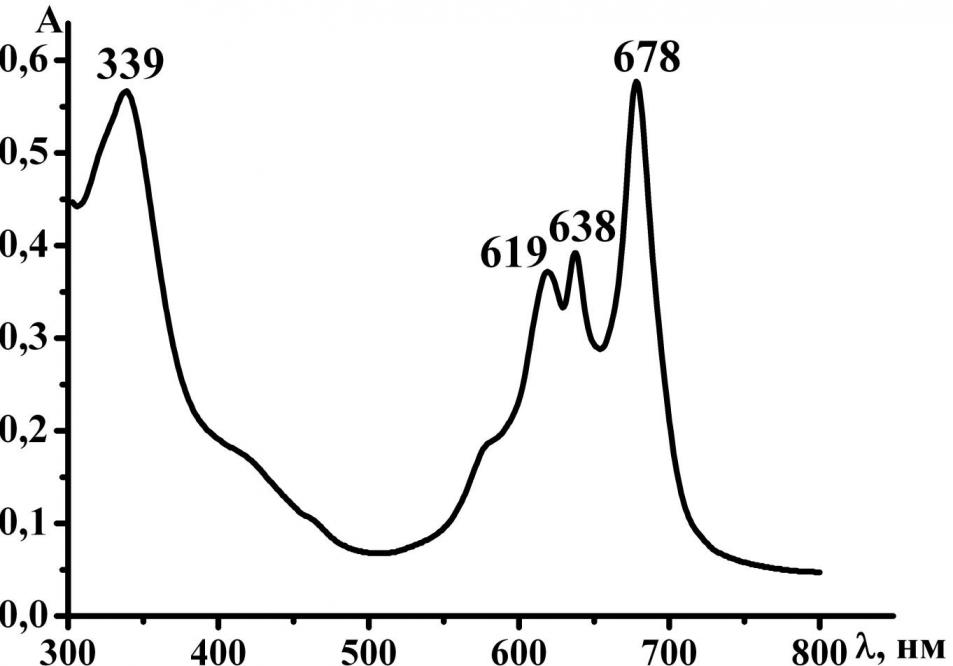 Рис.3. ЭСП [Bz3ImHPzH2] в CHCl3-CH3OH Рис.3. ЭСП [Bz3ImHPzH2] в CHCl3-CH3OH | 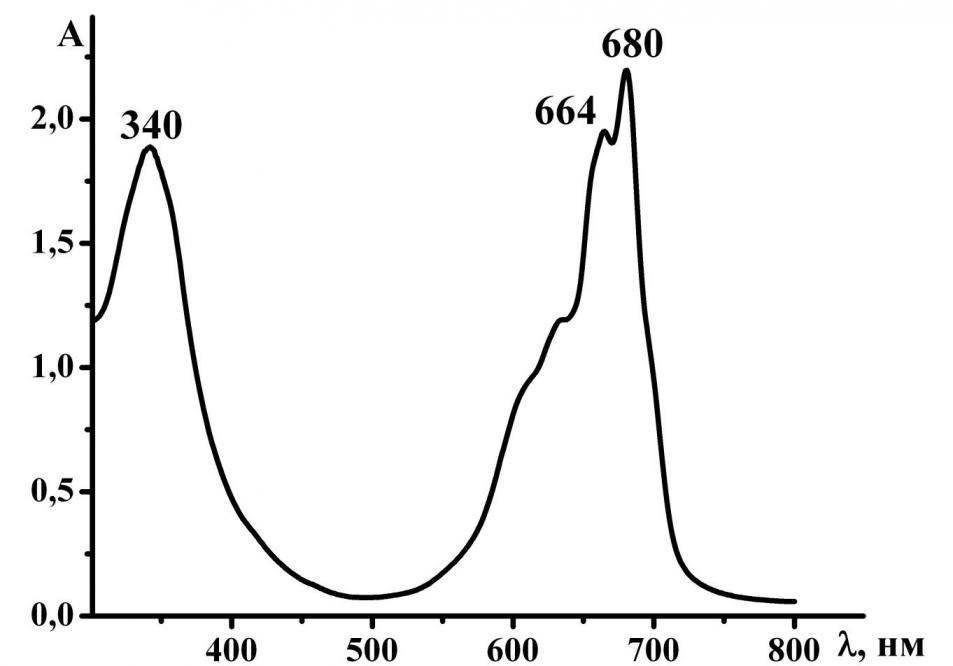 Рис.4. ЭСП [Bz3PyzPzH2] в CHCl3-CH3OH Рис.4. ЭСП [Bz3PyzPzH2] в CHCl3-CH3OH |
Таким образом, метод сублимации является весьма удобным способом синтеза данных соединений. Особенно это важно для [Bz3ImHPzH2], который нельзя получить непосредственно методом темплатной циклотетрамеризации, поскольку 4,5-ди цианоимидазол не активен в этом синтезе. Метод сублимации предлагается нами в качестве метода синтеза и очистки имидазольных производных порфиразина с разными заместителями во втором положении имидазольного цикла, используя в качестве исходных продуктов разные производные диазепинопорфиразина.
(2,3-Дифенил)пиразинотрибензопорфиразин был также получен нами деметаллированием в 100%-ной трифторуксусной кислоте комплекса магния [Bz3PyzPzMg], который в свою очередь был синтезирован через фталоцианиновый интермедиат методом, разработанным Лежноффом для получения несимметричных порфиразинов (схема 2). [Bz3PyzPzMg] был выделен из смеси фталоцианина и других пиразинопроизводных порфиразинов методом колоночной хроматографии. Строение комплекса магния установлено по данным электронной абсорбционной, ИК-спектроскопии и элементного анализа.
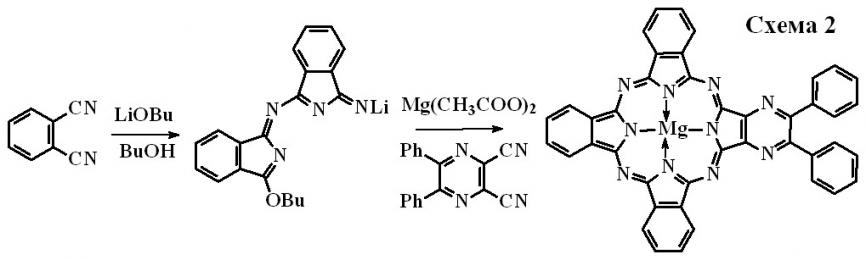
Показано, что магний координирует две молекулы воды. Как и лиганд [Bz3PyzPzH2], комплекс магния сильно агрегирован в растворах.
- Кислотно-основные взаимодействия (КОВ) порфиразинов
в протонодонорных и протоноакцепторных средах
Представляло интерес исследование влияния аннелированных N-гетероциклов на кислотно-основные взаимодействия порфиразинов. КОВ (2-фенил)имидазоло- и (2,3-дифенил)пиразинотрибензопорфиразинов изучить не удалось из-за их сильной агрегации в растворах. В связи с этим процессы КОВ рассмотрены на примере замещенных тетрапиразинопорфиразинов, а влияние введения металла - на примере комплексов с РЗЭ: с лютецием (III) и эрбием (III)[2] в протонодонорных средах (СH2Cl2-CF3COOH и CH3COOH-H2SO4) спектрофотометрическим методом и в протоноакцепторных средах спектрофотометрическим и спектропотенциометрическим методами, а также 5,7-дифенил-1,4-диазепинотрибензопорфиразина в протоноакцепторной среде спектропотенциометрическим методом.
- Кислотно-основные взаимодействия тетрапиразинопорфиразинов
в протонодонорных средах
В протонодонорной среде СH2Cl2-CF3COOH тетрапиразинопорфиразины (Et8Pyz4PzH2, Ph8Pyz4PzH2) протонируются по атомам азота пиразиновых фрагментов. Комплексы с редкоземельными элементами на первой стадии протонируются по мезо-атомам азота, а затем по атомам азота пиразиновых фрагментов. В случае комплекса лютеция (III) октапиридилтетрапиразинопорфиразина на первых стадиях возможно протонирование как атомов азота пиразиновых, так и пиридильных фрагментов. Сравнение величин рК (таблица 1) показывает, что металлокомплексы более основны, чем лиганды. Et8Pyz4PzH2 более основен, чем Ph8Pyz4PzH2, следовательно, этильные радикалы увеличивают основность макроцикла в большей степени, чем фенильные радикалы. Установлено, что аннелирование электроноакцепторных пиразиновых колец на периферии макроцикла приводит к значительному уменьшению основности. Ph8Pyz4PzErIII(Асас) более основен, чем Ph8Pyz4PzLuIII(Асас). Это можно объяснить увеличением ионного радиуса эрбия (III) по сравнению с величиной ионного радиуса лютеция (III), что приводит к большему выходу его из плоскости координационного центра, уменьшению ковалентного характера связей М-N и, соответственно, к увеличению основности комплекса. Сравнение основности мезо-атомов азота Ph8Pyz4PzLuIII(Асас) и Pyr8Pyz4PzLuIII(Асас) показывает, что пиридильные радикалы уменьшают основность вследствие их электроноакцепторного характера.
Таблица 1
Концентрационные константы кислотности пиразинопорфиразинов
в среде СH2Cl2-CF3COOH
| Соединение | pK | ||
| pK1 | pK2 | pK3 | |
| Et8Pyz4PzH2 | 1.26 ±0.01 | - | - |
| Ph8Pyz4PzH2 | 0.77 ±0.01 | - | - |
| Ph8Pyz4PzLuIII(Асас) | 2.59 ±0.04 | 0.70 ±0.07 | - |
| Ph8Pyz4PzErIII(Асас) | 3.10 ±0.04 | 0.95 ±0.01 | - |
| Pyr8Pyz4PzLuIII(Асас) | 2.57 ±0.01 | 1.85 ±0.05 | 0.36 ±0.01 |
| Ph8PzLuIII(Асас) | 3.35 ±0.02 | - | - |
Для Ph8Pyz4PzLuIII(Асас) в среде CH3COOH-H2SO4 была получена термодинамическая константа кислотности (4.17 ± 0.06), и установлено, что в интервале концентраций H2SO4 от 0 до 2% образуется монопротонированная форма комплекса по мезо-атому азота. На примере комплексов лютеция (III) с октафенилтетрааза-порфирином (pK = 5.57 для системы бензол – уксусная кислота) и октафенилтетрапиразинопорфиразином показано, что введение пиразиновых фрагментов в макроцикл уменьшает основность мезо-атомов азота, что подтверждают данные, полученные в среде СH2Cl2-CF3COOH.
- Кислотно-основные взаимодействия тетрапиразинопорфиразинов
в протоноакцепторных средах
Нами впервые проведено исследование кислотно-основных взаимодействий октаэтил- и октафенилтетрапиразинопорфиразинов в среде CH2Cl2-ДМСО спектрофотометрическим методом. Анализ спектральных изменений показывает, что в этой среде происходит процесс депротонирования внутрициклических NH-протонов с образованием комплексов с переносом протонов. Для того, чтобы определить, является ли процесс депротонирования тетрапиразинопорфиразинов в ДМСО постадийным, впервые он был изучен спектропотенциометрическим методом[3] в среде К[2.2.2]OH-ДМСО на примере октаэтилтетрапиразино- порфиразина. Спектральные изменения наблюдались в области pH от 5,3 до 8,9 (рис. 5). Процесс депротонирования [Et8Pyz4PzH2] двухстадийный с близкими значениями констант депротонирования (таблица 3). Cравнение тепловых эффектов реакций депротонирования и констант депротонирования (таблица 3) показывает, что [Et8Pуz4PzH2] имеет более сильные кислотные свойства, чем [(t-Bu)4PсH2] и [H2Pz], за счет электроноакцепторного действия пиразиновых фрагментов, которые уменьшают электронную плотность на порфиразиновом макроцикле и тем самым ослабляют связь N-H. Мы полагаем, что возможно, наиболее вероятной формой существования дианиона порфиразина [Et8Pуz4PzH2] в системе ДМСО – К[2.2.2]ОН является аквакомплекс с двумя молекулами реакционной воды (Hf = - 7.16 ккал/моль).
Таблица 3
Тепловые эффекты реакций депротонирования (РМ3 метод) и константы депротонирования порфиразинов (* - литературные данные)
| Вещество | Hf1, | Hf2, | pKa1 | pKa2 |
| ккал/моль | 298 К | |||
| H2Pz* | 325.52* | 414.50* | 11.94 ± 0.04* | 13.45 ± 0.08* |
| [(t-Bu)4PсH2]* | 323.60* | 399.80* | 10.76 ± 0.04* | 12.57 ± 0.04* |
| [Et8Pуz4PzH2] | 309.49 | 381.88 | 7.77±0.01 | 7.80 ±0.01 |
- Комплексообразование октаэтилтетрапиразинопорфиразина с ацетатом магния(II) в пиридине
Для подтверждения более сильных кислотных свойств внутрициклических протонов [Et8Pyz4PzH2] по сравнению с другими порфиразинами нами изучена реакция его комплексобразования с ацетатом магния в пиридине. На рис. 6 показаны спектральные изменения при комплексообразовании [Et8Pyz4PzH2] с ацетатом магния. Образование комплекса магния (II) имеет первый порядок по концентрации лиганда. Экспериментальные данные показали, что эффективные константы скорости реакции практически не зависят от концентрации соли. Порядок реакции по ацетату магния оказался близким к нулю (рис. 7). Таким образом, лимитирующая стадия комплексообразования является мономолекулярной. [Et8Pyz4PzH2] содержит сильные электроноакцепторные пиразиновые фрагменты, что благоприятствует делокализации отрицательного заряда дианиона, образующегося на стадии переходного состояния, и ведет к его стабилизации.
Можно предположить следующую схему процесса:
H2Pz + 2Py Pz2- + 2PyH+ (1)
Pz2- + [Mg(Ру)6](OAc)2 2AcO- + MgPz + 6Py (2)
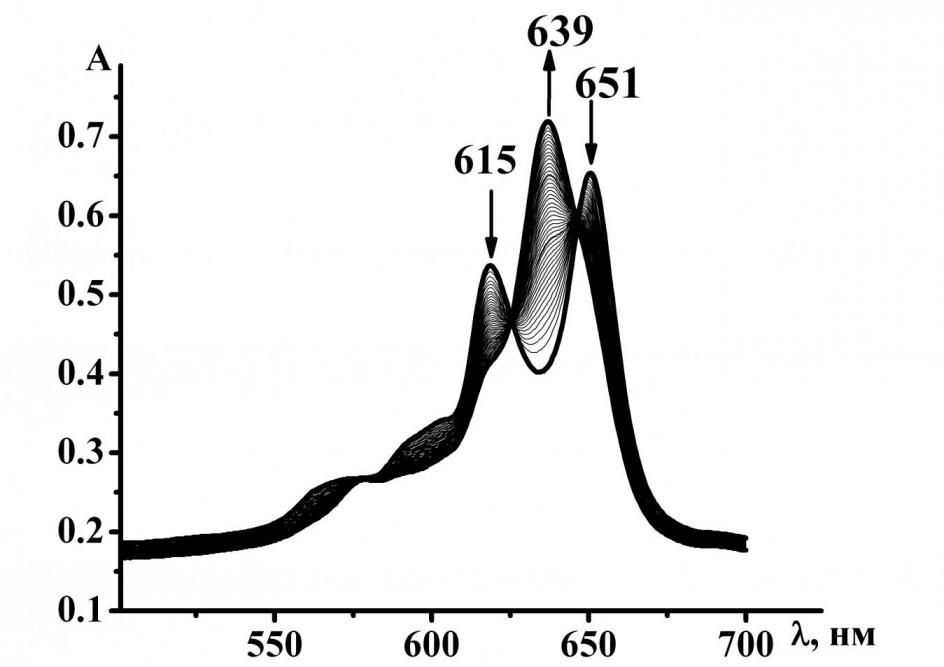 Рис. 6. Изменение ЭСП [Et8Pyz4PzH2] в процессе комплексообразования с Mg(OAc)2 в пиридине Рис. 6. Изменение ЭСП [Et8Pyz4PzH2] в процессе комплексообразования с Mg(OAc)2 в пиридине | 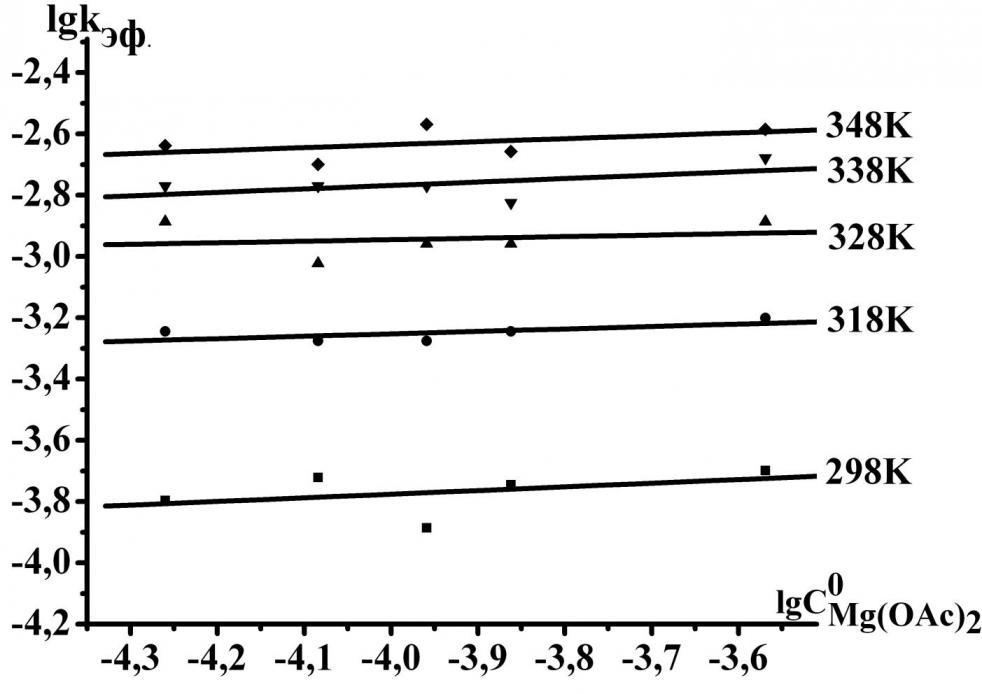 Рис.7. Зависимость lgkэф. от lgC0Mg(OAc)2 для реакции образования [Et8Pyz4PzMg] в Py Рис.7. Зависимость lgkэф. от lgC0Mg(OAc)2 для реакции образования [Et8Pyz4PzMg] в Py |
Лимитирующей стадией реакции является равновесие (1), которое в условиях избытка пиридина сдвигается в сторону образования дианиона порфиразина. Экспериментальные данные показывают (таблица 4), что скорость координации октаэтилтетрапиразинопорфиразина с ионами Mg2+ больше, чем для других порфиразинов, что может быть объяснено увеличением поляризации N-H связей за счёт электроноакцепторного действия пиразиновых фрагментов.
Таблица 4
Кинетические параметры образования комплексов магния (II) порфиразинов
в пиридине (* - литературные данные)
| Комплекс | kэф298104, с-1 | Е, кДж/моль | S,Дж/(моль К) |
| PzMg* | 0,9610-4 * | 115 * | -9 * |
| Ph8PzMg* | 0,01 * | 71 * | -130 * |
| Et8Pyz4PzMg | 1,72 ± 0.02 | 44 ± 3 | -178 ± 10 |
- Изучение кислотных свойств 5,7–дифенил-1,4-диазепинотрибензо-
порфиразина спектропотенциометрическим методом
Нами впервые проведено теоретическое исследование кислотных свойств 5,7–дифенил-1,4-диазепинотрибензопорфиразина полуэмпирическим методом РМ3 и спектропотенциометрическое исследование системы [Bz3DzPzН2] – ДМСО – К[2.2.2]ОН. На рисунке 8 представлены спектральные изменения процесса депротонирования. Установлено, что процесс депротонирования двухстадийный. Полученные константы депротонирования имеют близкие значения (таблица 5), что характерно для равновесий депротонирования NH-групп порфиразинов в ДМСО. ЭСП конечной формы для [Bz3DzPzН2]·в изученной среде имеет такой же характер, как для металлокомплексов [Bz3DzPzН2],·следовательно, в процессе депротонирования отщепляются внутрициклические протоны. Мы полагаем, что возможно, наиболее вероятной формой существования дианиона порфиразина [Bz3DzPzH2] в системе ДМСО – К[2.2.2]ОН является аквакомплекс с двумя молекулами реакционной воды
(H0f = - 11.22 ккал/моль) (рис. 9).
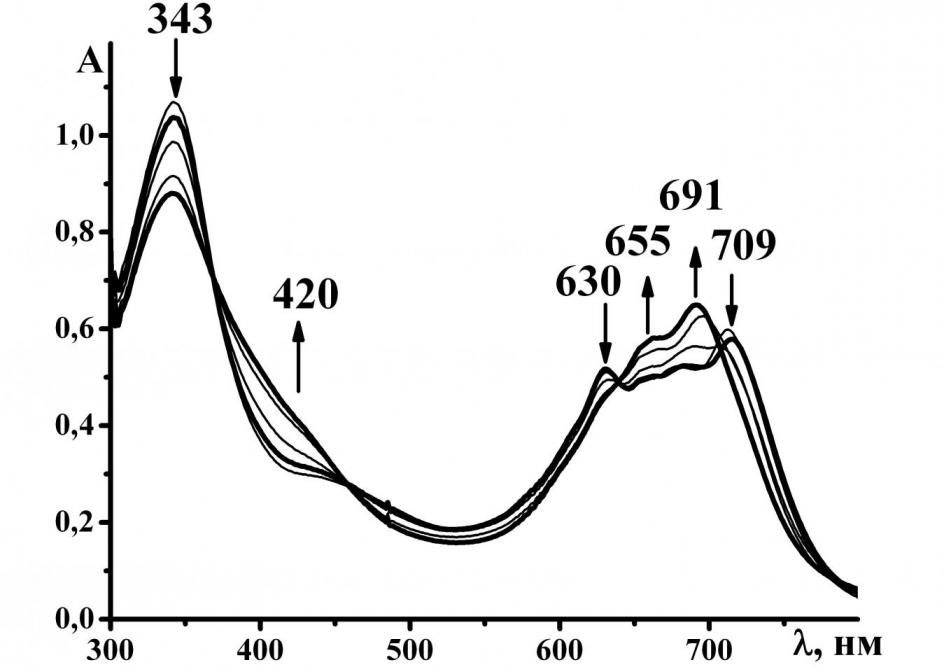 Рис.8. Спектральные изменения [Bz3DzPzН2]· в процессе депротонирования в области pH от 7,18 до 12,3 Рис.8. Спектральные изменения [Bz3DzPzН2]· в процессе депротонирования в области pH от 7,18 до 12,3 |
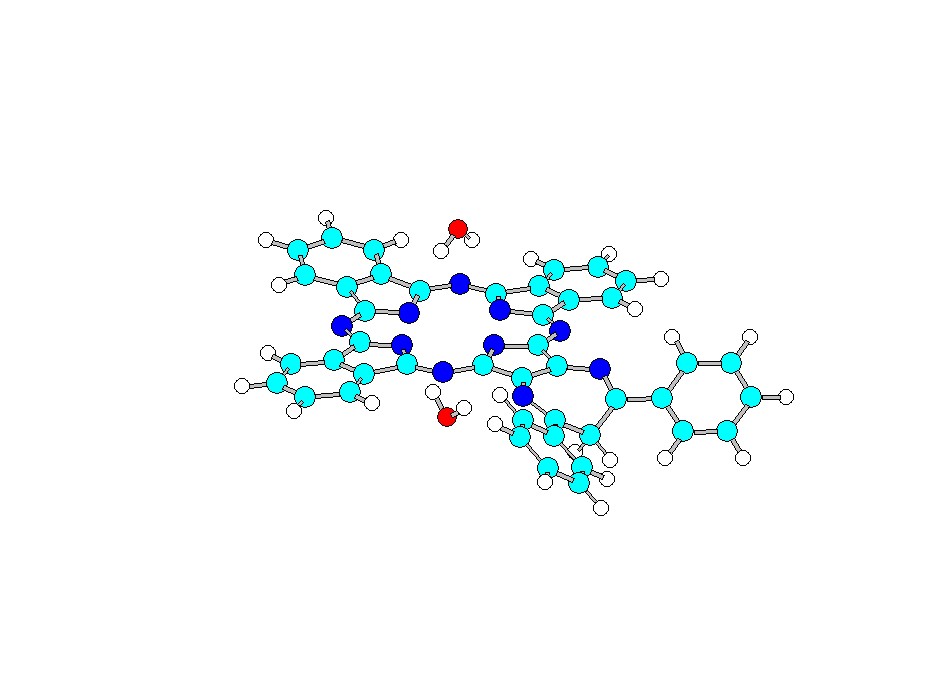
Рис. 9. [Bz3Dz(6H)Pz]2- (H2O)2
Данные таблицы 5 показывают, что в газовой фазе [Bz3DzPzН2] обладает более сильными кислотными свойствами по сравнению с [H2Pz] и [(t-Bu)4PсH2], а в растворе по величинам констант депротонирования занимает положение между [H2Pz] и [(t-Bu)4PсH2], следовательно, ДМСО нивелирует кислотность [Bz3DzPzН2].
Таблица 5
Тепловые эффекты реакций депротонирования(РМ3 метод) и константы депротонирования порфиразинов (* - литературные данные)
| Вещество | Hf1 | Hf2 | pKa1 | pKa2 |
| ккал/моль | 298 К | |||
| [H2Pz]* | 325.52* | 414.50* | 11.94 ± 0.04* | 13.45 ± 0.08* |
| [(t-Bu)4PсH2]* | 323.60* | 399.80* | 10.76 ± 0.04* | 12.57 ± 0.04* |
| [Bz3DzPzН2] | 320.33 | 393.52 | 11.06±0.01 | 11.52±0.01 |
- Синтез смеси изомеров бис-2,3-(пиридил-3-окси)-трис-9,(10),16,(17),23,(24)-(трет-бутил)фталоцианина [(t-Bu)3(OPy)2PcН2] и его комплексов с кобальтом (III) и хромом (III), тетра(трет-бутил) фталоцианинатов кобальта (III) и хрома (III) и их спектральные свойства.[4]
Одной из задач нашей работы был поиск катализаторов реакции сополимеризации пропиленоксида с углекислым газом. Катализаторы должны иметь хорошую растворимость в органических растворителях, особенно в пропиленоксиде и иметь в своей структуре положительно заряженные частицы. К сожалению пиразинопорфиразины вследствие плохой растворимости не показали хороших результатов как катализаторы.
В связи с этим впервые в качестве основополагающей структуры для синтеза катализаторов было выбрано несимметричное соединение [(t-Bu)3(OPy)2PcН2] (1), содержащее в своем составе три трет-бутильные группы, которые придают хорошую растворимость соединению, а также две пиридилокси-группы, которые в свою очередь дают возможность проводить реакции N-алкилирования с получением солей пиридиния.
- Синтез соединения [(t-Bu)3(OPy)2PcН2] (1)
Впервые [(t-Bu)3(OPy)2PcН2] (1) получен деметаллированием его комплекса магния [(t-Bu)3(OPy)2PcMg] в 100%-ной трифторуксусной кислоте. Комплекс магния выделен методом колоночной хроматографии из смеси Mg-фталоцианинов, полученной при соконденсации 4,5-бис(пиридил-3-окси)фталонитрила с 4-(трет-бутил)фтало нитрилом в присутствии октилата магния в октаноле.
Строение [(t-Bu)3(OPy)2PcН2] было установлено по данным элементного анализа, масс-спектрометрии, электронной абсорбционной, ИК-, 1Н ЯМР-спектроскопии (таблицы 6,7). В ИК-спектре лиганда обнаруживаются валентные колебания связей N-H (3288 см-1), трет-бутильных групп (2954, 2902, 2864 см-1), а также валентные колебания группировки С-О-С (1277, 1213 см-1). Соединение растворимо в CH2Cl2, CHCl3, ТГФ, бензоле, пиридине, частично растворимо в ДМФА, не растворимо в метаноле, ДМСО.
- Синтез соединений [(t-Bu)3(OPy)2PcCoIII(H2O, CN)] (2)
и [(t-Bu)4PcCoIII(H2O, CN)] (3)
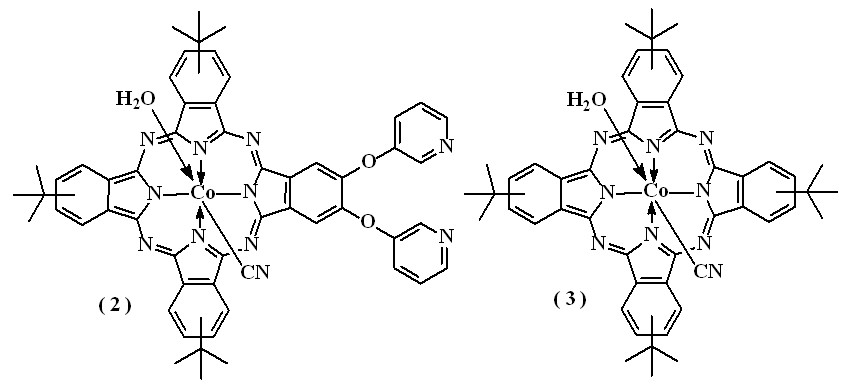
Комплексы кобальта (2) и (3) получали взаимодействием соответствующих лигандов [(t-Bu)3(OPy)2PcН2] и [(t-Bu)4РсН2] c ацетатом кобальта (II) в пиридине с последующим окислением 2,3-дихлор-5,6-дициано-п-бензохиноном (DDQ). При окислении Q-полоса в ЭСП смещается батохромно на 15 нм. Строение комплексов (2) и (3) было установлено данными электронной абсорбционной спектроскопии, ИК-спектроскопии, масс-спектрометрии, элементного анализа, которые показали, что в качестве экстралиганда соединения содержат воду и циано-группу (таблицы 6,7). Соединения (2) и (3) в метаноле, серном эфире растворяются ограниченно, но в ацетоне, CH2Cl2, ТГФ, бензоле, пиридине растворяются хорошо. В перечисленных растворителях соединение (2) находится в ассоциированном состоянии, поэтому изучить его 1Н ЯМР-спектр не удалось.
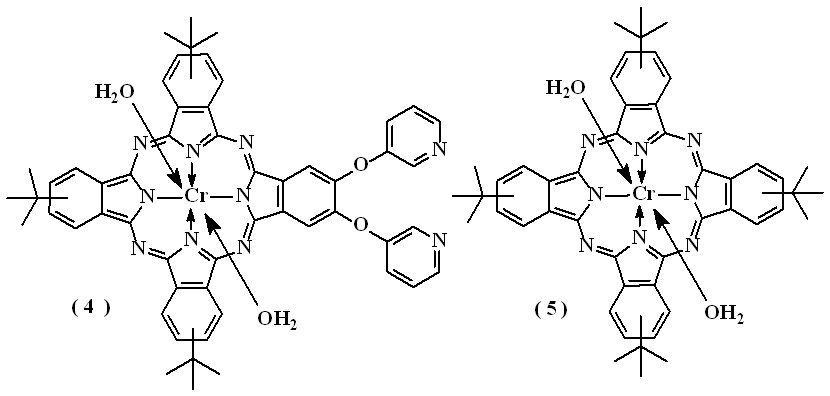
- Синтез соединений [(t-Bu)3(OPy)2PcCrIII(2H2O)] (4) и [Pc(t-Bu)4CrIII(2H2O)] (5)
[Pc(t-Bu)3(OPy)2CrIII] (4) был получен в две стадии: сначала проводили реакцию соединения (1) с гидридом калия в ТГФ в атмосфере аргона, а затем проводили комплексообразование с хлоридом хрома (II) с последующим окислением комплекса на воздухе. [Pc(t-Bu)4CrIII] (5) получали взаимодействием лиганда [(t-Bu)4РсН2] с хлоридом хрома (II) в ДМФА в атмосфере аргона с последующим окислением соединения на воздухе. Строение комплексов хрома (4) и (5) было установлено по данным электронной абсорбционной спектроскопии, ИК-спектроскопии, масс-спектрометрии, элементного анализа (таблицы 6,7). В качестве экстралигандов комплексы содержат воду. Соединения хорошо растворяются в CH2Cl2, ТГФ, пиридине.
- Синтез соединений [(tBu)3(OPyС11H23Br)2PсH2] (6), [(t-Bu)3(OPyСH3I)2PcСоIII(I)] (7), [(t-Bu)3(OPyС11H23Br)2PcСоIII(Br)] (8) [(t-Bu)3 (OPyС11H23Br)2PcСrIII(Br)] (9)
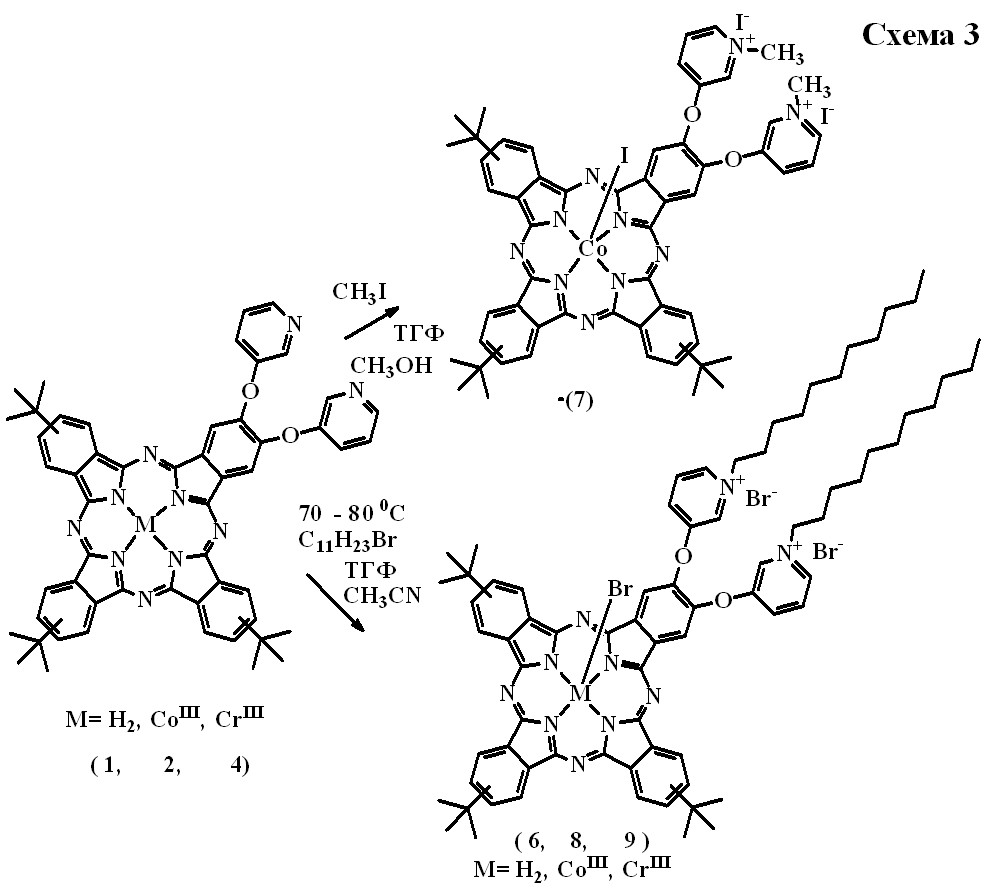
Для получения растворимых N-алкилпиридиниевых солей проводили реакции алкилирования соединений [(t-Bu)3(OРy)2PcH2], [(t-Bu)3(OРy)2PcСоIII(H2O,CN)] и [(t-Bu)3(OРy)2PcСrIII(2H2O)]. В качестве алкилирующих агентов использовали CH3I и С11H23Br (cхема 3). В качестве растворителей использовали ТГФ для растворения исходных соединений и ацетонитрил в качестве полярного растворителя, т.к. известно, что реакции алкилирования лучше протекают в полярных растворителях. Реакции алкилирования контролировали методом тонкослойной хроматографии. Получали следующие алкилированные производные - (6), (7), (8), (9), строение которых было доказано данными элементного анализа, ИК-спектроскопии (таблицы 6,7). Данные элементного анализа показали, что во всех случаях получаются диалкилированные производные, которые в качестве экстралигандов содержат йод или бром. Все соединения хорошо растворяются в CH2Cl2, ТГФ, но в этих растворителях ассоциированы, причем производные с ундецильными группами в растворах более ассоциированы, чем с метильными группами.
Таблица 6
| № | Данные элементного анализа порфиразинов |
| (1) | Вычислено для C54H48N10O2 (%): C 74.63, H 5.57, N 16.12. Найдено (%): C 73.74, H 5.50, N 16.06. |
| (2) | Вычислено для C54H46СоN10O2 (H2O, CN) (%): C 68.03, H 5.09, N 15.87. Найдено (%): C 68.10, H 4,99, N 15.88. |
| (3) | Вычислено для C49H50СоN9O2 (H2O, CN) (%): C 70.07, H 6.00, N 15.01. Найдено (%): C 70.23, H 6,09, N 14.03. |
| (5) | Вычислено для C48H52CrN8O2 (%): C 69.88, H 6.35, N 13.58. Найдено (%): C 69.84, H 6.46, N 13.33. |
| (6) | Вычислено для C76H94N10O2Br2 (%): C 68.15, H 7.07, N 10.46, Br 11,93. Найдено (%): C 66.74, H 7.01, N 10.60, Br 9.70. |
| (7) | Вычислено для C56H52СоI3N10O2 (%): C 50.32, H 3.92, N 10.48. Найдено (%): C 50.62, H 4,14, N 11.09. |
| (8) | Вычислено для C76H92СоBr3N10O2 (%): C 61.09, H 6.34, N 9.37, Br 16,04. Найдено (%):C 60.75, H 6.62, N 8.99, Br 14,40. |
Таблица 7
| Соединение | ЭСП (пиридин) l,нм / (lge): |
| (1) | 348 (4.86), 610 (4.47), 644 (4.62), 667(5.05), 696(5.07) |
| (2) | 344 (4.84), 614 (4.57), 677(5.04) |
| (3) | 345 (4.88), 612 (4.60), 676 (5.08) |
| (4) | 363 (4.31), 503 (3.88), 628(3.96), 696 (4.60) |
| (5) | 357 (4.32), 503 (3.90), 626(3.99), 695 (4.62) |
| (6) | 348 (4.99), 615 (4.65), 641(4.73), 675 (5.12), 691(5.24) |
| (7) | 345 (4.83), 607 (4.54), 671(4.96) |
| (8) | 345 (4.85), 610 (4.58), 674(5.04) |
| (9) | 357 (4.73), 505 (4.18), 627(4.42), 691(4.98) |
3.4. Исследование каталитической активности комплексов фталоцианинов с Co(III) и Cr(III) в реакции сополимеризации пропиленоксида (PO) с СО2
На схеме 4 представлена реакция сополимеризации пропиленоксида с углекислым газом, в результате которой образуются полипропиленкарбонат (PPC) и пропиленкарбонат (PC). Продукты полимеризации анализировали методом 1Н ЯМР-спектроскопии в CDCl3. Соединение (3) не активно в полимеризации. При использовании соединений (2), (5-9) образуется PC с разным выходом, а в случае катализатора (5) образуется смесь PPC и PC (рис. 10). На основании гель-проникающей хроматограммы определена молекулярная масса РРС, которая составила 7972 г/моль, следовательно, в реакции полимеризации образовался олигомер.
Выводы:
- Впервые темплатной циклотетрамеризацией синтезирован (2,3-дифенил)-пиразинотрибензопорфиразинат магния. Впервые из комплекса магния синтезирован (2,3-дифенил)пиразинотрибензопорфиразин. Впервые методом дробно-вакуумной сублимации 5,7-дифенил-1,4-диазепинотрибензопорфиразина синтезированы (2,3-дифенил)- пиразинотрибензопорфиразин и (2-фенил)имидазолотрибензопорфиразин. Метод дробно-вакуумной сублимации предложен в качестве метода синтеза и очистки пиразино- и имидазольных производных порфиразина.
- На примере октаэтил- и октафенилтетрапиразинопорфиразинов и их комплексов с лютецием (III) и эрбием (III) изучено влияние аннелированных пиразиновых фрагментов на кислотно-основные взаимодействия порфиразинов в протонодонорных средах. Получены концентрационные константы кислотности соединений. Показано, что введение пиразиновых фрагментов в порфиразиновый макроцикл уменьшает его основность. Установлено, что комплексы тетрапиразинопорфиразинов с лантаноидами более основны, чем лиганды.
- Изучены кислотные свойства октаэтилтетрапиразинопорфиразина и 5,7-дифенил-1,4-диазепинопорфиразина полуэмпирическим методом РМ3 и методом спектропотенциометрического титрования в среде ДМСО-K[2.2.2]OH. Показано, что процессы депротонирования протекают по двум ступеням с близкими значениями констант депротонирования. На основании рассчитанных тепловых эффектов реакции и экспериментальных значений констант депротонирования установлено, что аннелированные пиразиновые фрагменты порфиразина усиливают кислотность соединений. Высказано предположение, что в среде ДМСО-K[2.2.2]OH дианионы порфиразинов стабилизируются двумя молекулами воды.
- Синтезированы бис(пиридил-3-окси)трис(трет-бутил)фталоцианины и их комплексы с кобальтом (III) и хромом (III), а также получены их N-алкилированные производные. Синтезированы комплексы тетра(трет-бутил)фталоцианина с кобальтом (III) и хромом (III). Изучено строение и спектральные свойства синтезированных соединений методами электронной абсорбционной, ИК-, ЯМР-спектроскопии, масс-спектрометрии, элементного анализа.
- Установлено, что комплексы бис(пиридил-3-окси)трис(трет-бутил)фталоциа-нинов с кобальтом (III) и хромом (III), а также комплекс тетра(трет-бутил)-фталоцианина с хромом (III) проявляют каталитическую активность в реакции сополимеризации пропиленоксида с углекислым газом с образованием пропиленкарбоната и полипропиленкарбоната.
Основное содержание работы изложено в публикациях:
- О.Г. Хелевина, Е.А. Кокарева, А.С. Бубнова, Ю.В. Романенко, В.П. Кулинич, Г.П. Шапошников. Кислотно-основные взаимодействия октафенилтетрапиразинопорфиразина и его комплекса с лютецием в протонодонорных средах. Журнал общей химии. 2007. Т. 77. № 12. С. 2047-2052.
- Е.А. Кокарева, О.А. Петров, О.Г. Хелевина. Кислотные и комплексообразующие свойства тетрапиразинопорфиразинов Журнал общей химии. 2009. Т. 79. № 11. С. 1918 – 1923.
- Е.А. Кокарева, О.А. Петров, О.Г. Хелевина. Coordination properties of octaethyl- and octaphenyltetrapyrazinoporphyrazines in proton-acceptor media. Макрогетероциклы. 2009. Т. 2. №2. С. 157-163.
- E.A. Kokareva, O.G. Khelevina. Acid-Base Properties of Substituted Tetrapyrazinoporphyrazines. Journal of Porphyrins and Phthalocyanines. 2008. N 12. P. 587.
- Е.А. Кокарева, Н.Г. Никитина, О.Г. Хелевина. «Состояние комплексов тетрапиразинопорфиразинов с редкоземельными элементами в протонодонорных средах». Журнал общей химии. 2010. Т. 80. №9. С. 1876-1881.
- Е.А. Кокарева, О.Г. Хелевина. Исследование реакций кислотно-основного взаимодействия октафенилтетрапиразинопорфиразина и его комплекса с лютецием (III) в протонодонорных средах. IX Научная школа-конференция по органической химии. Москва. 2006. С. 194.
- Е.А. Кокарева, О.Г. Хелевина. Реакции кислотно-основного взаимодействия октафенил- и октаэтилтетрапиразинопорфиразина в протонодонорных средах. VII Школа-конференция молодых ученых стран СНГ по химии порфиринов и родственных соединений. Одесса. 2007. С. 87.
- E.A. Kokareva, O.G. Khelevina. Acid-Base Properties of Substituted Tetrapyrazinoporphyrazines. V International Conference on Porphyrins and Phthalocyanines. Moscow. 2008. P. 425.
- Е.А. Кокарева, Н.Г. Никитина, О.Г. Хелевина. Кислотно-основные взаимодействия комплексов лютеция (III) и эрбия (III) с арилзамещенными тетрапиразино-порфиразинами в протонодонорных средах. XXIV Международная Чугаевская конференция по координационной химии. Санкт-Петербург. 15-19 июня 2009. С. 297.
- Шейнин В.Б., Е.А. Кокарева, Хелевина О.Г. «Особенности депротонирования 5,7-дифенил-1,4-диазепинотрибензопорфиразина в ДМСО». XII Молодежная конференция по органической химии. Суздаль 7-11 декабря. 2009. С.101.
- Kokareva E.A., Sheinin V.B., Khelevina O.G. «Synthesis of Low-Symmetrical Pyrazinoporphyrazines» III Международная конференция по химии гетероциклических соединений (КОСТ-2010). Москва. 2010. С.105.
- Малясова А.С., Кокарева Е.А., Стужин П.А., Хелевина О.Г. «Монодиазепинопорфиразины: синтез и свойства» XI Международная конференция по физической и координационной химии порфиринов и их аналогов (ICPC-11). Одесса. 2011. С. 57.
Автор выражает глубокую признательность и благодарность своему научному руководителю доктору химических наук, профессору Хелевиной О.Г.
и к.х.н. Вагину С.И. за постоянное внимание к работе и ценные консультации.
Ответственный за выпуск Кокарева Е.А.
[1] Сублимация [Bz3DzPzH2]выполнена в ИХР РАН (г. Иваново) под руководством ведущего научного сотрудника, к.х.н. Шейнина В.Б.
[2] Комплексы предоставлены к.х.н., с.н.с. Кулиничем В.П.(кафедра ТТОС, ИГХТУ).
[3] Исследования выполнены в ИХР РАН (г. Иваново) под руководством ведущего научного сотрудника, к.х.н. Шейнина В.Б.
[4] Исследования выполнены в Мюнхенском техническом университете (г. Мюнхен, Германия) на кафедре макромолекулярной химии под руководством к.х.н. С.И. Вагина и профессора Б. Ригера.

