Термодинамика растворов монофункциональных производных бензола, l- -гистидина и l- -фенилаланина в смесях воды с мочевиной и диметилформамидом
На правах рукописи
Бекенева Анастасия Владимировна
ТЕРМОДИНАМИКА РАСТВОРОВ МОНОФУНКЦИОНАЛЬНЫХ ПРОИЗВОДНЫХ БЕНЗОЛА, L--ГИСТИДИНА И L--ФЕНИЛАЛАНИНА
В СМЕСЯХ ВОДЫ С МОЧЕВИНОЙ И ДИМЕТИЛФОРМАМИДОМ
Специальность 02.00.04-физическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Иваново – 2008
Работа выполнена на кафедре неорганической химии Ивановского государственного химико-технологического университета
Научный руководитель
доктор химических наук, профессор Королев Валерий Павлович
Официальные оппоненты:
доктор химических наук, профессор Абросимов Владимир Ксенофонтович
доктор химических наук, профессор Новоселов Николай Петрович
Ведущая организация
Ивановский государственный университет
Защита состоится 6 октября 2008 г. в 10 часов на заседании совета по защите докторских и кандидатских диссертаций Д 212.063.06 при Ивановском государственном химико-технологическом университете (153000, г. Иваново, пр. Ф. Энгельса, 7) в аудитории Г - 205
C диссертацией можно ознакомиться в библиотеке Ивановского государственного химико-технологического университета (153000, г. Иваново, пр. Ф. Энгельса, 10)
Автореферат разослан « » 2008 года
Ученый секретарь
совета по защите докторских и
кандидатских диссертаций Егорова Е.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Ароматические углеводороды и их производные представляют собой уникальный тип соединений, переоценить значение которых в современной науке и технике невозможно. Во-первых, они находят широкое применение в промышленности в реакциях восстановления нитросоединений при производстве красителей, синтезе лекарственных препаратов, изготовлении косметических средств и т.д. Поскольку эти процессы осуществляются преимущественно в растворах, то понимание механизма взаимодействия растворенных веществ с растворителем чрезвычайно важно для подбора оптимальных условий для получения целевого продукта. Во-вторых, ароматические соединения используют для построения эмпирических шкал полярности растворителей, которые находят широкое применение для анализа экспериментальных данных. В-третьих, поскольку бензол и его монофункциональные производные являются моделями боковых фрагментов пептидов и белков, то изучение особенностей их сольватации в растворах позволяет лучше понять поведение макромолекул в биосистемах на пути от простого к сложному. Особую актуальность в этом плане представляют исследования термодинамических характеристик растворов ароматических веществ в водных растворах неэлектролитов, оказывающих денатурирующее действие на глобулярные белки.
Диссертационная работа выполнена в рамках программы “Основные направления научных исследований” Ивановского государственного химико-технологического университета и поддержана грантами Минобразования (А 03-2.11-184), РФФИ (05-03-96401-р_центр_а, 06-03-96320-р_центр_а).
Цель работы состояла в установлении закономерностей термодинамических характеристик сольватации бензола, его монофункциональных производных, L--гистидина и L--фенилаланина в смесях воды с гидрофильной мочевиной (Мч) и преимущественно гидрофобным диметилформамидом (ДМФ), выявлении особенностей влияния природы растворенных веществ и растворителей, концентрации и температуры на термодинамические свойства растворов и параметры межчастичных взаимодействий. В связи с этим определились основные задачи исследования:
– измерить тепловые эффекты растворения бензола (С6Н6), анилина (С6Н5NH2), нитробензола (С6Н5NО2), L--фенилаланина (Phe) и L--гистидина (His) в смесях воды с диметилформамидом и мочевиной при 25 0С;
– измерить тепловые эффекты растворения Phe в системе вода-ДМФ при 15 - 45 0С;
– определить растворимость Phe и His в воде и ее смесях с ДМФ при 25 0С;
– установить основные закономерности влияния природы растворенных веществ, свойств смешанных растворителей и температуры (на примере Phe) на термодинамические свойства бинарных и тройных растворов ароматических веществ;
– в рамках теории МакМиллана-Майера исследовать особенности взаимодействия в водных и неводных растворах ароматических веществ. Выделить вклады функциональных групп в величины параметров взаимодействий, изучить влияние природы взаимодействующих частиц и температуры на закономерности их изменения.
Научная новизна. Впервые калориметрическим методом измерены энтальпии растворения анилина, бензола, нитробензола, Phe и His в смесях воды с ДМФ и Мч при 25 0С, а также Phe в системе вода-ДМФ в интервале температур 15 – 45 0С. Впервые определены величины растворимости Phe и His в смесях воды с ДМФ при 25 0С. Показано, что сольватация веществ в смешанных растворителях усиливается в ряду С6Н6< С6Н5NО2< С6Н5NН2, причем в смесях воды с сильными Н-акцепторами сольватация ароматической аминогруппы определяется специфическим взаимодействием аминогруппа (кислота) - растворитель (основание). Установлено, что парное взаимодействие бензола и его монофункциональных производных с молекулами амидов является энтальпийно неблагоприятным. Введение аминогруппы в бензольное кольцо в обоих случаях уменьшает величину параметра парного взаимодействия, а введение нитрогруппы существенно увеличивает, то есть в этом плане она ведет себя как неполярная. Впервые показано, что взаимодействие Phe и His и с гидрофобным ДМФ, и с гидрофильной Мч сопровождается убылью свободной энергии, однако природа этого явления в корне различна. В первом случае отрицательное значение g23 определяется энтропийным вкладом, что характерно для преимущественно гидрофобных веществ. Во втором, наоборот, энтальпийным, что указывает на гидрофильную природу взаимодействия. Установлено, что парное взаимодействие L-фенилаланина с гидрофильной Мч сопровождается появлением предпочтительных ориентаций между полярными группами взаимодействующих веществ. Сравнительное исследование влияния температуры на термодинамические свойства растворов Phe в смесях воды с Мч и ДМФ показало, что если энтальпиийные и энтропийные характеристики парного взаимодействия Мч - Phe проходят через выраженные максимумы при 31 0С, то в случае ДМФ они линейно изменяются с ростом температуры.
Практическая значимость. Высокая точность экспериментальных данных позволяет использовать их как справочный материал. Полученные результаты могут быть использованы для развития теоретических представлений об особенностях структуры, природе межчастичных взаимодействий в водных и неводных растворах ароматических веществ. Температурные зависимости термодинамических свойств растворов Phe в смесях воды с ДМФ позволяют предсказать поведение аминокислоты в не исследованном температурном интервале, а также оценить величины растворимости Phe в широком диапазоне температур, что имеет несомненную ценность для практики. Энтальпийные характеристики сольватации С6Н5NH2 и С6Н5NO2 могут быть также использованы для установления взаимосвязи сольватационных эффектов в растворах, термодинамических характеристик стадий адсорбции и реакционной способности ароматических веществ в гетерогенно-каталитических процессах, поскольку реакция каталитического восстановления ароматической нитрогруппы является одной из важнейших в промышленности.
Апробация работы. Результаты работы докладывались и обсуждались на: VII Международной конференции студентов и аспирантов по фундаментальным наукам “Ломоносов 2000: молодежь и наука на рубеже XXI века”, Москва, 2000; Международной конференции “Кинетика и механизм кристаллизации”, Иваново, 2000; Международной конференции студентов, аспирантов и молодых ученых “Молодая наука - XXI веку”, Иваново, ИВГУ, 2001; VIII Международной конференции “Проблемы сольватации и комплексообразования в растворах”, Иваново, 2001; Международной студенческой конференции “Фундаментальные науки специалисту XXI века”, Иваново, 2002; Всероссийском научном симпозиуме по термохимии и калориметрии, Нижний Новгород, 2004; IX Международной конференции «Проблемы сольватации и комплексообразования в растворах», Плес, 2004; III семинаре молодых ученых ИХР РАН, Иваново, 2004; XV Международной конференции по химической термодинамике в России, Москва, 2005; Международной конференции студентов, аспирантов и молодых ученых «Ломоносов 2005», Москва, 2005; XIII Симпозиуме по межмолекулярному взаимодействию и конформациям молекул, Санкт-Петербург, 2006; XXIII Международной Чугаевской конференции по координационной химии, г. Одесса, 2007. По теме диссертации опубликовано 18 работ, включая 6 статей, 5 из которых в журналах, рекомендованных ВАК и 12 тезисов докладов.
Личный вклад автора. Экспериментальные исследования и обработка полученных данных проведена лично соискателем. Планирование эксперимента, анализ результатов исследования, формулирование основных выводов диссертации выполнено совместно с научным руководителем доктором химических наук, профессором Королевым В.П.
Структура и объем диссертации. Работа (объемом 134 стр.) состоит из введения, обзора литературы, экспериментальной части, обсуждения результатов, выводов, списка цитируемой литературы (159 источников) и приложения. Диссертация содержит 36 рисунков и 25 таблиц.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснована актуальность работы, ее цель, научная новизна и практическая значимость. Обзор литературы состоит из пяти разделов, в которых рассмотрены особенности структуры и свойств воды, ряда апротонных растворителей и бинарных водно-органических смесей. Далее обсуждены вопросы, касающиеся современных представлений о сольватации атомно-молекулярных частиц в растворах, рассмотрено строение молекул ароматических веществ и термодинамика их сольватации в индивидуальных и смешанных растворителях. Последний раздел посвящен анализу формально строгой теории растворов МакМиллана-Майера и ее практическому применению для расчета параметров парных и тройных межчастичных взаимодействий в разбавленных растворах.
В экспериментальной части описываются калориметрическая установка с цифровой
Таблица 1. Cтандартные энтальпии растворения (рH0, кДж/моль) бензола, нитробензола и анилина в системе вода(1)-ДМФ(2) при 25 0C
| C6H6 | C6H5NO2 | C6H5NН2 | |||
| X2а·102 | рH0 | X2·102 | рH0 | X2·102 | рH0 |
| 0 | 2.05; 2.08б; 2.21в | 0 | 3.95 | 0 | 1.83; 1.82г |
| 2.473 | 3.71 | 1.061 | 4.92 | 0.0800 | 1.82 |
| 4.011 | 4.55 | 2.267 | 6.89 | 0.100 | 1.95 |
| 4.699 | 4.79 | 3.192 | 7.70 | 0.180 | 2.01 |
| 5.157 | 4.97 | 5.162 | 9.
27 | 0.230 | 2.00 |
| 5.518 | 5.11 | 6.777 | 10.05 | 0.830 | 2.25 |
| 7.094 | 6.09 | 10.14 | 11.78 | 1.320 | 2.37 |
| 10.01 | 7.19 | 12.55 | 12.64 | 1.430 | 2.49 |
| 10.80 | 7.52 | 19.08 | 13.34 | 1.980 | 2.65 |
| 13.76 | 8.17 | 24.73 | 12.47 | 2.930 | 3.04 |
| 15.53 | 8.71 | 36.91 | 8.79 | 4.820 | 3.53 |
| 18.84 | 8.93 | 47.73 | 5.76 | 7.080 | 4.12 |
| 22.03 | 8.89 | 68.50 | 2.09 | 10.11 | 4.64 |
| 27.58 | 8.59 | 82.86 | 0.69 | 15.84 | 4.97 |
| 38.71 | 6.47 | 85.54 | 0.28 | 18.48 | 4.67 |
| 49.89 | 4.49 | 93.23 | -0.35 | 24.21 | 3.10 |
| 59.37 | 3.15 | 94.75 | -0.46 | 33.96 | 1.01 |
| 74.12 | 1.65 | 97.28 | -0.60 | 58.33 | -5.89 |
| 82.84 | 1.22 | 100 | -0.71; -0.8д | 80.02 | -8.88 |
| 88.96 | 0.60 | 88.22 | -10.35 | ||
| 94.03 | 0.33 | 90.20 | -10.49 | ||
| 100 | 0.15; 0.17д | 94.03 | -10.67 | ||
| 97.37 | -11.12 | ||||
| 100 | -11.28; -11.21е | ||||
а – здесь и далее мольная доля второго компонента, б - J. Solut. Chem. – 1994. – V. 23. – P. 911; в - J. Chem. Thermodyn. - 1989. – V. 21. – P. 529; г - ibid. - 1986. – V. 18. – P. 339; д - Can. J. Chem. – 1985. – V. 63. – P. 2529; е - ibid. – P. 2540.
Таблица 2. Cтандартные энтальпии растворения (рH0, кДж/моль) L-фенилаланина и L-гистидина в водных растворах Мч и ДМФ при 25 0С
| Вода – Мч | Вода – ДМФ | ||||||||||
| Phe | His | Phe | His | ||||||||
| X2·102 | рH0 | X2·102 | рH0 | X2·102 | рH0 | X2·102 | рH0 | ||||
| 0 | 8.27; 8.28а | 0 | 14.22; 13.96 б | 0 | 8.27 | 0 | 14.22 | ||||
| 0.6873 | 7.85 | 1.604 | 13.26 | 2.008 | 9.80 | 1.304 | 14.62 | ||||
| 2.404 | 7.15 | 1.861 | 13.10 | 2.359 | 10.22 | 2.285 | 14.85 | ||||
| 3.229 | 6.89 | 3.059 | 12.42 | 3.439 | 10.73 | 3.406 | 15.21 | ||||
| 4.048 | 6.75 | 5.210 | 11.40 | 3.703 | 11.07 | 4.797 | 15.53 | ||||
| 4.945 | 6.38 | 6.169 | 10.95 | 4.507 | 11.45 | 7.366 | 15.89 | ||||
| 6.833 | 5.99 | 10.33 | 9.26 | 6.018 | 12.29 | 11.87 | 16.18 | ||||
| 7.956 | 5.69 | 12.41 | 9.07 | 7.226 | 12.73 | ||||||
| 10.20 | 4.99 | 7.261 | 12.79 | ||||||||
| 12.02 | 4.74 | 9.808 | 13.73 | ||||||||
| 10.02 | 13.73 | ||||||||||
| 11.49 | 14.02 | ||||||||||
а - J. Mol. Liquids. – 2000. – V. 84. – P. 279; б - J. Chem. Eng. Data. – 1982. – V. 27. – P. 74.
схемой регистрации тепловых эффектов на основе Эталонного измерителя температуры (Журн. физич. химии. - 2006. - Т. 80. - N. 9. - C. 1724), установка для определения растворимости, методики проведения опытов и обработки экспериментальных данных. Приводятся характеристики, методы очистки и оценка качества используемых реактивов. Описываются результаты проверки работы калориметрической установки путем измерения энтальпии растворения 1-пропанола в воде.
Обсуждение посвящено анализу полученных результатов. Основная часть экспериментальных данных приведена в табл. 1-3. Проведено сравнение полученных в настоящей
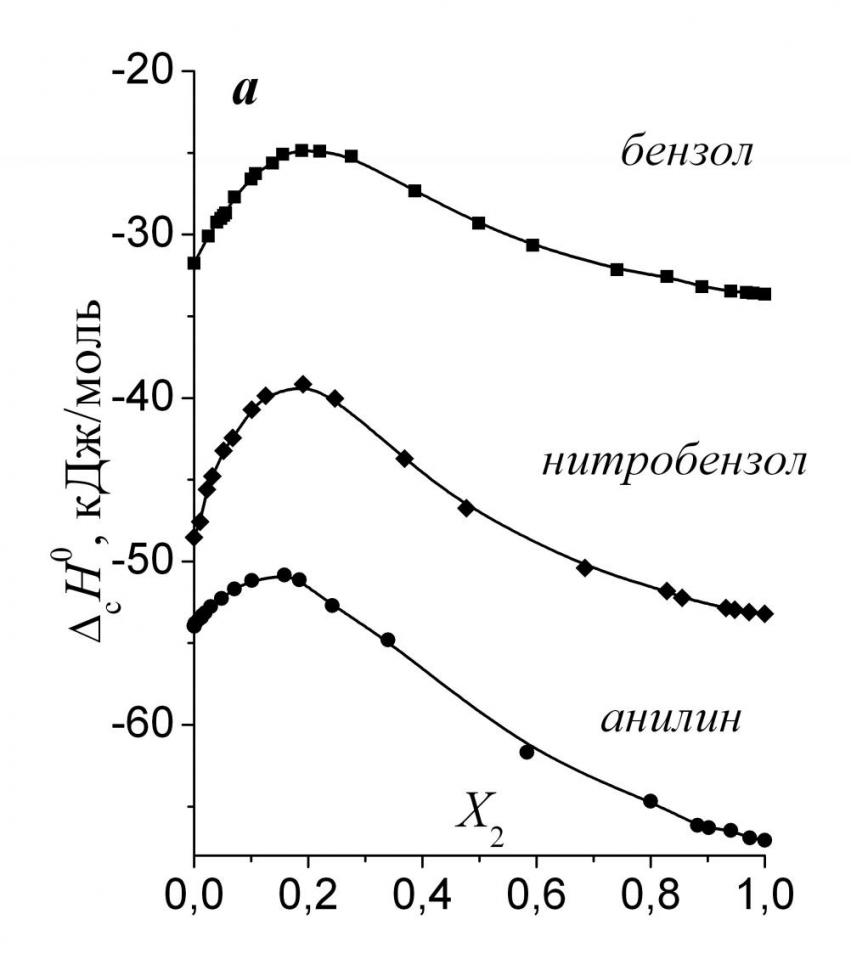 | 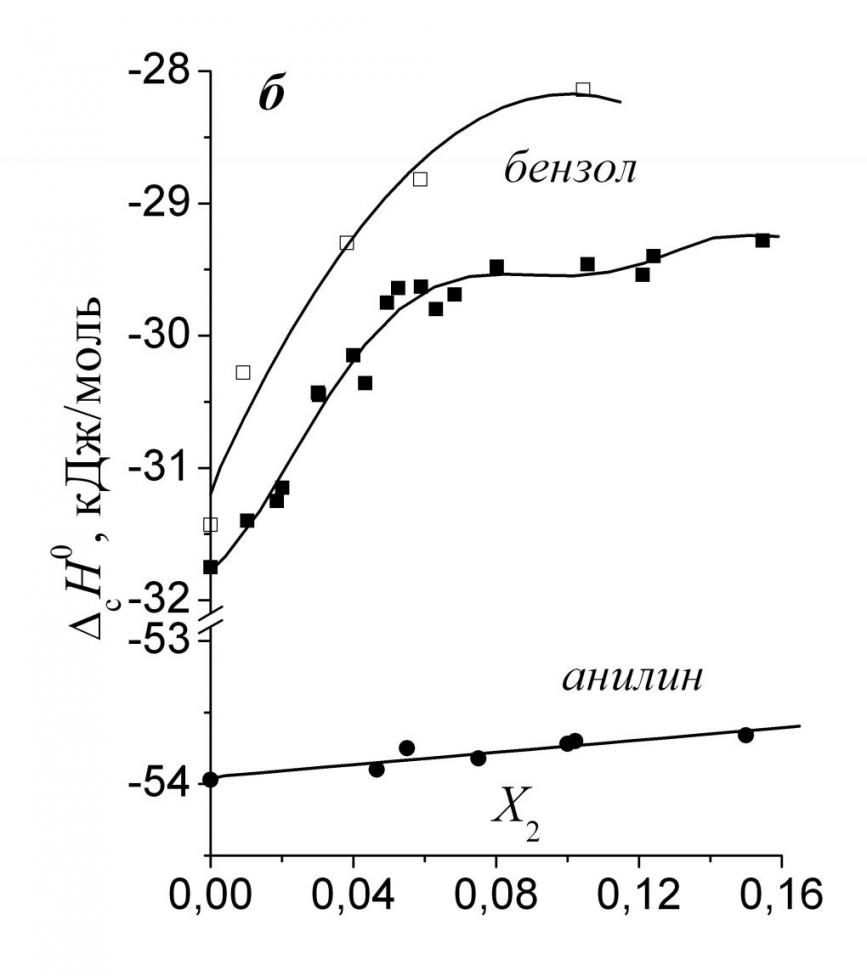 |
| Рис. 1. Энтальпии сольватации ароматических веществ в смесях воды с ДМФ (а) и Мч (б). | |
работе энтальпий растворения ароматических веществ в воде и ДМФ с имеющимися в литературе величинами, рассчитаны термодинамические характеристики растворов ароматических веществ в смесях воды с рядом органических неэлектролитов. Рис. 1а показывает, что зависимости энтальпий сольватации растворенных веществ от состава смешанного растворителя проходят через выраженные максимумы, положение которых близко к минимуму на зависимости теплот смешения воды с ДМФ. Это наводит на мысль, что одной из основных причин возникновения экстремумов является дестабилизация связей растворитель-растворитель в сольватной оболочке растворенного вещества. В смесях воды с Мч (рис. 1б) существуют значительные экспериментальные сложности в определении тепловых эффектов растворения бензола, что приводит к некоторому разбросу экспериментальных данных. Полученные нами данные качественно согласуются со значениями, рассчитанными по данным газожидкостной хроматографии. Из рис. 1а и 1б видно, что введение функциональных групп в бензольный остов приводит к существенно более отрицательным значениям сH0. Поэтому представляется важным оценить вклады амино- и нитрогрупп в энтальпии сольватации:
сН0 (-NH2) = сН0 (C6H5NH2) – сН0 (C6H6) (1)
сН0 (-NO2) = сН0 (C6H5NO2) – сН0 (C6H6) (2)
Результаты расчетов показали, что в системе вода-ДМФ -NH2-группа заметно экзотермичнее взаимодействует с растворителем, чем -NO2-группа. На рис. 2 приведены зависимости энтальпий сольватации аминогруппы в смесях воды с рядом апротонных растворителей от величины параметра основности смеси Камле-Тафта - BKT. Нетрудно заметить, что в смесях воды с ДМФ и ДМСО наблюдаются линейные корреляции между энтальпиями сольватации и основностью растворителя. В случае ацетона линейная зависимость отсутствует. Очевидно, что в смесях воды с сильными электронодонорами – ДМФ и ДМСО энтальпии сольватации аминогруппы преимущественно определяются специфическим взаимодействием с растворителем, в котором аминогруппа выступает в качестве Н-донора, а растворитель в качестве Н-акцептора. Чем больше основность растворителя, тем сильнее взаимодействие и, наоборот. Для нитрогруппы однопараметровых корреляций энтальпий сольватации с параметрами сольватирующей способности водно-органических смесей обнаружено не было.
Далее рассмотрены термодинамические характеристики растворов L--фенилаланина и L--гистидина в смесях воды с Мч и ДМФ. Поскольку, кроме энтальпийных характеристик, нами были получены величины растворимости аминокислот, то оказалось возможным провести расчет всех термодинамических функций переноса аминокислот из воды в ее смеси с амидами. Для расчета энтропийных и гиббсовых характеристик переноса аминокислоты из воды в ее смеси с амидами использовались соотношения:
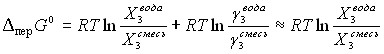 (3)
(3)
-T перS0 = перG0 - перH0 (4)
где X3 – мольная доля аминокислоты в насыщенном растворе. На рис. 3а и 3б показаны энтальпийные (перH0) и энтропийные (-T перS0) вклады в свободную энергию переноса (перG0) Phe из воды в ее смеси с Мч и ДМФ. Увеличение концентрации гидрофильной Мч в
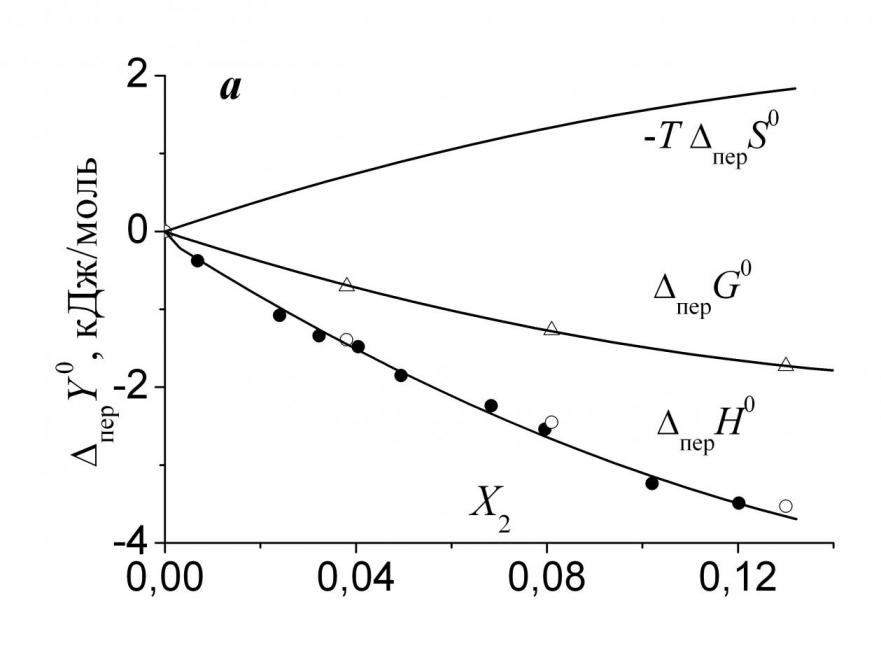 | 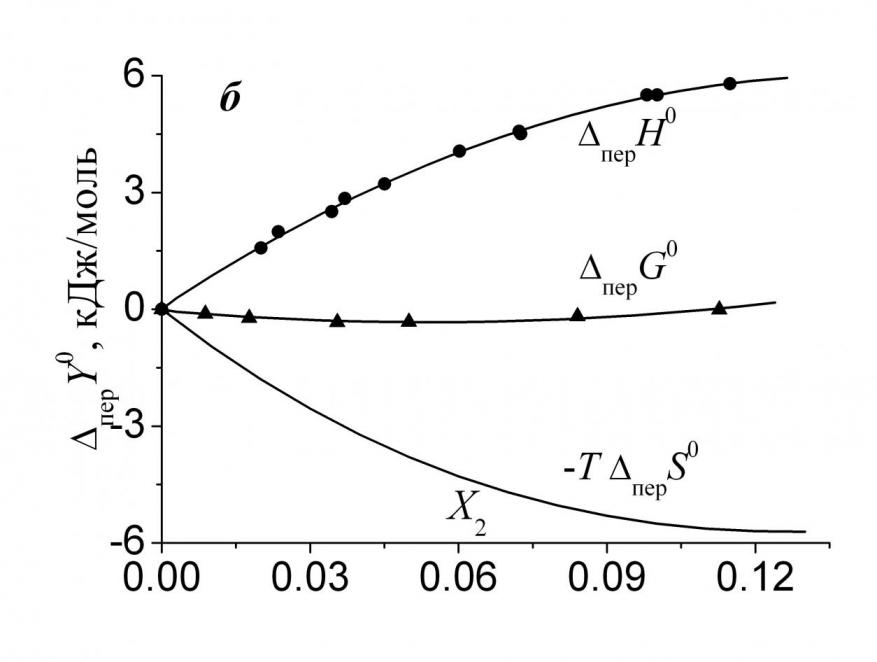 |
| Рис. 3. Изменение энтальпийного и энтропийного вкладов, а также свободной энергии переноса Phe из воды в ее смеси с Мч (а) и ДМФ (б): (-) - данные J. Chem. Eng. Data. – 1982. – V. 27. – P. 74; (8) - данные J. Biol. Chem. – 1963. – V. 238. – P. 4074. | |
растворе вызывает заметное уменьшение энтальпийного и рост энтропийного вкладов, указывая, что перG0<0 определяется энтальпийной составляющей. В водном растворе преимущественно гидрофобного ДМФ наблюдается обратная ситуация. В смесях воды с Мч происходит уменьшение энтропии сольватации в смеси по сравнению с чистой водой, что указывает на более высокую структурированность тройной системы по сравнению с бинарной; в растворах ДМФ, наоборот, добавки амида приводят к уменьшению структурированности (перS0 >0).
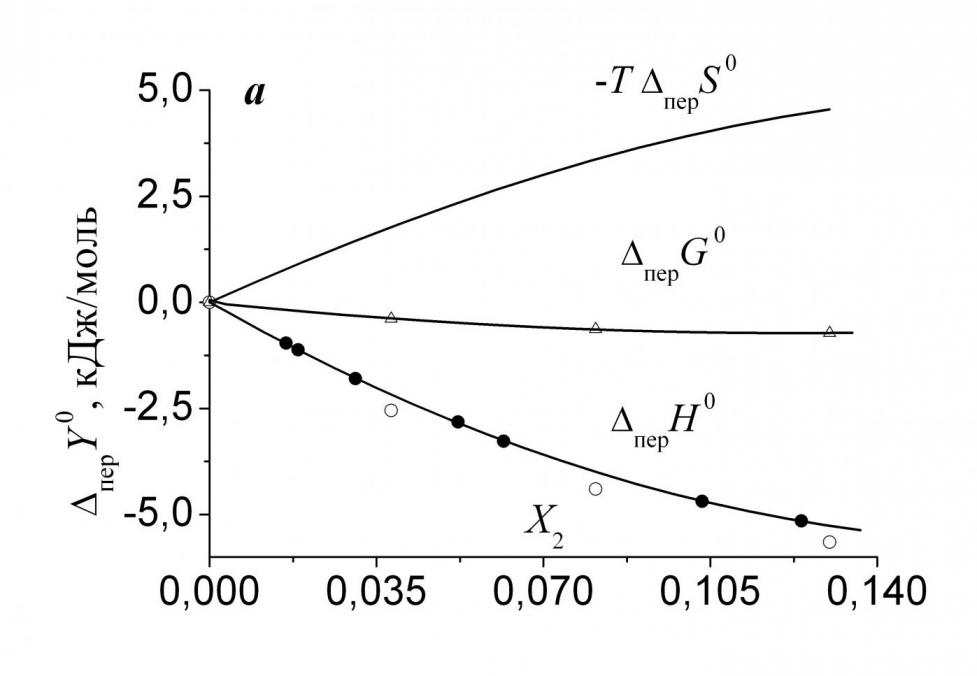 | 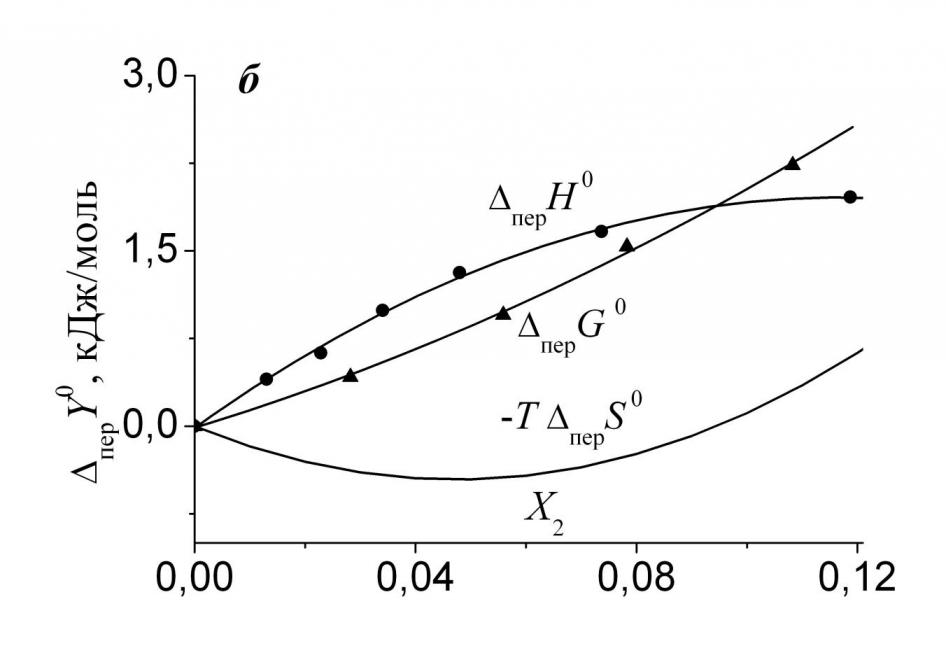 |
| Рис. 4. Изменение энтальпийного и энтропийного вкладов, а также свободной энергии переноса His из воды в ее смеси с Мч (а) и ДМФ (б): (-) - данные J. Chem. Eng. Data. – 1982. – V. 27. – P. 74; (8) - данные J. Biol. Chem. – 1963. – V. 238. – P. 4074. | |
На рис. 4а и 4б показаны энтальпийный и энтропийный вклады в свободные энергии переноса His из воды в ее смеси с Мч и ДМФ. Как и в случае Phe, в растворе гидрофильной Мч энтальпийный вклад отрицателен во всем исследованном интервале составов смешанного растворителя и благоприятствует переносу His из воды в раствор амида. Энтропийный вклад, в свою очередь, положителен и противодействует переносу. Очевидно, что и здесь пеpG0 <0 определяется энтальпийной составляющей, а увеличение концентрации Мч в системе приводит к росту структурированности (перS0 < 0). В растворе преимущественно гидрофобного ДМФ (рис. 4б) энтальпийный вклад положителен и определяет знак свободной энергии переноса. Важным отличием растворов ДМФ от растворов Мч является изменение энтропийной составляющей. Действительно, если в растворе Мч величина (-T перS0) положительна и велика, то в области малых добавок ДМФ она мала по абсолютной величине и отрицательна. Более того, зависимость (-T перS0) – f(X2) в системе вода-ДМФ-His проходит через минимум при X2 0.05 м.д., так что при X2 >0.1 м.д. амида энтропийный вклад становится положительным. Следовательно, первые добавки ДМФ к воде сначала приводят к некоторому уменьшению структурированности раствора L-гистидина, постепенно дестабилизация заканчивается и начинается рост структурированности системы.
Следующий раздел диссертации посвящен анализу межчастичных взаимодействий в разбавленных растворах ароматических веществ в рамках статистически строгой теории МакМиллана-Майера. Энтальпийные параметры парных взаимодействий растворенных веществ с молекулами органических неэлектролитов в воде h23 рассчитывались по известным соотношениям (J. Chem. Soc., Faraday Trans. I. - 1981. - V. 77. - P. 1191):
рH0 (3, 1+2) = b0 + b1 X2 + b2 X22; h23 = 1/2 b1 M1, (5)
где M1 – молярная масса растворителя (кг/моль).
Полученные результаты приведены в табл. 4. Как видно, по энтальпийным параметрам парного взаимодействия бензол и его производные в воде ведут себя в целом как гидрофобные вещества, поскольку h23>>0. Это свидетельствует о том, что парное взаимодействие растворенных веществ с молекулами неэлектролитов в воде является энтальпийно неблагоприятным, что вызвано перекрыванием сфер гидратации взаимодействующих частиц и вытеснением части молекул воды в объем растворителя. Чем более развиты сферы гидратации в радиальном направлении, тем сильнее проявляется эффект частичной дегидратации в процессе взаимодействия и тем положительнее величина параметра h23. Введение в молекулу бензола полярной аминогруппы уменьшает величину h23, а нитрогруппы существенно увеличивает, указывая на то, что нитрогруппа ведет себя в известной мере как неполярная. Переход от гидрофильной Мч к преимущественно гидрофобному ДМФ лишь количественно, но не качественно изменяет особенности взаимодействия ароматическое растворенное вещество-амид, поскольку в обоих случаях оно остается энтальпийно неблагоприятным. На рис. 5 представлена зависимость параметров парных взаимодействий аминогруппы с молекулами апротонных растворителей от их донорных чисел DN. Как видно, энтальпии взаимодействия отрицательны, но их значения не коррелирует с величинами донорной способности растворителей. Это, по-видимому, исключает образование контактных молекулярных пар в водном растворе и указывает на то, что энергетически выгодное парное взаимодействие аминогруппа-молекула апротонного растворителя осуществляется через одну или несколько молекул воды.
Для расчета энтропийных и гиббсовых параметров взаимодействия ароматических веществ с амидами в воде были использованы соотношения (6-8):
RT ln ![]() = а1 X2 + а2 X22 (6)
= а1 X2 + а2 X22 (6)
g23 = а1 M ![]() / 2; (7)
/ 2; (7)
-T s23 = g23 – h23 (8)
В табл. 5 сравниваются параметры парных взаимодействий бензола и аминокислот с Мч и ДМФ. Как видно, парное взаимодействие растворенных веществ с ДМФ является энергетически неблагоприятным, причем наиболее сильно это проявляется в случае более гидрофобного Phe. Взаимодействие аминокислот с гидрофильной Мч энтальпийно благоприятно, причем наиболее интенсивно взаимодействует мочевина с His, боковой фрагмент которого имеет несколько гидрофильных центров. Взаимодействие бензола с Мч неожиданно оказывается сильно энтальпийно отталкивательным. Поскольку для бензола h23>>0, а h23(Мч - His)< h23(Мч - Phe)<<0, то это наводит на мысль, что полярные и заряженные группы аминокислот проявляют выраженную тенденцию к специфическому взаимодействию с Мч в воде. Чем их больше в составе молекулы – тем энергетически выгоднее взаимодействие. Интересно отметить, что в случае ДМФ для бензола h23>>0, а h23(ДМФ - Phe)>>h23(ДМФ - L-аланин)> h23(ДМФ - His)>>0. Таким образом, опять-таки взаимодействие неполярных групп с амидом является энтальпийно неблагоприятным, а полярных, наоборот, сопровождается отрицательным изменением энтальпии.
Очевидно, что в молекуле Phe можно выделить два структурных фрагмента – неполярный бензольный остаток и полярную аланильную группу. Тогда, если принцип аддитивности групповых вкладов соблюдается, то величины параметров парных взаимодействий Phe-амид можно оценить как сумму величин соответствующих параметров для бензола и L-аланина. Из данных таблицы 5 следует, что для энтальпийных параметров парного взаимодействия ДМФ - Phe наблюдается удовлетворительное согласие расчетных и экспериментальных данных. Аналогичная ситуация имеет место и для параметров g23 Мч - Phe, однако в этом случае это всего лишь результат компенсации энтальпийного и энтропийного вкладов. Действительно, суммируя значения соответствующих параметров взаимодействия бензола и L-аланина с Мч, мы получим значения h23 и (-Ts23) отличные по знаку от экспериментальных величин. Очевидно, что вклад в величину параметра y23 дают все взаимные ориентации пары взаимодействующих частиц и все расстояния между ними, где потенциал средней силы отличен от нуля. Если при этом вклад от взаимодействия между какими-то группами оказывается определяющим (возникают предпочтительные ориентации), то величины вкладов остальных групп могут не соответствовать тем значениям, которые имели бы место при равновероятных ориентациях (Кесслер Ю.М., Зайцев А.Л. Сольвофобные эффекты. Теория, эксперимент, практика. Л.: Химия, 1989, - 312 с.). По-видимому, возникновение предпочтительных ориентаций между цвиттерионной группой Phe и молекулой Мч и приводит к нарушению групповой аддитивности. В пользу этого свидетельствует тот факт, что энтальпии взаимодействия большого числа аминокислот с Мч отрицательны и слабо зависят от природы боковой цепи. Более того, поскольку молекулы Мч и ДМФ имеют одинаковые Н-акцепторные фрагменты и, как показано выше, в растворе ДМФ принцип групповой аддитивности соблюдается, то можно осторожно предположить, что возникновение предпочтительных ориентаций вызвано взаимодействием -NH2-фрагментов Мч с цвиттерионной группой аминокислоты.
В последнем разделе рассмотрено влияние температуры на термодинамические свойства и параметры межчастичных взаимодействий в системе вода-ДМФ-Phe. Рассчитаны величины свободных энергий переноса, а также ее энтальпийных и энтропийных составляющих в интервале температур 0 - 60 0С. Поскольку L-фенилаланин малорастворим в воде, то можно принять, что коэффициент активности аминокислоты в насыщенном растворе будет мало отличаться от единицы (А.Г. Морачевский и др. Термодинамика разбавленных растворов неэлектролитов. Л.: Химия, 1982, - 240 с.) и, следовательно, pG0 RT ln (1/X3). Тогда становится возможным, используя полученные температурные зависимости энтальпий растворения и величины растворимости при 25 0С, с помощью уравнения Гиббса-Гельмгольца рассчитать значения X3 в воде и ее смесях с ДМФ в широком температурном интервале:
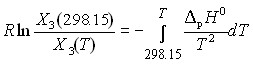 (9)
(9)
Полученные результаты показаны на рис. 6.
Рассчитанные из экспериментальных данных величины энтальпийных параметров парного взаимодействия L-фенилаланина с ДМФ при 15-45 0С приведены в табл. 6, где они сравниваются с литературными значениями h23 (Мч - Phe) (J. Therm. Analysis & Calorimetry. - 2007. - V. 89. - N. 3. - P. 841). Для расчета температурных изменений параметров парного взаимодействия для свободной энергии воспользуемся уравнением Гиббса-Гельмгольца в виде:
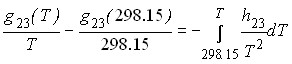 (10)
(10)
Далее, используя приведенные в табл. 5 значения, легко рассчитать величины энтропийных и гиббсовых параметров парного взаимодействия в широком температурном интервале. Рис. 7 показывает, что взаимодействие аминокислота-амид в обоих случаях притягивательное (g23<0), однако природа притяжения между частицами различна: в случае ДМФ она энтропийная (типично гидрофобная), а для Мч, наоборот, энтальпийная (гидрофильная). В растворах ДМФ с ростом температуры энтальпийный и энтропийный вклады становятся меньше по абсолютной величине, однако поскольку темп изменения их практически одинаков, то величины g23 почти не зависят от температуры. В растворах Мч отрицательные значения гиббсовых параметров парного взаимодействия определяются энтальпийной составляющей. Однако в этом случае зависимости энтальпийных и энтропийных параметров нелинейны и проходят через экстремумы в температурной области минимума теплоемкости чистой воды при постоянном давлении. Поскольку точка экстремума наблюдается примерно при 31 0С, то очевид-
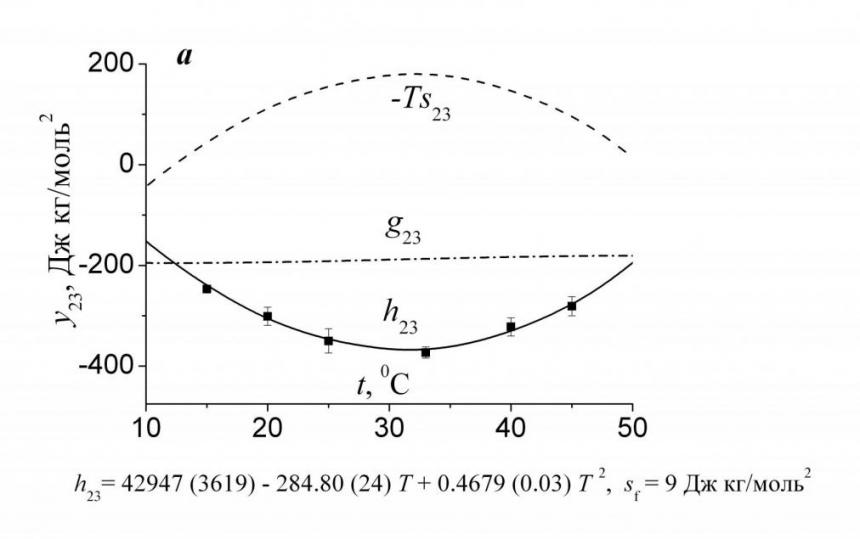 | 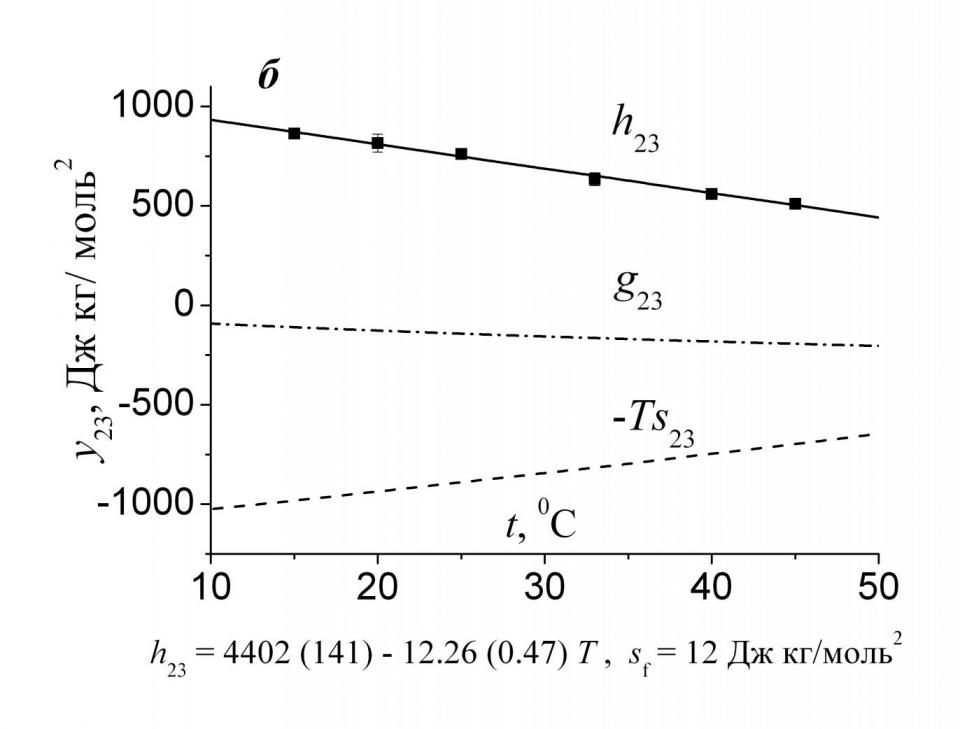 |
| Рис. 7. Температурные зависимости энтальпийных и энтропийных вкладов в гиббсовы параметры парных взаимодействий Phe с Мч (а) и ДМФ (б) в воде. Данные в растворах Мч взяты из J. Therm. Analysis & Calorimetry. - 2007. - V. 89. - N. 3. - P. 841. | |
но, что величины параметров взаимодействия при 25 и 37 0С, в силу симметрии функций h23(Т) и -Ts23(Т), оказываются практически идентичными. Следовательно, при анализе взаимодействия биологически активных веществ с Мч в физиологическом интервале температур принципиально возможно использовать энтальпийные и энтропийные характеристики, полученные при 25 0С. В то же время из рис. 7б ясно видно, что это не так при взаимодействии преимущественно гидрофобных Phe и ДМФ. Следовательно, переносить полученные в растворах ДМФ при 25 0С результаты на физиологический интервал температур рискованно.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ И ВЫВОДЫ
1. Впервые экспериментально измерены энтальпии растворения бензола, анилина, нитробензола, Phe и His в смесях воды с ДМФ и Мч при 25 0С, а также Phe в системе вода-ДМФ при 15– 45 0С. Показано, что в концентрационном интервале 0.0020.1 моль/кг энтальпии растворения исследованных ароматических веществ не зависят от моляльности раствора, что позволяет определять стандартные энтальпии растворения как средние значения в ряду экспериментальных величин.
2. Определены величины растворимости Phe и His в смесях воды с ДМФ при 25 0С, рассчитаны стандартные значения свободных энергий, энтальпий и энтропий переноса Phe и His из воды в ее смеси с амидами.
3. Установлено, что сольватация бензола и его производных в индивидуальных и смешанных растворителях усиливается в ряду C6H6< C6H5NO2< C6H5NH2. Обнаружено, что в смесях воды с ДМФ и ДМСО имеет место линейная зависимость между энтальпиями сольватации аминогруппы и параметрами основности смесей ВКТ, что свидетельствует об определяющей роли специфического взаимодействия -NH2-группа (кислота) - растворитель (основание) в сольватации аминогруппы.
4. Показано, что парное взаимодействие бензола и его монофункциональных производных с молекулами органических неэлектролитов является энтальпийно неблагоприятным, причем введение аминогруппы в бензольное кольцо уменьшает, а нитрогруппы заметно увеличивает положительные значения энтальпийных параметров взаимодействия.
5. Установлено, что парное взаимодействие Phe и His и с гидрофобным ДМФ, и с гидрофильной Мч сопровождается убылью свободной энергии, однако причины этого различны – в случае ДМФ взаимодействие имеет типично гидрофобную (энтропийную) природу, а для Мч – гидрофильную (энтальпийную). Взаимодействие Phe с гидрофильной Мч сопровождается появлением предпочтительных ориентаций между полярными группами взаимодействующих веществ, что приводит к нарушению аддитивности групповых вкладов в параметры -Ts23 и h23. Полученные результаты ясно показывают, что денатурирующее действие мочевины связано не только с тем, что ее добавки к воде ослабляют гидрофобное взаимодействие между неполярными фрагментами полипептидных цепей, но и с наличием прямого взаимодействия Мч с полярными и заряженными группами белков.
6. Проведено сравнительное исследование влияния температуры на термодинамические свойства тройных систем вода – ДМФ - Phe и вода – Мч - Phe и параметры взаимодействий аминокислота-амид. Показано, что энтальпийные и энтропийные параметры взаимодействия аминокислота-ДМФ линейно уменьшаются с ростом температуры. Сделан вывод, что при анализе взаимодействия ароматических аминокислот с гидрофильной Мч в физиологическом интервале температур допустимо использовать данные, полученные при 25 0С, а в случае преимущественно гидрофобного ДМФ использовать полученные при стандартной температуре энтальпийные и энтропийные характеристики некорректно.
Основное содержание диссертации изложено в следующих работах
1. Кустов, А.В. Сольватация анилина в смесях воды с N,N-диметилформамидом и ацетонитрилом / А.В. Кустов, А.В. Бекенева, О.А. Антонова, В.П. Королев // Журн. общей химии, -ISSN Print: 0036-0244. - 2002. – T. 72. – N. 6. – C. 981- 987.
2. Kustov, A.V. Enthalpic pair-interaction coefficients of benzene, aniline and nitrobenzene with N,N-dimethylformamide and acetonitrile in water at 298.15 K / A.V. Kustov, O.A. Antonova, A.V. Bekeneva, V.P. Korolev // Thermochim. Acta, -ISSN Print: 0040-6031. – 2003. -V. 398. - N. 1-2. – P. 9-14.
3. Бекенева, А.В. Энтальпия растворения фенилаланина в воде / А.В. Бекенева, А.В. Кустов, В.П. Королев // Журн. физич. химии, -ISSN Print: 0036-0244. - 2004. – T. 78. – N. 11. – C. 1927-1930.
4. Бекенева, А.В. Термохимические характеристики растворения гистидина / А.В. Бекенева, А.В. Кустов // Журн. физич. химии, -ISSN Print: 0036-0244. - 2005. – T. 79. – N. 11. – C. 2094-2095.
5. Королев, В.П. Термодинамика взаимодействия L--фенилаланина с мочевиной и диметилформамидом в воде / В.П. Королев, А.В. Кустов, А.В. Бекенева // Журн. общей химии, -ISSN Print: 0044 - 460 X. – 2007. - Т. 77. - N. 7. - C. 1149-1154.
6. Кустов, А.В. Термодинамические и структурные аспекты взаимодействия L-гистидина с мочевиной и диметилформамидом в воде / А.В. Кустов, А.В. Бекенева, В.П. Королев // Журн. общей химии, -ISSN Print: 0044 - 460 X. – 2008. – T. 78. – N. 1. - C. 106 - 110.
7. Кустов, А.В. Сольватация анилина в разбавленных водных растворах апротонных диполярных растворителей / А.В. Кустов, А.В. Бекенева, О.А. Антонова, В.П. Королев // VII Межд. конф. асп. и студ. по фунд. наукам "Ломоносов 2000". Тез. докл., Москва, МГУ, 2000, - С. 240.
8. Кустов, А.В. Энтальпийные коэффициенты парных взаимодействий бензола и анилина в смесях воды с органическими растворителями / А.В. Кустов, А.В. Бекенева, О.А. Антонова // Межд. научн. конф. "Кинетика и механизм кристаллизации". Тез. докл., Иваново, 2000, -С. 84.
9. Кустов, А.В. Состояние ароматических веществ и их функциональных групп в разбавленных водных и диметилформамидных растворах / А.В. Кустов, А.В. Бекенева // Межд. конф. студ. асп. и молодых ученых "Молодая наука - XXI веку", Иваново, ИВГУ, 2001, -С. 11.
10. Кустов, А.В. Энтальпии сольватации ароматических соединений и их функциональных групп в системах вода-диметилформамид и вода – ацетонитрил / А.В. Кустов, А.В. Бекенева, О.А. Антонова, В.П. Королев // VIII Межд. конф. "Пробл. сольв. и комплексообр. в растворах", Тез. докл., Иваново, 2001, -C. 190.
11. Кустов, А.В. Энтальпийные и теплоемкостные параметры взаимодействия L-фенилаланина с диметилформамидом и мочевиной в воде / А.В. Кустов, А.В. Бекенева, В.П. Королев // Всероссийский научный симпозиум по термохимии и калориметрии. Тез. докл., Нижний Новгород, 2004, - C. 175.
12. Кустов, А.В. Энтальпии сольватации ароматических веществ и их функциональных групп в смесях воды с диметилформамидом и ацетонитрилом / А.В. Кустов, А.В. Бекенева, В.П. Королев // там же, - C. 176.
13. Bekeneva, A.V. Thermal properties of ternary systems of water-amide-aromatic solute / A.V. Bekeneva, A.V. Kustov, V.P. Korolev // IX Int. Conf. "The problems of solvation and complex formation in solutions". Abstr., Plyos, 2004, - P. 144.
14. Кустов, А.В. Термодинамические свойства и параметры межчастичных взаимодействий в растворах биологически активных веществ в физиологическом интервале температур / А.В. Кустов, А.В. Бекенева, В.П. Королев // III семинар молодых ученых ИХР РАН, 2004, - C. 18.
15. Кустов, А.В. Термодинамические свойства и параметры межчастичных взаимодействий в системах вода-амид-биологически активное вещество / А.В. Кустов, А.В. Бекенева, Н.Л. Смирнова, Д.В. Батов, Н.Г. Манин, В.П. Королев // XV Международная конференция по химической термодинамике в России. Тез. докл., Москва, 2005, - C. 19.
16. Кустов, А.В. Гидрофобные эффекты в растворах биологически активных веществ / А.В. Кустов, А.В. Бекенева, А.Ф. Сыщенко, А.А. Емельянов, М.А. Крестьянинов, В.П. Королев // Межд. конф. cтуд., асп. и мол. ученых "Ломоносов 2005". Тез. докл., Москва, 2005, - C. 177.
17. Кустов, А.В. Гидрофобные и гидрофильные эффекты в системах вода-органический растворитель-аминокислота / А.В. Кустов, А.В. Бекенева, Н.Л. Смирнова, Д.В. Батов, Д.Д. Батов, Н.Г. Манин, В.П. Королев // XIII Симпозиум по межмолекулярному взаимодействию и конформациям молекул. Тез. докл., С-Петербург, 2006, - C. 114.
18. Бекенева, А.В. Взаимодействие аминокислот с денатураторами и стабилизаторами нативной структуры белков / А.В. Бекенева, А.В. Кустов, В.П. Королев // XXIII Межд. Чугаевская конф. по координац. химии. Тез. докл., Одесса, 2007, - C. 290.

