Универсальная шкала хроматографических времен удерживания биомакромолекул в задачах скорострельной протеомики
На правах рукописи
УДК 541.64:543.544
ПРИДАТЧЕНКО Марина Леонидовна
УНИВЕРСАЛЬНАЯ ШКАЛА ХРОМАТОГРАФИЧЕСКИХ ВРЕМЕН УДЕРЖИВАНИЯ БИОМАКРОМОЛЕКУЛ В ЗАДАЧАХ «СКОРОСТРЕЛЬНОЙ» ПРОТЕОМИКИ
01.04.17. – химическая физика, горение и взрыв, физика экстремальных состояний вещества
Автореферат
диссертации на соискание учёной степени кандидата физико-математических наук
Москва
2011
Работа выполнена в Учреждении российской академии наук Институте энергетических проблем химической физики РАН
Научный руководитель: кандидат физико-математических наук,
Горшков Михаил Владимирович
Официальные оппоненты: кандидат физико-математических наук
Козловский Вячеслав Иванович
доктор физико-математических наук Таганов Николай Геннадиевич
Ведущая организация: Московский государственный университет им. М.В.Ломоносова, г. Москва
Защита состоится “26” октября 2011 г. в “11” час. 00 мин. на заседании диссертационного совета № Д 002.112.01 при Институте энергетических проблем химической физики Российской академии наук по адресу: 119334 Москва, Ленинский проспект, д. 38, корп.1, 3 этаж, актовый зал.
С диссертацией можно ознакомиться в библиотеке Института химической физики им. Н.Н. Семенова Российской академии наук.
Автореферат разослан “__” сентября 2011 г.

Ученый секретарь
Диссертационного совета Д 002.112.01
кандидат физико-математических наук М.Н.Ларичев
© Учреждение российской академии наук Институт энергетических проблем химической физики РАН, 2011
Общая характеристика работы
Актуальность проблемы
В последние годы одним из наиболее быстро развивающихся направлений в науках о живых организмах стала "протеомика". Основной задачей протеомики является исследование белкового состава клеток живых организмов (протеом). Сложность этой задачи требует использования мощных аналитических средств, способных отслеживать карту протеома, изменяющуюся в зависимости от физиологических и патогенных состояний организма, что оказывает стимулирующее влияние на развитие высокопроизводительных методов так называемой «скорострельной» (в англоязычной литературе "shotgun") протеомики.
К аналитическим средствам, используемым в протеомике, в первую очередь, относятся такие физико-химические методы как масс-спектрометрия и жидкостная хроматография. В настоящее время масс-спектрометрия позволяет проводить измерения масс сложных биоорганических молекул с относительной точностью порядка одной миллионной в широком массовом диапазоне, в то время как воспроизводимость хроматографического разделения сложных смесей биомолекул достигает нескольких секунд в рамках продолжительного (до нескольких часов) хромато-масс-спектрометрического эксперимента. Благодаря прогрессу, достигнутому в последние годы в области хромато-масс-спектрометрических методов анализа биомолекул, одним из перспективных методов высокопроизводительной идентификации белков является подход, основанный на создании и использовании баз данных точных масс и хроматографических времен удерживания пептидных маркеров белков (Accurate Mass and Time tags, AMT). Создание баз данных AMT требует одновременных усилий со стороны разных исследовательских групп в рамках совместных проектов, однако, хроматографические данные в них оказываются привязанными к конкретным экспериментальным условиям и не переносимы с одной инструментальной платформы на другую. В диссертации рассматривается подход к решению этой проблемы. Актуальность темы исследования обусловлена необходимостью развития хромато-масс-спектрометрических методов "скорострельной" протеомики для использования в масштабных исследованиях протеомов живых организмов и их количественного анализа в рамках совместных исследований, включая реализацию международного проекта "Протеом человека".
Цель и задачи исследования
Основной целью работы является развитие метода жидкостной хроматографии на основе баз данных точных масс и времен удерживания пептидных маркеров белков для использования его в задачах «скорострельной» протеомики. Для реализации поставленной цели в рамках представленной работы были определены следующие конкретные задачи исследований:
(1) создание единой универсальной временной шкалы на основе концепции линейной корреляции времен удерживания, получаемых в различных экспериментальных условиях;
(2) экспериментальное исследование диапазона хроматографических условий, в которых наблюдается линейная зависимость хроматографических времен удерживания пептидов;
(3) проведение модельных экспериментов, создание прототипов баз данных AMT в универсальной шкале времен удерживания для статистически значимых массивов экспериментальных данных сложных смесей протеолитических пептидов, а также исследование точности представленных в них времен;
(4) теоретическое описание нелинейных эффектов в хроматографии полипептидов, в частности, инверсии времен удерживания пептидов при изменении хроматографических условий разделения;
(5) проверка возможности предсказания времен удерживания белков в обращено-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ) и идентификация точечных модификаций их аминокислотных последовательностей с целью возможного расширения применимости метода AMT для прямой идентификации белков, минуя стадию протеолитического гидролиза.
Используемые методы исследований
Эксперименты по разделению и идентификации индивидуальных пептидов и их смесей проводились на трех нано ВЭЖХ системах: две Agilent 1100 и одна Ultimate 3000 (Dionex). Каждая из трех ВЭЖХ систем была соединена с гибридными масс-спектрометрами LTQ-FT (Thermo Fisher, Бремен, Германия) с использованием хроматографических колонок со стационарной фазой C18. Для идентификации пептидов применялось несколько методов фрагментации ионов: фрагментация в результате столкновения с молекулами буферного газа (ДАС, CAD) в ионной ловушке и фрагментация в результате захвата медленных электронов (ДЭЗ, ECD) в ловушке ионного циклотронного резонанса (ИЦР). Спектры фрагментации использовались для восстановления пептидов по базе данных NCBI с помощью поисковых систем Mascot и X!Tandem.
В качестве образцов были использованы следующие коммерческие стандарты: триптические гидролизаты белка Cytochrome с и смеси шести белков (6 Protein Mixture: Bovine serum albumin, -Galactosidase, Lysozyme, Alcohol dehydrogenase, Cytochrome c, Apo-transferrin) производства компании Dionex/LCPacking (США).
Эксперименты по разделению модельных белков (Cytochrome с из организмов Equine, Bovine, Canine, производства Sigma-Aldrich и Calbiochem) и их пепсиновых гидролизатов были проведены на ВЭЖХ системе Janeiro CNS (Thermo Scientific, Швейцария) с использованием хроматографической колонки со стационарной фазой C18. Хроматографическая система была соединена с масс-спектрометром LTQ XL (Thermo Scientific, Бремен, Германия), в качестве метода фрагментации родительских ионов был выбран метод CAD.
Расчеты хроматографических времен удерживания производились с помощью модели критической хроматографии биомакромолекул BioLCCC (Liquid Chromatography of Biomolecules at Critical Conditions).
Научная новизна
Впервые было предложено использование физико-химической модели жидкостной критической хроматографии для идентификации полипептидов и белков на основе метода точных масс и времен удерживания AMT, а также предложен и реализован метод приведения хроматографических данных полипептидов и белков к единой временной шкале для создания универсальных баз данных AMT. Обнаружено и впервые описано явление инверсии порядка выхода пептидов с близкими временами удерживания при ВЭЖХ разделении на обращенной фазе в зависимости от их аминокислотного состава и их последовательности при изменении параметров хроматографической колонки (длина, размер пор, внутренний диаметр) и профиля градиента сильного растворителя. Определен масштаб явления инверсии в протеомных исследованиях при изменении профиля градиента сильного растворителя.
Положения, выносимые на защиту
- Концепция линейности хроматографических данных, получаемых при разделении пептидов в различных экспериментальных условиях.
- Результаты экспериментальных исследований условий разделения для определения границ применимости концепции линейности хроматографических данных.
- Метод многоточечной нормализации экспериментальных хроматографических времен пептидов к универсальной временной шкале, основанный на использовании модели критической жидкостной хроматографии макромолекул для предсказания времен удерживания.
- Результаты определения точности приведения хроматографических данных к единой универсальной шкале времен на основе создания прототипа базы данных AMT для смесей протеолитических пептидов модельных белков.
- Результаты исследования явления инверсии порядка выхода пептидов с близкими временами удерживания при ВЭЖХ разделении на обращенной фазе в зависимости от их аминокислотного состава и их последовательности при изменении параметров хроматографической колонки (длина, размер пор, внутренний диаметр) и профиля градиента сильного растворителя. Определение масштаба явления инверсии в протеомных исследованиях.
- Результаты исследования возможности предсказания времен удерживания целых белков при их разделении методом обращено-фазовой ВЭЖХ. Результаты разделения модельных белков, включая белки-гомологи, отличающиеся точечными мутациями аминокислотных последовательностей и теоретических расчетов их времен удерживания.
Научная и практическая ценность
Полученные результаты могут быть использованы специалистами в области высокоэффективной жидкостной хроматографии, а также протеомных исследований для решения следующих задач: развитие новых методов разделения смесей сложных веществ органического и биоорганического происхождения; разработка новых разделительных сред, обладающих высокой специфичностью по удерживанию макромолекул с заданными физико-химическими свойствами; фильтрация масс-спектрометрических идентификаций, получаемых при анализе протеомов живых организмов; создание баз данных времен удерживания для высокопроизводительного анализа белков; реализация хроматографически зависимых методов количественного анализа протеолитических смесей на основе мониторинга уникальных фрагментационных переходов MRM/SRM; разработка методов «скорострельной» протеомики на основе многомерной «предсказательной» хроматографии в сочетании с масс-спектрометрией; а также разработка новых поисковых протеомных машин, основанных на использовании хроматографических данных.
Личный вклад автора
Материал, представленный в диссертации, получен при непосредственном участии автора в реализации задач исследований, в выполнении экспериментов, в обсуждении и анализе полученных результатов. Диссертационная работа выполнена в период с 2007 по 2011 год.
Апробация работы
Результаты работы докладывались и обсуждались на следующих российских и международных конференциях: 35-ом конгрессе Международного хроматографического общества по высокоэффективной жидкостной хроматографии HPLC-2010 (Бостон, США, 2010), 57-ой и 58-ой конференции Американского масс-спектрометрического общества (Денвер, США, 2008 и Солт-Лейк-Сити, США, 2010 ), VI-ом Российском симпозиуме «Белки пептиды» (Казань, 2009), 50-ой, 51-ой и 52-ой научной конференции МФТИ (Москва, 2008, 2009, 2010), 3-ей международной конференции – школе «Масс-спектрометрия в химической физике, биофизике и энергетике» (Звенигород, 2007), III, IV и V Всероссийской конференции с международным участием Всероссийского масс-спектрометрического общества «Масс-спектрометрия и ее прикладные проблемы» (Москва, 2007, 2009, 2011).
Работы, вошедшие в диссертацию, были выполнены при поддержке РФФИ (гранты №№ 09-08-00663, 08-04-01339), программы президиума РАН №П8, Американского фонда гражданских исследований и развития АФГИР (грант CDRF RUB1-2909-MO-07) и Международного фонда поддержки науки ИНТАС (гранты №04-83-2643 и Genomics-05-1000004-7759).
Объем и структура диссертации
Работа изложена на 150 страницах, иллюстрирована 25 рисунками и содержит 13 таблиц. Диссертация состоит из введения, пяти глав, включая литературный обзор, основных результатов и выводов, списка цитируемой литературы, насчитывающей 70 наименований, трех приложений.
Содержание работы
Во введении обоснована актуальность темы диссертации и сформулирована цель исследования, приведены положения, выносимые на защиту.
Глава 1 является литературным обзором, посвящена хромато-масс-спектрометрии как основному методу исследования в протеомике. Рассмотрены основные проблемы, возникающие при идентификации белков в биологических смесях, представлены возможные пути их решения. Показаны роль высокоэффективной жидкостной хроматографии в анализе макромолекул и потенциальные возможности теоретических аналитических расчетов хроматографических данных разделяемых биомакромолекул. Приведен обзор существующих математических и полуэмпирических подходов к расчету времен удерживания пептидов.
Глава 2 содержит теоретическое описание модели жидкостной хроматографии биополимеров в критических условиях (BioLCCC). Рассматриваются основные предположения, которые легли в основу модели BioLCCC. Также в главе представлено теоретическое описание подхода многоточечной нормализации (МТН) хроматографических данных пептидов и обоснованы критерии выбора единой временной шкалы для реализации такой нормализации.
Основные уравнения градиентной хроматографии. Модель критической жидкостной хроматографии биомакромолекул BioLCCC аналитически описывается следующей системой уравнений:
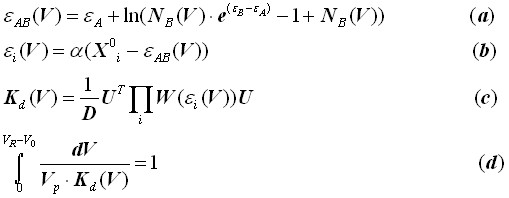 (1)
(1)
В системе уравнений (1), определяющей объем удерживания VR биомакромолекул в условиях градиентного элюирования, главным является уравнение (1с), связывающее коэффициент распределения Kd, численно совпадающий со статистической суммой цепи в поре, с ее микроскопическим строением. Состояние макромолекулы в поре задается цепью случайных блужданий, описываемых переходной матрицей W. Уравнение (1с) описывает конкуренцию между энергией притяжения, стремящейся упорядочить состояние звеньев на поверхности, и потерями энтропии. Произведение переходных матриц в (1с) некоммутативно и зависит от последовательности аминокислотных остатков. Таким образом, в диссертации показано, что текст последовательности заложен порядком произведения матриц. Модель одновременно учитывает и химическую природу аминокислотных остатков через их энергию адсорбции ![]() , и их последовательность, место в цепи, а также описывает все возможные режимы разделения – адсорбционный (LAC), эксклюзионный (SEC) и критический (LCCC).
, и их последовательность, место в цепи, а также описывает все возможные режимы разделения – адсорбционный (LAC), эксклюзионный (SEC) и критический (LCCC).
Остальные параметры в системе уравнений (1): V0 - объем межчастичного пространства (объем подвижной фазы), VP - объем пор (объем неподвижной фазы), D - размер пор, выраженный в единицах размера звена, NB - мольная доля одного из компонентов растворителя, V - объем прокачанного через колонку растворителя. U – единичный вектор–столбец, задающий начальное распределение С–концевой группы в поре. Феноменологическими параметрами модели являются эффективные энергии адсорбции ![]() , описывающие взаимодействие аминокислотных остатков с поверхностью. Стандартные энергии адсорбции аминокислотных остатков X0i (выраженные в единицах kT) при pH 2.0 на обращенной фазе C18 приведены в таблице 1.
, описывающие взаимодействие аминокислотных остатков с поверхностью. Стандартные энергии адсорбции аминокислотных остатков X0i (выраженные в единицах kT) при pH 2.0 на обращенной фазе C18 приведены в таблице 1.
Обозначения аминокислотных остатков соответствуют общепринятым. Параметры, описывающие энергии адсорбции молекул воды и ацетонитрила, равны, соответственно, A=0 kT, B=2,40 kT. В диссертации использовался тот факт, что природные белки обычно имеют концевые группы H2N- и -COOH, энергии которых составляют – 1,69 kT и – 0,03 kT, соответственно.
Таблица 1. Стандартные энергии адсорбции природных аминокислот X0i, выраженные в единицах kT.
| K | H | R | N | G | S | Q | D | T | E |
| 0,266 | 0,386 | 0,516 | 0,614 | 0,656 | 0,698 | 0,746 | 0,781 | 0,876 | 0,984 |
| A | P | C | Y | V | M | I | L | F | W |
| 1,143 | 1,143 | 1,296 | 1,686 | 1,751 | 1,822 | 2,156 | 2,298 | 2,319 | 2,436 |
Многоточечная нормализация хроматографических времен удерживания к универсальной шкале времен. В диссертации показано, что, используя предсказанные времена удерживания для выбранного пептидного стандарта и свойство линейной корреляции хроматографических данных, получаемых в различных условиях разделения, можно ввести новую шкалу времени, в которой экспериментальные значения времен удерживания исследуемых пептидов будут иметь одни и те же (для одних и тех же пептидов) нормализованные времена. Шкала нормализованных времен строится 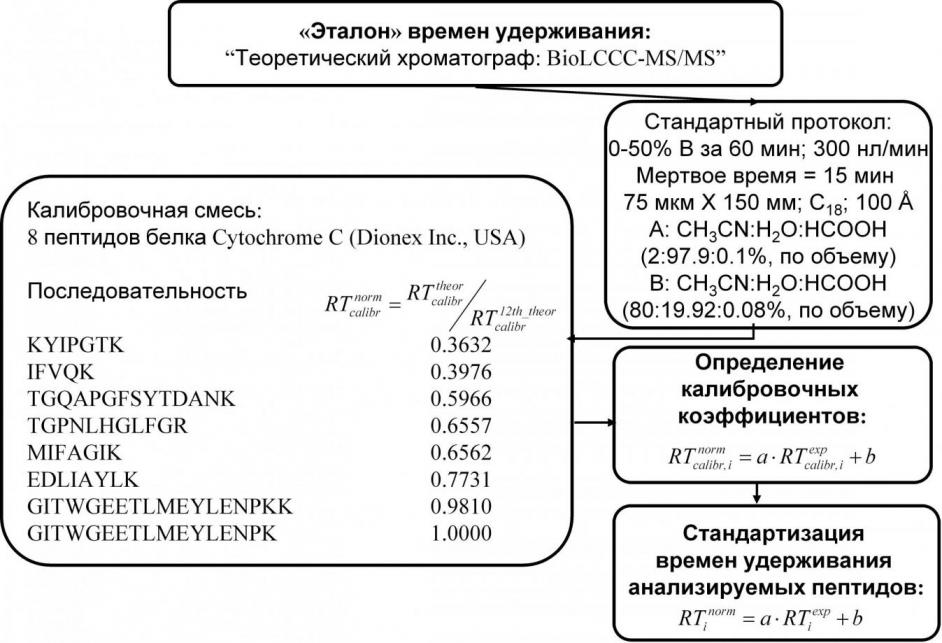
Рис.1. Схематическое представление стандартизации экспериментальных времен удерживания пептидов методом многоточечной нормализации с использованием модели BioLCCC для расчёта теоретических времен удерживания.
следующим образом: выбирается пептидный стандарт, для которого рассчитываются теоретические значения времен удерживания в условиях единого, заранее определенного протокола разделения («базисный» протокол). Далее теоретические времена удерживания для пептидов стандарта нормализуются в диапазоне [0;1], где время удерживания для наиболее гидрофобного пептида стандарта выбирается равным единице. Подставляя экспериментальные и нормализованные теоретические значения времен удерживания для пептидов стандарта в линейное уравнение (2а):
![]() (2а)
(2а)
определяются калибровочные коэффициенты a и b. Используя полученные калибровочные коэффициенты a и b, все экспериментальные времена ![]() для исследуемых пептидов переводятся в новую шкалу нормализованных времен с помощью линейного уравнения:
для исследуемых пептидов переводятся в новую шкалу нормализованных времен с помощью линейного уравнения:
![]() (2b)
(2b)
Такой подход к стандартизации хроматографических времен удерживания был назван авторами методом многоточечной нормализации (МТН).
Подробное пошаговое описание процедуры стандартизации времен, использованной в данной работе, схематически представлено на Рис.1. В работе в качестве стандартного («базисного») протокола предлагается использовать протокол, являющийся стандартным в микроколоночной хроматографии пептидов. В качестве стандартной смеси для построения шкалы и калибровки разделительных систем были использованы пептиды Cytochrome c.
Глава 3 посвящена экспериментальному исследованию диапазона хроматографических условий, в которых наблюдается линейная зависимость хроматографических времен удерживания пептидов, а также проведению модельных экспериментов, созданию прототипов баз данных AMT в универсальной шкале времен удерживания для статистически значимых массивов экспериментальных данных сложных смесей протеолитических пептидов и исследованию точности представленных в них времен.
При определении диапазона были рассмотрены условия, типичные для протеомных исследований с использованием методов ВЭЖХ-МС/МС: обращенная фаза C18 в качестве адсорбента, размер пор в диапазоне от 90 до 300, смесь вода/ацетонитрил (АЦН) в качестве бинарного растворителя со значениями pH в диапазоне 2,03,0 и линейные профили градиентов с наклоном 0,21,7% АЦН/мин. В качестве ион-парных агентов в ВЭЖХ-МС, как правило, использовалась муравьиная кислота. Хроматографические колонки, применявшиеся в этих исследованиях, представлены в Таблице 2А. Эксперименты по разделению и идентификации пептидов из гидролизата шести белков проводились в рамках совместной работы с учеными из Университета Уппсалы в Швеции, лаборатории исследования динамики протеомов Министерства атомной энергетики Франции в Гренобле и Института биохимической физики РАН в Москве с использованием различных инструментальных систем и протоколов ВЭЖХ, представленных в Таблице2Б.
Таблица 2. Условия хроматографических экспериментов, использованных при тестировании концепции линейности хроматографических данных.
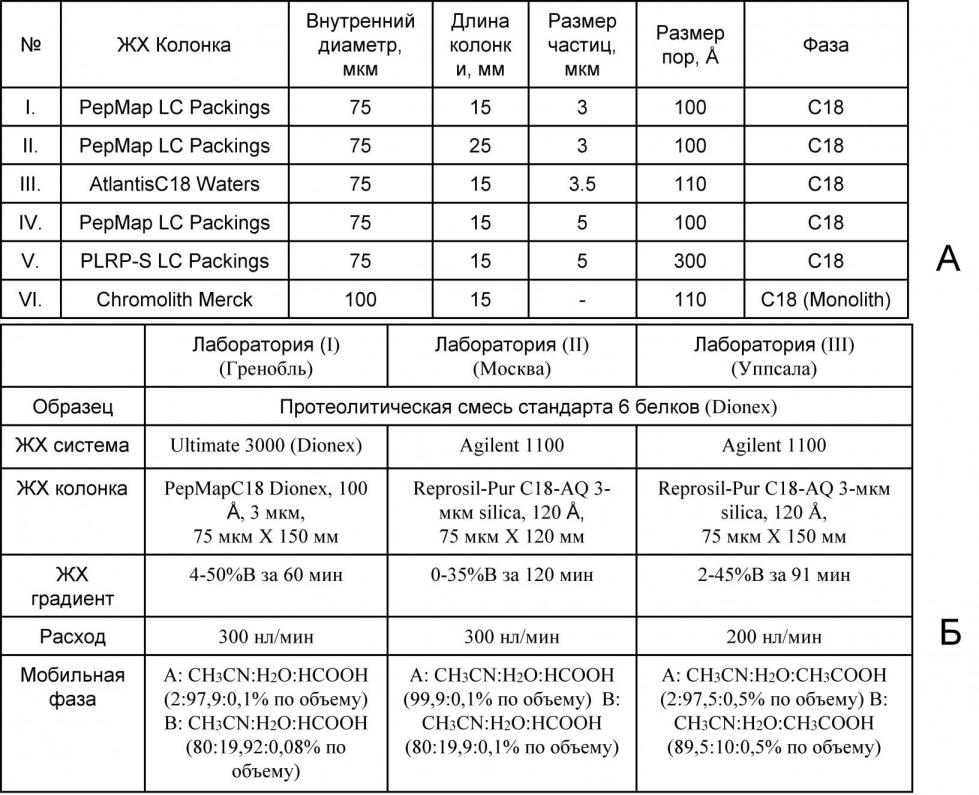
При определении диапазона применимости концепции линейности хроматографических данных было показано, что для обращенных фаз C18 различного типа (силикагелевые, монолитные и полимерные) наблюдается высокая степень линейной корреляции хроматографических данных (в среднем R2 = 0,9850,995). В Таблице 3 представлены результаты некоторых экспериментов, в которых изменялись следующие условия разделения: (1) профиль градиента (при фиксированных колонке I и скорости подачи растворителя (300 нл/мин)); (2) скорость подачи растворителя (при фиксированных колонке I и наклоне градиента 0,8% В/мин); а также (3) параметры колонок при разделении в двух различных градиентах 1,7% В/мин и 0,3% В/мин и фиксированном потоке - 300 нл/мин.
Таблица 3. Коэффициенты линейной корреляции экспериментальных времен удерживания пептидов белка Cytochrome c для различных условий разделения, колонок и протоколов.
| Фиксированные параметры | Значения R2 при различных наклонах градиента | |||||
| Колонка I–I* 300 нл/мин | 1,7 % B/мин | 1,4 % B/мин | 1,2 % B/мин | 0,8 % B/мин | 0,4 % B/мин | 0,3 % B/мин |
| 0,992 | 0,998 | 0,998 | 0,997 | 0,995 | 0,988 | |
| Фиксированные параметры | Значения R2 при различных скоростях потока растворителя | |||||
| Колонка I–I* 0,8 % В/мин | 200 нл/мин | 300 нл/мин | 400 нл/мин | |||
| 0,998 | 0,998 | 0,997 | ||||
| Фиксированные параметры | Значения R2 при использовании различных колонок | |||||
| 300 нл/мин | I–I* | II–I* | III–I* | IV–I* | V–I* | VI–I* |
| 1,7 % В/мин | 0,994 | 0,994 | 0,978 | 0,992 | 0,974 | 0,990 |
| 0,3 % В/мин | 0,998 | 0,992 | 0,966 | 0,990 | 0,967 | 0.988 |
Примечание: I* Коэффициенты R2 отражают корреляцию времен удерживания при тестируемых условиях с «эталонными» данными, полученными на колонке I (см. Таблицу 2А) при градиенте 0-50% В в течении 60 мин.
Создание прототипа базы данных AMT для смесей протеолитических пептидов модельных белков методом МТН. Экспериментальная проверка предложенной процедуры нормализации осуществлялась на примере смеси триптических пептидов шести белков. В состав смеси также входили пептиды белка Cytochrome c, по которым осуществлялась нормализация времен удерживания всех пептидов смеси («внутренняя калибровка»). Данные, полученные в различных лабораториях, были объединены в три группы: (1) пептиды, идентифицированные в Москве и Гренобле (174 пептида); (2) пептиды, идентифицированные в Москве и Упсале (103 пептида); а также (3) идентификации, общие для всех трех лабораторий (69 пептидов). При этом стандартные отклонения для полученных нормализованных хроматографических времен идентифицированных пептидов составляли, соответственно: 1,4%, 1,6% и 1,5%. В диссертации показано, что приведение хроматографических времен удерживания, полученных на разных инструментальных платформах и при различных параметрах разделения протеолитической смеси, к единой шкале выявило соответствие между нормализованными временами удерживания для одних и тех же пептидов с точностью порядка 1,5% при калибровке системы ВЭЖХ по внутреннему стандарту.
Продемонстрировано, что использование альтернативных моделей предсказания времен удерживания позволяет получать сопоставимые данные по точности нормализованных времен удерживания. Так, точность «внутренней калибровки» с использованием доступного алгоритма SSRCalc (Sequence Specific Retention Calculator) для расчёта времен удерживания варьировалась в пределах 0,9-1,5%. Следует отметить, что полуэмпирический алгоритм SSRCalc считается наиболее точным алгоритмом вычисления времен удерживания триптических пептидов и широко используется в протеомных исследованиях. Однако, в настоящее время этот алгоритм разработан, во-первых, для ограниченного количества экспериментальных условий разделения, и изменение, например, размера поры, профиля градиента, требует перенастройки алгоритма, а во-вторых, только для триптических пептидов. Модель BioLCCC не имеет указанных недостатков и позволяет рассчитывать времена удерживания при любых условиях ВЭЖХ на обращенной фазе C18 для произвольно заданных профилей градиента и параметров колонки. При этом в силу малого количества феноменологических параметров модель BioLCCC может быть легко адаптирована для работы с различными фазами.
Предложенная в диссертации процедура нормализации времен удерживания пептидов позволяет стандартизовать экспериментальные данные, полученные в рамках градиентной ВЭЖХ на обращенной фазе типа C18 при различных профилях градиента, параметрах колонок и мобильных фазах. Предложенный подход к нормализации времен удерживания пептидов и приведения их к единой временной шкале может быть использован в задачах идентификации белков методами «скорострельной» протеомики и при создании баз данных точных масс и времен удерживания пептидных маркеров белков AMT.
В Главе 4 представлены результаты изучения нелинейных эффектов в хроматографии полипептидов, в частности, явления инверсии времен удерживания пептидов при изменении хроматографических условий разделения и результаты исследования масштаба их влияния на идентификацию пептидов на основе использования баз данных AMT.
Модель BioLCCC позволяет вычислить изменения коэффициентов распределения Kd для выбранных пептидов в зависимости от процентного содержания органического растворителя %АЦН в мобильной фазе и построить кинетические кривые Kd(%АЦН). В случае пересечения кинетических кривых даже незначительные вариации экспериментальных параметров (габариты колонки при фиксированном размере пор, наклон профиля градиента, скорость подвижной фазы) могут приводить к изменениям времен выхода полипептидов вплоть до инверсии времен удерживания. В связи с этим, интересным представляется ряд вопросов, связанных с масштабом этого явления. К таким вопросам относятся: зависимость количества пар пептидов с измененными порядками выхода от состава и размера выборки пептидов; масштаб изменения профиля градиента, при котором число пар пептидов с инверсией становится значимым при работе с базами данных AMT; возможность теоретической оценки числа пар пептидов с изменившимися порядками выхода в зависимости от условий хроматографического эксперимента.
В модели BioLCCC при фиксированных энергиях адсорбции аминокислот и компонент мобильной фазы с поверхностью адсорбента, а также при фиксированном размере пор адсорбента, на угол наклона кинетической кривой влияет не только длина пептида, но и его аминокислотный состав и последовательность. На Рис.2 показана ситуация, когда более длинный пептид в инверсионной паре сильнее удерживается в пологом градиенте, а при более крутом градиенте — наоборот, имеет меньшее время удерживания. Это наиболее распространенная ситуация (примерно 95% всех случаев инверсии порядка выхода) в проанализированных экспериментальных данных. Кинетическая кривая для пептида TGPNLHGLFGR (количество аминокислотных остатков в цепи N = 12, средняя энергия адсорбции пептида![]() = 0.891 kT) характеризуется большим углом наклона в резко возрастающей части кривой, в то время как для более короткого пептида MIFAGIK (N = 8,
= 0.891 kT) характеризуется большим углом наклона в резко возрастающей части кривой, в то время как для более короткого пептида MIFAGIK (N = 8,![]() = 1.099 kT) этот наклон меньше. При этом оказывается, что в медленном градиенте (Рис.2В) более короткий пептид на протяжении всего эксперимента движется быстрее длинного пептида. В градиенте с резким наклоном (Рис.2Б) характер движения пептидов в колонке меняется: на начальном этапе короткий пептид движется быстрее, но по мере нарастания концентрации АЦН скорость перемещения короткого пептида уменьшается относительно скорости перемещения длинного пептида. В определенный момент времени координаты их положения в колонке становятся равными – эта точка обозначена на рисунке как точка инверсии – после прохождения этой точки длинный пептид начинает обгонять короткий. С точки зрения модели BioLCCC, такая картина разделения трактуется следующим образом. В медленном градиенте при разделении преобладает адсорбционный режим, при котором большим удерживанием характеризуются молекулы большего размера. В то время как, при разделении в градиентах с резким наклоном, по мере нарастания концентрации АЦН происходит смена режима с адсорбционного на эксклюзионный, что приводит к
= 1.099 kT) этот наклон меньше. При этом оказывается, что в медленном градиенте (Рис.2В) более короткий пептид на протяжении всего эксперимента движется быстрее длинного пептида. В градиенте с резким наклоном (Рис.2Б) характер движения пептидов в колонке меняется: на начальном этапе короткий пептид движется быстрее, но по мере нарастания концентрации АЦН скорость перемещения короткого пептида уменьшается относительно скорости перемещения длинного пептида. В определенный момент времени координаты их положения в колонке становятся равными – эта точка обозначена на рисунке как точка инверсии – после прохождения этой точки длинный пептид начинает обгонять короткий. С точки зрения модели BioLCCC, такая картина разделения трактуется следующим образом. В медленном градиенте при разделении преобладает адсорбционный режим, при котором большим удерживанием характеризуются молекулы большего размера. В то время как, при разделении в градиентах с резким наклоном, по мере нарастания концентрации АЦН происходит смена режима с адсорбционного на эксклюзионный, что приводит к

