Пространственная структура комплексов и механизм каталитического действия фермента saicar-синтазы saccharomyces cerevisiae
На правах рукописи
УДК 548.737
УРУСОВА ДАРЬЯ ВЛАДИМИРОВНА
ПРОСТРАНСТВЕННАЯ СТРУКТУРА КОМПЛЕКСОВ И МЕХАНИЗМ
КАТАЛИТИЧЕСКОГО ДЕЙСТВИЯ ФЕРМЕНТА SAICAR-СИНТАЗЫ SACCHAROMYCES CEREVISIAE
Специальность 01.04.18 – кристаллография, физика кристаллов
Автореферат
диссертации на соискание ученой степени
кандидата физико-математических наук
Москва – 2006
Работа выполнена в Институте кристаллографии имени А.В. Шубникова Российской академии наук
Научный руководитель: доктор физико-математических наук
Мелик-Адамян Вильям Рафаилович
Официальные оппоненты: доктор физико-математических наук
Лунин Владимир Юрьевич (Институт математических проблем биологии РАН)
доктор химических наук
Демидкина Татьяна Викторовна
(Институт молекулярной биологии РАН)
Ведущая организация: Институт белка РАН, г. Пущино
Защита диссертации состоится « » октября 2006 г. в «11час.00 мин» на заседании Диссертационного совета Д002.114.01 в Институте кристаллографии имени А.В. Шубникова РАН по адресу: 119333 Москва, Ленинский проспект, 59
С диссертацией можно ознакомиться в библиотеке Института кристаллографии
имени А.В. Шубникова РАН
Автореферат разослан « » сентября 2006 г.
Ученый секретарь Диссертационного совета
кандидат физико-математических наук В.М. Каневский
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
АКТУАЛЬНОСТЬ ТЕМЫ. Работа посвящена структурно-функциональному исследованию методами рентгеновской кристаллографии белков малоизученного фермента SAICAR-синтазы. Фермент участвует в многоступенчатом синтезе пуриновых нуклеотидов, играющих важнейшую роль в синтезе нуклеиновых кислот и других метаболических реакциях в живых организмах. Изучение структуры и действия ферментов, регулирующих ступени биосинтеза, может быть использовано для создания антисептических и противоопухолевых лекарств. В связи с этим получение отсутствовавшей информации о расположении субстратов в активном центре фермента, а также об изменениях структуры активного центра при связывании субстратов для создания структурной основы механизма действия фермента являлось актуальной задачей. Также не была ясна причина ингибирующего действия высокой концентрации ионов магния, необходимых для протекания реакции.
ЦЕЛЬ РАБОТЫ заключалась в определении методами рентгеноструктурного анализа пространственной структуры 6-ти комплексов фермента SAICAR-синтазы и предложении структурного механизма его каталитического действия.
НАУЧНАЯ НОВИЗНА РАБОТЫ
Впервые определены пространственные структуры комплексов фермента SAICAR-синтазы с аспарагиновой кислотой, с аденозинтрифосфатом, с аналогами субстратов AICAR и янтарной кислотой, тройного комплекса с ATP, AICAR и янтарной кислотой, а также с продуктом реакции, SAICAR. Пространственная структура комплексов с аспарагиновой кислотой и тройного комплекса определены с разрешением 1. Данные высокого разрешения позволили впервые определить места и характер связывания всех субстратов в активном центре фермента. Сравнительный анализ структур исследованных комплексов выявил существование «открытой» и «закрытой» форм молекулы фермента, и позволил предложить стереохимическй механизм действия фермента.
ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ Создана структурная основа для понимания механизма действия одного из важнейших ферментов биосинтеза пуриновых нуклеотидов, которая может быть использована для разработки лекарственных препаратов, регулирующих деление клеток. Координаты атомов и соответствующие структурные факторы исследованных комплексов помещены в международную базу данных белковых структур (Protein Data Bank).
ПУБЛИКАЦИИ. По теме диссертации опубликовано 8 работ. Список работ приведен в конце автореферата.
ОБЪЕМ И СТРУКТУРА РАБОТЫ Работа состоит из введения, четырех глав, выводов, списка цитируемой литературы и приложений. Она изложена на 120 страницах, содержит 36 рисунков и 11 таблиц.
ОСНОВНЫЕ ПОЛОЖЕНИЯ, ВЫНОСИМЫЕ НА ЗАЩИТУ:
- Определенные методами рентгеноструктурного анализа пространственные структуры 6-ти комплексов фермента SAICAR-синтазы.
- Места и характер связывания субстратов в активном центре фремента.
- Конформационные изменения молекулы SAICAR-синтазы при связывании субстратов.
- Предполагаемый механизм каталитического действия SAICAR-синтазы.
ЛИЧНЫЙ ВКЛАД АВТОРА. Участие в сборе и обработке дифракционных данных от кристаллов комплексов с помощью синхротронного излучения, за исключением комплекса с SAICAR. Проведение всех расчетов, связанных с решением и уточнением пространственной структуры представленных в работе комплексов SAICAR-синтазы. Анализ атомных моделей комплексов с целью определения мест и способов связывания субстратов в молекуле фермента, выявления конформационных изменений в молекуле белка и структурной основы механизма каталитического действия фермента SAICAR-синтазы.
АПРОБАЦИЯ РАБОТЫ Результаты работы докладывались на 19-ой Европейской кристаллографической конференции (Нанси, Франция, август 2000), Третьей национальной конференции по применению Рентгеновского, Синхротронного излучений, Нейтронов и Электронов для исследования материалов (РСНЭ-2001) (Москва, май 2001), Молодёжном конкурсе научных работ ИКРАН (октябрь 2001), Четвертой национальной конференции РСНЭ-2003 (Москва, ноябрь 2003), III Съезде биофизиков России (Воронеж, июнь 2004), Пятой национальной конференции РСНЭ-2005 (Москва, 2005).
КРАТКОЕ СОДЕРЖАНИЕ ДИССЕРТАЦИИ
Введение. Во введении на основании анализа роли SAICAR–синтазы в метаболизме клетки как фермента пуринового биосинтеза и необходимости изучения ее фермент-субстратных комплексов обоснована актуальность темы, содержится постановка задачи и сформулирована цель работы.
Глава 1. Фермент SAICAR-синтаза – участник биосинтеза пуриновых нуклеотидов (по литературным данным).
Глава посвящена обзору литературных данных по синтезу пуриновых оснований: описанию последовательности включения атомов в пуриновое кольцо и их источников, промежуточных соединений и ферментных систем, катализирующих химические реакции пуринового биосинтеза. Описаны известные биохимические свойства и пространственная структура нативной SAICAR-синтазы. Рассмотрены особенности SAICAR-синтазы среди других ATP-зависимых ферментов пуринового биосинтеза, приведено сравнение способа связывания ATP в SAICAR-синтазе с ATP-зависимыми белками из других семейств.
Биосинтез пуриновых нуклеотидов осуществляется за 11 этапов в большинстве микроорганизмов, последовательно превращающих 5-фосфорибозил-1-пирофосфат в инозинмонофосфат (IMP), который за два следующих шага преобразуется либо в аденозинмонофосфат (AMP), либо в гуанозинмонофосфат (GMP). Исследуемый фермент SAICAR-синтаза дрожжей Saccharomyces cerevisiae катализирует восьмую стадию биосинтеза пуриновых нуклеотидов, обеспечивая синтез 5’-фосфорибозил-4-(N-сукцинокарбоксамид)-5-аминоимидазола (SAICAR) из 5’-фосфорибозил-5аминоимидазолкарбоксилата (CAIR) и аспарагиновой кислоты в присутствии аденозинтрифосфата и ионов Mg. Реакция сопровождается гидролизом ATP до ADP и неорганического фосфата (Рис. 1а).
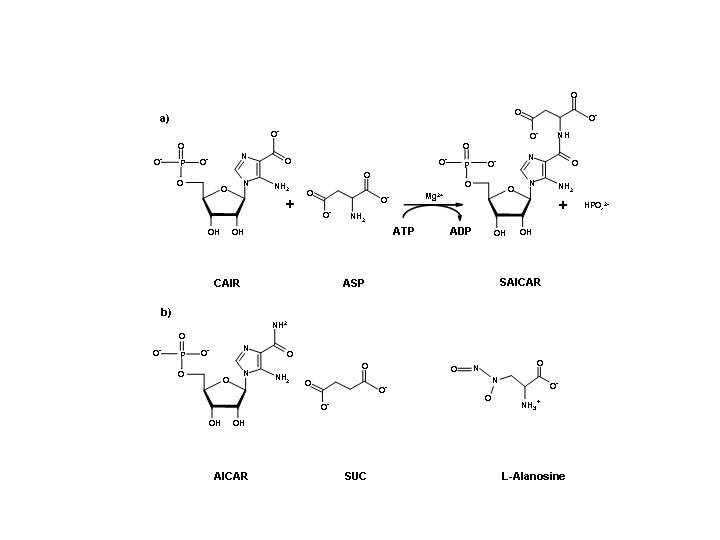
Рис. 1. а) Схема каталитической реакции SAICAR-синтазы; б) аналоги субстратов 5’-фосфорибозил-5-амино-4-имидазолкарбоксамид (AICAR) и янтарная кислота (SUC)
SAICAR-синтаза дрожжей Saccharomyces cerevisiae – мономерный белок с молекулярной массой 36 кДа. Ее аминокислотная последовательность содержит 306 остатков [1]. Препараты фермента SAICAR-синтазы были предоставлены Биологическим институтом Санкт-Петербургского Университета, где было проведено выделение и исследование ее биохимических свойств [2], а также определены оптимальные условия функционирования и субстратная специфичность фермента [2], [3]. Структура нативного фермента была решена с разрешением 1.9 [4]. Было установлено, что молекула SAICAR-синтазы имеет глобулярную форму с общими размерами примерно 70 х 60 х 40 3. Сворачиваясь в пространстве, полипептидная цепь образует три домена. В центре молекулы имеется глубокая полость с размерами приблизительно 15 х 15 х 30 3 (Рис. 2), достаточными для того, чтобы вместить одновременно молекулы субстратов CAIR ATP и ASP.
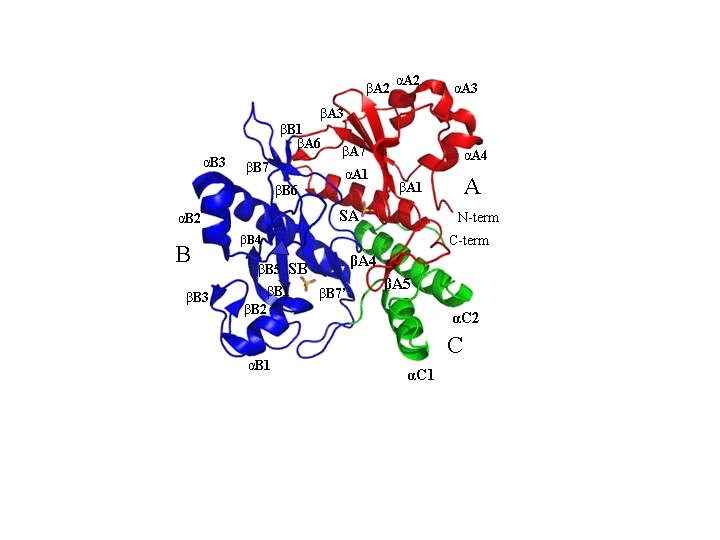
Рис. 2. Третичная структура и пространственное расположение элементов вторичной структуры SAICAR-синтазы. Три домена показаны разными цветами и обозначены буквами А, В и С соответственно; SA и SB- сульфат-ионы.
Структурное сравнение SAICAR-синтазы с различными нуклеотид-связывающими белками выявило, что ее домен А топологически очень близок малому домену циклической AMP-зависимой протеинкиназы, а домен B проявляет большое сходство с карбокси-концевым доменом глютатион синтетазы (GSHазы)[5] и D-alanine:D-alanine лигазы (DD лигазы)[6]
Кристаллы комплексов SAICAR-синтазы, использованные в работе, были выращены А.И. Гребенко в Институте кристаллографии РАН методом диффузии паров в висячей капле и достигали размеров 1.0 – 1.5 мм. Кристаллы комплексов (SS+ATP)-II и (SS+SAICAR) получены вымачиванием кристаллов нативной SAICAR-синтазы в растворах, содержащих 2.25-2.26 М сульфата аммония в 0.5 М Tris-HCl буфере, pH 7.5, 0.04 М аспарагиновой кислоты и добавленные субстраты. Кристаллы остальных комплексов получены сокристаллизацией с субстратами из растворов, содержащих белок в концентрации 24-30 мг/мл, 1 М сульфата аммония, 0.04 М аспарагиновой кислоты в 0.5 М Tris-HCl буфере, pH 7.5. Осаждающий раствор содержал 2.25-2.26 М сульфата аммония в 0.5 М Tris-HCl буфере, pH 7.5. Кристаллизация проводилась при комнатной температуре. Кристаллы всех комплексов SAICAR-синтазы принадлежат к пространственной группе симметрии P212121, содержат одну молекулу в независимой части ячейки и имеют сходные параметры элементарной ячейки (табл. 1).
Глава 2. Рентгеноструктурное исследование комплексов SAICAR-синтазы Saccharomyces cerevisiae.
Интенсивности дифракционных отражений от кристалллов исследуемых комплексов были измерены с помощью синхротронного излучения в Европейской лаборатории молекулярной биологии (г. Гамбург) на накопительном кольце DORIS (4.5 ГэВ) на станциях BW7A, BW7B, X11, X31 с использованием детектора MAR Research Imaging Plate. Дифракционные данные от кристаллов (SS+ATP)-I и (SS+SAICAR) были получены при комнатной тeмпературе до разрешения 2.05 и 2.00 соответственно, а от кристаллов остальных комплексов - при 100К до разрешения 1.4 - 1.0. Раствор, в котором выдерживали кристаллы перед низкотемпературной съемкой, содержал 30 % (от насыщения) глюкозы, 2.5 М сульфата аммония, 0.04 М аспарагиновой кислоты, 0.01 М MgCl2 и 0.05 М Tris-HCl буфера, pH 7.5. Обработка экспериментальных данных былa выполненa с помощью программ DENZO/SCALEPACK. Статистические характеристики экспериментальных данных представлены в табл. 1.
Таблица 1. Статистические характеристики экспериментальных данных, полученных от кристаллов комплексов SAICAR-синтазы.
| Комплексы | (SS+ ASP) | (SS+ ATP)-I | (SS+ ATP)-II | (SS+AIC+ SUC) | (SS+ATP+ AIC+SUC) | (SS+ SAICAR) |
| Параметры ячейки a, b, c () | 61.02, 62.50, 78.27 | 69.77, 74.19, 76.00 | 61.48, 63.05, 79.82 | 61.03, 62.83, 78.60 | 60.68, 61.85, 76.89 | 60.85, 62.75, 77.70 |
| Разрешение () | 24.0-1.05 | 13.82-2.05 | 24.74-1.4 | 48.80–1.30 | 48.2-1.00 | 24.4-2.00 |
| Число измеренных рефлексов | 131992 | 25206 | 59439 | 75822 | 150732 | 20692 |
| Повторяемость | 4 | 4 | 4 | 6 | 4 | 4 |
| Полнота набора, (%) | 94.4 | 98.5 | 97.0 | 97.2 | 96.4 | 99.9 |
| Полнота набора в последн. слое, (%) | 94.0 | 98.5 | 97.4 | 86.8 | 93.2 | 98.7 |
| I/ в последн. слое | 3.0 | 3.6 | 6.7 | 2.75 | 4.0 | 7.7 |
| Rуср(I) (%) | 4.7 | 7.0 | 8.5 | 3.3 | 3.5 | 3.7 |
Определение и уточнение структур комплексов SAICAR-синтазы. Так как кристаллы комплексов (SS+ASP), (SS+ATP)-II, (SS+AIC+SUC) и (SS+SAICAR) оказались изоморфны кристаллам нативного фермента, в качестве стартовой модели для уточнения их пространственных структур были использованы координаты атомов нативной SAICAR-синтазы, определенные при разрешении 1.9 [4]. Кристаллы (SS+ATP)-I и (SS+ATP+AICAR+SUC) не изоморфны кристаллам нативного фермента, поэтому структуры этих комплексов были решены методом молекулярного замещения с использованием программ AMORE и MOLREP. Уточнение моделей проводилось программой REFMAC в сочетании с программой ARP/wARP, моделирующей структуру растворителя, после каждого цикла уточнения. Дополнительно, молекулы растворителя добавлялись и удалялись вручную при визуальном контроле модели на графической станции, особенно в случаях альтернативных положений молекул воды. Для комплексов (SS+ASP) и (SS+ATP+AICAR+SUC) на промежуточных этапах уточнения была использована программа SHELX97. Для расчета Rfree-фактора использовались 5% рефлексов. Уточнение сопровождалось корректировкой моделей на графической станции с помощью программы О в соответствии с разностными синтезами электронной плотности. Разностные синтезы были рассчитаны с коэффициентами (2Fo – Fc, c) и (Fo – Fc, c), где Fo, Fc – экспериментальные и рассчитанные модули структурных амплитуд, c – фазы структурных амплитуд, рассчитанные по атомной модели. Были смоделированы двойные положения для боковых цепей нескольких остатков и для субстрата аспарагиновой кислоты в комплексе (SS+ASP). Координаты атомов всех субстратов были определены по разностным синтезам электронной плотности, рассчитанным с коэффициентами (Fo – Fc, c) после первых циклов уточнения, а затем включены в последующее уточнение моделей, как и ацетилированный N-концевой остаток Ser2. Так как для комплексов (SS+ASP) и (SS+ATP+AICAR+SUC) дифракционные данные были собраны до разрешения 1, для них в последних циклах уточнения был учтен вклад водородных атомов, помещенных в позиции, соответствующие идеальной геометрии, и применено анизотропное уточнение индивидуальных температурных факторов. Результаты уточнения моделей комплексов SAICAR-синтазы приведены в табл. 2
Описание и анализ атомных моделей комплексов SAICAR-синтазы. Достоверность уточненных моделей комплексов фермента подтверждают их статистические характеристики, приведенные в табл. 2, а также тот факт, что всем атомам полипептидной цепи на картах электронной плотности (2Fo-Fc) соответствуют отчетливые пики с уровнем выше 1, за двумя исключениями. Первое исключение составляет N-концевой остаток Met1, что может быть результатом посттрансляционной модификации и последующего ацетилирования Ser2. Ацетилированный Ser2 хорошо определен в электронной плотности и был включен во все окончательные модели. Второе исключение составляют остатки из подвижной («невидимой») петли 164-170, выходящей во внешний раствор. В разных комплексах разное количество остатков из невидимой петли определено в электронной плотности. Вследствие использования избыточных концентраций лигандов при получении комплексов, помимо основных мест связывания в активном центре белковой молекулы были обнаружены дополнительные молекулы лигандов на периферии молекулы фермента, имеющие более низкий уровень разностной электронной плотности. Общие количества молекул лигандов, а также сульфат-ионов и молекул воды, найденных в структурах комплексов, даны в табл. 2. Геометрический анализ, проведенный с помощью программы PROCHECK [7] показал, что все геометрические параметры моделей находятся в пределах, ожидаемых для данного разрешения. Значения конформационных углов для всех остатков попадают в области разрешенных значений на карте Рамачандрана [8].
Структура комплекса (SS+ASP). Анализ разностных синтезов электронной плотности показал, что молекула субстрата аспарагиновой кислоты (аспартата) связана в междоменной полости с петлей 39-45, принадлежащей первому домену, и с остатками из первой спирали (остатки 260-270) третьего домена (рис. 3, место А). Субстрат связан с белком водородными связями, формируемыми его карбоксильными группами с кислородом OG Ser40, атомами азота основной цепи Ala41, Tyr42 и Asp43, а также гуанидином Arg264 (рис. 4). В исследуемом комплексе молекула субстрата имеет два альтернативных положения с половинной заселенностью. Как видно из рисунка 4, оба положения характеризуются одинаковыми водородными связями карбоксильных групп с белком и с этой точки зрения являются равнозначными. Разностный синтез электронной плотности выявил на периферии белковой молекулы два сгущения, которые мы также описали как молекулы аспарагиновой кислоты (рис.3, места A’, A”). Их связывание с белком не специфично, и являясь, вероятнее всего, следствием избыточной концентрации аспарагиновой кислоты при кристаллизации, не играет значительной роли в ферментативной реакции.
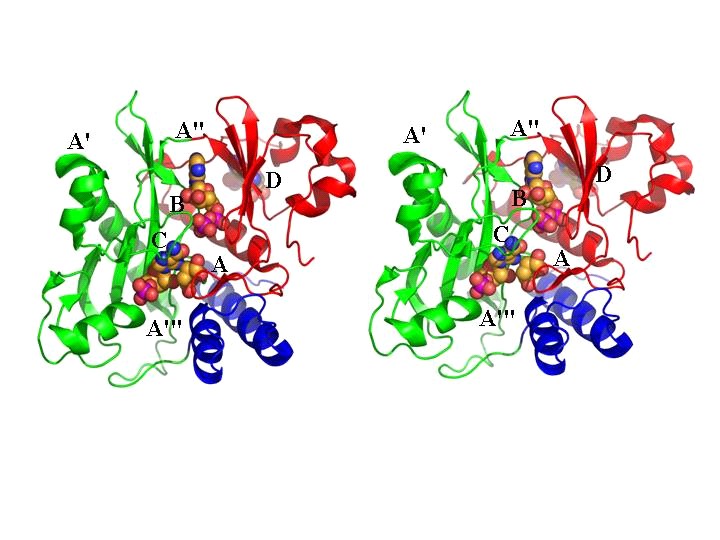
Рис. 3. Стерео изображение молекулы SAICAR-синтазы со схематичным обозначением мест связывания субстратов: A – ASP, B – ATP, C – CAIR, D – дополнительной молекулы ATP, A’, A’’, A’’’ – дополнительных молекул ASP/SUC
Структуры комплексов (SS+ATP)-I, (SS+ATP)-II.
В настоящей работе предствалены два комплекса SAICAR-синтазы с ATP, (SS+ATP)-I и (SS+ATP)-II, различные как способом получения, так и содержанием магния с целью изучения зависимости активности фермента от концентрации магния в растворе [2].
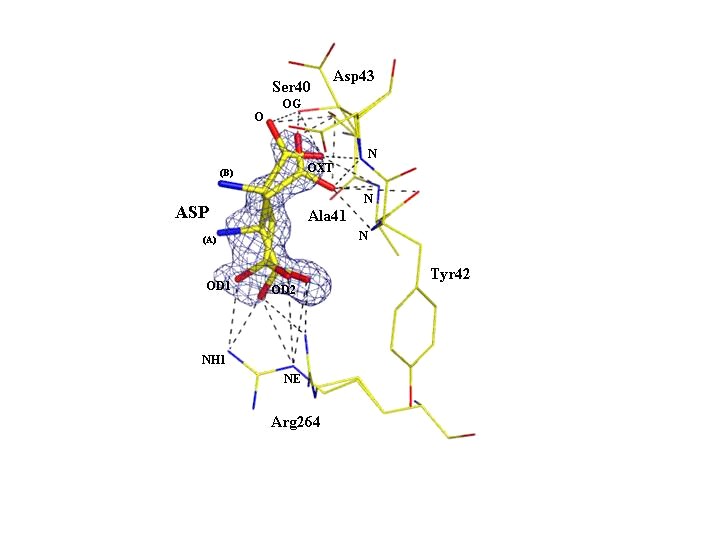
Рис. 4. Место связывания аспарагиновой кислоты в комплексе (SS+ASP). Уточненная модель наложена на разностную электронную плотность на уровне 3, вычисленную с коэффициентами (Fo-Fc) и фазами структурных амплитуд, рассчитанными по белковой модели без молекулы аспарагиновой кислоты (Омит-синтез). Водородные связи молекулы аспарагиновой кислоты с атомами соседних остатков показаны пунктирными линиями. Альтернативные положения ASP обозначены как (А) и (В).
Анализ карт разностной электронной плотности в исследованных комплексах показал, что в молекуле SAICAR-синтазы есть два места связывания молекулы ATP, на рис. 3 обозначенные как В и D. Молекула ATP в основном месте связывания (B) в исследуемых комплексах расположена в междоменной полости SAICAR-синтазы и вытянута вдоль центральной полости молекулы. При этом адениновое основание ATP и рибозное кольцо в двух комплексах расположены одинаково. Адениновое основание, находящееся в анти-конформации по отношению к рибозному кольцу, располагается в гидрофобном кармане, образованном Leu114 и Val232 с одной стороны междоменной полости и Leu31 и Phe33 с другой, а cпецифичность его связывания достигается за счет образования водородных связей N(1)... N (His112), N(6)... O (His110) и N(7)... N (Asp233) ( рис. 5а и б). Положение рибозного кольца ATP, находящегося в C3’-эндо-конформации, стабилизируется водородными связями О(2)... O(E2) (Glu219) в обоих комплексах, а также О(2)... N(Z) (Lys164) и О(3)... N(Z) (Lys164) в комплексе (SS+ATP)-I. В то же время расположение фосфатных групп молекулы ATP в двух комплексах существенно отличается. В комплексе (SS+ATP)-I положение -фосфата ATP соответствует положению иона сульфата SA1 в нативной структуре SAICAR-синтазы [4], (рис. 2, SA). Конформация аминокислотных остатков Lys19, Val20 и Arg21, образующих поворот полипептидной цепи в фосфат связывающей петле, такова, что аминогруппы этих остатков направлены в одну сторону, и между атомом О1В -фосфата и атомами азота основной цепи этих остатков образуются три водородные связи (рис. 5а). Относительно высокие температурные факторы атомов фосфатных групп и соответствующая им бедная разностная электронная плотность свидетельствуют об их подвижности в этом комплексе, которая может быть существенна при взаимодействии с другими субстратами фермента.
| Таблица 2.Статистические характеристики уточненных структур комплексов SAICAR-синтазы. | ||||||
| Комплексы | (SS+ASP) | (SS+ATP)-I | (SS+ATP)-II | (SS+AIC+SUC) | (SS+ADP+AIC+SUC) | (SS+SAICAR) |
| Rcryst, % / число рефлексов | 13.7/ 125306 | 16.6/ 23868 | 15.1/ 53449 | 18.1/ 69138 | 11.6 / 146103 | 14.8 / 19632 |
| Rfree %/ число рефлексов | 16.2 / 6644 | 20.6/ 1025 | 19.4/ 5989 | 21.3/ 3693 | 13.1 / 4546 | 22.2 / 1060 |
| Число атомов белка | 3596 | 2978 | 2776 | 2616 | 3600 | 2895 |
| Число молекул растворителя | 727 | 273 | 526 | 465 | 684 | 446 |
| Число сульфат-ионов | 7 | 2 | 2 | 3 | 2 | 2 |
| Число молекул ATP | - | 1 | - | - | - | |
| Число молекул ADP | - | - | - | - | 2 | - |
| Число молекул AMP | - | 2 | 1 | - | 1 | - |
| Число молекул AICAR | - | - | - | 2 | 2 | - |
| Число молекул SAICAR | - | - | - | - | - | 1 |
| Число молекул ASP | 3 | - | - | - | - | 2 |
| Число молекул SUC | - | - | - | 2 | 2 | - |
| Среднеквадратичные отклонения от идеальных значений: межатомных длин связей, межатомных углов связей, межатомных планарных углов, | 0.021 2.0 6.6 | 0.012 1.48 5.96 | 0.017 1.86 2.25 | 0.015 2.16 2.55 | 0.025 2.0 6.6 | 0.022 1.9 6.4 |
| DPI – показатель точности, () | 0.03 | 0.16 | 0.07 | 0.06 | 0.02 | 0.18 |
| <B> -фактор для основной цепи, 2 | 13.6 | 21.7 | 17.3 | 18.1 | 8.3 | 16.3 |
| <B> -фактор для боковой цепи, 2 | 16.1 | 30.5 | 22.0 | 24.5 | 10.2 | 19.6 |
| <B> -фактор для молекул воды, 2 | 30.6 | 46.2 | 36.7 | 31.8 | 21.8 | 31.6 |
В то же время электронную плотность более высокого уровня на -фосфате по сравнению с остальными фосфатами можно объяснить возможной примесью к
Рис. 5. Разностная электронная плотность (омит-синтез) в основном месте связывания ATP: а) в комплексе (SS+ATP)-I; б) в комплексе (SS+ATP)-II. Изолинии соответствуют уровню 3. Водородные связи молекулы ATP с атомами соседних остатков молекулы белка показаны пунктирными линиями. (Упомянутый в тексте Val232 не показан, так как находится над плоскостью рисунка.)
ATP молекул AMP и ионов сульфата на месте -фосфата ATP. В (SS+ATP)-II фосфатные группы расположены иначе, и им соответствует более высокий уровень электронной плотности на разностных синтезах. При этом два атома азота гуанидина Arg21 образуют водородные связи с двумя атомами кислорода, -фосфат не образует водородных связей с атомами белка, а -фосфат образует одну водородную связь O(3G)... N (Lys19) (рис. 5б). Эти отличия вызваны присоединением к фосфатным группам ATP в комплексе (SS+ATP)-II иона магния, образующего координационные связи с атомами кислорода всех трех фосфатных групп. Наличие ионов магния в комплексе (SS+ATP)-II вызвано тем, что при получении этого комплекса содержание магния в растворе было в 4 раза выше, чем при получении (SS+ATP)-I. Можно предположить, что присоединение ионов магния к фосфатным группам ATP понижает их подвижность и затрудняет реакцию. Такое предположение согласуется с результатами биохимических исследований SAICAR-синтазы, показавшими, что концентрация ионов Mg2+ более 30 мМ приводит к понижению ферментативной активности [2]. Как уже отмечалось, кроме основного места связывания, было выявлено дополнительное место связывания молекулы ATP, расположенное в небольшой полости аминоконцевого домена SAICAR-синтазы (место D на рис.3). При этом с ферментом контактируют атомы аденинового основания ATP, а фосфатные группы направлены в сторону окружающего молекулу фермента раствора. Пуриновое основание в этом месте фиксируется водородными связями с атомами основной цепи аминокислотных остатков Val77 и Leu108. Атомные температурные факторы и разностные синтезы электронной плотности свидетельствуют об увеличивающейся подвижности атомов ATP по мере приближения к фосфатным группам, причем наибольшей подвижностью отличаются выступающие в раствор и -фосфатные группы ATP, которые по этой причине в уточнении не участвовали. Функциональная роль второго места связывания ATP в молекуле SAICAR-синтазы пока остается неясной, однако не исключено, что это место может играть регуляторную роль при работе фермента.
Структура комплекса (SS+AICAR+SUC). Целью исследования данного комплекса было определение места присоединения к ферменту субстратов CAIR и аспарагиновой кислоты. Однако вместо природных субстратов для приготовления фермент-субстратного комплекса были использованы 5’-фосфорибозил-5-амино-4-имидазолкарбоксамид (AICAR), более устойчивый аналог CAIR, и аналог аспарагиновой кислоты, янтарная кислота (рис.1б). Единственное различие AICAR и CAIR, нуклеотидов с недостроенным адениновым основанием, состоит в замене OH-группы карбоксилата в CAIR на NH2-группу в AICAR. Чтобы предотвратить взаимное отталкивание аминогрупп AICAR и аспарагиновой кислоты, мы заменили ее на янтарную кислоту, отличающуюся от аспарагиновой кислоты отсутствием аминогруппы.
Было установлено, что в молекуле SAICAR-синтазы есть два места связывания AICAR. Одно из них расположено в активном центре фермента, при этом положение фосфатной группы AICAR совпадает с местом связывания второго из сульфат-ионов в структуре нативного фермента [4] (рис. 2, SB), другое находится на периферии белковой молекулы и совпадает с дополнительным местом связывания ATP в комплексах с ATP (рис. 3, места С и D). Разностная электронная плотность, соответствующая молекуле AICAR в активном центре фермента, достаточно полно представлена только для фосфатной группы и рибозного кольца (Рис. 6). Группе атомов недостроенного аденинового основания соответствуют бедная электронная плотность и относительно высокие значения температурного фактора, что говорит о ее возможной подвижности. Поэтому координаты атомов аденинового основания не использовались при уточнении модели, тогда как атомы фосфатной группы и рибозного кольца в последних циклах уточнения были включены в модель вместе с атомами белка.
Рис.6. Разностная электронная плотность и модель молекул AICAR и SUC в активном центре фермента. Изолинии соответствуют омит-синтезу на уровне 3. Положение недостроенного аденинового основания, не обеспеченного полной электронной плотностью, предположительно определено по расположению рибозного кольца. Пунктирными линиями показаны водородные связи с аминокислотными остатками SAICAR-синтазы (Arg242 не изображен, чтобы не загромождать рисунок).
В уточненной модели атомы кислорода фосфатной группы AICAR фиксированы водородными связями с аминокислотными остатками фермента Arg122, Ser128 и Arg242, а рибозное кольцо образует водородную связь O(2’)…O(D2)Asp215 (Рис.6). Анализ разностной электронной плотности позволил определить, что молекула янтарной кислоты в (SS+AICAR+SUC) располагается напротив молекулы AICAR, в месте связывания аспарагиновой кислоты в комплексе (SS+ASP) (Рис.3, место А). Положение молекулы янтарной кислоты фиксируется водородными связями с аминокислотными остатками Ser40 и Arg264 (Рис.6). «Побочная» молекула янтарной кислоты была обнаружена в месте A’’’ на рис. 3.
Структура комплекса (SS+ADP+AICAR+SUC) Анализ карт электронной плотности выявил, что место связывания ATP в активном центре молекулы белка в комплексе (SS+ADP+AICAR+SUC) то же, что и в комплексах с ATP. Однако вместо молекулы ATP мы обнаружили в этом месте молекулу ADP, связанную с белком тем же способом. Ион Mg координирован атомами кислорода фосфатов ADP и 4-мя молекулами воды (рис. 7). Фосфатная группа AICAR занимает то же положение, что и у AICAR в комплексе (SS+AICAR+SUC), но, в отличие от последнего, все атомы сахарного кольца и пуриновой группы прекрасно определены на карте электронной плотности, и видно, что пуриновая группа направлена на ATP. Атомы кислорода фосфатной группы AICAR формируют водородные связи с Arg122, Ser128 и Arg242,
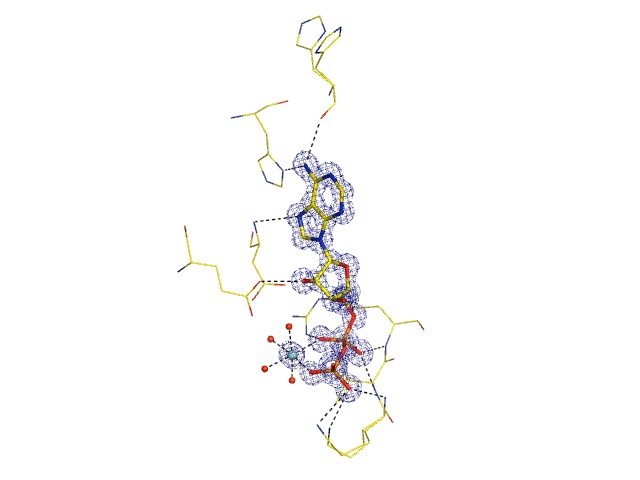
Рис. 7. Место связывания ADP в активном центре SAICAR-синтазы в комплексе (SS+ADP+AICAR+SUC). Уточненная модель наложена на разностную электронную плотность, соответствующую омит-синтезу на уровне 3. Водородные связи молекулы ADP с атомами соседних остатков показаны пунктирными линиями.
рибозное кольцо – с остатками Asp215 и Arg264, и незавершенное пуриновое основание AICAR - Asp171 и Asp239 (рис. 8). В этом комплексе в месте связывания дополнительной молекулы ATP была обнаружена электронная плотность, которую мы интерпретировали как смесь молекул AMP и AICAR с неполными заселенностями.
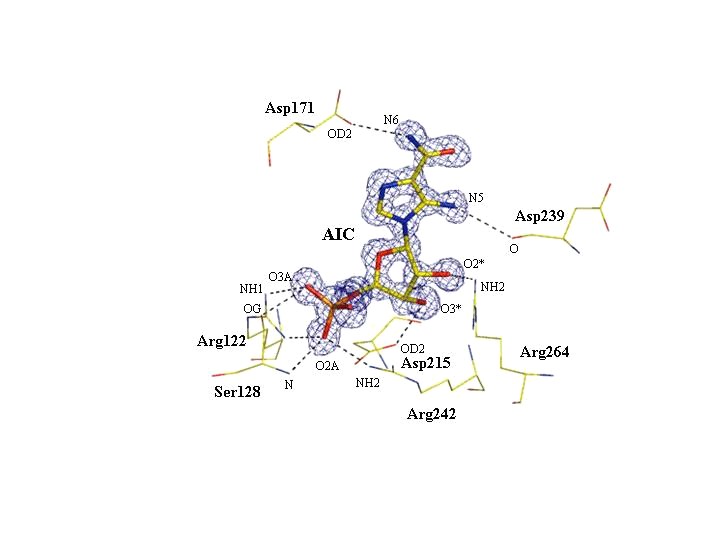
Рис. 8. Место связывания AICAR в молекуле SAICAR-синтазы в комплексе (SS+ADP+AICAR+SUC). Уточненная модель наложена на разностную электронную плотность, соответствующую омит-синтезу на уровне 3. Водородные связи молекулы AICAR с атомами соседних остатков показаны пунктирными линиями.
В месте связывания аспартата, где мы ожидали увидеть янтарную кислоту, мы обнаружили разностную электронную плотность в четыре раза более низкого уровня, чем в основном месте связывания ADP и AICAR, которую мы описали молекулой ADP с низкой заселенностью. Связывание ADP в этом месте явилось следствием чрезмерной концентрации ATP при кристаллизации. Не увидев молекулы янтарной кислоты в активном центре, мы обнаружили две побочные молекулы SUC в местах A’ и A’’’ (рис. 3).
Конформационные изменения в молекуле SAICAR-синтазы. Сравнение структур различных комплексов выявило, что (SS+ASP), (SS+ATP)-I, (SS+ATP)-
II, (SS+AIC+SUC) и (SS+SAICAR) имеют структуру нативного белка, в то время как структура комплекса (SS+ADP+AIC+SUC) отличается более близким распо-
ложением третьего домена к первому и второму доменам. Структура комплекса (SS+ADP+AIC+SUC) была названа «закрытой» структурой в отличие от «открытой» структуры нативного фермента. Наложение «открытой» и «закрытой» структур показано на рис.9.
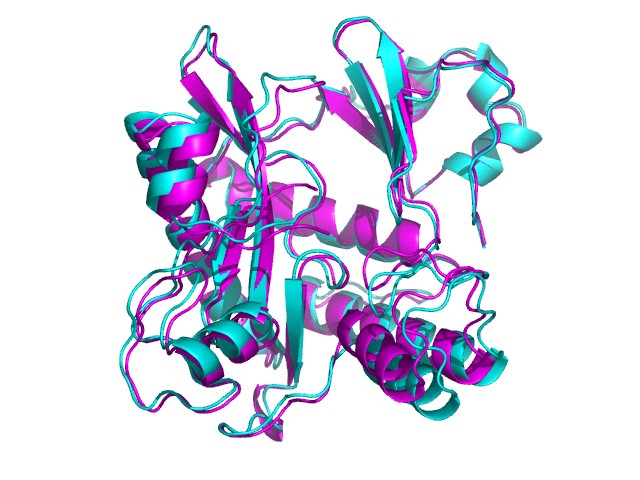
Рис. 9. Сравнение «открытой» и «закрытой» конформаций молекулы SAICAR-синтазы. Комплекс (SS+ASP) показан голубым цветом, комплекс (SS+ADP+AIC+SUC) – фиолетовым. Сравнить с рис. 2.
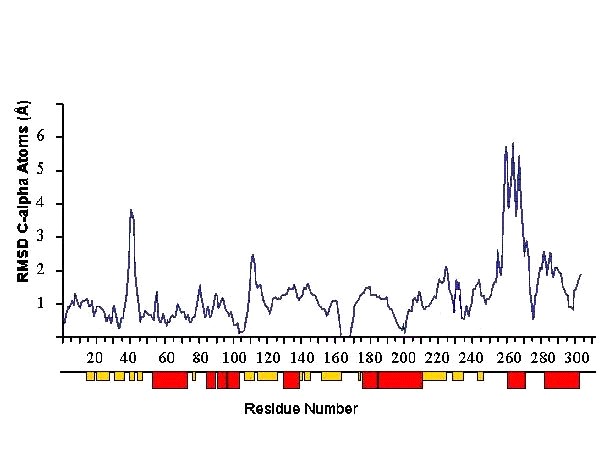
Анализ выявил, что наиболее значительные подвижки (на 4-6 ) испытывают С-атомы спирали С1 (остатки 260-270) и аспартат связывающей петли между А4 и А5 (остатки 39-45) (на 2-4 ). Обозначения элементов вторичной структуры приведены на рис. 2. Отклонение положений С-атомов показано на рис. 10. Примечательно, что на участках, испытывающих наибольший сдвиг, расположены остатки 40-42 и 264, участвующие в связывании ASP и AICAR.
Рис. 10. Отклонение положений C атомов (SS+ADP+AIC+SUC) от (SS+ASP).-Спирали и -слои изображены как красные и желтые прямоугольники в соответствии с [4].
Структура комплекса (SS+ SAICAR) Место присоединения продукта SAICAR в полости активного центра молекулы белка занимает, или точнее, объединяет, места связывания аналогов субстратов AICAR и янтарной кислоты в активном центре (рис. 3, места A и C).Фосфатная группа и рибозное кольцо молекулы SAICAR находятся примерно в том же положении, что и у молекулы AICAR, а сукцинат-подобная часть молекулы SAICAR располагается в месте связывания янтарной кислоты в комплексе (SS+AIC+SUC) и образуют аналогичные связи с белком. Большинство атомов молекулы SAICAR, за исклю-чением атома азота N6, хорошо определены в электронной плотности (Рис. 11). Связи, образованные остатками белка с фосфатной группой молекулы SAICAR, соответствуют также связям с фосфатной группой AICAR в комплексе (SS+ADP+AIC+SUC). Атомы кислорода фосфатной группы SAICAR формируют
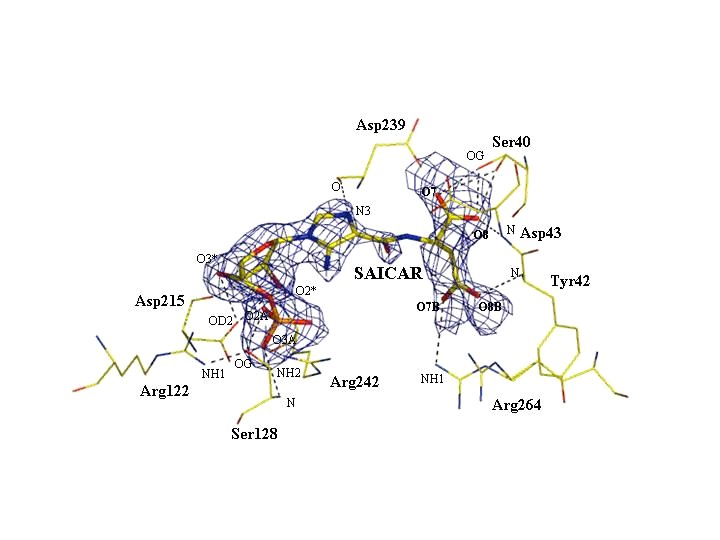
Рис. 11. Место связывания SAICAR в молекуле SAICAR-синтазы в комплексе (SS+SAICAR). Уточненная модель наложена на разностную электронную плотность, соответствующую омит-синтезу на уровне 2.5. Водородные связи молекулы SAICAR с атомами соседних остатков показаны пунктирными линиями.
водородные связи с Arg122, Ser128 и Arg242, рибозное кольцо связано с Asp215, а карбоксильные группы SAICAR – с Ser40, Tyr42, Asp43 и Arg264. Недостроенное пуриновое основание образует контакт с Asp239 (Рис. 11). Очевидно, что аминокислотные остатки, обеспечивающие связывание субстратов в белковой молекуле, их правильную ориентацию и распределение зарядов, отвечают и за связывание продукта реакции. Большинство этих остатков строго консервативно среди известных SAICAR-синтаз. Две дополнительные молекулы аспарагиновой кислоты были обнаружены в местах A’ и A’’ (рис. 3), как в комплексе (SS+ASP), что естественно, учитывая условия получения комплекса (SS+SAICAR).
Глава 3. Сравнение пространственной структуры SAICAR-синтазы Saccharomyces cerevisiae с пространственными структурами SAICAR-синтаз Thermatoga maritima и E.coli
Во время подготовки к печати данной диссертации были опубликованы статьи о структурных исследованиях SAICAR-синтаз Thermatoga maritima (tSS) [9] и E.coli (eSS) [10], для которой были исследованы структуры двух комплексов с ADP и ADP+CAIR. В этих работах авторы провели подробные сравнения определенных ими структур со структурой SAICAR-синтазы Saccharomyces cerevisiae (ySS). Оказалось, что оба фермента, tSS и eSS, являются димерами, состоящими из двух идентичных мономеров, структуры мономеров которых схожи со структурой ySS. Основные структурные различия - это дополнительные участки полипептидной цепи в ySS, которые можно рассматривать как вставки в структуру tSS и eSS, а также ход полипептидной цепи в третьем домене tSS [9], [10]. В диссертации приведено сравнение мест связывания субстратов, обнаруженных в ySS, с потенциальными местами связывания субстратов в tSS и L-аспартата в eSS, и на основании сравнения со структурами исследованных комплексов ySS высказано предположение о необходимости конформационных изменений в структурах tSS и eSS для осуществления ферментативной реакции.
Сравнение с SAICAR-синтазой Thermatoga maritima
Места связывания ATP. Совмещение структур комплекса (SS+ADP+AIC+SUC) и мономера tSS подтверждает аналогию ATP-связывающих остатков в обоих белках. В tSS также присутствует фосфат-связывающая петля и, как отмечено в [9], строго консервативный Glu172, аналогичный Glu 219 в ySS, образующий связь с ATP.
Места связывания AICAR/CAIR. Все остатки, связывающие AICAR в комплексе (SS+ADP+AIC+SUC), присутствуют в аминокислотной последовательности tSS и являются консервативными. Они занимают эквивалентные положения после пространственного совмещения структур, за исключением остатков Arg193, Lys203 и Arg207, соответствующих остаткам Arg242, Lys260 и Arg264 в ySS. Эти остатки оказываются удаленными от активного центра (на 20 для Arg207) благодаря отличию в ходе полипептидной цепи в третьем домене от ySS. Объяснением такой необычной укладки цепи, как предполагается в работе [10], может служить термофильность SAICAR-синтазы Thermatoga maritima, которая при высоких температурах, усиливающих гидрофобные и слабые электростатические взаимодействия, приобретает укладку цепи, близкую к ySS и eSS, но утрачивает ее при низких температурах. Возможно, однако, что упомянутые остатки занимают соответствующие позиции после конформационных изменений, претерпеваемых ферментом при связывании субстратов. Однако на данный момент нет никакой информации о фермент-субстратных комплексах SAICAR-синтазы Thermatoga maritima.
Места связывания ASP. Остатки, обеспечивающие связывание ASP в комплексе ySS (SS+ASP), - петля Ser40-Asp43 и Arg 264. К сожалению, в структурной модели tSS утрачены остатки, соответствующие остаткам 41-43 в ySS. После совмещения структур обеих моделей только Thr26 в tSS присутствует в позиции, эквивалентной Ser40 в ySS. Как было отмечено выше, Arg207 в tSS, находящийся по аминокислотной последовательности в соответствии с Arg264 in ySS, расположен далеко от него в пространстве.
Сравнение с SAICAR-синтазой E.coli
Места связывания ATP. В комплексе (SS+ADP+AICAR+SUC) ADP связан в той же манере, что и в комплексах eSS с небольшой разницей в числе водородных связей с молекулой белка [10].
Места связывания AICAR/CAIR. Несмотря на структурные различия между молекулами AICAR и CAIR, остатки, обеспечивающие их связывание в обоих белках, строго консервативны. Все они расположены в эквивалентных положениях. Однако имеется несколько отличий между (SS+ADP+ AICAR+ SUC) и комплексом eSS с ADP+CAIR. Атомы CAIR O8 и N3 входят в координационные сферы двух ионов магния, тогда как возле AICAR не найдено ионов магния. Взаимодействие с ионами магния может быть причиной наблюдаемого небольшого сдвига атомов карбоксильной группы CAIR при C6 по отношению к эквивалентным атомам AICAR и вследствие этого, разрыва водородной связи атома N5 CAIR с атомом кислорода карбонильной группы Asp196, тогда как атом N5 AICAR связан с карбонильным кислородом Asp239 в ySS.
Места связывания ASP. Несмотря на то, что место связывания L-аспартата в комплексах eSS не было обнаружено [10], наложение аспартат-связывающей петли в ySS на соответствующие остатки eSS позволяет предполагать, что связывание этого субстрата аналогично в обоих ферментах. Остаткам, образующим водородные связи в ySS с одной из карбоксильных групп аспартата, Ser40 (боковая цепь), Ala41и Asp43 (азот основной цепи), в eSS соответствуют Ser33 (боковая цепь), Ala34 и Asp36 (азот основной цепи). Остаткам, взаимодействующим с другой карбоксильной группой в ySS, Tyr42 (азот основной цепи) и Arg264 (боковая цепь), соответствуют в eSS Gly35 (азот основной цепи) и Agr215 (боковая цепь).
Конформационные изменения. В [10] авторами не было замечено конформационных изменений в активном центре фермента при сравнении комплексов eSS с ADP и с ADP + CAIR. Однако при наложении структур комплексов наблюдается сдвиг участка цепи 32-39, соответствующего аспартат-связывающей петле в ySS, аналогичный сдвигу, отличающему «открытую» и «закрытую» конформации ySS. В отличие от SAICAR-синтазы S.cerevisiae здесь конформационные подвижки не затрагивают спирали третьего домена 5 и 6. Тем не менее, правомерно говорить о возникновении конформационных изменений в молекуле SAICAR-синтазы E.coli при связывании субстратов ADP и CAIR, вызывающих движение аспартат-связывающего участка, которое приводит к сужению активного центра и взаимному сближению трех субстратов. Сравнение наблюдаемых конформационных изменений в молекулах обеих SAICAR-синтаз подтверждает наши выводы об их важности как обеспечивающих конформацию активного центра фермента, необходимую для осуществления каталитической реакции.
Глава 4. Механизм каталитической реакции SAICAR-синтазы Saccharomyces cerevisiae
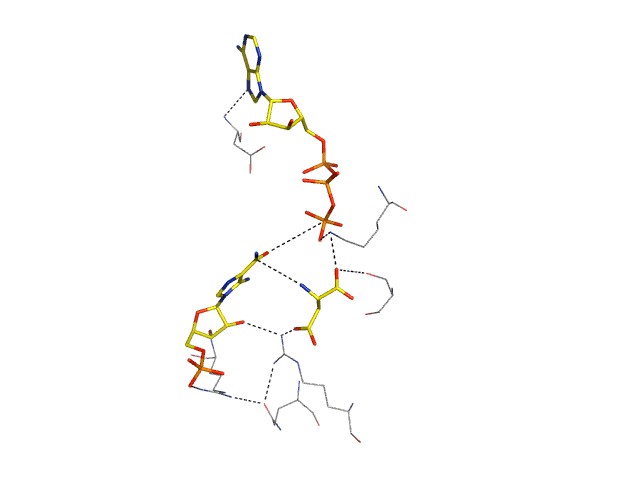
На основании полученных данных о местах присоединения и характере связывания субстратов в молекуле SAICAR-синтазы Saccharomyces cerevisiae и конформационных изменениях в активном центре фермента, сопровождающих связывание субстратов, а также простейшего моделирования (рис. 12), нами предложена модель каталитического действия фермента SAICAR-синтазы. Две модели механизма реакции, предлагаемые для SAICAR-синтазы E.coli [10], включают образование промежуточного, которым в одном случае является фосфорилированный CAIR, а в другом случае диоксианион как
Рис. 12. Модель взаимного расположения субстратов в активном центре SAICAR-синтазы. Молекула AICAR и окружающие остатки активного центра взяты из комплекса (SS+ADP+AICAR+SUC). Положение аспарагиновой кислоты смоделировано после специального наложения структур (SS+ASP) и (SS+ADP+AICAR+SUC) по остаткам 39-45 и 260-270, испытывающим наибольшее смещение при изменении конформации белковой молекулы. - фосфат ADP смоделирован после наложения структур комплексов (SS+ADP+AICAR+SUC) и (SS+ATP)-II по окружению молекулы ADP и ATP соответственно.
результат реакции между CAIR и L-аспартатом с последующим фосфорилированием ATP. Однако нет никакой фактической информации об образовании промежуточных продуктов в ходе реакции SAICAR-синтазы, как отмечено в [10]. Проведенные кинетические исследования также не дали доказательств существования связанного фосфорилированного промежуточного продукта в активном центре SAICAR-синтазы [11].
Более вероятным представляется механизм реакции, схожий с механизмом Бьюкенена, предложенным им для фосфорибозилглицинамид-синтетазы [12], при котором электрофильное действие -фосфата ATP на карбоксильную группу CAIR достигается не за счет образования ковалентной ангидридной связи, но вследствие взаимодействия парциальных зарядов, возникающих при сближении реагирующих групп. Этот электрофильный эффект делает карбоксильную группу CAIR более восприимчивой к нуклеофильной атаке со стороны аминогруппы ASP. Таким образом, амидная связь может образоваться без ангидридного промежуточного продукта при вовлечении всех трех субстратов в образование переходного комплекса.
Присоединение субстратов начинается в «открытой» конформации белковой молекулы, как в комплексе (SS+ASP), где ASP связан с остатками 40-43 из аспартат-связывающей петли и Arg264. Связывание ATP и CAIR приводит молекулу белка в «закрытую» форму, как в комплексе (SS+ADP+AICAR+SUC), где Arg264 сдвигается на 5.8, чтобы образовать водородную связь с атомом O2* гидроксильной группы рибозного кольца AICAR, в то же время сохраняя связи с карбоксильной группой аспарагиновой кислоты. Новое положение Arg264 фиксировано образующейся системой водородных связей, включающей Arg264, Gln261 и Arg242. Lys19 NZ, сохраняя контакт с ATP, одновременно может формировать водородную связь с карбоксильной группой аспарагиновой кислоты. Чтобы обеспечить эти новые взаимодействия, домен С (две С-концевые -спирали) и аспартат-связывающая петля из домена А (остатки 39-45) испытывают сдвиг как жесткое тело по отношению к домену B и остальной части домена A. Водороднавя связь Ser40 O - Lys260 NZ способствует этому движению. В результате активный центр, находящийся между доменами, становится значительно уже. Более того, в «закрытой» конформации водородная связь His170 ND1 - Asp43 OD1 может фиксировать «невидимую» петлю, которая защищает активный центр во время реакции. После каталитической реакции молекула фермента снова возвращается к «открытой» форме со связанным продуктом, как было обнаружено в комплексе (SS+SAICAR).
ОСНОВНЫЕ РЕЗУЛЬТАТЫ И ВЫВОДЫ
1. Определена и уточнена пространственная структура комплекса фермента SAICAR-синтазы с субстратом аспарагиновой кислотой с разрешением 1.0. Определены место и характер связывания молекулы аспарагиновой кислоты в активном центре фермента.
2. Определены и уточнены пространственные структуры двух комплексов фермента SAICAR-синтазы с аденозинтрифосфатом с разрешением 1.4 и 2.05. На основании сравнения связывания молекулы ATP в активном центре фермента получено рентгеноструктурное подтверждение установленной биохимическими исследованиями зависимости конформации фосфатных групп ATP от концентрации ионов магния.
3. Определена и уточнена пространственная структура комплекса фермента SAICAR-синтазы с аналогами субстратов AICAR и янтарной кислотой с разрешением 1.3. Определены место и характер связывания молекулы янтарной кислоты и частично молекулы AICAR в активном центре фермента.
4. Определена и уточнена пространственная структура комплекса фермента SAICAR-синтазы с аденозинтрифосфатом и аналогами субстратов AICAR и янтарной кислотой с разрешением 1.0. Определены место и характер связывания молекул ATP и AICAR в активном центре фермента. Молекулы янтарной кислоты обнаружены в побочных местах связывания.
5. Определена и уточнена пространственная структура комплекса фермента SAICAR-синтазы с продуктом ферментативной реакции SAICAR с разрешением 2.0. Определено место и характер связывания молекулы SAICAR в активном центре фермента.
6. В результате сравнения структур полученных комплексов выявлены конформационные изменения белковой молекулы, сопровождающие реакцию.
7. На основании анализа пространственной структуры активного центра полученных комплексов, а также выявленных конформационных изменений предложен возможный механизм каталитической реакции SAICAR-синтазы.
8. Координаты и соответствующие структурные факторы исследованных комплексов размещены в банке данных белковых структур Protein Data Bank с идентификационным номерами 1OBD, 1OBG, 2CNQ, 2CNU и 2CNV.
СПИСОК ПУБЛИКАЦИЙ ПО ТЕМЕ ДИССЕРТАЦИИ
- Antonyuk S.V., Levdikov V.M., Barynin V.V., Grebenko A.I., Urusova D.V., Popov A.N., Melik-Adamyan W.R. and Lamzin V.S. The structure of SAICAR synthase-substrate complexes at 1A resolution. (2000). ECM-19 posters abstracts, special issue, p. 243.
- Антонюк С.В., Гребенко А.И., Левдиков В.М., Урусова Д.В., Мелик-Адамян В.Р., Ламзин В.С., Вильсон К.С. Рентгеноструктурное исследование комплексов SAICAR-синтазы с аденозинтрифосфатом. Кристаллография, 2001, т.46, № 4, сс.687-691.
- Антонюк С.В., Гребенко А.И., Левдиков В.М., Урусова Д.В., Мелик-Адамян В.Р., Ламзин В.С., Вильсон К.С. Рентгеноструктурное исследование комплексов фермента SAICAR-синтазы дрожжей Saccharomyces cerevisiae с аденозинтрифосфатом. Тезисы докладов РСНЭ-2001, с.27.
- Урусова Д.В., Антонюк С.В., Гребенко А.И., Ламзин В.С., Мелик-Адамян В.Р. Рентгеноструктурное исследование комплекса фермента SAICAR-синтазы с аналогами субстратов. Кристаллография, 2003, т.48, № 5, сс. 821-825.
- Урусова Д.В., Антонюк С.В., Гребенко А.И., Ламзин В.С., Мелик-Адамян В.Р. Рентгеноструктурное исследование комплекса фермента SAICAR-синтазы дрожжей Saccharomyces cerevisiae с аналогами субстратов. Тезисы докладов РСНЭ-2003, с.65.
- Урусова Д.В., Антонюк С.В., Гребенко А.И., Мелик-Адамян В.Р., Ламзин В.С. Рентгеноструктурное исследование комплексов фермента SAICAR-синтазы дрожжей Saccharomyces cerevisiae с аденозинтрифосфатом и аналогами субстратов. Тезисы докладов III-го Съезда биофизиков России, 2004, т.1, с.115.
- Урусова Д.В., Антонюк С.В., Гребенко А.И., Мелик-Адамян В.Р., Ламзин В.С. Пространственная структура комплексов и механизм каталитической активности фермента SAICAR-синтазы Saccharomyces serevisiae. Тезисы докладов РСНЭ-2005, с.70.
- Урусова Д.В., Левдиков В.М., Антонюк С.В., Гребенко А.И., Ламзин В.С., Мелик-Адамян В.Р. Рентгеноструктурное исследование комплекса фермента SAICAR-синтазы с продуктом реакции. Кристаллография, 2006, т.51, № 5, сс. 878-881.
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ
1. Мясников, А.Н., Плавник, Ю.А., Саснаускас, К.В., Гедминене, Г.К., Янулайтис, А.А., Смирнов, М.Н., Нуклеотидная последовательность гена ADE1 дрожжей Saccharomyces cerevisiae. Биоорганическая химия, 1986. 12(4): p. 555-558.
2. Ostanin, K.V., et al., Isolation and properties of phosphoribosyl-aminoimidazole-succinocarboxyamide-synthestase from Saccharomyces cerevisiae yeasts. Biokhimiia, 1989. 54(8): p. 1265-73.
3. Alenin, V.V., et al., Substrate specificity of Phosphoribosyl-aminoimidazole-succinocarboxamide-synthetase (SAICAR-synthetase) of the yeast Saccharomyces cerevisiae. Biokhimiya (USSR), 1992. 57(6): p. 845-855.
4. Levdikov, V.M., et al., The structure of SAICAR synthase: an enzyme in the de novo pathway of purine nucleotide biosynthesis. Structure, 1998. 6(3): p. 363-76.
5. Yamaguchi, H., at al., & Katsube, Y., Three-dimentional structure of the glutathione synthetase from Escherichia coli B at 2.0 A resolution. J. Mol. Biol., 1993. 229: p. 1083-1100.
6. Fan, C., Moews, P.C., Walsh, C.T. & Knox, J.R., Vancomycin resistance: structure of D-alanine: D-alanine ligase at 2.5 a resolution. Science, 1994. 266: p. 439-443.
and the location of errors in these models. Acta Cryst., 1991. A47: p. 110-119.
7. Laskowski, R.A., et al., PROCHECK: a program to check the stereochemical quality of protein structures. J. Appl. Cryst.,. 1993. 26: p. 283-291.
8. Ramachandran, G.N., C. Ramakrishnan, and V. Sasisekharan, Stereochemistry of polypeptide chain conformations. J. Mol. Biol., 1963. 7: p. 95-99.
9. Zhang, R., et al., Structure of SAICAR synthase from Thermotoga maritima at 2.2 angstroms reveals an unusual covalent dimer. Acta Crystallograph Sect F Struct Biol Cryst Commun, 2006. 62(Pt 4): p. 335-9.
10. Ginder, N.D., et al., Nucleotide Complexes of Escherichia coli Phosphoribosylaminoimidazole Succinocarboxamide Synthetase. J Biol Chem, 2006. 281(30): p. 20680-8.
11. Nelson, S.W., et al., Mechanism of action of Escherichia coli phosphoribosylaminoimidazolesuccinocarboxamide synthetase. Biochemistry, 2005. 44(2): p. 766-74.
12. Hartman, S.C. and J.M. Buchanan, Biosynthesis of the purines. XXII. 2-Amino-N-ribosylacetamide-5'-phosphate kinosynthase. J Biol Chem, 1958. 233(2): p. 456-61.

