Оценка эффектов октреотида на функциональную активность нейтрофильных лейкоцитов
КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
На правах рукописи
Породенко Игорь Валериевич
ОЦЕНКА ЭФФЕКТОВ ОКТРЕОТИДА
НА ФУНКЦИОНАЛЬНУЮ АКТИВНОСТЬ
НЕЙТРОФИЛЬНЫХ ЛЕЙКОЦИТОВ
03.00.13 – физиология,
14.00.15 – патологическая анатомия
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Краснодар – 2009
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Кубанский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» (КГМУ).
Научные руководители: доктор медицинских наук
Курзанов Анатолий Николаевич,
доктор биологических наук профессор
Славинский Александр Александрович.
Официальные оппоненты:
доктор медицинских наук профессор Сторожук Пётр Григорьевич
доктор медицинских наук профессор Ермилов Виктор Владимирович
Ведущая организация: Ставропольская государственная медицинская академия.
Защита состоится «____» декабря 2009 г. в 10:00 часов на заседании диссертационного совета Д208.038.01 при КГМУ по адресу: 350063, Краснодар, ул. Седина, 4, КГМУ, тел. (861) 262-73-75.
С диссертацией можно ознакомиться в библиотеке КГМУ.
Автореферат разослан «____» ноября 2009 года.
Ученый секретарь
диссертационного совета
доктор медицинских наук
профессор ![]() Ю.Р. Шейх-Заде
Ю.Р. Шейх-Заде
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. Соматостатин нейропептид, вырабатываемый гипоталамусом, поджелудочной железой, а также слизистой оболочкой желудка и кишечника (Chen D. et al., 2006; Raufman J.P. et al., 2009). Этот пептид ингибирует секрецию соматотропного гормона передней доли гипофиза, угнетает желудочную секрецию и секрецию поджелудочной железы, тормозит выделение гастрина и мотилина, уменьшает висцеральный кровоток. В экспериментах на крысах показано, что соматостатин стимулирует активность ретикуло-эндотелиальной и лимфопоэтической систем. Изменение под его влиянием активности клеток-киллеров отмечено у человека (Case C.C., Wirfel K., Vassilopoulou – Sellin R., 2002).
Синтетический аналог соматостатина октреотид угнетает экзокринную функцию поджелудочной железы, снижает объем панкреатического секрета, содержание в нем ферментов и концентрацию бикарбонатов. Октреотид оказывает прямое угнетающее действие на экзокринную секрецию поджелудочной железы через специфические мембранные рецепторы. Препарат также обладает противовоспалительным действием, которое связано со стабилизацией клеточных мембран, блокадой цитокиногенеза и продукции простагландинов, антиоксидантной активностью (Ревтович М.Ю., 2003; Леонович С.И. с соавт., 2003). Обнаружено, что подкожно вводимая однократная доза октреотида подавляет секрецию инсулина через 30 минут после инъекции (Antony L.B., Woltering E.A., Espenan G.D., 2002). Эти свойства октреотида послужили основанием для его применения у больных, которым проводятся оперативные вмешательства на поджелудочной железе (Gur R., Meier R., 1996).
Существует представление о возможной роли нейропептидов в регуляции деятельности иммунной системы на разных уровнях ее организации – от субклеточного до системного. Накапливается все больше данных, свидетельствующих о роли нейропептидов, в том числе и соматостатина, в обеспечении взаимодействия нервной и иммунной систем (Perry M.D. et al., 2009).
Пептиды, взаимодействуя со специфическими рецепторами, расположенными на нейтрофильных лейкоцитах и в центральной нервной системе, способны регулировать механизмы резистентности организма (Kumar U. et al., 2009). Введение пептидов повышает уровень содержания катионных белков в нейтрофильных лейкоцитах. Установлено корригирующее влияние пептидов на поврежденный рецепторный аппарат нейтрофильных лейкоцитов (Andina N. et al., 2009).
Существует предположение, что система тканевых нейтрофилов выполняет посредническую роль между центральной нервной системой и соединительной тканью (Третьякова И.Е., Долгушин И.И., 2004). Нейтрофильные лейкоциты получают сигналы по нейросекреторным каналам, реализуют в тканях свой функциональный потенциал и одновременно осуществляют механизм обратной связи.
На поверхности нейтрофилов обнаружены рецепторы к различным пептидам, осуществляющим регуляторную функцию (Маянский Д.Н., Маянская С.Д., 2001). Количество и аффинность рецепторов, их способность вызывать различные проявления активации нейтрофильных лейкоцитов изменяются в зависимости от уровня функционального состояния клеток (Prasad V. et al., 2007). Нейтрофильные лейкоциты способны продуцировать пептиды, участвующие в регуляции иммуногенеза, что позволяет рассматривать нейтрофил как регуляторную клетку, связанную с поддержанием постоянства внутренней среды организма (Falanga A. et al., 2000; Femling J.K., 2005).
Установлено, что инфильтрация нейтрофилами поджелудочной железы – ключевое событие в развитии панкреатита (Tu W. et al., 2000; Wang X.P. et al., 2003). Ацинарные клетки поджелудочной железы способны нацеливать нейтрофильные лейкоциты на свою поверхность, что может привести к смерти не только клеток, но и самой железы (Hegyi P. et al., 2009). Это свидетельствует о том, что фатальный панкреатит может быть результатом прежде всего избыточной стимуляции нейтрофильных лейкоцитов (Maher O. et al., 1999; Zaninovic V. et al., 2000).
Вопрос о влиянии соматостатина и октреотида на функциональную активность нейтрофилов в норме и при развитии патологических состояний остается недостаточно изученным.
Цель исследования
Оценить влияние октреотида на функциональную активность нейтрофильных лейкоцитов крови в норме и при наличии патологических изменений поджелудочной железы у людей и крыс.
Задачи исследования
- Выявить воздействие октреотида на способность нейтрофилов крови здоровых людей к активации in vitro.
- Охарактеризовать октреотидиндуцированные эффекты на функционально-метаболическую активность нейтрофильных лейкоцитов больных острым панкреатитом in vivo и in vitro.
- Определить характер изменений функциональной активности нейтрофилов периферической крови крыс в процессе развития острого экспериментального панкреатита (ОЭП).
- Оценить влияние октреотида на состояние ткани поджелудочной железы крыс в динамике развития ОЭП.
- Установить характер воздействия октреотида на функционально-метаболическую активность нейтрофильных лейкоцитов в физиологических условиях и при остром панкреатите.
Новизна результатов исследования
- Представлены новые данные о влиянии октреотида in vitro на способность к активации нейтрофильных лейкоцитов периферической крови здоровых людей в зависимости от концентрации пептида.
- Выявлена способность октреотида оказывать ингибирующее действие in vitro на повышенную функциональную активность нейтрофилов крови больных с острым панкреатитом.
- Найдены новые особенности изменения функционально-метаболической активности нейтрофильных лейкоцитов (активность NADPH-оксидазы, миелопероксидазы, щелочной фосфатазы, содержание катионных белков, активационный потенциал ядерного хроматина) при развитии ОЭП.
4. Получены сведения о протекторном действии октреотида на ткань поджелудочной железы и ингибирующем – на функционально-метаболическую активность нейтрофильных лейкоцитов крови крыс с ОЭП.
Теоретическая значимость исследования
Выявлено модулирующее действие октреотида на функционально-метаболическую активность нейтрофильных лейкоцитов в норме и при патологии (острый панкреатит), что расширяет современные представления о взаимодействии нейроэндокринной и иммунной систем организма.
Результаты проведенной работы могут быть использованы в учебном процессе со студентами медицинских специальностей, а также служить основой для дальнейших прикладных исследований.
Практическая значимость исследования
Обнаруженное ингибирующее влияние октреотида на повышенную функционально-метаболическую активность нейтрофильных лейкоцитов in vitro у людей с острым панкреатитом и in vivo у крыс с острым экспериментальным панкреатитом может быть использовано для иммунокоррекции состояний, сопровождающихся избыточной активацией нейтрофилов крови.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования: венозная кровь 25 здоровых людей, 25 больных острым панкреатитом и капиллярная кровь 38 крыс. Экспериментальная часть работы выполнена на стандартизированных аутбредных крысах-самцах породы Sprague Dawley 4-5 месячного возраста массой 420-500 граммов, которые были разделены на 5 групп: 1 группа – ложнооперированые животные (5 крыс) с минимальным хирургическим вмешательством в виде лапаротомии; 2 группа – животные с острым экспериментальным панкреатитом (9 крыс); 3 группа – животные с острым экспериментальным панкреатитом, получавшие инъекции октреотида (9 крыс); 4 группа – ложнооперированые животные (5 крыс), получавшие инъекции октреотида; контрольная группа – интактные, здоровые животные (10 крыс).
Моделировали ОЭП путем глубокого охлаждения обеих поверхностей поджелудочной железы хлорэтилом (Малхасян В.А., Симоворян П.Р., 1972). Для подтверждения развития ОЭП проводили морфологическое исследование состояния поджелудочной железы крыс в динамике эксперимента.
Функционально-метаболическую активность нейтрофилов исследовали на первые (до манипуляций), третьи (после операции) и седьмые сутки эксперимента. В нейтрофильных лейкоцитах определяли активность NADPH-оксидазы с помощью НСТ-теста (Нестерова И.В., 1980), активность миелопероксидазы оценивали по методу Шафран М.Г. и соавт. (1979), щелочной фосфатазы – по методике М.Г. Шубича (1965). Содержание катионных белков выявляли по методике А.А. Славинского и Г.В. Никитиной (1999). Активационный потенциал ядерного хроматина оценивали поляризационно-оптическим методом А.А. Евглевского (2000).
Компьютерную морфометрию изображения нейтрофильных лейкоцитов выполняли при помощи цветной телевизионной системы для микроскопических исследований «CitoW» (Диаморф, Москва). Результаты оценивали с использованием интегрального цитохимического показателя - ИЦП (Славинский А.А., 2000).
Оценку значимости различий между средними значениями двух сравниваемых исследуемых показателей выполняли с помощью дисперсионного анализа, вычисляли критерий Стьюдента (t) и доверительную вероятность различий (p) (Гланц С., 1999). Диапазон, ограниченный ±2 S (стандартное отклонение от средней величины), использовали при характеристике границ нормы как наиболее приемлемый для гематологических показателей (Воробьев А.И., 2002).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Влияние октреотида на функционально-метаболическую
активность нейтрофилов крови здоровых людей in vitro
Изучение влияния нейропептида на функционально-метаболическую активность нейтрофильных лейкоцитов производили в опытах in vitro с помощью постановки НСТ-теста, отражающего изменение активности NADPH-оксидазы, по которой можно судить о способности нейтрофилов к активации. В контрольной группе без инкубации с октреотидом средние значения ИЦП составили 4,90±0,3 отн. ед. Воздействие пептида в диапазоне концентраций от 510-4 М до 510-7 М способствовало постепенному снижению активности NADPH-оксидазы. Наибольшее уменьшение показателей получено в результате использования октреотида в концентрации 510-7 М. При этом значения ИЦП составили 1,92±0,2 отн. ед., что ниже в 2,5 раза по сравнению с контролем (рис.1). Инкубация крови с раствором пептида в более низких концентрациях (510-9 М и 510-14 М) не вызывала такого выраженного угнетения функционально-метаболической активности нейтрофилов, как действие октреотида в концентрации 510-7 М.
Влияние октреотида на функционально-метаболическую активность нейтрофилов крови больных острым панкреатитом in vitro
При постановке НСТ – теста ИЦП нейтрофильных лейкоцитов на первые сутки наблюдения превышал аналогичный показатель нейтрофилов здоровых людей и составил 8,76±0,3 относительных единиц, что по сравнению с группой здоровых людей без инкубации с октреотидом было выше в 1,8 раза (p<0,05). Этот же показатель нейтрофилов на первые сутки наблюдения оказался меньше, чем в нейтрофилах образцов крови, не подвергавшихся инкубации с октреотидом, но при этом он был достоверно (p<0,05) больше соответствующего показателя у здоровых людей (рис. 2).
На третьи сутки наблюдения ИЦП нейтрофилов в пробах крови, инкубированных in vitro с октреотидом, в 2 раза уменьшился как по сравнению с результатами в первые сутки наблюдения, так и, хотя в меньшей степени, по сравнению с соответствующим показателем у здоровых лиц (в 1,2 раза).
На седьмые сутки наибольшие изменения в данной серии исследований отмечены по параметрам ИЦП в нейтрофилах образцов крови больных острым панкреатитом после инкубации с октреотидом. Он оказался в 5,5 раз меньше этого показателя функциональной активности нейтрофильных лейкоцитов по сравнению со здоровыми испытуемыми, а также в 4,3 раза меньше соответствующих значений, зафиксированных в тех же условиях у исследуемых пациентов на третьи сутки наблюдения.
Рис. 1 Рис. 2
Рис. 1. Влияние октреотида на функционально-метаболическую активность нейтрофилов здоровых людей.
Активность NADPH-оксидазы (отн. ед.):
![]() – кровь здоровых людей без инкубации с октреотидом (контроль);
– кровь здоровых людей без инкубации с октреотидом (контроль);
![]() – кровь здоровых людей, инкубированная с октреотидом в концентрации 510-7 М в течение 60 минут.
– кровь здоровых людей, инкубированная с октреотидом в концентрации 510-7 М в течение 60 минут.
Рис. 2. Влияние октреотида на функционально-метаболическую активность нейтрофилов больных острым панкреатитом.
Активность NADPH-оксидазы (отн. ед.):
![]() – кровь больных острым панкреатитом без инкубации с октреотидом;
– кровь больных острым панкреатитом без инкубации с октреотидом;
![]() – кровь больных острым панкреатитом, инкубированная с октреотидом в концентрации 510-7 М в течение 60 минут.
– кровь больных острым панкреатитом, инкубированная с октреотидом в концентрации 510-7 М в течение 60 минут.
ВЛИЯНИЕ ОКТРЕОТИДА НА СОСТОЯНИЕ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ КРЫС ПРИ ОСТРОМ ЭКСПЕРИМЕНТАЛЬНОМ ПАНКРЕАТИТЕ
Проведено моделирование ОЭП у 38 крыс-самцов. В качестве групп сравнения служили ложнооперированные животные без моделирования ОЭП, часть из которых получала инъекции раствора октреотида, а также животные, у которых выполняли моделирование ОЭП, но лечение октреотидом не проводили.
В селезеночном сегменте поджелудочной железы уже на 3-и сутки заболевания отмечались крупные масштабы незавершенного некроза ацинарной ткани и дольки с неполноценной протоковой регенерацией, а также жировые некрозы с нагноением. К 7-м суткам поврежденные дольки поджелудочной железы подвергались склерозу с сохраняющимся воспалением. Незавершенная регенерация жировых интерстициальных некрозов приводила к формированию крупных воспалительных инфильтратов, отграниченных фиброзной капсулой, спаянной с окружающими органами (рис. 3).
Лечение ОЭП октреотидом тормозило прогрессирование ацинарного некроза во всех отделах поджелудочной железы, приводило к быстрому (3-и сутки) отграничению атрофирующихся путем протоковой трансформации долек от неповрежденной ацинарной ткани. Мелкие интерстициальные жировые некрозы под влиянием миграции лейкоцитов подвергались разобщению, элиминации детрита под воздействием макрофагов и заместительному склерозу. При этом крупные жировые некрозы инкапсулировались, отделяясь от ткани поджелудочной железы фиброзной капсулой. Вокруг таких инкапсулированных некрозов в результате перипроцесса формировался воспалительный инфильтрат с вовлечением окружающих органов.
Таким образом, можно заключить, что при лечении ОЭП октреотидом морфологически выявлены положительные эффекты влияния на течение заболевания по сравнению с контрольной серией без лечения. Они состоят в уменьшении масштабов ферментного некроза ацинарной и жировой ткани, ранних процессах репарации поврежденных тканей без нагноения. Репарация ацинарной ткани протекает по типу неполноценной протоковой трансформации с последующим склерозом и убылью в большей или меньшей степени ацинарной ткани. Заживление жировых некрозов происходит по типу полноценной завершенной регенерации: сначала острого демаркационного воспаления с завершенным протеолизом липолитического некроза без нагноения, затем сменой воспалительного инфильтрата на макрофагальный с элиминацией некротического детрита и завершается заместительным склерозом и липоматозом без остаточных признаков интерстициального склероза.
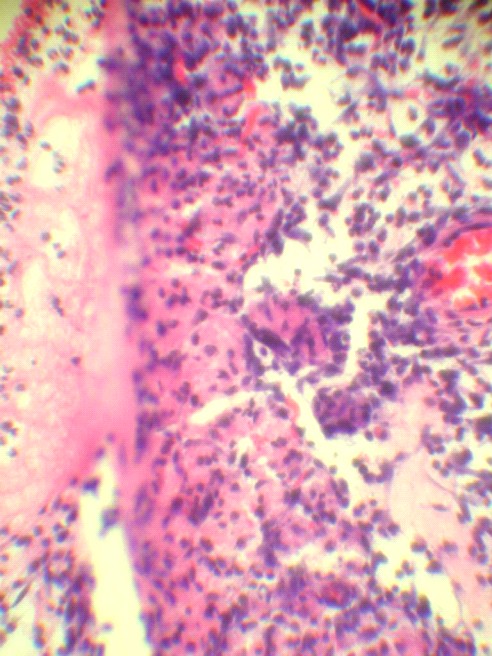
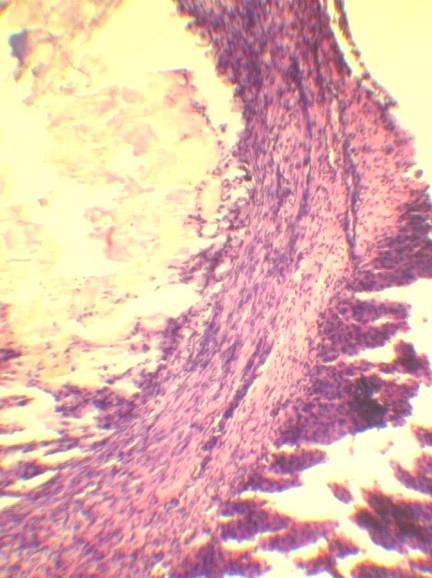
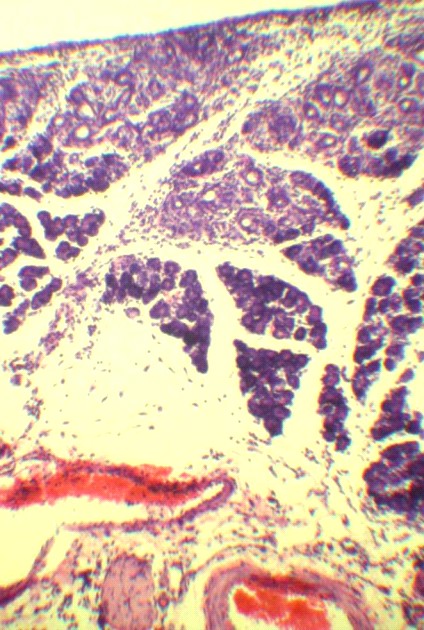
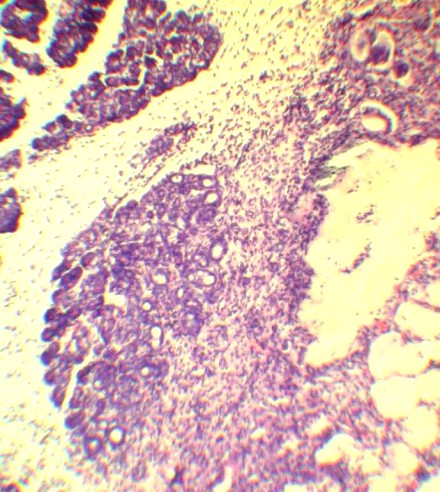
Рис. 3. Патогистологические изменения в селезеночном сегменте поджелудочной железы на 3 и 7 сутки ОЭП у крыс без лечения (а, б) и при лечении октреотидом (в, г):
а – атрофия и склероз дольки, макрофагальное воспаление вокруг жирового некроза (х125); б – незавершенный краевой некроз ацинусов с миграцией лейкоцитов в некротизированнные ткани (х400); в – краевая атрофия долек с воспалением интерстиция (х125); г – фиброзная капсула вокруг жирового некроза, спаянная с печенью (х125). Окраска гематоксилином и эозином.
ВЛИЯНИЕ ОКТРЕОТИДА НА функциональную АКТИВНОСТЬ НЕЙТРОФИЛОВ КРОВИ КРЫС ПРИ ОСТРОМ ЭКСПЕРИМЕНТАЛЬНОМ ПАНКРЕАТИТЕ
NADPH-оксидаза. В течение первых суток эксперимента не наблюдалось существенных изменений активности NADPH-оксидазы нейтрофильных лейкоцитов крови у подопытных животных всех групп. На третьи сутки эксперимента средние значения ИЦП нейтрофилов в 1-й группе ложнооперированных животных не имели статистически достоверных отличий по сравнению с группой интактных животных и с группой крыс, которой проводилась лапаротомия на 1-е сутки эксперимента. Во 2-й группе крыс с ОЭП значения ИЦП достигали значений 2,09±0,44 относительных единиц, что говорит о достоверном (p<0,05) повышении активности NADPH-оксидазы нейтрофилов в 4 раза по сравнению с активностью этого фермента у животных 1-й группы и более чем в 3,6 раза превышает соответствующий показатель у животных этой же группы на 1-е сутки наблюдения (рис. 4). Это свидетельствует о том, что развитие ОЭП сопровождается резким повышением активности NADPH-оксидазы нейтрофилов крови крыс. Значения ИЦП в 3-й группе животных с ОЭП и введением октреотида составили 0,86±0,12 относительных единиц, что по сравнению со 2-й группой животных с ОЭП ниже в 2,4 раза (р<0,01). Таким образом, введение октреотида достоверно уменьшило повышение активности этого фермента на фоне ОЭП. В 4-й группе ложнооперированных животных введение октреотида привело к снижению активности NADPH-оксидазы нейтрофилов до 0,41±0,01, что по отношению к группе животных с лапаротомией на 3-и сутки эксперимента ниже в 1,3 раза (р<0,05), а по сравнению с группой ложнооперированных животных, получавших инъекции октреотида, меньше в 1,1 раза (p>0,05).
На седьмые сутки эксперимента в 1-й группе крыс различия не были статистически достоверными в сравнении с группой интактных животных, а также в сравнении со значениями ИЦП нейтрофилов в группе ложнооперированных животных на 1-е и 3-и сутки наблюдения. Во 2-й группе животных с ОЭП значения ИЦП превышали в 3 раза этот показатель в группе ложнооперированных крыс и составили 1,68±0,04 относительных единиц (р<0,01). Активность NADPH-оксидазы нейтрофилов у крыс с ОЭП в этот период наблюдения в 2,9 раза превышала показатель активности этого фермента на 1-е сутки наблюдения, но по сравнению с 3-ми сутками оказалась в 1,2 раза меньше (p<0,05). Значения ИЦП в 3-й группе животных с ОЭП и введением октреотида снижались до 0,48±0,02, что по сравнению со 2-й группой крыс с ОЭП меньше в 3,5 раза (р<0,01) и в 1,8 раза меньше (p<0,05) того же показателя в 3-й группе животных на 3-и сутки наблюдения.
Таким образом, введение октреотида ложнооперированным крысам не вызвало заметных изменений активности NADPH-оксидазы в нейтрофильных лейкоцитах. Развитие ОЭП привело к достоверному увеличению активности этого фермента, в то время как введение животным октреотида существенно уменьшило, а к концу периода наблюдения фактически нормализовало уровень активности NADPH-оксидазы нейтрофилов крови.
Рис. 4. Влияние октреотида на динамику активности NADPH-оксидазы нейтрофилов крыс при моделировании острого экспериментального панкреатита: ![]() – интактные животные;
– интактные животные; ![]() – лапаротомия;
– лапаротомия; ![]() – ОЭП;
– ОЭП; ![]() – ОЭП с введением октреотида;
– ОЭП с введением октреотида; ![]() – лапаротомия с введением октреотида.
– лапаротомия с введением октреотида.
Миелопероксидаза. Колебания активности фермента в 1й группе ложнооперированных крыс на третьи и седьмые сутки эксперимента были статистически не достоверны (рис. 5).
На третьи сутки эксперимента во 2й группе животных с ОЭП введение октреотида привело к увеличению активности миелопероксидазы в 2 раза по сравнению с контрольной группой (р<0,05). Важно, что активность миелопероксидазы нейтрофилов на 3-и сутки эксперимента достоверно снизилась (p<0,05) по сравнению с 1-ми сутками наблюдения и в группе животных с острым экспериментальным панкреатитом, и в группе животных с этой же экспериментальной моделью патологии поджелудочной железы, которые получали инъекции октреотида.
На седьмые сутки эксперимента во 2й группе животных с ОЭП активность миелопероксидазы несколько повысилась (в 1,2 раза), но была существенно ниже того же показателя на 1-е сутки наблюдения (в 1,5 раза; p<0,05).
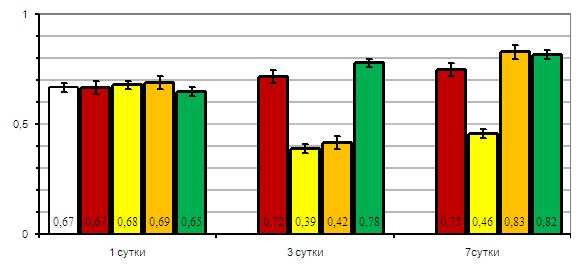
Рис. 5. Влияние октреотида на динамику активности миелопероксидазы нейтрофилов крыс при моделировании ОЭП: ![]() – интактные животные;
– интактные животные; ![]() – лапаротомия;
– лапаротомия; ![]() – ОЭП;
– ОЭП; ![]() – ОЭП с введением октреотида;
– ОЭП с введением октреотида;
![]() – лапаротомия с введением октреотида.
– лапаротомия с введением октреотида.
Сопоставление уровня активности миелопероксидазы нейтрофильных лейкоцитов на этом этапе эксперимента с аналогичным показателем во всех группах животных на 1-е и 3-и сутки наблюдения показало, что наиболее значимое изменение активности фермента имело место в группе подопытных животных с острым экспериментальным панкреатитом, которые получали инъекции октреотида. Введение октреотида ложнооперированным животным сопровождалось заметным увеличением активности миелопероксидазы нейтрофилов по сравнению с 1-и сутками.
Щелочная фосфатаза.
На третьи сутки во 2й группе животных значения ИЦП достигали 7,06±0,18 относительных единиц, что свидетельствует о повышении активности щелочной фосфатазы по сравнению с 1-й группой в 2,1 раза (рис. 6).
Значения активности щелочной фосфатазы в 3-й группе крыс с ОЭП и введением октреотида по сравнению со 2-й группой животных с ОЭП, не получавших препарат, были меньше в 1,4 раза (5,18±0,06, р<0,05).
В 4-й группе животных (ложнооперированные, получавшие инъекции октреотида) активность щелочной фосфатазы составила 3,43±0,17.
Рис. 6. Влияние октреотида на динамику активности щелочной фосфатазы нейтрофилов крыс при моделировании острого экспериментального панкреатита: ![]() – интактные животные;
– интактные животные; ![]() – лапаротомия;
– лапаротомия; ![]() – ОЭП;
– ОЭП;
![]() – ОЭП с введением октреотида;
– ОЭП с введением октреотида; ![]() – лапаротомия с введением октреотида.
– лапаротомия с введением октреотида.
На седьмые сутки активность фермента несколько снизилась, но при этом значения активности фермента достоверно (p<0,05) превышали соответствующие показатели как интактных животных, так и у крыс с ОЭП в 1-е сутки наблюдения. Введение октреотида в течение 7 суток крысам с ОЭП оказало достоверное (p<0,05) влияние на активность щелочной фосфатазы. Активность фермента под влиянием аналога соматостатина была существенно ниже и на 3-и, и на 7-е сутки наблюдения по сравнению с группой животных с ОЭП, не получавших инъекции октреотида, хотя к концу эксперимента все же несколько превышала этот показатель в группе интактных животных. В обеих группах ложнооперированных животных значимых изменений активности щелочной фосфатазы нейтрофильных лейкоцитов крови на протяжении всего периода наблюдения не отмечено.
Неферментные катионные белки. Содержание катионных белков в 1й группе ложнооперированных крыс составило 0,68±0,01 относительных единиц (рис. 7). На третьи сутки в группе крыс с ОЭП значения достигли 2,90±0,05 относительных единиц, что указывает на повышение содержания неферментных катионных белков по сравнению с группой ложнооперированных крыс в 4 раза (р<0,01), и в сравнении с группой животных с ОЭП на первые сутки эксперимента в 4,1 раза (p<0,05). На седьмые сутки содержание катионных белков в нейтрофилах достоверно (p<0,01) возросло у животных с ОЭП как не получавших октреотид, так и получавших его инъекции. Однако у животных с ОЭП, получавших инъекции октреотида, увеличение названного показателя было достоверно (p<0,05) меньшим. Следует отметить, что в динамике экперимента наиболее значимые изменения содержания неферментных катионных белков в нейтрофильных лейкоцитах крыс отмечены в группах животных с моделированием острого экспериментального панкреатита.
Рис. 7. Влияние октреотида на динамику содержания катионных белков нейтрофилов крыс при моделировании острого экспериментального панкреатита: ![]() – интактные животные;
– интактные животные; ![]() – лапаротомия;
– лапаротомия; ![]() – ОЭП;
– ОЭП;
![]() – ОЭП с введением октреотида;
– ОЭП с введением октреотида; ![]() – лапаротомия с введением октреотида.
– лапаротомия с введением октреотида.
Ядерный хроматин. В 1й группе ложнооперированных животных и во 2й группе крыс, получавших инъекции октреотида, статистически достоверных изменений показателя активационного потенциала ядерного хроматина нейтрофилов не выявлено (рис. 8).
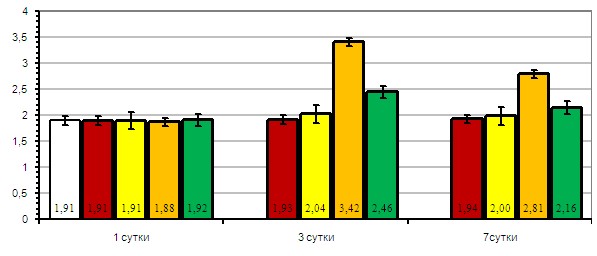
Рис. 8. Влияние октреотида на активационный потенциал ядерного хроматина нейтрофилов крыс при моделировании острого экспериментального панкреатита: ![]() – интактные животные;
– интактные животные;
![]() – лапаротомия;
– лапаротомия; ![]() – ОЭП;
– ОЭП; ![]() – ОЭП с введением октреотида;
– ОЭП с введением октреотида;
![]() – лапаротомия с введением октреотида.
– лапаротомия с введением октреотида.
На третьи сутки эксперимента моделирование ОЭП в 3й группе животных вызвало повышение показателя активационного потенциала хроматина нейтрофилов в 1,8 раза по сравнению с показателем контрольной группы (р<0,01). Инъекции октреотида животным 4й группы с ОЭП снизили активационный потенциал хроматина нейтрофильных лейкоцитов в 1,4 раза (р<0,01), по сравнению с группой животных с ОЭП без лечения.
На седьмые сутки эксперимента у крыс 3й группы с ОЭП показатель активационного потенциала хроматина нейтрофильных лейкоцитов был выше значения контрольной группы в 1,1 раза (р<0,01). Однако это значение было ниже, чем показатель, полученный на третьи сутки эксперимента, в 1,2 раза (р<0,01). В 4й группе животных с ОЭП, на фоне лечения октреотидом, наблюдалось снижение показателя активационного потенциала ядерного хроматина нейтрофилов в 1,3 раза по сравнению с 3й группой животных (р<0,01).
ВЫВОДЫ
- Синтетический аналог соматостатина нейропептид октреотид у здоровых людей угнетает функционально-метаболическую активность нейтрофильных лейкоцитов, о чем свидетельствует снижение активности NADPH-оксидазы. Наиболее выраженное действие пептид оказывает в концентрации 510-7М.
- У больных острым панкреатитом октреотид снижает повышенную функционально-метаболическую активность нейтрофильных лейкоцитов венозной крови in vitro, что проявляется уменьшением активности NADPH-оксидазы в цитоплазме клеток.
- Моделирование острого экспериментального панкреатита у крыс приводит к повышению функционально-метаболической активности нейтрофильных лейкоцитов. Воспалительно-деструктивным изменениям в поджелудочной железе сопутствует увеличение в нейтрофилах крови активационного потенциала ядерного хроматина, активности NADPH-оксидазы, щелочной фосфатазы и содержания неферментных катионных белков со снижением активности миелопероксидазы.
4. Репаративные изменения в поджелудочной железе крыс при остром экспериментальном панкреатите сопровождаются спонтанным снижением активационного потенциала ядерного хроматина, активности NADPH-оксидазы и щелочной фосфатазы, уменьшением содержания неферментных катионных белков и увеличением активности миелопероксидазы в нейтрофилах.
5. Инъекции октреотида животным с острым экспериментальным холодовым панкреатитом оказывают протективное действие на поджелудочную железу. При репаративных изменениях в поджелудочной железе после применения октреотида показатели функционально-метаболической активности нейтрофильных лейкоцитов крови нормализуются.
6. Октреотид проявляет модулирующее действие на функционально-метаболическую активность нейтрофильных лейкоцитов, снижая её при избыточном исходном уровне. Эффекты октреотида проявляются in vitro и in vivo в норме и при остром панкреатите как у экспериментальных животных, так и у людей.
РАБОТЫ, ОПУБЛИКОВАННЫЕ ПО ТЕМЕ ДИССЕРТАЦИИ
- Породенко И.В. Влияние октреотида на активность нейтрофильных лейкоцитов при остром панкреатите // Кубанский научный медицинский вестник. – 2008. – № 1-2. – С. 79-83.
- Породенко И.В., Курзанов А.Н., Славинский А.А. Октреотидиндуцированные изменения патоморфологических проявлений острого экспериментального панкреатита // Вестник хирургической гастроэнтерологии. – 2006. – № 1. – С. 127-128.
- Породенко И.В., Курзанов А.Н. Лиганды соматостатиновых рецепторов в экспериментальной и клинической панкреатологии. Сообщение 3. Октреотид и соматостатин в хирургической панкреатологии и онкопатологиии поджелудочной железы // Успехи современного естествознания. – 2006. – № 8. – С. 15-17.
- Породенко И.В., Курзанов А.Н. Лиганды соматостатиновых рецепторов в экспериментальной и клинической панкреатологии. Сообщение 1. Базисные предпосылки использования в гастроэнтерологии // Успехи современного естествознания. – 2006. – № 10. – С. 14-16.
- Породенко И.В., Курзанов А.Н. Лиганды соматостатиновых рецепторов в экспериментальной и клинической панкреатологии. Сообщение 2. Соматостатин и его аналоги в лечении острого и хронического панкреатита // Успехи современного естествознания. – 2006. – № 10. – С. 17-20.
- Породенко И.В. Иммунотропные эффекты лигандов соматостатиновых рецепторов // Открытое образование. – 2006. – № 3 – С. 248-250.
- Породенко И.В., Беспалова Ж.Д., Славинский А.А., Курзанов А.Н. Морфологические изменения в поджелудочной железе при лечении экспериментального панкреатита октреотидом // Новые информационные технологии в медицине, биологии, фармакологии и экологии, 2007. Материалы ХIV международной конференции и дискуссионного научного клуба. – Украина, Крым, Ялта-Гурзуф, 31 мая – 9 июня 2007. – С. 225-227.
- Породенко И.В., Славинский А.А., Балачевский Б.В., Курзанов А.Н. Октреотидиндуцированная оптимизация функциональной активности нейтрофильных лейкоцитов // Конгресс «Человек и лекарство. Краснодар – 2008». – 2008. – С. 72.
- Славинский А.А., Балачевский Б.В., Породенко И.В. Функционально-метаболическая активность нейтрофильных лейкоцитов при остром панкреатите // Тез. докл. ХII международного конгресса «Парентеральное и энтеральное питание». – 2008. – С. 28-29.
- Курзанов А.Н., Славинский А.А., Породенко И.В., Балачевский Б.В. Пептидергическая модуляция функционально-метаболической активности нейтрофильных лейкоцитов // Науч. труды II Съезда физиологов СНГ «Физиология и здоровье человека». Москва-Кишинев. – 2008. – С. 160.
- Курзанов А.Н., Славинский А.А., Породенко И.В., Балачевский Б.В. Пептидергическая модуляция функционально-метаболической активности нейтрофильных лейкоцитов как компонент их панкреатопротекторного действия // Тезисы докладов IV Российского симпозиума «Белки и пептиды». Казань, 23-27 июня 2009 г. – 2009. – С. 60.
Породенко Игорь Валериевич
ОЦЕНКА ЭФФЕКТОВ ОКТРЕОТИДА
НА ФУНКЦИОНАЛЬНУЮ АКТИВНОСТЬ
НЕЙТРОФИЛЬНЫХ ЛЕЙКОЦИТОВ
автореферат
Подписано в печать 02.11.2009. Формат А5.
Ризография. Усл.печ.л.1,3. Тираж 100 экз. Заказ 90,
МУ «Краснодарский медицинский информационно-вычислительный центр»
350059, г. Краснодар, ул. Дунайская, 62.

