Экологическая оценка влияния абиотических факторов на ассоциативный симбиоз klebsiella planticola тсха-91 и cucumis sativus l.
На правах рукописи
БЛИНКОВ ЕВГЕНИЙ АЛЕКСАНДРОВИЧ
ЭКОЛОГИЧЕСКАЯ ОЦЕНКА ВЛИЯНИЯ
АБИОТИЧЕСКИХ ФАКТОРОВ НА АССОЦИАТИВНЫЙ СИМБИОЗ
KLEBSIELLA PLANTICOLA ТСХА-91 И
CUCUMIS SATIVUS L.
Специальности: 03.02.08 – экология (биология)
03.02.03 – микробиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва - 2013
Работа выполнена на кафедрах экологии и микробиологии и иммунологии ФГБОУ ВПО «Российский государственный аграрный университет – МСХА имени К.А. Тимирязева».
| Научные руководители: | доктор биологических наук, профессор Васенёв Иван Иванович кандидат биологических наук, доцент Селицкая Ольга Валентиновна |
| Официальные оппоненты: | доктор биологических наук, доцент кафедры биологии почв факультета почвоведения ФГБОУ ВПО «Московский государственный университет имени М.В. Ломоносова» Манучарова Наталия Александровна кандидат биологических наук, заведующая кафедрой ландшафтной архитектуры и дизайна аграрного факультета ФГБОУ ВПО «Российский университет дружбы народов» Довлетярова Эльвира Анварбековна |
| Ведущая организация: | ФГБОУ ВПО «Воронежский государственный университет» |
Защита диссертации состоится «25» декабря 2013 г. в 17 час. 00 мин. на заседании диссертационного совета Д 220.043.03 при Российском государственном аграрном университете – МСХА имени К.А. Тимирязева по адресу: 127550, г. Москва, ул. Прянишникова, д.15; тел./факс: 8(499) 976-24-92; e-mail: [email protected].
С диссертацией можно ознакомиться в Центральной научной библиотеке Российского государственного аграрного университета – МСХА имени К.А. Тимирязева по адресу: 127550, г. Москва, ул. Тимирязевская, д. 49.
Автореферат разослан «25» ноября 2013 г.
Учёный секретарь
диссертационного совета А.Н. Смирнов
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. Одной из актуальных проблем современной аутэкологии является оценка явлений, зависимостей и связей, сложившихся между организмами и факторами среды (Черников и др., 2000).
Любой высший организм представляет собой систему экологических ниш для обширного микробного сообщества. Растения не являются исключением. Более того, как и другие высшие многоклеточные организмы, они не способны выжить в их отсутствие. В зависимости от локализации на растении микроорганизмы условно делят на ризосферные, эпифитные и эндофитные. Из них наименее изученными являются эндофиты, обитающие во внутренних тканях растения-хозяина (Емцев и др., 1994; El-Khawas, Adachi 1999; Кравченко и др., 2004; Spaepen et al., 2007; Sachdev et al., 2009; Сидоренко, 2012).
Симбиотические микроорганизмы играют важную роль в жизни растений, обеспечивая их минеральное питание, защиту от патогенов, а также адаптацию к различным стрессам. В настоящее время в сельском хозяйстве актуальна разработка вопросов культивирования микроорганизмов с целью интенсификации вызываемых ими процессов (Белимов и др., 1999; Полянская и др., 2002; Khalid et al., 2004; Сидоренко и др., 2005; Цавкелова и др. 2006).
Подбор микробно-растительных ассоциаций, в зависимости от различных экологических факторов, представляется очень перспективным для создания бактериальных препаратов – важного компонента адаптивных агроэкосистем.
Нерегулярная воспроизводимость результатов инокуляции, не позволяющая достаточно надёжно прогнозировать реакцию растений, является в настоящее время одной из основных причин ограниченного применения «ассоциативных» бактериальных удобрений в сельскохозяйственной практике (Шапошников и др., 2001; Лапыгина и др.. 2002; Белимов и др., 2004; Тихонович, 2006; Умаров и др., 2007).
Одними из главных абиотических факторов, лимитирующих ассоциативный симбиоз микроорганизмов и растений, являются температура и влажность. Наибольшее влияние эти факторы оказывают на теплолюбивые овощные культуры, в частности на огурцы.
Цель работы: проведение комплексных экологических исследований с оценкой влияния интродукции эндофитной ризобактерии Klebsiella planticola (штамм ТСХА-91) в ризоплану огурца (Cucumis sativus L.) на устойчивость растений к стрессовым температурам и дефициту влаги.
Задачи исследования. В соответствии с целью были поставлены следующие задачи:
- Уточнить диапазон экологической толерантности штамма Klebsiella planticola ТСХА-91 к негативному воздействию стрессовых температур.
- Исследовать влияние температурного стресс-фактора на развитие гибридов F1 огурца «Марьина роща», «Чистые пруды», «Эстафета», «Зозуля».
- Оценить влияние интродукции штамма Klebsiella planticola ТСХА-91 в ризоплану Cucumis sativus L. на изменение экологической пластичности с выявлением основных механизмов адаптации растений к температурному и водному стрессам в условиях ассоциативного симбиоза.
- Провести сравнительный анализ влияния ассоциативного симбиоза и действия производных от него ингибиторов (метаболитов штамма Klebsiella planticola ТСХА-91) на развитие и экологическую пластичность растений огурца в условиях абиотического стресса.
- Изучить влияние температурного фактора и состава питательной среды для выращивания Klebsiella planticola ТСХА-91 на процессы синтеза штаммом антистрессовых веществ индольной природы.
Научная новизна исследования. В результате проведённых исследований уточнены механизмы адаптации вступающих в ассоциативный симбиоз гибридов F1 огурца «Марьина роща», «Чистые пруды», «Эстафета», «Зозуля» и штамма Klebsiella planticola ТСХА-91. Проведён сравнительный анализ химических и биологических механизмов симбиотических реакций Klebsiella planticola ТСХА-91 и растений огурца, существенно расширяющих их диапазон экологической пластичности к действию абиотических стресс-факторов.
Доказана способность Klebsiella planticola ТСХА-91 синтезировать вещества индольной природы, а также изучено влияние на этот процесс наличия триптофана и источника азота в окружающей штамм среде. Объясняется необходимость разведения культуральной жидкости бактерий с целью её применения в качестве стимулятора роста растений.
Выявлена эффективность обработки растений метаболитами Klebsiella planticola ТСХА-91 в условиях дефицита влаги.
Уточнена экологическая валентность штамма Klebsiella planticola ТСХА-91 по отношению к температурному фактору.
Практическая значимость. Результаты инокуляции эндофитной ризобактерии Klebsiella planticola ТСХА-91, а также обработки метаболитами показали их эффективность по снижению действия стрессовых ситуаций на рост и развитие растений огурца. Полученные на гибридах F1 огурца «Марьина роща», «Чистые пруды», «Эстафета», «Зозуля» данные показывают потенциально высокую эффективность использования данного штамма при условии уточнения процесса производства препарата на его основе. Возможно повышение за счёт этого устойчивости к стрессовым экологическим факторам, скорости созревания и урожайности овощных культур при выращивании в закрытом и открытом грунте.
Апробация результатов исследования. Результаты исследований докладывались на заседаниях кафедры экологии и кафедры микробиологии и иммунологии в 2010-2013 гг., на Международных научных конференциях РГАУ–МСХА имени К.А. Тимирязева (Москва, 2009, 2010, 2011, 2012 гг.), на конференции молодых учёных У.М.Н.И.К. (Москва, 2009 г.), на Всероссийском симпозиуме с международным участием «Современные проблемы физиологии, экологии и биотехнологии микроорганизмов» (Москва, 2009 г.), на молодёжных школах-конференциях с международным участием «Актуальные аспекты современной микробиологии» (Москва, 2010, 2011, 2012 гг.), Международной конференции «Ломоносов» (Москва, 2011 г.), Всероссийской школе-конференции с международным участием «Химия биологически активных веществ» (Саратов, 2012 г.). Заочно принимал участие в конференциях в Саратове (2010 г.), Минске (2010 г.), Казани (2011 г.), Новосибирске (2011 г.). По результатам исследований опубликовано 16 научных работ, в т.ч. 2 работы в журналах, рекомендуемых ВАК (одна сдана в печать).
Структура и объём работы. Диссертационная работа состоит из введения, обзора литературы по данной тематике, описания объектов, методов и условий экспериментов, экспериментальной части и её обсуждения, заключения с выводами и рекомендациями. Объём диссертационной работы составляет ____ с., из них ___ с. приложения. Работа включает ___ таблицы, ___ рисунков, список использованной литературы из ____ наименований, в том числе ____ на иностранном языке.
Благодарности. Выражаю благодарность сотрудникам и аспирантам кафедр экологии и микробиологии и иммунологии РГАУ – МСХА имени К.А. Тимирязева за помощь при написании диссертационной работы. Приношу особую благодарность доценту кафедры микробиологии МГУ имени М.В. Ломоносова Цавкеловой Елене Аркадьевне за неоценимую помощь в проведении эксперимента и обсуждении результатов. Выражаю глубокую признательность гл. спец. лаборатории клеточной биологии ГНУ ВНИИСБ Россельхозакадемии Барановой Галине Борисовне, к.б.н. Самохину Леониду Викторовичу и выпускникам РГАУ – МСХА имени К.А. Тимирязева Дюкиной Татьяне, Васкиной Марине и Дрожжиной Лидии за помощь, оказанную при проведении исследований.
Объекты и методы исследований
Объектами исследований являлись ассоциативный диазотроф Klebsiella planticola (штамм ТСХА-91 и его метаболиты), сорт огурца (Cucumis sativus L.) «Конкурент» агрофирмы «Гавриш» и гибриды агрофирмы «Манул» F1 «Марьина роща», «Чистые пруды», «Эстафета», «Зозуля», а также их симбиотическая система.
Методы исследования. Исследование проводилось с применением комплексных традиционных методов факториальной экологии, микробиологии и физиологии растений с использованием модельных и вегетационных опытов.
Динамику роста штамма Klebsiella planticola ТСХА-91 на разных средах определяли по оптической плотности растущей культуры (Нетрусов и др., 2005). Учёт числа клеток азотфиксирующих микроорганизмов производился методом высева на плотные питательные среды (Теппер и др., 2004).
Влияние инокуляции семян огурца штаммом Klebsiella planticola ТСХА-91 и влияние температурного фактора на культуру микроорганизмов и их локализацию на корнях - методами световой и электронной микроскопии (Уикли, 1975; Нетрусов и др., 2005).
Оценку эффективности бактеризации семян проводили путём учёта их всхожести, количества боковых корней, длины главного корня и проростка, биомассы корней и проростка (Ткаченко, Топтиков, 2008). Концентрацию хлорофилла а и b в листьях определяли спектрофотометрическим методом (Третьяков, 2003).
Определение количества ИУК в культуральной жидкости проводили колориметрическим методом с использованием реактива Сальковского по описанной ранее методике (Gordon, Weber, 1951; Tsavkelova et al., 2007). Для анализа индольных веществ использовали тонкослойную хроматографию в системе хлороформ:этилацетат:формиат в соотношении 50:40:10 (по объему), силикагелевые пластины на алюминиевой подложке просматривали в УФ свете.
Биотест по изучению влияния ауксинов на процесс корнеобразования фасоли проводили согласно известной методике (Рубин, 1978).
Изучение влияния температуры на рост и развитие Klebsiella planticola ТСХА-91. Для культивирования использовали среду К2 (Емцев и др., 1994). Штамм выращивался в разных температурных условиях: +2, +5, +10, +22, +28, +37, +40 и +44 С. Через 24 и 48 ч замерялась оптическая плотность культуральной жидкости (на фотометре КФК-3-01-«ЗОМЗ», Россия) при длине волны 510 нм и производился посев на твёрдую питательную среду LB (Миллер, 1976) с последующим подсчётом выросших колоний. Особенности морфологии и строения клеток изучали методом световой микроскопии и фотографировали с помощью AxioCam MRc 5.
Изучение влияния температуры и инокуляции Klebsiella planticola ТСХА-91 на рост и развитие Cucumis sativus L. Для проведения исследований были взяты семена гибридов, отличавшихся по устойчивости к температурному фактору. Семена огурца обрабатывали 2 мл культуральной жидкости (по вариантам – без разведения, разведение 1:10 и 1:100), проращивали в простерилизованных чашках Петри. Контрольные растения замачивали в стерильной дистиллированной воде. Чашки Петри были помещены в температурные условия: +10, +18, +28, +37 и +44С. На 5-е сутки учитывали количество проросших семян, измеряли длину корня. На 12-й день оценивали ростовые процессы в проросших растениях по изменению длины корней, измеряли длину проростков (наземная часть).
Изучение влияния бактерий Klebsiella planticola ТСХА-91 и их метабо-литов на рост и развитие Cucumis sativus L. в условиях дефицита влаги. Исследования проводили в виде вегетационного опыта (с растениями огурца гибрида «Марьина роща») в сосудах Митчерлиха в условиях вегетационного домика с имитированием оптимального увлажнения (85-90% ПВ) и дефицита влаги (45-50% ПВ) (Эдельштейн, 1964). Для опыта был использован торфяной питательный субстрат (ТПС): 95,3% торфа низкой степени разложения широкого профиля применения, 1,6% минерального удобрения пролонгированного действия «Пи-Джи-Микс» с соотношением N:P:K, равном 12:14:24, 3,1% известняковой муки, рНсол.=5,5-6,0, влажность 45-60%. Элементный состав субстрата (мг/100 г сухого вещества): N – 140-180, Р2О5 – 120-160, К2О – 240-320, СаО – 3500-4000. После появления первого настоящего листа растения огурца инокулировали:
- суточной культурой бактерий (1 часть культуры на 100 частей водопроводной воды) на среде К2 (Емцев и др., 1995). Вносили под каждое растение 50 мл суспензии (титр 107 КОЕ/мл);
- проведя осаждение клеток центрифугированием (5000 об/мин в течение 5 минут) суточной культуры бактерий, получали раствор метаболитов. Вносили под каждое растение 50 мл раствора (1 часть раствора метаболитов на 100 частей водопроводной воды);
- контроль не инокулировали.
Схема опыта по определению образования ауксинов штаммом Klebsiella planticola ТСХА-91 и его влияния на развитие семян огурца. Штамм Klebsiella planticola ТСХА-91 культивировали в темноте на качалке (180 об/мин) при +32оС в условиях аэрации в конических колбах объёмом 100 мл, содержащих 20 мл одной из следующих питательных сред (г/л): (1) LB: триптон – 10,0; дрожжевой экстракт – 5,0; NaCl – 10,0; (2) К2: пептон – 1,25; K2HPO4 – 0,5; KH2PO4 – 0,3; MgSO4 7Н2О – 0,1; NaCl – 0,75; CaCl2 6Н2О – 0,03; сахароза – 6,0; (NH4)2SO4 – 0,14; дрожжевой экстракт – 0,1; раствор микроэлементов по Фёдорову – 1 мл; (3) модификация К2 безазотная (К2/No): то же, что и К2, но без добавления пептона, (NH4)2SO4 и дрожжевого экстракта; (4) модификация К2 с нитратным азотом (K2/NO3): то же, что и К2, но без добавления пептона и (NH4)2SO4, в качестве источника азота использовали NaNO3 – 1,25. Для изучения влияния на биосинтез ауксинов различных предшественников, в среды культивирования вносили 200 мкг/мл L-триптофана (Trp), а также индол-3-ацетамид (ИАМ) и индолил-3-пировиноградную кислоту (ИПвК) (ICN, Германия) в среду № 4 из расчета 0,5 мМ.
Для проращивания семян совместно с бактериальной культурой использовали гибрид «Марьина роща». Семена замачивали в дистиллированной воде или питательной среде К2/NO3 в качестве контроля. Опытные образцы семян замачивали в 1) неразведенной двухсуточной суспензии штамма K. planticola ТСХА-91, выращенного на среде К2/NO3 и в 2) суспензии клеток, разведенной в 100 раз. Эксперимент проводили в различных температурных условиях: при оптимальных условиях прорастания семян (+28оС) и в условиях, моделирующих холодовой стресс, для чего опытные образцы выдерживали в течение недели при +12оС, затем помещая в термостат с +28оС.
Все эксперименты проводили в 3-5 повторностях. Экспериментальные данные обрабатывались с использованием пакета прикладных программ «STRAZ», Microsoft Office Excel 2010 согласно стандартной методике математического анализа по Б.А. Доспехову.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
1. Экологическая толерантность к температурному фактору штамма Klebsiella planticola ТСХА-91
Известно, что эффективность функционирования искусственных растительно-бактериальных ассоциаций в значительной степени зависит от специфичной реакции различных видов и сортов растений на инокуляцию, от свойств интродуцируемых штаммов, а также от почвенно-климатических условий выращивания растений. Эти данные открыли перспективу для широкого поиска бактерий с целью применения их в качестве бактериальных удобрений для небобовых растений. В зависимости от почвенно-климатических условий увеличение урожая при инокуляции эффективными штаммами диазотрофов составляет 10…30 % для злаковых культур и 20…40 % для овощных (Кожемяков, 1991; Завалин, 2005; Умаров и др., 2007).
Одной из перспективных бактерий-ассоциантов является штамм Klebsiella planticola ТСХА-91, который хорошо зарекомендовал себя на широком спектре сельскохозяйственных культур в различных эколого-географических условиях, показав способность стимулировать рост растения-хозяина, а также повышать его устойчивость к неблагоприятным экологическим факторам и фитопатогенам (Емцев, 1994; Бирюкова, 2001; Селицкая и др., 2011, 2013).
Нами исследовалось влияние температурного фактора на штамм Klebsiella planticola ТСХА-91. Усреднённые данные приведены в таблице 1.
Таблица 1. Определение экологической толерантности штамма Klebsiella planticola ТСХА-91 к температурному фактору
| Время после посева | Численность бактерий в периодической культуре в зависимости от температуры, КОЕ/мл | |||||
| +2 °C | +5 °C | +10 °C | +28 °C | +37 °C | +44 °C | |
| 24 часа | 9,9х104 | 2,4х105 | 2,4х106 | 7,6х107 | 4,3х103 | 4,1х102 |
| 48 часов | 7,7х104 | 3,7х105 | 3,2х105 | 5,9х107 | 1,9х103 | 0 |
Оптимальной температурой для развития изучаемого штамма, как показал опыт, является +28 °C (в отличие от указанной в определителе бактерий Берджи +37 °C для вида Klebsiella planticola). Возможно, данный сдвиг оптимума характерен именно для штамма ТСХА-91, выделенного из ризопланы огурца, выращиваемого в средней полосе России. Также впервые был обнаружен рост штамма Klebsiella planticola ТСХА-91 при +2 °C. Низкие температуры обычно не вызывают гибели микроорганизмов, а лишь задерживают их рост и размножение. В данном случае при довольно низком значении температуры отмечен рост исследуемого штамма. При +44 °C рост бактерий лимитировался.
Кроме того, при вступлении эндофитных ризобактерий, к которым относится Klebsiella planticola, в ассоциативный симбиоз с растениями повышается устойчивость обоих симбионтов к воздействию негативных условий окружающей среды (Whipps, 2001; Montesinos, 2003; Блинков, 2010). В связи с этим нами была поставлена задача изучить механизмы адаптации растений и диазотрофных бактерий, находящихся в микробно-растительных ассоциациях, к температурному стрессу и дефициту влаги.
2. Изучение влияния температурного фактора и обработки культурой бактерий на прорастание семян Cucumis sativus L.
Изучалось влияние температурного фактора и обработки культуральной жидкостью Klebsiella planticola ТСХА-91 различных разведений на прорастание семян Cucumis sativus L. гибридов F1 «Марьина роща», «Чистые пруды», «Эстафета» и «Зозуля».
В вариантах опыта с температурой +10 и +44С всхожесть была нулевой, так как значения абиотического фактора являлись критическими. В температурных условиях, ниже оптимальных для прорастания семян Cucumis sativus L (+18 С), наибольшая длина главного корня отмечена в контрольных вариантах опыта. При обработке семян культуральной жидкостью разведения 1:100 длина главного корня была чуть меньше по сравнению с контрольными образцами (на 0,45 см у гибрида Марьина роща, на 0,5 см у Чистых прудов, на 1,54 см у Эстафеты и на 1,1 см у Зозули).
В условиях оптимальной для прорастания семян C. sativus L. температуры (+28 С) наибольшая длина главного корня в вариантах опыта выявлена у гибрида F1 Зозуля. Стимуляция роста главного корня при обработке семян культуральной жидкостью разведения 1:100 по сравнению с контрольными образцами наблюдалась у гибридов F1 Марьина роща (на 1,76 см) и Чистые пруды (на 1,78 см длиннее).
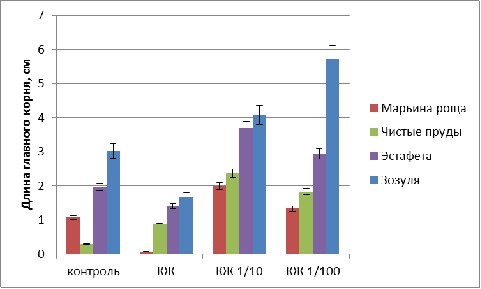
Рис. 1 Длина главного корня у гибридов огурца, пророщенных при +37 С
В условиях повышенной температуры (+37 С) длина главного корня проросших семян огурца всех изучаемых гибридов в вариантах с обработкой культуральной жидкостью разведения 1:10 и 1:100 была выше, чем в контрольных образцах (рис. 1).
Ассоциативные бактерии способны быстро колонизировать ризоплану растений и находят на корнях определённую экологическую нишу. Поэтому они менее подвержены воздействию неблагоприятных факторов окружающей среды. Для бактерий рода Klebsiella характерен высокий уровень приживаемости, в частности, за счёт их способности к инвазии (Бирюкова, 2001). Методами световой и трансмиссионной электронной микроскопии нами была подтверждена (Блинков, 2009) способность K. planticola к проникновению в ткани корня C. sativus L. (рис. 2). На срезах корней огурца (4 недели после инокуляции) в его проводящих тканях были обнаружены клетки бактерий, в том числе и K. planticola.
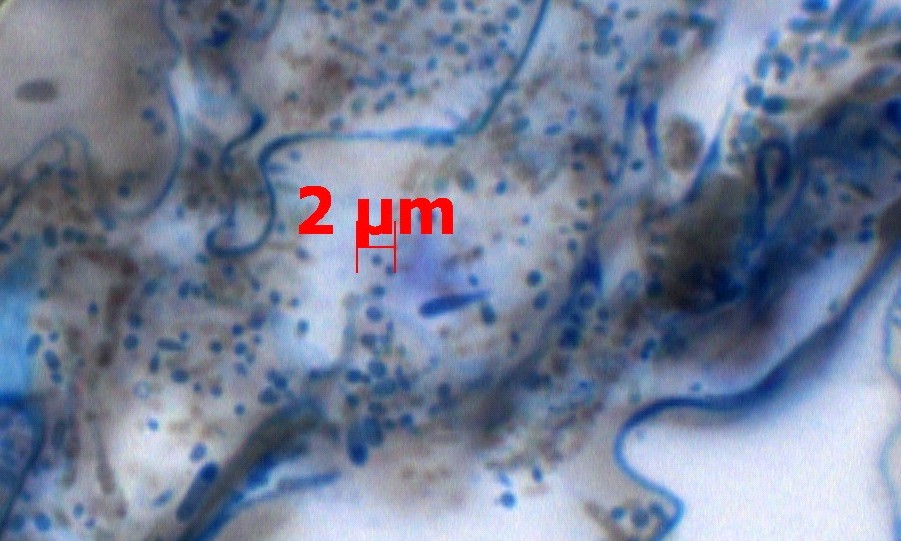
Рис. 2 Клетки бактерий в тканях корня огурца (данные световой микроскопии)
Нами было также показано (Селицкая и др., 2009), что обработка растений огурца сорта «Конкурент» культуральной жидкостью приводит к увеличению численности диазотрофов в ризоплане и филлосфере C. sativus L. в 10-1000 раз. На фоне пониженных температур (+12…15 °С) инокуляция Klebsiella planticola способствовала повышению численности диазотрофов в ризоплане во все сроки наблюдения как при оптимальном (85…90 % ПВ), так и при недостаточном (45…50 % ПВ) увлажнении почвы. В вариантах с инокуляцией при пониженных температурах численность диазотрофов в ризоплане и ризосфере огурца на 2-3 порядка выше по сравнению с контролем (при дефицитном увлажнении на порядок ниже, чем при оптимальном по понятным причинам). Данный факт можно объяснить способностью K. planticola ТСХА-91 к инвазии, а также синтезированием растениями огурца и бактериями некоторых веществ.
Поскольку положительное влияние на стимуляцию роста и развития семян в проведённых нами в ходе данного эксперимента и в предыдущих опытах (Колесников, Тимохина, 2010) оказывала инокуляция растений разведённой в 100 раз культурой микроорганизмов, была поставлена задача изучить механизм симбиотических реакций и выявить причину эффективности разбавлений жидкой формы биопрепарата.
3. Изучение влияния бактерий Klebsiella planticola ТСХА-91 и их метаболитов на рост и развитие растений в условиях дефицита влаги
Биометрические показатели характеризуют рост и развитие растений в определённых условиях, дают визуальное представление о том, насколько эти условия произрастания благоприятны для данного растения (Эдельштейн, 1964). Из большого разнообразия показателей нами были выбраны следующие: количество листьев, количество завязей, количество боковых побегов, длина боковых побегов, площадь листьев (нижний и верхний ярус), высота растений. В частности, площадь листьев является одним из показателей, по которому можно судить о потенциальной продуктивности растений (Третьяков, 2005).
В таблице 2 представлены данные, показывающие влияние бактерий K. planticola ТСХА-91 на рост и развитие гибрида «Марьина роща» в условиях разного увлажнения почвы на начало вегетации - 26-й день после посева.
Таблица 2. Влияние бактерий K. planticola ТСХА-91 и их метаболитов на рост и развитие растений огурца гибрида «Марьина роща» в условиях разного увлажнения почвы на 26-й день после посева
| Влажность почвы | Варианты | Показатели | |||
| Количество листьев на растении, шт. | Количество завязей на растении, шт. | Площадь листа, см2 | Высота растений, см | ||
| Оптимум (85-90% ПВ) | Контроль | 11,4±1,7 | 12±1,8 | 214,6±32,2 | 48,6±7,3 |
| K. planticola ТСХА-91 | 23,2±3,5* | 20,8±3,1* | 354,9±53,2* | 69,8±10,5* | |
| метаболиты | 13,8±2,1 | 8,2±1,2 | 229,5±34,4 | 48,2±7,2 | |
| Дефицит (45-50% ПВ) | Контроль | 11±1,6 | 8,2±1,2 | 167,9±25,2 | 42,6±6,4 |
| K. planticola ТСХА-91 | 14±2,1 | 8,4±1,3 | 266,2±39,9* | 48,2±7,2 | |
| метаболиты | 14,2±2,1 | 12,2±1,8 | 278,7±41,8* | 50,0±7,5* | |
| НСР05 | 4,3 | 3,6 | 53,4 | 6,7 | |
*- достоверные значения
В таблице 3 представлены данные, показывающие влияние бактерий K. planticola ТСХА-91 на рост и развитие гибрида «Марьина роща» в условиях разного увлажнения почвы на конец вегетации – 53-й день после посева.
Таблица 3. Влияние бактерий K. planticola ТСХА-91 и их метаболитов на рост и развитие растений огурца гибрида «Марьина роща» в условиях разного увлажнения почвы на 53-й день после посева
Из полученных данных можно сделать вывод о том, что инокуляция штаммом K. planticola ТСХА-91 оказывает на рост и развитие растений огурца заметный положительный эффект при оптимальном увлажнении почвы. При дефиците почвенной влаги заметного влияния данных бактерий на растения огурца не выявлено, что, видимо, связано с конкуренцией бактерий и растений за ресурсы.
Исследования показали положительное влияние метаболитов штамма K. planticola ТСХА-91 на содержание хлорофилла а и b в листьях растений огурца гибрида «Марьина роща». На 53-й день анализа при оптимальном увлажнении содержание составило: хлорофилл a – 14,95 мг/л, b – 6,21 мг/л, по сравнению с инокуляцией бактериями, где хлорофилл a – 10,54, b – 4,00.
Установлено положительное влияние инокуляции бактериями при оптимальной влажности на чистую продуктивность фотосинтеза: 0,42 г/м3 по сравнению с контролем, где этот показатель равен 0,18 г/м3. Высокие результаты отмечались и при обработке метаболитами данного штамма как в условиях оптимальной влажности, так и при дефиците влаги: 0,32 и 0,30 г/м3 по сравнению с вариантами, инокулированными бактериями при дефиците влаги, где показатель чистой продуктивности фотосинтеза равен 0,17 г/м3.
4. Изучение способности диазотрофной бактерии
Klebsiella planticola ТСХА-91 синтезировать ауксины
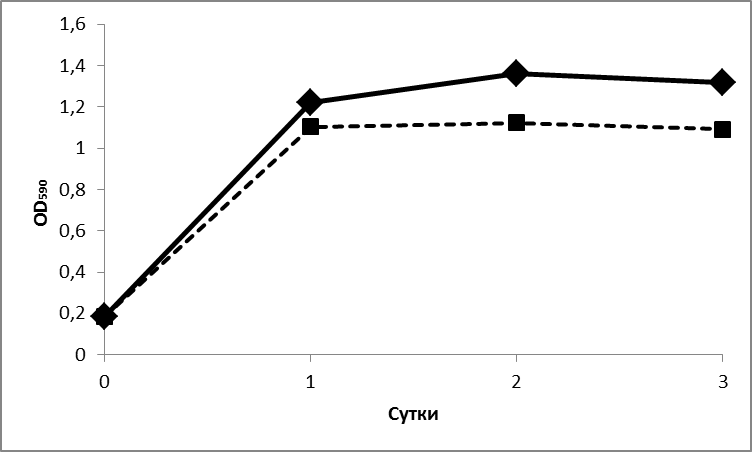
Для изучения влияния состава питательной среды на образование ауксинов К. planticola ТСХА-91, исследуемый штамм, известный своей азотфиксирующей активностью, культивировали на средах, не содержащих азота, и средах со связанным азотом в нитратной, аммонийной и органической формах. Максимального выхода биомассы (1,4-1,8 OD) культура достигала в первые сутки на богатой среде LB и ко вторым суткам при росте на минеральных средах с азотом (рис. 3). Добавление триптофана практически не влияло на развитие культуры на богатой аминокислотами и олигопептидами среде LB, в то время как на безазотной среде триптофан способствовал увеличению биомассы более чем вдвое, хотя максимальные значения не превышали 0,2 единиц.
Колориметрическое определение содержания ИУК в культуральной жидкости (КЖ) показало, что штамм Klebsiella planticola ТСХА-91 образует значительное количество ауксинов (рис. 4).
Из-за высокого содержания аминокислот (включая триптофан) в среде LB, базовый уровень биосинтеза ИУК в этих условиях (без триптофана) был максимальным (около 7 мкг/мл). На минеральных азотных средах образование ИУК без экзогенного триптофана составило 1,0 – 5,0 мкг/мл, а на безазотной среде ИУК вообще не детектировалась. При внесении в безазотную среду триптофана наблюдалось резкое увеличение биосинтеза ауксинов - до 85,5 мкг/мл.


А В

С D
Рис.3 Динамика роста K. planticola ТСХА-91 на средах различного состава
Обозначения: А) среда LB; В) безазотная среда К2/No; C) аммонийная среда К2; D) нитратная среда К2/NO3. Сплошная линия – среда без добавления триптофана, пунктирная линия – среда с добавлением 200 мкг/мл L-триптофана. Расхождения по значениям среди повторностей эксперимента составили менее 5%.
На среде с нитратным азотом и экзогенным триптофаном также отмечался высокий уровень синтеза веществ индольной природы (80,6 мкг/мл на вторые сутки). При выращивании культуры на минеральных средах без триптофана ауксины методом тонкослойной хроматографии обнаружены не были. При добавлении триптофана в среды в культуральной жидкости были обнаружены различные индольные соединения. Их концентрация и разнообразие зависели от используемого источника азота в среде. На безазотной среде ИУК не была основным компонентом, на средах с аммонийным и нитратным азотом ИУК являлась доминирующим индольным соединением. Внесённый в питательную среду ИАМ не вовлекался в биосинтез ИУК, в то время как экзогенный индолил-3-пируват в значительной степени метаболизировался (в соединение, сходное по Rf с индолил-3-ацетальдегидом - предшественником ИУК). Установление пути биосинтеза ИУК из L-триптофана штаммом K. planticola ТСХА-91 требует дальнейших исследований.


A B


C D
Рис. 4 Влияние экзогенного триптофана на образование ИУК Klebsiella planticola ТСХА-91 на средах различного состава
Обозначения: А) среда LB; В) безазотная среда К2/No; C) аммонийная среда К2; D) нитратная среда К2/NO3. Сплошная линия – среда без добавления триптофана, пунктирная линия – среда с добавлением 200 мкг/мл L-триптофана. Расхождения по значениям среди повторностей эксперимента составили менее 5%.

Рис. 5 Влияние культуральной жидкости бактерий, выращенных на разных средах, на корнеобразование черенков фасоли (слева направо: вода (контроль), КЖ (К2/No + Trp), КЖ (К2/NO3), КЖ (К2/NO3 + Trp)
Таблица 4. Влияние культуральной жидкости K. planticola ТСХА-91 на корнеобразование черенков фасоли (Phaseolus vulgaris)
| Вариант опыта | Содержание ИУК в КЖ (мкг/мл) | Высота стебля, на котором закладываются корни | Число корней на один черенок | |
| см | увел. в (раз) | |||
| Вода дистиллированная | - | 0,5±0,1 | 0 | 12,2±4,3 |
| КЖ (LB) | 7.1 | 4,3±0,5 | 8,5 | 7,5±5,6 |
| КЖ (LB, 1:50) | - | 3,4±1,5 | 6,8 | 10,4±2,8 |
| КЖ (LB + Trp) | 14.4 | 4,8±1,1 | 9,6 | 20,5±6,2 |
| КЖ (LB + Trp, 1:50) | - | 4,6±0,3 | 9,2 | 7,3±0,8 |
| КЖ (К2/No) | 0.2 | 2,7±1,5 | 5,4 | 6,8±1,3 |
| КЖ (К2/No + Trp) | 85.5 | 5,6±1,9 | 11,2 | 22,2±11,6 |
| КЖ (К2) | 1.0 | 3,3±0,3 | 12,3 | 20,8±6,6 |
| КЖ (К2 + Trp) | 4.9 | 5,6±1,3 | 11,2 | 29,2±9,3 |
| Ж (К2/NO3) | 4.9 | 3,4±1,5 | 6,8 | 21,4±13,1 |
| КЖ (К2/NO3 + Trp) | 80.6 | 7,8±0,6 | 15,6 | * |
| КЖ (К2/NO3 + Trp, 1:2) | - | 6,8±1,9 | 13,6 | 16,8±7,3 |
| КЖ (К2/NO3 + Trp, 1:5) | - | 7,8±1,4 | 15,6 | 39,6±14,1 |
Примечания к таблице: жирным шрифтом выделены варианты опыта с добавлением к среде экзогенного триптофана. Прочерк в графе «Содержание ИУК» - концентрацию ИУК не измеряли (для разведённых проб), либо она равно нулю (контроль). * - происходило расслаивание черенка из-за чрезмерной концентрации биологически активных веществ в КЖ. Доверительный интервал указан при Р=0.95.
Определение влияния ИУК на процесс корнеобразования у фасоли проводили согласно известной методике (Рубин, 1978). В контроле (на воде и на модификации среды К2 с нитратным азотом) «щётка корней» закладывалась у основания черенка. В вариантах, в которых присутствовал триптофан, высота закладки корней превышала показатели контрольных образцов (рис.5, табл.4). Вещества, содержащиеся в супернатанте бактерий, выращенных на среде К2/NO3 c триптофаном, активно стимулировали процесс закладки корней. Но, видимо, содержание ауксинов (более 80 мкг/мл) и других биологически активных веществ в исходной КЖ было чрезмерно высоким: по всей высоте черенка было множество «бугорков», соответствующих закладке корней, дальнейшее развитие которых, однако, не происходило. Более того, в некоторых местах стебель «разрывался» и растительные ткани расслаивались. В тоже время при разбавлении КЖ бактерий количество проросших корней и высота стебля, на котором они закладывались, увеличивались.
В экспериментах с гибридом огурца «Марьина роща» семена, обработанные разведённой в 100 раз культуральной жидкостью, и в течение недели хранившиеся при +12оС, на 5-е сутки после прорастания имели большую длину главного корня и высоту ростков (на 18 и 20 % соответственно), чем семена, также прошедшие холодовую обработку, но замоченные в воде. При этом в оптимальных условиях (+28оС) по всем биометрическим параметрам (длина главного корня, количество боковых корней, высота ростков) все семена показали сходные значения. Сухая биомасса корней огурца из опытного варианта (разведённая в 100 раз КЖ) также была больше по сравнению с контрольным (семена, замоченные в воде) на 42%, что подтверждает стимулирующее действие ауксинов на процесс корнеобразования, в то время как по биомассе зелёной части оба варианта имели сходные показатели (13,4 и 13,5 мг с одного растения соответственно). Во всех вариантах опыта количество боковых корней у растений, прошедших закаливание, было на 10-30% больше, чем у семян, прораставших при +28оС. Необходимо отметить, что биометрические показатели семян, замоченных в неразбавленной суспензии клеток, при обоих температурных режимах были ниже контрольных в среднем на 30%. Таким образом, обработка семян огурца культуральной жидкостью K. planticola ТСХА-91, выращенной на среде с нитратным азотом в разведении 1:100, приводит к значительному повышению экологической толерантности растений к действию температурного (холодового) стресс-фактора.
ВЫВОДЫ:
1. Впервые определена экологическая валентность штамма Klebsiella planticola ТСХА-91 по отношению к температурному фактору: оптимальной температурой является +28 °C, при +44 °C и ниже +2 °C рост бактерий лимитируется.
2. Показано, что в условиях повышенной температуры (+37 С) обработка семян огурца разведённой в 10 и 100 раз культуральной жидкостью стимулировала рост главного корня по сравнению с контрольными образцами в 1,5-2 раза. Это связано с особыми протекторными механизмами, которые запускаются при формировании симбионтами ассоциации и приводят к повышению экологической валентности видов по отношению к стрессовым факторам среды.
3.Установлено, что в условиях оптимального увлажнения (85%) инокуляция Klebsiella planticola стимулирует рост и развитие огурца и повышает урожайность гибрида «Марьина роща». Выявлены существенные отличия по высоте, площади, количестве листьев и плодов у растений, инокулированных бактериями, в сравнении с контрольными. В условиях дефицита влаги наблюдается существенное снижение продуктивности растений, однако инокуляция бактериями позволяет снизить негативное воздействие засухи: количество завязей и площадь листьев превышают контроль на 21 и 38% соответственно.
4. Обработка метаболитами бактерий в условиях дефицита влаги также влияла на показатели роста и развития растений: площадь листьев растений больше на 12,5 см2, а высота выше в 1,5 раза по сравнению с вариантами, обработанными K. planticola ТСХА-91. Обработка метаболитами приводит к увеличению содержания хлорофилла а и b в листьях растений огурца и повышает чистую продуктивность фотосинтеза, особенно при водном дефиците.
5. Впервые изучена способность Klebsiella planticola ТСХА-91 синтезировать индолил-3-уксусную кислоту и другие ауксины, качественный и количественный состав которых зависит от наличия триптофана и от источника азота в среде. Максимум выхода соответствует стационарной фазе развития культуры. Методом тонкослойной хроматографии установлено, что индолацетамидный путь не активен у данного штамма.
6. Произведена оптимизация питательной среды и условий культивирования, позволяющая увеличить биосинтез ауксинов. Показано, что добавление L-триптофана к минеральным средам значительно (до 85,5 мкг/мл) стимулирует биосинтез ауксинов (особенно в присутствии нитратного азота).
7. Биологическая активность ауксинов подтверждена в биотестах с черенками фасоли, высота закладки корней которых увеличивалась до 5 раз, а количество корней – до 3,5 раз.
8. В условиях низкотемпературного стресса показано протекторное влияние культуральной жидкости K. planticola ТСХА-91, проявившееся в стимуляции прорастания и развития семян Cucumis sativus L. Семена, обработанные КЖ, разведённой питательной средой в 100 раз, и подвергнутые недельному холодовому стрессу (+12оС) имели длину главного корня, количество боковых корней и высоту ростков, сходные с семенами, замоченными в воде и пророщенными при +28оС, а сухая биомасса корней была больше на 42%. Для применения Klebsiella planticola ТСХА-91 в качестве основы для биопрепарата необходимо учитывать мощный рост стимулирующий эффект, который оказывают на корни высших растений выделяющиеся вещества. В этой связи следует производить обработку семян или вносить данный препарат в прикорневую зону в разбавленном виде (1:100).
9. Результаты проведённых исследований позволяют выявить возможность применения биопрепаратов на основе Klebsiella planticola ТСХА-91 при выращивании рассады огурца. При планировании применения «ассоциативных» бактериальных удобрений необходимо учитывать характер предполагаемого действия стрессовых факторов.
Список работ, опубликованных по теме диссертации
1. Селицкая О.В. Влияние засухи и низких положительных температур на взаимодействие ассоциативных бактерий с растением огурца / Селицкая О.В., Самохин Л.В., Блинков Е.А. - Известия ТСХА, выпуск 4. - М.: Изд-во РГАУ - МСХА имени К.А. Тимирязева, 2009. - № 4.- С. 129-132.
2. Блинков Е. А. Влияние экологических факторов (температуры и влажности) на ассоциативный симбиоз Klebsiella planticola и Cucumis sativus L. // Сборник студенческих научных работ. Вып. 15. - М.: Изд-во РГАУ-МСХА имени К.А. Тимирязева, 2009. – С.119-122.
3. Селицкая О.В. Эффективность применения препаратов на основе ассоциативных бактерий в условиях экологического стресса / Селицкая О.В., Самохин Л.В., Блинков Е.А. - Современные проблемы физиологии, экологии и биотехнологии микроорганизмов: Всероссийский симпозиум с международным участием: Материалы. - М.: МАКС Пресс, 2009.- С.163.
4. Блинков Е.А., Самохин Л.В. Проект агроэкологической оптимизации применения уникальных биопрепаратов «Биоплант-К» и «Мизорин» в выращивании огурцов. - Перспективы развития инноваций в биологии: Материалы III Научно-практической конференции. - М.: МАКС Пресс, 2009.- С.24-26.
5. Селицкая О.В. Влияние температуры и влажности на ассоциативный симбиоз диазотрофных бактерий и растений огурца / Селицкая О.В., Самохин Л.В., Блинков Е.А. - Современное состояние и перспективы развития микробиологии и биотехнологии: Материалы VII Международной конференции (Минск, 31 мая-4 июня 2010 г.). - Минск: МИКРОБИО, 2010. - С. 251-253.
6. Блинков Е.А. Оптимизация применения «ассоциативных» бактериальных удобрений в сельскохозяйственной практике в условиях дефицитного увлажнения. - Актуальные аспекты современной микробиологии: VI молодёжная школа-конференция с международным участием. - М.: МАКС Пресс, 2010.- С.128-130.
7. Блинков Е.А. Ассоциативный симбиоз диазотрофных бактерий и растений огурца как способ адаптации к действию абиотических факторов окружающей среды. - Стратегия взаимодействия микроорганизмов и растений с окружающей средой: Материалы V Всероссийской конференции молодых учёных. - Саратов: Научная книга, 2010.- С. 111.
8. Блинков Е.А. Применение биопрепаратов на основе эндофитных ризобактерий в целях повышения адаптивности растений / Блинков Е.А., Селицкая О.В., Самохин Л.В. - Молодёжный научный экологический форум «Анализ причин и последствий засухи и пожаров 2010 года: приоритетные проблемы и пути их решения»: Сборник тезисов. – М.: Издательский Центр «СОЮЗ», 2011.–С. 3-4.
9. Блинков Е.А. Оптимизация применения «ассоциативных» бактериальных удобрений в выращивании огурцов. - Ломоносов 2011: XVIII Международная конференция студентов, аспирантов и молодых учёных; секция «Биология». – М.: МАКС Пресс, 2011. - С. 175-176.
10. Блинков Е.А. Взаимодействие ассоциативных диазотрофных бактерий с растениями. - Растения и микроорганизмы: сборник трудов Международной интернет-конференции. – Казань: Казанский университет, 2011. – С. 36-37.
11. Блинков Е.А., Самохин Л.В. Влияние ассоциативной азотфиксации на экологическую толерантность растений к стрессовым факторам. - Материалы XLVIII Международной научной студенческой конференции «Студент и научно-технический прогресс»: Биология / Новосибирск: Новосиб. гос. ун-т, 2011. – С. 60.
12. Селицкая О.В.Применение «ассоциативных» бактериальных удобрений в сельскохозяйственной практике в связи с меняющимися погодно-климатическими условиями / Селицкая О.В., Самохин Л.В., Блинков Е.А. - Доклады ТСХА: Сборник статей. Вып. 283. Часть I. М.: Изд-во РГАУ – МСХА имени К.А. Тимирязева, 2011. – С. 411-413.
13. Блинков Е.А. Экологическая ниша ассоциативных диазотрофных бактерий. - Актуальные аспекты современной микробиологии: VII молодёжная школа-конференция с международным участием. - М.: МАКС Пресс, 2011.- С.58-61.
14. Блинков Е.А. Ризосфера растений – «горячая точка» почвы. - Актуальные аспекты современной микробиологии: VIII молодёжная школа-конференция с международным участием. - М.: МАКС Пресс, 2012.- С.51-54.
15. Блинков Е.А. Биологически активные вещества, выделяемые ризосферными бактериями. - Химия биологически активных веществ: Межвузовский сборник научных трудов Всероссийской школы-конференции молодых учёных, аспирантов и студентов с международным участием. – Саратов: Изд-во «КУБиК», 2012. – С. 230-231.

