Активность тиреоидзависимых ферментов, энергетический обмен при гипотиреозе и его коррекции органоминеральным комплексом йодпектин
На правах рукописи
Лобырева Ольга Владимировна
АКТИВНОСТЬ ТИРЕОИДЗАВИСИМЫХ ФЕРМЕНТОВ, ЭНЕРГЕТИЧЕСКИЙ ОБМЕН ПРИ ГИПОТИРЕОЗЕ И ЕГО КОРРЕКЦИИ ОРГАНОМИНЕРАЛЬНЫМ КОМПЛЕКСОМ ЙОДПЕКТИН
03.01.04 – биохимия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Казань – 2013
Работа выполнена на кафедре биологической химии ГБОУ ВПО «Башкирский государственный медицинский университет Минздрава России» и на базе научно-исследовательской лаборатории «Пищевые технологии» филиала ГБОУ ВПО «Московский государственный университет технологий и управления им. К.Г. Разумовского» в г. Мелеузе.
Научный руководитель: заслуженный деятель науки РФ и РБ,
доктор медицинских наук, профессор
Камилов Феликс Хусаинович
Официальные оппоненты: Цейликман Вадим Эдуардович - профессор
дбн, заведующий кафедрой «Биологическая химия» ГБОУ ВПО "Южно –Уральский государственный медицинский университет". (г.Челябинск);
Мустафин Ильшат Ганиевича – профессор дмн, заведующийо кафедрой биохимии ГБОУ ВПО «Казанский государственный
медицинский университет», г.Казань.
Ведущая организация: Государственное бюджетное образовательное учреждение высшего профессионального образования «Тюменская государственная медицинская академия Министерства здравоохранения Российской Федерации».
Защита диссертации состоится 28 ноября 2013г. в 1300 часов на заседании диссертационного совета Д 212.081.08 при Казанском (Приволжском) федеральном университете по адресу: 420008, Республика Татарстан, г. Казань, ул. Кремлевская, д. 18, Казанский (Приволжский) федеральный университет, главное здание КФУ, аудитория 211.
С диссертацией можно ознакомиться в Научной библиотеке им. Н.И. Лобачевского при Казанском (Приволжском) федеральном университете.
Автореферат разослан «______»_______________ 2013 г.
| Ученый секретарь диссертационного совета, доктор биологических наук, профессор |  Абрамова З.И. Абрамова З.И. |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Дефицит йода в окружающей среде и обусловленные им заболевания формируют широкий спектр медико-социальных проблем во всем мире в связи с высокой распространенностью и серьезными клиническими последствиями (Дедов И.И. Проблемы эндокринологии. 2001. Т. 47, № 6. С. 6-12). Актуальность проблем йодного дефицита в России определяется наличием в большинстве регионов страны йоддефицитных заболеваний и низкой эффективностью профилактики эндемического зоба.
Заболевания щитовидной железы являются наиболее распространенной формой эндокринной патологии и охватывают большой контингент населения эндемических регионов, к числу которых относится и территория Республики Башкортостан. Несмотря на значительные успехи в области тиреоидологии, многие стороны механизмов формирования, профилактики и лечения йоддефицитных состояний не получили окончательного решения и остаются актуальными. Это обусловлено более широкой современной трактовкой йоддефицита, пониманием того, что недостаточность йода не только является основным этиологическим фактором эутиреоидного зоба, но и приводит к развитию целого ряда психосоматических заболеваний.
Применяемые в настоящее время способы восполнения дефицита йода в организме не лишены недостатков (Касаткина Э.П. Проблемы эндокринологии. 2009. Т. 55, № 1. С. 8-11). Так, установлено, что применение препаратов на основе неорганических соединений йода может сопровождаться развитием явлений гиперйодизации и индукцией процессов перекисного окисления с последующими морфологическими трансформациями в тиреоидной паренхиме (Герасимов Г.А. Клиническая тиреоидология. 2004. Т.2, № 3. С. 10-14). Использование препаратов на основе йодированных белков («Йодказеин») нередко сопровождается аллергическими реакциями (Терпугова О.В. Эндокринологические аспекты проблемы пищевых дисэлементозов и других пищевых дисбалансов: учеб. пособие. Ярославль: Александр Рутман, 2001. С. 37-38; Самохин В.Т. Профилактика нарушений обмена микроэлементов у животных. Воронеж: Воронежский государственный университет, 2003. 136 с.). К числу наиболее перспективных направлений в этой связи следует отнести исследование физиологической активности новых видов йодсодержащих соединений, в которых этот микроэлемент стабилизирован путем связывания с органическими матрицами, в частности, с полисахаридами растительного происхождения. Возможным преимуществом препаратов на основе органически связанных форм йода является обеспечение более адекватного усвоения этого микроэлемента и меньший риск развития гиперйодизации (Мамцев А.Н. Влияние йод-полисахаридных соединений на свободнорадикальные процессы в печени крыс. Уфа, 2006. С. 144-147; Мамцев А.Н. Влияние йодбиополимеров на процессы свободнорадикального окисления в модельных тест-системах. 2010. № 2. С. 61-66).
При исследовании тиреотропной активности потенциальных средств для коррекции йодного дефицита наряду с оценкой их влияния на профиль йодированных гормонов и тиреотропина в плазме крови, а также ультраструктуру щитовидной железы, особый интерес представляет и состояние тиреоидзависимых звеньев метаболизма в органах-мишенях йодированных гормонов. Этот методический прием ставит вопрос о выборе адекватной модели воспроизведения гипотиреоза и объекта исследования.
Действие тиреоидных гормонов носит многофункциональный характер. Среди широкого спектра эффектов влияния на взрослый организм наиболее специфичным можно считать контроль йодсодержащими гормонами энергетического режима клетки. Активность цитоплазматических и, особенно, митохондриальных ферментов окислительного метаболизма – дегидрогеназ и цитохромов, энергетический заряд, скорость дыхания – эти показатели являются чувствительными маркерами тиреоидного статуса (Антелава Н.А. Медицинские новости Грузии. 2001. № 4. С. 7-9). Очевидна сопряженность тиреоидного статуса и скорости оборота белка. Тиреоидные гормоны регулируют оборот белка на всех этапах – от контроля активности генома и рибосомального синтеза до скорости деградации. Последнее осуществляется, в том числе, и через контроль активности ферментов мочевинообразования (Смирнов А.Н. Злементы эндокринной регуляции: научное издание. М.: Гэотар-Медиа, 2006. 352 с.). Если влияние тиреоидных гормонов на энергетические процессы и синтез белка изучен довольно подробно, то до настоящего времени нет единого мнения о влиянии гормонов щитовидной железы на процессы свободнорадикального окисления. Тироксин и трийодтиронин относятся к соединениям, содержащим в своем составе фенольное кольцо, что позволяет предположить наличие у них собственно антиоксидантных свойств. Имеются и некоторые экспериментальные свидетельства о влиянии тиреоидных гормонов in vitro и in vivo на активность ферментов антиоксидантной защиты (Аметов А.С. Проблемы эндокринологии. 2007. Т.53, № 2. С.49-54).
В литературе практически отсутствуют сведения о влиянии йодполисахаридных комплексов, представляющих перспективный в отношении тиреотропной активности класс соединений, на состояние тиреоидзависимых звеньев метаболизма. Исследование тиреоидзависимых ферментов и реакций энергетического обмена в условиях гипотиреоза и при его коррекции йодполисахаридными соединениями имеет важное значение для экспериментальной и клинической тиреоидологии, в частности при оценке эффективности и безопасности их применения для коррекции йодного дефицита.
Цель работы. Оценка влияния йодпектина на морфофункциональное состояние гипофизарно-тиреоидной системы, активность тиреоидзависимых ферментов и энергетический обмен в печени крыс с экспериментальным гипотиреозом. Для реализации поставленной цели решались следующие задачи:
1. Исследовать активность сукцинатдегидрогеназы, малатдегидрогеназы, глюкозо-6-фосфатдегидрогеназы в печени крыс при коррекции экспериментального гипотиреоза йодпектином.
2. Оценить влияние йодпектина на активность аргиназы и глутаматдегидрогеназы в печени крыс при мерказолиловом гипотиреозе.
3. Изучить воздействие йодпектина на концентрацию окисленной и восстановленной форм никотинамидных коферментов (НАД+, НАДН), содержание АТФ при гипотиреозе у крыс и его коррекции йодпектином.
4. Определить влияние йодпектина на активность ферментов антиоксидантной системы – каталазы, глутатионпероксидазы и супероксиддисмутазы в печени крыс при экспериментальном гипотиреозе.
5. Установить направленность морфофункциональных изменений в щитовидной железе у крыс при коррекции гипотиреоза йодполисахаридным комплексом.
6. Провести сравнительный анализ содержания йода в йодпектине, йодказеине и образцах поваренной соли от разных производителей.
Научная новизна. Впервые в эксперименте показано корригирующее влияние йодпектина на активность тиреоидзависимых ферментов, концентрацию никотинамидных нуклеотидов, тканевой уровень АТФ в печени крыс с мерказолиловым гипотиреозом. Установлено, что мерказолиловый гипотиреоз сопровождается снижением активности малатдегидрогеназы, глутаматдегидрогеназы, глюкозо-6-фосфатдегидрогеназы, аргиназы и активацией сукцинатдегидрогеназы, а использование животными йодпектина способствует нормализации активности никотинамидных дегидрогеназ (МДГ, Гл-6-ФДГ) и повышению активности сукцинатдегидрогеназы и аргиназы по сравнению с интактными животными, характеризуя усиление процессов тканевого дыхания и метаболизма аминокислот.
Выявлено, что экспериментальная тиреоидная дисфункция по типу эндемического эффекта вызывает патохимические сдвиги в системе окислительного гомеостаза у крыс, характеризующийся снижением и процессов свободнорадикального окисления, и активности основных ферментов антиоксидантной защиты – супероксиддисмутазы, глутатионпероксидазы и каталазы. Использование йодполисахаридного комплекса у крыс восстанавливает интенсивность свободнорадикальных процессов в печени и способствует полной нормализации активности антиоксидантных ферментов.
Метаболические эффекты йодпектина сопряжены с восстановлением морфофункционального состояния щитовидной железы у крыс после экспериментального гипотиреоза.
Научно-практическая значимость работы. Проведенные исследования позволяют оценить влияние йодполисахаридных соединений на функциональное состояние тиреоидзависимых звеньев метаболизма в периферических тканях в условиях экспериментального гипотиреоза. Полученные результаты свидетельствуют о терапевтическом эффекте йодпектина для нормализации морфофункционального состояния щитовидной железы, метаболических сдвигов в системе окислительных процессов и энергетического обмена при гипотиреозе. Полученные результаты имеют фундаментальное значение для разработки и внедрения новых средств для профилактики йоддефицитных состояний.
Работа выполнялась в рамках государственной научно-технической программы Академии Наук Республики Башкортостан (2008 г): «Здоровье населения Республики Башкортостан: профилактика заболеваний, медицинские технологии, здоровый образ жизни» в рамках подпрограммы: «Состояние тиреоидзависимых ферментов и реакций энергетического обмена при введении биологически активных йодсодержащих органоминеральных соединений»; «Развитие научно-инновационной деятельности в сельском хозяйстве, биологии и в медицине. Медико-профилактические технологии оздоровления населения Республики Башкортостан» согласно госконтракта за № 290-ю от 04 апреля 2008 г и за № 19/2 М от 05 мая 2009 г соответственно.
Внедрение результатов исследования в практику. Материалы работы использованы при оформлении Патента на изобретение РФ № 2405385 от 10 декабря 2010 г «Йодсодержащая биологически активная добавка к пище и способ ее получения» и Патента № 2380984 от 10 февраля 2010 г «Биологически активная добавка к пище для профилактики йодной недостаточности».
Ряд положений, сформулированных в диссертации, внедрены в учебный процесс Филиала государственного бюджетного образовательного учреждения высшего профессионального образования «Московский государственный университет технологий и управления им. К.Г. Разумовского» в г. Мелеузе, кафедры биологической химии Государственного бюджетного образовательного учреждения высшего профессионального образования «Башкирский государственный медицинский университет Министерства здравоохранения Российской Федерации», Федерального государственного образовательного учреждения высшего профессионального образования Московская академия ветеринарной медицины и биотехнологии им. К.И. Скрябина, научно-практической деятельности ООО «Технопарк МГУТУ».
Йодсодержащий органоминеральный комплекс применяется для групповой профилактики йодной недостаточности детей младшего школьного возраста г. Мелеуза и Мелеузовского района, о чем получен акт внедрения.
Апробация работы. Основные положения работы доложены и обсуждены на Всероссийской научно-практической конференции «Интеграционные евразийские процессы в науке, образовании и производстве» (Кумертау, 2006); XII-й Международной научно-практической конференции «Стратегия развития пищевой промышленности» (Москва, 2006); V-й Международной научной конференции студентов и молодых ученых «Живые системы и биологическая безопасность населения» (Москва, 2006); Всероссийских научных конференциях «Инновации в интеграционных процессах образования, науки, производства» (Мелеуз 2007, 2008, 2009, 2010); XIII-й Международной научно-практической конференции «Стратегия развития пищевой промышленности» (Москва, 2007); Научной конференции с международным участием «Food sciense, engineering, and technologies 2009» (Болгария, Пловдив, 2009, 2010); Международной научно-практической конференции «Актуальные проблемы горно-металлургического комплекса Казахстана» (Караганда, 2009); Международной научно-практической конференции «Кадровое и научное обеспечение инновационного развития отрасли животноводства» (Казань, 2010); совместном заседании кафедр биологической химии, патофизиологии и эндокринологии ГБОУ ВПО «Башкирский государственный медицинский университет» Минздравсоцразвития России и научно-исследовательской лаборатории «Пищевые технологии» филиала «Московский государственный университет технологий и управления им. К.Г. Разумовского» в г. Мелеузе (Уфа, 2012); Научной конференции с международным участием «Науковi працi» (Украина, Одесса, 2012).
Публикации. Основные положения работы опубликованы в 23 научных статьях, из них 6 в рецензируемых журналах, рекомендованных ВАК для защиты докторских и кандидатских диссертаций, двумя патентами РФ на изобретение.
Положения, выносимые на защиту.
1. Гипотиреоз, вызванный введением мерказолила экспериментальным животным, характеризуется снижением в печени активности пиридинзависимых ферментов: малатдегидрогеназы, глутаматдегидрогеназы, глюкозо-6-фосфатдегидрогеназы, уровней АТФ и никотинамидных нуклеотидов на фоне активации сукцинатного пути окисления.
2. Экспериментальный гипотиреоз сопровождается нарушением в печени антиоксидантной защиты организма животных, снижая активность антиокислительных ферментов – супероксиддисмутазы, каталазы, глутатионпероксидазы.
3. Восстановление функции щитовидной железы применением йодпектина у крыс с экспериментальным гипотиреозом способствует нормализации в печени активности ферментов энергетического обмена и мочевинообразования, повышению уровней АТФ, никотинамидных нуклеотидов и активности ферментов антиоксидантной защиты.
4. Введение йодпектина ускоряет восстановление гистологической структуры щитовидной железы и содержания йодированных тиреоидных гормонов в периферической крови.
Структура и объем диссертации. Диссертация изложена на 161 странице машинописного текста. Состоит из введения, обзора литературы, материалов и методов исследований, результатов собственных исследований и их обсужения, заключения, выводов, практических рекомендаций, списка использованной литературы, приложений. Работа иллюстрирована 17 рисунками, 11 таблицами. Список литературы включает 348 источников (287 отечественных и 61 зарубежных авторов).
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследований
Настоящая работа выполнена на кафедре биологической химии ГБОУ ВПО «Башкирский государственный медицинский университет Министерства здравоохранения Российской Федерации» и в филиале ФГБОУ ВПО «Московский государственный университет технологий и управления им. К.Г. Разумовского» в г. Мелеузе на базе научно-исследовательской лаборатории «Пищевые технологии». Отбор животных в группы осуществлялся по принципу аналогов с учетом возраста, живой массы, упитанности, происхождения, породности и т.д. Опыты проведены на 96 лабораторных беспородных белых крысах-самцах половозрелого возраста массой 180-220 г, которые были разделены на 4 группы: 1-я – контрольная, у животных 2-й, 3-й и 4-й групп вызывался мерказолиловый гипотиреоз, руководствуясь подходами применявшимися в предыдущих исследованиях (Козлов В.Н. Ветеринарная медицина. 2005. № 1. С. 18-19; Козлов В.Н. Сибирский медицинский журнал. 2006. № 5. С. 27-30; Мамцев А.Н. Перспективы и развития пищевой промышленности России. Ренбург: ИПК ГОУ ОГУ, 2005. С. 405-407), позволившими разработать схему развития легкой формы гипотиреоза. Препарат вводили ежедневно в желудок крыс с помощью металлического зонда в дозе 2,5 мг/100 г массы тела в течение 3-х недель, затем животные 3-й группы в течение месяца находились на стандартной диете вивария, а животные 4-й группы в течение месяца получали йодобогащенный рацион – в пищу добавлялся анализируемый органоминеральный комплекс (йодпектин) в дозе, обеспечивающей суточную потребность крыс в йоде (от 2 до 3 мкг на 100 г массы тела). Способ получения йодпектина разработан коллективом сотрудников научно-исследовательской лаборатории «Пищевые технологии» филиала «МГУТУ им. К.Г. Разумовского» в г. Мелеузе в соавторстве с научными сотрудниками кафедры «Биологическая химия» «БГМУ Минздрава России» (патент РФ № 2265377 от 10 декабря 2005 г, патент РФ № 2380984 от 10 февраля 2010 г, патент РФ № 2405385 от 10 декабря 2010 г). Состав: пектин – 23,1-25,0 мас.%; йод кристаллический (I2) – 5,00-10,25 мас.%; йодид калия (KI) – 10,0-20,5 мас.%; вода дистиллированная – остальное. При проведении экспериментов полностью соблюдали положения Международной декларации о гуманном отношении к животным (Касаткина Т.Б., 2000) п. В конце опыта животных выводили из эксперимента одномоментным декапитированием под легким наркозом, извлекали для исследования щитовидную железу и печень.
В органоминеральных комплексах йодпектин и йодказеин определяли содержание йода с использованием метода инверсионной постояннотоковой вольтамперометрии с углеродным электродом на вольтамперометрическом анализаторе «Экотест-ВА» (Россия) по 3-х электродной схеме. Количество йода в образцах соли от разных производителей осуществляли методом, основанным на титровании йода, выделившегося при взаимодействии йодата калия и йодида калия в кислой среде, раствором серноватистокислого натрия в присутствии крахмала (ГОСТ 51575-2000).
В печени крыс определяли активность ферментов трикарбоновых кислот (СДГ и МДГ), пентозофосфатного пути окисления (Гл-6-ФДГ), реакции окислительного дезаминирования аминокислот (ГДГ), орнитинового цикла мочевины (аргиназа), концентрацию АТФ, НАД+, НАДН, интенсивность Fe-индуцированной хемилюминесценции, активность антиоксидантных ферментов (СОД, ГПО, каталаза). Ткань печени гомогенизировали на холоду в стеклянном гомогенизаторе с тефлоновым пестиком в 0,25 М сахарозе, содержащей 1мМ ЭДТА, 0,01 М трис-НСL (рН 7,4). Митохондриальную фракцию гепатоцитов получали методом дифференциального центрифугирования в рефрижераторной центрифуге. Суспензию митохондрий обрабатывали 0,1% раствором тритона Х-100 и использовали для определения активности МДГ (К.Ф. 1.1.37) по Ochoa S. (1955), СДГ (К.Ф. 1.3.99.1) по King (1965), ГДГ (К.Ф. 1.4.1.3) по методу, описанному Клюевой Н.Н. (1978). В цитоплазматической фракции гомогената печени исследовали активность Гл-6-ФДГ (К.Ф. 1.1.19) по Glock G, Me Lean P. (1953) и аргиназы (К.Ф. 3.5.3.1) по методу, описанному Гуртавенко В.М. и др. (1983), с определением уровня образующейся мочевины (реагенты фирмы «Lahema» Чехия).
Интенсивность хемилюминесценции изучали с помощью хемилюминомера ХЛ-003 (Россия) с автоматическим режимом измерения свечения и обработки полученных результатов (Фархутдинов Р.Р., Лиховских В.А. Хемилюминесцентные методы исследования свободнорадикального окисления в биологии и медицине. Уфа: БГМУ, 1995. 90 с.).
Активность каталазы (К.Ф. 1.11.1.6) в гомогенатах ткани печени оценивали по методу, описанному М.А. Королюком и соавт. (1988), СОД (К.Ф. 1.15.1.1) и ГПО (К.Ф. 1.11.1.9) и наборами реагентов «Ransod» и «Glutatione Peroxidase» фирмы «Randox Labor Ltd.».
Содержание АТФ определяли спектрофотометрически по нарастанию уровня НАДФН, используя ферментативный метод Lamprecht W., Trautschold I. (1965), уровни НАД+ и НАДН также – спектрометрически по изменению экстинкции поглощения при 340 нм с использованием этанола и алкагольдегидрогеназы, пирувата и лактатдегидрогеназы.
Содержание гормонов (оТ3, сТ4, ТТГ) определяли методом твердофазного иммуноферментного анализа с использованием тест-систем реагентов для определения концентрации гормонов крыс: оТ3, сТ4, ТТГ – наборами «ТироидИфа-трийодтиронин-01», «ТироидИфа-ТТГ-1», «ТироидИфа-свободный Т4» (ЗАО «Алкор Био», Санкт-Петербург) с помощью иммуноферментного автоматического анализатора УНИПЛАН (Россия).
Для характеристики гистологической структуры кусочки щитовидной железы фиксировали в 10 % нейтральном растворе формалина, делали общепринятую проводку и окрашивали срезы гематоксилином и эозином. Изучение микроскопических срезов осуществляли под микроскопом серии МС-300 (Австрия). Микрофотографирование производили на микроскопе МС-300 с помощью фотоаппарата Nikon Cool Pix 4500. Срезы окрашивали гематоксилином и эозином (Громов А.Г. Изъятие и заготовка органов и тканей для трансплантации // Судебно-медицинская экспертиза. 1992. № 3. С. 3-5).
Результаты исследований подвергали статистической обработке с использованием пакета программ Statistica 6.0 фирмы Soft с расчетом при нормальном распределении признака средней арифметической (М), средней ошибки арифметической (m) и t-критерия Стьюдента. Если распределение признака не подчиняется нормальному, использовали непараметрические методы – рассчитывали медиану (Ме), нижний и верхний квартили. Статистическую значимость различий признака между группами оценивали с помощью критерия Манна-Уитни (U) с поправкой Бонферрони. Статистически значимыми считали различия при р 0,05.
Результаты собственных исследований и их обсуждение
Активность тиреоидзависимых ферментов печени в условиях коррекции экспериментального гипотиреоза йодпектином. В таблице 1 представлены результаты исследований активности ферментов печени при развитии экспериментального гипотиреоза и введении животным в восстановительном периоде йодпектина.
Активность ферментов трикарбоновых кислот. Ферменты энергетического обмена являются звеном метаболизма наиболее чувствительным к изменениям тиреоидного статуса организма. При развитии мерказолилового гипотиреоза в печени крыс происходит снижение активности малатдегидрогеназы (МДГ) и повышение активности сукцинатдегидрогеназы (СДГ). Учитывая особую роль сукцинатного пути в адаптации митохондрий к гипоэргозу, полученные результаты показывают, что использованная модель гипотиреоза сопровождается универсальной компенсаторной реакцией митохондриальной дыхательной цепи с переключением на сукцинатный путь окисления (Кондрашова М.Н., 2000; Лукьянова Л.Д. Вестник Российской АМН. 2007. № 2. С. 3-10).
Таблица 1 – Активность ферментов в печени крыс при интоксикации
мерказолилом и коррекции гипотиреоза йодполисахаридным комплексом,
Ме [25 %; 75 %]; n = 12
| Ферменты | Группа животных | |||
| 1-я, контрольная | 2-я, экспериментальный гипотиреоз | 3-я, восстановительный период | 4-я, йодобогащенный рацион | |
| СДГ, нмоль/г·с | 9,9 [8,5; 11,8] | 16,2 [14,4; 17,0] р = 0,016 | 28,4 [25,3; 29,7] р = 0,028 р1 = 0,032 | 28,9 [26,0; 31,8] р = 0,028 р1 = 0,016 р2 = 0,291 |
| МДГ, нмоль/г·с | 2363 [2160; 2524] | 1675 [1438; 1748] р = 0,016 | 2211 [1868; 2448] р = 0,240 р1 = 0,179 | 3212 [3048; 3341] р = 0,028 р1 = 0,024 р2 = 0,029 |
| Гл-6-ФДГ, нмоль/мг·мин | 28,4 [26,0; 30,6] | 24,8 [24,0; 26,9] р = 0,082 | 29,5 [25,8; 30,1] р = 0,628 р1 = 0,342 | 35,7 [32,0; 38,9] р = 0,0317 р1 = 0,029 р2 = 0,095 |
| ГДГ, нмоль/г·с | 105,6 [92,4; 116,1] | 42,5 [39,4; 45,1] р = 0,036 | 116,0 [110,9; 128,9] р = 0,309 р1 = 0,008 | 125,6 [118,6; 142,2] р = 0,132 р1 = 0,008 р2 = 1,000 |
| Аргиназа, мкмоль/г·с | 1,32 [1,23; 1,46] | 0,41 [0,30; 0,56] р = 0,028 | 1,37 [1,23; 1,60] р = 0,868 р1 = 0,028 | 2,67 [2,25; 2,98] р = 0,028 р1 = 0,030 р2 = 0,028 |
Примечание: в данной и последующих таблицах р – различия с контрольной группой,
р1 – различия со 2-й группой, р2 – различия с 3-й группой.
Введение йодпектина в течение 30 дней после завершения интоксикации мерказолилом приводило к активации обеих исследованных дегидрогеназ цикла трикарбоновых кислот. Активность СДГ и МДГ в печени крыс, находившихся на йодобогащенном рационе, повысилась на 191,9 % и 35,9 % соответственно по отношению к группе клинически здоровых крыс.
Активность фермента пентозофосфатного пути окисления глюкозы в печени при гипотиреозе и его коррекции. Выраженное индуцирующее влияние оказывают тиреоидные гормоны на синтез ферментов пентозофосфатного цикла окисления глюкозы, в частности Гл-6-ФДГ. По данному пути поставляется восстановленный НАДФ, необходимый для биосинтеза жирных кислот, стероидов, холестерина и других соединений, а также процессов микросомальной детоксикации. Использованная модель мерказолилового гипотиреоза в эксперименте сопровождается некоторым снижением активности Гл-6-ФДГ. При оценке эффекта йодсодержащего рациона установлено корригирующее влияние йодпектина на активность глюкозо-6-фосфатдегидрогеназы. Активность ее у животных, получавших данный препарат, превосходила показатели контроля на 25,7 %.
Активность глутаматдегидрогеназы. ГДГ играет ключевую роль во взаимосвязи метаболизма аминокислот и общего пути катаболизма (Чиркин А.А. Биохимия: Учеб. руководство. М.: Мед. Лит, 2010. 624 с.). В условиях экспериментального гипотиреоза каталитическая активность ГДГ в печени снижалась более чем в 2 раза относительно контрольной группы. В восстановительном периоде наблюдалось повышение активности фермента до исходного уровня как при виварном питании, так и при обогащении рациона крыс йодполисахаридным комплексом. При этом активность фермента у животных 4-й группы несколько превышала таковую у крыс 3-й группы, характеризуя более интенсивный метаболизм аминокислот в печени «йодированных животных».
Таким образом, активность трех ферментов, имеющих в простетической группе НАД+ или НАДФ+, при гипотиреозе снижается, характеризуя нарушения в печени обмена, связанного с процессами первичного дегидрирования субстратов окисления, в то время как ФАД-зависимый путь окисления усиливается. Введение гипотиреоидным животным йодполисахаридного комплекса в восстановительном периоде приводит активации как пиридинзависимых, так и флавинового ферментов.
Активность аргиназы. Аргиназа является одним из ферментов, на экспрессию генов которых тиреоидные гормоны оказывают индуцирующий эффект. Фермент участвует в синтезе мочевины, катализируя расщепление аргинина до мочевины и орнитина. У животных, подвергнутых в течение 3-х недель интоксикации мерказолилом, активность аргиназы значительно снижается, составляя всего 31,1 % от активности у контрольных животных.
Через 30 дней после прекращения введения тиреостатика у животных 3-й группы, находившихся на виварном питании, наблюдается полное восстановление активности аргиназы. При обогащении рациона питания йодпектином в течение месячного восстановительного периода активность аргиназы в печени превышает уровень аналогичного показателя у контрольных крыс более чем 2 раза, свидетельствуя о более быстром купировании состояния гипотиреоза.
Содержание АТФ и никотинамидных нуклеотидов в печени крыс при коррекции гипотиреоза йодполисахаридным комплексом. Данные, полученные при исследовании дегидрогеназ цикла трикарбоновых кислот, подтверждаются результатами исследования АТФ и никотинамидных нуклеотидов. Мерказолиловый гипотиреоз у экспериментальных животных сопровождается статистически значимым падением в ткани печени АТФ (таблица 2).
Таблица 2 – Влияние йодполисахаридного комплекса на содержание в
печени АТФ и никотинамидных нуклеотидов при экспериментальном
гипотиреозе у крыс, Ме [25 %; 75 %]; n = 12
| Показатели | Группа животных | |||
| 1-я, контрольная | 2-я, экспериментальный гипотиреоз | 3-я, восстановительный период | 4-я, йодобогащенный рацион | |
| АТФ, мкмоль/г ткани | 2,47 [2,34; 2,71] | 1,91 [1,80; 2,13] р = 0,016 | 3,03 [2,63; 3,27] р = 0,029 р1 = 0,001 | 4,32 [3,85; 4,94] р = 0,008 р1 = 0,028 р2 = 0,021 |
| НАД+, мкмоль/г ткани | 0,347 [0,324; 0,411] | 0,132 [0,117; 0,159] р = 0,008 | 0,500 [0,414; 0,547] р = 0,035 р1 = 0,008 | 0,737 [0,721; 0,759] р = 0,002 р1 = 0,008 р2 = 0,008] |
| НАДН, мкмоль/г ткани | 0,183 [0,113; 0,217] | 0,253 [0,183; 0,254] р = 0,420 | 0,140 [0,125; 0,202] р = 1,000 р1 = 0,063 | 0,096 [0,070; 0,102] р = 0,008 р1= 0,008 р2 = 0,016 |
Примечание: в данной и последующих таблицах р – различия с контрольной группой,
р1 – различия со 2-й группой, р2 – различия с 3-й группой.
В восстановительном периоде в условиях общевиварного питания (3-я группа) наблюдается нормализация концентрации АТФ, а содержание животных на йодобогащенном рационе питания приводит к статистически выраженному увеличению продукции АТФ (4-я группа).
Об изменении процессов тканевого дыхания у подопытных животных свидетельствуют и результаты определения концентрации никотинамидадениндинуклеотида. Окисленная форма НАД+ при гипотиреозе статистически значимо снижается, в то время как восстановленная форма нуклеотида НАДН имеет тенденцию к повышению, что приводит к снижению окислительного потенциала и тканевого пула кофермента. Использование в восстановительном периоде йодполисахаридного комплекса способствует выраженному повышению как окислительного потенциала, так и общего содержания никотинамидадениндинуклеотидов (рис. 1).
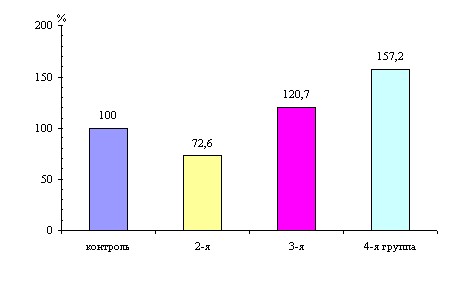
Рисунок 1. Изменение общего пула никотинамидадениндинуклеотидов в
ткани печени у крыс при экспериментальном гипотиреозе и введении
йодпектина (в % к контрольной группе, принятой за 100 %)
*) – статистические значимые изменения с группой контроля.
Интенсивность оксидативных процессов при экспериментальном гипотиреозе и его коррекции йодпектином.
Таблица 3 – Интенсивность хемилюминесценции в печени крыс при
экспериментальном гипотиреозе и содержании на йодобогащенном
рационе в восстановительном периоде, Ме [25 %; 75 %]; n =12
| Показатели, усл. ед. | Группа животных | |||||||
| 1-я, контрольная | 2-я, экспериментальный гипотиреоз | 3-я, восстановительный период | 4-я, йодобогащенный рацион | |||||
| Спонтанная светимость | 0,72 [0,59; 0,78] | 0,48 [0,41; 0,60] р = 0,0014 | 1,25 [0,84; 1,31] р = 0,0005 р1 = 0,0014 | 1,39 [1,30; 1,47] р = 0,0001 р1 = 0,0001 р2 = 0,0068 | ||||
| Амплитуда быстрой вспышки | 2,07 [1,91; 2,17 | 2,01 [1,88; 2,08] р = 0,378 | 3,84 [3,61; 3,99] р = 0,0001 р1 = 0,0001 | 4,45 [4,25; 4,74] р = 0,0001 р1 = 0,0001 р2 = 0,0001 | ||||
| Максимальная амплитуда медленной вспышки | 10,66 [10,35; 11,10] | 10,38 [10,23; 11,03] р = 0,376 | 13,41 [12,56; 13,91] р = 0,0001 р1 = 0,0001 | 13,66 [13,11; 14,12] р = 0,0001 р1 = 0,0001 р2 = 0,228 | ||||
| Светосумма свечения | 27,93 [25,93; 28,44] | 23,33 [22,00; 24,55] р = 0,095 | 30,13 [26,34; 36,15] р = 0,548 р1 = 0,309 | 38,41 [32,57; 39,85] р = 0,029 р1 = 0,011 р2 = 0,011 | ||||
Примечание: в данной и последующих таблицах р – различия с контрольной группой,
р1 – различия со 2-й группой, р2 – различия с 3-й группой.
В ходе проведения данного этапа исследований установлено, что у крыс с гипотиреозом развивались нарушения в механизмах окислительного гомеостаза, выражающиеся в ингибировании процессов свободнорадикального окисления (таблица 3). При введении мерказолила в печени подопытных крыс статистически значимо снижается спонтанная светимость, наблюдается тенденция к падению амплитуды быстрой вспышки и светосуммы свечения. Восстановительный период характеризуется повышением практически всех показателей хемилюминесценции ткани печени, а введение йодполисахаридного комплекса – более выраженным нарастанием, чем у животных третьей группы спонтанной светимости, амплитуды быстрой вспышки и светосуммы свечения, свидетельствующем о более высоком уровне окислительных процессов.
Исследование основных ферментов антиоксидантной защиты (таблица 4) выявило у животных с экспериментальным гипотиреозом статистическое значимое падение активности каталазы, некоторое снижение активности глутатионпероксидазы (ГПО) и супероксиддисмутазы (СОД). В восстановительном периоде у животных, которые находились на общевиварном питании (3-я группа) и при содержании крыс на йодобогащенной диете (4-я группа), активность СОД практически не претерпевает изменения. Активность ГПО и каталазы печени у крыс 3-й группы остается сниженной, а у животных 4-й группы превышает уровень контроля.
Таблица 4 – Активность ферментов антиоксидантной защиты печени крыс с
экспериментальным гипотиреозом и при его коррекции йодпектином,
Ме [25 %; 75 %]; n = 12
| Группа животных | Ферменты | ||
| СОД, Ед/мг белка | ГПО, Ед/мг белка | Каталаза, мкмоль/мг белка | |
| 1-я, контрольная | 22,7 [19,2; 24,0] | 0,72 [0,65; 0,75] | 3,12 [2,91; 3,24] |
| 2-я, экспериментальный гипотиреоз | 20,2 [17,8; 21,3] р = 0,060 | 0,53 [0,46; 0,59] р = 0,020 | 1,27 [1,00; 1,57] р = 0,004 |
| 3-я, восстановительный период | 21,2 [17,5; 23,1] р = 0,378 р1 = 0,219 | 0,58 [0,50; 0,61] р = 0,034 р1 = 0,443 | 2,37 [1,57; 3,36] р = 0,291 р1 = 0,030 |
| 4-я, йодобогащенный рацион | 20,9 [17,8; 22,7] р = 0,241 р1 = 0,443 р2 = 0,977 | 0,77 [0,67; 0,81] р = 0,143 р1 = 0,001 р2 = 0,002 | 3,478 [3,28; 3,65] р = 0,019 р1 = 0,001 р2 = 0,379 |
Примечание: в данной и последующих таблицах р – различия с контрольной группой,
р1 – различия со 2-й группой, р2 – различия с 3-й группой.
Таким образом, в состоянии гипотиреоза у экспериментальных животных в печени наблюдается некоторое снижение и процессов свободнорадикального окисления и активности ферментов антиоксидантной защиты – ГПО и каталазы. Стимуляция функционального состояния щитовидной железы йодполисахаридным комплексом повышает как интенсивность свободнорадикального окисления, так и активность ГПО и каталазы, формируя другой уровень оксидативного статуса ткани печени.
Состояние гипофизарно-тиреоидной системы крыс при гипотиреозе и его коррекции йодсодержащим полисахаридом. При интоксикации крыс мерказолилом наблюдалось достоверное снижение свободного тироксина на фоне повышения оТ3 и ТТГ (таблица 5). Наиболее информативным показателем функционирования гипофизарно-тиреоидной системы является ТТГ, уровень секреции которого компенсаторно повышается при гипофункции щитовидной железы. У животных, получавших йодполисахаридный комплекс, наблюдается снижение секреции ТТГ, содержание сТ4 превышает уровень контроля, а оТ3 практически не претерпевает существенных изменений. У животных, находившихся на общевиварном питании также наблюдаются положительные изменения по восстановлению функционального состояния гипофизарно-тиреоидной системы.
Таблица 5 – Содержание тиреотропного и тиреоидных гормонов в
периферической крови у подопытных крыс, Ме [25 %; 75 %]; n = 12
| Гормоны | Группа крыс | |||
| 1-я – контроль | 2-я – экспериментальный гипотиреоз | 3-я – общевиварный рацион | 4-я – рацион, обогащенный йодпектином | |
| ТТГ, мкМЕ/мл | 0,021 [0,018;0,027] | 0,034 [0,028; 0,040] р = 0,032 | 0,006 [0,004; 0,007] | 0,010 [0,005; 0,015] р1 = 0,045 |
| сТ4, пмоль/л | 10,51 [10,25; 10,70] | 4,29 [4,10; 4,85] р = 0,008 | 12,99 [12,27; 13,63] | 24,40 [21,60; 26,18] р1 = 0,000 |
| оТ3, нмоль/л | 2,32 [2,01; 2,41] | 2,67 [2,30; 2,94] р = 0,039 | 2,67 [2,59; 2,73] | 2,73 [2,57; 2,87] р1 = 0,478 |
Примечание: р – различия между 1-й и 2-й группами, р1 – различия между 3-й и 4-й
группами
На рисунке 2 представлены микрофотографии гистологической структуры щитовидной железы контрольных животных и крыс с экспериментальным гипотиреозом. У интактных крыс щитовидная железа содержит фолликулы округлой и овальной форм, в полости которых располагается коллоид. Стенки фолликулов образованы из тироцитов кубической формы с гомогенно распределенным хроматином. У животных с экспериментальным гипотиреозом выявляются деструктивные процессы. Фолликулы небольшого размера, часть из них лишена коллоида и заполнена прозрачной жидкостью. Тироциты сильно деформированы, имеют кубическую и плоскую формы, ядра клеток округлой или уплощенной формы, многие из них располагаются в области базальной мембраны.

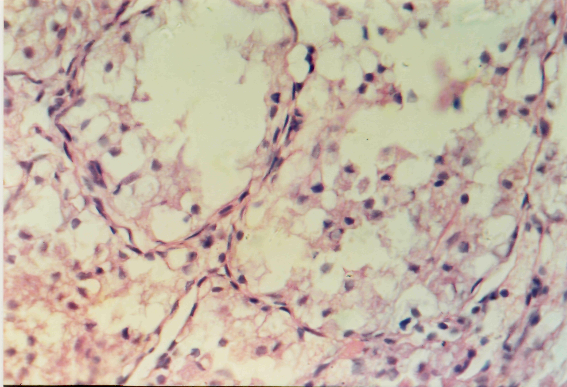
А Б
Рисунок 2. Гистологическая структура щитовидной железы крыс
контрольной группы (А) и животных с экспериментальным
гипотиреозом (Б): 1 – интрафолликулярный коллоид; 2 – гемокапилляры;
3 – одиночно расположенные клетки лимфоидной ткани; 4 – застойная гиперемия.
Окраска гематоксилином и эозином. Микрофото: ок. 10, об. 40.
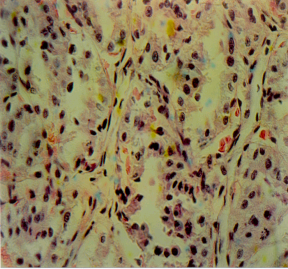
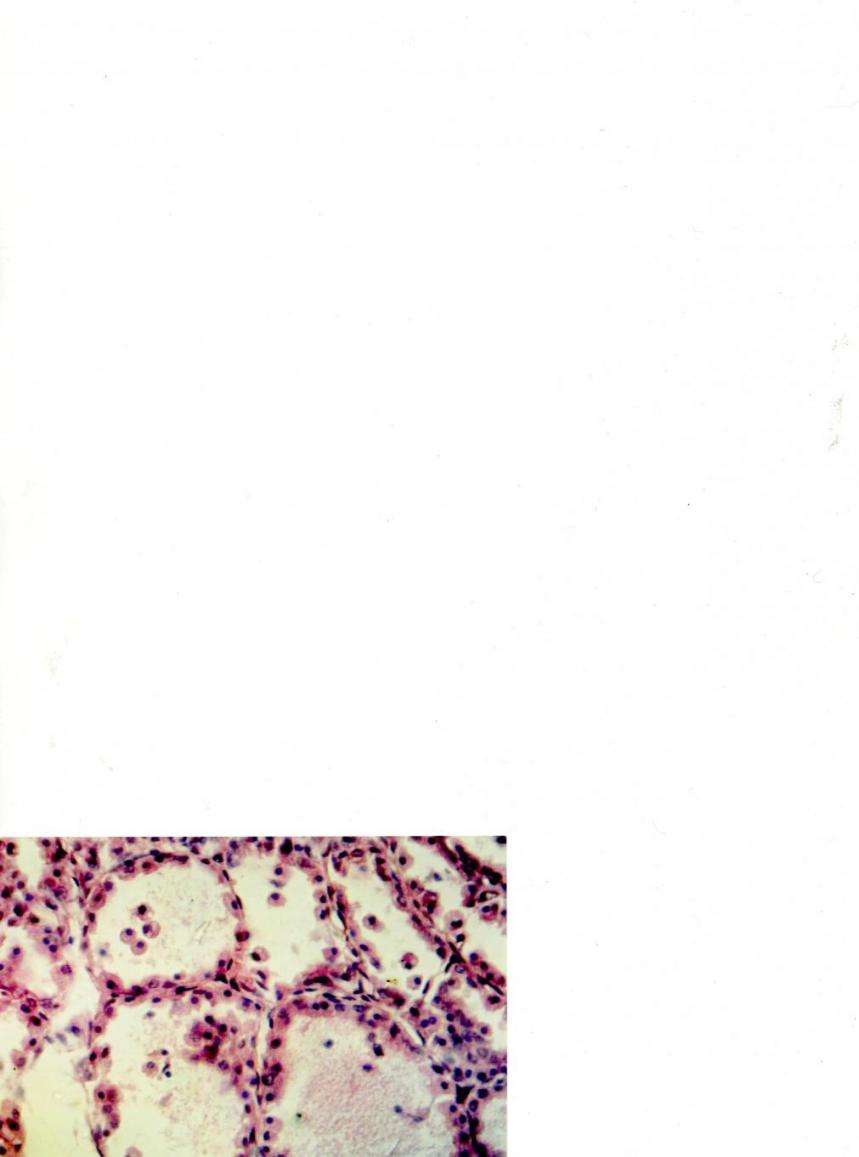
А Б
Рисунок 3. Гистологическая структура щитовидной железы гипотиреоидных
крыс, находившихся на общевиварном питании (А) и на йодобогащенном
рационе (Б): 1 – деформированные фолликулы; 2 – гемокапилляры; 3 – коллоид;
4 – интерфолликулярный эпителий. Окраска гематоксилином и эозином.
Микрофото: ок. 10, об. 40.
Гистоструктура щитовидной железы гипотиреоидных крыс, находившихся в восстановительном периоде на общевиварном рационе (3-я группа), характеризуется сохранением деструктивных изменений: при восстановлении общей структуры фолликулов интрафолликулярный коллоид практически отсутствует (рис. 3А). Отдельные тироциты оторваны от базальной мембраны и слущенные клетки располагаются свободно в полости фолликулов.
Йодобогащенный рацион в восстановительном периоде у животных с мерказолиловым гипотиреозом оказал позитивное влияние на восстановление гистоструктуры щитовидной железы (рис. 3Б). Хотя у животных этой группы еще сохраняются процессы деструкции, однако выявляются фолликулы, содержащие различное количество тиреоглобулина, наблюдается восстановление интерфолликулярной структуры. Эффективность коррекции экспериментального гипотиреоза у крыс йодполисахаридным комплексом также подтверждается данными иммуноферментного анализа крови на содержание гормонов гипофизарно-тиреоидной системы.
В целом, результаты проведенных исследований показали, что йодпектин представляется эффективным средством для коррекции метаболических сдвигов, развивающихся в печени при экспериментальном гипотиреозе, вызванном введением малых доз мерказолила. Коррекция гипотиреоза введением йодпектина повышает активность митохондриальных пиридиновых ферментов энергетического обмена и окислительного дезаминирования, гексозомонофосфатного окисления глюкозы, антиоксидантной системы и синтеза мочевины. В клетках печени животных при этом повышается концентрация АТФ, содержание и соотношение окисленных и восстановленных форм никотинамидных коферментов. Результаты исследований являются экспериментальной основой для разработки и внедрения нового класса йодсодержащих органических соединений в практику индивидуальной, групповой и массовой профилактики йоддефицитных состояний. Кроме того, содержание йода в составе органоминерального комплекса не снижается при хранении, при термической обработке пищи, при добавлении в молочные и хлебобулочные изделия. Так, определение содержания йода в поваренной соли от различных производителей и использованного в наших исследованиях йодполисахаридного комплекса йодпектин показало, что йодированная соль при регламентированных сроках хранения от 9 до 24 месяцев, даже при соблюдении условий хранения, теряет содержание йода на 20 % («Полесье», производитель Республика Беларусь), 34 % («Зимушка краса», производитель Нидерланды) и 45 % («Соль Илецкая», производитель Россия). Содержание йода в составе органоминеральных комплексов при хранении практически не меняется – уровень йода в йодпектине при завершении регламентированного срока хранения уменьшился лишь на 5,5 %.
ВЫВОДЫ
1. Гипотиреоз, вызванный воздействием мерказолила, сопровождается снижением в печени крыс активности пиридинзависимых окислительных ферментов – малатдегидрогеназы, глутаматдегидрогеназы и глюкозо-6-фосфатдегидрогеназы на фоне повышения активности флавинзависимой сукцинатдегидрогеназы. Введение животным с гипотиреозом органоминирального комплекса йодпектин приводит к повышению активности никотинамидных дегидрогеназ и активности сукцинатдегидрогеназы.
2. Экспериментальный гипотиреоз характеризуется выраженным снижением в печени активности аргиназы. Использование йодпектина у гипотиреоидных крыс способствует двукратному возрастанию активности аргиназы по сравнению с интактными животными.
3. Индуцированный мерказолилом гипотиреоз у крыс приводит к уменьшению в печени содержания никотинамидных коферментов, смещению соотношения НАД+/НАДН с превалированием восстановленной формы и снижению уровня АТФ. Введение этим животным йодпектина повышает уровень АТФ, суммарную концентрацию пиридиновых коферментов, изменяет их соотношение с увеличением окисленной формы.
4. Изменения окислительного гомеостаза в печени животных с гипотиреозом характеризуются снижением процессов свободнорадикального окисления и активности ферментов антиоксидантной защиты – глутатионпероксидазы и каталазы. Наибольшим изменениям при этом подвергаются спонтанная светимость, отражающая базальный уровень радикалообразования в ткани, и активность каталазы. При действии йодпектина наблюдается усиление процессов свободнорадикального окисления и повышение активности антиоксидантных ферментов.
5. Йодполисахаридный комплекс у гипотиреоидных животных способствует восстановлению морфофункционального состояния щитовидной железы, ускоряя процессы регенерации гистологической структуры и повышая уровень йодированных тиронинов в периферической крови.
6. В образцах йодированной поваренной соли разных производителей отмечается устойчивое снижение содержания йода на протяжении указанных сроков хранения. Пектин, как и казеин, обеспечивает стабилизацию неорганических форм йода.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
Наличие в большинстве регионов России йодного дефицита и низкая эффективность проводимой йодной профилактики свидетельствуют об актуальности разработки дополнительных методов восполнения йоддефицита на фоне массовой профилактики путем использования йодированной поваренной соли. Полученные результаты могут быть приняты как информационная база при разработке мероприятий по индивидуальной и групповой йодной профилактике в йоддефицитных регионах.
Список работ, опубликованных по теме диссертации
Статьи в ведущих научных журналах РФ, рекомендованных ВАК РФ
1. Камилов Ф.Х. Оценка биологической активности «йодполисахаридных соединений» на экспериментальной модели гипотиреоза / Ф.Х. Камилов, О.В. Лобырева // Достижения науки и техники АПК. – 2007. – № 12. – С. 37-39.
2. Мамцев А.Н. Оценка эффективности йодполисахаридного комплекса в коррекции окислительного метаболизма при экспериментальном гипотиреозе / А.Н. Мамцев, Ф.Х. Камилов, Г.М. Абдуллина, О.В. Лобырева // Вестник Оренбургского государственного университета. – 2009. – №12. – С. 118-121.
3. Лобырева О.В. Тиреоидный статус и его влияние на активность окислительных ферментов / Лобырева О.В. // Ученые записки Казанской государственной академии ветеринарной медицины. – 2010– Т. 201.. – С. 259-263.
4. Козлов В.Н. Результаты изучения тиреоидного статуса и физического развития детей препубертатного возраста / В.Н. Козлов, Е.В. Кузнецова, О.В. Лобырева // В мире научных открытий. – 2011. – № 5 (17). – С. 102-106.
5. Лобырева О.В. Активность антиоксидантных ферментов печени крыс при экспериментальном гипотиреозе и его коррекции йодсодержащим полисахаридным комплексом / О.В. Лобырева, Г.М. Абдуллина, Ф.Х. Камилов // Омский научный вестник. – 2011. – № 1 (104). – С. 92-94.
6. Камилов Ф.Х. Активность антиоксидантных ферментов и процессы свободнорадикального окисления при экспериментальном гипотиреозе и коррекции тиреоидных сдвигов йодированным полисахаридным комплексом / Ф.Х. Камилов, А.Н. Мамцев, В.Н. Козлов, Г.М. Абдуллина, О.В. Лобырева // Казанский медицинский журнал. – 2012. – Т. 93, № 1. – С. 116-119.
Патенты РФ
1. Патент RU 2380984 С1 А L. Биологически активная добавка к пище для профилактики йодной недостаточности и способ ее получения / А.Н. Мамцев, А.Н. Байматов, Ф.Х. Камилов, Е.Е. Пономарев, А.М. Нестерова, Л.И. Васильев, Л.Ф. Пономарева, О.В. Лобырева, В.Н. Козлов – Заявл. 08.07.2008; Опубл. 10.02.2010 // Бюл. – 2010. – № 4.
2. Патент RU 2405385 С2 А 23 L 1/30, 1/304. Йодсодержащая биологически активная добавка к пище и способ ее получения / А.Н. Мамцев, Л.И. Васильев, В.Н. Козлов, Р.М. Мухамедзянов, Е.Р. Мухамедзянова, Л.Ф. Пономарева, О.В. Лобырева. – Заявл. 24.02.2009; Опубл. 10.12.2010 // Бюл. – 2010. – № 34.
Статьи и тезисы в других изданиях
1. Мамцев А.Н. Перекисное окисление липидов у крыс при гипотиреозе и коррекции органически связанными формами йода / А.Н. Мамцев, В.Н. Козлов, Е.Е. Пономарев, О.В. Лобырева // Актуальные вопросы биологии и медицины: Сб. науч. труд. – М.-Уфа: РИО БашГу, 2006. – С. 106-109.
2. Мамцев А.Н. Интеграционные евразийские процессы в науке, образовании и производстве / А.Н. Мамцев, В.Н. Козлов, Е.Е. Пономарев, О.В. Лобырева // Мат. Всеросс. науч.-практ. конф. – Уфа: Гилем, 2006. – С. 144-146.
3. Мамцев А.Н. К вопросу о методах оценки биодоступности йодсодержащих биологически активных веществ / А.Н. Мамцев, Т.В. Зверева, В.Н. Козлов, О.В. Лобырева // Стратегия развития пищевой промышленности: Мат. XII Межд. науч.-практ. конф. – М., 2006. – С. 260-261.
4. Камилов Ф.Х. Функциональная активность ферментов цикла трикарбоновых кислот при гипо- и атиреозе / Ф.Х. Камилов, Р.Г. Юсупова, О.В. Лобырева // Инновации в интеграционных процессах образования, науки, производства: Сб. тр. Межд. научн. конф. – Уфа: Гилем, 2008. – С. 53-54.
5. Камилов Ф.Х. Активность митохондриальных ферментов энергетического обмена печени крыс при экспериментальном гипотиреозе и его коррекции йодполисахаридным комплексом «Йодпектин» / Ф.Х. Камилов, Г.М. Абдуллина, О.В. Лобырева // Инновации в интеграционных процессах образования, науки, производства: Сб. науч. тр. Межд. науч. конф. – Уфа: Гилем, 2009. – С. 36-38.
6. Мамцев А.Н. Влияние йодпектинового комплекса на процессы аэробного метаболизма углеводов в норме и в экспериментальных условиях / А.Н. Мамцев, Ф.Х. Камилов, Г.М. Абдуллина, В.Н. Козлов, О.В. Лобырева // Актуальные проблемы горно-металлургического комплекса Казахстана: Науч. тр. Межд. науч.-практ. конф. – Караганда: Изд-во КарГТУ, 2009. – Ч. 1. – С. 76-78.
7. Мамцев А.Н. Тиреоидная система и ее влияние на активность ферментов энергетического обмена. / А.Н. Мамцев, Ф.Х. Камилов, Г.М. Абдуллина, О.В. Лобырева // Scientific works «Food science, engineering and technologies 2010». – Plovdiv, 2010. – Vol. LVII, IS. 1. – Р. 432-436.
8. Лобырева О.В. Тиреоидный статус и его влияние на активность окислительных ферментов / О.В. Лобырева // Кадровое и научное обеспечение инновационного развития отрасли животноводства: Мат. Межд. науч. практ. конф.– Т. 201. – Казань, 2010. – С. 259-263.
9. Лобырева О.В. Интенсивность процессов перекисного окисления липидов в щитовидной железе у крыс при гипотиреозе и его коррекции / О.В. Лобырева // Проблеми харчових технологiй I харчування: Тез. докл. VII межд. науч.-практ. конф. – Донецк, 2011. – С. 242-245.
10. Mamtsev A.N. Enzymes activity of the cycle of ureapoiesis with rats a hypothyroidism and at its correction by organic forms of iodine / A.N. Mamtsev, F.Kh. Kamilov, V.N. Kozlov, E.V. Kuznetsova, O.V. Lobyreva // Scientific works «Food science, engineering and technologies 2011»: Plovdiv, 2011. – Vol. LVIII, IS. 1. – Р. 291-294.
11. Ивлева Л.П. Исследование антиокислительных свойств йодсодержащего органоминерального соединения в эксперименте / Л.П. Ивлева, А.К.Турсунбаева, О.В. Лобырева // Наука и образование – ведущий фактор стратегии «Казахстан -2030»: Тр. Межд. науч. конф. – Караганда: Изд-во КарГТУ, 2011. – Ч. IV. – С. 100-102.
12. Камилов Ф.Х. Активность ферментов пентозофосфатного цикла окисления глюкозы при гипотиреозе и его коррекции / Ф.Х. Камилов, А.Н. Мамцев, Г.М. Абдуллина, В.Н. Козлов, О.В. Лобырева // Науково фахове видання «ПРАЦI». –Мелiтополь: ТДАТУ, 2011. – Вып. 11, Т. 6. – С. 45-49.
15. Мехоношин Е.П. Вопросы профилактики йододефицитных состояний / Е.П. Мехоношин, Р.Т. Муллагулов, О.В. Лобырева // Инновационное развитие малых городов России: научный, технологический и образовательный потенциал: Мат. межд. науч.-практ. конф. – Уфа: АН РБ, Гилем, 2012. – С. 211-214.
13. Лобырева О.В. Влияние йодполисахаридного комплекса на содержание пиридиновых нуклеотидов и АТФ в печени крыс с мерказолиловым гипотиреозом / О.В. Лобырева, Г.М. Абдуллина // Здоровье человека в XXI веке: Сб. науч. статей IV-й Рос. науч.-практ. конф. – Казань: Изд-во Казанского медицинского университета, 2012. – С. 759-764.
14. Мамцев А.Н. Активность НАД(Ф)-зависимых дегидрогеназ в тканях печени при экспериментальной тиреоидной дисфункции / А.Н. Мамцев, О.В. Лобырева, Ю.В. Касьянов, Ф.Х. Камилов, Г.М. Абдуллина // Науковi працi: Одеськоi национальнi академii харчових технологiй. – Одесса, 2012. – В. 42, Т.2. – С. 134-136.
Перечень сокращений и условных обозначений
АТФ – аденозинтрифосфат
Гл-6-ФДГ – глюкозо-6-фосфатдегидрогеназа
ГДГ – глутаматдегидрогеназа
ГПО – глутатионпероксидаза
МГУТУ – Московский государственный университет технологий и
управления
МДГ – малатдегидрогеназа
НАД+ – никотинамидадениндинуклеотид окисленный
НАДН – никотинамидадениндинуклеотид восстановленный
НАДФ+ – никотинамидадениндинуклеотидфосфат окисленный
НАДФН – никотинамидадениндинуклеотидфосфат восстановленный
оТ3 – общий 3,5,3/-трийодтиронин
СДГ – сукцинатдегидрогеназа
СОД – супероксиддисмутаза
сТ4 – свободный тетрайодтиронин, свободный тироксин
ТТГ – тиреотропный гормон
у.е. – условные единицы
ХЛ – хемилюминесценция
ЩЖ – щитовидная железа

