Роль индикации отдельных специфических маркеров вируса гепатита в в обеспечении вирусной безопасности препаратов иммуноглобулинов - аллергология и иммунология
На правах рукописи
МОИСЕЕВА МАРИНА АЛЕКСАНДРОВНА
РОЛЬ ИНДИКАЦИИ ОТДЕЛЬНЫХ СПЕЦИФИЧЕСКИХ МАРКЕРОВ ВИРУСА ГЕПАТИТА В В ОБЕСПЕЧЕНИИ ВИРУСНОЙ БЕЗОПАСНОСТИ ПРЕПАРАТОВ ИММУНОГЛОБУЛИНОВ
- - Аллергология и иммунология
03.00.06 - Вирусология
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Москва - 2006
Работа выполнена в ФГУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Роспотребнадзора и филиале ФГУП «НПО «Микроген» МЗ РФ «Нижегородское предприятие по производству бактерийных препаратов «ИмБио»
Научные руководители:
доктор биологических наук, профессор В.В. Анастасиев
кандидат биологических наук Н.В. Зубкова
Официальные оппоненты:
доктор медицинских наук, профессор М.И. Михайлов
доктор биологических наук А.Г. Лютов
Ведущая организация: ФГУН «Государственный научно-исследовательский институт стандартизации и контроля медицинских биологических препаратов имени Л.А.Тарасевича» Роспотребнадзора.
Защита диссертации состоится «___» _____________2006 г. в «___» часов на заседании Диссертационного Совета К 208.046.01 при ФГУН «Московский НИИ эпидемиологии и микробиологии им. Г.Н. Габричевского» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по адресу: 125212, г. Москва, ул. Адмирала Макарова, д.10.
С диссертацией можно ознакомиться в библиотеке ФГУН МНИИЭМ им. Г.Н. Габричевского Роспотребнадзора.
Автореферат разослан «___»_________2006 г.
Ученый секретарь
Диссертационного совета
кандидат медицинских наук Л.И. Новикова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Вирусная безопасность препаратов из плазмы крови обеспечивается многосту-пенчатым комплексом мер, включающих: отбор доноров; проверку индивидуаль-ных порций плазмы на отсутствие вирусных маркеров; введение в технологичес-кий процесс стадий инактивации вирусов и контроль готовых продуктов. Для обна-ружения маркеров вирусных инфекций в плазме и препаратах крови в настоящее время используется иммуноферментный анализ (ИФА) и полимеразная цепная реакция (ПЦР). Эти методы основаны на разных принципах обнаружения возбуди-теля и взаимно дополняют друг друга.
Однако несмотря на такой контроль сохраняется риск инфицирования пулов плазмы вирусом гепатита В (Kleinman S.H. et al., 2005; Alvarez do Barrio M. et al., 2005; Soldan K. et al. 2005). Это связано с широким распространением заболевания, малой инфицирующей дозой и высокой устойчивостью вируса гепатита В (ВГВ). Для снижения этого риска рекомендовано расширить перечень обязательных тес-тов при обследовании доноров и контроле готовых продуктов, в частности Всемир-ной организацией здравоохранения (ВОЗ) рекомендовано проводить контроль уровня антител к НВsAg (анти-HBs), концентрация которых в препаратах иммуно-глобулинов нормируется. Введение этого дополнительного контроля в нашей стра-не сдерживается отсутствием отечественных тест-систем для количественного оп-ределения анти-HBs. Как показал многолетний опыт, анти-HBs являются факто-ром защиты. Однако связывание анти-HBs с HBsAg может влиять на результаты анализа, экранируя HBsAg в составе иммунных комплексов.
Учитывая погрешности лабораторной диагностики (Джумагулова А.Б. и др., 2001; Нетёсова И.Г. и др., 2005) нерешённой остаётся также проблема по созданию алгоритма тестирования пулов плазмы для фракционирования и препаратов имму-ноглобулинов. В монографии «Плазма человека для фракционирования» в Евро-пейской фармакопее 4-го издания предусмотрено тестирование первого гомоген-ного пула плазмы на HВsAg. Пул плазмы считается пригодным для дальнейшей ра-боты, если в нём не выявлен HВsAg. Национальная фармакопейная статья этого требования не предусматривает. Поэтому усовершенствование алгоритма обсле-дования на присутствие маркеров вируса гепатита В пулов плазмы для фракциони-рования, используемых для получения препаратов иммуноглобулинов, является актуальным.
Цель исследования
Определить оптимальный алгоритм тестирования пулов плазмы для фракцио-нирования и препаратов иммуноглобулинов на HBsAg, анти-HBs и ДНК ВГВ для обеспечения вирусной безопасности готовых препаратов в отношении гепатита В.
Задачи
1. Оценить влияние иммунной нейтрализации на обнаружение HBsAg методом ИФА и количественно охарактеризовать способность специфических антител экранировать НВsAg в пулах плазмы для фракционирования и в препаратах иммуноглобулинов.
2. Изучить влияние процесса формирования иммунных комплексов HBsAg/анти-HBs на возможность выявления ДНК ВГВ.
3. Разработать иммуноферментную тест-систему для количественного определения анти-НВs.
4. Определить уровень анти-НВs в индивидуальных образцах плазмы крови, пулах плазмы для фракционирования и препаратах иммуноглобулинов.
Научная новизна
Изучена эффективность выявления НВsAg в пулах плазмы для фракционирования и препаратах иммуноглобулинов. Установлено, что одним из основных факторов снижения эффективности выявления HBsAg методом ИФА в пулах плазмы для фракционирования и препаратах иммуноглобулинов является иммунная нейтрализация HВsAg антителами. В опытах in vitro показано, что в оптимальных температурных условиях при равновесной концентрации антигена и антител в системе достигается наиболее полная иммунная нейтрализация. В этом случае анти-НВs в количестве 1 МЕ способны связывать не менее 50 нг НВsAg.
Исследовано влияние процесса формирования иммунных комплексов HBsAg/анти-HBs на возможность выявления HBsAg и ДНК ВГВ. Продемонстрировано, что процесс формирования иммунных комплексов не влиял на эффективность выявления генома вируса гепатита В методом ПЦР. Разработана иммуноферментная тест-система для количественного определения анти-НВs и рабочий стандарт для калибровки с концентрациями 10, 50 и 100 МЕ/л, для стабилизации которого использована мальтоза.
Разработан оригинальный способ очистки HВsAg из сформированного иммунного комплекса HBsAg/анти-HBs.
Практическая значимость
В результате проведённых исследований разработана технология производства иммуноферментной тест-системы для количественного определения антител к поверхностному антигену вируса гепатита В. Для упрощения расчета количествен-ного содержания антител наряду с традиционным использованием калибровочного графика предложена формула, позволяющая определять содержание анти-НВs только по одному контрольному образцу с концентрацией антител (50 МЕ/л). Тест-система успешно прошла апробацию на базе цеха гаммаглобулинов Нижего-родского филиала ФГУП «НПО «Микроген» и государственные испытания в ФГУН ГИСК им. Л.А. Тарасевича. Проект нормативной документации находится на утверждении в Фармакопейном Государственном комитете. На изобретение «Тест-система для определения анти-HBs в биологическом образце» получена приоритетная справка № 2005107749 от 21.03.05. Сравнение разработанного диагностического набора с зарубежными аналогами показало высокую специ-фическую активность разработанной тест-системы и целесообразность её исполь-зования для количественного определения анти-НВs в плазме (сыворотке) крови при обследовании доноров, для определения напряжённости иммунитета, а также для определения соответствия препаратов иммуноглобулинов стандартам ВОЗ.
В фармакопейную статью предприятия на «Имбиоглобулин» (ФСП 42-0504-4266-04) внесены дополнительные показатели, улучшающие безопасность препарата: контроль уровня антител к поверхностному антигену вируса гепатита В.
Основываясь на изученных закономерностях «экранирования» НВsAg специ-фическими антителами, показано, что определение НВsAg не может считаться достаточным критерием оценки вирусной безопасности препаратов иммуноглобу-линов. Рекомендовано внести дополнение в алгоритм мониторинга препаратов им-муноглобулинов – определение анти-HBs. В случае выявления концентрации анти-тел, не соответствующей международным требованиям, необходимо проводить тестирование препаратов иммуноглобулинов на ДНК ВГВ методом ПЦР.
Положения, выносимые на защиту
1. Экспериментальные данные, свидетельствующие об эффективности связывания HBsAg специфическими антителами, содержащимися в пулах плазмы для фракционирования и препаратах иммуноглобулинов.
2. Алгоритм контроля плазмы для фракционирования и препаратов иммуноглобулинов с целью снижения риска передачи вируса гепатита В.
3. Технология изготовления иммуноферментной тест-системы для количественного определения антител к поверхностному антигену вируса гепатита В.
Апробация работы
Результаты работы представлены на 10-й Международной конференции «СПИД, рак и родственные проблемы» (С.-Петербург, 2002); на II научной конференции с международным участием «Проблемы инфекционной патологии в регионах Сибири, Дальнего Востока и Крайнего Севера» (Новосибирск, 2002); на международном конгрессе «Ликвидация и элиминация инфекционных болезней – прогресс и проблемы» (С.-Петербург, 2003); на Всероссийской научной конференции молодых учёных «Актуальные вопросы инфекционной патологии человека, клинической и прикладной иммунологии» (Уфа, 2004); на научной конференции, посвящённой 75-летию Нижегородского НИИЭМ (Н.Новгород, 2004); на VI Российской научно-практической конференции с международным участием «Вирусные гепатиты – проблема эпидемиологии, диагностики, лечения и профилактики» (Москва, 2005). Апробация диссертации состоялась на заседании межлабораторного семинара Нижегородского НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной с участием сотрудников Нижегородского филиала ФГУП «НПО «Микроген» 24 ноября 2005 г.
Публикации
По теме диссертации опубликовано 11 печатных работ.
Структура и объём диссертации
Диссертационная работа в объёме 124 листа состоит из введения, обзора ли-тературы, описания материалов и методов исследований, собственных результатов и их обсуждения, заключения, выводов и списка литературы. Диссертация иллюстрирована 12 рисунками и 15 таблицами. Библиографический указатель включает 175 источников литературы (59 отечественных и 116 иностранных).
Работа выполнена в отделении НВ-диагностикумов цеха диагностических препаратов Нижегородского филиала ФГУП «НПО «Микроген» (рук. Зубов С.В.)
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
В работе были использованы следующие материалы: плазма донорская (n=8570), полученная со станций переливания крови Приволжского федерального округа; пулы плазмы для фракционирования объёмом 5,0+0,5 л (n=443), производственные пулы (n=84), модельные пулы плазмы для фракционирования, контаминированные HBsAg (n=60); образцы плазмы донорской (n=100), отбракованной по наличию HВsAg на 5 станциях переливания крови Приволжского федерального округа (гг.. Нижний Новгород, Дзержинск, Чебоксары, Канаш, Киров); образцы сыворотки крови детей, иммунизированных против гепатита В (n=141), полученные в Областном вирусологическом центре г. Нижнего Новгорода; коммерческие препараты иммуноглобулина нормального человеческого для внутримышечного и внутривенного введения (195 серий) отечественных и зарубежных производителей; раствор альбумина 10 %; рекомбинантный поверхностный антиген вируса гепатита В субтипов ay и ad (НПК «Комбиотех», г.Москва).
Антигенные и антительные маркеры вируса гепатита В определяли методом ИФА с помощью диагностических иммуноферментных тест-систем отечественного производства: «ИФА-HBsAg», «ИФА-НВе» (Нижегородский филиал ФГУП «НПО «Микроген», г. Нижний Новгород), «ИФА-HВsAg/м», «ИФА-анти-HBs» (НПО «Диагностические системы», г. Нижний Новгород), «ВектогепВ-HBs-антиген», «ВектоHBsAg-антитела-стрип», «ВектоHBсAg-антитела-стрип» (ЗАО «Вектор-Бест», г. Новосибирск), а также тест-системы для количественного определения антител к поверхностному антигену вируса гепатита В зарубежного производства: «MONOLISA anti-HBs 3.0» (фирма «BIO-RAD», Франция) в соответствии с инструкциями по применению. Регистрацию результатов проводили с помощью анализатора иммуноферментного «SUNRISE» фирмы ТECAN (Австрия). Количественное определение НВsAg в исследуемых образцах проводили методом ИФА с использованием отраслевого стандартного образца HВsAg вируса гепатита В «ОСО-HВsAg» (ОСО 42-28-311-03П) в программе Microsoft Excel.
Определение ДНК ВГВ в плазме, содержащей HВsAg, и в модельных образцах проводили методом полимеразной цепной реакции (ПЦР). Раздел работы был выполнен на базе Нижегородского НИИЭМ им. академика И.Н. Блохиной. Выражаем глубокую благодарность заведующему лабораторией молекулярно-генетических методов надзора за инфекционными заболеваниями к.б.н. Мазепе В.Н. за оказанную помощь и консультации. Раздел работы по определению ДНК ВГВ методом ПЦР в режиме реального времени был выполнен на базе Центрального НИИ эпидемиологии Минсоцздрава РФ (г. Москва). Выражаем глубокую благодарность заведующему НПЛ ФНМЦ СПИД Минсоцздрава РФ Шипулину Г.А. за оказанную помощь и консультации.
При разработке иммуноферментной тест-системы для количественного определения анти-HBs в качестве химических компонентов использовали фосфатно-солевой раствор (ФСР-Т), содержащий 0,9 % NaCl, 0,1 % Na2HPO4, 0,1 % твин-80; раствор 3,3’,5,5’-тетраметилбензидина (ТМБ); цитратный буферный раствор (рН 3,9-4,1), содержащий 0,015 % перекиси водорода; 1 М раствор кислоты серной (стоп-реагент).
При получении очищенного HВsAg в качестве исходного материала использовали плазму крови доноров-антигеноносителей с титром HBsAg 1:2000 и выше. Титр HBsAg определяли при помощи реакции обратной пассивной гемагглютинации (РОПГА) с использованием эритроцитарного диагностикума «РОПГА-HВsAg» (Нижегородский филиал ФГУП «НПО «Микроген»). HВsAg получали двумя способами: физико-химическим способом [Михайлов М.И., 1980] и разработанным с нашим участием методом осаждения иммунных комплексов. Концентрацию HBsAg в очищенном препарате определяли спектрофотомет-рическим методом по формуле: Е1 мг/мл, 280 нм = 3,76 [Bourbonnais R. et al., 1975].
При изготовлении иммуносорбента применялся метод «пассивной» адсорбции [Стендифер Д.К., 1988]. В качестве твёрдого носителя использовали планшеты полистироловые для биохимических исследований отечественного производства «ГосНИИ «Медполимер», ООО «Биомедикал» (г. Москва) и планшеты фирмы «Nunc» (Дания); выделенный из плазмы крови доноров-вирусоносителей НВsAg и рекомбинантный НВsAg (субтипы ay и ad) (НПК «Комбиотех», г. Москва).
Конъюгат HВsAg с пероксидазой хрена RZ 3.0 (фирмы «Сигма», США) получали перйодатный методом [Егоров А.М., 1991]. Полученный конъюгат хранили в виде 10-кратного концентрата в 50%-ном растворе глицерина с добавлением сыворотки крови доноров.
Для получения контрольного отрицательного образца (К-) нормальную донорскую плазму (не содержащую маркеров вируса гепатита В, антител к ВИЧ-1,2 и к вирусу гепатита С) инактивировали прогреванием, добавляли трихлорметан и центрифугировали в течение 1 ч при 18000 об/мин. В качестве консерванта использовали фенол.
Для получения контрольных положительных образцов использовали нормальную донорскую плазму, в которую добавляли иммуноглобулин человека нормальный для внутривенного введения (производства Нижегородского филиала ФГУП «НПО «Микроген», ФСП 42-0100178901). В качестве стабилизатора вносили 2-10 % мальтозы. В качестве стандарта для определения концентрации анти-HBs в контрольных положительных образцах использовали разведения отраслевого стандартного образца иммуноглобулина человека против вируса гепатита В (ОСО 42-28-320-00).
Статистическую обработку результатов исследований проводили с помощью персонального компьютера с применением программы Microsoft Excell (раздел описательная статистика). Анализ данных проводили при уровне надёжности 95 %.
Результаты и их обсуждение
Особенности выявления НВsAg в пулах плазмы для фракционирования
Контроль пулов плазмы для фракционирования на присутствие HBsAg позволяет оценить качество скрининга индивидуальных донаций, поступающих на предприятия фракционирования, минимизировать присутствие вируса гепатита В в производственных пулах плазмы и снизить вероятность попадания его в конечные препараты иммуноглобулинов.
Предварительный анализ состояния рынка показал, что, несмотря на имеющийся широкий выбор тест-систем, отсутствуют наборы с декларированной возможностью определения НВsAg в пулах плазмы для фракционирования. Поэтому перед нами стояла задача оценить тест-системы, производимые Нижегородским филиалом «НПО «Микроген», и установить факторы, влияющие на эффективность выявления НВsAg в пулах плазмы.
Первоначально необходимо было установить, влияет ли смешивание индивидуальных донаций в пулах плазмы для фракционирования на специфическую активность тест-систем «ИФА-HВsAg». Для этого из негативных по НВsAg индивидуальных образцов плазмы формировали 20 производственных пулов объемом 5,0±0,5 л (путём смешивания 24±4 индивидуальных донаций) и 20 аналогичных модельных пулов (путём смешивания по 1 мл плазмы), затем тестировали их методом ИФА с использованием вышеуказанных тест-систем с чувствительностью 0,06-0,1 нг/мл. Результаты анализа модельных и производственных пулов совпали, ложноположительных результатов не выявлено.
Для оценки эффективности выявления НВsAg в пулах плазмы формировали модельные пулы, смешивая по 1 мл 19-27 нормальных (негативных) образцов с 1мл заведомо положительного по HВsAg индивидуального образца донорской плазмы. Положительные образцы, используемые для формирования модельных пулов (n=10), разделили на две группы: с исходной концентрацией HВsAg менее 100 нг/мл (24, 54, 60, 80 нг/мл) и более 100 нг/мл (140, 190, 700, 1540, 5800, 24960 нг/мл).
Показано, что эффективность выявления НВsAg для всех пулов, контаминированных НВsAg-содержащими образцами с концентрацией НВsAg более 100 нг/мл, и для пулов из 19 донаций, контаминированных положительными образцами плазмы с концентрацией НВsAg менее 100 нг/мл, составляла 100 %. При внесении плазмы с концентрацией НВsAg менее 100 нг/мл в пул из 27 донаций, НВsAg обнаруживался только в 80 % случаев (табл.1).
Как свидетельствовали полученные данные, одной из причин снижения эффективности выявления НВsAg в пулах плазмы было разведение антигена плазмой, не содержащей этого маркера. В то же время это обстоятельство не объясняло, почему в случае добавления положительного образца с концентрацией НВsAg 24 нг/мл антиген был выявлен в пулах плазмы, а при добавлении образца с концентрацией НВsAg 54 нг/мл антиген выявить не удалось.
Таблица 1
Эффективность выявления НВsAg методом ИФА в пулах плазмы (n=60)
| Кол-во модельных пулов | Кол-во индивидуальных донаций доноров в 1 пуле | Результаты тестирования пулов | Эффектив-ность выявления, (%) | ||
| Негативных | Позитивных (концентрация HBsAg) | Отр. | Пол. | ||
| 20 | 19 | 1 (>100 нг/мл) | 0 | 10 | 100 |
| 20 | 27 | 1 (>100 нг/мл) | 0 | 10 | 100 |
| 10 | 19 | 1 (<100 нг/мл) | 0 | 10 | 100 |
| 10 | 27 | 1 (<100 нг/мл) | 2 | 8 | 80 |
Установлено, что это не было связано с аналитической чувствительностью используемых тест-систем. Аналогичные результаты были получены на тест-системах трёх производителей. В связи с этим было сделано предположение, что одной из причин этого явления было присутствие в пулах плазмы анти-НВs, которые нейтрализовали НВsAg, тем самым исключая его из реакционной смеси. Эта проблема подробно будет рассмотрена ниже. В то же время возникал вопрос, насколько часто встречаются донации, контаминированные НВsAg в концентрации 100 нг/мл и выше, которые можно обнаружить в мини-пулах и исключить их из фракционирования. Как показали наши исследования (рис. 1), среди отбракованных по НВsAg донаций более чем в 85 % случаев концентрация НВsAg была выше 100 нг/мл и только 9,3 % доноров-вирусоносителей имели концентрацию НВsAg в плазме менее 100 нг/мл.
Таким образом, по результатам распределения концентрации НВsAg у доноров-вирусоносителей, а также, учитывая, что на предприятия фракционирования обычно поступает плазма, прошедшая первичный скрининг, нами рассчитан риск получения плазмы с концентрацией НВsAg менее 100 нг/мл. Он является достаточно низким и составляет 1 случай на 92150 индивидуальных донаций.
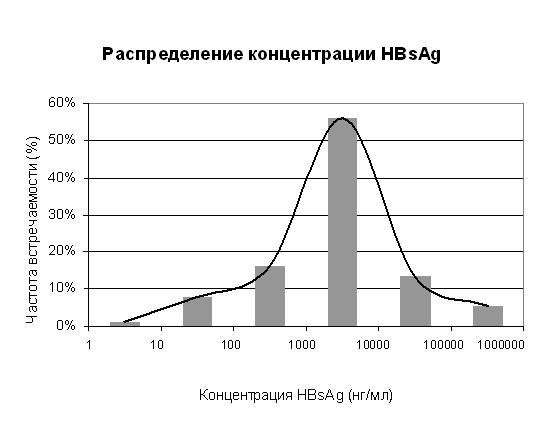
Рис. 1. Распределение концентраций НВsAg в плазме крови
доноров-вирусоносителей Приволжского федерального округа
Учитывая, что эффективность выявления таких образцов в пулах плазмы от 24+4 доноров находится на уровне 80 %, риск контаминации плазменного пула поверхностным антигеном вируса гепатита В ниже уровня детекции составлял по нашим данным приблизительно 1 случай на 19197 мини-пулов.
Для снижения риска контаминации пулов плазмы НВsAg маркерами гепатита В мы попытались использовать метод ПЦР. Однако результаты предварительного исследования модельных пулов, контаминированных НВsAg- и ДНК ВГВ-позитивными образцами с невысокой концентрацией антигена (менее 100 нг/мл), показали, что эффективность выявления маркеров ВГВ не улучшилась. При тестировании модельных пулов методом ИФА выявление НВsAg в пробах составило 85 %, а выявление ДНК ВГВ методом ПЦР составило менее 30 %. Это можно объяснить ингибированием полимеразы, а также тем, что концентрация НВsAg в плазме крови доноров-вирусоносителей обычно многократно превышает концентрацию полных вирусных частиц [Майер К.-П., 1999]. Поэтому эффективность выявления НВsAg в пулах плазмы от 20-28 доноров признана удовлетворительной, а тест на НВsAg обязательным для оценки вирусной безопасности пулов плазмы.
Нейтрализация поверхностного антигена вируса гепатита В специфическими антителами
Одной из основных причин снижения эффективности выявления НВsAg явилось присутствие вируснейтрализующих анти-НВs. Поэтому перед нами стояла задача в опытах in vitro изучить динамику образования иммунных комплексов НВsAg/анти-НВs и количественно охарактеризовать способность специфических антител экранировать НВsAg в пулах плазмы и препаратах иммуноглобулинов. Для этой цели в качестве источника антител были использованы препараты иммуноглобулинов с содержанием анти-НВs (770+20 МЕ/л), предварительно разбавленные нормальной донорской плазмой до содержания анти-НВs 10 МЕ/л, а в качестве источника НВsAg использован отраслевой стандарт «ОСО-HВsAg» (ОСО 42-28-311-03П). Растворы иммуноглобулина и ОСО смешивали в соотношении 1/10. Контрольный опыт, подтверждающий отсутствие неспецифического связывания антигена, выполнили на 10 % растворе альбумина.
Как свидетельствовали полученные результаты, нейтрализация антигена зависела от концентрации НВsAg в системе и времени инкубации исследуемых проб. Наиболее полно нейтрализация НВsAg происходила через 24 часа при температуре 37 C при условии равновесной концентрации антигена и антител в системе, в этом случае 1 МЕ анти-НВs был способен связывать до неопределяемого методом ИФА уровня не менее 50 нг НВsAg. При избытке антигена в системе, несмотря на иммунную нейтрализацию, НВsAg выявлялся в растворах (рис.2).
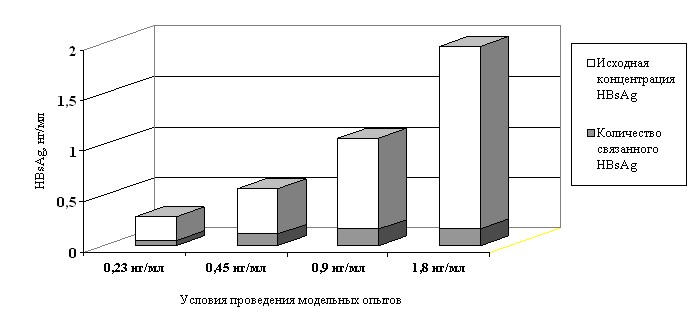
Рис.2. Уровень связывания НВsAg антителами при различной
концентрации его в исходных пробах
Аналогичные результаты были получены с препаратами иммуноглобулинов, в которые добавляли вируссодержащую плазму (табл.2).
Таблица 2
Нейтрализация HВsAg специфическими антителами, содержащимися
в препаратах иммуноглобулина
| Исходная концентрация (С) HВsAg в модельных образцах, нг/мл | Количество связанного HВsAg, нг/мл | |||
| через 2 ч при 37 С | через 24 ч при 37 С | |||
| M+m | % от исходного | M+m | % от исходного | |
| 6 | полная ** | 100,0 | полная ** | 100,0 |
| 24 | полная ** | 100,0 | полная ** | 100,0 |
| 49 | 48,8±0,9 | 99,5 | полная ** | 100,0 |
| 195 | 159±20 | 81,5 | 194±1,3 | 99,5 |
| 781 | 431±63 | 55,2 | 675±106 | 86,4 |
| 1562 | 812±129 | 52,0 | 921±129 | 59,0 |
| 3125 | 734±146 | 23,5 | 1515±343 | 48,5 |
| 6250 | 750±283 | 12,0 | 950±234 | 15,2 |
| 12500 | не выявлено* | 0 | не выявлено* | 0 |
| 25000 | не выявлено* | 0 | не выявлено* | 0 |
| 50000 | не выявлено* | 0 | не выявлено* | 0 |
* не выявлено статистически достоверных изменений концентрации НВsAg р>0,05)
** нейтрализация HВsAg до неопределяемого методом ИФА уровня
В соответствии с классическими закономерностями процесса формирования иммунных комплексов при низкой концентрации НВsAg (менее 49 нг) и существенном избытке специфических антител происходила полная его нейтрализация до неопределяемого методом ИФА уровня. Дальнейший рост концентрации антигена до 1562-3125 нг способствовал увеличению количества сформированных иммунных комплексов до тех пор, пока не достигал зоны эквивалентности: количество антигена примерно равнялось количеству доступных мест связывания на антителах. При существенном избытке антигена (более 25 мкг/мл) процесс нейтрализации был неэффективным и не приводил к статистически значимому изменению концентрации НВsAg в реакционной смеси.
Учитывая, что в процессе выделения иммуноглобулинов происходит концентрирование анти-НВs-антител и, одновременно, очистка от вирусов и НВsAg [Анастасиев В.В., 2000] ставится под сомнение корректность применения теста на НВsAg в ИФА для контроля вирусной безопасности препаратов иммуноглобулинов согласно отечественных Фармакопейных статей.
Сравнение методов ИФА и ПЦР при оценке маркеров вируса гепатита В в модельных опытах
Нами были проведены сравнительные исследования определения НВsAg и ДНК ВГВ в препаратах иммуноглобулинов, контаминированных вируссодержащей плазмой с высоким содержанием НВsAg (около 1 мг/мл) и ДНК ВГВ (9,3*108 копий/мл). В препараты иммуноглобулинов вносили вируссодержащую плазму донора-вирусоносителя, разведенную в 50000 – 400000 раз. Тестирование опытных проб проводили через 15 минут и после инкубации при 37°С в течение 24 часов (табл. 3).
Таблица 3
Сравнение методов ИФА и ПЦР для оценки вирусной безопасности препаратов иммуноглобулинов
| Титр вирус- содержащей плазмы | Результат тестирования проб | |||
| на НВsAg методом ИФА | на ДНК ВГВ методом ПЦР | |||
| через 15 мин | через 24 часа при 37°С | через 15 мин | через 24 часа при 37°С | |
| 50 000 | + | - | + | + |
| 100 000 | +/- | - | + | + |
| 200 000 | - | - | + | + |
| 400 000 | - | - | +/- | +/- |
(-) отрицательный; (+) положительный; (+/-) слабоположительный
ДНК ВГВ была обнаружена во всех пробах. В то же время НВsAg через 24 часа не выявлялся ни в одной из проб, а при немедленном тестировании был выявлен в пробах с меньшими разведениями вируссодержащей плазмы. Моделируя искусственно контаминацию иммуноглобулинов маркерами вируса гепатита В, выявлено, что, даже в этом случае специфические антитела в них содержались в избытке и активно связывали НВsAg. В то же время присутствие иммунных комплексов не мешало выявлению вирусного генома. Поэтому введение мониторинга анти-НВs и ДНК ВГВ при оценке качества препаратов иммуноглобулинов даст большую информацию об их вирусной безопасности.
Разработка тест-системы для количественного определения
антител к поверхностному антигену вируса гепатита В
Для определения уровня анти-HBs в сыворотке (плазме) крови человека и в препаратах иммуноглобулинов была разработана иммуноферментная тест-система, в основу которой положен принцип одностадийного прямого «сэндвич»-анализа. Особенностью тест-системы являлось то, что для изготовления иммуносорбента и конъюгата использован высокоочищенный плазменный антиген (НВsAg), свободный от ДНК вируса гепатита В, позволяющий с максимальной чувствительностью и специфичностью выявлять анти-НВs. Для этого разработан способ приготовления очищенного HВsAg из иммунного комплекса. Он включал инактивацию вирусов в плазме пастеризацией, очистку НBsAg физико-химическими методами, выделение комплекса НВsAg/анти-HBs, очистку HBsAg из комплекса с помощью гидролиза пепсином и центрифугирование в градиенте плотности сахарозы.
Для получения иммуносорбента использовали 96-луночный разборный планшет для ИФА, в лунках которого сорбировали НВsAg. Была проведена сравнительная оценка чувствительности тест-систем при нанесении на планшеты антигенов в трех вариантах: только НВsAg, выделенного из плазмы крови доноров-вирусоносителей; «плазменного» НВsAg в сочетании с рекомбинантным НВsAg субтипа ad в соотношении 3 : 1; и рекомбинантного НВsAg субтипов ay и ad в соотношении 1:1. Чувствительность тест-системы оценивали по калибровочным кривым, построенным по отраслевому стандартному образцу иммуноглобулина человека против вируса гепатита В (ОСО 42-28-320-00) с концентрацией 5, 10, 25, 50, 100, 150, 200 МЕ/л.. Чувствительность тест-системы, изготовленной с использованием только «плазменного» HBsAg составляла 5,8+2,6 МЕ/л, что было достоверно выше, чем при использовании «плазменного» антигена в комбинации с рекомбинантным или только рекомбинантного. Чувствительность в этом случае была 11,0+2,1 МЕ/л и 14,5+4,3 МЕ/л соответственно.
Чтобы выбрать оптимальные условия сорбции, оценивали интенсивность иммуноферментной реакции при различных концентрациях антигена в растворе: 1, 2, 4 и 8 мкг/мл. В качестве тестируемых образцов использовали контрольные образцы: К+ и К-. Максимальные различия между значениями оптической плотности (ОП) в контрольном положительном образце (К+) и величиной фоновых значений в лунках, куда вносили контрольный отрицательный образец (К-), не содержащий анти-HBs, наблюдались при двух концентрациях раствора антигена, используемого для сорбции - 2 и 4 мкг/мл. Поскольку при концентрации 2 мкг/мл значение ОП К- было ниже, а ОП в К+ практически не отличалось от такового при концентрации 4 мкг/мл, концентрация 2 мкг/мл была сочтена оптимальной и использована в дальнейшей работе.
На следующем этапе работы подбирали оптимальные разведения конъюгата - HBsAg - пероксидаза хрена. Контрольные образцы должны были иметь следующие показатели оптической плотности: ОП К+ не ниже 0,500 о.е., ОП К- – не выше 0,150 о.е. Первоначально для приготовления конъюгата использовали тот же антиген, что и для приготовления иммуносорбента. Однако при оптимальном рабочем разведении конъюгата 1:20 значение ОП К+ составило менее 0,300 о.е., что не соответствовало заданным условиям. Вероятно, это было связано с тем, что при физико-химическом способе очистки НВsAg могли повреждаться участки связывания с пероксидазой хрена. В связи с этим нами был использован НВsAg, очищенный оригинальным способом осаждения иммунного комплекса. При исследовании конъюгата, приготовленного с использованием очищенного данным способом антигена, результаты, соответствующие заданным условиям были получены при рабочем разведении 1:500.
Для изготовления контрольных положительных образцов (К+10, К+50, К+100) нами предложен состав стабилизирующего матричного раствора, содержащий нормальную донорскую плазму и мальтозу в концентрации 2-10%, позволивший сохранять их активность на протяжении срока наблюдения (9 месяцев).
При определении концентрации анти-HBs с целью упрощения интерпретации результатов предложено использование формулы. При сравнении двух способов определения концентрации анти-HBs: с помощью построения графика и с использованием предложенной формулы показано, что относительная разность между значениями концентраций анти-HBs, полученных по графику и по формуле, была статистически не значима и не превышала для плазмы крови 5,3 % (t=0,698; p=0,05), а для препаратов иммуноглобулинов 1,84 % (t=1,394; p=0,05).
При апробации тест-системы мы исследовали уровень поствакцинального иммунитета в 141 образце сыворотки крови здоровых вакцинированных против гепатита В детей. Было выявлено 11 негативных образцов (7,8%), не содержащих анти-НВs или содержащих ниже предела детекции (менее 5 МЕ/л). Аналогичные результаты были получены с использованием зарубежной тест-системы для количественного определения антител к HBsAg «MONOLISA ANTI-HBs 3.0» (рис.3).
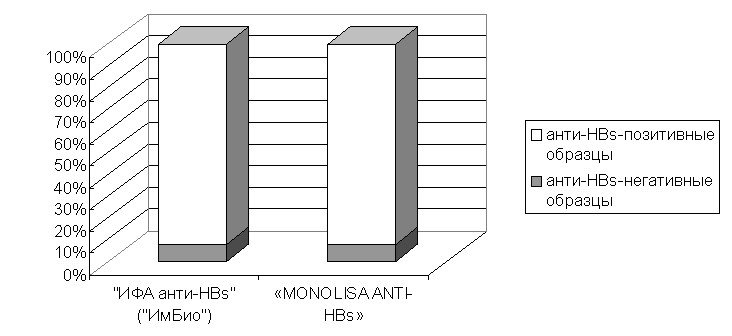
Рис. 3. Соотношение серонегативных и серопозитивных образцов
при тестировании на двух тест-системах.
В серопозитивных образцах изучено распределение концентраций анти-HBs с использованием двух тест-систем (табл. 4).
Таблица 4
Результаты определения концентрации антител к поверхностному антигену вируса гепатита В в образцах сыворотки крови вакцинированных детей (n=130)
| Концентрация анти-HBs, МЕ/л | Разработанная тест-система | «MONOLISA ANTI-HBs» | ||
| n | % | n | % | |
| Менее 10 | 2 | 1,5 | 2 | 1,5 |
| 10-100 | 45 | 34,7 | 53 | 40,7 |
| 101-1000 | 48 | 36,9 | 47 | 36,2 |
| Более 1000 | 35 | 26,9 | 28 | 21,6 |
Из таблицы видно, что при тестировании на двух тест-системах были получены совпадающие результаты для образцов сывороток с концентрацией анти-НВs менее 10 МЕ/л, и сходные данные для диапазона концентраций от 10 до 1000 МЕ/л и более.
Таким образом, по результатам оценки специфической активности с использованием ОСО иммуноглобулина человека, а также по результатам сравнительных испытаний с тест-системой «MONOLISA ANTI-HBs 3.0» показано, что разработанная тест-система может быть использована для количественного определения анти-НВs в сыворотке, плазме крови и препаратах иммуноглобулинов. В настоящее время тест-система успешно прошла государственные испытания в ФГУН ГИСК им. Л.А. Тарасевича.
Определение уровня анти-HBs в плазме для фракционирования
и препаратах иммуноглобулинов
В соответствии с требованиями Европейской фармакопеи препараты иммуноглобулинов должны содержать анти-НВs не менее 0,5 МЕ/г белка, то есть гарантировать определённое количество антител.
С помощью разработанной тест-системы была определена концентрация анти-HBs в индивидуальных образцах донорской плазмы крови, мини-пулах плазмы для фракционирования объёмом 5,0±0,5 л, в производственных пулах плазмы и в препаратах иммуноглобулинов отечественного и зарубежного производства.
Показано, что анти-НВs-позитивными были 32,4 % индивидуальных образцов плазмы крови, концентрация анти-HBs в которых распределялась следующим образом: 23 % имели низкую концентрацию анти-HBs - от 2-5 до 10 МЕ/л, 32 % - среднюю концентрацию (от 10 до 100 МЕ/л), 42 % - высокую концентрацию (от 101 до 1000 МЕ/л) и 3 % - концентрацию анти-HBs более 1000 МЕ/л (рис.4).
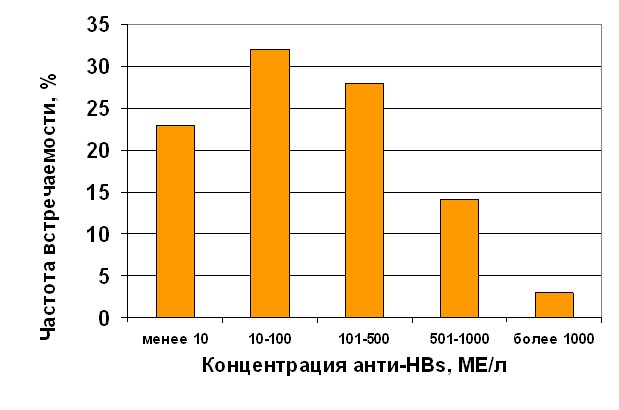
Рис. 4. Распределение концентраций анти-НВs
в индивидуальных образцах плазмы крови
Анти-НВs были выявлены в 96,16 % мини-пулах плазмы для фракционирова-ния. Все производственные пулы, как и следовало ожидать, также содержали анти-HBs, но в разной концентрации - от 99 до 1655 МЕ/л (средняя концентрация 431±311 МЕ/л). Учитывая, что концентрация специфических антител к вирусу гепатита В при производстве иммуноглобулинов увеличивается в 2,6 – 6,2 раза, в зависимости от вида препарата, было закономерным, что все исследованные серии иммуноглобулинов содержали анти-НВs в концентрации более 0,5 МЕ/г белка. Кроме того, показано, что уровни анти-НВs в отечественных препаратах практически не отличались от аналогичных показателей качества зарубежных препаратов и соответствовали требованиям Европейской фармакопеи (табл. 5).
Таблица 5
Содержание антител к НВs-антигену вируса гепатита В
в препаратах иммуноглобулинов
| Наименование препарата | n серий | Содержание анти-НВs (М±) | |
| МЕ/л | МЕ/г белка | ||
| Иммуноглобулин человека нормальный («ИмБио») | 18 | 2654±1342 | 26,54±13,42 |
| Иммуноглобулин для внутривенного введения («ИмБио») | 144 | 1132±464 | 22,64±9,28 |
| «Иммуновенин» (г.Уфа) | 4 | 1382±654 | 27,64±13,08 |
| «Пентаглобин» (Германия) | 7 | 2607±802 | 52,14±16,06 |
| «Интраглобин» (Германия) | 6 | 2219±630 | 44,38±12,62 |
| «Октагам» (Австрия) | 4 | 2366±919 | 47,32±18,38 |
| «Хумаглобин» (Венгрия) | 3 | 1142±688 | 22,84±13,76 |
| «Ig VENA» (Италия) | 3 | 2781±387 | 55,62±7,75 |
р=0,05
Однако, существенные колебания концентрации анти-НВs в производственных пулах, а также риск, связанный с возможностью контаминации исходной плазмы и формирования иммунных комплексов анти-НВs/НВsAg, свидетельствовали о том, что для того, чтобы гарантировать это соответствие, необходимо в контроль качества иммуноглобулинов ввести обязательный тест на анти-HBs.
Суммируя вышеизложенное, можно заключить, что результатом выполненной работы стала разработка алгоритма контроля пулов плазмы и препаратов иммуноглобулинов на предприятиях фракционирования. Предложен оптимальный размер плазменного пула (5,0+0,5 л от 20-28 донаций) с учетом особенностей производства и эффективности выявления НВsAg. Экспериментально подтверждена нецелесообразность тестирования препаратов иммуноглобулинов на НВsAg. Для подтверждения соответствия отечественных препаратов иммуноглобулинов международным требованиям необходимо определение уровня анти-НВs. С этой целью разработана иммуноферментная тест-система для количественного определения антител к поверхностному антигену вируса гепатита В.
ВЫВОДЫ.
1. Установлено, что одним из основных факторов снижения эффективности выявления НВsAg в пулах плазмы для фракционирования является присутствие анти-НВs.
2. В модельных опытах показано, что процесс нейтрализации НВsAg специфическими антителами зависит от концентрации антигена в смеси. В оптимальных условиях анти-НВs в количестве 1 МЕ способны связывать не менее 50 нг НВsAg.
3. На основе изученных закономерностей «экранирования» НВsAg анти-НВs-антителами следует считать недостаточным критерием отсутствие НВsAg в препаратах иммуноглобулинов. В связи с этим в алгоритм мониторинга препаратов необходимо ввести определение анти-HBs. В случае несоответствия уровня анти-HBs международным требованиям проводить тестирование иммуноглобулинов на ДНК ВГВ методом ПЦР.
4. Экспериментально продемонстрировано, что формирование иммунных комплексов HBsAg/анти-HBs не оказывает влияния на способность метода ПЦР выявлять ДНК ВГВ в препаратах иммуноглобулинов.
5. Разработан оригинальный способ получения HВsAg осаждением из иммунных комплексов.
6. Разработана иммуноферментная тест-система для количественного определения анти-HBs в плазме (сыворотке) крови и препаратах иммуноглобулинов. Стабилизация жидкого рабочего стандарта для калибровки с концентрацией анти-HBs 10, 50 и 100 МЕ/л мальтозой позволила сохранять его активность на протяжении срока наблюдения.
Список работ, опубликованных по теме диссертации
- Зубкова Н.В., Анастасиев В.В., Моисеева М.А., Зубов С.В. Нейтрализация поверхностного антигена вируса гепатита В препаратами иммуноглобулинов // Журнал микробиол., эпидемиол. и иммунол.-2006.-№ 2.-С.60-65.
- Зубкова Н.В., Зубов С.В., Моисеева М.А. Разработка ИФА-тест-системы для количественного определения анти-HBs в сыворотке крови и препаратах иммуноглобулинов // Международный конгресс «Ликвидация и элиминация инфекционных болезней – прогресс и проблемы»: Тезисы докладов.- С.-Пб. 2003.- С.12-13.
- Зубкова Н.В., Зубов С.В., Моисеева М.А. Использование иммуноферментной тест-системы «ИмБио анти-HBs» для количественного определения антител к вирусу гепатита В // Мир вирусных гепатитов.-2003.-№ 9.-С. 9-13.
- Зубкова Н.В., Моисеева М.А., Зубов С.В., Анастасиев В.В. Определение уровня нейтрализации поверхностного антигена вируса гепатита В специфическими антителами // VI Российская научно-практическая конференция с международным участием «Вирусные гепатиты – проблемы эпидемиологии, диагностики, лечения и профилактики»: Тезисы докладов.- М., 24-26 мая 2005.-С.116-118.
- Зубкова Н.В., Спиридонова Н.А., Моисеева М.А. Проблема вирусной безопасности препаратов из плазмы крови: входной и выходной производственный контроль на маркёры вирусных гепатитов // Всероссийская научная конференция молодых учёных «Актуальные вопросы инфекционной патологии человека, клинической и прикладной иммунологии»: Тезисы докладов.- Уфа, 2004.-С.238-240.
- Зубов С.В., Егорова Н.И., Моисеева М.А., Зубкова Н.В., Кузнецов К.В. Распределение концентрации HBsAg в плазме крови доноров-вирусоносителей // VI Российская научно-практическая конференция с международным участием «Вирусные гепатиты – проблемы эпидемиологии, диагностики, лечения и профилактики»: Тезисы докладов.- М., 24-26 мая 2005.-С.118-120.
- Моисеева М.А., Зубкова Н.В. Определение антител к поверхностному антигену вируса гепатита В в препаратах иммуноглобулинов // Всероссийская научная конференция молодых учёных «Актуальные вопросы инфекционной патологии человека, клинической и прикладной иммунологии»: Тезисы докладов.- Уфа, 2004.- С.235-236.
- Моисеева М.А., Зубкова Н.В., Зубов С.В. Выявление маркеров парентеральных вирусных гепатитов среди различных групп детей Нижегородской области // Материалы научной конференции, посвящённой 75-летию Нижегородского НИИЭМ «Новые технологии в профилактике, диагностике, эпиднадзоре и лечении инфекционных заболеваний».- Н.Новгород, 2004.- С.38-43.
- Моисеева М.А., Зубкова Н.В., Зубов С.В. Оценка специфического иммунитета против гепатита В у персонала, работающего с кровью // II научная конференция с международным участием «Проблемы инфекционной патологии в регионах Сибири, Дальнего Востока и Крайнего Севера»: Тезисы докладов.- Новосибирск, 2002.- С.43.
- Моисеева М.А., Зубкова Н.В., Спиридонова Н.А., Зубов С.В. Определение маркеров гемотрансмиссивных инфекций в препаратах крови // VI Российская научно-практическая конференция с международным участием «Вирусные гепатиты – проблемы эпидемиологии, диагностики, лечения и профилактики»: Тезисы докладов.- М., 24-26 мая 2005.-С.212-214.
- Zubkova N.V., Moiseyeva M.A. Anti-HBs content in the intravenous Immunoglobulin preparation at different viruses inactivation methods // Russian Journal of HIV/AIDS and Related Problems. 2002. – т.6.- №1.- С.189.

