Комплексная диагностика и прогнозрование осложнений острых воспалительных заболеваний органов брюшной полости
На правах рукописи
КЧИБЕКОВ ЭЛДАР АБДУРАГИМОВИЧ
Комплексная диагностика и
прогнозрование осложнений острых воспалительных заболеваний органов брюшной полости
14.01.17 – хирургия
03.01.04- биохимия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Астрахань – 2011
Работа выполнена в государственном образовательном
учреждении высшего профессионального образования
«Астраханская государственная медицинская академия»
Министерства здравоохранения и социального развития
России
Научные консультанты:
Заслуженный деятель науки РФ
доктор медицинских наук, Зурнаджьянц
профессор Виктор Ардоваздович
доктор медицинских наук, Никулина
профессор Дина Максимовна
Официальные оппоненты:
Заслуженный деятель науки РФ
доктор медицинских наук, Дибиров
профессор Магомед Дибирович
член-корреспондент РАМН
доктор медицинских наук, Терентьев
профессор Александр Александрович
доктор медицинских наук, Мустафин
профессор Дамер Гибатович
Ведущая организация: ГОУ ВПО «Волгоградский государственный медицинский университет» Минздравсоцразвития Росси
Защита состоится « » 2011 года в часов на заседании диссертационного совете Д.208.005.01. при ГОУ ВПО «Астраханская государственная медицинская академия» Минздравсоцразвития России по адресу 414000, г. Астрахань, ул. Бакинская,121
С диссертацией можно ознакомиться в научной библиотеке ГОУ ВПО «АГМА» Минздравсоцразвития России (414000, г. Астрахань, ул. Бакинская,121).
Автореферат разослан «___»_____________2011 г.
Ученый секретарь диссертационного
совета кандидат медицинских наук,
доцент Заклякова Л.В
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. За последние десятилетия многие исследователи отмечают рост хирургических воспалительных заболеваний органов брюшной полости и частоты гнойных осложнений. (Белобородов В.В., 2001; Илюкевич Г.В., 2002; Гаин Ю. М., 2005; Брискин Б.С., 2007; Галимзянов Ф.В., 2008; Дибиров М.Д. и соавт, 2010).
Факторами, определяющими злободневность проблемы, являются широкая распространенность гнойно-септических заболеваний, среди которых перитонит занимает до 25%. Ошибки в диагностике, несвоевременная госпитализация, неоправданно длительное консервативное лечение, поздние операции, тактические ошибки по ходу операции и в послеоперационном периоде, нарушения иммунной системы, связанные с действием факторов хирургического стресса, являются основными причинами развития гнойно-воспалительных осложнений, среди которых послеоперационный перитонит составляет - 52,4-63,8% от общего числа осложнений (Савельев В.С., 2004; Минаев С. В., 2004; Фаллер А.П. и соавт,2009; Дибиров М.Д., 2010). Атипичность клинической картины послеоперационных осложнений приводит к несвоевременному выполнению релапаротомий у 17-48% больных и является главной причиной их неблагоприятного исхода (Будневский В.И. и соавт., 2005). Летальность при этом составляет 20,9-37,2% (Глабай В.П. и соавт., 2005; Голик А.Д. и соавт., 2005; Рычковский Г.Ф. и соавт., 2005). При этом отсутствие надежных лабораторных методов ранней и своевременной диагностики осложнений и контроля лечения затрудняет выбор врачебной тактики (Дружинина Т.А., 2010).
Улучшение исходов после операций на органах брюшной полости многие авторы связывают с возможностью прогнозировать течение патологического процесса и выявлять гнойные осложнения на ранних стадиях их возникновения (Гостищев В.К. 2002; Зурнаджьянц В.А., Жидовинов А. А., 2008; Пацай Д.И., 2008; Дружинина Т.А. и соавт, 2010; Zimmerman, J. 2000). Существующие методы прогнозирования: система APACHE - II, индекс перитонита Маннгеймера (Панцырев Ю.М, 1993; Золотовская Н.Б., 2010; Дибиров М.Д., 2010; Knaus W.A.,1994; Demmel, N., 1994) направлены в основном на определение вероятности летального исхода и не оценивают риск возникновения инфекционных осложнений
Для контроля системных воспалительных и иммунных реакций, септических осложнений, деструктивных процессов и органной недостаточности, имеется широкий выбор маркерных белков различных групп, среди которых немаловажную роль играют белки острой фазы (БОФ), ассоциированные с воспалением и отражающие разные стороны патологического процесса (Никулина Д.М., Трубников Г.А., 1996; Илюкевич Г.В., 2002; Кушалаков A.M., 2004 Huang, H.H., 2005). К числу иммунохимических тестов, отражающих воспалительные и острофазовые реакции, относят определение С-реактивного белка (СРБ), лактоферрина (ЛФ), ферритина (Ф), альфа2- макроглобулина (МГ), связанного с беременностью альфа2-гликопротеина (СБАГ) в биологических жидкостях (Татаринов Ю.С., 1970; Назаров П. Г., 2001; Никулина Д.М., 2001; Илюкевич Г.В., 2002; Пацай, Д.И., 2008.; Дружинина Т.А.; 2010; Torti, F.M, 2002.).
Поэтому разработка схем оценки состояния больных с острой хирургической патологией органов брюшной полости на основе иммунохимического определения специально подобранного комплекса острофазовых белков является актуальной проблемой.
Цель исследования
Разработка эффективной диагностической концепции на основе комплексной оценки традиционных и новых клинико-лабораторных показателей острых воспалительных заболеваний органов брюшной полости для прогнозирования гнойных осложнений, оптимизации тактики и контроля лечения больных.
Задачи исследования
- Изучить уровень БОФ: С-реактивного белка (СРБ), связанного с беременностью a2-гликопротеина (СБАГ), лактоферрина (ЛФ), ферритина (Ф), a2-макроглобулина (МГ) в сыворотке крови больных с острыми хирургическими воспалительными заболеваниями органов брюшной полости в динамике.
- Изучить уровень БОФ: С-реактивного белка (СРБ), связанного с беременностью a2 гликопротеина (СБАГ), лактоферрина (ЛФ), ферритина (Ф), a2 макроглобулина (МГ), в перитонеальной жидкости больных с острыми хирургическими воспалительными заболеваниями органов брюшной полости в динамике.
- Определить мониторинговые колебания концентрации всех изученных БОФ в биологических жидкостях при каждой нозологической форме острых воспалительных заболеваний органов брюшной полости в зависимости от степени выраженности воспаления.
- Выделить из комплекса клинических, анамнестических, лабораторных и иммунохимических параметров, наиболее информативные, необходимые для диагностики и прогнозирования гнойно-воспалительных осложнений острых заболеваний органов брюшной полости.
- Сформировать группу наиболее информативных параметров, необходимых для диагностики и прогнозирования гнойно-воспалительных осложнений острых заболеваний органов брюшной полости, из комплекса клинических, анамнестических, лабораторных и иммунохимических параметров.
- Разработать новые критерии диагностики степени выраженности воспалительно-деструктивных процессов органов брюшной полости и прогнозирования гнойных осложнений с учетом полученных результатов определения уровня БОФ.
- Рассчитать количественные интегральные показатели прогнозирования вероятности послеоперационных гнойных осложнений на основе многофакторного анализа общедоступных клинических и лабораторных тестов, включая иммунохимические.
- Оценить степень выраженности воспалительных и деструктивных процессов в послеоперационном периоде, влияющей на дальнейшую тактику лечения, с помощью разработанной балльной системы диагностики.
Научная новизна
Предложен комплекс иммунохимических тестов для диагностики острых воспалительных заболеваний органов брюшной полости и прогнозирования осложнений.
Дана комплексная оценка изменения концентрации БОФ при остром холецистите, остром панкреатите, остром аппендиците, перфорации гастродуоденальных язв и их осложнениях.
Дана сравнительная оценка отдельно взятых показателей и традиционно применяемых прогностических шкал в оценке тяжести состояния больных с острыми воспалительными заболеваниями органов брюшной полости.
Предложен новый способ (балльная оценка) диагностики – диагностический индекс, контроля лечения и прогнозирования – прогностический индекс, осложнений хирургической патологии органов брюшной полости.
На основании разработанной балльной оценки клинико-лабораторных и иммунохимических критериев определена тактика ведения больных с острыми хирургическими заболеваниями органов брюшной полости.
Получены результаты комплексного исследования пяти БОФ, позволяющие уточнить степень выраженности воспаления, деструкции пораженного органа и сформировать алгоритм диагностики, прогнозирования осложнений и контроля эффективности лечения данной патологии.
Практическая значимость
Результаты исследования позволяют усовершенствовать диагностику, контроль лечения острой хирургической патологии органов брюшной полости, своевременно предупредить гнойно-септические осложнения.
Предложен способ объективной оценки тяжести состояния больных и эффективности проводимого лечения на основе клинико-лабораторных тестов.
На основе разработанных диагностических критериев предложены рекомендации по тактике ведения больных в послеоперационном периоде и выработаны показания к повторным оперативным вмешательствам.
Предложенный комплексный подход к использованию клинических и лабораторных диагностических и прогностических критериев значительно расширяет возможности раннего распознавания и своевременного лечения острой хирургической патологии органов брюшной полости и гнойных осложнений.
Внедрение в практику разработанной программы диагностики и прогнозирования позволяет улучшить результаты лечения больных с гнойно-воспалительными заболеваниями органов брюшной полости.
Положения, выносимые на защиту
- Определение исходных значений показателей БОФ у больных с острыми хирургическими заболеваниями органов брюшной полости позволяет выявлять степень деструктивных изменений органов и прогнозировать вероятность возникновения гнойно-воспалительных осложнений в послеоперационном периоде.
- Исследование БОФ в сочетании с клиническими проявлениями интоксикации отражают активность гнойно-воспалительного процесса в брюшной полости и могут использоваться для мониторинга состояния больных в до - и послеоперационном периодах.
- Использование иммунохимических методов, наряду с инструментальными, повышает точность диагностики гнойно-воспалительного процесса в брюшной полости и позволяет прогнозировать осложненное течение заболевания.
Внедрение результатов работы в практику
Результаты работы внедрены в лечебную работу ЛПУ и применяется при обследовании и лечении больных в отделениях хирургии, реанимации и интенсивной терапии МУЗ ГКБ №3, НУЗ Отделенческая больница на ст. Астрахань-1 ОАО «РЖД» г. Астрахани. Разработано и внедрено в практическую деятельность врачей хирургов, анестезиологов-реаниматологов, врачей - интернов и студентов методическое пособие “Особенности клинического течения и диагностика острого калькулезного холецистита” (Астрахань, 2010). В ходе работы над диссертацией получено 2 патента на изобретение, касающиеся усовершенствования диагностики воспаления и деструкции. Результаты исследования используются в учебном процессе на хирургических кафедрах.
Апробация работы
Основные положения диссертации доложены и обсуждены: на Всероссийской конференции хирургов (Астрахань, 2006), на Всеросийской научно-практической конференции с международным участием (Анапа, 2009); на Международной научной конференции «Молодежь - медицине будущего» (Одесса, 2009); на научно-практической конференции и школы-семинара для молодых учёных с международным участием (Астрахань, 2006, 2008, 2010); на ежегодных научно-практических конференциях сотрудников Астраханской государственной медицинской академии и врачей города и области (Астрахань, 2006, 2007, 2009, 2010); на межкафедральном заседании ГОУ ВПО АГМА (Астрахань, 2011).
Публикации
По материалам диссертации опубликовано 30 научных работ, 15 из которых в рецензируемых журналах, рекомендованных ВАК РФ для диссертаций, получено два патента на изобретения: № 2395085 РФ, № 2407017, одно методическое пособие для врачей.
Объем и структура работы
Диссертация изложена на 248 страницах машинописного текста, состоит из введения, обзора литературы, главы «Материалы и методы исследования», главы результатов «Собственные исследования», обсуждения полученных результатов, выводов, практических рекомендаций, иллюстрирована 38 таблицами и 38 рисунками. Библиографический указатель включает 198 отечественных и 115 иностранных источников.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Исходя из цели и задач, было обследовано 409 больных, оперированных на органах брюшной полости в хирургической клинике ГКБ №3 г. Астрахани за период с 2005 по 2010г, структура которых представлена в таблице 1.
Таблица 1
Распределение больных по нозологическим формам
| Нозология | Число больных | мужчины | женщины | умершие | |||
| n | % | n | % | n | % | ||
| ПЯ | 64 | 59 | 92 | 5 | 8 | 2 | 3 |
| ОА | 120 | 55 | 46 | 65 | 34 | ||
| АИ | 14 | 9 | 64 | 3 | 36 | ||
| ОХ | 82 | 25 | 31 | 57 | 69 | 4 | 5 |
| ОП | 28 | 16 | 57 | 12 | 43 | 3 | 10 |
| АБП | 18 | 13 | 72 | 5 | 28 | 1 | |
| П | 83 | 43 | 51 | 40 | 49 | 7 | 8 |
| Всего | 409 | 215 | 57 | 189 | 43 | 17 | 4 |
| Доноры | 120 | ||||||
По возрасту, больные распределились следующим образом (табл. 2).
Таблица 2
Распределение больных по возрасту
| Диагноз | 15-20 лет | 21-30 лет | 31-40 лет | 41-50 лет | 51-60 лет. | >60 лет |
| ПЯ | 4 | 17 | 13 | 11 | 12 | 7 |
| ОА | 10 | 42 | 28 | 20 | 9 | 11 |
| АИ | 1 | 2 | 4 | 4 | 3 | |
| ОХ | 4 | 11 | 13 | 21 | 33 | |
| ОП | 1 | 7 | 9 | 4 | 7 | |
| АБП | 1 | 3 | 4 | 4 | 6 | |
| П | 2 | 6 | 17 | 24 | 11 | 23 |
| Всего | 16 | 72 | 81 | 85 | 65 | 90 |
В наших исследованиях больные острым аппендицитом были распределены соответственно классификации (табл. 3).
Таблица 3
Распределение больных острым аппендицитом
| Форма аппендицита | n | % | |
| Простой (катаральный) | 12 | 9 | |
| Деструктивный | Флегмонозный | 62 | 46 |
| Гангренозный | 21 | 15 | |
| Осложненный | Перитонит | 25 | 19 |
| Аппендикулярный инфильтрат | 14 | 11 | |
| Итого: | 134 | 100 | |
Группа больных с острым панкреатитом разделена на три подгруппы, а больные с острым холециститом - на четыре подгруппы (табл. 4, 5).
Таблица 4
Распределение больных острым панкреатитом
Таблица 5
Распределение больных острым холецистито
Больные перитонитом были разделены на группы согласно распространенности воспалительного процесса в брюшной полости и характеру экссудата (табл. 6).
Таблица 6
Распределение больных перитонитом
| Форма перитонита | n | % | |
| Отграниченный | 38 | 22, 6 | |
| Неотграниченный | Местный | 68 | 40,4 |
| Распространенный | 62 | 27,3 | |
| Серозный | 47 | 27,9 | |
| Фибринозный | 65 | 38,6 | |
| Гнойный | 56 | 33,3 | |
При поступлении, больным проводили стандартные обследования, необходимые в хирургии: оценка анамнеза, физикальных данных, по показаниям рентгенография грудной и брюшной полостей, УЗИ, эндоскопия. Выполняли лабораторные обследования: общий анализ крови, мочи, определение гематокрита, диастазы мочи, билирубина, общего белка и белковых фракций, лейкоцитарной формулы.
Анализ клинических и лабораторных параметров производили до операции и после неё в сроки 1 - 3-и, 5- 7-е, 9- 13-е сутки, также перед повторной операцией и после неё в динамике.
Объектом лабораторного исследования явились образцы сыворотки крови, экссудата больных острой хирургической патологией органов брюшной полости.
Кровь для приготовления сыворотки получали пункцией кубитальной вены. Экссудат собирали интраоперационно и из дренажей брюшной полости после операции в 1,3,5,7 сутки и перед удалением дренажей. В качестве контрольных объектов использовали сыворотку крови здоровых людей (доноров).
Лейкоцитарный индекс интоксикации (ЛИИ) вычисляли на основании данных гематологического анализатора по формуле, предложенной Я.Я. Кальф-Калифом (1941).
Для идентификации и количественного определения изучаемых белков использованы следующие иммунохимические методы:
метод иммунодиффузионного анализа (ИДА) в агаре по O.Ouchterlony (1958) в модификации Н.И.Храмковой и Г.И.Абелева — для полуколичественного определения дискриминантных уровней острофазовых белков СБАГ, МГ и СРБ в сыворотках и экссудатах (чувствительность метода 3-5 мкг/мл), а также для конструирования моноспецифических тест-систем на МГ и СБАГ;
метод иммуноферментного анализа (ИФА) по инструкциям фирм изготовителей с использованием коммерческих тест-систем (чувствительность метода 1-5 нг/мл) — для определения концентрации Ф и ЛФ (набора реагентов ЗАО «Вектор-Бест» г. Новосибирск).
Для определения СРБ, Ф и ЛФ использовали коммерческие реагенты, а для выявления МГ и СБАГ – самостоятельно смоделированные тест-системы.
Для статистической обработки и анализа полученных результатов исследования, а также построения графиков на полученных данных был использован лицензионный пакет прикладных программ статистического анализа Excel-98 (Microsoft), Statistica 6.0 (StatSoft. Inc.).
Для каждой выборки вычисляли средние величины (М), среднее квадратичное отклонение (), среднюю ошибки средней арифметической (m). Оценку нормальности распределений проводили с использованием коэффициентов асимметрии и эксцесса.
С целью определения значимости (достоверности) р различий сопоставляемых средних величин применялся критерий t Стьюдента и однофакторный дисперсионный анализ с вычислением критерия F Фишера. Разницу средних величин считали достоверной при р < 0,05.
Статистические взаимосвязи между показателями оценивались применением корреляционного, регрессионного анализа и методов многомерной статистики (Гланц С., 1999).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Выявление СРБ, СБАГ, 2-МГ, ЛФ и Ф в сыворотке крови больных с острыми воспалительными заболеваниями
органов брюшной полости
Исследование содержания белков острой фазы в сыворотках крови больных с разной нозологией выявило следующие общие закономерности : все БОФ, изученные при острых воспалительных заболеваний органов брюшной полости, кроме 2-макроглобулина, выявляли повышенные концентрации по сравнению с контрольной группой доноров, каждый со своей динамикой и зависимостью от степени тяжести и характера острых воспалительных заболевания органов брюшной полости.
Кроме того, нами рассматривался коэффициент Ф/ЛФ, как дополнительный критерий наличия гнойно-некротической деструкции тканей для адекватной оценки активности воспаления и с целью раннего выявления деструктивных процессов. Вычисляли их соотношение К по формуле Ф/ЛФ100: где Ф концентрация ферритина в сыворотке крови, нг/мл; ЛФ - концентрация лактоферрина сыворотке крови, нг/мл. При значениях К менее 10 определяют отсутствие деструкции, при значениях от 11 до 15 определяют локализованный очаг гнойно-некротической деструкции в брюшной полости, при значениях от 16 до 20 определяют распространенный гнойно-деструктивный процесс брюшной полости, значения более 20 свидетельствуют о неблагоприятный исходе заболевания. Применение способа позволяет повысить точность диагностики гнойно-некротической деструкции в органах и тканях, а также определить степень ее распространенности, что дает возможность провести своевременное лечение.
Как видно из табл.7, уровни СРБ в сыворотке крови у больных с ОА достоверно выше контрольных значений СРБ у доноров при поступлении, на 1-3 и 5-7 сутки после операции в 1-3 сутки наблюдения. В другие сроки наблюдения больных с ОА уровни СРБ близки к нормальным величинам.
Анализируя динамику СРБ в подгруппах, обращает на себя внимание отличающаяся от других подгрупп диаграмма ОГА и значительно менее высокий уровень СРБ на диаграмме в подгруппе ОФА.
При ОГА уровень сывороточного СРБ максимально высокий (в 30 раз) до операции при поступлении и сохраняется на достоверно высоком уровне в течение 7 первых дней, при ОФА пик СРБ смещен к 1-3 суткам после операции снижается в 2 раза к 5-7 суткам, а при ОКА средние значения СРБ от контроля достоверно не отличаются (табл.7). Обращают на себя внимание достоверно высокие (в 8-9 раз) по сравнению с нормой показатели СРБ у больных с АИ на 1-3 сутки от начала наблюдения и дальнейшее падение до нормы уровня СРБ в группе больных с АИ.
Как видно из табл.7 и рис.1, уровни СБАГ в сыворотке крови у больных деструктивными формами ОА и АИ достоверно выше нормальных значений СБАГ только до операции (примерно в 3 раза). На 1-3 сутки и в последующие сутки после операции различия с группой доноров становятся статистически недостоверными/
При детальном анализе всех трех форм ОА обнаружена следующая картина: достоверные отличия от доноров до операции и в 1-3 сутки и 5-7 сутки после операции наблюдаются в подгруппе больных ОГА, только до операции – в подгруппе больных ОФА. В остальных подгруппах средние концентрации СБАГ на уровне контрольных цифр.
Что касается динамики изменений уровня СБАГ в группе ОА и ее подгруппах, то как видно из рис.1, имеются особенности снижения среднего уровня СБАГ в каждой из форм ОА. При ОГА после пика на 1-3 сутки и задержки на 5-7 сутки наблюдается крутой спуск до нормы к 9-13 дню после операции. При ОФА уровень СБАГ в 2,5 раз превышающий норму до операции сразу же после нее резко падает практически до контрольных донорских цифр. При ОКА уровень СБАГ на всем протяженеии исследования не отличается от нормы.
Таблица 7
Динамика БОФ в сыворотке крови больных острым аппендицитом и доноров
| БОФ | Срок после операции | ОКА (n=12) | ОФА (n=62) | ОГА (n=21) | АИ (n=14) | Доноры (n=120) |
| СРБ (мг/л) | До 1-3 сутки 5-7 сутки 9-13 сутки | 3,9±1,09 4,7±1,29 3,6±0,86 – | 8,2±1,09* 12,7±0,68* 6,4±0,43* 2,9±0,66 | 30,4±4,29* 27,6±6,14* 21,3±6,77* 3,6±1,29 | – 11,6±3,11* 3,1±1,54 2,6±0,56 | 0,7±0,4 |
| СБАГ (мг/л) | До 1-3 сутки 5-7 сутки 9-13 сутки | 1,8±0,42 1,9±0,63 1,7±0,78 – | 4,5±1,76* 2,3±0,68 1,9±0,62 1,4±0,42 | 5,6±1,53* 5,9±1,75* 4,3±1,03* 1,6±0,58 | – 2,2±0,91 1,8±0,83 1,6±0,72 | 1,8±0,31 |
| МГ (мг/л) | До 1-3 сутки 5-7 сутки 9-13 сутки | 1185±33 1201±44 1104±27 – | 931±90 1245±149 1223±161 1150±111 | 992±135 1044±139 1156±162 1225±176 | – 1036±167 907±36 1040±67,7 | 1033±67 |
| Ф (нг/мл) | До 1-3 сутки 5-7 сутки 9-13 сутки | 106±16,5 66±20,3 61±18,3 – | 264±26,6* 250±23,1* 201±28,9* 192±22,9 | 296±31,5* 235±37,7* 156±10,5* 103±12,8 | – 195±52,1 202±93,6 170±42,7 | 115±20,5 |
| ЛФ (нг/мл) | До 1-3 сутки 5-7 сутки 9-13 сутки | 870±75 1210±256 1060±203 – | 2770±302* 3110±105* 3650±183* 1640±62* | 1960±148* 2800±512* 2940±413* 1360±213 | – 4200±420* 1990±285* 1670±195* | 1050±55 |
| Ф/ЛФ | До 1-3 сутки 5-7 сутки 9-13 сутки | 10 5 5 – | 9 8 5 10 | 15 8 10 10 | – 4 10 10 | 10 |
Примечание. *- достоверные (начиная с р<0,05) различия с контрольной группой доноров

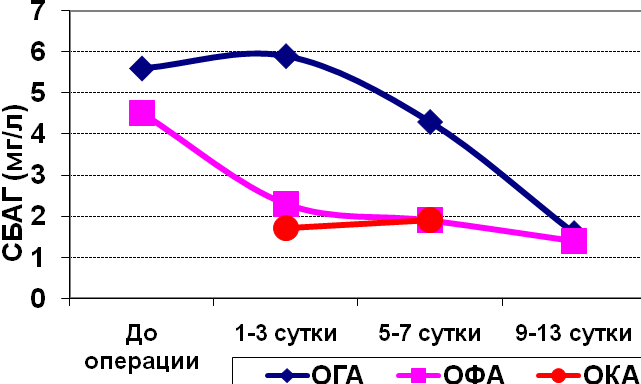
Рис. 1. Динамика изменения уровня СРБ и СБАГ в сыворотке крови больных острым аппендицитом
В связи с близкими к нормальным цифрам (1033±67 мг/л) значениями в подгруппах больных с ОГА, ОФА и ОКА диаграммы динамики МГ не несут какой-либо полезной информации. Имеется несущественная тенденция к подъему до контрольных цифр в подгруппе больных ОГА, резкий подъем до нормы и плато в подгруппе больных ОФА и плато слегка превышающее контрольные значения у больных ОКА.
Изучение средних уровней Ф в сыворотках крови больных ОА показало (табл.7), что достоверно повышенные уровни этого белка наблюдаются у больных до операции и на 1-3 и 5-7 сутки после операции, нормализуясь к 9-13 дню. Аналогичная картина в подгруппе больных с ОГА, а в подгруппе больных с ОФА повышенные уровни Ф статистически значимы во все сроки наблюдения. Слегка повышенные уровни Ф, наблюдаемые у больных с АИ, также как и пониженные уровни Ф в подгруппе ОКА.
Как видно из таб.7, максимальные уровни Ф в сыворотке крови у больных деструктивными формами ОА наблюдаются только до операции (примерно в 2,5 раза в подгруппе ОГА).
При ОГА после пика до операции наблюдается быстрое и равномерное снижение концентрации Ф до нормы к 9-13 дню. При ОФА, стартуя с более низкого уровня Ф до операции, мы наблюдали более пологий график снижения уровня Ф, который даже к 9-13 дню не возвращался к норме.
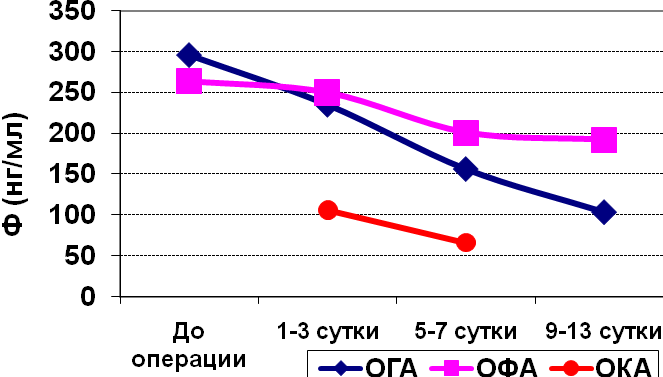

Рис. 2. Динамика изменения уровня Ф и ЛФ в сыворотке крови больных острым аппендицитом
Как следует из табл. 7 и рис.2, уровень Ф отражает степень тяжести в подгруппах больных ОА только при поступлении, когда четко прослеживается взаимосвязь среднего уровня Ф в сыворотках крови больных со степенью тяжести процесса и четко выявляется тенденция к повышению уровня Ф в последовательности ОКА АИ ОФА ОГА.
Изучение средних уровней ЛФ в сыворотках крови больных с ОА показало (табл.7), что достоверно повышенные уровни этого белка наблюдаются у больных этой группы во все сроки наблюдения до и после операции. Также достоверно во все сроки наблюдения до и после операции повышенные уровни ЛФ встречаются в подгруппе ОФА, во все сроки наблюдения в группе больных АИ, до операции и на 1-3 и 5-7 сутки после операции – в подгруппе ОГА. В подгруппе больных с ОКА колебания уровней ЛФ от контрольных значений статистически существенно не отличались.
Особенно следует обратить внимание на аномально высокую продукцию ЛФ в крови у больных с АИ (4200±420 нг/мл) при поступлении. Коэффициент Ф/ЛФ равен 4, что свидетельствует о выраженном воспалительном процессе с вовлечением в инфильтрат соседних органов, но отсутствует деструкция.
Таким образом, концентрация в крови больного Ф и ЛФ могут служить маркерами абсцедирования АИ и индикатором перевода больного на оперативную тактику лечения.
Анализируя средние уровни СРБ в сыворотках крови больных с ОП во взаимосвязи со степенью тяжести процесса (табл.8), можно заметить, что на всем протяжении наблюдения высокодостоверные различия с контрольной группой доноров сохраняются при отечной форме панкреатита и у тяжелых больных с распространенным инфицированным панкреонекрозом (РИП), а в группе больных с распространенным стерильным панкреонекрозом (РСП) статистически значимые отличия от контроля нами выявлены не во все сроки. Как для отечной формы ОП, так и для РСП, характерен очень высокий уровень (в 24 раза выше нормы) сывороточного СРБ при поступлении (соответственно, 24,9±6,60 и 27,5±10,74 мг/л) и тенденция к достаточно быстрому снижению концентраций СРБ в последующие сутки.
Средний уровень СРБ в крови больных с РИП, измеренный при поступлении до операции и на 1-3 сутки после операции, был достоверно выше нормы (табл.8) всего лишь в 13 раз (14,0±5,74 и 12,5±4,62 мг/л соответственно). Однако, основная тенденция экспрессии в кровь СРБ у больных с РИП резко отличалась от двух других подгрупп больных с ОП и РСП, начиная с 5-7 суток: наблюдалось повторное повышение средних концентраций СРБ до 18,9±6,51 на 5-7 сутки и 22,6±7,80 мг/л на 9-13 сутки после операции. Можно предположить, что повторный подъем средних значений СРБ при РИП связан с крайне неблагоприятным течением послеоперационного периода у таких больных и неблагоприятным исходом заболевания.
Таблица 8
Динамика БОФ в сыворотке крови доноров и больных острым панкреатитом
| БОФ | Срок после операции | Отечный панкреатит (n=10) | РСП (n=9) | РИП (n=9) | Доноры (n=120) |
| СРБ (мг/л) | До операции 1-3 сутки 5-7 сутки 9-13 сутки | - 24,9±6,60* 17,2±5,71* 9,4±2,03* | 27,5±10,74* 12,5±3,58* 9,2±3,53 5,5±1,50 | 14,0±5,74* 12,5±4,62* 18,9±6,51* 22,6±7,80* | 0,7±0,4 |
| СБАГ (мг/л) | До операции 1-3 сутки 5-7 сутки 9-13 сутки | - 8,4±1,79* 5,0±1,36* 2,5±0,74 | 7,5±2,79 5,0±2,33 3,4±1,02 2,7±0,79 | 6,4±2,19 6,0±2,20 5,4±2,26 5,2±1,96 | 1,8±0,31 |
| МГ (мг/л) | До операции 1-3 сутки 5-7 сутки 9-13 сутки | - 785±180 980±216 1237±206 | 618±166* 836±333 921±116 1148±260 | 483±144* 615±161* 783±249 800±210 | 1033±67 |
| Ф (нг/мл) | До операции 1-3 сутки 5-7 сутки 9-13 сутки | - 285±58,0 209±41,4 163±40,8 | 472±96,6* 350±33,1* 201±28,9* 192±32,9 | 564±124,3* 424±73,1* 331±98,9* 242±62,9 | 115±20,5 |
| ЛФ (нг/мл) | До операции 1-3 сутки 5-7 сутки 9-13 сутки | - 1430±317* 1060±146 830±376 | 2770±302* 3110±335* 2650±283* 1640±162* | 3390±560* 2100±465* 1780±222* 1200±367 | 1050±55 |
| Ф/ЛФ | До операции 1-3 сутки 5-7 сутки 9-13 сутки | - 18 18 18 | 17 10 7 10 | 16 20 19 21 | 10 |
Примечание. *-достоверные (начиная с р<0,05) различия с контрольной группой доноров.
Нами обнаружено, что достоверно повышенные уровни СБАГ (табл.8) встречаются на 1-3 сутки и 5-7 сутки консервативного лечения отечной формы острого панкреатита. Причем, средние цифры у этих больных превышали средние значения СБАГ в обеих подгруппах деструктивных форм панкреатита.
Для отечной формы панкреатита и РСП кривые снижения уровня СБАГ аналогичны таким же кривым для СРБ при ОП. При РИП изменения уровней СБАГ в динамике заболевания практически отсутствуют и держатся на недостоверно повышенных в 3-4 раза по сравнению с нормой уровнях.
Таким образом, анализируя динамику СБАГ во взаимосвязи со степенью тяжести острого панкреатита можно сделать следующие, кажущиеся противоречивыми, выводы: 1) чем легче степень тяжести панкреатита при поступлении, тем выше уровень СБАГ в крови, то есть при тяжелых формах ОП наблюдается угнетение биосинтеза СБАГ; 2) чем тяжелее форма ОП, тем медленнее идет восстановление уровня СБАГ до нормы.
Противоположные свойства относительно всех остальных БОФ проявляет МГ и при остром панкреатите (негативный БОФ). Также как у больных с другими изученными острыми воспалительными заболеваниями органов брюшной полости, при ОП уровень МГ, достоверно ниже нормы до операции и на 1-3 день после лапаротомии. Причем, больные с ОП давали максимально низкие средние значения МГ среди всех больных с острыми воспалительными заболеваниями органов брюшной полости (55,7% от нормы до операции и 74,1% на 1-3 сутки после операции по данным табл.8. Еще более низкие цифры средних значений МГ обнаружены в крови у больных из подгруппы РИП при поступлении (46,8% от нормальных величин МГ). Все это может свидетельствовать об активном участии МГ в процессах ингибирования протеолитических ферментов при ОП.
Из этой же таблицы 8 видно, что достоверно пониженные уровни МГ до операции встречаются при обеих формах деструкивного панкреатита (618±166 и 483±144 мг/л), а на 1-3 день после операции – только у больных с РИП (615±161 мг/л). Во все остальные сроки, а также во все сроки наблюдения у лечившихся консервативно больных с отечной формой острого панкреатита, различия средних величин МГ с контролем статистически недостоверны.
Вместе с тем, сравнивая динамику МГ в группах и подгруппах с ОП можно проследить однообразную тенденцию восстановления уровня МГ.
Детальный анализ средних уровней МГ в сыворотках крови больных ОП во взаимосвязи со степенью тяжести процесса (табл.8, рис.3) на любом сроке обследования выявляет четкую тенденцию к снижению уровня МГ с увеличением степени тяжести панкреатита в последовательности ОП РСП РИП.

Рис. 3. Динамика изменения уровня МГ в сыворотке крови больных острым панкреатитом
Таким образом, при панкреатите низкий уровень МГ в сыворотке крови больных до операции (ниже 500 мг/л) и отсутствие существенного повышения уровня МГ на 1-3 сутки после операции с высокой степенью вероятности может свидетельствовать о неблагоприятном прогнозе. Повторное снижение МГ является индикатором осложнений.
Изучение средних уровней железосодержащего белка Ф в сыворотках крови больных ОП во взаимосвязи со степенью тяжести процесса показало, что достоверно повышенные уровни этого белка наблюдаются у больных обеих подгрупп деструктивного панкреатита до операции, на 1-3 сутки и на 5-7 сутки после операции. Имевшее место достоверное повышение уровня Ф у всех 18 больных деструктивными формами панкреатита на 9-13 сутки (табл.8), после разделения группы на подгруппы стало статистически недостоверным по сравнению с контролем в связи с небольшим числом наблюдений в подгруппах. При этом во всех трех подгруппах ОП уровни сывороточного Ф максимально высокие до операции или в начале консервативного лечения, и всегда проявляется предсказуемая тенденция к снижению Ф во всех подгруппах в последующие дни наблюдения, независимо от исхода заболевания. Однако в подгруппах больных средние уровни Ф в сыворотках крови больных ОП связаны со степенью тяжести процесса и на любом сроке обследования выявляет четкую тенденцию к повышению уровня Ф с увеличением степени тяжести панкреатита в последовательности ОП РСП РИП.
Таким образом, чем тяжелее протекает ОП чем выраженнее процессы тканевой деструкции, тем более интенсивно протекает накопление в крови Ф в послеоперационные дни. Два противоположных процесса: постепенное истощение резервов Ф и уменьшение объема очага деструкции в процессе репаративной регенерации после операции приводит к снижению уровня этого белка в крови.Значительные различия по Ф при деструктивных формах панкреатита позволяет применить Ф, также как СБАГ, МГ и СРБ, в качестве прогностического индекса различных осложнений послеоперационного периода. Кроме того, как было отмечено выше, маркер тканевой деструкции Ф может одновременно служить индикатором качества проведенного оперативного вмешательста.
Также как и Ф, ЛФ в объединенной группе больных деструктивным панкреатитом сохранялся на достоверно повышенном уровне вплоть до 9-13 суток после операции (табл.8). Разделение этой группы выявило разные тенденции по ЛФ в подгруппах. В подгруппах статистически значимое повышение сывороточного уровня ЛФ наблюдали у больных с РИП во все сроки, кроме 9-13 суток, а для РСП – во все сроки наблюдения.
При сравнении подгрупп РСП и РИП, особенностью экспрессии в кровь ЛФ у больных с деструктивными формами панкреатита явилось обнаружение при РСП специфической отсроченной динамики снижения уровня ЛФ, начиная с пика на 1-3 сутки после операции (табл.8).
Однако, на момент поступления до операции средние концентрации ЛФ выше при РИП, чем при РСП. Высокий коэффициент Ф/ЛФ при остром панкреатите свидетельствует о выраженном деструктивном процессе в поджелудочной железе.
Ранее нами установлено, что при катаральной форме острого холецистита уровень СРБ также достоверно выше нормы (доноры): 28,6±4,2 мг/л до операции и 20,4±3,9 мг/л в раннем послеоперационном периоде и быстро снижается до нормы к 9-13 суткам после операции. Похожие изменения при катаральной форме острого холецистита характерны для СБАГ (4,2±0,86 4,5±1,44 3,5±1,67 норма) и других БОФ. Для деструктивных форм острого холецистита восстановления БОФ к 5-13 суткам после операции не наблюдается (табл.9). Быстрая нормализация этих цифр при катаральной форме не несет прогностической информации в отношении осложнений ОХ, не соответствует целям и задачам данного исследования, поэтому в таблицу 9 включены только деструктивные формы ОХ: флегмонозный (ФХ), гангренозный (ГХ) и осложненный (ОХ), требующие ургентного оперативного вмешательства.
Анализируя средние уровни СРБ в сыворотках крови больных деструктивными формами ОХ во взаимосвязи со степенью тяжести процесса (табл.9), можно заметить, что при ФХ и ГХ уровень сывороточного СРБ к 5-7 суткам снижается в 2-2,5 раза, а при осложненных формах ОХ, темп снижения остается вялым, отношение концентрации СРБ на 5-7 сутки после операции, к уровню СРБ до операции.
Как видно из таблицы 9, уровни СБАГ в сыворотке крови у больных деструктивными формами ОХ достоверно выше нормальных значений СБАГ только до операции (в 4 раза), на 1-3 сутки после операции (в 3 раза) и на 5-7 сутки после операции (в 2,5 раза). На 9-13 сутки, различия с группой доноров становятся статистически недостоверными, несмотря на то, что средние величины СБАГ в 1,8 раза выше нормы. При этом, необычно высокие концентрации СБАГ выявлены нами до операции в подгруппе больных с ФХ (8,1±1,50 мг/л).
Таблица 9
Динамика БОФ в сыворотке крови больных острым холециститом и доноров
| БОФ | Срок после операции | Флегмонозный (n=34) | Гангренозный (n=27) | Осложненный (n=21) | Доноры (n=120) |
| СРБ (мг/л) | До операции 1-3 сутки 5-7 сутки 9-13 сутки | 32,7±4,02* 21,6±5,89* 17,0±4,67* 12,6±3,86* | 35,8±9,92* 26,7±8,94* 14,4±6,68* 9,7±4,55* | 37,0±11,35* 30,2±10,40* 25,3±9,42* 16,0±4,44* | 0,7±0,4 |
| СБАГ (мг/л) | До операции 1-3 сутки 5-7 сутки 9-13 сутки | 8,1±1,50* 5,7±0,88* 4,5±0,96* 2,7±0,65 | 6,7±2,33* 5,3±1,49* 4,2±1,00* 3,6±1,40 | 6,9±2,41* 6,2±1,05* 4,7±1,04* 3,8±1,03 | 1,8±0,31 |
| МГ (мг/л) | До операции 1-3 сутки 5-7 сутки 9-13 сутки | 1087±127 923±96 801±93 834±72 | 1150±118 777±267 872±257 885±284 | 561±125* 670±171 714±244 735±235 | 1033±67 |
| Ф (нг/мл) | До операции 1-3 сутки 5-7 сутки 9-13 сутки | 445±113,6* 342±92,8* 317±124,0 202±51,6 | 587±134,7* 376±129,3 257±77,1 140±41,4 | 591±138,4* 308±91,6* 245±80,2 216±30,5 | 115±20,5 |
| ЛФ (нг/мл) | До операции 1-3 сутки 5-7 сутки 9-13 сутки | 4540±1217* 2550±961 1920±847 1330±496 | 4830±1459* 2330±1453 1370±524 920±316 | 3550±650* 2440±606* 2300±575* 1660±630 | 1050±55 |
| Ф/ЛФ | До операции 1-3 сутки 5-7 сутки 9-13 сутки | 9 13 16 15 | 14 16 12 10 | 16 13 10 10 | 10 |
Примечание. *- достоверные (начиная с р<0,05) различия с контрольной группой доноров
Уровни МГ в сыворотке крови у больных деструктивными формами ОХ достоверно не отличаются от нормальных значений МГ ни в целом по группе, ни в подгруппах больных с ФХ и ГХ. Исключение составляет достоверно пониженный уровень МГ перед операцией (или релапаротомией) у больных с осложненным (перитонитом) течением ОХ (табл.9).
Изучение средних уровней Ф в сыворотках крови больных деструктивными формами острого холецистита показало, что достоверно повышенные уровни этого белка наблюдаются у больных всех форм тяжести только до операции и на 1-3 сутки после операции. На 5-7 сутки и на 9-13 сутки, уровень сывороточного Ф статистически значимо от нормы не отличается ни в одной подгруппе больных деструктивными формами ОХ.
Как видно из таблицы 9, уровни Ф в сыворотке крови у больных деструктивными формами ОХ достоверно выше нормальных значений Ф до операции: при ФХ в 4 раза, а при ГХ и осложненном течении ОХ более чем в 5 раз. На 1-3 сутки после операции: примерно в 3 раза при всех деструктивных формах ОХ. На 5-7 сутки после операции различия с группой доноров становятся статистически недостоверными, несмотря на то, что средние величины Ф в 2-2,5 раза выше нормы во всех трех деструктивных форм ОХ.
При этом во всех трех подгруппах деструктивного ОХ уровни сывороточного Ф максимально высокие до операции и всегда проявляется предсказуемая тенденция к снижению Ф во всех подгруппах в последующие дни наблюдения, независимо от исхода заболевания.
Причем, уровень Ф отражает степень тяжести в подгруппах больных ОХ только при поступлении, когда четко прослеживается взаимосвязь среднего уровня Ф в сыворотках крови больных со степенью тяжести процесса и четко выявляется тенденция к повышению уровня Ф в последовательности ФХ ГХ осложненный ОХ. После оперативного лечения эта тенденция у больных с деструктивными формами ОХ не прослеживается.
Анализируя динамику ЛФ в подгруппах обращает на себя внимание сходная диаграмма в подгруппах ФХ и ГХ и значительно более высокий уровень ЛФ в этих двух подгруппах, по сравнению с третьей.
Таким образом, при осложненных перитонитом формах ОХ уровень ЛФ в крови больных при поступлении оказывается ниже, чем при ФХ и ГХ (табл.9). После операции на 1-3 и 5-7 сутки при осложненных формах ОХ наблюдается плато из показателей ЛФ. Коэффициент Ф/ЛФ при осложненном течении острого холецистита равен 16, что свидетельствует о распространенном гнойно-деструктивном процессе в брюшной полости.
Группа больных с перитонитом была нами рапределена на три подгруппы в соответствии с величиной Маннгеймского перитонеального индекса (МПИ).
Анализируя средние уровни СРБ в сыворотках крови больных перитонитом во взаимосвязи со степенью тяжести процесса (табл.10), можно заметить, что при I степени тяжести перитонита (MPI менее 20 баллов) на всем протяжении наблюдения, уровень сывороточного СРБ в 1,5-2,5 раза ниже, чем средние цифры СРБ у всех больных с перитонитом (соответственно, 18,8±5,62 против 30,2±7,70 мг/л до операции, 13,9±4,24 против 24,5±6,90 на 1-3 сутки, 7,7±2,55 против 17,2±5,23 на 5-7 сутки и 5,8±1,21 против 10,2±3,84 на 9-13 сутки после операции).
При II и III степени тяжести перитонита уровни СРБ максимально высокие и до, и после операции, и их динамика практически не отличается в этих подгруппах (рис.4).
Следовательно, отсутствие различий по СРБ в группах, отличающихся прогнозом летального исхода, не позволяет использовать тест на этот белок как прогностический маркер летального исхода. Однако, значительные различия по СРБ при MPI менее 20 баллов (I степень) и MPI более 20 баллов (II и III степень тяжести) позволяет применить его в качестве прогностического и диагностического критерия различных осложнений послеоперационного периода.
Таблица 10
Динамика БОФ в сыворотке крови больных перитонитом и доноров
| БОФ | Срок после операции | MPI(баллы) | |||
| до 20 (I степень) (n=68) | 21 – 30 (II степень) (n=72) | больше 30 (III степень) (n=28) | Доноры (n=120) | ||
| СРБ (мг/л) | До операции 1-3 сутки 5-7 сутки 9-13 сутки | 18,8±5,62* 13,9±4,24* 7,7±2,55* 5,8±1,21* | 38,4±9,20* 32,2±8,89* 23,3±6,94* 13,7±4,47* | 36,7±14,03* 30,4±10,09* 24,1±9,56* 12,0±5,04* | 0,7±0,4 |
| СБАГ (мг/л) | До операции 1-3 сутки 5-7 сутки 9-13 сутки | 7,7±2,68* 3,0±0,90 2,0±0,64 2,0±0,76 | 6,5±2,33* 3,9±1,05 4,4±1,24 3,3±0,56 | 7,8±3,10* 6,0±2,25* 5,3±0,94* 4,0±0,92 | 1,8±0,31 |
| МГ (мг/л) | До операции 1-3 сутки 5-7 сутки 9-13 сутки | 776±152 934±194 1091±240 976±205 | 655±82* 747±63* 878±75 930±88 | 462±125* 443±98* 610±143* 735±233 | 1033±67 |
| Ф (нг/мл) | До операции 1-3 сутки 5-7 сутки 9-13 сутки | 376±48,2* 254±27,3* 169±24,0 167±25,7 | 591±74,4* 256±51,6* 295±73,2* 191±32,5 | 606±111,4* 556±115,0* 353±98,6* 224±60,7 | 115±20,5 |
| ЛФ (нг/мл) | До операции 1-3 сутки 5-7 сутки 9-13 сутки | 3670±379* 1270±233 1330±169 1160±148 | 3480±439* 1720±286* 2290±172* 1660±230* | 2990±765* 2500±570* 1960±324* 1740±331* | 1050±55 |
| Ф/ЛФ | До операции 1-3 сутки 5-7 сутки 9-13 сутки | 10 20 12 14 | 17 14 12 11 | 20 22 19 12 | 10 |
Примечание. *- достоверные (начиная с р<0,05) различия с контрольной группой доноров


Рис. 4. Динамика изменения уровня СРБ и СБАГ в сыворотке крови больных перитонитом
Анализируя средние уровни СБАГ в сыворотках крови больных разлитым гнойным перитонитом во взаимосвязи со степенью тяжести процесса (табл. 10), нами установлено, что в послеоперационном периоде также выявляются достоверно повышенные уровни СБАГ, но только в одной подгруппе – при III степени тяжести перитонита. При I степени тяжести перитонита (MPI менее 20 баллов) в послеоперационном периоде уровень сывороточного СБАГ нормализуется с 5-7 дня и в последующие дни наблюдения.
При II степени тяжести перитонита уровни СБАГ в послеоперационном периоде недостоверно выше нормы в 1,5-2,5 раза на всем протяжении наблюдения, и при III степени тяжести перитонита в послеоперационном периоде уровень сывороточного СБАГ превышают нормальные цифры СБАГ в 3 раза на 1-3 сутки и 5-7 сутки (р<0,05), оставаясь недостоверно повышенным в 2 раза до конца наблюдения (рис.4).
Детальный анализ средних уровней МГ в сыворотках крови больных разлитым гнойным перитонитом во взаимосвязи со степенью тяжести процесса (табл.10) выявляет четкие тенденции к снижению уровня МГ с увеличением степени тяжести перитонита. Однофакторный дисперсионный анализ подтверждает высокую степень достоверности этой зависимости (р=0,007895). При перитонитах II степени концентрация МГ в крови достоверно ниже нормы до операции и на 1-3 день после лапаротомии, оставаясь несущественно пониженной на 5-7 и 9-13 сутки. При перитонитах III степени тяжести обнаруживаются максимально низкие сывороточные уровни МГ как до, так и после операции (р<0,01) на 1-3 и 5-7 сутки. При этом при III степени, в отличие от двух других подгрупп больных с меньшими баллами MPI отмечается слабая тенденция к восстановлению уровня сывороточного МГ.
Таким образом, при перитоните низкий уровень МГ в сыворотке крови больных до операции (ниже 500 мг/л) и отсутствие повышения уровня МГ на 1-3 сутки после операции с высокой степенью вероятности может свидетельствовать о неблагоприятном прогнозе.
Изучение средних уровней железосодержащего белка Ф в сыворотках крови больных разлитым гнойным перитонитом во взаимосвязи со степенью тяжести процесса показало (табл.10), что достоверно повышенные уровни этого белка наблюдаются у больных всех трех степеней тяжести до операции и на 1-3 сутки после операции. На 5-7 сутки, уровень сывороточного Ф статистически значимо выше нормы при II и III степени тяжести перитонита и достоверно не отличается от нормы при I степени тяжести перитонита. Однако, в подгруппе больных с MPI 20-30 баллов на 1-3 сутки после лапаротомии наблюдается двухкратное снижение уровня Ф, а у больных с MPI более 30 баллов в эти же сроки уровень ферритина сохраняется на очень высоком уровне (табл.10).
Таким образом, чем тяжелее протекает перитонит, тем более интенсивно протекает биосинтез Ф в первые послеоперационные дни. Постепенное истощение резервов Ф к 9-13 суткам после операции при перитоните III степень тяжести приводит к падению его уровня в крови и высокой степени вероятности летального исхода. Значительные различия по Ф при MPI менее 20 баллов (I степень) и MPI более 20 баллов (II и III степень тяжести) позволяет применить Ф, также как и СРБ, в качестве прогностического и диагностического индекса различных осложнений послеоперационного периода.
Анализируя динамику ЛФ (табл.10) в подгруппах обращает на себя внимание тот факт, что чем легче степень тяжести перитонита, тем выше уровень ЛФ в крови до операции. После операции на 1-3, 5-7 и 9-13 сутки при первой степени тяжести перитонита наблюдается плато из показателей ЛФ, не отличающихся от нормы. При II степени тяжести перитонита мы обнаружили волновую динамику экспрессии в кровь ЛФ: на 5-7 сутки наблюдается повторный подъем уровня ЛФ в крови и повторное его снижение на 9-13 сутки.
Значения коэффициента Ф/ЛФ от 16 определяют распространенный гнойно-деструктивный процесс брюшной полости и II степени тяжести перитонита, значения более 20 соответствуют III степени тяжести перитонита и свидетельствуют о неблагоприятный исходе заболевания. Данное исследование показало, что повышение значения коэффициента Ф/ЛФ сопровождалось увеличением тяжести процесса и степени его распространенности
Таким образом, коэффициент Ф/ЛФ определяет степень гнойно-некротической деструкции в органах и распространенность патологического процесса при воспалительных заболеваниях органов брюшной полости, позволяющий повысить качество диагностики, на основании которой своевременно и адекватно клинической ситуации выбирать тактику лечения.
Выявление СРБ, СБАГ, 2-МГ, ЛФ и Ф в перитонеальном экссудате больных с острыми воспалительными
заболеваниями органов брюшной полости
Впервые установлено, что концентрации БОФ в экссудате достоверно выше, чем в сыворотке (табл.11). Нами обнаружено, что в среднем концентрации Ф в экссудате выше сывороточных в 2-3 раза, ЛФ – в 3-4 раза, СРБ – в 4-5 раза, а СБАГ – даже в 15-20 раз. Из 5 исследованных БОФ исключение составил только МГ, средние концентрации которого в перитонеальном экссудате достоверно в 2-4 раза ниже, чем в сыворотке (табл.11).
Таблица 11
Динамика БОФ в перитонеальном экссудате и сыворотке крови больных с перитонитом
| БОФ | Срок после операции | Гнойный перитонит (ГП) (n=56) | Фибринозный перитонит (ФП) (n=65) | Серозный перитонит (СП) (n=47) | |||
| экссудат | кровь | экссудат | кровь | экссудат | кровь | ||
| СРБ (мг/л) | 1-е сутки 3-е сутки 5-7 сутки 9-13 сутки | 107±27,4* 248±90,2* 155±64,3* 25±6,2 | 36,7±14,03 30,4±10,09 24,1±9,56 12,0±5,04 | 138±14,3* 112±17,5* 74±8,8* 16±4,3* | 30,4±4,29 27,6±6,14 21,3±6,77 3,6±1,29 | 34±4,8* 29±1,50* – – | 8,2±1,09 12,7±0,68 6,4±0,43 2,9±0,66 |
| СБАГ (мг/л) | 1-е сутки 3-е сутки 5-7 сутки 9-13 сутки | 147±13,4* 104±26,7* 74±28,2* 49±3,7* | 7,8±3,10 6,0±2,25 5,3±0,94 4,0±0,92 | 141±17,3* 95±13,4* 57±14,6* 38±9,2* | 5,6±1,53 5,9±1,75 4,3±1,03 1,6±0,58 | 99±8,9* 43±6,6* – – | 4,5±1,76 2,3±0,68 1,9±0,62 1,4±0,42 |
| МГ (мг/л) | 1-е сутки 3-е сутки 5-7 сутки 9-13 сутки | 190±40* 240±69* 130±28* 110±21* | 462±125 443±98 610±143 735±233 | 240±15* 320±29* 290±30* 240±27* | 992±135 1044±139 1156±162 1225±176 | 310±49* 360±92* – – | 931±90 1245±149 1223±161 1150±111 |
| Ф (нг/мл) | 1-е сутки 3-е сутки 5-7 сутки 9-13 сутки | 1288±70,2* 1119±30,5* 971±49,5* 766±51,6* | 606±111,4 556±115,0 353±98,6 224±60,7 | 701±179,2* 635±33,6* 605±50,5* 563±121,9* | 296±31,5 235±37,7 156±10,5 103±12,8 | 548±79,5* 441±18,9* – – | 264±26,6 250±23,1 201±28,9 192±22,9 |
| ЛФ (нг/мл) | 1-е сутки 3-е сутки 5-7 сутки 9-13 сутки | 12480±510* 9040±889* 6900±547* 4040±689* | 2990±765 2500±570 1960±324 1740±331 | 10330±1113* 9420±966* 7290±632* 4360±561* | 1960±148 2800±512 2940±413 1360±213 | 10800±570* 6120±280* – – | 2770±302 3110±105 3650±183 1640±62 |
Примечание. *- достоверные (начиная с р<0,05) различия с сывороточным уровнем в аналогичной группе больных.
Таким образом, обнаружение более высоких цифр для четырех БОФ в перитонеальном экссудате создает предпосылку для разработки на основе этого диагностического биоматериала более простых, экономичных и высокочувствительных тестов для абдоминальной хирургии.
Максимально высокие уровни СРБ в экссудате, как абсолютные (табл.11), так и относительно сыворотки крови, наблюдаются у больных с разлитым гнойным перитонитом (ГП). Причем, если пик белка в сыворотке наблюдался непосредственно в день операции, то в отделяемом по дренажам экссудате, его уровень был в 3 раза выше этого пика, и содержание СРБ продолжало нарастать в экссудате с максимумом на 3 день (248±90,2 мг/л или 816% от уровня СРБ в крови), сохраняясь в динамике на крайне высоком уровне и на 5-7 сутки (155±64,3 мг/л или 643% от уровня СРБ в крови). К 9-13 суткам уровень СРБ в экссудате снижался в 10 раз по сравнению с максимумом 3-го послеоперационного дня. Динамику изменения абсолютных значений СРБ в перитонеальном экссудате наглядно демонстрирует рис.5.

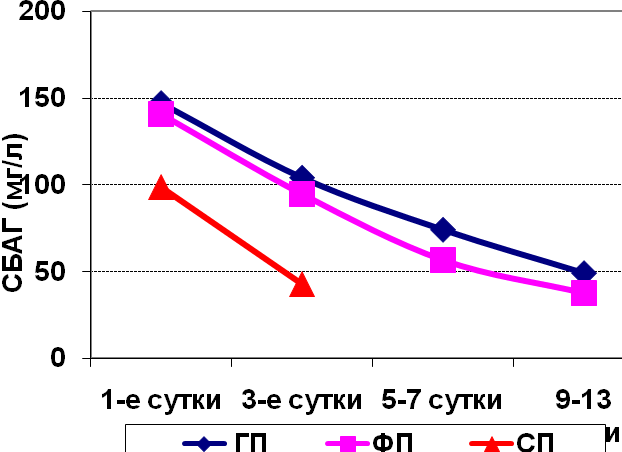
Рис. 5. Динамика изменения уровня СРБ и СБАГ в перитонеальном экссудате больных с перитонитами в зависимости
от характера экссудата
При фибринозном перитоните (ФП) в экссудате больных в течение всей первой недели нами также наблюдались высокие значения СРБ, каких никогда не встречалось в сыворотке крови больных. Максимум СРБ (138±14,3 мг/л или 454% от уровня СРБ в крови) наблюдался в день операции и в дальнейшей динамике снижения СРБ в этой группе больных (рис.5) наблюдался полный параллелизм с падением сывороточного СРБ, что выражалось в стабильном отношении СРБэкс к СРБсыв.
Степень корреляции (r) между СРБэкс и СРБсыв при ГП равна +0,58, а при ФП равна +0,98.
Анализируя в перитониальных экссудатах содержание СБАГ (табл.11, рис. 5), нами выявлены настолько высокие средние уровни этого белка в экссудатах по сравнению с кровью, что их абсолютные значения даже превосходили уровни СРБ: при гнойном и фибринозном перитоните (ГП и ФП) в экссудатах взятых интраоперационно или по дренажам сразу же после операции. Степень корреляции (r) между СБАГэкс и СБАГсыв при ГП равна +0,99, а при ФП равна +0,81.
Кроме отмеченных ранее достоверно низких уровней МГэкс по сравнению с МГсыв, обращает на себя внимание четкая взаимосвязь средних уровней МГэкс с характером перитонеального экссудата: чем тяжелее перитонит, тем больше депрессия биосинтеза МГ (табл.11).

Рис. 6. Динамика изменения уровня МГ в перитонеальном экссудате больных с перитонитами в зависимости от
характера экссудата
Из этой же таблицы 11 видно, что, независимо от степени тяжести перитонита, на 3 сутки после лапаротомии наблюдается относительный подъем средних уровней МГ, который при тяжелых формах перитонита (ГП и ФП) сменяется на 5-7 и 9-13 сутки дальнейшей прогрессивной депрессией экспрессии МГ в экссудат. Эта закономерность совершенно противоположна тенденции, наблюдаемой в сыворотке крови этих же больных, когда либо наблюдается плавное восстановление уровня МГсыв при ФП (степень корреляции (r) между МГэкс и МГсыв при ГП равна -0,93), либо постепенное восстановление МГсыв начинается после минимума на 3 сутки после операции (ФП) и тогда полностью отсутствует взаимосвязь между МГэкс и МГсыв (r= -0,18). И только при серозном выпоте (СП) проявляется тесная прямопропорциональная взаимосвязь между МГэкс и МГсыв.
Уровень ферритина (Ф) в отделяемом по дренажам экссудате больных с перитонитами достоверно повышен и полностью коррелирует с сывороточными уровнями Ф во все сроки наблюдения: степень корреляции (r) между Фэкс и Фсыв при ГП равна +0,97, а при ФП равна +0,98.
Кроме того, степень экспрессии Ф в экссудат тесно связана с характером экссудата. В динамике перитонита максимально высокие уровни Фэкс обнаруживаются интраоперационно, а после оперативного вмешательства происходит плавное, но неуклонное снижение средних уровней Ф во всех трех группах больных.
Анализируя по данным табл.11пятый БОФ – лактоферрин (ЛФ), обращает на себя внимание следующее: максимально высокие абсолютные (ЛФэкс) и относительные (ЛФэкс/ЛФсыв) уровни белка наблюдаются в день операции. Далее наблюдается постоянное снижение уровней ЛФ во всех группах. Причем более крутое падение абсолютных средних концентраций ЛФэкс наблюдается при ГП и более пологое с сохранением более повышенных уровней ЛФ на 3, 5-7 и 9-13 сутки наблюдается в группе больных с ФП.
Аналогичная динамика наблюдаются и в сыворотках этих больных. Относительные уровни ЛФ (ЛФэкс/ЛФсыв) при ГП имеют динамику похожую на динамику абсолютных уровней ЛФ (ЛФэкс), а при ФП на 9-13 сутки относительные уровни ЛФ повторно повышаются за счет опережающего падения в этот срок ЛФсыв.
Степень корреляции (r) между ЛФэкс и ЛФсыв при ГП равна +0,98, а при ФП равна +0,48.
Таким образом, динамика изменения уровня пяти избранных нами БОФ в перитонеальных экссудатах больных имеет свои особенности для каждого белка и указывает на специфическую роль каждого из них в патогенезе острых воспалительных заболеваний органов брюшной полости. Корреляционный анализ уровней БОФэкс (табл.12) подтверждает обнаруженный факт.
Таблица 12
Значения коэффициентов корреляции (r) между уровнями отдельных БОФ в перитонеальных экссудатах в динамике острых воспалительных заболеваний органов брюшной полости
| СРБ | СБАГ | МГ | Ф | ЛФ | |
| СРБ | 1,00 | ||||
| СБАГ | 0,55 | 1,00 | |||
| МГ | -0,18 | -0,06 | 1,00 | ||
| Ф | 0,67 | 0,58 | -0,60 | 1,00 | |
| ЛФ | 0,43 | 0,92 | 0,22 | 0,43 | 1,00 |
Комплексная программа прогнозирования осложнений острых воспалительных заболеваний органов брюшной
полости
Все исследуемые больные разделены на две группы. Первую группу составили 99 больных с неосложненным послеоперационным течением острого аппендицита, острого холецистита, острого панкреатита, острой кишечной непроходимости, перфоративной язвы желудка и двенадцатиперстной кишки, во вторую вошли 69 больных с внутрибрюшными послеоперационными гнойными осложнениями (табл.13).
Нами разработана прогностическая таблица 14, при помощи которой оцениваются шансы развития послеоперационных осложнений на основании клинических и иммунохимических данных, взятых до оперативного вмешательства и интраоперационно.
Таблица 13
Распределение больных по характеру послеоперационных гнойных осложнений
| Характер заболевания | n |
| Перитонит в результат несостоятельности кишечных швов | 11 |
| Перитонит без несостоятельности кишечных швов | 28 |
| Перитонит в результате перфорации острой язвы тонкой кишки | 4 |
| Множественные межпетельные абсцессы | 9 |
| Абсцесс подпеченочного пространства | 7 |
| Абсцесс сальниковой сумки | 4 |
| Абсцесс брюшной полости с подкожной эвентрацией | 6 |
| Всего | 69 |
Прогностическая значимость каждого критерия оценивалась по величине t - критерия Стьюдента с последующим расчетом показателя наглядности в баллах относительно самого высокого, который принят за 10 баллов. При этом количество процентов равно количеству баллов (табл.14).
Таблица 14
Балльная оценка клинических, лабораторных и иммунохимических параметров для прогнозирования осложненного течения
заболевания при поступлении и интраоперационно.
| ФАКТОРЫ РИСКА | t | БАЛЛЫ |
| Ф экс (нг/мл) более 700 | 6,98 | 10 |
| Ф/ЛФ более 16 | 4,39 | 7 |
| Возраст > 60 лет | 3,41 | 5 |
| Длительность заболевания > 24 часов | 3,64 | 5 |
| СБАГ экс (мг/л) более 70 | 2,98 | 5 |
| Источник перитонита – толстая кишка | 2,81 | 5 |
| ЛИИ более 8 | 2,73 | 4 |
| Источник перитонита – поджелудочная железа | 2,64 | 4 |
| МГ экс (мг/л) менее 240 | 2,64 | 4 |
| СРБ экс (мг/л) более 150 | 2,62 | 4 |
| Ф сыв более 600 | 2,43 | 4 |
| МГ сыв (мг/л) менее 600 | 2,39 | 4 |
| ЛФ экс (нг/мл) более 10000 | 2,20 | 4 |
| ЛФ сыв (нг/мл) более 3500 | 2,09 | 4 |
| Источник перитонита – желчный пузырь | 2,1 | 3 |
Сумма баллов (прогностический индекс – ПИ) при неосложненном течении перитонита колебалась от 0 до 38 и в среднем составила 17 баллов. У больных с ПГО сумма баллов находилась в пределах 21-75 баллов и в среднем составила 49 баллов. В первой группе больных перитонитом ПГО не было, во второй группе ПГО возникли у 13 человек, в третьей подгруппе ПГО отмечались у всех больных (табл.15).
Таблица 15
Распределение больных в зависимости от величины
прогностического индекса
| Группы больных | Величины индекса (баллы) | Число больных | Без осложнений | С осложнениями |
| первая | До 21 | 71 | 71 | 0 |
| вторая | 22 – 38 | 41 | 28 | 13 |
| третья | Более 38 | 56 | 0 | 56 |
| всего | 168 | 99 | 69 | |
Таким образом, средние значения прогностических индексов (ПИ) достоверно различались у больных с неосложненным течением и у больных с гнойными осложнениями (р<0,05). Полученные результаты позволили нам разделить всех больных на три группы. Первая группа с суммой баллов до 21 (71 человек), вторая - с суммой 22-38 баллов (41 человек), третья - более 38 баллов (56 человек). В первой группе больных перитонитом ПГО не было, во второй группе ПГО возникли у 13 человек, в третьей подгруппе ПГО отмечались у всех больных (табл.15).
Это позволяет нам сделать вывод, что у больных с суммой до 21 балла вероятность возникновения ПГО низкая, поэтому тактика ведения таких пациентов должна быть стандартной и не требует дополнительных диагностических и лечебных мероприятий; в группе с суммой 22-38 баллов вероятность ПГО высокая, есть необходимость в особо тщательном контроле состояния больных в послеоперационном периоде, дополнительных лечебные мероприятиях (усиление антибактериальной, дезинтоксикационной терапии эфферентных методов, иммуномодулирующей терапии). Если сумма более 38 баллов, то вероятность ПГО очень высокая и таким больным показана релапаротомия, мощная антибактериальная, иммуномодулирующая, дезинтоксикационная терапия. При изучении ПИ у 69 больных с ПГО, у 56 из них (81,2%) его величина превышала 38 баллов, что рассматривалось нами в качестве одного из показаний к релапаротомии.
Отбор критериев для ранней диагностики ПГО осуществлялся путем выделения из всех получаемых показателей тех, значения которых достоверно различались у больных с ПГО на момент их выявления, и в соответствующий срок послеоперационного периода у больных с нормальным его течением.
Дана балльная оценка степени отклонения каждого из показателей от нормальных значений (табл.16).
Таблица 16
Балльная оценка тяжести состояния больных
в послеоперационном периоде
| Параметры | 0 баллов | 1 балл | 2 балла | 3 балла |
| Клинические показатели | ||||
| Температура, °С | до 37 | 37 – 38 | 38 - 39 | выше 39 |
| ЧСС в 1 мин. | до 80 | 80 - 92 | 93 - 116 | более 116 |
| ЧДД в 1 мин. | до 20 | 20 - 24 | 25 - 32 | более 33 |
| Парез кишечника | нет | легкий | ср. тяжести | тяжелый |
| Лабораторные показатели | ||||
| ЛИИ | до 1,5 | 2 - 5 | 5 - 8 | более 9 |
| Ф СЫВ (нг/мл) | до 200 | 200-500 | 500-600 | более 600 |
| Ф ЭКС(нг/мл) | до 200 | 400-550 | 550-700 | более 700 |
| ЛФ СЫВ (нг/мл) | до 1500 | 1500-2000 | 2000-2500 | 2500-3500 |
| ЛФ ЭКС (нг/мл) | до 1500 | 6000-10000 | 7000-10000 | более 10000 |
| МГ СЫВ (мг/л) | до 1000 | 950-750 | 750-650 | менее 600 |
| МГ ЭКС (мг/л) | до 1000 | 300-400 | 240-300 | менее 240 |
| СБАГ СЫВ (мг/л) | до 2 | 2-8 | 5-8 | более 8 |
| СБАГ ЭКС (мг/л) | до 2 | 20-35 | 35-70 | более 70 |
| СРБ СЫВ (мг/л) | до 3 | 3-20 | 20-35 | более 35 |
| СРБ ЭКС (мг/л) | до 3 | 10-35 | 35-150 | более 150 |
| Ф/ЛФ | до 10 | до 15 | до 20 | более 20 |
В первые сутки после операции имеется достоверная разница между суммами баллов у больных с неосложненным и осложненным послеоперационным периодом – они равнялись соответственно 23 и 36 баллов (р < 0,05). Как видно из представленного графика, в последующем различие в значениях этих показателей увеличивалось: в группе с неосложненным послеоперационным периодом сумма баллов резко снижалась и на девятые сутки равнялась нулю; у больных с ПГО сумма баллов оставалась высокой, что сопровождалось возникновением ПГО( рис.7).
 Рис. 7. ДИ у больных с осложненным и неосложненным послеоперационным периодом
Рис. 7. ДИ у больных с осложненным и неосложненным послеоперационным периодом
На основе полученных результатов нами рассчитаны критические значения ДИ, превышение которых свидетельствует о высокой вероятности возникновения ПГО. Для первых - третьих суток послеоперационного периода «критический» ДИ равен 26 баллам, для пятых-седьмых - 12, для девятых и последующих - 4 баллам в сумме двух различных параметров.
При изучении ДИ у 69 больных с ПГО, у 65 из них (94,2%) его величина превышала критические значения, что рассматривалось нами в качестве одного из показаний к релапаротомии. Во время повторной операции наличие гнойно-воспалительного процесса в брюшной полости подтверждалось.
Превышение критического уровня ДИ в первые-третьи сутки после операции диктует необходимость в усилении интенсивной консервативной терапии и может служить одним из показаний для релапаротомии в ближайшие сутки. Если ДИ повышен в третьи-девятые сутки послеоперационного периода, то это является косвенным признаком наличия ПГО и служит основанием для постановки вопроса о повторной операции.
Эти показатели объективно отражают динамику воспалительного процесса, являются дополнительными информативными критериями для своевременной коррекции проводимого лечения, в том числе при определении показаний к ранней релапаротомии. Сочетанное использование ПИ и ДИ у больных с острой хирургической патологией органов брюшной полости позволило снизить летальность при ПЯ в 2,5 раза, при ОП на 3,6%, уменьшить среднюю длительность пребывания на койке на 1,2%, уменьшить число гнойных послеоперационных осложнений на 0,4%.
Специфичность (точность прогноза развития висцеральных осложнений) была от 78,6% до 82,4%, итоговая оценка безошибочности составляла 79,5%. Чувствительность, как показатель, характеризовавший точность прогноза развития висцеральных осложнений, находился на высоком уровне, итоговая оценка составляла 92,9% при уровне достоверности p<0,001.
ВЫВОДЫ
- Выявленные изменения концентрации БОФ: С-реактивного белка (СРБ), связанного с беременностью a2-гликопротеина (СБАГ), лактоферрина (ЛФ), ферритина (Ф), a2-макроглобулина (МГ) в биологических жидкостях (сыворотке крови, перитонеальном экссудате) у больных с острой хирургической патологией органов брюшной полости коррелируют со степенью выраженности воспаления и гнойно-деструктивных изменений в органах.
- Выявленные достоверно более высокие, чем в сыворотке крови, концентрации СРБ, Ф, ЛФ, СБАГ и низкий уровень МГ в перитонеальном экссудате коррелируют со степенью тяжести перитонита.
- Определены диагностически значимые уровни БОФ в сыворотке крови и экссудате, которые являются эффективными критериями оценки степени выраженности воспаления при каждой нозологической форме острых воспалительных заболеваний органов брюшной полости.
- Достоверно более высокие, чем в сыворотке крови, концентрации СРБ, Ф, ЛФ, СБАГ в перитонеальном экссудате на фоне низкого уровня МГ позволяет использовать этот диагностический биоматериал, как простой, экономичный и высокочувствительный тест для ранней диагностики гнойно-деструктивного процесса и его распространенности абдоминальной хирургии.
- Разработанный комплекс основных иммунохимических показателей объективного состояния пациента, достаточно полно отражает сдвиги, произошедшие в организме больного в динамике, при этом повторное нарастание СРБ, СБАГ, ЛФ, Ф и снижение уровня МГ в сыворотке и экссудате является ранним признаком послеоперационных гнойных осложнений.
- Коэффициент Ф/ЛФ более 16 характерен для распространенного гнойно-деструктивного процесса в брюшной полости и может быть использован для раннего выявления деструкции, степени распространенности патологического процесса, что позволило у 82% больных острым аппендицитом, 78% больных острым холециститом, 84% больных острым панкреатитом выявить ограниченный гнойный процесс в брюшной полости, и у 87% больных – разлитой гнойный перитонит.
- Для диагностики и прогнозирования гнойно-воспалительных осложнений острых заболеваний органов брюшной полости сформированы оптимальные диагностические критерии обследования больных, включающие комплексную оценку клинических, анамнестических, лабораторных и иммунохимических параметров, среди которых наиболее информативными являются: возраст, длительность перитонита, источник инфекции, концентрации СРБ, СБАГ, ЛФ, Ф, МГ, в сыворотке крови и перитонеальной жидкости.
- На основании клинико-лабораторных, анамнестических и иммунохимических данных, разработан прогностический индекс, значения которого у 81% больных превышали 38 баллов, что свидетельствовало о возникновения послеоперационных гнойных осложнений.
- Использование диагностического индекса у 94,2% больных с высоким риском развития послеоперационных гнойных осложнений позволило своевременно корректировать объем и тактику лечебных мероприятий.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Учитывая вариабельность проявления клинической картины острой воспалительной патологии органов брюшной полости в зависимости от возраста, пола, недостаточной информативности традиционных клинико-лабораторных данных, необходимо проводить тщательную диагностику степени воспаления и деструкции используя иммунохимические тесты на острофазовые белки: СРБ, МГ, СБАГ, Ф и ЛФ.
- Динамическое определение концентрации БОФ в сыворотке и экссудате в качестве маркеров воспаления и деструкции вносит существенный вклад в контроль эффективности лечения острой хирургической патологии органов брюшной полости.
- Коэффициент соотношения ферритин/лактоферрин рекомендуется использовать для дифференциальной диагностики воспалительных и гнойно-деструктивных процессов в абдоминальной хирургии.
- Для прогнозирования гнойно-воспалительных осложнений у больных, с острыми хирургическими заболеваниями органов брюшной полости, рекомендуется определение прогностического индекса. При этом оценку вероятности развития гнойно-воспалительных осложнений и коррекцию лечебной тактики целесообразно осуществлять в зависимости от величины прогностического индекса.
- С целью ранней диагностики гнойно-воспалительных осложнений у больных с острой хирургической патологией органов брюшной полости рекомендуется проводить ежесуточный мониторинг состояния с использованием диагностического индекса.
- Для достижения наибольшей эффективности диагностических и лечебных мероприятий у больных с острой хирургической патологией органов брюшной полости необходимо сочетанное использование прогностического и диагностического индексов. При этом наиболее целесообразным является использование диагностического индекса у больных с высоким риском гнойно-воспалительных осложнений, который определяется в зависимости от величины прогностического индекса.
Список работ по теме диссертации, опубликованных в
рецензируемых изданиях, рекомендованных ВАК РФ
- Зурнаджьянц, В. А. Диагностическая и прогностическая роль белков острой фазы при остром панкреатите/ В. А.Зурнаджьянц, Э. А. Кчибеков // Инфекции в хирургии. – 2009.-Т.7, № 2.- С.- 45-47.
- Зурнаджьянц, В. А. Диагностические и прогностические критерии комплексного лечения острого холецистита / В. А.Зурнаджьянц, Э. А. Кчибеков // Инфекции в хирургии. – 2009.-Т.7, № 4.- С.- 24-26.
- Кчибеков, Э.А. Диагностическое значение ферритина и лактоферрина при остром калькулезном холецистите / Э.А. Кчибеков, А.В. Журихин // Вестник РУДН.-,2009, №4.- С.- 114.
- Абрамов, А.А. Комплексный подход в диагностике скрытых форм острого холецистита / А.А. Абрамов, Э. А. Кчибеков, А.Г. Сердюков // Вестник новых медицинских технологий.- 2009.- Т 16, №2.-С.- 131-133.
- Кчибеков, Э. А. Иммунохимический способ диагностики деструктивных форм острого холецистита / Э. А. Кчибеков // Вестник Национального медико-хирургического центра им. Н.И. Пирогова.-2010.- Т-5, № 1.- С.- 98-101.
- Кчибеков, Э. А. Иммунохимический способ дифференциальной диагностики острого панкреатита и острого холецистита / Э. А. Кчибеков, В. А. Зурнаджьянц // Сибирский медицинский журнал.- 2010, № 3.- С.-81-83.
- Кчибеков, Э. А. Современные аспекты оценки степени тяжести состояния больных перитонитом / Э. А. Кчибеков // Астаханский медицинский журнал.- 2010, №3.- С.- 90-92.
- Кчибеков, Э. А. Диагностическая и прогностическая роль концентрации лактоферина и ферритина в биологическом материале у больных острым холециститом / Э. А. Кчибеков // Астраханский медицинский журнал – 2010, № 3. - С.22-23.
- Кчибеков, Э. А. Железосодержащие белки, как маркеры деструкции при остром аппендиците / Э. А. Кчибеков // Военно-медицинский журнал.- 2010.- Т. 331, № 8.-С.- 50-51.
- Топчиев, М.А. Особенности цитокинэмии и острофазного ответа при перфоративной гастродуоденальной язве, осложненной различными формами перитонита / М.А. Топчиев, Э. А. Кчибеков, Н.Ю. Шапошников, И.В. Срибный // Астаханский медицинский журнал.- 2010, №3.- С.- 52-55.
- Кчибеков, Э. А. Диагностическая и прогностическая роль металлопротеинов при остром аппендиците / Э. А. Кчибеков // Вестник Национального медико-хирургического центра им. Н.И. Пирогова.- 2010. Т. 5, №3. С.- 91.
- ТопчиевМ.А. Клинико-диагностическое значение связанного с беременностью альфа2-гликопротеина при различных формах острого аппендицита / М.А. Топчиев, Ф.В. Орлов, Э. А. Кчибеков, Д.С. Паршин, Ю.А. Кривенцев // Астаханский медицинский журнал.- 2011, №1.- С.- 158-160.
- Рамазанов, М.В. Анализ корреляции ферропротеинов при распространенном перитоните / М.В. Рамазанов, Е.В. Бутырина, Э. А. Кчибеков // Астраханский медицинский журнал. – 2011, № 1. - С.101-104.
- Кчибеков, Э. А Комплексная программа прогнозирования осложнений острых воспалительных заболеваний органов брюшной полости / Э. А. Кчибеков // Астраханский медицинский журнал – 2011, № 2. - С.89-101.
- Никулина, Д.М. Диагностика степени выраженности и распространенности воспалительного процесса в брюшной полости при перитоните / Д.М. Никулина, В. А. Зурнаджьянц, Э. А. Кчибеков // Астраханский медицинский журнал – 2011, № 2. - С.121-123.
Авторские свидетельства и патенты на изобретение:
- Патент на изобретение РФ № 2395085 РФ, G01N 33/48 от 20.07.2010 «Способ дифференциальной диагностики острого панкреатита и острого холецистита» (Соавт. Зурнаджьянц В.А.).
- Патент на изобретение РФ № 2407017 С1 РФ, G01N 33/68 от 20.12.2010 «Способ диагностики деструктивных форм острого холецистита» (Соавт. Рамазанов М.В.).
Список остальных научных работ, опубликованных по теме диссертации.
- Кчибеков, Э. А. Минорные белки в оценке степени тяжести состояния больных перитонитом / Э. А. Кчибеков, В. А. Зурнаджьянц, Ю. А. Кривенцев // Анналы хирургии. - 2007. - N 3. - С. 61-62.
- Кчибеков, Э.А. Роль лактоферина и альфа два макроглобулина в диагностике острого панкреатита / Э.А. Кчибеков, Д.М. Никулина, В.Е. Кутуков // « Актуальные вопросы современной хирургии» - Астрахань. – 2006. – С. 122.
- Кчибеков, Э.А. Уровни лактоферина, ферритина и фетального гемоглобина при заболеваниях гепатобиллиарной зоны и травмах / Э.А. Кчибеков, А.В. Коханов, Е.В. Метелкина // « Актуальные вопросы современной хирургии» Материалы Всероссийской конференции, посвященной 85-летию Астраханского областного научного медицинского общества хирургов — Астрахань. - 2006. - С. – 313-314.
- Кчибеков, Э.А. Роль альфа два макроглобулина в дифференциальной диагностике острого панкреатита и острого холецистита / Кчибеков Э.А // Материалы Международной научной конференции «Молодежь - медицине будущего».- Одесса.- 2009. - С.146-147.
- Кчибеков, Э.А. Сравнительная характеристика железосодержащих белков в эктомированных желчных пузырях больных острым холециститом / Э.А. Кчибеков, М.В. Рамазанов // Материалы Международной научной конференции «Молодежь- медицине будущего».- Одесса.- 2009. - С. -147-148.
- Кчибеков, Э.А. Современный аспект иммунохимического метода дифференциальной диагностики острого панкреатита / Э.А. Кчибеков, Д.М. Никулина, М.А. Топчиев // Сборник научных трудов АГМА, посвященный 90-летию АГМА. Актуальные вопросы современной медицины - Астрахань. - 2008. -Том 37 - С. -94-95.
- Кчибеков, Э.А. Лактоферрин в диагностике острого холецистита / Э.А. Кчибеков, А.В.Журихин // Перитонит. Материалы Всеросийской научнопрактической конференции с международным участием.- Анапа.- 2009.- С.186-188.
- Журихин, А.В. Диагностика, лечение и профилактика послеоперационного желчеистечения и желчного перитонита / А.В. Журихин, Г.Д. Одишелашвили, Э.А. Кчибеков, Р.М. Курбанов // Перитонит. Материалы Всеросийской научнопрактической конференции с международным участием.- Анапа.- 2009.- С.94-96.
- Савенков, М.С.Динамика ферритина в эволюции острого обструктивного холецистита / М.С. Савенков, О.В. Петрова, Э.А. Кчибеков, А.А. Оганесян, В.И. Балашов // Современные проблемы науки и образования.-2006.- №3.-С.- 47-49.
- Зурнаджьянц, В. А. Сравнительная оценка инструментальных и иммунохимических показателей степени выраженности деструкции при остром холецистите / В. А. Зурнаджьянц, Э. А. Кчибеков, В.А. Иванников, А.Н. Панов, А.А.Чистяков, А.А. Тюрин // - Материалы межрегиональной научно-практической конференции «Актуальные вопросы ургентной хирургии».- Вестник экспериментальной и клинической хирургии.- Воронеж.- 2010.-С.- 49-50.
- Зурнаджьянц, В. А. Оптимизация прогноза гнойных осложнений острого аппендицита / В.А. Зурнаджьянц, Э.А. Кчибеков //. Труды АГМА « Актуальные вопросы современной медицины»- Астрахань.- 2010.- Т.-41.-С.- 162 -163.
- Кчибеков, Э.А. Диагностическая ценность белков острой фазы в оценке степени тяжести состояния больных с прободными гастродуоденальными язвами / Э.А. Кчибеков, Ю.А. Кривенцев, М.В. Рамазанов // Достижения фундаментальных наук в решении актуальных проблем медицины - Материалы научно-практической конференции и школы-семинара для молодых ученых с международным участием – Астрахань. -2010.- Т 5.- №1.– С. - 46-48.
Методическое пособие
30.Журихин, А.В. Особенности клинического течения и диагностика острого калькулезного холецистита / А.В. Журихин, Э.А. Кчибеков // Астрахань: АГМА, 2010.-31с.
Список условных сокращений
| АБП– | абсцесс брюшной полости |
| АИ– | аппендикулярный инфильтрат |
| БОФ- | белки острой фазы |
| ГО– | гнойные осложнения |
| ГП– | гнойный перитонит |
| ДИ– | диагностический индекс |
| ДП– | деструктивный панкреатит |
| ИФА | иммуноферментный анализ |
| ЛФ– | лактоферрин |
| ЛИИ– | лейкоцитарный индекс интоксикации |
| МГ– | альфа2-макроглобулин |
| МПИ- | индекс перитонита Маннгеймера |
| ОА– | острый аппендицит |
| ОГА– | острый гангренозный аппендицит |
| ОГХ– | острый гангренозный холецистит |
| ОКА– | острый катаральный аппендицит |
| ОП– | острый панкреатит |
| ОФА- | острый флегмнозный аппендицит |
| ОФХ- | острый флегмнозный холецистит |
| ОХ– | острый холецистит |
| П– | перитонит |
| ПГО– | послеоперационные гнойные осложнения |
| ПИ– | прогностический индекс |
| ПЯ– | перфоратиная язва |
| СБАГ- | связанный с берменонстью алфа2-гликопртеин |
| СРБ– | С - реактивный белок |
| СП– | серозный перитонит |
| СФ– | сывороточный ферритин |
| Ф– | ферритин |
| ФП - | фибринозный перитонит |
| АРАСНЕ-II | Acute Physiology and ChronicHealth Evalution II |
| MPI- | Мангеймский перитонеальный индекс |
Кчибеков Элдар Абдурагимович
Комплексная диагностика и
прогнозирование осложнений острых воспалительных заболеваний
органов брюшной полости
14.01.17 – хирургия
03.01.04- биохимия
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Подписано в печать 29.03.2011 г. Тираж 200 экз. Заказ №
Издательство ГОУ ВПО «Астраханская государственная медицинская академия» Минздравсоцразвития России, 414000, г. Астрахань, ул. Бакинская, 121

