Разработка мишеней для терапии колоректального рака на основе функциональной геномики
На правах рукописи
Коротаева Александра Алексеевна
Разработка мишеней ДЛЯ ТЕРАПИИ колоректального рака на основе функциональной геномики
03.02.07 — генетика
Автореферат
диссертации на соискание учёной степени
кандидата медицинских наук
Москва – 2013
Работа выполнена в Федеральном государственном бюджетном учреждении «Медико-генетический научный центр» Российской академии медицинских наук
Научный руководитель:
Карпухин Александр Васильевич, доктор биологических наук, профессор
Официальные оппоненты:
Петрин Александр Николаевич, доктор медицинских наук, профессор.
Государственное бюджетное образовательное учреждение высшего профессионального образования «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Министерства здравоохранения Российской Федерации, заведующий лабораторией медицинских генетических технологий
Асанов Алий Юрьевич доктор медицинских наук, профессор
Государственное бюджетное образовательное учреждение высшего профессионального образования «Первый Московской государственный медицинский университет им. И.М.Сеченова» Министерства здравоохранения Российской Федерации, заведующий кафедрой медицинской генетики
Ведущая организация:
Государственное бюджетное образовательное учреждение высшего профессионального образования “Российский национальный медицинский университет имени Н.И.Пирогова” Министерства здравоохранения Российской Федерации
Защита состоится «____»________ 2013г. в _____ часов на заседании Диссертационного ученого совета Д 001.016.01 при Федеральном государственном бюджетном учреждении «Медико-генетический научный центр» Российской академии медицинских наук (115478, Москва, ул. Москворечье, д. 1)
С диссертацией можно ознакомиться в библиотеке Федерального государственного бюджетного учреждения «Медико-генетический научный центр» Российской академии медицинских наук по адресу: 115478, Москва, ул. Москворечье, д. 1.
Автореферат разослан «___»___________ 2013 г.
Ученый секретарь Диссертационного совета Д 001.016.01
по защите диссертаций на соискание ученой
степени кандидата наук, на соискание
ученой степени доктора наук,доктор медицинских наук, профессор Зинченко Рена Абульфазовна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования
Одним из основных средств терапевтического лечения колоректального рака является химиотерапия. Применяемые в настоящее время средства химиотерапии характеризуются не высокой эффективностью, но весьма значимой токсичностью, ограничивающей возможности длительного воздействия на опухоль (Galluzi L. et al., 2012). Наиболее современным средством в настоящее время является так называемая таргетная терапия, направленная на блокирование проявления конкретных генов. Но используемые сейчас способы и средства блокирования отдельных генов также несовершенны. Многие из них токсичны, недостаточно специфичны или не оказывают должного терапевтического эффекта. Требуется развитие новых подходов, базирующихся на последних достижениях и учитывающих структурно-функциональные особенности клеток злокачественной опухоли.
К наиболее современным способам блокирования функции генов относится РНК-интерференция. Применение малых интерферирующих РНК (миРНК), с высокой специфичностью ингибирующих функцию генов, является перспективным для разработки противоопухолевого средства, позволяющего существенно снизить дозировку стандартного химиопрепарата и, соответственно, свести к минимуму его побочное действие, при повышении эффективности терапии (Pecot C.V.et al., 2011).
Как известно, одной из причин, неконтролируемого размножения раковых клеток является нарушение механизма апоптоза. Современная химиотерапия опухолей часто базируется на стимулировании апоптоза раковых клеток. Индуцирование апоптоза раковых клеток является одним из основных направлений в современной терапии рака (Miura K et al., 2011). Исследование генов, участвующих в апоптозе, может помочь разобраться в процессах, происходящих в раковых клетках, а в последующем и улучшить антираковую терапию. Белки ингибиторы апоптоза - IAP (inhibitors of apoptosis proteins) играют очень важную роль в регуляции апоптоза, препятствуя его развитию. Повышенная экспрессия генов репарации и репликации ДНК позволяет опухолевой клетке восстанавливаться после воздействия цитостатиков, нейтрализуя терапевтический эффект (Krawczyk P et al., 2012). «Выключение» генов - ингибиторов апоптоза и генов, участвующих в контроле целостности генома, должно приводить к запрограммированной гибели раковой клетки, особенно в условиях индукции апоптоза при воздействии химиопрепарата.
Исследование таких генов имеет как фундаментальное значение, с точки зрения выявления функции генов в норме и при злокачественной трансформации, так и практическое значение, заключающееся в создании новых лекарственных средств.
Цель исследования
Разработка мишеней для терапии колоректального рака на основе малых интерферирующих РНК и функционального анализа генов.
Задачи исследования:
1) На модели культивируемых клеток колоректального рака с мутацией в гене АРС с использованием малых интерферирующих РНК изучить значение экспрессии гена c-MYC для жизнеспособности раковых клеток. Сравнить полученные характеристики с уровнем экспрессии и апоптоза в клетках колоректального рака с отсутствием мутации в гене АРС.
2) Изучить апоптотический эффект от блокирования гена KRAS на модели клеток НТ-29. Определить уровень апоптоза при совместном ингибировании генов c-MYC и KRAS.
3) Изучить профили экспрессии сформированного набора генов в культивируемых клетках колоректального рака в зависимости от дозы и времени действия химиотерапевтического препарата оксалиплатина. Выявить потенциальные гены-мишени терапевтического воздействия.
4) Изучить апоптотический эффект от блокирования генов-мишеней в культивируемых клетках колоректального рака с помощью малых интерферирующих РНК на фоне воздействия оксалиплатина.
Новизна полученных результатов
Выявлено, что ингибирование функциональной активности гена c-MYC с помощью малых интерферирующих РНК приводит к апоптотическому эффекту в клетках колоректального рака с мутацией в гене АРС, но не эффективно для клеток рака этой локализации без мутации в гене АРС. Показано, что совместное ингибирование генов c-MYC и KRAS приводит к аддитивному апоптотическому эффекту. На основании исследования профилей экспрессии генов в клетках колоректального рака с мутацией в гене АРС выявлены потенциальные мишени терапевтического воздействия - гены Birc3, Birc7 и MCM4. Впервые изучен апоптотический эффект от ингибирования гена МСМ4 в клетках колоректального рака с мутацией в гене АРС. Впервые показано, что совместное ингибирование генов Birc7 и MCM4 дает синергетический апоптотический эффект, близкий к аддитивному при низкой дозе оксалиплатина.
Научно-практическая значимость работы
Разработан подход к таргетной терапии колоректального рака, основанный на выявлении генов-мишеней, блокирование которых позволяет существенно усилить ответ на стандартную химиотерапию. Выявлены гены, которые реагируют повышением экспрессии на разные концентрации оксалиплатина на всем протяжении культивирования. Такой подход является перспективным для поиска новых генов-мишеней терапевтического воздействия. Сконструированы и синтезированы малые интерферирующие РНК (миРНК) для ингибирования функции выявленных генов-мишеней. Найдена комбинация миРНК, обладающая синергетическим эффектом. При 5 мкМ оксалиплатина уровень апоптоза при ингибировании комбинации генов составил 80%, что соответствует действию в 16 раз большей дозы оксалиплатина без ингибирования этих генов. Разработка нового эффективного противоопухолевого препарата на основе полученных результатов позволит повысить эффективность противоопухолевой терапии при снижении уровня побочных явлений, что приведет к сохранению деятельной жизни многих больных и увеличению ее продолжительности.
Положения, выносимые на защиту
1) Подавление гена с-MYC в культуре клеток колоректального рака НТ-29 с мутацией в гене APC приводит к апоптотическому эффекту достигающему 15-17 %. На клетках культуры Сасо2 без мутации в гене АРС при ингибировании гена с-MYC апоптоз практически не развивается.
2) Ингибирование гена KRAS в культуре клеток колоректального рака НТ-29 приводит к апоптотическому эффекту, достигающему 14 %. Совместное ингибирование генов c-MYC и KRAS приводит к аддитивному апоптотическому эффекту на уровне 30% клеток.
3) Определены профили экспрессии набора генов в зависимости от дозы и времени действия химиотерапевтического препарата оксалиплатина в культуре клеток НТ-29. В результате проведенного анализа выявлены потенциальные мишени терапевтического воздействия - гены Birc3, Birc7 и MCM4.
4) При ингибировании генов Birc3, Birc7 и MCM4 малыми интерферирующими РНК в сочетании с низкими концентрациями оксалиплатина 1 мкМ и 5 мкМ выявлено, что ингибирование гена МСМ4 приводит к наиболее высокому уровню апоптоза, достигающему 60% в сочетании с 5 мкМ оксалиплатина.
5) При ингибировании попарных комбинаций этих трех генов выявлена наиболее эффективная пара, включающая гены Birc7 и MCM4, ингибирование которых приводит к значительному апоптотическому эффекту, достигающему 80% на фоне 5 мкМ оксалиплатина.
Апробация работы
Основные положения и результаты работы представлены и обсуждены на российских и международных научно-практических конференциях и съездах: XV, XVI Российских Онкологических Конгрессах (Москва 2011-2012 гг.); Всеросс. конф. с международным участием «Молекулярная онкология» (Новосибирск. 2008), 8-ой Международной конференции «Молекулярная генетика соматических клеток». (Звенигород, 2011); VI Съезд Российского общества медицинских генетиков (Ростов, 2010), European Human Genetics Conferences (Вена, 2009; Гетеборг, 2010; Амстердам, 2011); работа стала лауреатом конкурса «Авангард знаний» 2012 г. в категории «Онкология».
По результатам работы подана заявка на патент №2013136339 от 02.08.2013 «Способ индукции апоптоза клеток злокачественной опухоли колоректального рака и средство для его осуществления».
Работа апробирована и рекомендована к защите на заседании научного семинара ФГБУ «МГНЦ» РАМН 19 июня 2013 года.
Личное участие диссертанта
Автором проанализирована отечественная и зарубежная литература по теме диссертации. Все использованные в работе данные получены при непосредственном участии автора: на этапах постановки цели и задач, разработки методов их выполнения, проведении исследований, обработки, анализа и обобщения полученных результатов, написания и оформления рукописи. Результаты исследования опубликованы в научных журналах и доложены на конференциях.
Публикации
По теме диссертации опубликовано 14 научных работ, из них 4 – в журналах, рекомендуемых ВАК МОН РФ для опубликования основных научных результатов диссертации на соискание учёной степени кандидата наук.
Структура и объём работы
Диссертационная работа состоит из введения, обзора литературы, описания использованных в работе материалов и методов, результатов исследований и обсуждения полученных результатов, заключения, выводов и списка цитируемой литературы. Диссертация изложена на 134 страницах машинописного текста, содержит 32 рисунка и 5 таблиц. Список цитируемой литературы включает 133 источника, из них 8 отечественных и 125 иностранных источников.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали культивируемые in vitro клетки колоректального полипозного рака человека НТ-29 (АРС-/-), с мутацией в гене АРС, и Сасо-2 (АРС+/+), без мутации в гене АРС. Последовательность РНК олигонуклеотидов подбирались с помощью специализированной программы BLOCK-iT™ RNAi Designer (Invitrogen, Life Technologies, USA). Для каждого гена мишени подбиралось несколько вариантов миРНК, из которых выбирались наиболее эффективные. Эффективность в данном случае определялась наибольшим подавлением экспрессии гена при наименьшей концентрации миРНК. В дальнейшую работу отобраны олигонуклеотиды, проявляющие максимальную ингибирующую активность.
Трансфекцию клеток синтетическими олигонуклеотидами (миРНК) проводили липосомным методом согласно протоколу производителя с использованием реагентов Lipofectamine RNAiMAX (“Invitrogen”, США). Трансфекция сделана прямым методом, т.е. смесь для трансфекции вносили непосредственно в среду культивирования. За 2 дня до эксперимента (трансфекции) клетки высевали на 12-ти луночные плашки, в концентрации 7,5*104 клеток в 1 мл среды. Перед трансфекцией питательную среду с 10% сывороткой заменяли на ту же среду с 1% сывороткой, согласно протоколу.
Анализ апоптотических клеток проводили через 24 и 48 часов после трансфекции с помощью инвертированного микроскопа AxioObserver D1 (“Carl Zeiss”), оснащенного цветной цифровой камерой Icc1. Анализ фотографий проводили с помощью пакета прикладных программ AxioVision 3.1 (“Carl Zeiss”).
Число апоптотических клеток подсчитывали после прижизненного окрашивания с помощью набора для определения апоптоза Vybrant Apoptosis Assay Kit #5 (Invitrogen, USA), включающего флуоресцентные красители (Hoechst 33342 и пропидиум йодид (PI).
В ходе работы проведен анализ изменения уровня экспрессии мРНК набора генов в клетках НТ-29 и Сасо-2. Измерения уровня экспрессии клеток, обработанных оксалиплатином и/или миРНК, проводили относительно ничем не обработанных клеток. В процессе анализа выполнены следующие процедуры: выделение суммарной (тотальной) РНК из клеточных культур (РНК RNeasy Mini Kit (QIAGEN, США)); определение концентрации водного раствора суммарной РНК (Nanodrop 1000); проведение реакции обратной транскрипции (ImProm-II™ Reverse Transcriptase (Promega)); ПЦР в реальном времени (RT-PCR) с продуктами обратной транскрипции (Real time StepOnePlus (Applied Вiosystems)), оценка качества проведенной RT-ПЦР. Оценку чистоты реакции проводили по кривой плавления амплифицированных фрагментов ДНК, соответствующих каждому гену. Все эксперименты повторены несколько раз и оценивались только после получения одинаковых повторяющихся результатов в разных экспериментах. Для проверки зоны линейности сделаны серийные разведения кДНК. По результатам ПЦР в реальном времени построены калибровочные кривые для каждого гена.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
- АНАЛИЗ ИНГИБИРОВАНИЯ ГЕНА C-MYC
Для исследований отобраны две культуры клеток полипозного рака кишечника - НТ-29 (с мутацией в гене АРС) и Сасо2 (без мутации в гене АРС). Культура Сасо2 выбрана как контрольная, т.к. вследствие отсутствия в ней мутации в гене АРС ген с-MYC не должен находиться в состоянии повышенной экспрессии.
Определена функциональная активность (экспрессия) гена с-MYC в обоих из указанных типах культивируемых клеток колоректального рака. Найдено, что экспрессия гена с-MYC в культуре НТ-29 более, чем в 5 раз превышает экспрессию этого гена в культуре Сасо2 (Рис. 1).
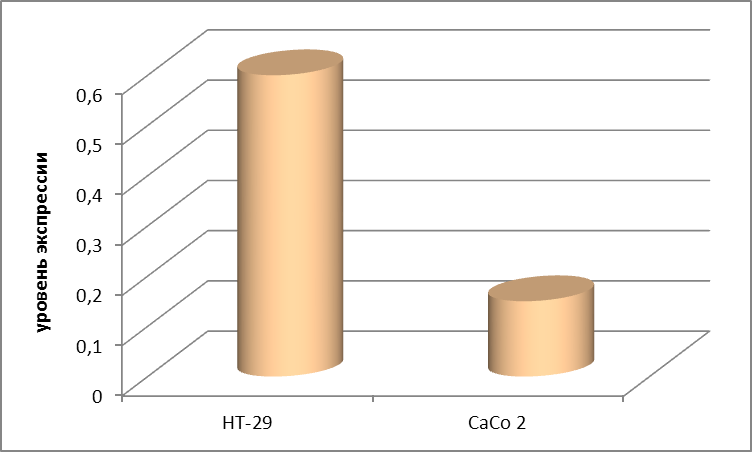
Рис. 1 Сравнение экспрессии гена с-MYC в культурах клеток полипозного колоректального рака
Чтобы выявить значения уровня экспрессии гена с-MYC для жизнеспособности раковых клеток, провели ингибирование гена с-MYC в обеих клеточных линиях.
Число апоптотических клеток подсчитывали после прижизненного окрашивания флуоресцентными красителями. Предварительно во всех лунках оценивали конфлюентность. Подсчет проводили визуально, не менее, чем в 10 полях на лунку. Вначале общее количество клеток подсчитывали под проходящим светом, потом микроскоп переводили во флуоресцентный режим и проводили подсчет апоптотических и мертвых клеток. В клетках обоих культур определили число апоптотических клеток.
Обнаружено, что после подавления гена с-MYC апоптоз в культуре клеток НТ-29 в 2-3 раза превышает апоптоз в культуре клеток Сасо2. При этом, в культуре НТ-29 наблюдался значительно больший апоптотический эффект относительно ничем не обработанных клеток, и клеток, обработанных случайной последовательностью нуклеотидов (Табл 1, Рис. 2).
Таблица 1 Сравнение апоптотического эффекта при ингибировании гена с-MYC на культурах клеток полипозного колоректального рака
| Культура клеток | Гибель клеток в контроле, без подавления гена с-MYC | Гибель клеток при подавлении гена с-MYC | Гибель клеток при добавлении олигонуклеотида со случайной последовательностью нуклеотидов |
| НТ-29 | 1-2% | 15-17% | 8-10% |
| Сасо2 | 2-3% | 6-7% | 6-8% |
 | 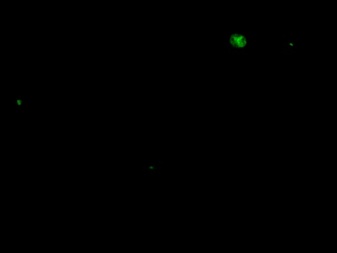 | 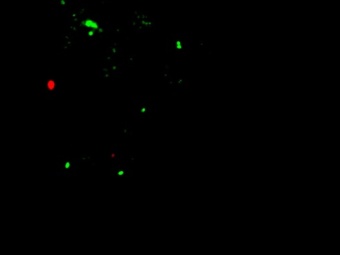 | 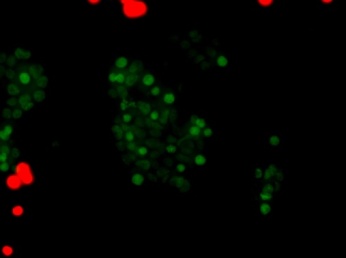 | |
| 1-Культура Caco2, контрольные клетки. Окрашиваются единичные апоптотические клетки (1-3%). | 2-Культура НТ-29, контрольные клетки. Окрашиваются единичные апоптотические клетки (1-3%). | 3–Культура Сасо2 с блокированным геном c-MYC. Гибель клеток 6-7%. | 4–Культура НТ-29 с блокированным геном c-MYC. Гибель клеток 15-17%. | |
Рис. 2 Фотографии клеток рака толстой кишки НТ-29 и Caco2 под флуоресцентным микроскопом.
К генам, играющим ключевую роль в развитии колоректального рака, относится также ген KRAS. Изучен апоптотический эффект, вызываемый ингибированием гена KRAS «дикого» типа. В культуре клеток НТ-29 этот ген не имеет мутации. Поставлены эксперименты на культуре клеток НТ-29 с ингибированием гена KRAS. Апоптоз при этом составил 14%. Это значение не сильно отличалось от ингибирования гена с-MYC (17%). Для усиления апоптотического эффекта поставлены эксперименты по совместному ингибированию этих генов, в результате общий апоптотический эффект составил 30% (Рис. 3).
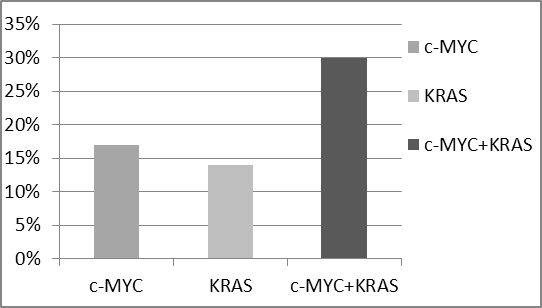
Рис. 3 Апоптотические эффекты при ингибировании генов c-MYC и KRAS
Полученный данные показывают, что эффект совместного ингибирования генов c-MYC и KRAS носит аддитивный характер.
В то же время, уровень стимулирования апоптоза при блокировании генов с-MYC и KRAS, относящихся к ключевым для развития колоректального рака, в исследованных клетках рака этой локализации недостаточен для применения такого подхода в терапевтических целях.
Актуальным является создание препаратов для комплексной терапии, включающей стандартную химиотерапию в сочетании с таргетными препаратами. Для химиотерапевтического воздействия выбран препарат оксалиплатин.
- ЗАВИСИМОСТЬ АПОПТОТИЧЕСКОГО ЭФФЕКТА ОТ ДОЗЫ И ВРЕМЕНИ ВОЗДЕЙСТВИЯ ОКСАЛИПЛАТИНА
Основным направлением настоящей работы явилась разработка основ нового перспективного противоопухолевого средства, которое могло бы свести к минимуму побочные эффекты от воздействия химиопрепарата и при этом добиться максимального апоптотического эффекта. Работу проводили на культивируемых клетках полипозного колоректального рака с мутацией в гене АРС (НТ-29). Для химиотерапевтического воздействия выбран один из наиболее современных препаратов, используемых при лечении рака кишечника, - оксалиплатин. Оксалиплатин – это препарат третьего поколения, имеющий в своем составе атом платины (Liu H.F. et al. 2010). При применении в стандартных дозировках, оксалиплатин имеет много побочных эффектов (Nannizzi S. et al, 2010).
На первом этапе изучена реакция культуры клеток НТ-29 на различные концентрации оксалиплатина. Определены концентрации оксалиплатина в диапазоне 1 мкМ - 250 мкМ в 1 мл. (Рис 4)
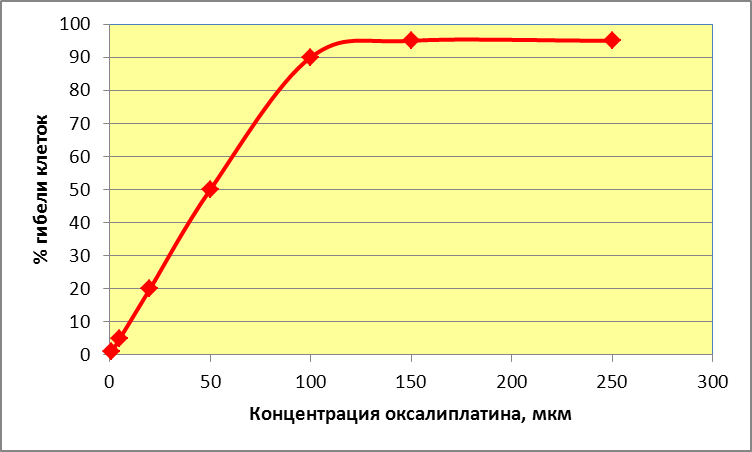
Рис. 4 Зависимость гибели клеток от различных концентраций оксалиплатина
При концентрации оксалиплатина 50 мкм гибель клеток составила около 50 %. При концентрации оксалиплатина достигающей 100 мкм и более мы наблюдали почти тотальную гибель клеток. Наибольший интерес представляли минимальные концентрации оксалиплатина 1 мкм и 5 мкм. При этих концентрациях гибель клеток практически не отличалась от контроля и составляла 1-3%, то есть, токсический эффект от воздействия химиопрепарата незначителен.
В предшествующих экспериментах показано, что через 24 и 48 часов после введения оксалиплатина происходит повышение экспрессии генов, отвечающих на оксалиплатин (Seetharam R. et al., 2010). Поэтому для дальнейших экспериментов выбраны два временных интервала 24 и 48 часа.
- ПРОФИЛИ ЭКСПРЕССИИ ГЕНОВ В КУЛЬТУРЕ КЛЕТОК НТ-29 ПРИ ДЕЙСТВИИ ОКСАЛИПЛАТИНА
Изучен функциональный ответ генов на оксалиплатин для выявления потенциальных генов-мишеней, ингибирование которых должно давать наибольший эффект гибели раковых клеток. Сформирована панель генов, каждый из этих генов потенциально мог играть важную роль в защите раковой клетки от воздействия химиопрепарата. Формирование панели генов проводили на основании анализа литературы и баз данных по экспрессионным характеристикам. Принцип отбора состоял в выборе генов, наиболее часто экспрессирующихся при колоректальном раке и, особенно, при химиотерапевтическом воздействии. Нас интересовали гены, отвечающие на химиопрепаты, содержащие платину, в особенности на оксалиплатин.
Уровень экспрессии генов измеряли с помощью ПЦР в реальном времени. Оценку чистоты реакции проводили по кривой плавления амплифицированных фрагментов ДНК, соответствующих каждому гену. Все эксперименты повторены несколько раз и оценивались только после получения одинаковых повторяющихся результатов в разных экспериментах. Для проверки зоны линейности сделаны серийные разведения кДНК, и произведён ПЦР в реальном времени с этими разведениями, по каждому исследуемому гену, затем построены калибровочные кривые по каждому гену.
Чтобы выявить наиболее эффективные гены мишени, использован подход, опирающийся на анализ дозовых и временных зависимостей функционального ответа раковых клеток на действие оксалиплатина. Эксперименты поставлены при 2-х концентрациях оксалиплатина - 1 мкМ и 5 мкМ, экспрессию оценивали в 2-х временных интервалах – через 24 ч и через 48 ч. после постановки эксперимента. Далее проанализированы полученные диаграммы в зависимости от дозы оксалиплатина и от времени инкубации (Рис. 5,6,7,8). При анализе экспрессию считали повышенной при ее возрастании в 2 и более раза. Было важно выявить те гены, которые проявляют зависимость от дозы и времени и реагируют повышением экспрессии на разные концентрации оксалиплатина на всем протяжении культивирования.
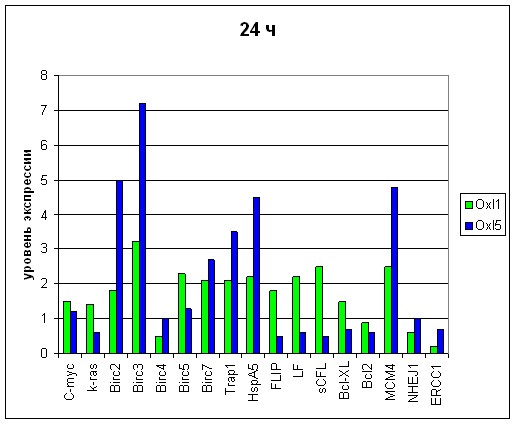
Рис. 5 Экспрессионный профиль генов через 24 часа после постановки эксперимента. Сравнение при дозировках оксалиплатина (Oxl), составляющих 1 и 5 мкм.
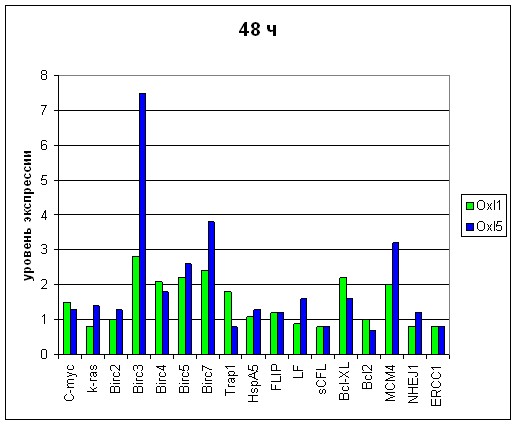
Рис. 6 Экспрессионный профиль генов через 48 часов после постановки эксперимента. Сравнение при дозировках оксалиплатина (Oxl), составляющих 1 и 5 мкм
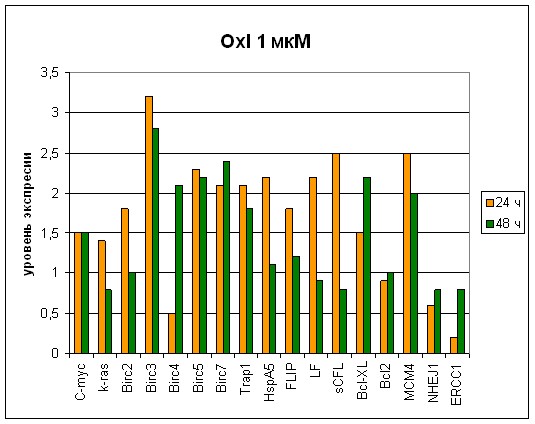
Рис. 7 Экспрессионный профиль генов при концентрации оксалиплатина 1 мкм. Сравнение временных характеристик (при 24 ч и при 48 ч).
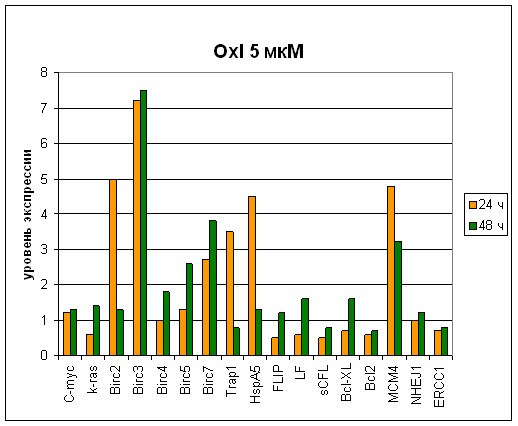
Рис. 8 Экспрессионный профиль генов при концентрации оксалиплатина 5 мкм. Сравнение временных характеристик (при 24 ч и при 48 ч).
В сформированную панель вошли гены:
- гены BIRC – семейства (baculoviral IAP repeat-containing proteins) - из группы ингибиторов апоптоза (Birc2, Birc3, Birc4, Birc5, Birc7) (Fulda S et al., 2012),
- ингибитор каспазы 8 - FLIP (FLIP, длинная и короткая изоформы) (FLIP, sCFL, LF) (Mannhold K. et al., 2010),
- гены семейства Bcl-2 (Bcl-2, Bcl-XL) (Portt L. et al., 2011);
- ген Trap1 (TNFR ассоциированный белок), ингибитор апоптоза путем блокирования митохондриального стресса (Landriscina M. et al, 2009);
- гены с-MYC и KRAS, усиливают пролиферацию раковых клеток (Prochownik E.V. et al., 2010);
- гены, участвующие в контроле целостности генома (МСМ4, NHEJ1, ERCC1) (Kirschner K. et al., 2010);
- ген теплового шока (HspA5) (Ramp U. et al., 2007).
При анализе экспрессию считали повышенной при ее возрастании в 2 и более раза.
При использованных дозах оксалиплатина в обоих временных промежутках повышенную экспрессию имели только 3 гена - Birc3, Birc7 и MCM4, которые демонстрируют четкую зависимость от дозы в обоих изученных временных интервалах (Рис 9).
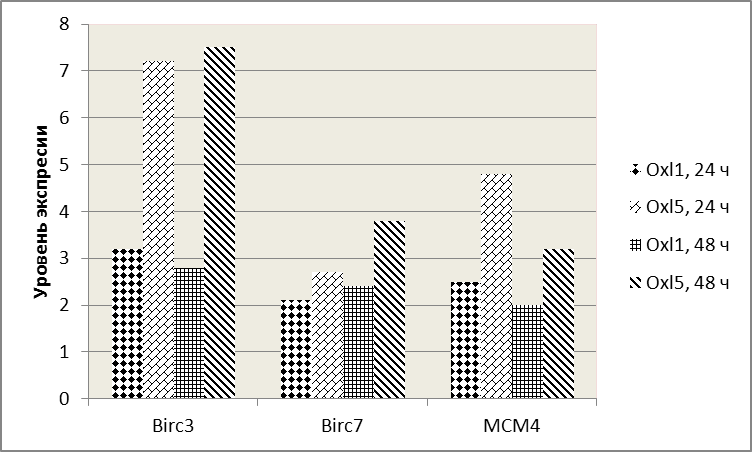
Рис. 9 Экспрессионный профиль генов Birc3, Birc7, MCM4 в зависимости от времени и дозировки воздействия оксалиплатина. Эти 3 гена реагируют повышением уровня экспрессии более, чем в 2 раза и демонстрируют четкую зависимость от дозы в обоих из изученных временных интервалах
Из полученных данных следует, что гены Birc3, Birc7 и MCM4 имеют повышенную и связанную с дозой оксалиплатина экспрессию в течение всего времени инкубации, в отличие от других исследованных генов.
4. ИЗУЧЕНИЕ АПОПТОТИЧЕСКОГО ЭФФЕКТА В КЛЕТКАХ КОЛОРЕКТАЛЬНОГО РАКА КУЛЬТУРЫ НТ-29 ПРИ ИНГИБИРОВАНИИ ВЫЯВЛЕННЫХ ГЕНОВ-МИШЕНЕЙ.
Первоначально изучен апоптотический эффект от ингибирования функции генов Birc3, Birc7 и МСМ4 по отдельности. В качестве контроля использовали три варианта:
- ничем не обработанные клетки,
- клетки, обработанные только оксалиплатином,
- клетки, обработанные оксалиплатином, с добавлением олигонуклеотида со случайной последовательностью.
Апоптотический эффект изучен при ингибировании отдельных генов Birc3, Birc7 и МСМ4 с разными концентрациями оксалиплатина (1 и 5 мкм). При обоих из исследованных концентраций оксалиплатина наименьшая доля апоптотических клеток (30% - 40%, в зависимости от дозы) наблюдается при ингибировании гена Birc3 (с-IAP2), наибольшее (50% - 60%, в зависимости от дозы) - при ингибировании гена МСМ4. Различие в доле апоптотических клеток при ингибировании указанных генов составляет 20%, то есть, ингибирование гена МСМ4 дает возрастание апоптотического эффекта на примерно 50% по сравнению с ингибированием гена Birc3. Ингибирование гена Birc7 (ML-IAP, Livin) приводит к промежуточной, по отношению к генам Birc3 и МСМ4, доле апоптотических клеток – на уровне 45% - 50%.
Хотя ингибирование гена МСМ4 позволило достичь высокого апоптотического эффекта при низких концентрациях химиотерапевтического средства – оксалиплатина, мы предположили, что комбинированное действие миРНК против выявленных генов-мишений может еще более увеличить этот эффект. С этой целью изучены различные парные комбинации ингибирования генов.
При обеих исследованных дозах оксалиплатина (1 мкМ и 5 мкМ) самый слабый результат дало совместное ингибирование генов Birc3/Birc7 (Рис. 10). Комбинированное ингибирование этих генов позволило только на 5% -10% увеличить долю апоптотических клеток по сравнению с ингибированием только гена Birc7.
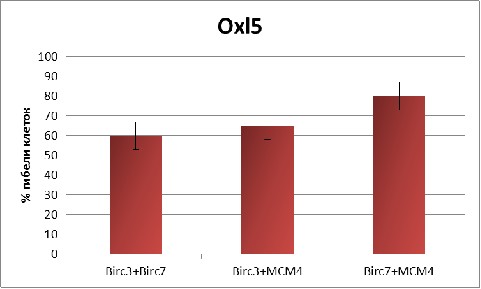
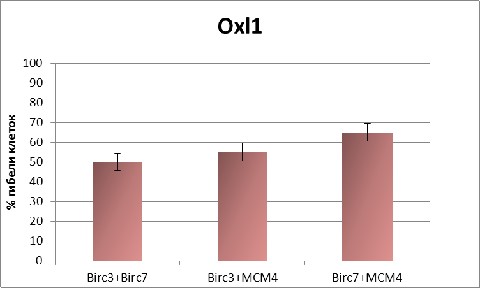
Рис. 10 Апоптотический эффект при ингибировании комбинаций генов Birc3, Birc7 и МСМ4 при разных концентрациях оксалиплатина (1 и 5 мкм).
Подобный результат получен при совместном ингибировании генов Birc3/МСМ4 (Рис. 10). По сравнению с эффектом от ингибирования только гена МСМ4, дополнительное ингибирование еще и гена Birc3 добавляло к доле апоптотических клеток только 5%. То есть, комбинированное ингибирование генов Birc3/МСМ4 не приводит к синергетическому эффекту.
В то же время, совместное ингибирование генов МСМ4 и Birc7 дало существенный синергетический эффект. Доля апоптотических клеток возросла на 15% - 20% по отношению к эффекту от ингибирования только гена МСМ4, достигнув 80% при 5 мкМ оксалиплатина (Рис. 10, 11).
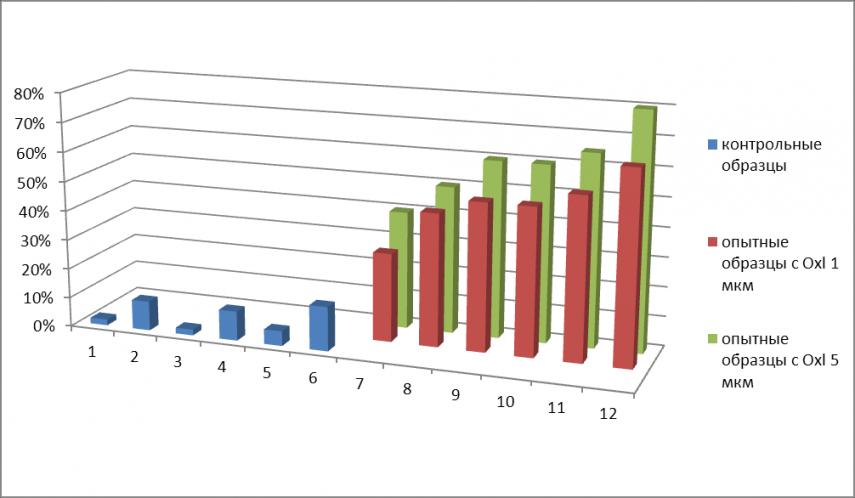
Рис. 11 Сводная диаграмма объединяющая эффекты апоптоза (доля апоптотических клеток,%) в контрольных образцах, при ингибировании отдельных генов Birc3, Birc7 и МСМ4 и их комбинаций
- ничем не обработанные клетки
- клетки, обработанные миРНК со случайной последовательностью нуклеотидов
- клетки, обработанные оксалиплатином 1 мкM
- клетки, обработанные миРНК со случайной последовательностью нуклеотидов + оксалиплатин 1 мкM.
- клетки, обработанные оксалиплатином 5 мкM
- клетки, обработанные миРНК со случайной последовательностью нуклеотидов + оксалиплатин 5 мкM.
- апоптотический эффект от подавления гена Birc3
- апоптотический эффект от подавления гена Birc7
- апоптотический эффект от подавления гена МСМ4
- апоптотический эффект от подавления комбинации генов Birc3+Birc7
- апоптотический эффект от подавления комбинации генов Birc3+MCM4
- апоптотический эффект от подавления комбинации генов Birc7+MCM4
Ген Birc7 осуществляет не только антиапоптотическую функцию, но и участвует также в контроле клеточного цикла и его ингибирование с помощью миРНК приводит к снижению синтеза ДНК (Chen et al., 2012). Скорее всего, именно эта функциональная особенность гена Birc7 обеспечивает синергию в апоптотическом эффекте при его ингибировании одновременно с геном МСМ4, блокирование которого нарушает репликацию ДНК и остановку деления клетки для репарации дефектов.
Вследствие высокого уровня апоптоза при ингибировании генов МСМ4 или Birc7 в присутствии оксалиплатина (50% - 60%), было трудно оценить характеристики их вклада в апоптотический эффект при их совместном ингибировании. В этой связи изучены апоптотические эффекты ингибирования указанных генов при меньшей дозе оксалиплатина – 0,3 мкМ и меньшем времени 40 ч. (Рис.12).
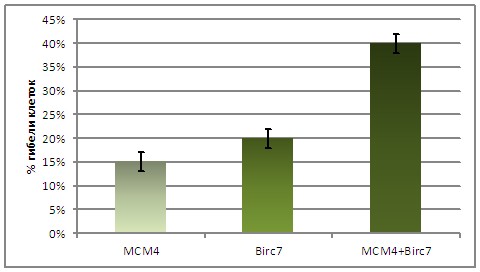
Рис. 12 Апоптотические эффекты при ингибировании генов при дозе оксалиплатина 0,3 мкМ (время постановки эксперимента 40 часов)
Таким образом, полученные данные показывают, что эффект от ингибирования изучаемых генов носит аддитивный характер.
Возможно, при низкой концентрации оксалиплатина и, соответственно, малом числе повреждений ДНК, действие гена Birc7 ограничивается выполнением антиапоптотической функции. Ингибирование генов Birc7 и МСМ4 приводит к возникновению двух независимых событий – активации каспазы 9, приводящей к апоптозу, и нарастанию апоптотических сигналов из-за нарушений репликации ДНК, соответственно.
На рис. 13 представлены сигнальные пути с участием изучаемых генов. Апоптотические пути подразделяют на внутрений и внешний. Внешний путь связан со стимуляций клеточных рецепторов, внутренний характеризуется стрессовым воздействием на клеточные ораганеллы, прежде всего митохондрии и ЭПР. Действие оксалиплатина должно «запускать» механизм апоптоза, но активирующиеся гены защищают клетку от воздействия химиопрепарата. Ген МСМ4 участвует в репликации ДНК и играет важную роль в поддержании целостности генома. При нарушении этого процесса накопление дефектов ДНК приводит к апоптозу раковой клетки. Ген Birc7 блокирует активацию каспазы 9, предотвращая развитие апоптоза. При ингибировании гена Birc7 происходит активация каскада каспаз, что приводит к апоптозу раковой клетки. Ингибирование этих генов в сочетании с низкими дозировками оксалиплатина может быть перспективным для обеспечения высокой эффективности терапии.
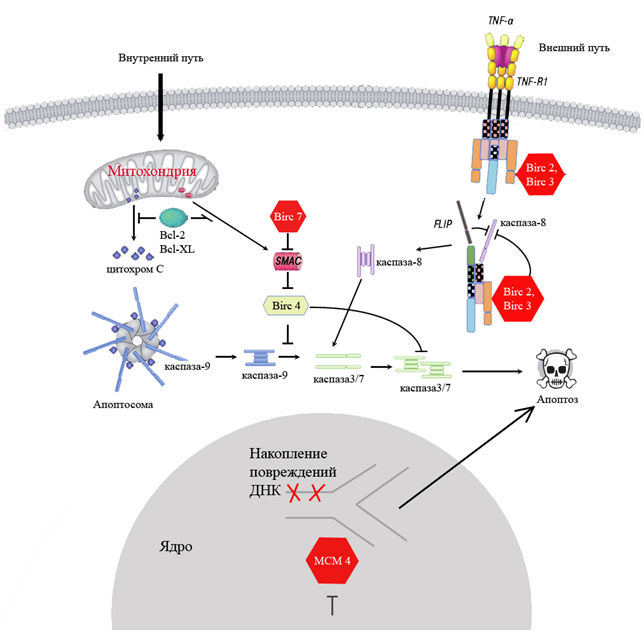
Рис. 13 Схема сигнальный путей генов, проявивших повышенную экспрессию при воздействии оксалиплатином
В целом, совместное ингибирование экспрессии генов Birc7 и МСМ4 на фоне оксалиплатина позволяет достигнуть значительно более высокого уровня апоптоза, чем просто при воздействии оксалиплатина. На рис. 14 видно, что к гибели 80% клеток приведет либо воздействие оксалиплатина в дозировке более 80 мкМ, либо воздействие генов Birc7 и МСМ4 на фоне 5 мкм оксалиплатина. Таким образом, совместное ингибирование экспрессии генов Birc7 и МСМ4 позволяет достигнуть высокого уровня апоптоза при дозировке оксалиплатина в 16 раз меньшей, по сравнению с применением только этого химиопрепарата. (Рис. 4 и 14).
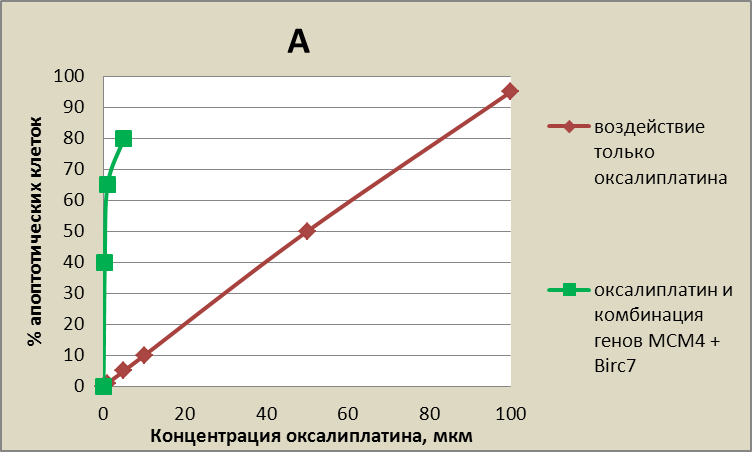
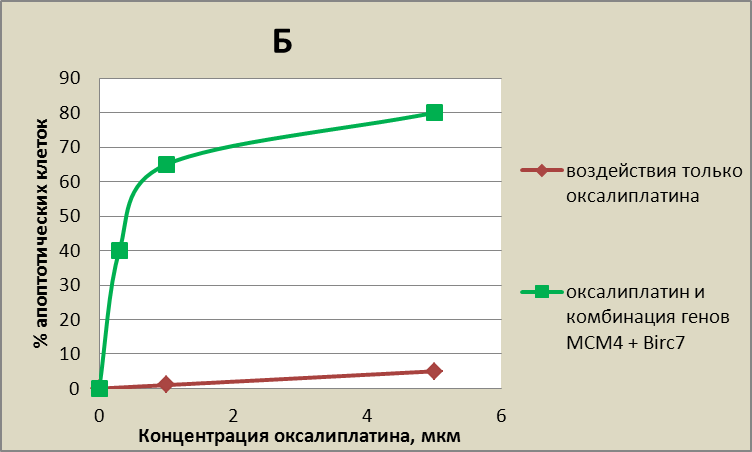
Рис. 16 Количество апоптотических клеток (%) в зависимости от концентрации оксалиплатина. Графики с одними и теми же данными, но приведены в разных масштабах. А – рассмотрен вид кривых, при концентрации оксалиплатина до 100 мкм. Б – это тот же самый график, рассмотреный в другом маштабе, вид кривых, при концентрации оксалиплатина до 5 мкм.
Разработка терапевтического средства на основе соответствующих миРНК позволит принципиально снизить токсический эффект химиопрепарата при достижении высоких противоопухолевых результатов.
ВЫВОДЫ.
- Показано, что ингибирование с помощью миРНК гена с-MYC, активирующегося вследствие мутации в гене АРС в культуре клеток колоректального рака НТ-29, приводит к апоптозу клеток на уровне 15-17 %. В культуре клеток колоректального рака Сасо2 без мутации в гене АРС, уровень экспрессии гена с-MYC существенно ниже и при его ингибировании апоптоз практически не развивается.
- Ингибирование гена KRAS, являющегося еще одним ключевым геном при развитии колоректального рака, приводит к апоптозу клеток на уровне 14% в культуре НТ-29. Совместное ингибирование генов c-MYC и KRAS дает аддитивный апоптотический эффект на уровне 30% клеток.
- Определены профили экспрессии сформированного набора генов в культуре клеток НТ-29 в зависимости от дозы и времени действия химиотерапевтического препарата оксалиплатина. В результате проведенного анализа профилей экспрессии выявлены потенциальные мишени терапевтического воздействия - гены Birc3, Birc7 и MCM4.
- Показано, что ингибирование малыми интерферирующими РНК генов Birc3, Birc7 и MCM4 при 5 мкМ оксалиплатина приводит к апоптозу клеток колоректального рака НТ-29 на уровнях 40%, 50% и 60%, соответственно.
- Показано, что совместное ингибирование генов Birc7 и MCM4 дает синергетический апоптотический эффект, близкий к аддитивному при низкой (0,3 мкМ) дозе оксалиплатина. Другие комбинации интерферирующих РНК, ингибирующих гены Birc3, Birc7 и MCM4, синергетическим воздействием на уровень апоптоза не обладают.
- Показано, что уровень апоптоза при ингибировании комбинации генов Birc7 и MCM4 составил 80% на фоне 5 мкМ оксалиплатина. Этот результат соответствует действию в 16 раз большей дозы оксалиплатина без ингибирования этих генов.
Список работ, опубликованных по теме диссертации:
Статьи, опубликованные в изданиях, рекомендованных ВАК:
- Bavykin A.S., Korotaeva A.A., Poyarkov S.V., Syrtsev A.V., Tjulandin S.A., Karpukhin A.V. Double siRNA-targeting of cIAP2 and LIVIN results in synergetic sensitization of HCT-116 cells to oxaliplatin treatment // OncoTargets and Therapy. 2013. V.6. P. 1333 - 1340
- Коротаева А.А., Бавыкин А.С., Поярков С.В. Карпухин А.В. Ингибирование потенциальных генов-мишеней с помощью интерферирующих РНК в клетках колоректального рака // Интеграл. 2012. № 5. С. 26-28.
- Коротаева А.А., Музаффарова Т.А., Сачков И.Ю., Кузьминов А.М., Карпухин А.В. Мутации в генах MYH и АРС при множественном полипозе среди российских больных // Медицинская генетика. 2011. Т. 10 №1. С.14-18.
- Коротаева А.А., Музаффарова Т.А., Карпухин А.В. Молекулярно-генетические причины множественного полипоза и рака толстой кишки: наследственные мутации в гене MYH // Медицинская генетика. 2008. T.7. № 9. C. 10-17.
Публикации в других изданиях:
- Бавыкин А.С., Коротаева А.А., Сырцев А.В., Тюляндин С.А., Карпухин А.В. Разработка способов повышения эффективности химиотерапии на основе малых интерферирующих РНК // Журнал «Злокачественные опухоли» (Journal of Malignant Tumours). 2012. Т.2. №2. С.111-116.
- Бавыкин А.С., Коротаева А.А., Сырцев А.В., Тюляндин С.А., Карпухин А.В. Преодоление резистентности клеток рака толстой кишки к оксалиплатину с помощью таргетного ингибирования экспрессии генов малыми интерферирующими РНК. //Материалы III международной научно-практической конференции: «Постгеномные методы анализа в биологии, лабораторной и клинической медицине». 2012. C. 57-58.
- Bavykin A.S., Korotaeva A. A., Goncharova E.A. Zenit-Zhuravlouva E.G., Syrtsev A.V., Karpukhin A.V. Analysis of different apoptosis ways by gene expression analysis and siRNA silencing in colorectal cancer cells // Eur. J. Hum.Gen. 2011. V.19. P. 201
- Карпухин А.В., Бавыкин А.С., Коротаева А.А., Шубин В.П., Апанович Н.В., Кавнацкий И.О, Петерс М.В., Черняев В.М., Кашурников А.Ю., Зенит-Журавлева Е.Г, Завадский С.В., Сырцев А.В, Любченко Л.Н., Грицай А.Н., Матвеев В.Б., Тюляндин С.А. Особенности экспрессии генов злокачественно трансформированных клеток при раке ряда локализаций. // Матер. 8-ой Международной конференции «Молекулярная генетика соматических клеток». - Звенигород, 2011, С.35
- Коротаева А.А., Бавыкин А.С., Зенит-Журавлева Е.Г.,. Гончарова Е.А, Карпухин А.В. Ингибирование функции генов сигнальных путей и различия в апоптотическом эффекте при разных структурных характеристиках генома раков // Матер. VI съезда мед. генетиков. Медицинская генетика. 2010. С.91.
- Музаффарова Т.А., Коротаева А.А., Сачков И.Ю., Кузьминов А.М., Гинтер Е.К., Карпухин А.В. Мутации в генах МУН и АРС среди российских больных с множественным полипозом. // Матер. VI съезда мед. генетиков. Медицинская генетика. 2010. С.121.
- Бавыкин А.С., Зенит-Журавлева Е.Г., Коротаева А.А., Гончарова Е.А., Сырцев А.В., Карпухин А.В Эффективная индукция апоптоза клеток рака толстой кишки с помощью интерферирующих РНК // Матер. VI съезда мед. генетиков Медицинская генетика. 2010. С.15
- Korotaeva A.A., Bavykin A.S., Zenit-Zhuravlouva E.G., Goncharova E.A., Karpukhin A.V. The differentl effect of the gene knockdown on apoptosis of two human colon cancer cell lines // Eur. J. Hum.Gen. 2010. V.18. P.193
- Карпухин А.В., Поспехова Н.И., Логинова А.Н., Музаффарова Т.А., Цуканов А.С., Смирнова Т.Ю., Апанович Н.В., Коротаева А.А., Гончарова Е.А., Любченко Л.Н., Новикова О.В., Гинтер Е.К. Генетическая гетерогенность проявления мутаций в генах-супрессорах наследственных форм онкологических заболеваний// Матер. 7-ой Международной конференции «Молекулярная генетика соматических клеток». - Звенигород, 2009. С.16-17
- Карпухин А.В., Поспехова Н.И., Логинова А.Н., Музаффарова Т.А., Смирнова Т.Ю., Цуканов А.С., Апанович Н.В., Коротаева А.А., Любченко Л.Н., Гинтер Е.К. Молекулярные особенности генов-супрессоров наследственных форм ряда частых онкологических заболеваний// Сборник матер. Всеросс. конф. с международным участием «Молекулярная онкология». – Новосибирск. 2008. С. 112-113.
Список сокращений
ДНК – дезоксирибонуклеиновая кислота
ОНП – однонуклеотидный полиморфизм
ПААГ – полиакриламидный гель
П. н. – пар нуклеотидов
ПЦР – полимеразная цепная реакция
САП – семейный аденоматозный полипоз
ХН – хромосомная нестабильность
АРС – Adenomatous Polyposis Coli gene – ген семейного аденоматозного полипоза толстой кишки
BSA – бычий сывороточный альбумин
CSGE – метод конформационно - чувствительного электрофореза
МВА – N,N' – метилен бисакриламид
MYH – MutY homologue –гомолог гена MutY
Oxl - оксалиплатин
РСА – персульфат аммония
PТT - метод тестирования неполноценного белка
SDS – додецилсульфат натрия
SSCP – метод анализа конформационного полиморфизма однонитевой ДНК
ТЕМЕД – N,N,N',N – тетраметилэтилендиамин
ЭДТА – этилендиаминтетраацетат

