Изучение полиморфных маркеров днк в кандидатных генах болезни двигательного нейрона
На правах рукописи
УДК 575.17.174.015.3
Жеребцова Анна Леонидовна
ИЗУЧЕНИЕ ПОЛИМОРФНЫХ МАРКЕРОВ ДНК В КАНДИДАТНЫХ ГЕНАХ БОЛЕЗНИ ДВИГАТЕЛЬНОГО НЕЙРОНА
Специальность 03.00.26 - молекулярная генетика
АВТОРЕФЕРАТ
Диссертации на соискание учёной степени
кандидата биологических наук
Москва
2006
Работа выполнена в Отделе молекулярных основ генетики человека Института Молекулярной генетики РАН
Научный руководитель:
доктор биологических наук П.А. Сломинский
Официальные оппоненты:
доктор биологических наук А.В. Карпухин
кандидат медицинских наук С.А. Клюшников
Ведущая организация:
ГУ НИИ экспериментальной медицины РАМН
Защита состоится «____» декабря 2006 г. в _____ час. на заседании Диссертационного совета Д 001.016.01 при Медико-генетическом научном центре РАМН по адресу: 115478, Москва, ул. Москворечье, 1.
С диссертацией можно ознакомиться в библиотеке Медико-генетического научного центра РАМН по адресу: Москва, ул. Москворечье, 1.
Автореферат разослан «____» ноября 2006 г.
Учёный секретарь Диссертационного совета
Доктор биологических наук, профессор Курило Л.Ф.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Накопление информации о природе моногенных наследственных заболеваний позволило вплотную подойти к анализу так называемых сложных заболеваний, имеющих мультифакториальную природу - то есть зависящих как от генетических факторов, так и от факторов внешней среды. Особое место в работах по изучению роли генома в патологических процессах занимают заболевания нервной системы, поскольку некоторые из них достаточно широко распространены, затрагивают важнейшие функции организма и приводят к ранней инвалидизации, а иногда и смерти больного.
К числу таких тяжелых неврологических патологий относится болезнь двигательного нейрона (БДН). Это группа нейродегенеративных заболеваний, при которых наблюдается избирательная гибель мотонейронов головного и спинного мозга. БДН, как правило, развивается на фоне полного здоровья, носит прогрессирующий характер и за несколько лет приводит к тяжёлой инвалидизации и фатальному исходу. Заболеваемость БДН в мире в среднем составляет 3-7 на 100 тыс. человек в год, при этом в последнее время отмечены тенденции к росту частоты встречаемости БДН во всех возрастных группах. В основном заболевание носит спорадический характер, но в 5-10% случаев выявляется положительный семейный анамнез.
На сегодняшний день выделяют несколько наиболее вероятных причин развития заболевания - оксидантный стресс, изменения структуры цитоскелета, эксайтотоксичность, а также нарушения процессов детоксикации ксенобиотиков.
Для изучения вклада генетической составляющей в патогенезе БДН наиболее широко используются методы ассоциативного анализа, основанные на исследовании полиморфных вариантов генов-кандидатов в выборках больных и случайных контрольных выборках по типу случай-контроль. Такие исследования дают возможность установить вовлеченность в патогенез заболевания конкретных генов-кандидатов и на основе этого в дальнейшем выявить группы лиц с риском развития БДН.
Цель и задачи работы
Целью настоящей работы было молекулярно-генетическое исследование ассоциации болезни двигательного нейрона с генами, мутации в которых влияют на развитие оксидантного стресса, эксайтотоксичности, нарушение структуры цитоскелета мотонейронов и функционирование системы детоксикации ксенобиотиков.
В соответствии с поставленной целью были сформулированы следующие задачи исследования:
- Провести поиск мутаций в кодирующей области и участках экзон-интронных соединений гена алсина (ALS2).
- Провести анализ IVS9-675 C>A полиморфизма гена индуцируемого гипоксией фактора 1 (HIF1A).
- Провести анализ полиморфизмов генов глутаматэргической системы: G603A гена транспортёра глутамата EAAT2, rs545098 и rs9307959 генов ионотропных рецепторов глутамата GRIA1 и GRIA2.
- Исследовать полиморфизмы генов, белковые продукты которых принимают участие в процессах детоксикации ксенобиотиков: инсерционный полиморфизм гена этанол-индуцибельного цитохрома Р-450 (CYP2E1), CYP2D6*4 полиморфизм гена дебризоквин-4-гидролазы (CYP2D6), делеционный полиморфизм генов глутатион-S-трансферазы Т1, М1 и Р1 (GSTT1, GSTM1, GSTP1), полиморфизм гена ариламин-N-ацетилтрансферазы (NAT2).
- Провести анализ ассоциации полиморфных вариантов изученных генов с основными клиническими характеристиками заболевания: диагнозом и вариантом заболевания, типом прогрессирования, возрастом начала заболевания.
Научная новизна
В группе больных боковым амиотрофическим склерозом из России проведен комплексный молекулярно-генетический анализ ряда генов, предположительно вовлеченных в патогенез заболевания.
Обнаружено, что в российской популяции развитие спорадической формы БДН не связано с мутациями в кодирующей области гена ALS2.
Впервые показано, что генотип 1C/1C гена CYP2E1 ассоциирован с шейным дебютом БДН, а инсерционный генотип 1D/1D коррелирует с более тяжелыми формами БДН, такими как БДН с грудным и диффузным дебютами и прогрессирующим бульбарным параличом. Гомозиготность по CYP2E1*D аллелю ассоциирована с повышенным риском развития БДН в российской популяции.
Показано, что гомозиготность по мутантному аллелю CYP2D6*4 гена CYP2D6 ассоциирована с более ранним возрастом начала заболевания БДН в российской популяции.
Обнаружено, что присутствие аллеля GSTP1*B гена GSTP1 коррелирует с сегментарно-ядерным и пирамидным вариантами вовлечения мотонейронов, в то время как аллель дикого типа GSTP1*A ассоциирован с классической вовлечённостью мотонейронов.
Показано, что у больных БДН наблюдается снижение частоты генотипа GSTM1 0/0 гена глутатион-S-трансферазы типа М1 (GSTM1). Это указывает на то, что нулевой аллель этого гена при болезни двигательного нейрона играет роль протективного фактора.
Изучение полиморфных вариантов генов индуцируемого гипоксией фактора 1, транспортёра глутамата EAAT2, ионотропных глутаматных рецепторов, глутатион-S-трансферазы типа Т1 (GSTT1), а также N-ацетилтрансферазы не выявило ассоциации с развитием БДН у больных из России.
Полученные данные позволяют оценить роль ряда генетических систем в развитии болезни двигательного нейрона и являются основанием для разработки методов молекулярно-генетической идентификации лиц с повышенным риском развития данного заболевания. Результаты, полученные в ходе проведения работы, вносят вклад в рассмотрение проблемы этиологии БДН с точки зрения изучения генетических факторов риска развития заболевания. В дальнейшем это может быть использовано для разработки молекулярно-генетических методов, позволяющих в будущем выявлять лиц с повышенным риском развития болезни двигательного нейрона и начинать направленную профилактику заболевания на доклинической стадии.
Апробация работы
Результаты, полученные в данной работе, были представлены на конференциях Американского Общества Генетики Человека (ASHG) 2003 г., Европейского Общества Генетики человека (ESHG) 2003-2005 г.г., конференции HUGO 2003 г., ежегодных конференциях по боковому амиотрофическому склерозу 2003-2005 г.г., съездах Российского общества медицинских генетиков 2001 и 2005 г.г. и изложены на конкурсе аспирантских работ на стипендию фонда «Будущее молекулярной генетики» (Москва, ИМГ РАН, 2003 г.).
Публикации
По материалам диссертации опубликовано 7 печатных работ.
Структура и объём диссертации
Диссертация состоит из следующих разделов: «Введение», «Обзор литературы», «Материалы и методы», «Результаты и обсуждение», «Заключение», «Выводы», «Список литературы». Работа изложена на 125 стр. машинописного текста, содержит 24 таблицы и 23 рисунка. Список литературы включает 165 источников.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Количество проанализированных больных составило 75 человек с очевидной спорадической формой БДН. Среди больных БДН было 41 (55%) мужчин и 34 (45%) женщин. Возраст больных составил 28–72 лет (средний возраст начала заболевания - 55,5 ± 10,9 лет). Все исследования проводились с информированного согласия больных или их ближайших родственников.
Кроме группы больных, для проведения исследования были сформированы контрольные группы, представленные случайными выборками, которые по полу, возрасту и этнической принадлежности были сопоставимы с группой больных БДН.
В таблице 1 приведены данные о форме БДН у обследованных больных, вариантах вовлечения мотонейронов и скорости развития заболевания.
| Клиническая характеристика | N (%) | |
| Диагноз | БДН с шейным дебютом (БДНШД) | 37 (49,3) |
| БДН с поясничным дебютом (БДНПД) | 13 (17,3) | |
| БДН с грудным дебютом (БДНГД) | 5 (6,7) | |
| БДН с диффузным дебютом (БДНДД) | 4 (5,3) | |
| Прогрессирующий бульбарный паралич | 16 (21,3) | |
| Варианты вовлечения мотонейронов | Классический | 40 (53,3) |
| Сегментарно-ядерный (С/Я) | 23 (30,7) | |
| Пирамидный | 12 (22,7) | |
| Скорость развития заболевания | Быстрая | 41 (54,6) |
| Умеренная | 17 (22,7) | |
| Медленная | 17 (22,7) | |
Таблица 1. Клиническая характеристика больных БДН.
Оценка вклада мутаций в гене ALS2 в патогенез спорадической формы БДН.
Ген ALS2 вовлечён в развитие ювенильной рецессивной формы БДН. Мутации этого гена были найдены в семьях с аутосомно-рецессивной ювенильной формой при некоторых других нейродегенеративных заболеваниях. Не исключено, что ген алсина может играть роль в патогенезе классической спорадической формы БДН. В связи с этим нами был проведён поиск мутаций этого гена в выборке больных со спорадической формой БДН из России.
Поиск мутаций осуществлялся при помощи DGGE метода и анализа одноцепочечного конформационного полиморфизма (SSCP). Для этого были подобраны праймеры для амплификации всех 34 экзонов и фланкирующих интронных последовательностей для всех экзонов гена алсина.
В результате проведённого исследования ни у одного из 75 обследованных больных во всех экзонах гена ALS2 не было выявлено патогенетически значимых мутаций. Выявлено только несколько однонуклеотидных полиморфных замен в интронных областях гена ALS2, которые, по-видимому, являются редкими нормальными полиморфизмами и не ассоциированы с развитием спорадической формы БДН.
Анализ IVS9-675 C>A полиморфизма гена HIF1A
Для гена HIF1A на сегодняшний день описано несколько полиморфных сайтов, причем ни один из них не является кодирующим. Поэтому в настоящем исследовании нами был выбран интронный полиморфизм с высокой гетерозиготностью по данным SNP Database и простым методом определения – IVS9-675 C>A. Сначала проводилась амплификация соответствующего фрагмента ДНК, а затем применялась рестрикция амплифицированной ДНК рестриктазой Smi M1. Данные генотипирования представлены в таблице 2.
Видно, что частоты аллельных вариантов и генотипов гена HIF1A практически не отличаются в обеих исследуемых выборках.
| аллели/генотипы исследуемого гена | БДН | Контроль | Критерий | |||
| N=75 | частота, % | N=105 | частота, % | 2 | P | |
| HIF1A (А) | 138 | 92 | 186 | 88,6 | 0,85 | 0,76 |
| HIF1A (С) | 12 | 8 | 24 | 11,4 | ||
| HIF1A (A/A) | 66 | 88 | 85 | 81 | 1,24 | 0,55 |
| HIF1A (C/A) | 6 | 8 | 16 | 15,2 | ||
| HIF1A (C/C) | 3 | 4 | 4 | 3,8 | ||
Таблица 2. Сравнительный анализ частот аллелей и генотипов гена HIF1A в группе больных БДН и в контрольной выборке.
Далее был проведён анализ возможной связи гена HIF1A с клинической картиной заболевания и характером развития патологического процесса посредством анализа корреляций между генотипом гена HIF1A, диагнозом, вариантом клинического дебюта, скоростью прогрессирования патологического процесса по шкале Норриса, оценивающей неврологический и функциональный дефицит у больных, и возрастом начала заболевания. В результате между этими показателями не было выявлено никаких статистически значимых корреляций.
Анализ полиморфизма G603A транспортёра глутамата EAAT2
Нами был проведён молекулярно-генетический анализ замены p.G603A в 5 экзоне гена ЕААТ2. Частоты аллелей и генотипов исследуемого полиморфизма гена транспортёра глутамата представлены в таблице 3.
| аллели/генотипы исследуемого гена | БДН | Контроль | Критерий | |||
| N=75 | частота, % | N=105 | частота, % | 2 | P | |
| ЕААТ2 (G) | 102 | 68 | 141 | 67,1 | 0,3 | 0,9 |
| ЕААТ2 (A) | 48 | 32 | 69 | 32,8 | ||
| ЕААТ2(G/G) | 35 | 46,6 | 50 | 47,7 | 0,4 | 0,8 |
| ЕААТ2(G/A) | 32 | 42,6 | 41 | 39 | ||
| ЕААТ2(A/A) | 8 | 10,6 | 14 | 13,3 | ||
Таблица 3. Сравнительный анализ частот аллелей и генотипов гена ЕААТ2 в группе больных БДН и в контрольной выборке.
Было установлено, что более часто встречается аллель G603 как в группе больных БДН (68%), так и в контрольной выборке (67,14%). Из представленных вариантов генотипов более частым является генотип G/G.
При сопоставлении полученных данных в двух выборках видно, что все варианты генотипов у больных БДН встречаются в сходных с контрольной группой частотах. Распределение частот генотипов в каждой из выборок соответствует уравнению Харди-Вайнберга (2 = 0,4; р = 0,82).
Также нами был проведён анализ корреляции клинических признаков БДН с изученными полиморфными вариантами гена EAAT2. При этом статистически значимых корреляций выявлено не было. На основании полученных данных можно говорить о том, что полиморфизм G603A гена ЕААТ2, по всей видимости, не является функционально значимым в патогенезе болезни двигательного нейрона у больных из России.
Анализ интронного полиморфизма AMPA – глутаматных рецепторов
В гене GRIA1 нами был исследован интронный полиморфизм rs545098 (замена G/A), вследствие высокой частоты минорного аллеля и простого метода определения. После амплификации соответствующего участка гена, проводилась рестрикция амплифицированной ДНК рестриктазой Mbo II. Частоты аллелей и генотипов исследуемого полиморфизма данного гена представлены в таблице 4.
| аллели/генотипы исследуемого гена | БДН | Контроль | Критерий | |||
| N=75 | частота, % | N=105 | частота, % | 2 | P | |
| GRIA1 (G) | 131 | 87,3 | 187 | 89 | 0,2 | 0,8 |
| GRIA1(A) | 19 | 12,6 | 23 | 11 | ||
| GRIA1 (G/G) | 63 | 84 | 89 | 84,8 | 0,4 | 0,8 |
| GRIA1(A/G) | 5 | 6,6 | 8 | 8,6 | ||
| GRIA1 (A/A) | 7 | 9,3 | 7 | 6,6 | ||
Таблица 4. Сравнительный анализ частот аллелей и генотипов гена GRIA1 в группе больных БДН и в контрольной выборке.
Было установлено, что более часто встречается аллель G как в группе больных БДН (87,3%), так и в контрольной выборке (89,05%). Из генотипов по частоте встречаемости преобладает генотип G/G (84% в группе больных и 84,8% в контроле). Распределение частот генотипов в группе больных БДН и контрольной выборке практически совпадает. Распределение частот генотипов в каждой из выборок соответствует уравнению Харди-Вайнберга (2 = 0,45; р = 0,82).
Также нами был проведён анализ корреляции клинических признаков БДН с изученными полиморфными вариантами гена GRIA1.
При этом статистически значимых корреляций выявлено не было. Таким образом, исходя из полученных данных, можно говорить о том, что изученный нами полиморфный вариант rs545098 гена GRIA1 не связан с риском развития болезни двигательного нейрона у больных БДН из России.
В гене GRIA2, кодирующем субъединицу GluR2 (В) нами был исследован интронный полиморфизм rs9307959 (замена C/T). Частоты аллелей и генотипов исследуемого полиморфизма данного гена представлены в таблице 5. Наиболее частым по встречаемости в обеих выборках оказался аллель С (76% в группе больных БДН и 74,3% в контроле). Из генотипов наиболее частым является генотип С/С (57,3% в группе больных БДН и 58% в контроле). Распределение частот генотипов в группе больных и в контроле практически одинаково и соответствует уравнению Харди-Вайнберга (2 = 1,3; р = 0,52).
| аллели/генотипы исследуемого гена | БДН | Контроль | Критерий | ||||
| N=75 | частота, % | N=105 | частота, % | 2 | P | ||
| GRIA2 (С) | 114 | 76 | 156 | 74,3 | 0,1 | 0,71 | |
| GRIA2(Т) | 36 | 24 | 54 | 25,7 | |||
| GRIA2 (С/С) | 43 | 57,3 | 61 | 58 | 1,3 | 0,5 | |
| GRIA2(С/Т) | 28 | 37,3 | 34 | 32,4 | |||
| GRIA2 (Т/Т) | 4 | 5,3 | 10 | 9,5 | |||
Таблица 5. Сравнительный анализ частот аллелей и генотипов гена GRIA2 в группе больных БДН и в контрольной выборке.
Также нами был проведён анализ корреляции клинических признаков БДН с изученными полиморфными вариантами гена GRIA2. При этом статистически значимых корреляций выявлено не было. Таким образом, исходя из полученных данных, можно говорить о том, что изученный нами полиморфный вариант rs9307959 гена GRIA2 не связан с риском развития болезни двигательного нейрона у больных БДН из России.
Анализ инсерционного полиморфизма гена CYP2E1
У больных спорадическим БДН был проведён анализ инсерционного полиморфизма 96 п.н. в промоторе гена CYP2E1, локализованном в регионе -2270 и -1672. Как было установлено, в присутствии инсерционного аллеля CYP2E1*1D происходит увеличение ферментативной активности по сравнению с диким аллельным вариантом (CYP2E1*1C).
Результаты генотипирования представлены в таблице 6.
| аллели/генотипы исследуемого гена | БДН | Контроль | Критерий | |||
| N=75 | частота, % | N=105 | частота, % | 2 | P | |
| CYP2E1*1C Ins96(-) | 129 | 86 | 205 | 97,5 | 7,63 | <0,001 |
| CYP2E1*1D Ins96(+) | 21 | 14 | 5 | 2,5 | ||
| CYP2E1*1C/ CYP2E1*1C | 60 | 80 | 100 | 95 | 12,64 | 0,0018* |
| CYP2E1*1C/ CYP2E1*1D (a) | 11 | 14,7 | 5 | 5 | ||
| CYP2E1*1D/ CYP2E1*1D (b) | 4 | 5,3 | 0 | 0 | ||
| CYP2E1*1C/ CYP2E1*1C | 60 | 80 | 100 | 95 | 11,6 | <0,001 |
| a+b | 15 | 20 | 5 | 5 | ||
Таблица 6. Распределение аллелей и генотипов для инсерционного полиморфизма гена CYP2E1 в группе больных БДН и контрольной выборке
(*-рассчитано при помощи программы R x C).
Аллель CYP2E1*1D встречался крайне редко, особенно в контрольной группе и различий в частоте этого аллеля между нашим контролем (2,5%) и частотой данного аллеля, характерной для европейцев (2%), не наблюдалось. Однако были обнаружены важные отличия в частотах аллеля между контролем и больными БДН. Так, в группе больных аллель CYP2E1*1D встречался значительно чаще (14%) по сравнению с контрольной выборкой (2,5%).
Сравнительный анализ распределения генотипов продемонстрировал статистически значимые расхождения между больными и контролем в нашей популяции. В группе больных достоверно чаще встречались гомозиготы по инсерционному аллелю.
Поскольку было обнаружено, что генотипы, которые содержат инсерцию, ассоциированы с более высокой ферментативной активностью, мы объединили в одну группу гетерозиготы CYP2E1*1C/ CYP2E1*1D (a) и гомозиготы CYP2E1*1D/ CYP2E1*1D (b). Совместный генотип CYP2E1 (a+b) также в основном преобладал в группе больных БДН по сравнению с контрольной группой (2 = 11,6; р = <0,001) (рис.1).
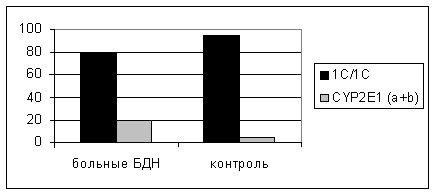
Рисунок 1. Варианты генотипов гена CYP2E1 в группе больных БДН и контроле.
Мы провели оценку возможного влияния наличия инсерционного аллеля, повышающего ферментативную активность, на клинические характеристики болезни. Для этой цели мы исследовали корреляции между объединённым CYP2E1 генотипом и больными, с различными клиническими признаками. При этом была выявлено две корреляции между клиническим диагнозом и объединённым генотипом, а также скоростью прогрессирования по Норрису (табл.7).
Дальнейший анализ показал, что у гомозигот по аллелю дикого типа (CYP2E1*1C/CYP2E1*1C) значительно чаще наблюдается БДН с шейным дебютом, в то время как наличие аллеля CYP2E1*1D коррелирует с остальными, более тяжелыми формами БДН, такими как БДН с грудным и диффузным дебютами и прогрессирующим бульбарным параличом
(2= 3,85; p= 0,0492) (рис.2).
.
| Клинические признаки | CYP2E1 | |
| p-level | ||
| Диагноз/Дебют | -0,43 | 0,004 |
| Вариант | -0,24 | 0,15 |
| Скорость прогрессирования по Норрису | 0,35 | 0,03 |
| Возраст начала заболевания | -0,26 | 0,06 |
Таблица 7. Непараметрические значения корреляций клинических признаков с инсерционным полиморфизмом в промоторе гена CYP2E1.
В то же время корреляция между генотипом по Ins\Del полиморфизму гена CYP2E1 и скоростью прогрессирования по Норрису не подтвердилась при анализе таблиц сопряженности 2х3 с использованием программы GraphPad InStat (2= 0,30; p= 0,85). Также было показано, что относительный риск развития заболевания у носителей инсерционного аллеля CYP2E1 повышен в 2,00 раза (Д.и. 1,45 – 2,76) у больных спорадической формой БДН в выборке больных из России.
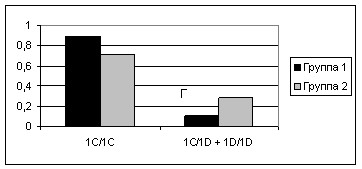
Рисунок 2. Варианты генотипов гена CYP2E1 в группе больных БДН и контроле в сравнении с распределением по варианту заболевания.(Группа 1 –Больные БДН с шейным дебютом; Группа 2 –Больные с другими формами БДН. 2= 3,85; p= 0,0492).
Анализ полиморфизма гена CYP2D6
В данной работе проведён анализ полиморфизма гена CYP2D6 в контрольной группе и в группе больных БДН из России. Следует отметить, что нами использовался метод, позволяющий отличить мутантный аллель CYP2D6*4 от других аллелей гена CYP2D6 (Non-CYP2D6*4). Результаты анализа данного полиморфизма гена CYP2D6 представлены в таблице 8.
| аллели/генотипы исследуемого гена | БДН | Контроль | Критерий | |||
| N=75 | частота, % | N=105 | частота, % | 2 | P | |
| Non-CYP2D6*4 | 114 | 76 | 174 | 82,8 | 2,57 | 0,11 |
| CYP2D6*4 | 36 | 24 | 36 | 17,2 | ||
| Non-CYP2D6*4/ Non-CYP2D6*4(a) | 49 | 65,3 | 74 | 70,5 | 4,28* | 0,12* |
| Non-CYP2D6*4/ CYP2D6*4 (b) | 16 | 21,3 | 26 | 24,8 | ||
| CYP2D6*4/CYP2D6*4 | 10 | 13,3 | 5 | 4,7 | ||
| a+b | 65 | 85,7 | 100 | 95,3 | 4,21 | 0,04 |
| CYP2D6*4/CYP2D6*4 | 10 | 13,3 | 5 | 4,7 | ||
Таблица 8. Распределение аллелей и генотипов для полиморфизма гена CYP2D6 в группе больных БДН и контрольной выборке.
(*-рассчитано при помощи программы R x C).
Видно, что число гомозигот CYP2D6*4 преобладает в группе больных БДН. Для дальнейшего анализа мы объединили в одну группу гомозиготы и гетерозиготы по Non-CYP2D6*4 аллелю (генотипы (а) и (b). Сравнительный анализ распределения объединённого генотипа CYP2D6*4 (a + b) и гомозигот по аллелю CYP2D6*4 выявил статистически значимые отклонения между группой больных и контролем (рис. 3). Было показано повышение доли гомозигот по аллелю CYP2D6*4 в выборке больных БДН (р = 0,04).
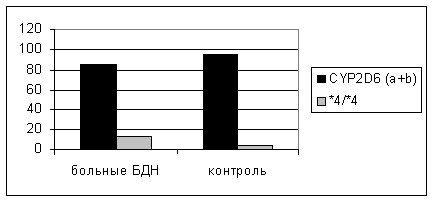 Рисунок 3. Распределение гомозигот CYP2D6*4 и объединённого генотипа CYP2D6*4 (a + b) в группе больных и контроле.
Рисунок 3. Распределение гомозигот CYP2D6*4 и объединённого генотипа CYP2D6*4 (a + b) в группе больных и контроле.
Была также проведена оценка возможного влияния наличия аллеля CYP2D6*4 на клинические характеристики болезни. Для этой цели мы изучили корреляции между комбинированным генотипом CYP2D6 и больными с различными клиническими проявлениями (табл.9).
| Клинические признаки | CYP2D6 - общий | |
| p-level | ||
| Диагноз/Дебют | -0,24 | 0,10 |
| Вариант | -0,49 | 0,0006 |
| Скорость прогрессирования по Норрису | 0,08 | 0,57 |
| Возраст начала заболевания | -0,39 | 0,0008 |
Таблица 9. Непараметрические значения корреляций клинических признаков с полиморфизмом гена CYP2D6.
При этом было выявлено две корреляции, ассоциированные с вариантом и возрастом начала заболевания. Для проверки достоверности полученных корреляций использовались статистические программы GraphPad InStat и STATISTICA 6.0. При этом статистически достоверной оказалась корреляция между комбинированным генотипом гена CYP2D6 и более ранним возрастом начала заболевания (t = 2,23; P= 0,03). Корреляция между вариантом и объединённым генотипом гена CYP2D6 статистически не подтвердилась (2= 2,35; p= 0, 31).
Таким образом, наличие аллеля CYP2D6*4 гена CYP2D6 у больных БДН оказывает влияние на возраст начала заболевания. Также было показано, что относительный риск развития заболевания у гомозигот по мутантному аллелю CYP2D6 повышен в 3,077 раза (Д.и. 1,006 – 9,414) у больных спорадической формой БДН в выборке больных из России.
Анализ полиморфных маркеров генов глутатион-S-трансфераз типа М1 и Т1
Генетический анализ делеционного полиморфизма генов GSTM1 и GSTT1 осуществлялся одновременно, при помощи мультиплексной ПЦР. Результаты генотипирования генов GSTM1 и GSTT1 представлены в таблице 10. Из приведенных данных видно, что как в контроле, так и в группе больных БДН были обнаружены генотипы + и 0/0 для обоих анализируемых генов. Частоты делеционных гомозигот для генов GSTT1 и GSTM1, наблюдаемые в нашем контроле, оказались сходны с частотами, характерными для европейцев.
| аллели/генотипы исследуемого гена | БДН | Контроль | Критерий | |||
| N=75 | частота, % | N=105 | частота, % | 2 | P | |
| GSTT1(+) | 56 | 74,4 | 85 | 81,0 | 0,68 | 0,41 |
| GSTT1(0/0) | 19 | 25,3 | 20 | 19,0 | ||
| GSTM1(+) | 45 | 60 | 46 | 43,8 | 4,59 | 0,032 |
| GSTM1(0/0) | 30 | 40 | 59 | 56,2 | ||
Таблица 10. Сравнительный анализ частоты генотипов (+) и (0/0) и комбинаций генов GSTM1 и GSTT1 в группе больных БДН и контрольной выборке.
В группе больных гомозиготы по делеции гена GSTT1 встречались чаще (25,3%) по сравнению с контролем (19%). Однако данные различия не являются статистически достоверными (2=0,68, p<0,41). В то же время мы выявили значительное отклонение в распределении частот генотипа GSTM 0/0 между двумя исследуемыми выборками. Установлено, что генотип GSTM 0/0 встречается реже в группе больных БДН (40% и 56,2% соответственно), по сравнению с частотой генотипа GSTМ1+, которая преобладает в группе больных БДН (60% и 43,8% соответственно).
Нами была выявлена повышенная частота генотипа GSTM1+ в группе больных БДН. Это может быть связано с тем, что некоторые глутатионовые коньюгаты ксенобиотиков могут быть токсичны для клеток нервной системы. С другой стороны, не исключены этнос-специфичные варианты взаимодействия между генетическими полиморфизмами и риском развития мультифакториальных заболеваний.
Мы изучили корреляцию между GSTТ1(0/0) и GSTМ1(0/0) генотипами и различными клиническими признаками болезни двигательного нейрона. При этом были выявлены две из них: корреляция с вариантом заболевания и скоростью прогрессирования по Норрису. Однако при дальнейшем статистическом анализе с использованием программы GraphPad InStat они не подтвердились.
Анализ Ile105Val полиморфизма гена GSTP1
В группе больных БДН и контрольной выборке был проведён анализ полиморфизма Ile105Val. Результаты генотипирования гена GSTP1 представлены в таблице 11.
| аллели/генотипы исследуемого гена | БДН | Контроль | Критерий | |||
| N=75 | частота, % | N=105 | частота, % | 2 | P | |
| GSTP1*A | 99 | 66 | 146 | 69,5 | 0,50 | 0,48 |
| GSTP1*B | 51 | 34 | 64 | 30,5 | ||
| GSTP1*A/GSTP1*A | 31 | 41,3 | 48 | 45,7 | 0,60 | 0,74 |
| GSTP1*A/GSTP1*B (a) | 37 | 49,5 | 50 | 47,6 | ||
| GSTP1*B/GSTP1*B (b) | 7 | 9,3 | 7 | 6,7 | ||
| GSTP1*A/GSTP1*A | 31 | 41,3 | 48 | 45,7 | 0,34 | 0,56 |
| a+b | 44 | 58,7 | 57 | 54,3 | ||
Таблица 11. Распределение аллелей и генотипов для Ile105Val полиморфизма гена GSTP1 в группе больных БДН и контрольной выборке.
Как видно из представленных данных, частоты аллельных вариантов и генотипов гена GSTP1 практически не отличаются в обеих исследуемых выборках. Наблюдаемая частота гомозигот по GSTP1*B аллелю в нашей контрольной выборке была сходна с частотой, доложенной другими авторами для европейцев.
В группе больных наблюдается незначительный перевес гомозигот по мутантному аллелю (34%), по сравнению с контролем (30,5%), а также некоторое понижение частоты нормального аллеля (на 3,5%). Однако данные различия не являются статистически достоверными.
Так как предыдущие исследования показали, что фермент, содержащий в 105 кодоне валин, имеет изменённую тепловую стабильность и каталитическую активность для широкого ряда ксенобиотиков (70,165), мы объединили в одну группу гетерозигот (а) и гомозигот (b) по аллелю GSTP1*B. Однако как показано в таблице 11, распределение частот объединённого генотипа GSTP1 (a+b) и гомозигот GSTP1*А было очень сходно.
Далее был проведён анализ возможной связи гена GSTP1 с клинической картиной заболевания и характером развития патологического процесса. Для этого был проведён анализ корреляции между объединённым генотипом гена GSTP1 (a+b) и клиническими признаками. В результате была обнаружена только одна ассоциация между вариантами вовлечения двигательного нейрона и объединённым генотипом GSTP1 ( = 0,38; р = 0,002, табл. 12).
| Клинические признаки | ген GSTP1 | |
| p-level | ||
| Диагноз/Дебют | -0,13 | 0,28 |
| Вариант | 0,38 | 0,002 |
| Скорость прогрессирования по Норрису | -0,18 | 0,18 |
| Возраст начала заболевания | -0,14 | 0,16 |
Таблица 12. Непараметрические значения корреляций клинических признаков с полиморфизмом Ile105Val гена GSTP1
Дальнейший анализ показал, что генотип GSTP1*A/GSTP1*A ассоциирован с классическим вариантом вовлечения мотонейронов, в то время как присутствие аллеля GSTP1*B коррелирует с сегментарно-ядерным и пирамидным вариантами вовлечения мотонейронов (рис.4).
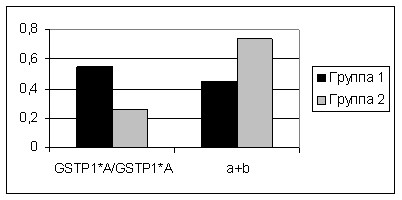
Рисунок 4. Распределение генотипов по полиморфизму Ile105Val гена GSTP1 у больных БДН с различными формами болезни.
(Группа 1 – Больные БДН с классическим вариантом вовлечения мотонейронов; Группа 2 – Больные БДН с сегментарно-ядерным и пирамидным вариантами вовлечения мотонейронов; 2= 6,60; p= 0,0102).
Анализ полиморфизма гена NAT2
Результаты генотипирования гена NAT2 представлены в таблице 13. Так как частота аллелей S1, S2 и S3 и частота соответствующих генотипов в отдельности была довольно небольшой, мы объединили все аллели в две группы: медленные (S) и быстрые (F1), а также все генотипы в две группы генотипов: быстрые ацетиляторы (F1\F1) и медленные, и промежуточные ацетиляторы (F1\S и S\S).
Наблюдаемое распределение ацетиляторов в обеих группах в нашей контрольной выборке не отличалось от данных, представленных для европейцев. Из таблицы видно, что распределение частот аллелей в обеих исследуемых выборках практически не отличается друг от друга.
| Аллели и фенотипы | БДН | Контроль | Критерий | |||
| N=75 | частота, % | N=105 | частота, % | 2 | P | |
| F1 аллели | 35 | 23,3 | 56 | 26,7 | 0,83 | 0,36 |
| S аллели | 115 | 76,6 | 154 | 73,3 | ||
| Быстрые ацетиляторы | 32 | 42,7 | 52 | 49,5 | ||
| Промежуточные и медленные ацетиляторы | 43 | 57,3 | 53 | 50,5 | ||
Таблица 13. Распределение аллелей и генотипов гена NAT2 в группе больных БДН и контрольной выборке.
При этом было установлено преобладание «медленных» ацетиляторов в группе больных. Это связано с тем, что у больных наблюдается уменьшение количества «быстрого» аллеля и увеличение числа «медленных аллелей». Однако данные различия не являются статистически достоверными (2 = 0,83; р = р=0,36).
Также мы исследовали корреляцию между разными ацетиляторами и различными клиническими признаками. Однако никаких значимых корреляций не было обнаружено.
ВЫВОДЫ
1. У больных со спорадической формой болезни двигательного нейрона (БДН) проведён анализ мутаций в кодирующей области гена (ALS2). При этом патогенетически значимых мутаций в гене алсина выявлено не было.
2. Изучение полиморфизма генов индуцируемого гипоксией фактора 1 (HIF1A), транспортёра глутамата типа 2 (EAAT2), ионотропных глутаматных рецепторов (GRIA1, GRIA2), глутатион-S-трансферазы типа Т1 (GSTT1) а также N-ацетилтрансферазы (NAT2) не выявило ассоциации между изученными полиморфными вариантами генов, риском развития БДН и особенностями ее клинического течения.
3. Изучение делеционного полиморфизма гена глутатион-S-трансферазы типа М1 (GSTM1) выявило снижение частоты генотипа GSTM1 0/0 в группе больных БДН (2= 4,59; p= 0,032). Это указывает на то, нулевой аллель этого гена при болезни двигательного нейрона играет роль протективного фактора.
4. Показана корреляция инсерционно-делеционного полиморфизма 5’-фланкирующей области гена CYP2E1 с клиническим типом заболевания. Делеционный вариант (аллель CYP2E1*1C) ассоциирован с шейным дебютом БДН, а аллель с инсерцией 96 п.н. (CYP2E1*1D) достоверно чаще встречается у больных с более тяжёлыми формами заболевания. Гомозиготность по CYP2E1*1D аллелю ассоциирована с повышенным риском развития БДН в российской популяции.
5. Обнаружено, что гомозиготность по аллелю CYP2D6*4 гена CYP2D6 ассоциирована с повышенным риском развития БДН. У больных БДН носителей этого аллеля наблюдается более раннее развитие заболевания.
6. Обнаружено, что Ile105Val полиморфизм гена глутатион-S-трансферазы (GSTP1) коррелирует с вариантом вовлечённости в патологический процесс мотонейронов. У носителей аллеля GSTP1*B гена GSTP1 преобладают сегментарно-ядерный и пирамидный варианты вовлечения мотонейронов, в то время как аллель дикого типа GSTP1*A ассоциирован с классической вовлечённостью мотонейронов.
ОСНОВНОЕ СОДЕРЖАНИЕ ДИССЕРТАЦИИ ИЗЛОЖЕНО В СЛЕДУЮЩИХ РАБОТАХ
- Жеребцова А.Л., Шадрина М.И., Левицкий Г.Н., Левицкая Н.И., Алёхин
А.В., Сломинский П.А., Скворцова В.И., Лимборская С.А. Анализ Ile105Valполиморфизма гена глутатион-S-трансферазы Р1 у больных со спорадическойформой болезни двигательного нейрона из России // Генетика. 2004. Т.40. №6.С.1-3. - Жеребцова А.Л., Шадрина М.И., Семёнова Е.В., Левицкий Г.Н., Алёхин
А.В., Сломинский П.А., Скворцова В.И., Лимборская С.А.. Анализ возможного участия генов транспортера глутамата EAAT2 и рецепторов GRIA1 и GRIA2 в патогенезе БДН в российской популяции // Генетика. 2006, №1. С.104-109. - Жеребцова А.Л., Шадрина М.И., Левицкий Г.Н., Алёхин А.В., Сломинский П.А., Скворцова В.И., Лимборская С.А. Отсутствие мутаций в гене ALS2 у больных со спорадической формой болезни двигательного нейрона из России //Медицинская генетика. 2006, №2, c. 28-30.
- Жеребцова А.Л., Шадрина М.И., Левицкий Г.Н., Алёхин А.В., Сломинский П.А., Скворцова В.И., Лимборская С.А. Ген HIF1A не является фактором риска развития болезни двигательного нейрона в российской популяции // Медицинская генетика. 2006, №2, c. 47-48.
- Скворцова В.И., Сломинский П.А., Шадрина М.И., Левицкий Г.Н., Левицкая Н.И., Алёхин А.В., Жеребцова А.Л., Сердюк А.В., Лимборская С.А. Полиморфизм генов детоксикации и предрасположенность к спорадической болезни мотонейронов в российской популяции // Ж. неврологии и психиатрии им. Корсакова, 2000, 106 (1), с. 4-13.
- Skvortsova V., Shadrina M., Slominsky P., Levitsky G., Kondratyeva E., Zherebtsova A., Levitskaya N., Alekhin A., Serdyuk A., Limborska S. Analysis of heavy neurofilament subunit gene polymorphism in Russian patients with sporadic motor neuron disease (MND)// Eur.J.Hum.Genet.2004. V.12. P. 241-244.
- Shadrina M., Slominsky P., Zherebtsova A., Levitsky G., Levitskaya N., Alekhin A., Serdyuk A., Semenova E., Skvortsova V., Limborska S. Detoxification gene polymorphisms and susceptibility to sporadic motor neuron disease in Russian population. Balkan J. of Medical Genetics. 2006, V. 16. P. 81-87.

