Внутривидовой полиморфизм фитопатогенного гриба cryphonectria parasitica в причерноморской части ареала каштана посевного ( castanea sativa )
На правах рукописи
Белов Анатолий Алексеевич
ВНУТРИВИДОВОЙ ПОЛИМОРФИЗМ ФИТОПАТОГЕННОГО ГРИБА CRYPHONECTRIA PARASITICA В ПРИЧЕРНОМОРСКОЙ ЧАСТИ АРЕАЛА КАШТАНА ПОСЕВНОГО (CASTANEA SATIVA)
03.02.08 - Экология (биологические науки).
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата биологических наук
Москва 2010
Работа выполнена на кафедре ботаники и основ сельского хозяйства Московского государственного областного университета и в лаборатории экологической биохимии Естественно-экологического института Московского государственного областного университета.
Научный руководитель:
доктор биологических наук, профессор Коничев Александр Сергеевич
Официальные оппоненты:
д.б.н. Топунов А.Ф.
к.б.н. доц. Живухина Е.А.
Ведущая организация: Всероссийский научно-исследовательский институт фитопатологии РАСХН.
Защита состоится 16 декабря 2010 года в 15:00 часов на заседании Диссертационного совета Д 212.155.13 при Московском государственном областном университете по адресу 141014, Московская обл., г. Мытищи, ул. Веры Волошиной, д 24
С диссертацией можно ознакомиться в библиотеке Московского государственного областного университета по адресу: 105005, Москва, ул. Радио, д. 10а
Автореферат разослан «____» ___________________ 2010 г.
Ученый секретарь диссертационного совета
доктор биологических наук Т.А.Снисаренко
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Одним из важнейших направлений популяционной и прикладной экологии является изучение влияния биологических факторов среды на состояние хозяйственно ценных видов растений. В этой связи, несомненный интерес представляет изучение воздействия фитопатогенных грибов на лесообразующие виды растений. Фитопатогенный гриб Cryphonectria parasitica (Murrill) Barr, является одним из самых известных представителей аскомицетовых грибов относящихся к классу Sordariomycetes. Он наносит большой вред лесному хозяйству, поражая своих основных хозяев, представителей рода Castanea. Гриб C. parasitica – раневой паразит, его споры инфицируют ветви и стволы через различные повреждения растительных тканей, после чего распространяясь по лубу, камбиальному слою и затем по внешним слоям заболони образует на поверхности повреждения в виде язв. Участки дерева выше точки инвазии погибают, из-за блокирования обмена веществ между органами растения. Вызванная данным паразитом эпидемия крифонекроза, разразившаяся в США и Европе в начале ХХ столетия, по праву считается крупнейшей из наблюдавшихся ботанических катастроф [Придня М.В. 2004].
C. parasitica как инфекционный агент на территории Северной Америки впервые был отмечен в 1904 году, а к 1950-м годам фактически уничтожил зубчатый каштан (Castanea dentata (Marsh.) Borkh.) – лесообразующий вид восточной части США (болезнь уничтожила порядка 3.5 миллиардов деревьев). В Европе, где основным растением-хозяином данного патогена является каштан посевной (C. sativa Mill.), гриб C.parasitica впервые был обнаружен в 1938 году в Италии. В течение нескольких последующих десятилетий он распространился почти на весь ареал произрастания каштана. В настоящий момент не тронутыми заболеванием остаются только рассеянные насаждения в северной Европе и Великобритании. Азиатские виды каштана (C.mollissima Blume., C.crenata Siebold & Zucc.) также подвержены крифонекрозу, однако погибают от него достаточно редко. Полагают, что они эволюционировали вместе с грибом-паразитом и, обладая достаточной толерантностью, являются естественным резервуаром инфекции. В частности, проникновение C.parasitica в США и Европу связывают с интродукцией азиатских каштанов, а последовавшее стремительное вымирание американского каштана – с его недостаточной устойчивостью к данному патогену.
Существенным моментом в истории исследований крифонекроза стало открытие в 1950-х годах явления гиповирулентности у C. parasitica. С этого времени большинство исследований, посвященных крифонекрозу, были связаны с этим явлением. Гиповирулентные штаммы обладают рядом характерных признаков: слабая пигментация (за что они получили название «белые» штаммы), низкий уровень бесполого спороношения, слабый и замедленный рост мицелия; поражение подобным штаммом, как правило, не приводит к гибели дерева. Как впоследствии было выявлено, гиповирулентность C. parasitica обусловлена присутствием вируса, который представляет собой двуцепочечную молекулу РНК, лишенную капсида, что делает невозможным его активное распространение через внешнюю среду. Вирус способен проникнуть в нового хозяина только через гифальные анастомозы образуемые между штаммами гриба. Проникая в конидиоспоры, вирус поражает значительную часть бесполого поколения своего хозяина. Данный вирус получил название Cryphonectria Hypovirus (CHV) и выделен в отдельное семейство Hypoviridae, в котором на сегодняшний день обнаружено четыре вида: CHV1, CHV2, CHV3, CHV4.
На CHV возлагали большие надежды как на естественного агента, способного помочь справиться с агрессивным фитопатогеном, снизив его вирулентность. Однако опыты по искусственному внедрению CHV, за некоторыми исключениями, в большинстве случаев закончились неудачей [Robin et al. 2010]. В США лишь в лесничествах штата Мичиган удалось спасти местную популяцию американского каштана, заражая деревья гиповирулентными штаммами гриба, однако на остальной территории, даже по прошествии нескольких десятилетий, CHV так и не смог распространиться [Milgroom et al. 1999]. Как полагают, преобладание половой стадии в цикле размножения C. parasitica обуславливает высокий уровень его генетической гетерогенности в Северной Америке, что является существенной преградой на пути распространения гиповируса в местной популяции гриба. В Европе популяция C.parasitica характеризуется малым аллельным разнообразием, а также низким уровнем рекомбинации, и несмотря на то, что опыты по искусственному заражению каштана гиповирулентными штаммами были успешными лишь в некоторых лесничествах на территории Италии, гиповирус сумел самостоятельно распространиться практически по всему ареалу европейского каштана. Таким образом, к настоящему моменту, большая часть выявляемых в Европе штаммов C.parasitica являются гиповирулентными [Robin et al. 2010]. Гиповирулентность штаммов C. parasitica, пораженных CHV, по праву считается одним из наиболее изученных, с точки зрения молекулярных основ, модельных объектов взаимодействия вирус-гриб, и по-прежнему представляет интерес для исследователей работающих в области популяционной и прикладной экологии.
Вопрос о состоянии популяции каштана посевного на территории РФ в связи с крифонекрозом требует детального исследования, ввиду практически полного отсутствия работ по данной теме. Оценка влияния сверхпаразита CHV на полиморфизм и вирулентные свойства штаммов C. parasitica, является ключевым факторам при рассмотрении возможных стратегий по борьбе с данным фитопатогеном. Сохранение каштана посевного в причерноморском ареале является актуальной научной и практической задачей защиты леса.
Цель и задачи исследования. Целью данной работы является проведение комплексного обследования распространенности и полиморфизма фитопатогенного гриба Cryphonectria parasitica в причерноморской части ареала каштана посевного, что позволит сравнить ситуацию с крифонекрозом на территории Кавказа РФ с общеевропейской и определить степень угрозы патогена для российской популяции каштана.
Исходя из цели работы, были поставлены следующие задачи:
- Провести обследование популяции каштана посевного на территории Северо-западного Кавказа в связи с крифонекрозом.
- Провести анализ вирулентных свойств штаммов C. parasitica выявленных в причерноморской популяции каштана посевного.
- Провести тесты на вегетативную совместимость с выявленными на Северо-Западном Кавказе гиповирулентными штаммами C. parasitica и дать оценку возможной роли CHV в качестве агента биологического контроля.
- Выявить молекулярно-генетические особенности CHV, обнаруженных в штаммах C. parasitica на территории РФ и Турции.
Научная новизна работы. В результате проведенного комплексного обследования распространенности и полиморфизма возбудителя крифонекроза C. parasiticа, впервые установлено, что фитопатоген распространен по всей причерноморской части ареала каштана посевного.
Проведенные тесты на вегетативную совместимость 99 штаммов C. parasitica, позволили выявить высокий уровень генетической гетерогенности C. parasitica на территории РФ, что позволило дать оценку перспективам использования CHV в качестве возможного агента способного ограничить распространите крифонекроза на территории РФ.
Впервые проведен анализ геномов гиповирусов, обнаруженных в выявленных на территории РФ и Турции штаммах C. parasitica, на основе чего определена их видовая принадлежность.
Практическая значимость работы. В рамках диссертационного исследования разработан метод идентификации C. parasitica в пораженной коре каштана с помощью полимеразной цепной реакции (ПЦР), позволяющий быстро и точно идентифицировать патоген в образце коры, не прибегая к фитопатологической экспертизе. Также, разработан метод идентификации CHV в изолированных штаммах C. parasitica, позволяющий оценить вирулентность гриба. В целом, результаты исследования позволяют дать общую оценку состояния популяции каштана посевного на Северо-Западном Кавказе в связи с крифонекрозом.
Апробация работы. Материалы диссертации докладывались на: Международной научно-практической конференции «Актуальные проблемы биоэкологи» (Москва, 21-24 октября 2008 г.), VI Международной научной конференции «Экология и безопасность жизнедеятельности» (6-7 декабря 2007 г., Сумгаит, Азербайджанская Республика), научных семинарах кафедры ботаники и основ сельского хозяйства МГОУ в 2007 – 2010 гг.
Публикации. По материалам диссертации опубликовано 8 статей, из которых 4 в периодических изданиях рекомендованных ВАК РФ.
Структура и объем работы. Диссертация состоит из введения; обзора современных литературных сведений о крифонекрозе каштана и его возбудителе C. parasitica (глава 1); описания биологических объектов, материалов и методов исследования (глава 2); изложения и обсуждения собственных экспериментальных данных (глава 3); заключения и выводов; списка цитированной литературы. Диссертация изложена на 104 страницах, содержит 1 таблицу и 10 рисунков, включая фотографии и схемы.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Биологический материал. В работе использованы образцы биологического материала, собранные на территории Северо-Западного Кавказа и севера Турции. Сбор образцов коры каштана посевного на территории РФ проводился нами в Сочинском национальном парке[1]. Выделение штаммов C. parasitica из образцов коры каштана проводили на твердой среде (картофельно-глюкозный агар – КГА) в чашках Петри. Видовую идентификацию чистых культур осуществляли на основании культурально-морфологических признаков, основываясь на имеющихся в литературе рекомендациях, а также с помощью разработанной нами методики ПЦР-идентификации C. parasitica. Штаммы C. parasitica А2 и А9 были любезно предоставлены нам для исследований д.б.н., г.н.с. ГНУ «Адлерская опытная станция» ВИР им. Н.И.Вавилова Н.Н. Гринько.
Штаммы C. parasitica из Зонгулдакской и Бартинской областей Турции получены в рамках реализации проекта «Исследование «рака» каштана (Castanea sativa Mill.) в лесных массивах Зонгулдакской области Турции и выращивание устойчивых саженцев»[2] в 2005 – 2008 гг. Выделение штаммов C. parasitica в чистые культуры проводилось на базе института биохимии и физиологии микроорганизмов им. Г. К. Скрябина РАН. Все выделенные штаммы помещены на хранение во Всероссийскую коллекцию микроорганизмов (ВКМ).
Основные методы исследования. Тест на вегетативную совместимость проводили по модифицированной методике [Robin et al. 2000], в серии парных сращиваний оценивая совместимость каждого из выделенных штаммов C. parasititca с гиповирулентными штаммами (73.2, А2, А9). При этом, визуально и с помощью ПЦР-идентификации CHV фиксировали передачу гиповируса вирулентным штаммам.
Для молекулярно-генетической идентификации C. parasitica нами были разработаны две пары праймеров, для которых в качестве мишени выступали гены белков-предшественников половых феромонов гриба Mf1/1, Mf2/1 (Vir1) и Mf2/2 (Vir2). Определение гиповирулентных штаммов C. parasitica осуществляли путем идентификации CHV в культуре гриба на основе специфических ПЦР-маркеров. В качестве молекулярных маркеров CHV использовали два консервативных участка вирусного генома, расположенные в районе мотивов вирусной РНК-полимеразы и хеликазы, которые остаются неизменными у всех представителей семейства Hypoviridae [Hillman et al., 1994].
Получение препаратов нуклеиновых кислот проводилось с использованием стандартных наборов реактивов «SILICA М» и «Diatom» (ООО «Компания «Биоком») с рядом модификаций. При выделении препаратов РНК также применялся фенол-хлороформный метод. Обратную транскрипцию и амплификацию проводили с помощью набора «RT-PCR-Core» (ООО «Компания «Биоком»). Детекцию продуктов ПЦР осуществляли при помощи гель-электорофореза.
Амплификацию целевых ПЦР-продуктов в препаративных целях проводили путем клонирования рекомбинантной плазмиды в трансформированных клетках E.coli. Приготовление компетентных клеток E.coli проводили кальциевым методом [Маниатис и др. 1984]. В работе использовался штамм С600 E.coli, любезно предоставленный ФГУП «Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов» (ГосНИИгенетика). В качестве плазмидного вектора для трансформации E.coli нами использовался набор pGEM-T Vector System I («Promega», США). Трансформация клеток E.coli проводилась методом теплового шока. После процедуры трансформации клетки выращивались на селективной среде с добавлением ампицилина.
Выделение плазмидной ДНК из трансформированных культур E.coli проводилось с применением стандартного набора для выделения плазмидной ДНК (ООО «Цитокин», С-Петербург, РФ). Секвенирование кДНК-копий участков генома CHV проводилось ЗАО «Евроген» (Москва, РФ) с использованием автоматического секвенатора ABI 3730 («Applied Biosystems Inc», США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Состояние популяции Castanea sativa на Северо-Западном Кавказе в связи с крифонекрозом. Обследование популяции каштана посевного было проведено в ходе экспедиции на территории Сочинского национального парка (СНП) (рис. 1). В лесничествах Лазаревской группы (Лазаревское, Головинское, Марьинское, Лыготхское, Макопсинское), где сосредоточены основные каштанники СНП [Придня М.В. 2005], нами отмечена близкая к 100%-ной пораженность каштана благородного крифонекрозом. Наиболее неблагополучна ситуация в Лазаревском лесничестве: здесь нами не встречено практически ни одного абсолютно здорового (без признаков заболевания крифонекрозом) каштана, все растения, начиная с 4-5-летнего возраста, имели в той или иной степени выраженные поражения стволов и ветвей. В лесничествах адлерской группы (Адлерское, Кепшинское, Краснополянское) отмечен более низкий процент заболевших деревьев. Тем не менее, C. parasitica обнаружен нами практически во всех обследованных каштановых рощах и даже на отдельно стоящих деревьях. Единственное исключение составляла небольшая каштановая роща около Красной Поляны (N 43 39.866 Е 40 10.421), где фитопатоген не был обнаружен. В целом, на основании полученных данных можно констатировать, что C. parasitica присутствует по всему ареалу каштана посевного на Северном Кавказе.
Отметим, что картина распространения крифонекроза в российской части ареала каштана посевного с самого начала обнаружения болезни отличалась крайним своеобразием. Первые очаги крифонекроза были найдены здесь в 1939 году, практически одновременно с обнаружением C. parasitica в Европе (1938 г.) [Иссинский П.А., 1968]. К рубежу 1970-х годов, несмотря на широкое диффузное распространение крифонекроза по всей кавказской части ареала каштана, активные его очаги занимали сравнительно небольшие площади. Как отмечается в работе [Придня М.В. 2004], за последние 50-60 лет популяция каштана оставалась в стабильном состоянии и очаги болезни занимали не более 4% от площади насаждений.
К сожалению, в бывшем СССР и нынешней РФ исследования крифонекроза каштана не получили должного развития (в отличие от Европы и США). В связи с этим на данный момент трудно опредилить причины столь своеобразной истории распространения C. parasitica на Кавказе и отмеченной нами внезапной вспышки крифонекроза в последние годы.
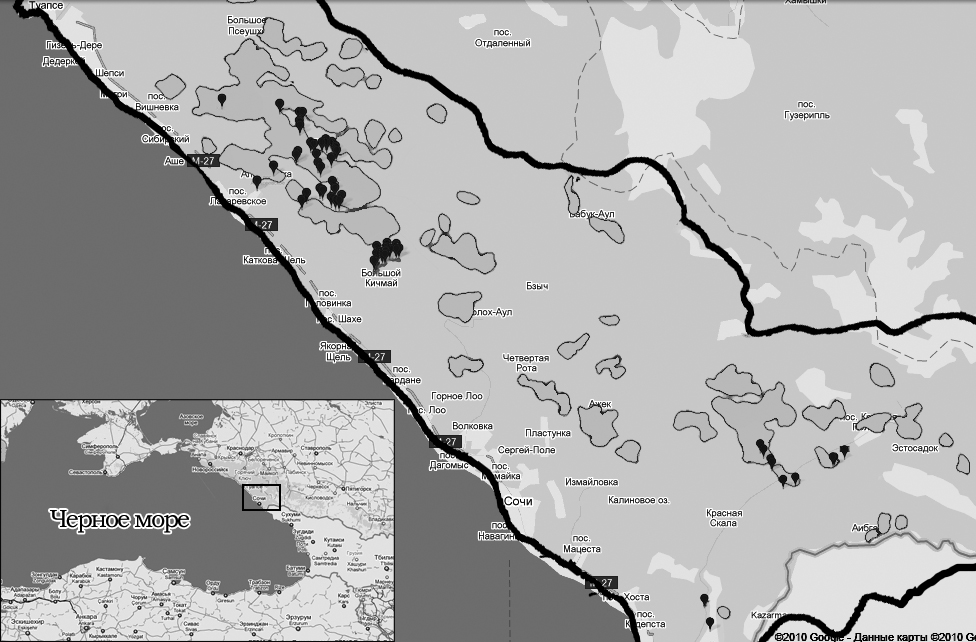 |
| Рисунок 1. Границы Сочинского национального парка. Точками показаны места сбора образцов. В границах парка темным цветом очерчены границы каштанников (по данным «Карты лесов Краснодарского края», 1962г.). |
Анализ вирулентных свойств и исследование внутривидового полиморфизма штаммов C. parasitica выявленных на территории РФ и Турции.
При проведении данной работы нами изучено 99 штаммов C. parasitica, выявленных на территории Северо-Западного Кавказа, а также 25 штаммов из Бартинской и Зонгулдакской областей Турции.
Выделенные нами российские штаммы C. parasitica обнаружили выраженные различия по макроморфологическим признакам и скорости роста, в связи с чем их можно разделить на несколько групп. Первая – наиболее многочисленная – группа характеризовалась быстрым радиальным ростом, пигментацией от светло-желтой до красно-оранжевой и пурпурной, и обильным спороношением, то есть классическими признаками вирулентных штаммов. Выделенный нами штамм 73.2, а также штаммы А2 и А9, отличались более медленным ростом, отсутствием пигментации и спороношения, то есть демонстрировали признаки гиповирулентных морфотипов. Наконец, штаммы третьей группы (№№ 16, 25, 27, 59, 66, 80.2) обнаруживали в целом нормальный уровень пигментации и спороношения при крайне ослабленном росте; мицелий у них был тонким, недоразвитым.
По результатам ПЦР-анализа, CHV был идентифицирован только в штаммах 73.2, А2 и А9, то есть из 97 штаммов C. parasitica, выделенных нами на территории РФ, только у одного была диагностирована CHV-обусловленная гиповирулентность. Это соотносится с полученными ранее данными Н.Н. Гринько [Гринько, 2008], которая, проанализировав материал из 385 географических точек Кавказа РФ, выделила только единичные гиповирулентные («alb») морфотипы патогена, предположив наличие в них CHV. Это предположение было подтверждено нами в ходе выполнения данной работы: с помощью ПЦР-анализа штаммов C. parasitica гиповирус был идентифицирован именно (и исключительно) в морфотипах характеризовавшихся отсутствием пигментации и спороношения (штаммы А2 и А9). Столь низкая распространенность гиповирулентности в северокавказской популяции C. parasitica коренным образом отличается от ситуации в Европе, для которой характерно доминирование гиповирулентных штаммов патогена, результатом чего, несмотря на большой процент пораженных крифонекрозом каштанов, является относительно низкий уровень смертности деревьев от этого заболевания.
Открытым остается вопрос о причинах гиповирулентности третьей группы российских штаммов C. parasitica. При сборе образцов было отмечено, что штаммы 16, 25, 27, 59, 66, 80.2 вызывали у каштанов поверхностные либо локализованные каллусом (заживающие) поражения. Не исключено, что их атипичный морфотип обусловлен инфицированием каким-либо другим вирусным агентом. Исходя из фенотипических проявлений гиповирулентности указанных штаммов можно предположить, что она вызвана микореовирусами – относительно недавно обнаруженными патогенами C. parasitica, которые были выделены в отдельный род в составе семейства Reoviridae. Следует заключить, что атипичные штаммы C. parasitica из кавказского ареала каштана посевного требуют дальнейшего изучения, с целью выявления агента вызывающего их гиповирулентность.
Считается, что вегетативная несовместимость у грибов, выражающаяся в неспособности штаммов образовать гифальные анастомозы, выполняет функцию барьера, который препятствует распространению цитоплазматических агентов, способных нанести вред организму гриба [Caten, 1972]. Кроме того, вегетативная несовместимость изолятов является природным маркером генетической гетерогенности популяций грибов.
Главной целью проведения нами соответствующих тестов являлось оценить уровень генетической гетерогенности штаммов гриба и возможность распространения CHV в популяции C. parasitica на территории РФ. Для этого нами были взяты имеющиеся в нашем распоряжении гиповирулентные штаммы 73.2, А2 и А9, и проведено три серии попарных сращиваний каждого из них с выявленными нами на территории РФ вирулентными штаммами C. parasitica. Проведенный тест на совместимость между гиповирулентными штаммами, показал, что штаммы А2 и А9 относятся к одной группе вегетативной совместимости (ВС) и оба несовместимы со штаммом 73.2. Благодаря этому штаммы А2 и А9 продемонстрировали идентичные реакции на совместимость с двумя штаммами (2.1 и 19.3), а со штаммом 73.2 положительную реакцию на совместимость показали шесть штаммов (3, 29, 49, 58, 62 и 69) (таблица 1).
Передача CHV вирулентным штаммам фиксировалась визуально и с помощью ПЦР. Визуально, передачу гиповируса можно определить в случае проявления вирулентными штаммами гиповирулентного фенотипа, после чего данные штаммы подвергаются ПЦР анализу, который дает окончательное подтверждение передачи CHV. В результате передача гиповируса была зафиксирована в шести случаях (штаммы 2.1, 17, 19.3, 28, 31 и 36) от штамма А9 и А2, и в 11 случаях (штаммы 3, 29, 42, 43, 49, 55, 58, 62, 69, 80.1 и 100) от штамма 73.2 (таблица 1). Несмотря на то, что, как известно, передача CHV от гиповирулентного штамма к вирулентному штамму C. parasitica происходит беспрепятственно только в пределах одной группы ВС, случаев передачи гиповируса выявлено больше, чем совместимых штаммов, поскольку в некоторых случаях она также возможна и между несовместимыми штаммами. На сегодняшний день выявлено семь генов vic, которые ответственны за вегетативную совместимость штаммов гриба, и штаммы, обладающие одинаковым набором аллелей всех семи генов, относят к одной группе ВС. При этом процент передачи CHV между несовместимыми штаммами определяется числом гетерогенных аллелей генов совместимости у сращиваемых штаммов: совместимость падает с увеличением гетероаллелизма и становится невозможной при различиях более чем по 4 аллелям vic [Дьяков Ю.Т., Долгова А.В. 1995].
Столь высокий уровень полиморфизма в северокавказской популяции C. parasitica не характерен для Европы, где за все время наблюдений была обнаружена 31 группа ВС, при этом 60% всех исследованных штаммов относились к одной группе [Milgroom et al., 2008]. В некоторых странах Европы, как например в Греции, все обнаруженные изоляты относились к одной группе ВС [Sotirovski et al. 2004]. Напротив, американская популяция C. parasitica отличается не только большим разнообразием групп ВС, но и более высоким уровнем рекомбинации, который в некоторых случаях настолько высок, что приближается по значениям к панмиксии. Высокая гетерогенность C. parasitica наблюдается даже в небольших локальных популяций каштана в США, где на одном или нескольких рядом растущих деревьях зачастую можно обнаружить штаммы гриба, принадлежащие к разным группам ВС [Milgroom & Cortesi, 1999].
| Таблица 1. Результаты тестов на вегетативную совместимость российских штаммов Cryphonectria parasiticа. | ||||||||
| № | Место сбора (геогр. координ. / лесничество) | А9, A2 | 73.2 | № | Место сбора (геогр. координ. / лесничество) | А9, A2 | 73.2 | |
| 1 | СШ43 54.528 ВД39 25.229 /Л | - | 40 | СШ43 51.551 ВД39 31.346 /Г | - | - | ||
| 2.1 | СШ43 54.528 ВД39 25.229 /Л | +п | - | 47 | СШ43 51.618 ВД39 31.936 /Г | - | - | |
| 2.2 | СШ43 54.528 ВД39 25.229 /Л | - | - | 48 | СШ43 51.718 ВД39 32.241 /Г | - | - | |
| 3 | СШ43 55.172 ВД39 26.648 /Л | - | +п | 49 | СШ43 51.718 ВД39 32.241 /Г | - | +п | |
| 4 | СШ43 55.172 ВД39 26.648 /Л | - | - | 51 | СШ43 51.692 ВД39 32.758 /Г | - | - | |
| 5 | СШ43 55.172 ВД39 26.648 /Л | - | - | 53 | СШ43 51.744 ВД39 32.951 /Г | - | - | |
| 7 | СШ43 55.080 ВД39 26.856 /Л | - | - | 54 | СШ43 51.984 ВД39 32.760 /Г | - | - | |
| 8 | СШ43 55.080 ВД39 26.856 /Л | - | - | 55 | СШ43 51.984 ВД39 32.760 /Г | - | п | |
| 9 | СШ43 55.080 ВД39 26.856 /Л | - | - | 57 | СШ43 51.835 ВД39 31.994 /Г | - | - | |
| 10 | СШ43 54.689 ВД39 27.552 /Л | - | - | 58 | СШ43 52.038 ВД39 32.029 /Г | - | +п | |
| 11 | СШ43 54.689 ВД39 27.552 /Л | - | - | 59 | СШ43 52.038 ВД39 32.029 /Г | - | - | |
| 12 | СШ43 54. 689 ВД39 27.552 /Л | - | - | 60 | СШ43 52.038 ВД39 32.029 /Г | - | - | |
| 13 | СШ43 54.689 ВД39 27.552 /Л | - | - | 61 | СШ44 00.332 ВД39 18.850 /Мк | - | - | |
| 14 | СШ43 54.537 ВД39 27.915 /Л | - | - | 62 | СШ44 00.332 ВД39 18.850 /Мк | - | +п | |
| 15 | СШ43 54.537 ВД39 27.915 /Л | - | - | 63 | СШ43 59.576 ВД39 25.031 /М | - | - | |
| 16 | СШ43 54.537 ВД39 27.915 /Л | - | - | 64 | СШ43 59.560 ВД39 25.244 /Лг | - | - | |
| 17 | СШ43 54.498 ВД39 28.206 /Л | - | - | 65 | СШ43 59.560 ВД39 25.244 /Лг | - | - | |
| 18 | СШ43 54.782 ВД39 28.514 /Л | - | - | 66 | СШ43 59.560 ВД39 25.244 /Лг | н/о | н/о | |
| 19.1 | СШ43 54.782 ВД39 28.514 /Л | - | - | 67 | СШ43 59.560 ВД39 25.244 /Лг | - | - | |
| 19.2 | СШ43 54.782 ВД39 28.514 /Л | - | - | 71.1 | СШ43 57.829 ВД39 27.176 /М | - | - | |
| 19.3 | СШ43 54.782 ВД39 28.514 /Л | +п | - | 71.2 | СШ43 57.829 ВД39 27.176 /М | - | - | |
| 20 | СШ43 55.204 ВД39 27.864 /Л | - | - | 72 | СШ43 57.858 ВД39 27.624 /М | - | - | |
| 21 | СШ43 55.204 ВД39 27.864 /Л | - | - | 73.2 | СШ43 57.858 ВД39 27.624 /М | - | - | |
| 22 | СШ43 55.594 ВД39 27.658 /Л | - | - | 75 | СШ43 57.606 ВД39 27.901 /М | - | - | |
| 23.1 | СШ43 56.415 ВД39 26.709 /Л | - | - | 76 | СШ43 57.379 ВД39 27.981 /М | - | - | |
| 23.2 | СШ43 56.415 ВД39 26.709 /Л | - | - | 77 | СШ43 56.958 ВД39 27.575 /М | - | - | |
| 25 | СШ43 56.415 ВД39 26.709 /Л | - | - | 78 | СШ43 57.828 ВД39 26.821 /М | - | - | |
| 27 | СШ43 56.652 ВД39 26.478 /Л | - | - | 79 | СШ43 57.828 ВД39 26.821 /М | - | - | |
| 28 | СШ43 57.179 ВД39 26.359 /Л | п | - | 80.1 | СШ43 57.814 ВД39 25.926 /Л | - | п | |
| 29 | СШ43 57.179 ВД39 26.359 /Л | - | - | 80.2 | СШ43 57.814 ВД39 25.926 /Л | - | - | |
| 30 | СШ43 57.737 ВД39 26.164 /Л | - | - | 81 | СШ43 56.487 ВД39 22.934 /Л | - | - | |
| 31 | СШ43 57.737 ВД39 26.164 /Л | п | - | 82 | СШ43 55.610 ВД39 21.651 /Л | - | - | |
| 32 | СШ43 57.317 ВД39 24.885 /Л | - | - | 83 | СШ43 28.910 ВД39 58.602 /А | - | - | |
| 33 | СШ43 57.317 ВД39 24.885 /Л | - | - | 84 | СШ43 30.406 ВД39 58.110 /А | - | - | |
| 34 | СШ43 57.123 ВД39 24.782 /Л | - | - | 85 | СШ43 30.406 ВД39 58.110 /А | - | - | |
| 35 | СШ43 57.123 ВД39 24.782 /Л | - | - | 86 | СШ43 30.406 ВД39 58.110 /А | - | - | |
| 36 | СШ43 49.030 ВД39 28.638 /Г | п | - | 91 | СШ43 39.425 ВД40 09.508 /Кр | - | - | |
| 38 | СШ43 51.450 ВД39 31.209 /Г | н/о | - | 93 | СШ43 38.136 ВД40 06.105 /К | - | - | |
| 39 | СШ43 51.450 ВД39 31.209 /Г | - | - | 94 | СШ43 38.136 ВД40 06.105 /К | - | - | |
| Продолжение таблицы 1 | ||||||||
| 40 | СШ43 51.551 ВД39 31.346 /Г | - | - | 95 | СШ43 38.136 ВД40 06.105 /К | - | - | |
| 41 | СШ43 51.845 ВД39 31.202 /Г | - | - | 96 | СШ43 39.132 ВД40 04.029 /К | - | - | |
| 42 | СШ43 51.845 ВД39 31.202 /Г | - | п | 97 | СШ43 39.312 ВД40 03.925 /К | - | - | |
| 43 | СШ43 51.415 ВД39 31.628 /Г | - | +п | 98 | СШ43 39.922 ВД40 03.270 /291 | - | - | |
| 44 | СШ43 51.404 ВД39 31.840 /Г | - | - | 99 | СШ43 39.922 ВД40 03.270 /291 | - | - | |
| 45 | СШ43 51.404 ВД39 31.840 /Г | - | - | 100 | СШ43 40.265 ВД40 02.998 /304 | - | п | |
Примечание: «+» – штаммы вегетативно совместимы, «–» – штаммы не совместимы, «п» – происходит передача CHV. Курсивом выделены штаммы с гиповирулентным и атипичным фенотипами. Лесничества: А – Адлерское, Мк – Макопсинское, М – Марьинское, Л – Лазаревское, Лг – Лыготхское, Г – головинское, К – Кепшинское, Кр – Краснополянское.
Подобное явление в североамериканской популяции C. parasitica объясняют преобладанием в ней полового размножения [Marra & Milgroom, 2001]. Схожая картина выявлена нами при анализе вегетативной совместимости кавказских штаммов C. parasitica. Ряд штаммов, выделенных из образцов коры, взятых с одного дерева, оказались несовместимы друг с другом (2.1 и 2.2, 13.1 и 13.2, 23.1 и 23.2, 71.1 и 71.2, 73.1 и 73.2 (гиповирулентный штамм), 80.1 и 80.2 (гиповирулентный штамм), а также 19.1, 19.2, 19.3) (таблица 1).
Среди 25 турецких штаммов, по их макроморфологическим признакам, нами были выделены две группы: первая группа характеризовалась быстрым радиальным ростом, обильным спороношением и высоким уровнем пигментации (16 штаммов); вторая группа представлена штаммами с низким уровнем пигментации и отсутствием спороношения (9 штаммов). Указанные макроморфологические признаки турецких изолятов C. parasitica в целом позволяют довольно точно идентифицировать пораженные CHV штаммы (группа 2), что было подтверждено с помощью ПЦР. Полученные результаты, в целом, соответствуют картине, описываемой исследователями для европейской популяции C. parasitica, низкий уровень генетического разнообразия которой способствовал широкому распространению гиповируса, где в зависимости от района, число обнаруживаемых гиповирулентных штаммов колеблется от 30% до 90%. [Akilli et al., 2009; Milgroom & Cortesi, 1999; Cortesi & Milgroom, 1998; Milgroom et al., 2009].
Наличие большого количества вегетативно несовместимых штаммов C. parasitica является серьезной преградой для распространения гиповирулентности в популяции гриба на Северо-Западном Кавказе. Кроме того, математические модели «каштан-C.parasitica-CHV» («дерево-паразит-гиперпаразит») показывают, что успешность распространения CHV среди C. parasitica при внедрении последней в популяции каштана во многом определяется начальными параметрами инвазии. Согласно разработанным моделям [Morozov et al. 2007], доминирование гиповирулентной формы фитопатогена (ситуация, в целом характерная для Европы) возможно только в том случае, если на начальных этапах распространения крифонекроза зараженные CHV штаммы преобладали над вирулентными штаммами гриба. В противном случае CHV имеет мало шансов закрепиться в популяции C. parasitica, и высокая агрессивность патогена в конечном итоге приводит к деградации насаждений каштана.
Подводя итог, можно заключить, что тотальная пораженность популяции каштана посевного C. parasitica, высокая генетическая гетерогенность паразита и эпизодическая встречаемость гиповирулентных штаммов гриба определяют невозможность широкого естественного распространения гиповирулентности в популяции фитопатогена на Северо-Западном Кавказе. При этом успешное искусственное внедрение гиповирулентных штаммов C. parasitica не осуществимо на основных территориях каштанников, уже массово охваченных крифонекрозом. Не исключено, что единственно возможным вариантом спасения каштана в данном регионе остается интродукция азиатских видов каштана и гибридизация их с местными формами. Подобные работы, проводимые в США на протяжении нескольких десятилетий, дали положительные результаты – в результате селекционной работы и спонтанной гибридизации (происходившей в смешанных насаждениях разных видов и гибридов каштанов) были получены устойчивые к крифонекрозу гибридные формы.
Выявление молекулярно-генетических особенностей CHV, обнаруженных в штаммах C. parasitica на территории Турции и РФ. Организация генома четырех известных на сегодняшний день гиповирусов C. parasitica имеет ряд характерных особенностей. Так, на рисунке 2 приведена схема генома гиповируса CHV1, который содержит две открытые рамки считывания (open reading frame – ORF) ORF A и ORF B. Средняя длина генома CHV1 составляет 12700 пар оснований, при этом около 75% приходится на ORF B. Каждая ORF кодирует по одному полипептиду, которые в последующем распадаются, путем автокаталитического протеолиза, образуя ряд вирусных белков. Для ORF А это протеазы р29 и р40, из которых первая собственно и осуществляет автокатализ. Довольно массивный (300 кДа) белок-предшественник кодируемый ORF В, включает в себя гены протеазы р48, обладающей автокаталитическими свойствами, и мотивы вирусных РНК-зависимой РНК-полимеразы и хеликазы [Lin et al. 2007].
Для выявления пораженных CHV штаммов C. parasitica нами разработана методика идентификации гиповируса с помощью ОТ-ПЦР. Симптоматика, которую демонстрировали гиповирулентные штаммы из Турции (группа 2) и России (штаммы 73.2, А2 и А9), была наиболее характерной для поражения гиповирусом CHV1. Исходя из этого, нами были разработаны две пары праймеров, для которых в качестве мишени выступают два участка вирусного генома расположенных на ORF B. Выбранные последовательности располагаются рядом с мотивами вирусной РНК-полимеразы и хеликазы, особенность которых состоит в том, что они являются консервативными и остаются практически неизменными у всех основных представителей семейства Hypoviridae.
 |
| Рисунок 2 – Схема генома гиповируса типа CHV1. ORF A и B – открытые рамки считывания (ORF – open reading frame); р29, р40 и р48 – гены вирусных протеаз; 5'-UTR и 3'-UTR - 5'- и 3'-нетранслиремые области (untranslated region – UTR); Pol - РНК-зависимая РНК-полимераза; Hel – хеликаза. |
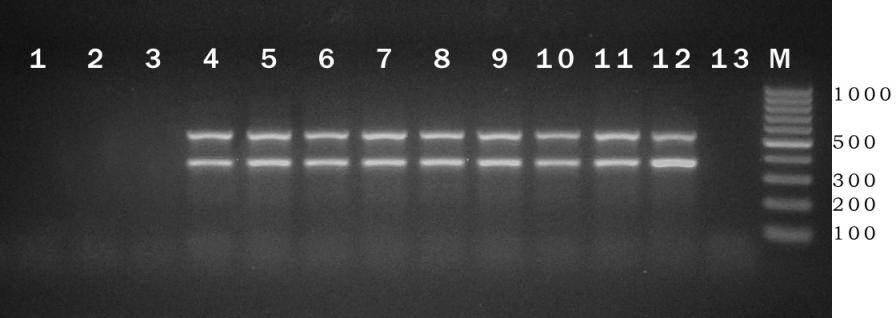 |
| Рисунок 3. Электрофореграмма продуктов ПЦР на видоспецифичные для CHV праймеры (целевые фрагменты – 533 и 355 н.п.). 1 и 2 – отрицательные контроли; 3 и 13 – вирулентные штаммы; 4-12 – гиповирулентные штаммы (группа 2); М – маркер молекулярных масс. |
Результаты проведенного нами ПЦР-анализа гиповирулентных штаммов C. parasitica из Турции приведены на рисунке 3. Постановка ПЦР на CHV-специфические праймеры с вирулентными, турецкими (группа 1) и российскими (группы 1 и 3), штаммами давала одинаково отрицательный результат (рис. 3, 3 и 13). В результате, целевые продукты ПЦР, были получены только для тех штаммов, которые обладали выраженными симптомами CHV-обусловленной гиповирулентности. Полученные результаты позволяют сделать вывод, что гиповирулентность девяти турецких штаммов, и трех российских, вызывается гиповирусом CHV1, что подтвердилось и при последующем анализе нуклеотидной последовательности полученных ПЦР-продуктов.
На сегодняшний день на территории Европы выделяют 7 подтипов гиповирусов CHV1 [Allemann, 1999]. В целом в европейской популяции C. parasitica наиболее распространены гиповирусы подтипа I, к которым относятся, в частности, менее агрессивные («слабые») вирусы CHV1-Euro7 и CHV1-EP721, тогда как вызывающий наиболее явные симптомы гиповирулентности («сильный») CHV1-EP713 (подтип F1) встречается эпизодически [Lanz, 2010]. У CHV1-ЕР713 и CHV1-Euro7 последовательности дцРНК в кодирующей области генома идентичны на 93% [Chen et al. 1999]. Сходство дцРНК вируса CHV1-EP721 с геномами CHV1-Euro7 и CHV1-EP713 составляет соответственно 99% и 90% [Lin et al. 2007].
Нами был проведен анализ нуклеотидной последовательности четырех участков генома гиповирусов (5'-UTR – участок в 448 н.п; р29 – участок в 500 н.п., р48 – участок в 552 н.п.; мотив РНК-полимеразы – участок в 467 н.п.), выделенных из российских и турецких гиповирулентных штаммов (рис. 4). Гиповирусы, выделенные нами из турецких штаммов FW-3138 и FW-3143 продемонстрировали наибольшее сходство (99%) с гиповирусами CHV1-EP721 и CHV1-Euro7, по всем исследованным участкам. Однако у CHV, выделенных из российских штаммов C. parasitica, наблюдался ряд интересных особенностей. На участке 5'-UTR и р29 гиповирусы из штаммов А9 и 73.2, так же как и турецкие штаммы, обнаружили наибольшее сходство (95% и 93% соответственно) с гиповирусами CHV1-I (рис. 4а,б). Однако на участках расположенных в ORF B наблюдалась кардинально иная картина. На участке р48 российские гиповирусы обнаружили сильное сходство (97%) с гиповирусом CHV1-EP713 (рис. 4в), а на участке мотива РНК-полимеразы показали наименьший процент сходства (87%) со всеми исследованными штаммами гиповирусов (рис. 4г). Последнее представляет особенный интерес в связи с тем, что как показали исследования [Chen et al. 2000], именно с отличиями в последовательности ORF B связывается разница в проявлении основных симптомов гиповирулентности. Тем не менее, у всех исследованных гиповирусов была обнаружена делеция двух и вставка одного нуклеотида на участке 5'-UTR, а также сайт автокатализа, разделяющий последовательности р29 и р40 на ORF A, расположен между кодонами глицина и аспарагина (рис. 4б). Данные признаки являются характерными исключительно для подтипа CHV1-I, что и дает нам основание отнести обнаруженные на территории РФ и Турции штаммы гиповирусов в данную группу, несмотря на высокий процент отличий по нуклеотидной последовательности российских штаммов от европейских и турецких.
| А | 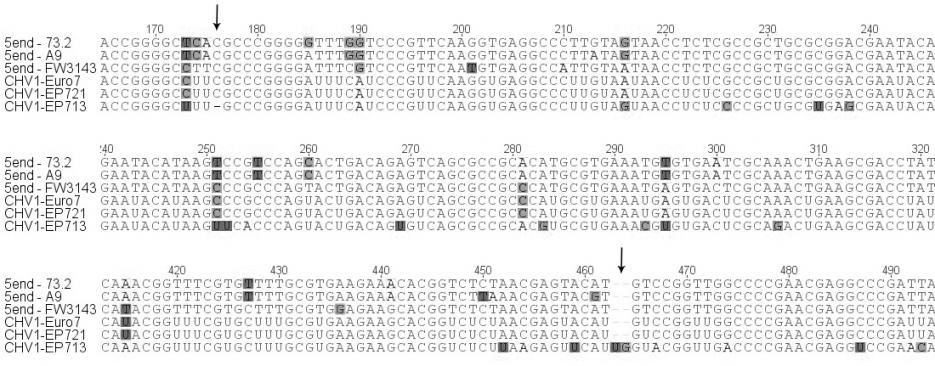 |
| Б | 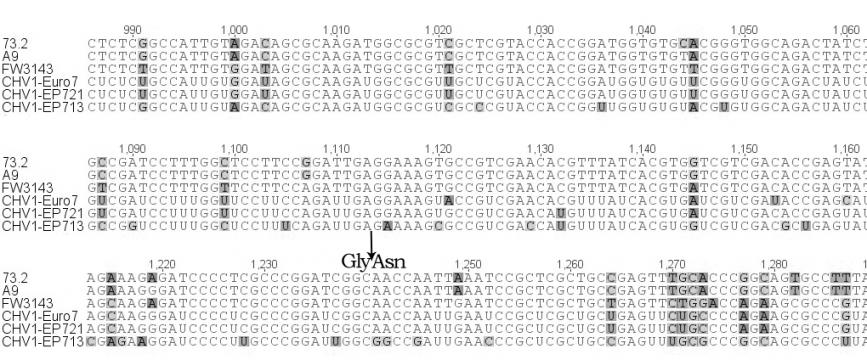 |
| В | 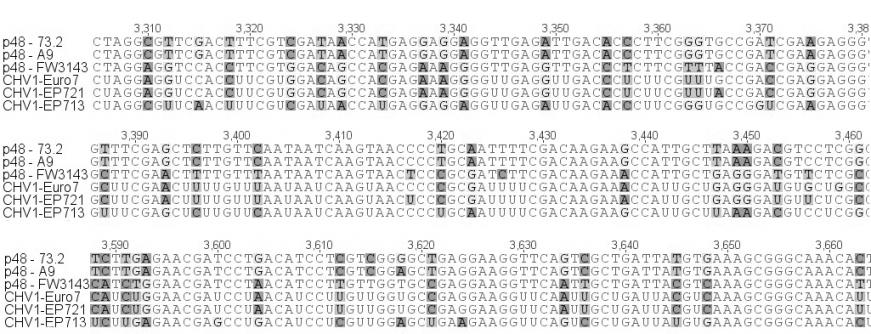 |
| Рисунок 4. Секвенированные участки геномов CHV выделенных из российских (73.2 и А9) и турецкого (FW3143) штаммов C. parasitica (часть пояснений в тексте). (А) участок 5'-UTR, стрелками показаны вставка одного и делеция двух оснований у гиповирусов CHV1-подтип I; (Б) участок гена белка р29, вверху последовательность сайта ответственного за автокатализ, внизу стрелкой показал сайт автокатализа (Asn – аспарагин и Gly – глицин); (В) участок гена белка р48, вверху показан участок ответственный за автокатализ; (Г) участок мотива вирусной РНК-полимеразы. | |
| Г | 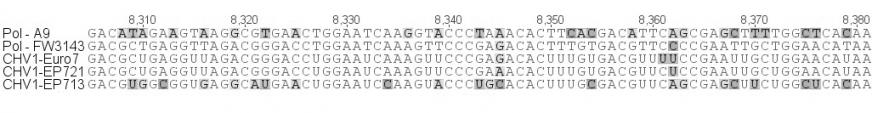 |
| Рисунок 4. Продолжение. | |
Выводы:
- Изучено распространение фитопатогенного гриба Cryphonectria parasitica (Murrill) Barr, вызывающего крифонекроз каштана посевного (Castanea sativa Mill), что позволило установить практически полную пораженность каштана на территории Северо-Западного Кавказа.
- Разработаны методики ПЦР-идентификации C. parasitica в образцах коры каштана посевного, позволяющие выявить возбудителя крифонекроза и диагностировать его вирулентные свойства, не прибегая к традиционным методам фитопатологической экспертизы.
- В популяции каштана на территории Северо-Западного Кавказа выявлены лишь единичные гиповирулентные (пораженные CHV) штаммы, тогда как в исследованых районах Турции их доля составляла 40%.
- Анализ отдельных участков генома гиповирусов, выявленных в штаммах C. parasitica на территории РФ и Турции, позволил установить, что данные гиповирусы принадлежат к виду CHV1.
- Нами выявлены «атипичные» штаммы C. parasitica, обладающие гиповирулентным морфотипом, но при этом не пораженные CHV. Возможно, гиповирулентность этих штаммов вызвана не встречавшимся ранее на территории Европы вирусом.
- Проведенные тесты на вегетативную совместимость выявили высокий уровень генетической гетерогенности в северокавказской популяции C. parasitica, что кардинальным образом отличается от ситуации в Европе, а также в причерноморских областях Турции. Общая картина внутривидового полиморфизма C. parasitica на территории Турции в целом соответствует общеевропейской.
- Высокий уровень генетической гетерогенности C. parasitica и единичная встречаемость пораженных CHV штаммов гриба указывают на невозможность биологического контроля крифонекроза на Кавказе РФ на основе явления CHV-обусловленной гиповирулентности. В этой связи более перспективным методом борьбы с крифонекрозом в данном регионе может быть интродукция азиатских видов каштана и их гибридизация с местными формами.
Содержание работы в основном отражено в следующих публикациях:
- Пасечник В.В., Коничев А.С., Аллахвердиев С.Р., Цветков И.Л., Снисаренко Т.А., Попов А.П., Коничева А.П., Белов А.А. Рак каштана: история распространения, биохимические основы экспрессии и перспективы преодоления // Вестник МГОУ. Труды Центра фундаментальных научных исследований. 2006, №1, с. 5-12. (авторский клад – 10%)
- Коничев А.С., Попов А.П., Цветков И.Л., Белов А.А. Диагностика эндотиевого рака каштана методом ПЦР // Мат. VI Международ. научной конференции «Экология и безопасность жизнедеятельности» (6-7 декабря 2007 г., Сумгаит, Азербайджанская Республика). Сумгаит. 2007. С. 17-18. (авторский клад – 20%)
- Белов А.А., Попов А.П. РНК-вирусы как детерминанты гиповирулентности Cryphonectria parasitica – возбудителя рака коры каштана // Актуальные проблемы биоэкологи. Сб. мат. Международ. научно-практической конференции 21-24 октября 2008 г. М., 2008. С. 53-55. (авторский клад – 70%)
- Коничев А.С., Белов А.А., Попов А.П. Молекулярно-биологическая идентификация CHV-вируса в штаммах Cryphonectria parasiticа // Труды Института микробиологии НАН Азербайджана. 2009. Т. VII. С. 235-238. (авторский клад – 35%)
- Аллахвердиев С.Р., Коничев А.С., Попов А.П., Цветков И.Л., Кырдар Э., Гюндюз Г., Атик А., Баязыт Ш.И., Белов А.А. Мониторинг грибковых заболеваний анатолийского (европейского) каштана (Castanea sativa Mill) в Турции // Труды Института микробиологии НАН Азербайджана. 2009. Т. VII. С. 30-36. (п.л., авторский клад – 10%)
- Белов А.А. Идентификация CHV в штаммах Cryphonectria parasitica методом полимеразной цепной реакции // Вестник МГОУ. Серия «Естественные науки». 2009. №2. С. 22-24. (авторский клад – 100%)
- Попов А.П., Цветков И.Л., Белов А.А., Коничев А.С., Иванушкина Н.Е., Кочкина Г.А., Озерская С.М. Молекулярно-генетическая идентификация фитопатогенного гриба Cryphonectria parasiticа // Микробиология. 2010. Т. 79. № 2. С. 246-251. (авторский клад – 20%)
- Попов А.П., Белов А.А., Цветков И.Л., Коничев А.С. Исследование полиморфизма Cryphonectria parasitica – возбудителя крифонекроза каштана посевного – на Северо-Западном Кавказе // Вестник МГОУ. Серия «Естественные науки». 2010. № 3. С. 92-97. (авторский клад – 30%).
- Попов А. П., Белов А. А., Иванушкина Н. Е., Цветков И. Л., Коничев А. С. Молекулярно-генетические детерминанты внутривидового полиморфизма фитопатогенного гриба Cryphonectria parasitica // Генетика. 2011. (в печати). (авторский клад – 20%).
[1] Работы по исследованию C. parasiticа на Северо-Западном Кавказе выполнены при финансовой поддержке ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы (Государственный контракт № П624 от 07.08.2009 г.).
[2] Автор выражает глубокую благодарность д.б.н., проф. Аллахвердиеву С.Р. и д.б.н. Гринько Н.Н. за предоставленный биологический материал.

