Использование водных макрофитов в очищении воды от тяжелых металлов
На правах рукописи

ЧАН КУОК ХОАН
ИСПОЛЬЗОВАНИЕ ВОДНЫХ МАКРОФИТОВ В ОЧИЩЕНИИ ВОДЫ
ОТ ТЯЖЕЛЫХ МЕТАЛЛОВ
Специальность 03.02.08 – Экология (биология)
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Астрахань – 2012
Работа выполнена на кафедре гидробиологии и общей экологии ФГБОУ ВПО
«Астраханский государственный технический университет»
| Научный руководитель: | кандидат биологических наук, доцент Мельник Ирина Викторовна |
| Официальные оппоненты: | доктор биологических наук, заведующий кафедрой «Прикладная экология» ФГБОУ ВПО «Кубанский государственный аграрный университет», профессор Стрельников Виктор Владимирович доктор биологических наук, заведующая кафедрой «Прикладная биология и микробиология» ФГБОУ ВПО «Астраханский государственный технический университет», профессор Сопрунова Ольга Борисовна |
| Ведущая организация: | Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Саратовский государственный технический университет» |
Защита состоится « 28 » декабря 2012 г. в «11.00» часов на заседании диссертационного совета Д.307.001.05 при Астраханском государственном техническом университете, по адресу: 414025, Астрахань, ул. Татищева,16, главный учебный корпус, ауд. 313.
С диссертацией можно ознакомиться в библиотеке Астраханского государственного технического университета по адресу: 414025, Астрахань, ул. Татищева, 16.
Отзывы на автореферат диссертации просим направлять по адресу: 414025, г. Астрахань, ул. Татищева 16, ФГБОУ ВПО «АГТУ», диссертационный совет Д.307.001.05, тел./факс (8512) 54-91-03, e-mail: [email protected]
Автореферат разослан « 28 » ноября 2012 г.
Ученый секретарь

диссертационного совета,
кандидат биологических наук Мелякина Эльвира Ивановна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность исследования. Водные экосистемы в настоящее время подвергаются значительному антропогенному загрязнению, что отражается как на их продуктивности, так и на качестве воды (Arnold, 2006). Из загрязняющих веществ особую опасность представляют тяжелые металлы (ТМ), которые при избытке оказывают существенное негативное воздействие на водную биоту и способны накапливаться в компонентах экосистем, в конечном итоге ухудшая качество воды и водной продукции, используемых человеком. В этой связи проблема снижения содержания ТМ в водоемах в настоящее время сохраняет свою актуальность.
Среди тяжелых металлов 4 иона Cr6+, Fe3+, Cu2+ и Cd2+ имеют наиболее широкое распространение в сточных водах многих предприятий (горнодобывающих, металлургических, текстильных, гальванических, машиностроения, топливно-энергетического комплекса, сельскохозяйственного производства), которые к тому же характеризуются широким диапазоном рН среды – от 3 до 12 (Овцов и др., 1989; Кривошеин и др., 2003; Колесников, Меньшутина, 2005; Каплин, 2006; Титов и др., 2007).
Эффективность очистки воды от данных ионов с концентрацией ниже 5 мг/л традиционными методами низкая и составляет только 10-75% (Колесников, Меньшутина, 2005; Oliveira et al., 2007; Johnson et al., 2008). В некоторых случаях отдельные методы очистки, такие как коагуляция и флокуляция могут дать более высокие результаты, но использование при этом дорогих химических реагентов неоправданно увеличивает затраты. Поэтому назрела необходимость в новых экологически и экономически более эффективных методах очистки сточных вод от ионов тяжелых металлов.
Одним из перспективных способов очистки сточных вод является фиторемедиация. Известно (Vymazal, 2005; Nelson et al., 2006; Wallace, Knight, 2006), что в Америке и Европе широкое применение получили искусственные и естественные ветланды для очистки сточных вод от тяжелых металлов многих промышленных и сельскохозяйственных предприятий, где используются, в основном, такие водные макрофиты, как Phragmites australis, Typha latifolia, Scirpus lacustris, Eichhornia crassipes, Potamogeton natans. По этим видам имеются многочисленные исследования их очистительной способности, проведенные как в лабораторных условиях, так и в промышленных масштабах. Напротив, Ceratophyllum demersum, Najas guadalupensis, Elodea сanadensis, Lemna minor и Salvinia natans, распространенные повсеместно, обладающие высокой продуктивностью и играющие важную роль в самоочищении воды (Лукина, Смирнова, 1988; Эйнор, 1992; Морозова, 2001; Kadlec, Wallace, 2008), еще недостаточно изучены с точки зрения их способности к очищению воды от тяжелых металлов. Поэтому требуется проведение новых экспериментов с данными видами макрофитов с целью поиска путей их практического применения для очистки сточных вод от тяжелых металлов.
Другое современное направление в очистке воды от тяжелых металлов - использование фитомассы водных макрофитов в качестве сорбентов для извлечения тяжелых металлов из воды. Особый интерес это направление представляет для развивающихся стран, в том числе и Вьетнама, из-за низких капиталовложений, обильного источника сырья и технологической простоты. Применение сорбентов в сочетании с очистными ветландами позволяет наладить непрерывный процесс очистки, исключая его зависимость от сезонов года. Следовательно, данное направление является перспективным не только с научной точки зрения, но и с экономической.
Цель исследования: Экспериментально определить возможность использования водных макрофитов (Ceratophyllum demersum, Najas guadalupensis, Elodea сanadensis, Lemna minor, Salvinia natans) в очищении воды от тяжелых металлов (Cr6+, Fe3+, Cu2+ и Cd2+).
Задачи исследования:
1. Выявить реакцию Ceratophyllum demersum, Najas guadalupensis, Elodea сanadensis на воздействие ионов Cr6+, Fe3+, Cu2+ и Cd2+ с концентрацией 0,1; 1,5; 2 и 0,5 мг/л, соответственно, при различных значениях pH воды.
2. Определить способность Ceratophyllum demersum, Najas guadalupensis, Elodea сanadensis снижать концентрации ионов Cr6+, Fe3+, Cu2+ и Cd2+.
3. Экспериментально определить продолжительность экспозиции Ceratophyllum demersum, Najas guadalupensis, Elodea сanadensis и значение pH воды, оптимальные для очистки воды от ионов Cr6+, Fe3+, Cu2+ и Cd2+.
4. Определить возможность и эффективность использования порошка из фитомассы Ceratophyllum demersum, Najas guadalupensis, Elodea сanadensis, Lemna minor, Salvinia natans в качестве сорбентов ионов Cr6+, Fe3+, Cu2+ и Cd2+.
Научная новизна работы.
Экспериментально доказана возможность использования Ceratophyllum demersum, Najas guadalupensis, Elodea сanadensis, Lemna minor, Salvinia natans) в качестве активных агентов фиторемедиации
Определена продолжительность экспозиции Ceratophyllum demersum, Najas guadalupensis, Elodea сanadensis, при которой обеспечивается максимальная очистка воды от ионов Cr6+, Fe3+, Cu2+ и Cd2+.
Получены новые сведения об использовании в качестве сорбентов ионов Cr6+, Fe3+, Cu2+ и Cd2+ порошка из фитомассы Ceratophyllum demersum, Najas guadalupensis, Elodea сanadensis, Lemna minor, Salvinia natans
Установлены значение pH воды и количество сорбента из растений (Ceratophyllum demersum, Najas guadalupensis, Elodea сanadensis, Lemna minor, Salvinia natans), необходимые для эффективной очистки воды от ионов Cr6+, Fe3+, Cu2+ и Cd2+.
Установлены математические уравнения, описывающие зависимость остаточной концентрации ионов Cr6+, Fe3+, Cu2+ и Cd2+ в конце очистки от значений pH и количества сорбента из растений.
Теоретическая и практическая значимость работы.
Результаты диссертационной работы позволяют рекомендовать наиболее подходящий вид макрофитов для использования в очистных ветландах и эффективный сорбент из них для извлечения ионов Cr6+, Fe3+, Cu2+ и Cd2+ из воды.
На основе полученных результатов предложены оптимальные параметры (продолжительность экспозиции, значение pH, количество сорбента из растений) для достижения максимальной эффективности использования изучаемых макрофитов в очищении воды от ионов Cr6+, Fe3+, Cu2+ и Cd2+.
Построенные математические уравнения можно использовать для расчета остаточной концентрации ионов тяжелых металлов в растворах после очистки при заданных значении pH и количестве сорбента из растений.
Таким образом, полученные результаты могут быть использованы при разработке очистных ветландов и производстве сорбентов из фитомассы Ceratophyllum demersum, Najas guadalupensis, Elodea сanadensis, Lemna minor, Salvinia natans для очищения воды от тяжелых металлов.
Методология и методы исследования.
Методологической базой диссертации являются исследования ученых, такие как Н.В. Морозов (2001), А.Г. Дмитриева (2002), А.С. Гринин (2003), О.А. Розенцвет (2006), А.Ф. Титов (2007), Л.Г. Бондарева (2008), О.П. Калякина (2008), Т.А. Зотина (2009), С. А. Остроумов (2009), B. Voleksy (1990), I.A.H. Schneider (1995), T.C. Wang (1996), M.N.V. Prasad (2004), R.H. Kadlec (2008), R.L. Knight (2008), J. Wang (2009) и др.
Концентрация ионов Cr6+, Fe3+, Cu2+ в растворах определялась на фотометре Эксперт-003 (Россия) по принятым стандартным методам: для Cr6+ по РД 52.24.446-2008; для Fe3+ - ПНД Ф 14.; 2.2-95 и для Cu2+ - ПНД Ф 14.; 2.48-96. Концентрация ионов Cd2+ измерялась лабораторным иономером И-160 МИ (Россия) (Мидгли, Торренс, 1980).
В диссертационной работе использованы методы обработки статистических данных, наименьших квадратов, регрессионного анализа и математического моделирования с помощью статистических методов. Результаты экспериментов обработаны с помощью программы STATISTICA 8 и Microsoft Excel 2010.
Положения, выносимые на защиту.
Максимальное снижение концентрации ионов Cr6+, Fe3+, Cu2+ и Cd2+ в воде в присутствии Ceratophyllum demersum, Najas guadalupensis, Elodea сanadensis достигалось в определенных продолжительности экспозиции и значении pH.
Интервал значения pH, оптимальный для очистки воды от ионов Cr6+, Fe3+, Cu2+, Cd2+ сорбентами из изучаемых макрофитов различный для каждого иона.
Зависимость остаточной концентрации ионов тяжелых металлов в воде после очистки от значения pH и количества сорбента из растений описывается нелинейными уравнениями с высокой адекватностью.
Декларация личного участия автора. Автор самостоятельно разработал и проводил все эксперименты, и сделал обработку и анализ полученных данных. Диссертационная работа написана автором самостоятельно под руководством к.б.н., доц. Мельник И.В.
Степень достоверности результатов определяется применением современного сертифицированного аналитического оборудования, соблюдением требований действующих стандартов, а также общепринятыми статистическими методами обработки данных.
Апробация работы. Основные положения диссертационной работы представлены на следующих конференциях: International scientific conference on environment and biodiversity (Beograd, Serbia, 2010); Ежегодной Всероссийской научной конференции учащихся, студентов и молодых ученых «Научное творчество XXI века» (Красноярск, 2010); III-й Международной научно-практической конференции молодых ученых “Молодёжь и наука XXI века” (Ульяновск, 2010); Международной отраслевой научной конференции профессорско-преподавательского состава Астраханского государственного технического университета, посвященная 80-летию основания Астраханского государственного технического университета (Астрахань, 2010); Международной научно-практической конференции “Фундаментальные и прикладные исследования университетов, интеграция в региональный инновационный комплекс” с участием в рамках программы “Участник молодёжного научно-инновационного конкурса”, “У.М.Н.И.К.” (Астрахань, 2010); Всероссийской научной конференции, посвященной 15-летию биологического факультета Сургутского государственного университета (Сургут, 2011); V-й Международной научной конференции молодых ученых и талантливых студентов (Москва, 2011); Международном молодежном научном форуме «ЛОМОНОСОВ-2012» (Москва, 2012).
Публикации. По теме диссертации опубликовано 14 работ, в том числе 4 в изданиях, рекомендуемых ВАК.
Структура и объем диссертации. Диссертационная работа состоит из введения, обзора литературы, описания материала и методов исследования, результатов собственных исследований и их обсуждения, заключения, выводов, практических рекомендаций, списка использованной литературы, включающего 178 источников, из них 89 зарубежных.
Материал изложен на 160 страницах, содержит 11 таблиц, 29 рисунков, 21 приложения.
Глава 1. Обзор литературы
В главе приведен обзор литературы о роли водных макрофитов в фиторемедиации сточных вод. Описано их практическое применение в очистных ветландах. Изложены сведения о аккумулирующей способности различных видов водных макрофитов по отношению к ионам ТМ. Проанализированы результаты современных исследований, посвященных изучению водных макрофитов, как биосорбентов для удаления ТМ из воды.
Глава 2. Материалы и методы исследования
Работа выполнялась на кафедре гидробиологии и общей экологии Астраханского государственного технического университета в 2009 – 2012 годах. Объектами исследований служили следующие виды водных макрофитов: роголистник погруженный (Ceratophyllum demersum L.), наяда гваделупская (Najas guadalupensis (Spreng.) Magnus), элодея канадская (Elodea canadensis Michx.), ряска малая (Lemna minor L.), сальвиния плавающая (Salvinia natans (L.) All.). Три первые виды макрофитов выращивались в лабораторных условиях при искусственном освещении при 12-часовом световом дне, для чего применялись люминесцентные лампы (3500 Лк) (Coutris et al., 2011). Температура воды поддерживалась в пределах +19…26°С. Для выращивания растений использовалась водопроводная отстоянная в течение 2-3 дней вода. Растения росли, развивались и морфологически практически не отличались от подобных, произрастающих в естественной среде. Lemna minor и Salvinia natans отбирались в местах, где гидрохимические показатели были в пределах ПДК.
Эксперименты моделировали условия, которые могут создаваться при поступлении сточных вод от различных источников в очистные ветланды. При этом выбранный диапазон рН составлял от 3,5 (сточные воды угольных месторождений, крахмало-паточного производства и предприятий металлургического комплекса) до 12 (сточные воды текстильных предприятий) (Овцов и др., 1989; Колесников, Меньшутина, 2005).
В экспериментах с сырой биомассой:
Макрофиты тщательно промывались дистиллированной водой и взвешивались. Масса Ceratophyllum demersum в опытах составляла 3,96 ± 0,13 г; Najas guadalupensis - 3,94 ± 0,12 г и Elodea сanadensis - 3,98 ± 0,07 г в соответствии с работами других исследователей (Keskinkan et al., 2004; Бондарева, Калякина, 2008; Соломонова, 2009).
Растворы ТМ необходимой концентрации приготавливались из государственных стандартных образцов (ГСО) ТМ. Для подготовки растворов ионов ТМ со значением pH = 3,6 и pH = 6 использовался ацетатный буферный раствор (CH3COOH+CH3COONa); а со значением pH =12 - добавлением щелочного раствора гидроксида натрия (NaOH) (Лурье, 1971; Справочник биохимика, 1991). Использование различных значений pH (3,6; 6; 12) в экспериментах связано с разнообразностью среды сточных вод от сильно кислой до щелочной (Овцов и др., 1989; Колесников, Меньшутина, 2005; Nelson et al., 2006).
Растворы ТМ с определенными концентрацией и значением pH заливались в стеклянные стаканы емкостью 500 мл, куда и помещали макрофит. В течение 13 - 15 суток через определенные промежутки времени проводился отбор и измерение концентрации ионов ТМ в растворах. В качестве контроля использовались растворы ионов ТМ без растений.
Начальная выбранная концентрация растворов составляла: Cr6+ - 0,1 мг/л, Fe3+ - 1,5 мг/л, Cu2+ - 2 мг/л и Cd2+ - 0,5 мг/л в соответствии с работами других исследователей (Wolverton, McDonald, 1975; Muramoto, Ohi, 1983; Yao, Ramelow, 1997; Aziz et al., 2005; Bounheng et al., 2006; Ibrahim et al., 2009).
Для оценки вредных действий ТМ на водные макрофиты в различных первоначальных значениях (ПНЗ) pH растворов использовались визуальные морфологические изменения.
В экспериментах с порошком из сухой биомассой:
Водные макрофиты промывалась дистиллированной водой и высушивалась в термошкафе при температуре 850С в течение 6 часов, измельчалась в порошок частицами диаметром не более 0,5 мм с помощью лабораторной мельницы ЛЗМ-1 (Россия). После чего осуществлялось взвешивание порошка растений по порциям 0,05; 0,1; 0,15 и 0,2 г. Для Najas guadalupensis такая порция составляла 0,025; 0,05; 0,1 и 0,15 г. Причина выбора сорбентов из разных видов водных макрофитов заключается в том, что их способность к очистке воды от ТМ имеет видовой характер, что подтверждено в других работах (Schneider et al., 1995; Schneider, Rubio, 1999; Bounheng et al., 2006; Hasan et al., 2010; Mahamadi, Nharingo, 2010; Shoaib et al., 2011).
Удельная поверхность сорбентов из биомассы водных макрофитов определялась методом Брунауэра-Эммета-Теллера (БЭТ) с помощью прибора ASAP 2010 (Matthias Thommes, 2010). Эти работы проведены на кафедре химии Лавальского университета (Канада).
Для приготовления растворов Cr6+, Fe3+, Cu2+ и Cd2+ определенных концентраций (0,1 мг/л; 1,5 мг/л; 2 мг/л и 0,5 мг/л, соответственно) применялись ГСО ионов ТМ, а для растворов с определенными значениями pH - буферные растворы (Справочник биохимика, 1991). Значения pH растворов составляли 3,5; 4,5; 5,5; 7; 9. Интервал pH 3-9 обычно используется при внедрении сорбентов для очистки сточных вод от ТМ (Volesky, 1990).
В мерный стакан заливалось 50 мл раствора ТМ определенной концентрации и определенным значением pH, куда помещалось заданное количество сорбента (КС) из растений, после чего раствор перемешивался на мешалке в течение 30 минут для получения эквивалентной адсорбции (Schneider, Rubio, 1999). В качестве контроля использовались растворы ионов ТМ без растений. После перемешивания проводился отбор проб и измерение концентраций ионов ТМ.
Определение концентрации ионов ТМ в растворах:
Концентрация ионов Cr6+, Fe3+, Cu2+ в растворах определялась с помощью фотометра Эксперт-003 (Россия) по принятым стандартным методам, а концентрация ионов Cd2+ - лабораторным иономером И-160 МИ (Россия) (Мидгли Д., Торренс К., 1980). Каждое определение концентрации ионов ТМ осуществлялось в трех повторностях.
Результаты экспериментов обработаны с помощью программы STATISTICA 8 и Microsoft Excel 2010. Данные экспериментов представлены как средние или средневзвешенные значения. Достоверность различий средних величин оценивали по t-критерию Стьюдента. Критический уровень значимости при проверке статистической гипотезы принимался при р < 0,05. Для проверки значимости коэффициентов корреляции использовалась t-статистика, а для проверки значимости математического уравнения - F-статистика (Jorgensen, Bendoricchio, 2001; Гринин и др., 2003; Симчера, 2008).
Глава 3. Использование водных макрофитов в очищении воды от ТМ
3.1. Реакция водных макрофитов на изменение значений pH
и концентрацию ТМ в растворе
Для изучаемых макрофитов отмечены следующие основные морфологические негативные изменения на действие ионов ТМ: обесцвечивание листьев и стеблей; полная потеря зеленой окраски листьев; потеря тургора у листьев и стеблей; отделение листьев от стеблей; распад листьев и стеблей растения.
Сравнительный анализ ответной реакции водных макрофитов на действие ТМ показал, что ионы Cr6+, Fe3+, Cu2+ оказывают наиболее выраженное негативное воздействие на Ceratophyllum demersum, а ионы Cd2+ - на Elodea сanadensis. Значение pH 12 приводит к повышению токсичных воздействий ионов Cr6+, Fe3+, Cu2+ и Cd2+ на Ceratophyllum demersum, Najas guadalupensis, Elodea сanadensis. В слабокислой (pH 6) и кислой (3,6) средах, в основном, не наблюдалось отделения, распада листьев и стеблей, что отмечалось при pH 12.
При наблюдении морфологических изменений водных макрофитов под действием ТМ в различных значениях pH, следует отметить, что наиболее часто регистрируемыми негативными имениями являются обесцвечивание и потеря тургора листьев и стеблей растения. Это происходило из-за редукции и разрушения хлорофилла, что находит подтверждение в других работах (Horwith et al., 1996; Mysliwa-Kurdziel, Strzalka, 2004; Vassilev et al., 2004). Остальные указанные в нашей работе морфологические изменения осуществлялись по причине нарушения структуры и ультраструктуры клеток растений. Таким образом, вредное последствие, которое отмечено у растений зависит от вида водных макрофитов, иона ТМ и значения pH раствора.
3.2. Способность водных макрофитов в очищении воды от ТМ
3.2.1. Роголистник погруженный (Ceratophyllum demersum)
Концентрация Cr6+ в растворах с роголистником погруженным имела различный характер изменений в течение 15 суток (рисунок 1).
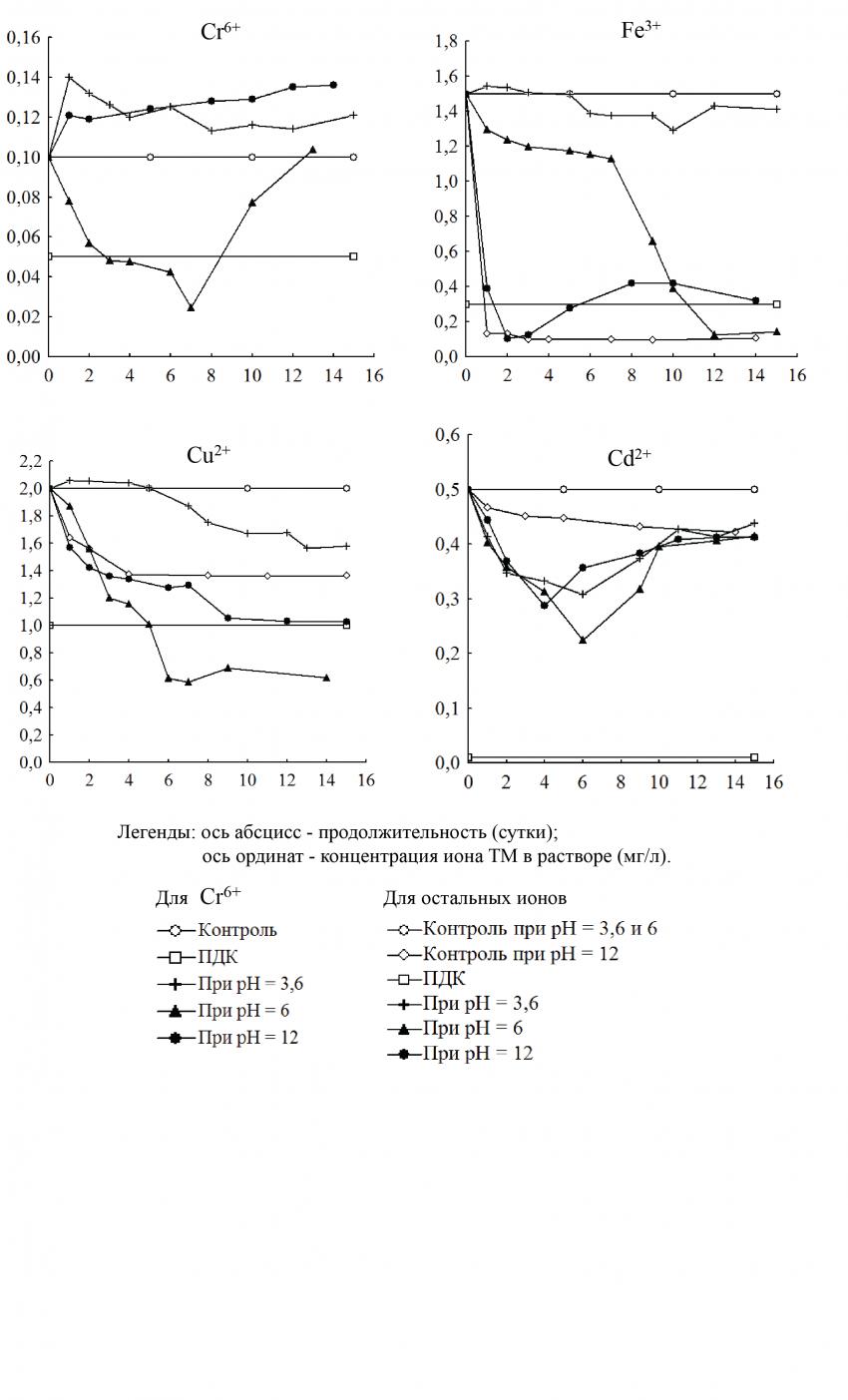
Рис. 1. Изменение концентрации ионов ТМ в контрольных и опытных растворах с Ceratophyllum demersum при различных ПНЗ pH
Повышение концентрации ионов Cr6+ в растворах наблюдалось при pH = 3,6 и 12 с первых и 8-х суток, соответственно, после добавления растений (по t-критерию). При pH = 6 концентрация Cr6+ в растворе сначала постепенно снижалась до своего минимального значения (0,025 мг/л) на 7-е сутки, после чего начала возрастать до исходной величины в конце эксперимента. В контроле (без растений) концентрация Cr6+ оставалась на уровне первоначального значения во всех вариантах pH (3,6; 6 и 12).
Увеличение концентрации Cr6+ в опыте, возможно, происходило из-за экстракции ионов ТМ из растений в растворы, что объясняется повреждением клеточных мембран, пассивной утечкой солей из вакуолей или нарушением структур клеточных компонентов (Дмитриева и др., 2002). Такие нарушения можно наблюдать невооруженным глазом - это потеря тургора, отделение и распад листьев и стеблей растения. Однако, возможно, существует нарушение внутренних клеточных структур, которое невозможно наблюдать обычным глазом. Так, в работах других исследователей (Molas, 1997; Кузнецов, Дмитриева, 2006) показано, что ТМ могут воздействовать на ультраструктуру клетки и нарушать ее. Увеличение концентрации ионов ТМ в растворах в присутствии макрофитов также наблюдалось в работе Г.В. Лобковой (2012), в которой концентрация ТМ в растворе увеличилась с первых суток после добавления Lemna minor и Elodea сanadensis (Лобкова, 2012).
Заметное снижение концентрации Fe3+ в опытах с роголистником погруженным наблюдалось при ПНЗ pH = 6 и 12. Следует отметить, что при pH = 12 осуществлялось скачкообразное уменьшение концентрации Fe3+ до минимального значения (0,1 мг/л) уже на 2-е сутки, при ПДК Fe3+ равном 0,3 мг/л. С 3-его дня концентрация Fe3+ снова начала увеличиваться, достигнув уровня выше ПДК примерно после 6-ого дня эксперимента.
При pH = 6 концентрация Fe3+ постепенно уменьшалась и только на 8-ые сутки наблюдалось ее резкое снижение до минимального значения (0,123 мг/л) на 12-е сутки. При pH = 3,6 с 5-го дня и до конца эксперимента концентрация Fe3+ находилась на уровне 1,3 - 1,4 мг/л.
В контрольных растворах при ПНЗ pH = 3,6 и 6 концентрация Fe3+ была практически постоянной в течение всего опыта. Однако в варианте с pH = 12 концентрация Fe3+ резко снизилась уже в самом начале эксперимента в связи с выпадением в осадок нерастворимого гидроксида Fe(OH)3.
Концентрация Сu2+ в опытных растворах с pH = 6 и 12 постепенно уменьшалась до конца эксперимента. Однако в варианте с pH = 6 это уменьшение носило более интенсивный характер, чем в случае с pH = 12. После 6-ти суток в растворе с pH = 6 концентрация Cu2+ достигла 0,6 мг/л (ниже ПДК) и оставалась постоянной до конца эксперимента. Подобная картина повторилась и при pH = 12. Особый случай наблюдался в варианте с pH = 3,6, в котором концентрация Cu2+ немного увеличилась после добавления растений, затем стала уменьшаться до значения 1,578 мг/л к концу эксперимента. При этом сначала происходила экстракция ионов ТМ из растений в растворы, затем вступили в действие процессы сорбции.
Для контрольных растворов концентрация Cu2+ изменилась также, как и в эксперименте с ионами Fe3+. При pH = 3,6 и 6 концентрация данного элемента была постоянной в течение всего опыта, а при pH = 12 она снизилась до постоянного значения (примерно 1,360 мг/л) на 4-ые сутки, что находит объяснение в образовании синего нерастворимого хлопьевидного осадка гидроксида Cu(OH)2. Однако необходимо отметить, что концентрация Cu2+ опытного раствора ниже контрольного примерно на 0,35 мг/л в последние сутки эксперимента. Это свидетельствует о том, что после образования нерастворимого осадка Cu(OH)2 свободные ионы Cu2+ еще адсорбировались растением.
Изменения концентраций ионов Cd2+ в опытных растворах при различных ПНЗ pH носят схожий характер (рисунок 1). Во всех вариантах исследуемый показатель сначала в течение некоторого времени уменьшался, затем начинал увеличиваться. При этом своих минимальных значений (от 0,356 до 0,224 мг/л) он достиг: при ПНЗ pH = 3,6 на 4-е сутки; на 6-е сутки при ПНЗ pH = 6 и 12.
Концентрация Cd2+ в контрольных растворах при ПНЗ pH = 3,6 и 6 не изменилась в течение всего эксперимента и оставалась на первоначальном уровне (0,5 мг/л). В отличие от этого при ПНЗ pH = 12 наблюдалось снижение ее в контроле до значения 0,422 мг/л к концу эксперимента вследствие образования нерастворимого осадка Cd(OH)2.
3.2.2. Наяда гваделупская (Najas guadalupensis)
Динамика концентраций ионов Cr6+ при pH = 12 очень схожа с результатами исследований, полученными нами с роголистником погруженным (рисунок 2).
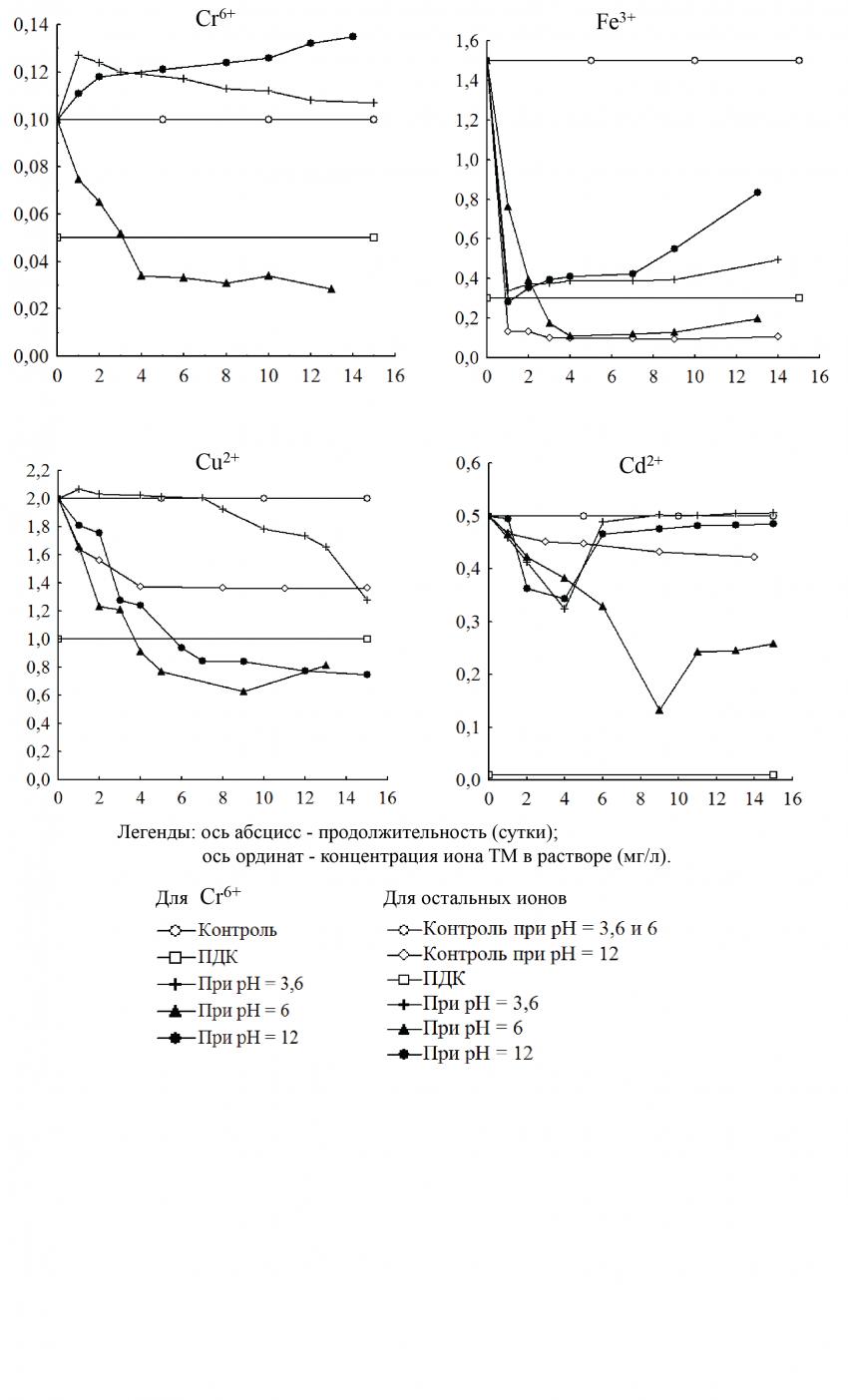
Рис. 2. Изменение концентрации ионов ТМ в контрольных и опытных растворах с Najas guadalupensis при различных ПНЗ pH
В опытном варианте при pH = 3,6 концентрация Cr6+ возрастала до максимального значения 0,127 мг/л, что в 1,27 раза выше первоначального. После чего наметилась тенденция ее прямолинейного снижения до минимальной величины в 0,107 мг/л к концу эксперимента. В варианте с pH = 6 у наяды гваделупской наблюдалась высокая очистительная способность. Так, концентрация Cr6+ в данном растворе непрерывно снижалась в течение 4-х суток до величины примерно 0,03 мг/л, сохраняясь на данном уровне до конца эксперимента. Это величина значительно ниже ПДК Cr6+ (0,05 мг/л).
Результаты исследований свидетельствуют о том, что во всех опытных растворах концентрация Fe3+ резко уменьшалась после добавления Najas guadalupensis. При pH = 3,6 и 12 на 2-ые сутки данный показатель снизился почти в 5 раз по сравнению с первоначальным значением, после чего последовало увеличение концентрации до величины, превышающей ПДК Fe3+. В варианте при pH = 6 в течение первых 4-х суток концентрация Fe3+ стабилизировалась на уровне приблизительно 0,1 мг/л. Это значение в 15 раза ниже первоначального и в 3 раза меньше ПДК Fe3+.
В экспериментах с Cu2+ отмечено заметное снижение концентрации этого иона с течением времени в опытных растворах при pH =6 и 12, однако в первом случае интенсивность изменения выше, чем во втором. По истечению 5-ти суток при pH = 6, 7 и при pH = 12 данный показатель достиг величин приблизительно 0,7 мг/л и 0,8 мг/л, соответственно, которые ниже ПДК Cu2+. В варианте опыта при ПНЗ pH = 3,6 концентрация Cu2+ увеличилась после добавления макрофита, затем стала постепенно уменьшаться, что продолжалось до конца эксперимента. Однако полученное значение концентрации данного элемента превышало ПДК.
При pH = 3,6 и 12 в опытных растворах изменения концентрации ионов Cd2+ носили схожий характер. Концентрация Cd2+ сначала снижалась и достигла минимального значения на 4-е сутки, после чего стала увеличиваться. В обоих случаях различие между концентрациями Cd2+, начиная с 6-х суток и до конца эксперимента, не имело статистической значимости (по t-критерию). Поэтому данная концентрация Cd2+ может считаться постоянной. При ПНЗ pH = 6 концентрация Cd2+ опытного раствора уменьшилась до значения 0,132 мг/л, что в 3,8 раза ниже исходной величины (0,5 мг/л). Однако после достижения своего минимального уровня она обратно увеличилась к последним суткам эксперимента до значения 0,24 мг/л.
3.2.3. Элодея канадская (Elodea сanadensis)
В опытном варианте с ПНЗ pH = 12 отмечался особый случай, при котором концентрация Cr6+ в растворе постоянно возрастала до конца эксперимента. В варианте с ПНЗ pH = 6 отмечалось снижение концентрации Cr6+ в растворе примерно до 0,055 мг/л, что выше ПДК Cr6+ (рисунок 3).
Самая высокая очистительная способность по отношению к ионам Cr6+ у Elodea canadensis отмечалась в варианте с ПНЗ pH = 3,6, когда концентрация Cr6+ раствора уменьшилась до минимального значения (0,0196 мг/л) на 8-е сутки, после чего она снова возросла. При этом тенденция изменения концентрации Cr6+ носит параболический характер.
Характер изменений концентрации ионов Fe3+ у Elodea canadensis с ПНЗ pH = 12 схож с таковым у Najas guadalupensis при ПНЗ pH = 6. В опытном варианте с ПНЗ pH = 6 концентрация Fe3+ после достижения минимального значения (0,815 мг/л) на 8-е сутки начала расти до значения, превышающего первоначальное.
В экспериментах с Cu2+ во всех опытных растворах наблюдалось заметное снижение концентрации Cu2+, значение которой к концу эксперимента было ниже ПДК Cu2+. До 7-ых суток исследований наиболее интенсивное снижение концентрации данного элемента осуществлялось в опытном варианте с ПНЗ pH = 12, а на 8-ые - с ПНЗ pH = 6. Самая низкая концентрация Cu2+ (0,545 мг/л) наблюдалась в опытном растворе с ПНЗ pH = 6, что в 3,7 раза ниже первоначального значения. Следует отметить, что снижение данного показателя опытного раствора с ПНЗ pH = 12 выражено более интенсивно, чем в контрольном варианте с ПНЗ pH = 12.
Высокая способность Elodea canadensis к очистке воды от Cd2+ наблюдалась при ПНЗ pH = 3,6. После добавления растения в раствор концентрация Cd2+ опытного раствора стала интенсивно снижаться и через 4- суток она достигла постоянной величины в 0,1 мг/л, в 5 раза ниже первоначальной. В варианте при ПНЗ pH = 6 концентрация Cd2+ опытного раствора постепенно уменьшалась со временем, достигая минимального значения в 0,298 мг/л на 6-е сутки, после чего тенденция изменения кардинально меняет свое направление на возрастание.
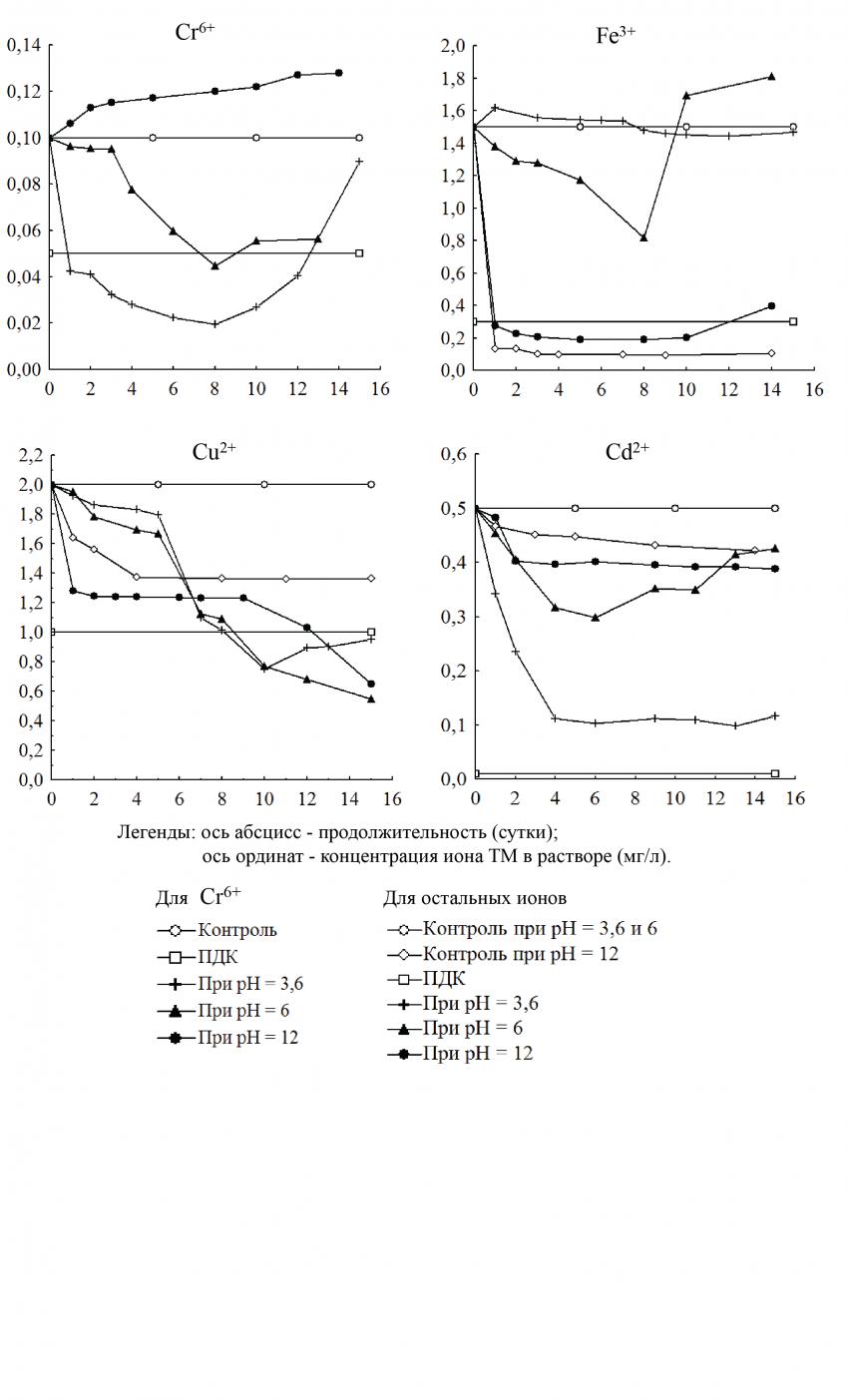
Рис. 3. Изменение концентрации ионов ТМ в контрольных и опытных растворах с Elodea
сanadensis при различных ПНЗ pH
3.2.4. Видовая специфика водных макрофитов в очистке воды от ТМ
Способность Ceratophyllum demersum, Najas guadalupensis, Elodea canadensis к очищению воды от ионов Cr6+, Fe3+, Cu2+ и Cd2+ оценивалась по максимальной эффективности их очистки при определенных ПНЗ pH и продолжительности экспозиции (таблица 1).
Для каждого вида изучаемых макрофитов определен порядок снижения эффективности очистки воды от ТМ, который можно представить в следующем виде:
- Ceratophyllum demersum: Fe3+ > Cr6+ > Cu2+ > Cd2+
- Najas guadalupensis: Fe3+ > Cd2+ Cr6+ > Cu2+
- Elodea сanadensis: Fe3+ > Cd2+ > Cu2+ > Cr6+
Таблица 1
Максимальная эффективность очистки воды от тяжелых
металлов изучаемыми макрофитами
| Виды изучаемых макрофитов | Ионы ТМ | Максимальная эффективность очистки (%) | ПНЗ pH | Продолжительность (сутки) |
| Ceratophyllum demersum | Cr6+ | 75 | 6 | 7 |
| Fe3+ | 93,1 (91,8) | 12 (6) | 2 (12) | |
| Cu2+ | 70,75 | 6 | 7 | |
| Cd2+ | 55,2 | 6 | 6 | |
| Najas guadalupensis | Cr6+ | 72 | 6 | 13 |
| Fe3+ | 92,7 | 6 | 4 | |
| Cu2+ | 68,6 | 6 | 9 | |
| Cd2+ | 73,6 | 6 | 9 | |
| Elodea canadensis | Cr6+ | 55 | 3,6 | 8 |
| Fe3+ | 87,3 | 12 | 5 (8) | |
| Cu2+ | 72,75 | 6 | 15 | |
| Cd2+ | Около 80 | 3,6 | 4 (13) |
Таким образом, все взятые в эксперименты виды макрофитов обладают наивысшей способностью к очистке воды от Fe3+, затем следуют Cd2+ и Cr6+.
Отдельно по эффективности очистки воды от каждого ТМ водные макрофиты выстраиваются в следующие ряды:
- для Cr6+: Ceratophyllum demersum > Najas guadalupensis > Elodea canadensis
- для Fe3+: Ceratophyllum demersum Najas guadalupensis > Elodea canadensis
- для Cu2+: Elodea canadensis > Ceratophyllum demersum > Najas guadalupensis
- для Cd2+: Elodea сanadensis > Najas guadalupensis > Ceratophyllum demersum
Таким образом, наивысшая эффективность очистки воды от Cr6+ и Fe3+ отмечена у Ceratophyllum demersum, а Cu2+ и Cd2+ - у Elodea сanadensis.
Результаты проведенных нами исследований свидетельствуют о высокой очистительной способности сырой биомассы Ceratophyllum demersum, Najas guadalupensis, Elodea сanadensis по отношению к ионам Fe3+, что находит подтверждение в работах других авторов (Кадукин и др., 1982; Борисова и др., 2005; Rai et al., 1995). Степень очистки воды от ионов Cr6+, Cu2+, Cd2+ зависит от видовой принадлежности макрофитов. Так например, наивысшей эффективностью очистки воды от ионов Cr6+ и Fe3+ обладает Ceratophyllum demersum, от Cu2+ и Cd2+ - Elodea сanadensis. Для каждого вида растения наибольшая эффективность очистки воды от ионов ТМ достигается через определенное время и ПНЗ pH.
Глава 4. Использование сорбентов из водных макрофитов
для очистки воды от ионов ТМ
4.1. Некоторые характеристики сорбентов из водных макрофитов
Макрофиты до и после сушки взвешены и рассчитано отношение между их сырой и сухой биомассами, которое для исследуемых видов имеет следующий убывающий ряд: Lemna minor (26,75 ± 1,64) = Najas guadalupensis (25,57 ± 3,41) > Salvinia natans (18,67 ± 1,39) > Elodea Canadensis (13,90 ± 0,78) = Ceratophyllum demersum (13,55 ± 1,17).
Удельная поверхность сорбентов из макрофитов (м2/г) представлена следующим рядом: Salvinia natans (163,60 ± 0,80) = Ceratophyllum demersum (162,00 ± 4,96) > Elodea сanadensis (133,70 ± 0,59) > Najas guadalupensis (109,60 ± 0,75) > Lemna minor (95,30 ± 0,58).
Анализ рядов свидетельствует о том, что между отношением сырой, сухой биомассы и удельной поверхностью сорбентов из растений существует обратная связь: для макрофитов с низким отношением сырой, сухой биомассы характерна высокая удельная поверхность.
4.2. Сорбент из роголистника погруженного (Ceratophyllum demersum)
На основе данных экспериментов с Ceratophyllum demersum с помощью программы STATISTICA 8 при использовании t-статистика и F-статистика определены следующие математические уравнения зависимости концентрации ионов ТМ растворов от значения pH и количества сорбента (КС) из Ceratophyllum demersum:
- для иона Cr6+: R2 = 0,94
z = -1,3798+1,09826x -0,79063y+0,060107xy-0,29342x2+0, 033505x3-0,00138x4
- для иона Fe3+: R2 = 0,97
z = 16,7-11,8x-28,2y+3,28x2+341,7y2-0,38x3+0,02x4
- для иона Cu2+: R2 = 0,942
z = -33,825+26,5689x-1,4647xy-7,0381x2+119,127y2+0,79159x3-354,3y3-0,03204x4-0,03204y4+0,073352x4y4
- для иона Cd2+: R2 = 0,79
z = 15,2303-10,758x-0,23383xy+2,82921x2-0,31802x3+0,012919x4
При этом: z - концентрация ионов ТМ растворов (мг/л); x - значение pH растворов; y – количество сорбента из растений (г); R2 - коэффициент детерминации.
Графическое изображение таких уравнений представлено на рисунке 4.
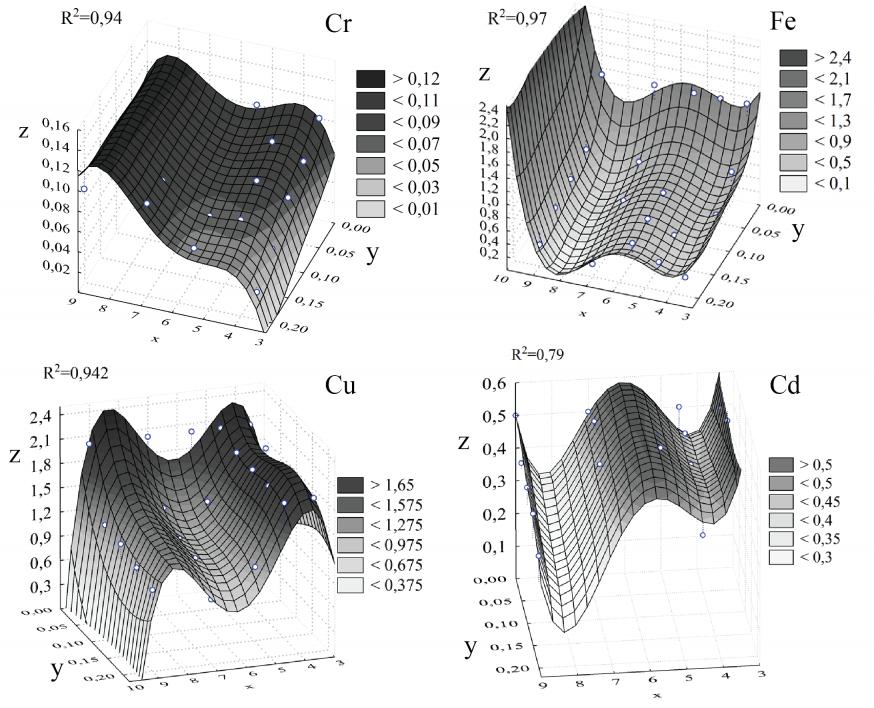
Рис. 4. Графическое изображение математических уравнений, описывающих изменение концентрации ионов ТМ растворов в зависимости от значения pH и КС из Ceratophyllum demersum. Где: z - концентрация ионов тяжелого металла растворов (мг/л); x - значение pH растворов; y - количество сорбента из растений (г); R2 - коэффициент детерминации.
Самое интенсивное снижение концентрации Cr6+ в опытных растворах наблюдалось при pH = 3,5, при этом с увеличением КС концентрация Cr6+ уменьшалась и достигла значения 0,027 мг/л, которое примерно в 3,7 раза ниже первоначальной величины (0,1 мг/л). В вариантах с pH = 7 и 9 изменений концентрации данного металла не отмечалось (по t-критерию). В эксперименте с ионами Fe3+ во всех вариантах прослеживалось заметное уменьшение их концентрации в растворах с увеличением КС. Однако характер изменений данного показателя был различным при опытных значениях pH, при этом минимальное его значение отмечалось при pH = 7 (0,196 мг/л). Динамика концентрации Cu2+ опытных растворов при различных значениях pH и КС также носила неоднозначный характер. С увеличением КС данный показатель уменьшался незначительно, и минимального значения (0,801 мг/л) он достиг при pH = 7 и КС = 0,2 г.
В отличие от всех вышеописанных случаев, в эксперименте с ионом Cd2+ у Ceratophyllum demersum появилась способность увеличивать концентрацию данного иона опытных растворов при pH = 3,5 и 5,5. В остальных вариантах с pH = 4,5; 7 и 9 наблюдалось уменьшение данного показателя с увеличением КС.
4.3. Сорбент из наяды гваделупской (Najas guadalupensis)
Определенные нами уравнения зависимости концентрации ионов ТМ растворов от значения pH и КС из Najas guadalupensis имеют следующий вид:
- для иона Cr6+: R2 = 0,92
z = 0,229059-1,3574y+0,051331xy+10,4002y2-35,579y3
- для иона Fe3+: R2 = 0,80
z = -16,766y-1,9858x2+464,712y2 +0,246172x3-4670,8y3-0,01089x4
- для иона Cu2+: R2 = 0,83
z = 10,0147-4,3281x+0,745586x2-0,0409x3
- для иона Cd2+: R2 = 0,82
z = 11,6131-7,8067x+1,98144x2-0,21609x3+0,008562x4
При этом: z - концентрация ионов ТМ растворов (мг/л); x - значение pH растворов; y – количество сорбента из растений (г); R2 - коэффициент детерминации.
Графическое изображение данных уравнений представлено на рисунке 5.
В экспериментах с ионами Cr6+ отмечено, что с увеличением КС концентрация Cr6+ опытных растворов снижалась и минимальное ее значение (0,034 мг/л) отмечалось при pH = 4,5 и КС = 0,15 г. Исключением являлись результаты опыта с pH = 9, где добавление порошка Najas guadalupensis не оказывало никакого влияния на изменение концентрации Cr6+ опытных растворов (по t-критерию).
В варианте с pH = 5,5 с увеличением КС произошло уменьшение концентрацию Cr6+ до одного уровня (0,05 мг/л). В опытах с pH = 7 при КС = 0,025 и 0,05 г отмечалась подобная картина. Увеличение массы до 0,15 г не способствовало увеличению адсорбции Cr6+, концентрация его оставалась на уровне как в варианте с КС = 0,05 г.
В опытах с Fe3+ наблюдалась неоднозначная картина, свидетельствующая о том, что КС в большинстве случаев не играет существенной роли в изменении концентрации данного иона в растворах. Адсорбционная способность в большей степени проявилась при pH = 4,5 и КС = 0,025 и 0,05 г, а при pH = 7 отмечалось увеличение концентрацию Fe3+ с 1,542 до 1,715 мг/л при увеличении КС с 0,025 до 0,15 г.
В эксперименте с ионами Cu2+ отмечалась явная тенденция уменьшения концентрации ионов Cu2+ опытных растворов и такое изменение было самым интенсивным при pH = 9. При КС = 0,05 г концентрация Cu2+ снизилась до 1,085 мг/л, после чего при КС = 0,1 и 0,15 сохранилась на прежнем уровне.
В опытах с ионами Cd2+ (кроме варианта с pH = 3,5) у сорбента из Najas guadalupensis появилась способность снижать концентрацию Cd2+ до определённого значения вне зависимости от значения pH. В случае с pH = 4,5 при КС = 0,15 г наблюдалось самое значительное снижение данного показателя до 0,203 мг/л. В целом, изменение концентрации ионов Cu2+ и Cd2+ не зависит от КС из Najas guadalupensis.
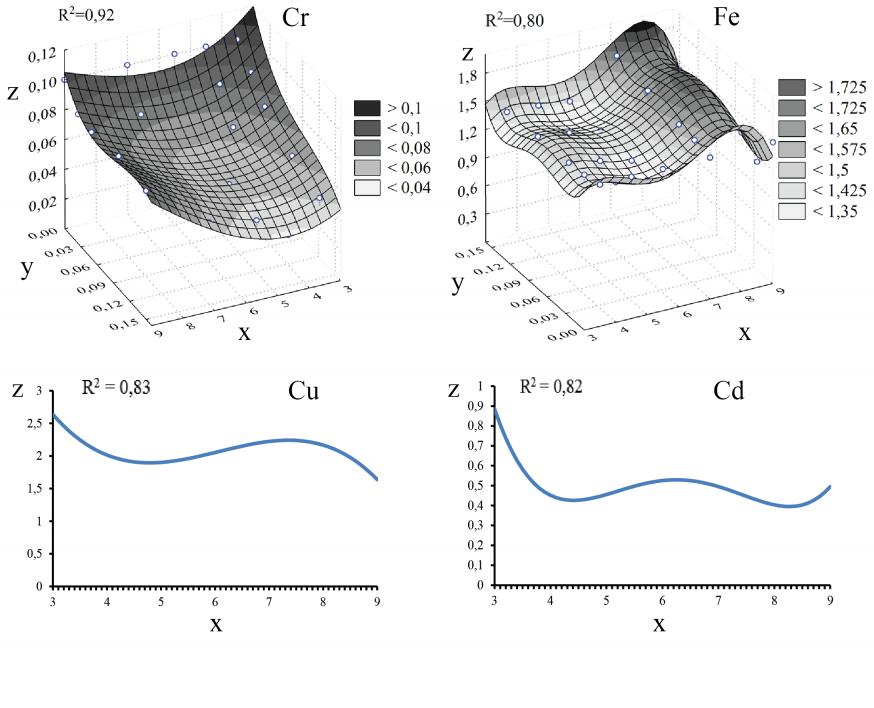
Рис. 5. Графическое изображение математических уравнений, описывающих изменение концентрации ионов ТМ растворов в зависимости от значения pH и КС из Najas guadalupensis. Где: z - концентрация ионов тяжелого металла растворов (мг/л); x - значение pH растворов; y - количество сорбента из растений (г); R2 - коэффициент детерминации.
4.4. Сорбент из элодеи канадской (Elodea canadensis)
Математические уравнения зависимости концентрации ионов ТМ растворов от значения pH и КС из Elodea canadensis имеют следующий вид:
- для иона Cr6+: R2 = 0,81
z = 0,05334x-0,49753y-0,00396x2
- для иона Fe3+: R2 = 0,70
z=11,4737-5,8695x-25,239y+1,07484x2-0,06119x3-0,52579x3y3
- для иона Cu2+: R2 = 0,98
z = 10,1883x-43,881y-2,6511x2+640,834y2-3810y3+7866,67y4
- для иона Cd2+: R2 = 0,85
z = 14,3894-10,634x-0,19832xy+2,92935x2-0,34351x3+0,014472x4
При этом: z - концентрация ионов ТМ растворов (мг/л); x - значение pH растворов; y – количество сорбента из растений (г); R2 - коэффициент детерминации.
Графическое изображение построенных уравнений показано в рисунке 6.
В исследованиях с ионами Cr6+ из всех вариантов pH растворов только при значении 3,5 у сорбента из Elodea canadensis появилась способность снижать концентрацию Cr6+ до минимального уровня при КС = 0,05 г. В экспериментах с ионами Fe3+ при увеличении КС концентрация данного металла опытных растворов при рН = 7 увеличилась, достигая максимального значения 2,532 мг/л. Причиной этого является десорбция ионов Fe3+ из сорбента в опытные растворы. Во всех остальных опытных вариантах концентрация данного иона только уменьшалась, но с различной интенсивностью.
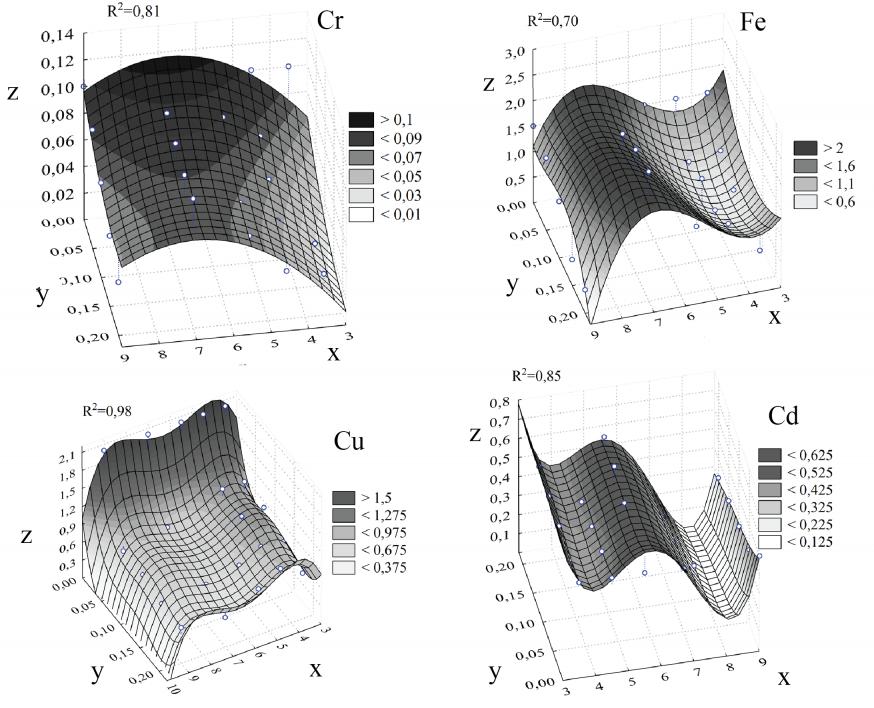
Рис. 6. Графическое изображение математических уравнений, описывающих изменение концентрации ионов ТМ растворов в зависимости от значения pH и КС из Elodea сanadensis. Где: z - концентрация ионов тяжелого металла растворов (мг/л); x - значение pH растворов; y - количество сорбента из растений (г); R2 - коэффициент детерминации.
По отношению к ионам Cu2+ у сорбента из Elodea canadensis при всех значениях pH (кроме pH = 4,5) отмечалась способность снижать концентрацию Cu2+ до значения ниже ПДК. С увеличением КС степень снижения концентрации Cu2+ изменялась в зависимости от значения pH. В эксперименте с ионами Cd2+ у данного макрофита обнаружились две способности: при рH = 5,5 - десорбция ионов Cd2+ из сорбента в растворы; при pH = 4,5- сорбция, т.е. статистически значимое уменьшение концентрации Cd2+.
4.5. Сорбент из ряски малой (Lemna minor)
Зависимость концентрации ионов ТМ растворов от значения pH и КС из Lemna minor определяется следующими уравнениями:
- для иона Cr6+: R2 = 0,87
z = 1,25514-0,85614x+0,024706xy+0,227479x2-0,0257x3+0,001044x4
- для иона Fe3+: R2 = 0,82
z = -28,478+22,7346x+1,31808xy-6,1829x2+0,715839x3-,02984x4
- для иона Cu2+: R2 = 0,89
z = -39,59+32,0516x-27,391y-8,7266x2+0, 999106x3-0,04088x4
- для иона Cd2+: R2 = 0,87
z = 1,05477-0,307x-0,16855xy+0,052161x2+14,7429y2-0,00275x3-41,6y3
При этом: z - концентрация ионов ТМ растворов (мг/л); x - значение pH растворов; y – количество сорбента из растений (г); R2 - коэффициент детерминации.
Графическое изображение построенных уравнений показано в рисунке 7.
В опытных вариантах с pH = 3,5 и 4,5 при добавлении сорбента из ряски малой отмечено одинаковое снижение концентрации Cr6+ растворов при каждом КС, а при pH = 5,5; 7 и 9 сорбционной способности по отношению к ионам Cr6+ не обнаружилось.
В экспериментах с ионами Fe3+ самая значительная степень ее уменьшения была зафиксирована в варианте с pH = 5,5, где с увеличением КС исследуемый показатель постепенно снизился до 0,563 мг/л при КС = 0,2 г. В опытах с pH = 7 и 9 отмечалась десорбция ионов Fe3+ из сорбента в растворы, что привело к увеличению концентрации данного металла в опытных растворах.
В исследованиях с ионами Cu2+ отмечена высокая способность сорбента из Lemna minor к удалению данного иона из раствора (91,1%). При всех опытных значениях pH прослеживалась общая тенденция уменьшения концентрации Cu2+ растворов с увеличением КС. В целом, Lemna minor снижает концентрацию Cu2+ до величины ниже ПДК Cu2+ при pH = 4,5; 5,5 и 7.
В экспериментах с ионами Cd2+ отмечено незначительное снижение его концентрации в опытных растворах при pH = 5,5; 7 и 9, а в вариантах с pH = 3,5 и 4,5 присутствие порошка Lemna minor не вызвало изменений концентрации Cd2+.
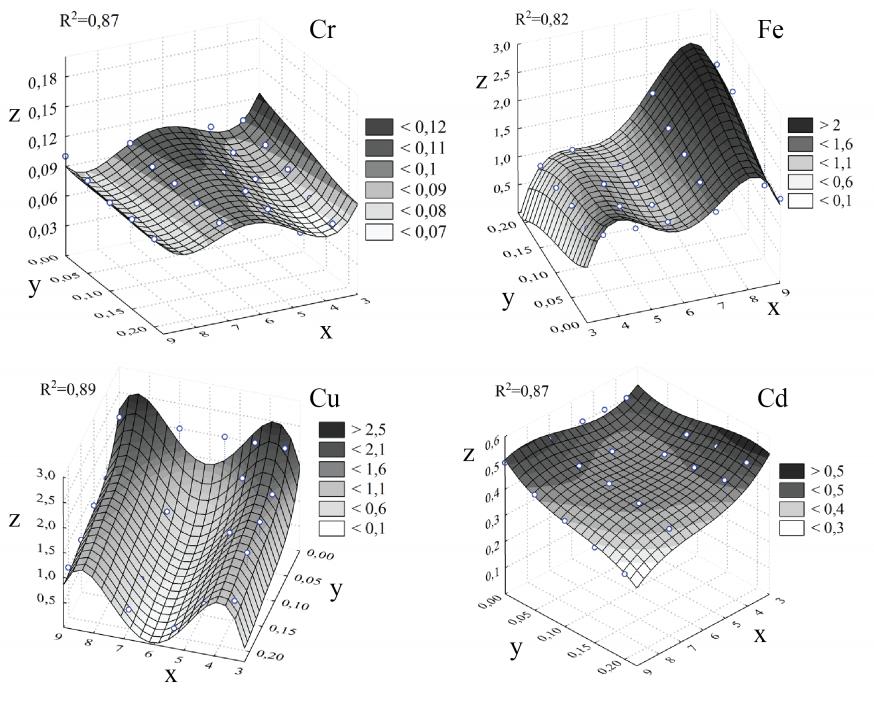
Рис. 7. Графическое изображение математических уравнений, описывающих изменение концентрации ионов ТМ растворов в зависимости от значения pH и КС из Lemna minor. Где: z - концентрация ионов тяжелого металла растворов (мг/л); x - значение pH растворов; y - количество сорбента из растений (г); R2 - коэффициент детерминации.
4.6. Сорбент из сальвинии плавающей (Salvinia natans)
Нами определены следующие математические уравнения зависимости концентрации ионов ТМ растворов от значения pH и КС из Salvinia natans:
- для иона Cr6+: R2 = 0,82
z = 0,282708 -0,11441x -0,24940y+0,022122x2-1,45713y2- 0,00131x3
- для иона Fe3+: R2 = 0,89
z = -53,515+40,8199x-27,232y+0,870895xy-10,972x2+1,26445x3-0,05264x4
- для иона Cu2+: R2 = 0,93
z = -36,217+29,9538x-0,72419xy-8,3418x2+0,980377x3-0,04121 x4
- для иона Cd2+: R2 = 0,82
z = 0,650094x-2,3601y-0,12101x2+0,006948x3
При этом: z - концентрация ионов ТМ растворов (мг/л); x - значение pH растворов; y – количество сорбента растений (г); R2 - коэффициент детерминации.
Графическое изображение построенных уравнений представлено на рисунке 8.
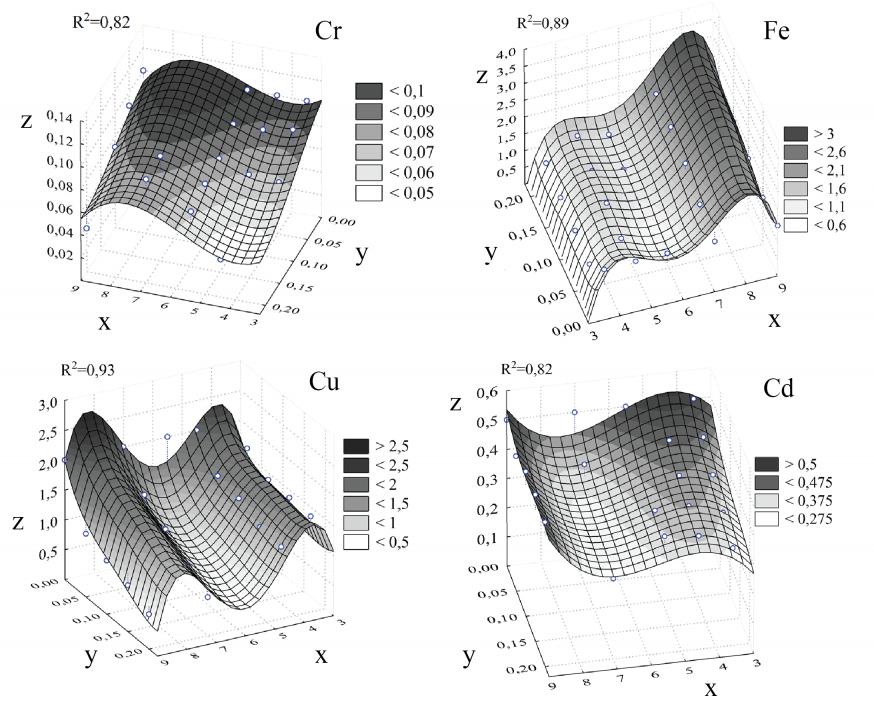
Рис. 8. Графическое изображение математических уравнений, описывающих изменение концентрации ионов ТМ растворов в зависимости от значения pH и КС из Salvinia natans. Где: z - концентрация ионов тяжелого металла растворов (мг/л); x - значение pH растворов; y - количество сорбента из растений (г); R2 - коэффициент детерминации.
Во всех вариантах с добавлением порошка Salvinia natans при различных значениях pH и КС = 0,05 г не отмечалось статистически значимого отличия в концентрации Cr6+ между опытными и контрольными растворами. А при КС = 0,1 г подобная картина наблюдалась во всех опытах кроме случая с pH = 7. Также следует отметить, что при pH = 3,5; 4,5 и 9 сорбент из Salvinia natans снижал концентрацию Cr6+ до одного значения при каждой КС. При pH = 5,5 увеличение КС с 0,1 до 0,2 г не вызвало статистически значимого отличия в концентрации Cr6+ между опытными растворами, а при pH = 7 изменений концентрации Cr6+ не наблюдалось.
В экспериментах с ионами Fe3+ наблюдалась не только сорбционная, но и десорбционная способности у данного макрофита (при pH = 3,5; 4,5 и 5,5 - сорбция, а при pH = 7 и 9 – десорбция). Общая тенденция уменьшения концентрации Cu2+ с увеличением КС при всех значениях pH отмечалась в опытах с данным металлом. Максимальное его снижение отмечалось в варианте с pH = 5,5. В экспериментах с ионами Cd2+ добавление сорбента из Salvinia natans приводило к уменьшению концентрации Cd2+ до определенного значения (около 0,4 мг/л) при pH = 5,5 вне зависимости от КС. Самое значительное его уменьшение отмечено при pH = 7 (при КС = 0,05 г на 20%, а при КС = 0,2 г на 45,2%).
4.7. Оценка эффективности очистки воды от ТМ сорбентом
из водных макрофитов
Для оценки способности водных макрофитов к очищению воды от ионов Cr6+, Fe3+, Cu2+ и Cd2+ использован критерий максимальной достигаемой эффективности очистки. Значения такого критерия представлены в таблице 2.
Таблица 2
Максимальная достигаемая эффективность очистки воды от ТМ сорбентом из водных макрофитов при определенных значениях pH и КС (%).
| Ионы ТМ | Виды водных макрофитов | |||||
| Ceratophyllum demersum | Najas guadalupensis | Elodea canadensis | Lemna minor | Salvinia natans | ||
| Cr6+ | Эффективность | 73 | 66 | 69 | 35 | 67 |
| pH | 3,5 | 4,5 | 3,5 4,5 | 3,5 и 4,5 | 3,5; 4,5 и 9 | |
| КС | 0,2 | 0,15 | 0,1-0,2 0,2 | 0,15-0,2 | 0,2 | |
| Fe3+ | Эффективность | 86,9 | 23,3 | 69,3 | 62,5 | 55,7 |
| pH | 7 | 9 | 9 | 5,5 | 3,5 и 5,5 | |
| КС | 0,15-0,2 | 0,025 | 0,15-0,2 | 0,2 | 0,05 | |
| Cu2+ | Эффективность | 59,9 | 65,7 | 75,1 | 91,1 | 78,4 |
| pH | 7 | 4,5 | 7 | 5,5 | 5,5 | |
| КС | 0,2 | 0,15 | 0,2 | 0,2 | 0,2 | |
| Cd2+ | Эффективность | 31,6 | 59,4 | 50 | 35,2 | 45,2 |
| pH | 4,5; 7 и 9 | 4,5 | 7 | 9 | 7 | |
| КС | 0,2 | 0,15 | 0,15-0,2 | 0,15-0,2 | 0,15-0,2 | |
При сравнении очистительной способности макрофитов по каждому элементу были определены следующие ряды:
- для Cr6+: Ceratophyllum demersum > Elodea canadensis > Salvinia natans Najas guadalupensis > Lemna minor.
- для Fe3+: Ceratophyllum demersum > Elodea сanadensis > Lemna minor > Salvinia natans > Najas guadalupensis.
- для Cu2+: Lemna minor > Salvinia natans > Elodea canadensis > Najas guadalupensis > Ceratophyllum demersum.
- для Cd2+: Najas guadalupensis > Elodea canadensis > Salvinia natans > Lemna minor > Ceratophyllum demersum.
Для каждого из видов исследуемых макрофитов установлены следующие порядки уменьшения очистительной способности по отношению к ионам ТМ:
- Ceratophyllum demersum: Fe3+ > Cr6+ > Cu2+ > Cd2+
- Najas guadalupensis: Cr6+ Cu2+ > Cd2+ > Fe3+
- Elodea canadensis: Cu2+ > Fe3+ Cr6+ > Cd2+
- Lemna minor: Cu2+ > Fe3+ > Cd2+ Cr6+
- Salvinia natans: Cu2+ > Cr6+ > Fe3+ > Cd2+
Представленные данные свидетельствуют о том, что у всех макрофитов обнаружена высокая очистительная способность по отношению к ионам Cu2+ и Fe3+, и в меньшей степени к ионам Cr6+.
Заключение
Результаты работы показывают, что у Ceratophyllum demersum, Najas guadalupensis и Elodea сanadensis отмечается высокая способность очистки воды от ТМ, при этом максимальная ее эффективность достигается только через определенное время (до несколько суток экспозиции).
Результаты проведенных исследований с макрофитами свидетельствуют о том, что в опытных растворах имеет место не только сорбция и аккумуляция, но и экстракция ионов ТМ в растворы. Подобные данные были получены и другими авторами (Molas, 1997; Кузнецов, Дмитриева, 2006), которые отмечали, что при низких значениях pH может происходить повреждение клеточных мембран и, как следствие, пассивная утечка солей ТМ из вакуолей (Дмитриева и др., 2002).
Установленные математические уравнения обладают высокими коэффициентами детерминации (R2 0,8), свидетельствующими о высокой их адекватности экспериментальным данным, и показывают, что во многих случаях остаточная концентрация ионов ТМ в конце очистки в большей степени зависит от значения pH.
Значение pH растворов оказывает существенное влияние на изменение концентрации ионов ТМ растворов в присутствии изучаемых макрофитов. Это объясняется тем, что ионы H+ и OH- значительно влияют на сорбционные процессы (комплексообразование, координация, хелирование, ионный обмен, адсорбция, микроскопическое осадкообразование, диффузия, экстракция). Ионы H+ и OH- могут способствовать или ингибировать такие процессы в зависимости от микроскопической структуры и химического состава сорбентов из макрофитов, и ионов ТМ.
Результаты проведенных нами исследований доказывают возможность использования водные макрофиты в качестве сорбентов для удаления ионов Cr6+, Fe3+, Cu2+ и Cd2+ из воды.
Выводы
1. Значение pH воды 12 приводит к повышению токсичных воздействий ионов Cr6+, Fe3+, Cu2+ и Cd2+ на Ceratophyllum demersum, Najas guadalupensis, Elodea сanadensis, из-за чего отмечены у них следующие морфологические изменения: обесцвечивание листьев и стеблей; полная потеря зеленой окраски листьев; потеря тургора у листьев и стеблей; отделение листьев от стеблей; распад листьев и стеблей растения. В слабокислой (pH 6) и кислой (3,6) средах, в основном, не наблюдалось отделения, распада листьев и стеблей.
2. Ceratophyllum demersum, Najas guadalupensis и Elodea сanadensis в количестве 8 г/л воды способны максимально снижать концентрации ионов Cr6+, Fe3+, Cu2+ и Cd2+ в воде при определенном значении pH:
- Ceratophyllum demersum – по Cr6+ в 4,0; по Fe3+ в 14,6; по Cu2+ в 3,4 и по Cd2+ в 2,2 раза при pH = 6;
- Najas guadalupensis – по Cr6+ в 3,6; по Fe3+ в 13,8; по Cu2+ в 3,2 и по Cd2+ в 3,8 раза при pH = 6;
- Elodea сanadensis – по Cr6+ в 5,3 раз при pH = 3,6; по Fe3+ в 7,9 раз при pH = 12; по Cu2+ в 3,7 раз при pH = 6 и по Cd2+ в 5,0 раз при pH = 3,6.
3. Оптимальная продолжительность экспозиции для очистки воды макрофитами Ceratophyllum demersum, Najas guadalupensis и Elodea сanadensis (в количестве 8 г/л воды) от ионов Cr6+, Fe3+, Cu2+ и Cd2+ находится в интервале 4-9 суток при значении pH= 6.
4. С помощью построенных математических уравнений определена зависимость остаточных концентраций ионов Cr6+, Cu2+, Cd2+ в воде от значения pH и количества сорбента из растений (Ceratophyllum demersum, Elodea сanadensis, Lemna minor, Najas guadalupensis, Salvinia natans), на основе чего установлены оптимальные интервалы значения pH и количества сорбента для очистки воды:
- для Cr6+: pH - 3,5-4,5; количество сорбента – 3-4 г/л;
- для Cu2+: pH - 5,5-7; количество сорбента – 4 г/л;
- для Cd2+: pH - 7,5-8,5; количество сорбента – 3-4 г/л.
5. Сорбент из биомассы Ceratophyllum demersum в количестве 4г/л воды обладает наивысшей эффективностью очистки воды от ионов Cr6+ (73%) при pH = 3,5 и Fe3+ (86,9%) при pH = 7; сорбент из Lemna minor в количестве 4г/л – от ионов Cu2+ (91,1%) при pH = 5,5; а Najas guadalupensis в количестве 3г/л – от Cd2+ (59,4%) при pH = 4,5.
Практические рекомендации
1. При разработке и постройке очистных ветландов рекомендуется использовать:
- Ceratophyllum demersum для очистки воды от Cr6+ и Fe3+ при pH = 6;
- Najas guadalupensis для очистки воды от Fe3+ и Cd2+ при pH = 6;
- Elodea сanadensis для очистки воды от Cu2+ при pH = 6
2. Для удаления ионов ТМ из воды в качестве сорбентов предлагается применять биомассу:
- Ceratophyllum demersum для удаления Cr6+ при pH = 3,5; Fe3+ при pH = 7;
- Najas guadalupensis для удаления Cd2+ при pH = 4,5;
- Lemna minor при pH = 5,5; Salvinia natans при pH = 5,5 и Elodea сanadensis при pH = 7 для удаления Cu2+.
Список работ, опубликованных по теме диссертации
1. Чан, Куок Хоан. Методы математического моделирования процесса очистки сточных вод в очистных ветландах / Чан Куок Хоан, В.Ф. Зайцев, И.В. Мельник // Университетская экология. Международный сборник научных трудов. – Махачкала: ИПЭ, 2010. (– 568 с.) С. 530-532
2. Tran, Quoc Hoan. Role of constructed and natural treatment wetlands in biodiversity conservation / Tran Quoc Hoan, I.V. Melnik // Book of abstracts. International Scientific Conference on Environment and Biodiversity, 22-24 April 2010, Beograd, Serbia. р. 42-43.
3. Чан, Куок Хоан. P-k-C* модель в математическом описании работы очистных работы очистных ветландов / Чан Куок Хоан, И.В. Мельник // В мире научных открытий. - Красноярск: Научно-инновационный центр, 2010. - №4(10). - С. 41-42.
4. Чан, Куок Хоан. Моделирование процесса очистки вод в ветландах / Чан Куок Хоан, И.В. Мельник // Международная отраслевая научная конференция профессорско-преподавательского состава Астраханского государственного технического университета, посвященная 80-летию основания Астраханского государственного технического университета – АГТУ (54 ППС): тез. докл. В 2 т. / под общей редакцией проф. Н.Т. Берберовой, проф. А.В. Котельникова; Астрахан. гос. техн. ун-т. – Астрахань: Изд-во АГТУ, 2010. – Т. I.– 296 с.
5. Чан, Куок Хоан. Разработка компьютерной программы проектирования очистных ветландов / Чан Куок Хоан, И.В. Мельник // Фундаментальные и прикладные исследования университетов, интеграция в региональный инновационный комплекс: доклады молодых ученых в рамках программы “Участник молодёжного научно-инновационного конкурса”, “У.М.Н.И.К.” / Астран. гос. техн. ун-т. – Астрахань: Изд-во АГТУ, 2010. – Т.2. – 160 с.
6. Чан, Куок Хоан. Использование водно-болотных угодий в очистке сточных вод / Чан Куок Хоан, И.В. Мельник, Нго Тхе Кыонг // Современные проблемы биологических исследований в Западной Сибири и на сопредельных территориях: Материалы Всероссийской научной конференции, посвященной 15-летию биологического факультета Сургутского государственного университета, 2-4 июня 2011 г., город Сургут / Отв. ред. В.П. Стариков, - Сургут, Издательство ООО “Таймер”, 2011 - С. 274-276.
7. Чан, Куок Хоан. Рекомендация использования водных макрофитов для очистки различных типов сточных вод / Чан Куок Хоан, И.В. Мельник, Нго Тхе Кыонг // Экология России: на пути к инновациям. Межвузовский сборник научных трудов. Астрахань: Издатель: Сорокин Роман Васильевич, 2011. – Вып. 4. - С. 100-103.
8. Чан, Куок Хоан. Удаление ионов шестивалентного хрома (Cr6+) от воды с использованием водных макрофтов / Чан Куок Хоан, И.В. Мельник, М. Ю. Карапун // Водные ресурсы, экология и гидрологическая безопасность: Сборник трудов V международной научной конференции молодых ученых и талантливых студентов, 23-25 ноября 2011 г., Учреждение Российской академии наук Институт водных проблем РАН, Москва, РФ / Отв. ред. Н.Н. Митина. М: ИВП РАН, 2011 г. - С. 198-200.
9. *Чан, Куок Хоан. Динамика концентраций меди (Cu2+) и хрома (Cr6+) в воде в присутствии макрофитов / Чан Куок Хоан, И.В. Мельник, М. Ю. Карапун // Вестник АГТУ. Серия: Рыбное хозяйство. Астрахань, 2011. -№ 2. - С. 63-68.
10. *Чан, Куок Хоан. Накопление ионов хрома (Cr6+) водными макрофитами при различных значениях водородного показателя / Чан Куок Хоан, М.Ю. Карапун // Журнал «Естественные науки». - Астрахань, 2011 г. - №4. - С. 47 - 53.
11. *Чан, Куок Хоан. Поглощение ионов меди (Сu2+) из воды некоторыми макрофитами / Чан Куок Хоан, И.В. Мельник // Журнал «Естественные науки». - Астрахань, 2012 г. - №2 (39). – С. 71-76.
12. Чан, Хоан Куок. Удаление ионов тяжелых металлов (Cr6+, Fe3+, Cu2+) от воды с помощью водных макрофитов / Чан Хоан Куок // Материалы Международного молодежного научного форума «ЛОМОНОСОВ-2012» / Отв. ред. А.И. Андреев, А.В. Андриянов, Е.А. Антипов, М.В. Чистякова. [Электронный ресурс] - М.: МАКС Пресс, 2012. - 1 электрон. опт. диск (DVD-ROM). c. 228-229. ISBN 978-5-317-04041-3. Режим доступа: http://lomonosov-msu.ru/archive/Lomonosov_2012/structure_2_1693.htm.
13. Tran, Quoc Hoan. Justification for the use of aquatic macrophytes in wastewater treatment in the Astrakhan region / Tran Quoc Hoan, I.V. Melnik, M.Y. Karapun // The Caspian sea. Natural resources. International journal. – Baku: Baku state university, 2012. – № 5. – Р. 137-144.
14. *Чан, Куок Хоан. Водные макрофиты как биосорбенты для удаления ионов тяжелых металлов из воды / Чан Куок Хоан, И.В. Мельник // Вода: химия и экология. – 2012 г. - № 12 (в печати).
* – статьи, опубликованные в журналах, рекомендованных ВАК РФ
____________________________________________
Подписано в печать «22» ноября 2012 г. Тираж 100 экз. Заказ № 705.
Типография ФГБОУ ВПО «АГТУ», тел. 61-45-23
г. Астрахань, Татищева 16 ж

