Клинико-генетические факторы предрасположенности к артериальной гипертензии и поражению органов-мишеней
На правах рукописи
КУЗНЕЦОВА
Татьяна Юрьевна
КЛИНИКО-ГЕНЕТИЧЕСКИЕ ФАКТОРЫ
ПРЕДРАСПОЛОЖЕННОСТИ К АРТЕРИАЛЬНОЙ
ГИПЕРТЕНЗИИ И ПОРАЖЕНИЮ ОРГАНОВ-МИШЕНЕЙ
14.00.06. – кардиология
03.00.15. – генетика
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Петрозаводск
2009
Работа выполнена на кафедре факультетской терапии медицинского факультета ГОУ ВПО «Петрозаводский государственный университет» Министерства образования и науки Российской Федерации
Научные консультанты:
Доктор мед. наук, профессор Бойцов Сергей Анатольевич
Доктор мед. наук Постнов Антон Ювенальевич
Официальные оппоненты:
Доктор мед. наук Мычка Виктория Борисовна
Доктор мед. наук, профессор Остроумова Ольга Дмитриевна
Доктор мед. наук Ижевская Вера Леонидовна
Ведущая организация:
ГОУ ВПО Российский государственный медицинский университет (РГМУ) МЗ и СР РФ
Защита состоится «17» сентября 2009 г. в 13.30 час. на заседании
диссертационного совета Д 208.073.04. при ФГУ «РКНПК» МЗ и СР РФ по адресу: г. Москва, 3-я Черепковская, 15 А.
С диссертацией можно ознакомиться в библиотеке ФГУ «РКНПК»
МЗ и СР РФ
Автореферат разослан «___» _______________ 2009 г.
Ученый секретарь
диссертационного совета,
канд. мед. наук Полевая Т. Ю.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Артериальная гипертензия – много-
факторное заболевание, на развитие которого оказывают влияние генетические, демографические и факторы окружающей среды. Вклад генетических механизмов в развитие АГ изучался во многих клинических исследованиях [С. А. Бойцов, 2004, В. И. Мазуров, 2006, S. Oparil, 2003, F. C. Luft, 2004, D. S. Timberlake 2001]. Результаты проведенных исследований показывают, что АГ – это полигенное заболевание [A. Y. Deng, 2007].
В большинстве генетических исследований изучалась взаимосвязь между однонуклеотидным полиморфизмом гена-кандидата
и АГ методом «случай-контроль», или же оценивалось влияние ал-
леля полиморфного сайта на АД в общей популяции [A. F. Do-
miniczak, 2004, G. H. Gibbons, 2004].
Основными генами-кандидатами были признаны гены, ответственные за функцию главных физиологических систем, участвую-
щих в регуляции АД: РААС, симпатоадреналовой системы, гены, отвечающие за различные обменные процессы, в частности внутриклеточный ионный гомеостаз (гены G протеина, альфа-адду-
цина), или окисление жирных кислот. Среди генов, ответственных за функцию эндотелия, изучались гены, определяющие струк-
туру эндотелиальной NO синтазы (eNOS) и NADPH оксидазы.
Проведенные исследования по изучению однонуклеотидных полиморфизмов генов-кандидатов и их сочетаний у больных АГ в сравнении с лицами, имеющими нормальное АД, показали, что распространенность различных генотипов отличается в зависимости от популяционной группы, возраста больных, пола и т. д. Подобные исследования более информативны, если проводятся
в многочисленных группах с изучением нескольких генов, ответственных за какой-либо один важный физиологический механизм.
Профилактика, раннее выявление, замедление прогрессирования поражения органов – наиболее важная задача при лечении пациента с АГ. В связи с этим очень важно изучение факторов, определяющих органные осложнения. Молекулярно-генетические
исследования так же важны для оценки роли генетических факторов в ремоделировании сердечно-сосудистой системы и опреде-
ления прогноза у данной категории пациентов.
Последние годы важными маркерами, определяющими прогноз у больных АГ, признаны такие признаки субклинического поражения органов, как гипертрофия миокарда, микроальбуминурия и ультразвуковые признаки поражения сонных артерий
в виде увеличения показателя «толщина интима/медия» и атеросклеротических бляшек [Ж. Д. Кобалава, 2007, Н. А. Мухин, 2007,
G. Mancia, 2007, A. Persu, 2004, J. A. Staessen, 1999, S. Takiuchi, 2004].
Анализ литературы свидетельствует о том, что органные пора-
жения при АГ – результат комплексного воздействия различных факторов. Это и хорошо изученные клинические факторы, такие как возраст, пол, ожирение, дислипидемия, сахарный диабет, курение, и особенности течения самой АГ (ее степень, длительность), и генетические факторы. Однако, исследований, в которых бы изучалось влияние этих факторов в комплексе в большой популяционной группе, недостаточно, особенно для российской популяции.
Цель данного исследования: провести анализ влияния полимор-
физмов группы генов, кодирующих белки, участвующие в регуляции функции эндотелия, на развитие артериальной гипертензии и поражение органов-мишеней, в сравнении с клиническими факторами риска.
Задачи:
1. Проанализировать характер распределения генотипов и аллелей полиморфизмов генов, кодирующих белки, участвующие
в регуляции функции эндотелия: Glu298Asp гена эндотелиальной NO синтазы, С242Т гена субъединицы p22phox NADPH оксидазы, и генов РААС: М235Т и G(-6)A гена ангиотензиногена (AGT) и А1166С гена рецептора 1 типа к ангиотензину 2 (ATR1) у боль-
ных артериальной гипертензией и в группе контроля.
2. Проанализировать частоту выявления ультразвуковых признаков поражения сонных артерий при артериальной гипертензии и изучить зависимость поражения сосудов от клинических факторов и полиморфизмов Glu298Asp гена eNOS, С242Т гена NADPH оксидазы, М235Т и G(-6)A гена AGT и А1166С гена ATR1.
3. Проанализировать частоту выявления гипертрофии миокарда левого желудочка при артериальной гипертензии и изучить зависимость поражения миокарда от клинических факторов и по-
лиморфизмов Glu298Asp гена eNOS, С242Т гена NADPH оксидазы, М235Т и G(-6)A гена AGT и А1166С гена ATR1.
4. Проанализировать частоту выявления микроальбуминурии при артериальной гипертензии и изучить зависимость поражения почек от клинических факторов и полиморфизмов Glu298Asp гена eNOS, С242Т гена NADPH оксидазы, М235Т и G(-6)A гена AGT и А1166С гена ATR1.
5. Провести анализ распределения генотипов и аллелей полиморфизмов Glu298Asp гена eNOS, С242Т гена NADPH оксидазы, М235Т и G(-6)A гена AGT и А1166С гена ATR1 у больных артериальной гипертензией с наличием поражений органов-мишеней в сравнении с группой контроля.
Положения, выносимые на защиту
1. Среди отобранной группы генов, кодирующих белки, участвующие в регуляции функции эндотелия (эндотелиальной NO синтазы, субъединицы p22phox NADPH оксидазы, генов РААС: ангиотензиногена и рецептора 1 типа к ангиотензину 2), обнаружена взаимосвязь аллеля G полиморфизма Glu298Asp гена эндотелиальной NO синтазы с артериальной гипертензией у мужчин
в сравнении с группой контроля.
2. Ультразвуковые признаки поражения сонных артерий при АГ выявляются с частотой 65%; в большей степени зависят от клинических факторов (возраст, мужской пол, давность и степень АГ, курение, дислипидемия, ожирение, а так же их сочетание); поражение сонных артерий ассоциируется с аллелем G полиморфизма Glu298Asp гена eNOS, в большей степени данная зависимость выражена у лиц до 50-ти лет, при установлении АГ в возрасте до 35-ти лет и у мужчин, при установлении АГ до 35-ти лет риск изменений в сонных артериях ассоциируется так же с аллелем Т полиморфизма С242Т гена субъединицы p22phox NADPH оксидазы, у женщин риск снижается при наличии генотипа АА полиморфизма А1166С гена рецептора 1 типа к ангиотензину 2.
3. Гипертрофия миокарда левого желудочка у больных АГ встречается с частотой 39%; зависит от клинических факторов (возраст старше 50-ти лет, мужской пол, вторая и третья степень АГ, давность АГ более 5 лет, сахарный диабет, ожирение, дислипидемия, а так же их сочетание); риск ГЛЖ ассоциирован с Т аллель содержащими генотипами полиморфизма М235Т гена AGT; у лиц до 50-ти лет ГЛЖ так же ассоциируется с генотипами МТ
и ТТ, и С аллелем полиморфизма С242Т гена NADPH оксидазы, при установлении АГ в возрасте до 35-ти лет ГЛЖ ассоциируется с аллелем А полиморфизма Glu298Asp гена eNOS; у мужчин
в возрасте до 50-ти лет – с аллелем Т полиморфизма М235Т гена AGT, у женщин в возрасте до 50-ти лет повышали риск ГЛЖ М аллель полиморфизма М235Т гена AGT, аллель А полиморфизма Glu298Asp гена eNOS и С аллель полиморфизма С242Т гена NADPH оксидазы.
4. Микроальбуминурия при АГ выявляется в 10,5%; зависит от клинических факторов (курение, сахарный диабет и степень АГ), у лиц до 50-ти лет риск МАУ ассоциируется с аллелем G полиморфизма G(-6)A гена AGT; при установлении АГ в возрасте до 35-ти лет – с аллелем А полиморфизма Glu298Asp гена eNOS и аллелем С полиморфизма А1166С гена ATR1.
Научная новизна
Впервые:
1. В российской популяции проанализирован характер распре-
деления генотипов и аллелей полиморфизма С242Т гена субъеди-
ницы p22phox NADPH оксидазы.
2. Проведен молекулярно-генетический анализ и оценено распределение генотипов и аллелей пяти полиморфизмов у мно-
гочисленной группы пациентов с артериальной гипертензией (672 человека) в сравнении с группой контроля: Glu298Asp гена eNOS, С242Т гена субъединицы p22phox NADPH оксидазы, М235Т и G(-6)A гена AGT и А1166С гена ATR1.
3. Проведен сравнительный анализ влияния клинических и гене-
тических факторов (полиморфизмы Glu298Asp гена eNOS, С242Т гена NADPH оксидазы, М235Т и G(-6)A гена AGT, А1166С гена ATR1) на развитие субклинических поражений органов-мише-
ней: ультразвуковых признаков поражения сосудов, гипертрофии миокарда левого желудочка и микроальбуминурии.
4. Установлены особенности влияния клинических и генетических факторов (полиморфизмы Glu298Asp гена eNOS, С242Т гена NADPH оксидазы, М235Т и G(-6)A гена AGT, А1166С гена ATR1) на развитие поражений органов-мишеней в зависимости от пола, возраста больных и возраста установления АГ.
5. Проведен сравнительный анализ распределения аллелей
и генотипов полиморфизмов Glu298Asp гена eNOS, С242Т гена NADPH оксидазы, М235Т и G(-6)A гена AGT и А1166С гена ATR1
у больных артериальной гипертензией с наличием поражений органов-мишеней и в группе контроля.
Практическая значимость
Полное клиническое обследование больных АГ, включающее такие методы исследования как определение микроальбуминурии,
УЗИ сонных артерий, эхокардиография позволило более объективно провести стратификацию риска при АГ, выявить с боль-
шой частотой субклинические поражения органов-мишеней –
микроальбуминурию в 10,5 %, гипертрофию миокарда ЛЖ в 39%,
ультразвуковые признаки поражения сонных артерий в 65%.
Проанализировано распределение генотипов и аллелей пяти полиморфизмов генов, кодирующих белки, участвующие в регуляции функции эндотелия (эндотелиальной NO синтазы, субъединицы p22phox NADPH оксидазы, генов РААС: ангиотензиногена и рецептора 1 типа к ангиотензину 2) у больных АГ в сравнении с группой контроля, установлена большая распространенность А аллеля гена eNOS в контрольной группе мужчин (30%) по сравнению с подгруппой мужчин с АГ (23%), других ассоциаций изучаемых полиморфизмов с АГ не получено.
Оценены факторы риска развития поражений органов-мише-
ней – клинические (возраст, пол, давность АГ, степень АГ, сахар-
ный диабет, ожирение, дислипидемия, курение, отягощенная наследственность) и генетические (полиморфизмы Glu298Asp гена eNOS, С242Т гена NADPH оксидазы, М235Т и G(-6)A гена AGT и А1166С гена ATR1). Установлено, что клинические факторы оказывают большее влияние, по сравнению с генетическими, на возникновение органных поражений у больных АГ. Влияние генетических факторов зависело от пола, в большей степени проявилось в молодом возрасте и при раннем возрасте установления АГ.
Внедрение результатов исследования
Исследование проводилось на базе поликлиники ОАО «Кондопога», в повседневную практику которой внедрена система диспансерного наблюдения за больными АГ на основе электрон-
ной карты, позволившая сократить сроки временной нетрудоспособности при АГ, и снизить количество таких осложнений АГ, как инфаркт миокарда и инсульт.
Созданная система ДН, и результаты данного исследования включены в программу обучения студентов медицинского факультета Петрозаводского госуниверситета (семинарские занятия и лекции для студентов 4 курса по дисциплине «Внутренние болезни»), в программу сертификационных циклов повышения квалификации и первичного усовершенствования врачей по специальности «кардиология», подготовку клинических ординаторов, обучающихся на кафедре факультетской терапии по специальностям «внутренние болезни» и «кардиология».
Методика определения полиморфизмов внедрена в процесс обучения студентов факультета фундаментальной медицины МГУ им. М. В. Ломоносова.
Апробация материалов диссертации
Материалы диссертации доложены и обсуждены на:
– научно-практической конференции «Медицинские информационные системы» (Кондопога, 2002 г.);
– симпозиуме «Медицинские информационные системы» в рам-
ках второй научной сессии Северо-Западного отделения Российской академии медицинских наук (Кондопога, 2005 г.);
– научной сессии общего собрания СЗО РАМН «Генетика
в профилактике, диагностике и лечении заболеваний человека»
(Санкт-Петербург, 2005 г.);
– I-м конгрессе общероссийской общественной организации ОССН «Сердечная недостаточность 2006» (Москва, 2006 г.);
– 7-й всероссийской научно-практической конференции «Инфор-
мационное обеспечение реализации национального проекта «Здоровье» (Москва, 2006 г.);
– 6-й Северо-Западной научно-практической конференции по ревматологии (Петрозаводск, 2006 г.);
– научной сессии общего собрания СЗО РАМН «Фундаментальные и прикладные исследования в области атеросклероза» (Санкт-Петербург, 2006 г.);
– II-м конгрессе общероссийской общественной организации ОССН «Сердечная недостаточность 2007» (Москва, 2007 г.);
– III-й Всероссийской научно-практической конференции «Тео-
ретические и практические аспекты артериальной гипертензии» (Казань, 2007);
– седьмом международном конгрессе по ишемической болезни сердца (Венеция, 2007 г.);
– всероссийской научно-практической конференции «Стандарты диагностики и лечения в клинике внутренних болезней. Сердечно-сосудистые заболевания» (Санкт-Петербург, 2007 г.);
– конгрессе Европейского общества по атеросклерозу (Хельсинки, 2007 г.);
– III-м конгрессе общероссийской общественной организации ОССН «Сердечная недостаточность 2008» (Москва, 2008 г.);
– научно-практических конференциях терапевтов и кардиологов (Петрозаводск, 2006, 2007 гг.);
– заседании межотделенческого совета по апробациям ФГУ РКНПК МЗ и СР РФ.
Публикации
По теме диссертации опубликовано 45 печатных работ, в том числе, 12 статей в изданиях, рекомендуемых Высшей аттестационной комиссией для опубликования материалов диссертаций, из них 1 статья в зарубежном издании, 31 тезисы, изданы практическое руководство и учебное пособие.
Объем и структура диссертации
Работа изложена на 276 страницах машинописного текста. Диссертация состоит из введения, четырех глав – «Обзор литературы», «Материал и методы исследования», «Анализ влияния генетических факторов на развитие артериальной гипертензии», «Анализ влияния клинико-генетических факторов на развитие поражения органов-мишеней при артериальной гипертензии», заключения, выводов, практических рекомендаций, списка литературы (содержит 45 работ отечественных авторов и 295 зарубежных). Работа иллюстрирована 45 таблицами и 88 рисунками. Диссертация изложена на русском языке.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы. На диспансерном учете по поводу АГ
в поликлинике, где проводилось данное исследование, состояло 1641 человек. На основании национальных рекомендаций по профилактике, диагностике и лечению АГ (2001, 2005, 2008 гг.), нами предложен алгоритм обследования больных АГ, на основе которого создана электронная карта-анкета наблюдения. Диагноз АГ, определение стадии, расчет риска развития осложнений определялись на основании данных анамнеза, лабораторных и инструментальных исследований согласно принятой стратификации риска после исключения симптоматической АГ.
При сборе анамнеза анализировались степень АГ, давность АГ,
возраст установления АГ, уточнялись факторы риска: отягощенная наследственность, курение.
Ожирение диагностировали на основании расчетного показателя «индекс массы тела» (ИМТ). За избыточную массу тела принимали ИМТ от 25 до 29,9 кг/м2, ожирение – ИМТ 30 кг/м2.
Лабораторные тесты включали оценку метаболических ФР: показателей липидного спектра и глюкозы. За нормальные значения принимались следующие показатели: общий холестерин –
<5 ммоль/л, ХС ЛПНП – <3,0 ммоль/л, ХСЛПВП – >1,0 ммоль/л для мужчин, и >1,2 ммоль/л для женщин, триглицериды –
<1,7 ммоль/л. При отклонении минимум одного из показателей от нормальных значений диагностировалась дислипидемия.
Для диагностики поражений органов-мишеней проводились: осмотр сосудов глазного дна, стандартная ЭКГ в 12-ти отведениях, эхокардиоскопия (ультразвуковой аппарат Vivid 7 Рro (фирма «General electric», США), цветовое дуплексное сканирование брахиоцефальных артерий (ультразвуковой аппарат Vivid 7 Рro (фирма «General electric», США), общий анализ мочи для диагностики протеинурии, анализ мочи на МАУ, анализ крови на креатинин.
ГЛЖ диагностировалась по ЭКГ или ультразвуковым критериям: признак Соколова-Лайона более 38 мм, Корнельское произведение более 2440 мм х мс; ИММ ЛЖ 125 г/м2 для мужчин
и 110 г/м2 для женщин (по R. Devereux).
По характеру поражений изменения в сосудах дифференциро-
вали на: ремоделирование сонных артерий (изменение комплекса интима-медиа сонных артерий: утолщение (увеличение толщины интима-медиа (ТИМ) более 0,9 мм), изменение эхо-структуры
и эхогенности, нарушение дифференцировки на слои) и атеросклероз сонных артерий (наличие атеросклеротической бляшки).
Выявление МАУ производили иммунологическим полуколичественным методом при помощи тест-полосок Micral-test (фирма «Roche Diagnostics GmbH», Германия). Положительным результат на МАУ считался >20 мг/л, выявленный дважды.
На основании данных анамнеза диагностировались общепринятые ассоциированные клинические состояния.
Молекулярно-генетический анализ
Изучались полиморфизмы следующих генов: Glu298Asp ге-
на эндотелиальной NO синтазы (672 человека), С242Т гена
субъединицы p22phox NADPH оксидазы (672 человека), М235Т
и G(-6)A гена ангиотензиногена и А1166С гена рецептора 1 типа к ангиотензину 2 (414 человек).
Генотипирование по однонуклеотидным заменам Glu298Asp, С242Т, и А1166С проводилось методом ПЦР с анализом полиморфизма длины рестрикционных фрагментов (ПДРФ), а по заменам М235Т, G(-6)A с помощью аллель-специфичной ПЦР
«в реальном времени».
Определение полиморфизма генов проводилось при научно-методической помощи факультета фундаментальной медицины Московского государственного университета им. М. В. Ломоносова в «Лаборатории генных и клеточных технологий в меди-
цине».
Статистическая обработка результатов
Достоверность различий определяли с использованием критерия 2, рассчитанного по таблицам сопряженности с помощью программы STATISTICA 5,0. Для количественной оценки риска развития АГ и ее осложнений использовали стандартные математические модели на основе четырехпольной таблицы. Относи-
тельный риск (ОР) определялся как вероятность возникно-
вения заболевания в экспонированной группе по сравнению с неэкспонированной группой (ОР=(a/(a+b))/(c/(c+d)). Для ОР рассчитывали доверительный интервал на уровне надежности 95% (ДИ=(ln(RR)-1.96*se; ln(RR)+1.96*se), где «se» стандартная ошибка (se=((b/a) / (a+b)) + ((d/c) / (c+d)). Помимо ОР определяли отношение шансов. ОШ — отношение шансов события в одной группе к шансам события в другой группе. ОШ рассчитывали по формуле ОШ = a/b : c/d.
Расчет по представленным формулам проводился с помощью программы, созданной на кафедре теории вероятности и анализа данных математического факультета ПетрГУ.
Клиническая характеристика больных
Объектом данного исследования послужила группа, состоящая из 672-х пациентов с АГ и 184-х человек без АГ (см. таблицу 1).
Таблица 1
Объект исследования

Как представлено в таблице 1, в группе больных преобладали мужчины: 450 человек, что составило 67%, и было включено 222 женщины. Средний возраст больных АГ составил 50,9±
±8,7 лет (от 18-ти до 83-х лет), средний возраст у мужчин –
50,6±9,5 (от 18-ти до 83-х лет), у женщин – 51,6±6,7 (от 27-ми до 77-ти лет). По национальности 89% пациентов с АГ – предста-
вители славянских народностей (русские, украинцы, белорусы),
7% – финны и карелы, 4% – представители других национальностей (литовцы, чуваши, татары, немцы, евреи и др.).
В группу контроля вошли 184 человека без АГ, сахарного диабета, клинических проявлений ишемической болезни сердца, и отсутствием признаков гипертрофии левого желудочка по ЭКГ, средний возраст 37±14 лет (от 21-го до 66-ти лет), преобладали мужчины (154 человека, 83%). Средний возраст мужчин – 33,9±
±13,8 (от 21-го до 66-ти лет), средний возраст женщин – 51,4±4,9 (от 46-ти до 65-ти лет). В группе контроля по национальности так же преобладали славяне – 96%, 4% составили финны, эстонцы, немцы.
Примерно у половины больных (53%) степень повышения АД была в пределах первой. 2 степень АГ диагностирована в 39%,
3 – в 8%. В 43% случаев давность АГ составила до 5 лет, от
5 до10 лет – в 24%, более 10 лет – 33%.
Таблица 2
Распространенность факторов риска в подгруппах больных АГ
в зависимости от пола
| Признак | Число пациентов (%) | Мужчины | Женщины | ||
| n | % | n | % | ||
| Отягощенная наследственность по АГ (n=664) | 446 (67) | 284* | 63 | 162* | 73 |
| Отягощенная наследственность по РСК (n=661) | 166 (25) | 90* | 20 | 76* | 34 |
| Курение (n=672) | 312 (46) | 273* | 61 | 39* | 18 |
| Ожирение (n=672) Избыточная масса тела | 256 (38) 256 (38) | 139* 209 | 31 46 | 117* 70 | 53 32 |
| Дислипидемия (n=672) | 325 (48) | 233* | 52 | 92* | 41 |
| СД (n=672) | 61 (9) | 33* | 7 | 28* | 13 |
| * - р<0,05 | |||||
Самым распространенным фактором риска в исследуемой группе оказалась отягощенная наследственность по АГ (67%) (см. таблицу 2). Далее по частоте встречаемости следует дислипидемия (48%). Курение достоверно чаще выявлено в группе мужчин – 61%, процент курящих женщин составил 18% (p<0,0001), общая распространенность этого фактора риска составила 46%.
Высоко распространенным оказалось ожирение. ИМТ30 кг/м2
оказался у 256-ти человек (38%), причем у женщин ожирение выявлено в половине случаев (53%), у мужчин – в 31%, разница оказалась достоверной (p<0,0001). Необходимо отметить, что высокой оказалась и частота выявления избыточной массы тела (ИМТ от 25 до 29,9 кг/м2) – 38%. Таким образом, лица с нормальным весом составили в исследуемой группе только 25%.
Отягощенная наследственность по ранним сердечно-сосу-
дистым катастрофам отмечена у 166 человек (25%). Сахарный диабет диагностирован у 61 больных АГ (9%), достоверно чаще
у женщин (13% против 7%, р=0,025).
Выявленные при обследовании поражения органов-мишеней представлены в таблице 3. Наиболее часто в исследуемой группе были выявлены признаки патологических изменений в сонных артериях – у 65% пациентов, на втором месте по частоте – поражение сосудов глазного дна (63%), в 39% случаев диагностирована ГЛЖ, и у 10,5% больных выявлена МАУ.
Таблица 3
Поражения органов мишеней в подгруппах больных АГ
в зависимости от пола
| Признак | Число пациентов (%) | Мужчины | Женщины | ||
| n | % | n | % | ||
| Сужение артериол сетчатки (n=636) | 400 (63) | 274 | 64 | 126 | 60 |
| МАУ (n=371) | 39 (10,5) | 25 | 10,3 | 14 | 10,8 |
| Гипертрофия левого желудочка (n=672) | 262 (39) | 188* | 42 | 74* | 33 |
| Поражение сонных артерий (n=557) | 362 (65) | 270* | 73 | 92* | 40 |
| * - p<0,05 | |||||
ИБС диагностирована у 139 человек (21%), достоверно чаще
у мужчин (24% против 14%, р<0,001). Хроническая сердечная недостаточность (ХСН) диагностирована у 42-х человек (6%), их них у всех отмечена ИБС, соответствующие ХСН жалобы, и по ЭХО КС выявлена или диастолическая (31 человек), или систолическая дисфункция (11 человек). ОНМК перенесли в анамнезе 44 человека (6,5%), примерно с одинаковой частотой и мужчины, и женщины (7% и 6% соответственно, р=0,7). Облитерирующий атеросклероз сосудов ног выявлен у небольшого числа пациентов –
12 человек (1,9%), только у мужчин. Так же редко отмечены поражения почек и сосудов глазного дна в виде АКС: у 12-ти больных диагностирована диабетическая нефропатия (1,8%), ретинопатии выявлено не было.
Суммируя полученные результаты оценки факторов риска, признаков поражения органов-мишеней и АКС, была проведена оценка стадии АГ и риска. Стратификация риска больных исследуемой группы представлена в таблице 4.
Таблица 4
Стратификация риска у больных АГ
| Параметр | Стадия АГ | Риск | |||||
| 1 | 2 | 3 | 1 | 2 | 3 | 4 | |
| Число пациентов | 113 | 386 | 173 | 8 | 67 | 395 | 202 |
| % | 17 | 57 | 26 | 1 | 10 | 59 | 30 |
Как видно из представленных данных, в подавляющем большин-
стве случаев у пациентов АГ, наблюдаемых в поликлинике, была установлена 2 и 3 стадия АГ (83%), высокий и очень высокий риск (89%), что объясняется большой распространенностью ФР и поражений органов-мишеней.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ влияния генетических факторов
на развитие артериальной гипертензии
Для анализа влияния генетических факторов на развитие АГ оценивалось распределение аллелей и генотипов пяти полиморфизмов в группе больных АГ и контрольной группе. Кроме того, проводился сравнительный анализ данного распределения у муж-
чин и женщин, в подгруппах в зависимости от возраста исследуемых (до 50-ти лет, и более 50-ти лет) и от возраста установления АГ (до 35-ти лет, и после 35-ти лет).
Распределение генотипов и аллелей полиморфизмов Glu298Asp
гена eNOS, С242Т гена NADPH оксидазы, М235Т и G(-6)A гена AGT и А1166С гена ATR1 у больных АГ и в группе контроля,
а так же в подгруппах по полу представлено в таблице 5. Из представленных данных видно, что по частоте генотипов и аллелей все группы практически не отличалась.
Ассоциация с АГ показана только в отношении полиморфизма Glu298Asp гена эндотелиальной NO синтазы у мужчин: G аллель достоверно чаще встречался у больных АГ при сравнении
с группой контроля (77% против 70%, ОР 1,09, ОШ 1,4, ДИ: (1,08;
1,09), р=0,033). Аллель А при АГ достоверно реже, чем в группе контроля (23% против 30%, ОР 0,9, ОШ 0,7, ДИ: (0,89;0,93), р=0,033). При подсчете ОР превышение его выше единицы показано у мужчин с АГ для генотипа GG (ОР 1,1, ОШ 1,5, ДИ: (1,09;1,12), р>0,05).
В отношении двух полиморфизмов были получены противоположные результаты в подгруппах мужчин и женщин (см. таблицу 5). Это М235Т полиморфизм гена ангиотензиногена и полиморфизма А1166С гена рецептора 1 типа к ангиотензину 2.
У женщин аллель Т полиморфизма М235Т ассоциировался с повышением риска АГ (66% при АГ и 62% в группе контроля,
р> 0,05; ОР 1,04, ОШ 1,22), у мужчин – со снижением (59% против 64%, ОР 0,96, ОШ 0,81). У мужчин аллель А полиморфизма А1166С ассоциировался с повышением риска АГ (80% при АГ против 75% в группе контроля, ОР 1,05, ОШ 1,36), у женщин – со снижением (71% против 78%, ОР 0,92, ОШ 0,66), отличия между подгруппами мужчин и женщин с АГ достоверны (р=0,0023).
Таблица 5
Распределение генотипов и аллелей пяти полиморфизмов
у больных АГ и группе контроля в зависимости от пола
| Гено- типы и аллели | АГ n (%) | Контроль n (%) | Мужчины с АГ n (%) | Мужчины контроль n (%) | Женщины с АГ n (%) | Женщины контроль n (%) | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| Glu298Asp гена eNOS | GG | 393 (58) | 96 (52) | 273 (61) | 78 (51) | 120 (54) | 18 (60) |
| GA | 232 (35) | 71 (39) | 143 (32) | 61 (39) | 89 (40) | 10 (33) | |
| AA | 47 (7) | 17 (9) | 34 (7) | 15 (10) | 13 (6) | 2 (7) | |
| G | 326 (24) | 105 (29) | 211* (23) | 91* (30) | 115 (26) | 14 (23) | |
| A | 1018 (76) | 263 (71) | 689* (77) | 217* (70) | 329 (74) | 46 (77) | |
| C242Tгена NADPHокс | СС | 288 (43) | 72 (40) | 198 (44) | 61 (41) | 90 (40) | 11 (37) |
| СТ | 312 (46) | 94 (53) | 213 (47) | 80 (54) | 99 (45) | 14 (47) | |
| ТТ | 72 (11) | 13 (7) | 39 (9) | 8 (5) | 33 (15) | 5 (16) | |
| С | 456 (34) | 120 (34) | 291 (32) | 96 (32) | 165 (37) | 24 (40) | |
| Т | 888 (66) | 238 (66) | 609 (68) | 202 (68) | 279 (63) | 36 (60) | |
| М235Т гена AGT | MM | 74 (18) | 14 (17) | 58 (20) | 10 (19) | 16 (13) | 4 (13) |
| MT | 171 (41) | 32 (39) | 123 (31) | 17 (33) | 48 (41) | 15 (50) | |
| TT | 169 (41) | 36 (44) | 114 (49) | 25 (48) | 55 (46) | 11 (37) | |
| M | 319 (38) | 60 (37) | 239 (41) | 37 (36) | 80 (34) | 23 (38) | |
| T | 509 (62) | 104 (63) | 351 (59) | 67 (64) | 158 (66) | 37 (62) | |
| G(-6)A гена AGT | GG | 105 (25) | 26 (32) | 84 (29) | 19 (37) | 21 (18) | 7 (23) |
| GA | 231 (56) | 38 (46) | 153 (52) | 24 (46) | 78 (66) | 14 (47) | |
| AA | 78 (19) | 18 (22) | 58 (19) | 9 (17) | 20 (16) | 9 (30) | |
| G | 441 (53) | 90 (55) | 321 (54) | 62 (60) | 120 (50) | 28 (47) | |
| A | 387 (47) | 74 (45) | 269 (46) | 42 (40) | 118 (50) | 32 (53) | |
Окончание таблицы 5
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| A1166C гена ATR1 | АА | 247 (60) | 50 (61) | 192 (65) | 31 (59) | 55 (46) | 19 (63) |
| АС | 148 (36) | 25 (30) | 90 (31) | 16 (31) | 58 (49) | 9 (30) | |
| СС | 19 (4) | 7 (9) | 13 (4) | 5 (10) | 6 (5) | 2 (7) | |
| А | 642 (78) | 125 (76) | 474* (80) | 78 (75) | 168* (71) | 47 (78) | |
| С | 186 (22) | 39 (24) | 116* (20) | 26 (25) | 70* (29) | 13 (22) | |
| * - р<0,05 | |||||||
В подгруппах по возрасту пациентов и возрасту установле-
ния АГ в распределении вариантов изучаемых полиморфизмов были обнаружены некоторые тенденции. Их можно проследить по показателю ОШ, рассчитанному в данных подгруппах в сравнении с соответствующими по возрасту подгруппами контроля (см. табл. 6).
Таблица 6
Показатели ОШ генотипов и аллелей пяти полиморфизмов
в различных возрастных подгруппах
| Генотипы и аллели | Общая группа | Возраст до 50-ти лет | Возраст старше 50-ти лет | Возраст установления АГ до 35-ти лет | Возраст установления АГ позже 35-ти лет | |
| 1 | 2 | 3 | 4 | 5 | 6 | |
| Glu298Asp гена eNOS | GG | 1,29 | 1,31 | 1,37 | 1,43 | 1,26 |
| GA | 0,84 | 0,89 | 0,72 | 0,77 | 0,85 | |
| AA | 0,74 | 0,52 | 0,94 | 0,65 | 0,75 | |
| G | 1,25 | 1,32 | 1,23 | 1,36 | 1,22 | |
| A | 0,8 | 0,75 | 0,81 | 0,73 | 0,81 | |
| C242T гена NADPHокс | СС | 1,11 | 0,84 | 2,05 | 0,77 | 1,2 |
| СТ | 0,78 | 1 | 0,47 | 1,2 | 0,7 | |
| ТТ | 1,53 | 1.67 | 1,2 | 1,2 | 1,6 | |
| С | 0,98 | 0,83 | 1,38 | 0,85 | 1,01 | |
| Т | 1,01 | 1,2 | 0,72 | 1,17 | 0,98 | |
Окончание таблицы 6
| 1 | 2 | 3 | 4 | 5 | 6 | |
| М235Т гена AGT | MM | 1,05 | 1,22 | 0,88 | 1,11 | 1,03 |
| MT | 1,09 | 0,87 | 1,48 | 1,18 | 1,07 | |
| TT | 0,88 | 1,02 | 0,73 | 0,79 | 0,91 | |
| M | 1,08 | 1,04 | 1,12 | 1,16 | 1,06 | |
| T | 0,92 | 0,95 | 0,89 | 0,85 | 0,94 | |
| G(-6)A гена AGT | GG | 0,73 | 0,72 | 0,73 | 0,73 | 0,73 |
| GA | 1,46 | 1,96 | 1,21 | 1,65 | 1,4 | |
| AA | 0,82 | 0,58 | 1,1 | 0,66 | 0,88 | |
| G | 0,93 | 1,06 | 0,85 | 1,0 | 0,91 | |
| A | 1,06 | 0,93 | 1,16 | 0,99 | 1,09 | |
| A1166C гена ATR1 | АА | 0,94 | 1,13 | 0,79 | 0,84 | 0,98 |
| АС | 1,03 | 1,37 | 1,26 | 1,35 | 1,24 | |
| СС | 0,51 | 0,26 | 1,02 | 0,66 | 0,46 | |
| А | 1,07 | 1,41 | 0,84 | 0,96 | 1,11 | |
| С | 0,92 | 0,704 | 1,17 | 1,04 | 0,89 | |
Примечание – все отличия недостоверны
Было обнаружено, что G аллель полиморфизма Glu298Asp гена эндотелиальной NO синтазы ассоциируется с повышением риска АГ (ОР 1,05, ОШ 1,2), А аллель – со снижением риска (ОР 0,95, ОШ 0,8). В большей степени эта зависимость проявилась
в возрасте установления АГ до 35-ти лет (генотип АА – ОР 0,76, ОШ 0,65, аллель А – ОР 0,82, ОШ 0,73, генотип GG – ОР 1,23, ОШ 1,4, аллель G – ОР 1,2, ОШ 1,36), а так же в возрасте до 50 лет (генотип АА – ОР 0,77, ОШ 0,52, аллель А – ОР 0,9, ОШ 0,7, генотип GG – ОР 1,09, ОШ 1,3, аллель G – ОР 1,1, ОШ 1,3).
Обнаруженная тенденция к снижению риска АГ при наличии С аллеля полиморфизма С242Т гена субъединицы p22phox NADPH оксидазы (ОР 0,99, ОШ 0,98), подтвердилось у больных АГ в возрасте до 50-ти лет (ОР 0,94, ОШ 0,83), и при возрасте установления АГ до 35-ти лет (ОР 0,91, ОШ 0,85).
Анализ распространенности аллелей полиморфизма М235Т гена ангиотензиногена при АГ показал, что Т аллель ассоциируется со снижением риска повышения АД (ОР 0,98, ОШ 0,92), у больных с возрастом установления АГ до 35-ти лет это влияние аллеля Т более выражено (ОР 0,93, ОШ 0,85), кроме того, риск АГ оказался ниже при наличии генотипа ТТ (ОР 0,89, ОШ 0,79).
Полиморфизм G(-6)A гена ангиотензиногена не оказывал существенного влияния на развитие АГ, преобладал гетерозиготный вариант GA (ОР 1,06, ОШ 1,46). Но у больных с возрастом установления АГ до 35-ти лет при сохраняющемся влиянии гетерозиготного варианта на развитие АГ (GA ОР 1,25, ОШ 1,65), генотип АА снижал риск АГ в большей степени (ОР 0,82, ОШ 0,66), чем генотип GG (ОР 0,86, ОШ 0,73).
Риск АГ оказался немного повышен при наличии А аллеля полиморфизма А1166С гена рецептора 1 типа к ангиотензину 2
(ОР 1,01, ОШ 1,07), и он немного больше в возрасте больных до 50-ти лет (ОР 1,05, ОШ 1,41), но при возрасте установления АГ до 35-ти лет А аллель снижал риск АГ (ОР 0,98, ОШ 0,96), так же как генотип АА (ОР 0,92, ОШ 0,84).
Таким образом, данное исследование показало, что ассоциация АГ с различными генотипами однонуклеотидных полиморфизмов может проявляться в ситуациях, когда повышение АД впервые фиксируется в молодом возрасте. Обнаруженная ассоциация аллеля G полиморфизма Glu298Asp гена эндотелиальной NO синтазы с АГ у мужчин в обследованной выборке больных АГ
может свидетельствовать о том, что данный полиморфизм оказывает влияние на функциональное состояние эндотелия и участвует в формировании АГ.
Анализ влияния клинико-генетических факторов
на развитие поражения органов-мишеней при АГ
Был проведен анализ влияния различных факторов на развитие МАУ, ГЛЖ и поражение сонных артерий. Анализировались клинические факторы (возраст, пол, степень АГ, давность АГ, отягощенная наследственность, курение, ожирение, дислипидемия,
сахарный диабет и их сочетание) и генетические (полиморфизмы Glu298Asp гена эндотелиальной NO синтазы, С242Т гена субъединицы p22phox NADPH оксидазы, М235Т и G(-6)A гена ангиотензиногена, А1166С гена рецептора 1 типа к ангиотензину 2).
Ультразвуковые признаки поражения сонных артерий при АГ выявлены в 65% случаев.
Основными клиническими факторами, влияющими на пораже-
ние сонных артерий при АГ оказались возраст, пол, давность АГ,
степень АГ, курение, дислипидемия, ожирение у женщин, а так же
сочетание 3-х и более ФР (см. рисунок 1).
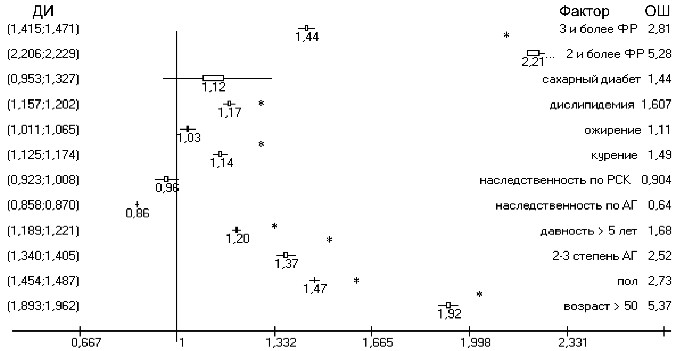
Рисунок 1 – ОР поражения сонных артерий у больных АГ
в зависимости от клинических факторов
В возрасте старше 50-ти лет изменения в сосудах зафиксированы в 79%, а у молодых лиц – в 41% (ОР 1,9, ОШ 5,4, ДИ:
(1,89;1,96), р<0,0001), у мужчин они достоверно чаще, чем у женщин – 73% против 49% (ОР 1,47, ОШ 2,7, ДИ: (1,45;1,48), р<0,0001), при 1-й степени АГ частота сосудистых изменений составила 55%, а при АД свыше 160/100 мм рт. ст. она увеличилась до 76% (ОР 1,37, ОШ 2,5, ДИ: (1,34;1,4), р<0,0001). Частота ультразвуковых признаков поражения сонных артерий прогрессивно увеличивалась с каждым пятилетием течения АГ: в подгруппе больных со стажем АГ до 5 лет она составила 55%, от
5 до 10 лет – 63%, более 10 лет – 77% (ОР 1,24, ОШ 1,9, ДИ: (1,19;1,29), р<0,05).
Достоверно чаще поражение сосудов отмечалось у больных АГ при наличии таких факторов, как курение (ОР 1,14, ОШ 1,5, ДИ: (1,12;1,17), р=0,025) и дислипидемия (ОР 1,17, ОШ 1,6, ДИ: (1,15;1,2), р=0,008). При ожирении изменения в сонных артериях отмечались немного чаще (67%), чем у больных АГ с нормальным
весом (64%), но достоверность отличий в общей группе не получена (ОР 1,03, ОШ 1,11, ДИ: (1,01;1,06), р>0,05). У женщин сосудистые изменения достоверно чаще ассоциировались с ожирением
(57% и 41% соответственно, ОР 1,39, ОШ 1,9, ДИ: (1,33;1,45),
р=0,03).
При наличии СД в общей группе, и подгруппах по полу частота ультразвуковых изменений в сонных артериях значительно
превышала показатель их частоты у больных без СД (72% против
64%, (ОР 1,12, ОШ 1,44, ДИ: (0,95;1,32), р>0,05), однако, в связи с небольшим числом пациентов с СД, достоверность отличий
не подтвердилась.
Сочетание 3-х и более учитываемых ФР достоверно повышало частоту поражения сосудов при АГ (64% против 52%, ОР 1,44, ОШ 2,8, ДИ: (1,41;1,47), р=0,016).
Обнаружена зависимость поражения сосудов при АГ от изучаемых полиморфизмов генов.
Достоверность отличий получена при сравнении подгруппы больных АГ с изменениями в сонных артериях и группы контроля. Риск развития изменений в сосудах достоверно увеличивался при наличии аллеля G Glu298Asp эндотелиальной NO синтазы,
и уменьшался при наличии аллеля А (частота А аллеля в подгруппе больных АГ с изменениями в сосудах достоверно меньше –
23% против 29% в группе контроля, ОШ 0,7; а аллеля G больше –
77% против 71%, ОШ 1,4, р=0,038) (см. рисунок 2).
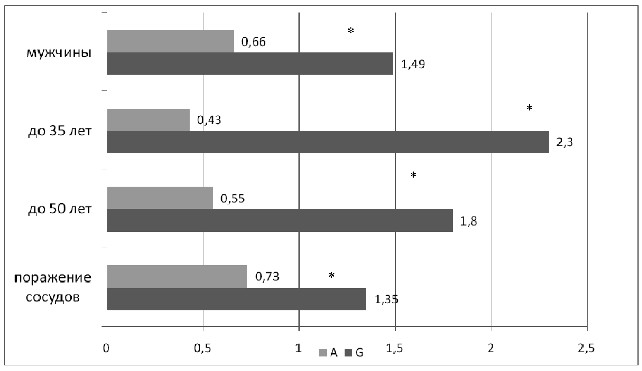
Рисунок 2 – ОШ аллелей полиморфизма Glu298Asp гена eNOS
в различных подгруппах больных АГ с наличием изменений
в сонных артериях и группе контроля
На рисунке 2 представлены показатели ОШ аллелей полиморфизма Glu298Asp гена eNOS в различных возрастных подгруппах. Было обнаружено, что данный генетический фактор
у молодых пациентов и при раннем возрасте установления АГ ассоциируется с поражением сосудов в большей степени. Так, меньшая частота встречаемости аллеля А и превалирование аллеля G по сравнению с группой контроля обнаружены в подгруппах пациентов с признаками поражения сонных артерий молодого возраста (А – 18%, ОШ 0,5, G – 82% ОШ 1,8, р=0,006)
и молодого возраста установления АГ (A – 15%, ОШ 0,4, G –
85%, ОШ 2,3, р=0,016). Подтвердилась данная зависимость
у мужчин (аллель А – 22% при АГ с изменениями в сосудах
и 30% в контрольной группе, ОШ 0,7, G – 78% против 70% соответственно, ОШ 1,5, р=0,013).
Как показано на рисунке 3, при сравнении подгрупп больных АГ с наличием изменений в сосудах и без таковых достоверности отличий не получено, но сохранялась выявленная тенденция
и показатели ОШ для генотипа GG и аллеля G гена eNOS увеличивались в зависимости от возраста.
Так, ОШ развития поражений сосудов в целом по группе составило при наличии генотипа GG 1,37, в возрасте до 50-ти лет – 1,67, при установлении АГ до 35-ти лет – 2,54, ОШ сосудистых изменений при наличии аллеля G – 1,15, 1,43, 1,85 (соответственно по подгруппам). Для аллеля А данный показатель снижался в исследуемых возрастных подгруппах – 0,86, 0,69, 0,53.

Рисунок 3 – ОШ аллелей полиморфизма Glu298Asp гена eNOS
в различных подгруппах больных АГ в зависимости
от наличия изменений в сонных артериях
На рисунке 4 представлены показатели ОШ аллелей полимор-
физма С242Т гена субъединицы p22phox NADPH оксидазы. Аллель Т ассоциировался с поражением сосудов, если возраст установления АГ до 35-ти лет: при наличии изменений в сосудах аллель Т чаще выявлен в более молодой подгруппе пациентов
с АГ (44%, ОШ 1,38), реже при более поздней диагностике АГ (32%, ОШ 0,9), и при сравнении этих двух подгрупп получена достоверность отличий (ОР 1,57, ОШ 1,7, р=0,049).
Т аллель и ТТ генотип ассоциировался с повышением риска поражения сосудов у женщин (частота Т аллеля 40% против 35%, ОШ 1,24, для генотипа ТТ – 20% против 8%, ОШ 2,61), у мужчин –
противоположная зависимость – аллель Т встречался реже при наличии изменений в сосудах – 31% против 36%, ОШ 0,82 (р>0,05)
(см. рисунок 4).

Рисунок 4 – ОШ аллелей полиморфизма С242Т гена
субъединицы p22phox NADPH оксидазы в различных подгруппах
больных АГ с наличием изменений в сонных артериях
Достоверного влияния полиморфизма М235Т гена ангиотензи-
ногена на поражение сонных артерий не было получено, но выяв-
лена тенденция к снижению риска развития сосудистых изменений при наличии генотипа ТТ (ОШ 0,84) и аллеля Т (ОШ 0,82), и, соответственно к увеличению риска сосудистых изменений при наличии генотипа ММ (ОШ 1,38) и аллеля М (ОШ 1,2). У больных с возрастом установления АГ до 35-ти лет влияние генотипов противоположное: ТТ генотип и Т аллель повышают риск поражений сосудов (ТТ ОШ 1,51; Т ОШ 1,28), М аллель – снижает
(ОШ 0,78). Противоположное влияние и в подгруппах по полу:
у женщин Т аллель – повышает риск сосудистых изменений (ОШ 1,32), М аллель – снижает (ОШ 0,75), у мужчин – наоборот (аллель T – ОШ 0,7; аллель M – ОШ 1,4).
Так же только о тенденциях можно говорить в отношении влияния полиморфизма G(-6)A гена ангиотензиногена на поражение сосудов при АГ. У пациентов АГ младше 50-ти лет повышение риска развития изменений в сосудах ассоциировалось с А аллелем (ОШ 1,31), а снижение – с генотипом GG (ОШ 0,48)
и аллелем G (ОШ 0,76). Обратная зависимость в старшей группе –
ОШ поражения сосудов при наличии аллеля А – 0,66, аллеля G –
1,5. Отличие во влиянии на развитие сосудистых изменений выявлено в подгруппах по полу. У женщин риск поражения сосудов повышался при наличии аллеля G (ОШ 1,11), и снижался при наличии аллеля А (ОШ 0,89), у мужчин – наоборот (для аллеля G
ОШ 0,82, для аллеля A ОШ 1,2).
Анализ распространенности вариантов полиморфизма А1166С гена рецептора 1 типа к ангиотензину 2 показал, что генотип СС ассоциируется со снижением риска поражения сосудов (ОШ 0,5), так же, как и аллель С (ОШ 0,9). При возрасте установления АГ до 35-ти лет это влияние выражено максимально (ОШ для алле-
ля С 0,68). Подтвердилась данная закономерность у мужчин (ОШ для аллеля С 0,92). Но у женщин аллель С ассоциируется с большим риском поражения сосудов (ОШ 1,23). При сравнении влияния аллеля С в подгруппах мужчин и женщин на развитие сосудистых изменений была получена достоверность отличий (частота аллеля С 19% против 32%, ОШ 0,5, р=0,006). У женщин генотип АА ассоциировался со снижением риска развития пораже-
ний сосудов по сравнению с группой контроля (38% против 63%, ОШ 0,4, р=0,028).
Гипертрофия миокарда левого желудочка диагностирована у 262-х человек (39%).
На рисунке 5 представлена зависимость развития ГЛЖ от кли-
нических факторов.
Убедительная зависимость ГЛЖ продемонстрирована от возраста (ОР 1,95, ОШ 2,8, ДИ: (1,93;1,96), р<0,0001). Мужской пол достоверно чаще ассоциировался с ГЛЖ (ОР 1,25, ОШ 1,4, ДИ: (1,24;1,26), р=0,035). Частота ГЛЖ увеличивалась при более высоких цифрах АД (ОР 2,08, ОШ 3,4, ДИ: (2,05;2,11), р<0,0001)
и большей давности течения АГ (ОР 1,79, ОШ 2,5, ДИ: (1,77;1,8), p<0,05). Так же достоверно влиял на развитие ГЛЖ сахарный диабет (ОР 1,8, ОШ 3,3, ДИ: (1,58;2,05), р<0,0001). Ожирение увеличивало риск ГЛЖ (ОР 1,31, ОШ 1,6, ДИ: (1,28;1,33), р=0,005). Дислипидемия – ФР ГЛЖ (ОР 1,28, ОШ 1,5, ДИ: (1,26;
1,29), р=0,0099). Сочетание 3-х и более ФР существенно влияло на развитие ГЛЖ при АГ (ОР 1,76, ОШ 1,8, ДИ: (1,75;1,76), р=0,0001).
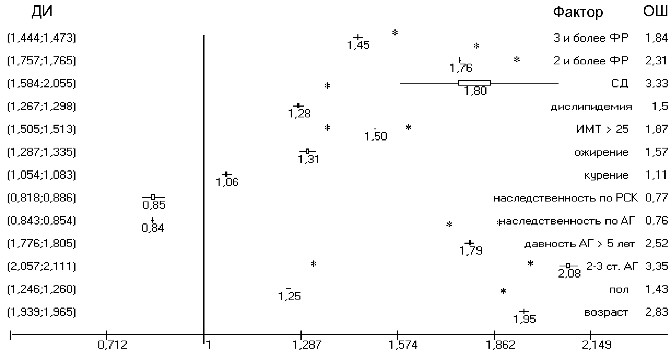
Рисунок 5 – ОР гипертрофии левого желудочка у больных АГ
в зависимости от клинических факторов
Генетические факторы так же оказывали влияние на развитие ГЛЖ. При анализе полиморфизма Glu298Asp гена эндотелиальной NO синтазы обнаружена ассоциация генотипа АА и аллеля А с ГЛЖ при АГ.
На рисунке 6 представлены показатели ОШ развития ГЛЖ
в различных подгруппах обследуемых больных АГ. Показатели риска увеличивались в зависимости от возраста. ОШ развития ГЛЖ при наличии генотипа АА eNOS составило 1,54, в возрастной группе до 50-ти лет – 3,41, а при возрасте установления АГ до 35-ти лет – 6,66. Показано увеличение риска развития ГЛЖ
и для аллеля А, так же усиливающееся в молодом возрасте, показатели ОШ по группам следующие: 1,08, 1,44, 1,98. Обнаруженная ассоциация ГЛЖ с аллелем А и генотипом АА была достоверно подтверждена в подгруппах с молодым возрастом установления АГ (для аллеля А ОШ 1,98, р=0,037, аллеля G ОШ 0,5, р=0,037). Подтвердилась данная зависимость у женщин. Частота А аллеля достоверно больше в группе женщин до 50-ти лет при наличии ГЛЖ (33% против 18%, ОШ 2,3, р=0,027).
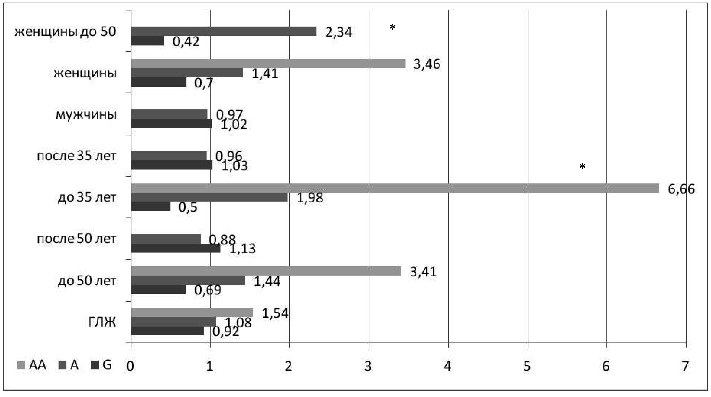
Рисунок 6 – ОШ аллелей полиморфизма Glu298Asp гена
эндотелиальной NO синтазы в различных подгруппах
больных АГ с ГЛЖ
Прослеживается взаимосвязь ГЛЖ с генотипом СС С242Т полиморфизма гена субъединицы p22phox NADPH оксидазы (ОШ 1,04), и снижение ее риска при наличии генотипа ТТ (ОШ 0,52)
и аллеля Т (ОШ 0,85), но отличия недостоверны.
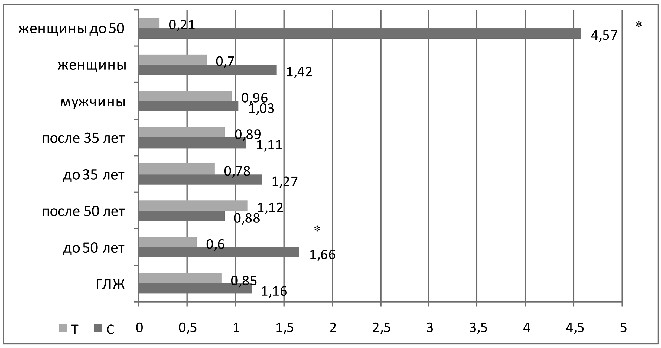
Рисунок 7 – ОШ аллелей полиморфизмаС242Т гена
субъединицы p22phox NADPH оксидазы
в различных подгруппах больных АГ с наличием ГЛЖ
При возрасте установления АГ до 35-ти лет обнаруженные тен-
денции так же сохраняются (ОШ развития ГЛЖ при наличии
Т аллеля 0,78, ОШ при наличии С аллеля 1,27) (см. рисунок 7). Достоверность отличий получена в возрасте до 50-ти лет (аллель Т ассоциировался со снижением риска ГЛЖ: 28% против 39%, ОШ 0,6, аллель С – с повышением: 72% против 61%, ОШ 1,7 р=0,01). Преимущественно отличия отмечены в подгруппе женщин до 50-ти лет – Т аллель достоверно реже при наличии ГЛЖ (ОШ 0,21), аллель С – достоверно чаще (ОШ 4,6, р=0,001).
Генотип ММ полиморфизма М235Т гена ангиотензиногена ассоциировался со снижением риска развития ГЛЖ при АГ: его частота была достоверно меньше в подгруппе с ГЛЖ (12% против 21%, ОШ 0,5, р=0,019) (см. рисунок 8).
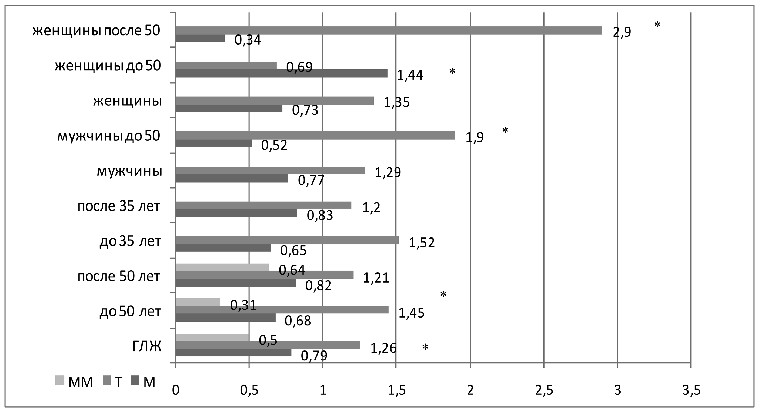
Рисунок 8 – ОШ генотипа ММ и аллелей М235Т полиморфизма
гена AGT в различных подгруппах больных АГ с ГЛЖ
Т аллель содержащие генотипы полиморфизма М235Т гена AGT (МТ и ТТ) повышали риск ГЛЖ (ОШ 1,9, р=0,019). Достоверность отличий подтвердилась в возрасте до 50-ти лет (для ММ генотипа ОШ 0,31, МТ и ТТ – ОШ 3,1, р=0,018).
Обнаружена ассоциация Т аллеля с развитием ГЛЖ (65% против 59%, ОШ 1,26), которая подтвердилась и в молодом возрасте больных АГ (69% против 61%, ОШ 1,45), и при раннем выявлении АГ (67% против 58%, ОШ 1,52, р>0,05). Отсутствие достовер-
ности можно объяснить отличиями в подгруппах мужчин и женщин.
Как представлено на рисунке 8, у мужчин в возрасте до 50-ти лет Т аллель ассоциировался с развитием ГЛЖ (73% против 59%, ОШ 1,9, р=0,014), в сравнении с подгруппой старше 50-ти лет показатель ОШ оказался еще выше (ОШ 2,18, р=0,006). У женщин
в возрасте до 50-ти лет, наоборот, аллель Т ассоциировался со снижением риска развития ГЛЖ (57% против 83%, ОШ 0,69, р=0,017), и в сравнении с подгруппой старше 50-ти лет так же подтверждена достоверность отличий (83% против 63% без ГЛЖ,
ОШ 2,9, р=0,03).
Не получено доказательств влияния полиморфизма G(-6)A гена ангиотензиногена на развитие ГЛЖ при АГ. Можно проследить лишь тенденцию к снижению риска развития ГЛЖ при наличии генотипа АА (15% против 21%, ОШ 0,68) и аллеля А (45% и 48%, ОШ 0,87), и повышение ее риска при наличии аллеля G (55% и 52%, ОШ 1,13, р>0,05). Но в группе больных АГ молодого возраста аллель А, наоборот, ассоциировался с повышением риска ГЛЖ (50% и 46%, ОШ 1,18), соответственно, с аллелем G ассоциировался меньший риск развития ГЛЖ в молодом возрасте (50% против 54%, ОШ 0,84).
Не обнаружено достоверного влияния полиморфизма А1166С гена рецептора 1 типа к ангиотензину 2 на развитие ГЛЖ при АГ. СС генотип и С аллель ассоциировались с повышением риска ГЛЖ
при АГ (СС – 7% против 3%, ОШ 2,53, аллель С 25% против 21%, ОШ 1,21). Эта тенденция проявлялась не зависимо от возраста пациентов.
Микроальбуминурия была выявлена у 10,5% обследованных больных АГ.
Клинические факторы, которые в данном исследовании оказались наиболее значимыми по влиянию на развитие МАУ, следующие: курение, сахарный диабет и степень АГ (см. рисунок 9).
Так, при первой и второй степени АГ МАУ выявлялась с одинаковой частотой – 9,5% и 9% соответственно, а при третьей степени – 25% (ОР 2,67, ОШ 3,2, ДИ: (1,95;3,67), р=0,009). В группе больных АГ с МАУ процент курящих составил 15%, в группе неку-
рящих частота МАУ оказалась достоверно меньше – 7% (ОР 2,06,
ОШ 2,2, ДИ: (1,98;2,14), р=0,017). Частота МАУ при наличии СД составила 21%, без него – 9% (ОР 2,35, ОШ 2,7, ДИ: (1,99;2,79), р=0,009). Чаще МАУ отмечена в пожилом возрасте (ОР 1,35, ОШ 1,4, ДИ: (0,97;1,86), р>0,05) и при ожирении (ОР 1,64, ОШ 1,74, ДИ: (1,56;1,73), р>0,05). В меньшей степени на появление МАУ влияли давность АГ, отягощенная наследственность и дислипидемия. При сочетании 3-х и более ФР частота МАУ выше – 13% против 7% (ОР 2,5, ОШ 2,7, ДИ: (2,48;2,51), р> 0,05).
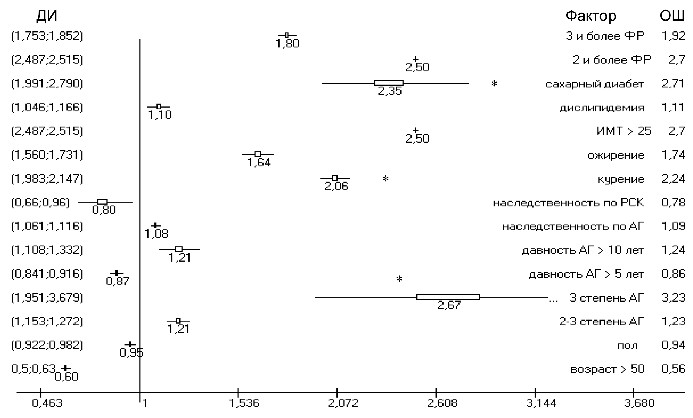
Рисунок 9 – ОР МАУ у больных АГ в зависимости
от клинических факторов
Среди генетических факторов установлена зависимость МАУ от полиморфизма Glu298Asp гена eNOS: аллель А преобладал у больных с МАУ, имеющих более молодой возраст установления АГ – 50% по сравнению с 22%, ОШ 3,6, р=0,02 (см. рисунок 10). Снижение риска развития МАУ ассоциировалось с аллелем G при молодом возрасте установления АГ – 50% против 78%, ОШ 0,27, р=0,02.
В подгруппе пациентов с возрастом установления АГ старше 35-ти лет с аллелем А ассоциировалось снижение риска развития МАУ (ОШ 0,6), а повышение риска – с аллелем G (ОШ 1,65). При сравнении подгрупп больных АГ с МАУ с различным возрастом установления АГ получена достоверность отличий (50% против 17%, ОШ 5,2, р=0,005). У женщин аллель А ассоциировался со снижением риска МАУ (ОШ 0,6), а аллель G – с его повышением (ОШ 1,66), у мужчин, наоборот – аллель G ассоциировался со снижением риска МАУ (ОШ 0,86).
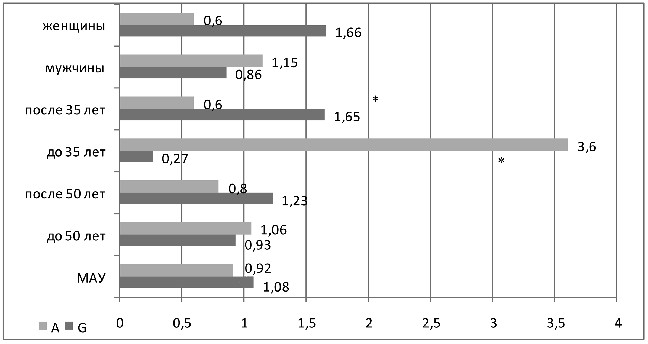
Рисунок 10 – ОШ аллелей полиморфизма Glu298Asp гена
эндотелиальной NO синтазы в различных подгруппах
больных АГ с МАУ
Достоверного влияния полиморфизма С242Т гена субъединицы p22phox NADPH оксидазы на развитие МАУ не получено как в целом по группе больных АГ, так и в отдельных анализируемых подгруппах. В возрасте до 50-ти лет риск развития МАУ ассоциировался с аллелем Т (ОШ 1,34). У женщин аллель Т ассоциировался со снижением риска МАУ (ОШ 0,76), а аллель С –
с его повышением (С ОШ 1,3). У мужчин наоборот – частота аллеля Т преобладала при наличии МАУ (ОШ 1,34), а аллель С снижал риск поражения почек (С ОШ 0,74).
Так же не получено свидетельства достоверного влияния поли-
морфизма М235Т гена ангиотензиногена на развитие МАУ при АГ.
Тенденция к большей частоте аллеля Т у больных с МАУ, выявленная у больных АГ (ОШ 1,2), в большей степени проявилась у молодых пациентов (ОШ 1,37). Аллель Т у мужчин уменьшал риск МАУ (ОШ 0,9), у женщин – повышал (ОШ 1,7).
В распределении вариантов полиморфизма G(-6)A гена ангиотензиногена получены достоверные различия (см. рисунок 11).
С аллелем G ассоциировалось увеличение риска развития МАУ
(ОШ 1,68), в большей степени при возрасте установления АГ до 35-ти лет (ОШ 2,76). Аллель А снижал риск поражения почек (ОШ 0,59, у больных с возрастом установления АГ до 35-ти лет ОШ 0,36). Достоверность отличий получена в возрастной подгруппе больных до 50-ти лет: частота А аллеля составила 29% при наличии поражения почек против 51% у больных АГ без МАУ (ОШ 0,37 р=0,02). Аллель G повышал риск развития МАУ в молодом возрасте (71% против 49%, ОШ 2,6, р=0,02).
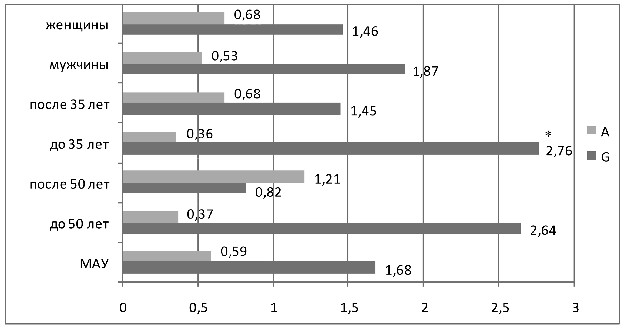
Рисунок 11 – ОШ аллелей полиморфизма G(-6)A гена
ангиотензиногена в различных подгруппах больных АГ с МАУ
В подгруппах мужчин и женщин обнаружены те же закономер-
ности влияния данного полиморфизма – аллель А снижал риск МАУ (у мужчин – ОШ 0,53, у женщин – ОШ 0,68), аллель G –
повышал (у мужчин ОШ 1,87, у женщин – ОШ 1,46).
При анализе влияния полиморфизма А1166С гена рецептора 1
типа к ангиотензину 2 на развитие МАУ было обнаружено, что аллель А снижает риск поражения почек (ОШ 0,85), аллель С –
повышает (ОШ 1,16). Влияние аллеля С усиливалось в подгруппе больных молодого возраста (ОШ 1,6). Но наибольшей частота аллеля С оказалась у больных с МАУ и возрастом установле-
ния АГ до 35-ти лет – 40%, против 20% у пациентов без МАУ, ОШ 2,6, р=0,034. Аллель А снижал риск поражения почек в этой возрастной подгруппе – 60% против 80%, ОШ 0,38, р=0,034.
У мужчин с АГ аллель А умеренно повышал риск развития МАУ (ОШ 1,2), у женщин поражение почек ассоциировалось с аллелем С (ОШ 1,43).
Таким образом, молекулярно-генетический анализ, проведенный наряду со стандартными лабораторно-инструментальными методами обследования у пациентов с АГ, существенно дополнил информацию о факторах, влияющих на прогноз в отношении развития поражения органов-мишеней, особенно у больных моло-
дого возраста.
ВЫВОДЫ
1. Анализ генетических факторов в обследованной выборке больных артериальной гипертензией по сравнению с группой контроля показал, что у мужчин аллель G полиморфизма Glu298Asp
гена eNOS ассоциирован с заболеванием (ОШ 1,4, р=0,033).
2. Частота выявления ультразвуковых признаков поражения сонных артерий (ремоделирование и атеросклеротическое поражение) в обследованной выборке больных АГ составила 65%; на появление изменений в сосудах достоверно влияли возраст старше 50-ти лет (ОШ 5,4, р<0,0001), мужской пол (ОШ 2,7, р<0,0001),
давность АГ более 5 лет (ОШ 1,9, р<0,05), вторая и третья степень АГ (ОШ 2,5, р<0,0001), курение (ОШ 1,5, р=0,025), дислипи-
демия (ОШ 1,6, р=0,008), ожирение у женщин (ОШ 1,9, р=0,03),
а так же сочетание 3-х и более факторов риска (ОШ 2,8, р=0,016).
3. Патологические изменения сонных артерий при АГ без учета фактора возраста ассоциированы с аллелем G полиморфизма Glu298Asp гена eNOS (ОШ 1,4, р=0,038), ассоциация подтвердилась у мужчин: аллель G так же повышал риск поражения сонных артерий (ОШ 1,5, р=0,013), у женщин риск снижался при наличии генотипа АА полиморфизма А1166С гена ATR1 (ОШ 0,4,
р=0,028).
4. Ассоциация поражения сосудов с аллелем G полиморфиз-
ма Glu298Asp гена eNOS в большей степени выражена у лиц до 50-ти лет (ОШ 1,8, р=0,006) и при установлении АГ в возрасте до 35-ти лет (ОШ 2,3, р=0,016), у пациентов, которым АГ установлена в возрасте до 35-ти лет, изменения в сонных артериях ассоциируются так же с аллелем Т полиморфизма С242Т гена субъединицы p22phox NADPH оксидазы (ОШ 1,7, р=0,049).
5. Частота гипертрофии миокарда левого желудочка в обследованной выборке больных АГ составила 39%; влияние на развитие ГЛЖ оказывали возраст старше 50-ти лет (ОШ 2,8, р<0,0001), мужской пол (ОШ 1,4, р=0,035), вторая и третья степень АГ (ОШ 3,4, р<0,0001), давность АГ более 5 лет (ОШ 2,5, p<0,05), сахарный диабет (ОШ 3,3, р<0,0001), ожирение (ОШ 1,6, р=0,005), дислипидемия (ОШ 1,5, р=0,009), а так же наличие 3-х и более факторов риска (ОШ 1,8, р=0,0001).
6. Факт гипертрофии левого желудочка при АГ без учета факто-
ров возраста и пола ассоциирован с Т аллель содержащими генотипами полиморфизма М235Т гена AGT (МТ и ТТ) (ОШ 1,9, р=0,019).
7. В возрастной категории обследованных больных АГ до
50-ти лет ГЛЖ ассоциировалась с генотипами МТ и ТТ полимор-
физма М235Т гена AGT (ОШ 3,1, р=0,018), с С аллелем полимор-
физма С242Т гена NADPH оксидазы (ОШ 1,7, р=0,01); у мужчин
с аллелем Т полиморфизма М235Т гена AGT (ОШ 1,9, р=0,014), у женщин – с М аллелем полиморфизма М235Т гена AGT (ОШ 1,4, р=0,017), аллелем А полиморфизма Glu298Asp гена eNOS (ОШ 2,3, р=0,027) и аллелем С полиморфизма С242Т гена NADPH
оксидазы (ОШ 4,6, р=0,001).
8. У пациентов, которым АГ установлена возрасте до 35-ти лет,
ГЛЖ ассоциировалась с аллелем А полиморфизма Glu298Asp гена eNOS (ОШ 1,9, р=0,037).
9. Частота встречаемости МАУ в обследованной выборке больных АГ 10,5%; достоверно повышали ее риск курение (ОШ 2,2,
р=0,017), сахарный диабет (ОШ 2,7, р=0,009) и третья степень АГ (ОШ 3,2, р=0,009).
10. МАУ в обследованной выборке больных АГ у лиц до 50-ти лет ассоциировалась с аллелем G полиморфизма G(-6)A гена AGT (ОШ 2,6, р=0,02); при установлении АГ в возрасте до 35-ти лет
риск МАУ ассоциировался с аллелем А полиморфизма Glu298Asp гена eNOS (ОШ 3,6, р=0,02) и аллелем С полиморфизма А1166С гена ATR1 (ОШ 2,6, р=0,034).
11. Таким образом, на поражение органов мишеней при АГ влияют не только фенотипические факторы (возраст, пол, давность
и степень выраженности артериальной гипертонии, курение, ожи-
рение, диабет и т.д.), но и генетический фон белков, участвую-
щих в регуляции функции эндотелия.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. В случаях установления АГ в молодом возрасте целесообразно проведение молекулярно-генетического анализа с целью выявления генотипов, ухудшающих прогноз в плане развития поражения органов-мишеней.
2. Выполнение дуплексного сканирования БЦА показано боль-
ным АГ старше 50-ти лет, мужчинам, с давность АГ более 5-ти лет, при повышении АД 2-й и 3-й степени, наличии таких ФР как курение, дислипидемия, ожирение, а так же имеющих сочетание 3-х и более ФР, вероятность выявления поражения сонных артерий в этих случаях максимальна.
3. Прогностически неблагоприятные генетические факторы
риска поражения сосудов при АГ: аллель G полиморфизма Glu298Asp
eNOS, особенно у лиц молодого возраста и у мужчин; аллель Т полиморфизма С242Т гена субъединицы p22phox NADPH оксидазы, особенно при установлении АГ в возрасте до 35-ти лет; аллель С полиморфизма А1166С гена ATR1 у женщин.
4. Выполнение ЭКГ в комплексе с эхокардиографией для выявления ГЛЖ показано больным АГ в возрасте старше 50-ти лет, у мужчин, при 2-й и 3-й степени повышения АД, давности АГ более 5-ти лет, наличии сахарного диабета, ожирения, дислипидемии, а так же наличие 3-х и более ФР.
5. Развитию ГЛЖ способствуют генотипы МТ и ТТ полиморфизма М235Т гена AGT, аллель Т у мужчин в возрасте до 50-ти лет, аллель М у женщин в возрасте до 50-ти лет; аллель А полиморфизма Glu298Asp гена eNOS при установлении АГ в молодом возрасте и у женщин до 50-ти лет; С аллель полиморфизма С242Т гена субъединицы p22phox NADPH оксидазы в возрасте до 50-ти лет, в большей степени это влияние выражено у женщин.
6. Определение МАУ целесообразно пациентам с АГ 2-й и 3-й степени, при наличии сахарного диабета, и у курящих.
7. Риск поражения почек увеличивается в молодом возрасте при
наличии аллеля А полиморфизма Glu298Asp гена eNOS, аллеля G полиморфизма G(-6)A гена AGT; аллель С полиморфизма А1166С гена ATR1.
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ
1. Кузнецова Т. Ю. Влияние артериальной гипертензии на воз-
никновение и течение инфаркта миокарда // Современные аспекты артериальной гипертензии: материалы всерос. научной конфер. – С-Пб., 1995. – С. 152.
2. Кузнецова Т.Ю. Гипертрофия миокарда у больных ИБС с сопутствующей артериальной гипертензией – компенсаторный фактор, влияющий на отбор к хирургическому лечению // 1-ая Северо-Западная научно-практическая конфер. по проблемам внезапной смерти: сб. трудов. – С-Пб., 1996. – С. 52.
3. Кузнецова Т.Ю., Татарко Н.И., Губанова Н.Ю. Возможности
раннего выявления гипертонического сердца у больных артериальной гипертензией // Лечение и профилактика артериальной гипертензии: сб. тезисов межд. форума «Кардиология-2000». – М., 2000. – С. 121-122.
4. Кузнецова Т.Ю., Татарко Н.И., Губанова Н.Ю. Значение комплексного обследования больных гипертонической болезнью для диагностики «гипертонического сердца» // Вестник аритмологии. – С-Пб., 2000. – № 15. – С. 21.
5. Кузнецова Т.Ю., Татарко Н.И., Губанова Н.Ю. Оценка риска
при артериальной гипертензии // Новое в диагностике и лечении внутренних болезней: сб. тезисов конференции терапевтов. – Петро-
заводск, 2000. – С. 60-62.
6. Русских Н.В., Кузнецова Т.Ю., Дуданов И.П. Использование
возможностей единой информационной системы для улучшения качества диагностики, лечения и диспансерного наблюдения больных гипертонической болезнью // Медицинский академический журнал. – С-Пб., 2002. – Том 2, прил. 2. – С. 50-51.
7. Кириллова А. В., Кузнецова Т.Ю., Русских Н. В., Гусев А. В.,
Кемпи С. И., Дуданов И. П. Преимущества диспансерного мониторинга больных артериальной гипертонией на основе электронной карты наблюдения // Сердечно-сосудистые заболевания: бюллетень НЦССХ им. А.Н. Бакулева РАМН. – М., 2004. – Том 5,
№ 5. – С. 405.
8. Русских Н. В., Кириллова А. В., Кузнецова Т.Ю., Гусев А. В.,
Кемпи С. И., Дуданов И. П. Опыт диспансерного наблюдения больных артериальной гипертонией с применением электронной карты // Сердечно-сосудистые заболевания: бюллетень НЦССХ им. А. Н. Бакулева РАМН. – М., 2004. – Том 5, № 5. – С. 428.
9. Кириллова А.В., Кузнецова Т.Ю., Русских Н.В., Гусев А.В., Дуданов И.П. Совершенствование диспансеризации больных с ишемической болезнью сердца // Медицинский академический журнал. – С-Пб., 2005. – Том 5, № 1. – С. 93-99.
10. Кириллова А.В., Русских Н.В., Кузнецова Т.Ю., Гусев А.В.,
Дуданов И.П., Гаврилов Д.В. Создание системы оценки риска
и индивидуального наблюдения больных артериальной гиперто-
нией на промышленном предприятии с помощью единой информационной системы // Бюллетень НИИ кардиологии им. В. А. Алма-
зова. – С-Пб., 2005. – Том 3, № 1. – С. 5.
11. Кузнецова Т.Ю. Оценка влияния артериальной гипертензии на выраженность коронарного атеросклероза // Медицинский академический журнал. – С-Пб., 2005. – Том 5, № 2, приложение 6. –
С. 200-203.
12. Кузнецова Т.Ю., Русских Н.В., Кириллова А.В., Кемпи С.И.,
Гусев А.В., Дмитриев А.Г., Гаврилов Д.В., Дуданов И.П. Анализ степени тяжести поражения органов-мишеней у пациентов с артериальной гипертензией с использованием единой информационной системы // Медицинский академический журнал. – С-Пб., 2005. –
Том 5, № 3. – С. 80-87.
13. Кузнецова Т.Ю., Русских Н.В., Гаврилов Д.В., Кириллова А.В.,
Гусев А.В., Дуданов И.П. Организация диспансерного наблюдения больных артериальной гипертензией на промышленном предприятии // Матер. V северо-западной конференции по ревматологии. – С-Пб., 2005. – С. 64-66.
14. Гаврилов Д.В., Гусев А.В., Кузнецова Т.Ю., Дуданов И.П. Автоматическое формирование диагноза гипертонической болез-
ни в условиях работы учреждения в комплексной медицинской информационной системе // Медицинский академический журнал. – С-Пб., 2005. – Том 5, № 3, приложение 7. – С. 64-67.
15. Кузнецова Т.Ю., Русских Н.В., Гаврилов Д.В., Кириллова А.В.,
Гусев А.В., Дуданов И.П. Информационная система для диспансерного наблюдения больных артериальной гипертонией в амбулаторных условиях // Медицинский академический журнал. – С-Пб.,
2005. – Том 5, № 3, приложение 7. – С. 144-146.
16. Русских Н.В., Гаврилов Д.В., Кириллова А.В., Кузнецова Т.Ю.,
Гусев А.В., Дуданов И.П. Информационная система для диспансерного наблюдения больных артериальной гипертензией в амбулаторных условиях // Сердечно-сосудистые заболевания: бюллетень НЦССХ им. А.Н. Бакулева РАМН. – М., 2005. – Том 6, № 5, приложение. – С. 241.
17. Кузнецова Т.Ю., Дуданов И.П., Бочков В.Н., Самоходская Л.М.,
Русских Н.В. Гаврилов Д.В. Оценка индивидуального риска эссенциальной артериальной гипертензии на основе комплексного изучения механизмов ее развития // Медицинский академический журнал. – С-Пб, 2006. – Том 6, № 1. – С. 102-112.
18. Гаврилов Д.В., Кузнецова Т.Ю., Дуданов И.П. Диспансерное
наблюдение пациентов с гипертонической болезнью - возможно ли эффективное решение старой проблемы? // Врач и информационные технологии. – М., 2006. - № 4. – С. 106-111.
19. Кузнецова Т.Ю., Дуданов И.П., Гаврилов Д.В., Русских Н.В.,
Самоходская Л.М. Полиморфизм гена метилентетрагидрофолат-редуктазы не влияет на развитие осложнений артериальной гипертензии // Сердечно-сосудистые заболевания: матер. Х ежегод-
ной сессии НЦССХ им. А.Н.Бакулева РАМН. – М., 2006. –Том 7,
№ 3, приложение. – С. 96.
20. Кузнецова Т.Ю., Русских Н.В., Гаврилов В.Д., Дуданов И.П.
Значение диспансерного наблюдения больных по поводу гипертонической болезни в сокращении сроков временной нетрудоспособности // Кардиоваскулярная терапия и профилактика. – М., 2006. – Том 5, № 6 (приложение). – С. 202.
21. Кузнецова Т.Ю., Гаврилов Д.В., Русских Н.В., Дуданов И.П.,
Самоходская Л.М. Влияние полиморфизма гена метилентетрагидрофолатредуктазы (MTHFR) на развитие осложнений артериальной гипертензии // Кардиоваскулярная терапия и профилактика. – М., 2006. – Том 5, № 6 (приложение). – С. 202-203.
22. Кузнецова Т.Ю., Дуданов И.П., Гаврилов Д.В., Парфенова Е.В.,
Самоходская Л.М., Балацкий А.В., Макаревич П.И. Влияние полиморфизма Glu298Asp гена эндотелиальной NO синтазы на развитие хронической сердечной недостаточности при артериальной гипертензии // Сердечная недостаточность 2006: сб. тезисов 1-го конгресса общества специалистов по сердечной недостаточности. –
М., 2006 г. – С. 4.
23. Андреенко Е.Ю., Балацкий А.В., Макаревич П.И., Кузнецо-
ва Т.Ю., Дуданов И.П., Бойцов С.А., Самоходская Л.М. Роль С677Т полиморфизма гена метилентетрагидрофолат-редуктазы (MTHFR)
в развитии артериальной гипертонии и инфаркта миокарда у мужчин до 55 лет // Теоретические и практические аспекты артериальной гипертензии: сб. тезисов III Всероссийской научно-прак-
тической конференции. – Казань, 2007. – С. 58.
24. Кузнецова Т.Ю., Гаврилов Д.В., Дуданов И.П., Самоходская Л.М., Парфенова Е.В., Макаревич П.И., Балацкий А.В. Гипер-
трофия миокарда левого желудочка и полиморфизмы GLU298ASP
гена эндотелиальной NO синтазы и C242Т P22PHOX гена NADPH
оксидазы при артериальной гипертензии // Перспективы кар-
диологии в свете достижений медицинской науки: сб. тезисов Всероссийской научно-практической конференции. – М., 2007. – С. 82.
25. Кузнецова Т.Ю., Гаврилов Д.В., Цымлякова Л.С., Кирилло-
ва А.В., Гусев А.В., Дуданов И.П. Оценка тяжести поражения сосудов при артериальной гипертензии // Регионарное кровообращение и микроциркуляция. – С-Пб., 2006. – № 4. – С. 54-63.
26. Kuznetsova T.Y., Dudanov I.P., Gavrilov D.V, Balatski A.V., Makarevich P.I., Parfjonova E.V., Samokhodskaja L.M Polymorphism Glu298Asp of endothelial nitric oxide synthase gene and it’s influence on incidence of atherosclerosis in patients with arterial hypertension // Atherosclerosis. – 2007. – Vol.8 (1), suppl. – P. 55-56.
27. Кузнецова Т.Ю. Генетические механизмы артериальной ги-
пертензии: состояние проблемы // Регионарное кровообращение и микроциркуляция. – С-Пб., 2006. – №4. – С. 75-89.
28. Кузнецова Т.Ю., Дуданов И.П., Гаврилов Д.В., Балацкий А.В.,
Макаревич П.И., Парфенова Е.В., Самоходская Л.М. Полиморфизм Glu298Asp гена эндотелиальной NO-синтазы и особенности течения артериальной гипертензии // Медицинский академический журнал. – С-Пб., 2007. – №2. – С. 49-60.
29. Кузнецова Т.Ю., Гаврилов Д.В., Дуданов И.П., Самоходская Л.М., Парфенова Е.В., Макаревич П.И., Балацкий А.В. Поли-
морфизмы GLU298ASP гена эндотелиальной NO синтазы и С242Т Р22 РНОХ гена NADPH оксидазы и осложнения течения артериальной гипертензии // Кардиоваскулярная терапия и профилактика. –
М., 2007. – № 6 (5), прил. 1. – С. 165-166.
30. Дуданов И.П., Гаврилов Д.В., Цымлякова Л.С., Кузнецова Т.Ю.,
Кириллова А.В., Орлова Р. И. Поражения ветвей дуги аорты при артерииальной гипертензии // Сердечно-сосудистые заболевания: бюллетень НЦССХ им. А.Н. Бакулева РАМН. – М., 2007. – Том 8,
№ 3, приложение. – С. 57.
31. Дуданов И.П., Орлова Р.И., Гаврилов Д.В., Цымлякова Л.С.,
Кузнецова Т.Ю., Кириллова А.В., Гусев А.В. Профилактика инсульта при сосудистых заболеваниях головного мозга // Сердечно-сосудистые заболевания: бюллетень НЦССХ им. А.Н. Бакулева РАМН. – М., 2007. – Том 8, № 3, приложение. – С. 58.
32. Гаврилов Д.В., Кузнецова Т.Ю., Дуданов И.П. Варианты по-
ражений сосудов брахиоцефальных артерий при гипертонической болезни // Актуальные вопросы клинической и экспериментальной медицины: материалы научно-практической конференции молодых ученых. – СПб, 2007. – С. 89.
33. Кузнецова Т.Ю., Гаврилов Д.В., Цымлякова Л.С., Дуданов И.П.
Значение ультразвукового исследования сонных артерий для оценки риска при артериальной гипертензии // Кардиоваскулярная терапия и профилактика. – М., 2007. – № 6 (5), приложение 1. –
С. 166.
34. Кузнецова Т.Ю., Гаврилов Д.В., Русских Н.В., Дуданов И.П.,
Гусев А.В. Эпидемиологическая ситуация по артериальной гипертонии на промышленном предприятии // Медицина труда
и промышленная экология. – 2007. – № 8. – С. 5-10.
35. Дуданов И.П., Кузнецова Т.Ю., Гаврилов Д.В., Кемпи С.И.,
Кириллова А.В., Самоходская Л.М., Гусев А.В. Выяснение роли медико-генетических факторов и влияния внешней среды на развитие артериальной гипертензии (промежуточный отчет) / Петрозаводский государственный университет, Петрозаводск, 2007, № ГР 0120.0603133, Инв. № 02.2.00702991, 60 с.
36. Дуданов И.П., Гаврилов Д.В., Кириллова А.В., Кузнецова Т.Ю.,
Гусев А.В. Модернизация диспансерного наблюдения пациентов
с гипертонической болезнью // Вестник Российской военно-
-медицинской академии. – С-Пб., 2007. – № 2 (18), приложение. – С. 51-52.
37. Кузнецова Т.Ю., Дуданов И.П., Гаврилов Д.В., Парфенова Е.В.,
Самоходская Л.М., Балацкий А.В., Макаревич П.И. Анализ влияния полиморфизмов Glu298Asp гена эндотелиальной NO синтазы
и С242Т p22phox гена NADPH оксидазы на развитие хронической сердечной недостаточности и гипертрофии левого желудочка у больных артериальной гипертензией // Сердечная недостаточность 2007: сб. тезисов II конгресса общества специалистов по сердечной недостаточности. – М., 2007. – С. 6-7.
38. Кузнецова Т.Ю., Дуданов И.П., Гаврилов Д.В., Парфенова Е.В.,
Самоходская Л.М., Балацкий А.В., Макаревич П.И. Хроническая сердечная недостаточность у пациентов с артериальной гипертензией и полиморфизмы Glu298Asp гена эндотелиальной NO синтазы и С242Т p22phox гена NADPH оксидазы // Журнал Сердечная недостаточность. – М., 2007. – Том 8, № 6 (44). – С. 274-278.
39. Кузнецова Т.Ю., Гусев А.В., Гаврилов Д.В., Кириллова А.В.,
Кемпи С.И., Дуданов И.П. Гипертоническая болезнь. Медицин-
ская информационная система в диспансерном наблюдении (Прак-
тическое руководство). – Петрозаводск, издательство ПетрГУ,
2006. – 56 с.
40. Гуменюк Е.Г., Кузнецова Т.Ю., Власова Т.А., Погодин О.К.
Акушерство. Артериальная гипертензия и беременность (учебное пособие). – Петрозаводск, издательство ПетрГУ, 2007. – 3,6 п.л.
41. Дуданов И.П., Кузнецова Т.Ю., Гаврилов Д.В., Кемпи С.И.,
Кириллова А.В., Самоходская Л.М., Гусев А.В. Выяснение роли медико-генетических факторов и влияния внешней среды на развитие артериальной гипертензии (заключительный отчет) / Петрозаводский государственный университет, Петрозаводск, 2008, № ГР 0120.0603133, Инв. № 0220.0 800913, 77 с.
42. Кузнецова Т.Ю., Гаврилов Д.В., Дуданов И.П., Макаревич П.И.,
Балацкий А.В., Самоходская Л.М., Парфенова Е.В. Влияние поли-
морфизмов эндотелиальной NO синтазы и NADPH-оксидазы на развитие осложнений артериальной гипертензии // Кардиология. –
М., 2008. – № 3. – С. 27-33.
43. Kuznetsova T.Y., Gavrilov D.V, Kirillova A.V., Dudanov I.P., Kempi S.I., Samokhodskaja L.M. The influence of genetic factors on incidence of coronary artery disease in hypertensive patients in comparison with other risk factors // New horizons in coronary artery disease: Proceedings of the 7-th International Congress on Coronary artery disease. – Venice (Italy), 2007. – P. 27-30.
44. Кузнецова Т.Ю., Гаврилов Д.В., Самоходская Л.М., Балац-
кий А.В., Макаревич П.И., Парфенова Е.В., Дуданов И.П. Комплексный анализ факторов риска развития ишемической болезни сердца у пациентов с артериальной гипертензией // Кардиоваску-
лярная терапия и профилактика. – 2008. – № 7 (6), приложение 1. –
С. 201-202.
45. Кузнецова Т. Ю., Гаврилов Д. В., Парфенова Е. В., Самоход-
ская Л. М., Балацкий А. В., Макаревич П. И., Дуданов И. П., Бой-
цов С. А. Клинические и генетические факторы риска развития
диастолической дисфункции у больных артериальной гипертен-
зией // Сердечная недостаточность 2008: сб. тезисов III конгресса
общероссийской общественной организации ОССН. – Москва,
2008. – С. 10.
СПИСОК ИСПОЛЬЗОВАННЫХ СОКРАЩЕНИЙ
АГ Артериальная гипертензия
АД Артериальное давление
ГЛЖ Гипертрофия миокарда левого желудочка
ДИ Доверительный интервал
ДН Диспансерное наблюдение
ИБС Ишемическая болезнь сердца
ИММ ЛЖ Индекс массы миокарда левого желудочка
ИМТ Индекс массы тела
МАУ Микроальбуминурия
ОНМК Острое нарушение мозгового кровообращения
ОР Относительный риск
ОШ Отношение шансов
ПЦР Полимеразная цепная реакция
РААС Ренин-ангиотензин-альдостероновая система
РСК Ранние сердечно-сосудистые катастрофы
СД Сахарный диабет
ТИМ Толщина «интима/медия»
УЗИ Ультразвуковое исследование
ФР Факторы риска
ХС ЛПВП Холестерин липопротеидов высокой плотности
ХС ЛПНП Холестерин липопротеидов низкой плотности
ЭКГ Электрокардиограмма
AGT Ангиотензиноген
ATR1 Рецептор 1 типа к ангиотензину 2
eNOS Эндотелиальная NO синтаза
NADPH Никотинамиддифосфат
NO Оксид азота
Подписано в печать 22.05.09. Формат 60х84 1/16.
Бумага офсетная. Уч.-изд.л. 2,0. Тираж 130 экз. Изд. № 157
Государственное образовательное учреждение
высшего профессионального образования
ПЕТРОЗАВОДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Отпечатано в типографии Издательства ПетрГУ
185910, г. Петрозаводск, пр. Ленина, 33

