Роль гамк- и глутаматергической медиаторных систем неостриатума крыс в регуляции двигательного поведения
На правах рукописи
Цверина Виктория Марковна
РОЛЬ ГАМК- И ГЛУТАМАТЕРГИЧЕСКОЙ МЕДИАТОРНЫХ СИСТЕМ НЕОСТРИАТУМА КРЫС В РЕГУЛЯЦИИ ДВИГАТЕЛЬНОГО ПОВЕДЕНИЯ
03.00.13 – физиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург
2008
Работа выполнена на кафедре нормальной физиологии Государственного образовательного учреждения высшего профессионального образования «Санкт-Петербургский Государственный Медицинский Университет имени академика И.П. Павлова» Федерального агентства по здравоохранению и социальному развитию РФ.
Научный руководитель:
Доктор медицинских наук, профессор Якимовский Андрей Федорович
Официальные оппоненты:
Доктор медицинских наук, профессор Клименко Виктор Матвеевич
Доктор медицинских наук, профессор Шабанов Петр Дмитриевич
Ведущее учреждение: Институт эволюционной физиологии и биохимии имени И.М. Сеченова Российской Академии Наук
Защита состоится 2008 года в ____ часов на заседании диссертационного совета
по адресу: 194223 Санкт-Петербург, Каменноостровский пр. 69/71, конференц-зал.
С диссертацией можно ознакомится в библиотеке ГУ НИИ экспериментальной медицины РАМН, по адресу: 197376 Санкт-Петербург, ул. Акад. Павлова, 12.
Автореферат разослан 2008 года
Ученый секретарь диссертационного совета
доктор биологических наук профессор Пучкова Л.В.
Общая характеристика работы
Актуальность проблемы
Проблемы физиологии подкорковых ядер головного мозга остаются актуальными на протяжении уже более ста лет. Несмотря на обилие разнообразных по своему методическому происхождению экспериментальных данных о морфологии, взаимодействии с другими структурами головного мозга, медиаторной организации базальных ядер, их функциональная принадлежность еще далека до полного выяснения. По мере накопления фактов и с введением в практику тонких методов исследования, было доказано вовлечение подкорковых узлов в организацию практически всех функций организма – от вегетативных до высших мыслительных (Суворов, 1994). На настоящий момент исследователи располагают подробными данными о морфологии, нейрональной организации базальных ядер, об их многочисленных медиаторных системах, в том числе о биохимических и электрофизиологических эффектах каждого из нейротрансмиттеров. Однако, несмотря на обилие информации, до сих пор отсутствует целостное представление о физиологии подкорковых ядер, и отдельных структур, входящих в их состав.
Неостриатум, объединяющий в себе хвостатое ядро и скорлупу, филогенетически представляет собой самую молодую структуру из всего комплекса базальных ядер. Неостриатум является высшим центром сенсомоторной интеграции, благодаря циклическим системам связей с бледным шаром, черной субстанцией, таламусом, а также благодаря своей уникальной медиаторной организации (Шуваев, Суворов, 2001). Последняя заключается в том, что неостриатум получает афферентные воздействия посредством глутамат-, ацетилхолин-, дофаминергических и других медиаторных систем, а эфферентная и внутристриарная сигнализация передается преимущественно за счет тормозной ГАМК-ергической системы (Groves, 1983; Graybiel, 1990). ГАМК-ергической системе до сих пор приписывают роль фильтра или своеобразной плотины, главным образом, на пути эфферентной корковой импульсации (Ivry, Spenser, 2004), опираясь на данные о ведущей роли ГАМК-ергической системы в физиологии неостриатума. Однако роль ГАМК-ергической системы в физиологии стриатума несомненно намного сложнее (Шуваев, Суворов, 2001). Не менее значимой для деятельности стриатума является и глутаматергическая система, которая преимущественно обеспечивает передачу эфферентной импульсации от коры. Обе медиаторные системы стриатума принимают непосредственное участие в организации двигательного поведения. Но тонкие механизмы их физиологии до сих пор остаются не ясными для современной физиологии базальных ядер и требуют более детального исследования.
Помимо фундаментальных задач, исследование стриатума имеет важное прикладное – клиническое значение, продиктованное вовлечением структуры в целый ряд неврологических заболеваний, таких как хорея Гентингтона, болезнь Паркинсона, атетозы, дистонии и др. (Горбунова и др., 2002). Характерным проявлением всех указанных патологий является развитие двигательных нарушений в виде гиперкинетического синдрома (Ross, Margolis, 2002). До сих пор проблема лечения гиперкинезов остается неразрешенной. В клинической практике применяются лишь симптоматическую терапию, действие которой малоэффективно и не стойко. Экспериментальное исследование вклада медиаторных систем неостриатума в организацию двигательной функции стриатума, позволит ответить на ряд теоретических вопросов о патогенезе гиперкинезов. Моделирование гиперкинетического синдрома на животных (Coyle, Schwarcz, 1976; Isacson et al., 1985; Якимовский, 1988; Crossman et al., 1988; Shear et al., 1998; Broullet et al., 1999) позволяет экстраполировать получаемые результаты на человека, а, следовательно, это может создать основу для терапии экстрапирамидных расстройств.
Одной из черт современной нейробиологии мозга является углубленный интерес к исследованию внутринейрональных процессов, осуществляющихся с помощью молекулярных и мембранных механизмов (Greengard, 2001; Zhorov, 2004), делается попытка их корреляции не только со свойствами отдельного нейрона или их группы, но и с функцией отдельных ядер и всего мозга в целом. Ведется поиск ключевых фактов – определенных видов медиаторов, групп пептидов, ионов – нарушение активности которых способно качественно изменить деятельность мозга, вызвать определенные отклонения его функций (Besprozvany, 2000). Так появилась (и исчезла) "дофаминовая" теория шизофрении, но осталась, как базисная дофамино дефицитная теория патогенеза болезни Паркинсона (Mizuno et al., 1995). Предполагалось, что и в основе хореи Гентингтона лежит "превосходство" дофамина над ГАМК. Итоги многочисленных исследований по моделированию гиперкинетических расстройств, в том числе и создание управляемой модели хореомиоклонического гиперкинеза у крыс путем многократных введений в неостриатум антагониста ГАМК А рецепторов пикротоксина, подтверждают ведущую роль недостаточности ГАМК-ергической системы в данной патологии (Горбунова, 2002). Исследования, проводимые с помощью моделирования, расширят имеющиеся фундаментальные представления о роли ГАМК- и глутаматергических медиаторных и ионно-транспортных систем неостриатума в организации нормального, свободного и приобретенного, двигательного поведения, что имеет несомненное значение для клинической медицины гиперкинетического синдрома.
Цель работы
Целью настоящей работы является исследование роли тормозной (ГАМК-ергической) и возбуждающей (глутаматергической) медиаторных систем неостриатума крыс в регуляции свободного двигательного поведения, реализации избегательного условнорефлекторного поведения и изучение вклада данных медиаторных систем, а также ионных механизмов в генез дисфункции базальных ядер в виде хореомиоклонического гиперкинеза.
Задачи работы
- Исследовать на модели избегательного поведения вклад ГАМК-ергической медиаторной системы неостриатума крыс в организацию нормального - свободного и выученного двигательного поведения.
- Исследовать роль ГАМК-ергической медиаторной системы и систем хлорных котранспортеров неостриатума крыс в формировании дисфункции неостриатума в виде хореомиоклонического гиперкинеза.
- Исследовать на модели избегательного поведения вклад глутаматергической медиаторной системы неостриатума крыс в организацию нормального - свободного и выученного, двигательного поведения, а также в развитие вызванного пикротоксином патологического поведения.
- Исследовать влияние блокады мембранных ионных каналов, поддерживающих кальциевый гомеостаз нейронов, на развитие вызванной пикротоксином, дисфункции неостриатума крыс.
Научная новизна результатов исследования
На модели нормального (свободного и приобретенного), а также впервые, на модели патологического поведения в виде хореомиоклонического гиперкинеза у крыс, получены данные о взаимоотношении ГАМК- и глутаматергических медиаторных систем неостриатума в организации двигательного поведения. Получены новые данные о вкладе в развитие хореомиоклонического гиперкинеза как ионотропных NMDA, так и метаботропных рецепторных систем глутамата. Доказана роль кальциевых каналов нейронов в обеспечении неостриатумом регуляции спонтанного и условнорефлекторного (избегательного) двигательного поведения, а также в патогенезе, вызванной блокатором ГАМК А рецепторов пикротоксином, стриарной дисфункции.
Основные положения, выносимые на защиту
- ГАМК- и глутаматергическая медиаторные системы неостриатума участвуют в организации нормального - свободного и условнорефлекторного (избегательного) двигательного поведения крыс.
- Блокада ГАМК А рецепторов неостриатума, вызванная пикротоксином, приводит к нарушению реализации нормального – врожденного и приобретенного (избегательного) двигательного поведения, а также к развитию у крыс патологического двигательного поведения в виде хореомиоклонического гиперкинеза, моделирующего гиперкинетический синдром у человека при хорее Гентингтона.
- Активация глутаматергической системы неостриатума крыс усиливает, а блокада, как ионотропных, так и метаботропных, рецепторов глутамата - ослабляет вызванные пикротоксином нарушения реализации нормального (свободного и приобретенного - избегательного) двигательного поведения и проявления пикротоксин-индуцированного гиперкинеза, что доказывает значимость глутаматергической системы в указанных функциях стриатума, а также в развитии дисфункции стрио-паллидарной системы гиперкинетического типа.
- Насыщение ткани неостриатума антагонистом кальция - ионизированным магнием - предотвращает развитие пикротоксин-индуцированной дисфункции неостриатума в виде нарушения реализации нормального - приобретенного (избегательного) двигательного поведения и предупреждает развитие хореомиоклонического гиперкинеза, что доказывает значимость кальциевого гомеостаза в указанных функциях стриатума.
Теоретическая и практическая значимость работы
Полученные экспериментальные данные имеют как теоретическое, так и прикладное, клиническое значение. Они расширяют имеющиеся фундаментальные представления о роли ГАМК- и глутаматергических медиаторных систем неостриатума в организации нормального, свободного и приобретенного (избегательного), двигательного поведения. Используемый метод моделирования стриарной дисфункции демонстрирует вовлечение вышеуказанных медиаторных систем неостриатума в развитие его патологии. Результаты проведенных исследований расширяют представления о физиологической значимости нейрональных кальциевых каналов. Показан вклад кальциевого гомеостаза в обеспечение двигательной функции неостриатума. Также доказана роль нарушения деятельности мембранных ионных каналов, поддерживающих кальциевый гомеостаз, в генезе хореомиоклонического гиперкинеза. Результаты исследований представляют интерес и для клинической медицины. Аналогия между экспериментальным гиперкинезом и гиперкинетическим синдромом человека позволяет экстраполировать полученные данные на патогенез экстрапирамидных расстройств, вызванных недостаточностью стрио-паллидарной системы, а также расширить теоретические подходы их лечения.
Апробация работы
Основные результаты работы были доложены и обсуждены на 4-й, 5-й и 9-й медико-биологической конференциях молодых исследователей "Человек и его здоровье" (Санкт-Петербург, 2001, 2002, 2006), на Санкт-Петербургских научных чтениях Межрегиональной научно-практической конференции с международным участием (Санкт-Петербург, 2001), на 1-й международной научной интернет-конференции "Физиология человека и животных" (Ставрополь, 2002), на VIII Международном симпозиуме "Базальные ганглии и поведение в норме и при патологии" (Санкт-Петербург, 2002), на III международной научно-практической конференции молодых ученых и студентов "Санкт-Петербургский научный форум - 2003" (Санкт-Петербург, 2003), 8-th ECNP Regional Meeting (Moscow, Russia, 2005), второй международной конференции по когнитивной науке "Патология базальных ганглиев и когнитивные функции мозга" (Санкт-Петербург, 2006), ХIХ и ХХ Съездах физиологов России (Екатеринбург, 2004, Москва, 2007).
По материалам диссертации опубликовано 15 работ, из них 9 научных статей в рецензируемых журналах и 6 материалов конференций.
Личный вклад диссертанта
Диссертант самостоятельно проводила большинство экспериментов, обработку полученных результатов, анализ полученных данных, построение рисунков и таблиц, иллюстрирующих результаты.
Структура диссертации
Диссертация изложена на 178 страницах и состоит из введения, трех глав (обзора литературы, материалов и методов исследования, результатов и обсуждения), заключения, выводов и списка литературы (включает 186 источников). Диссертация иллюстрирована 29 рисунками и 2 таблицами.
Материалы и методы
Эксперименты проведены на 225 белых крысах-самцах породы Вистар массой 250 - 300 г. с выработанным условным рефлексом активного избегания (УРАИ) в челночной камере. Крыс обучали покидать затемненную половину камеры не позднее 10 с. действия условного раздражителя (тон 7000 Гц). Подкреплением служил электрический ток силой 1мА, подаваемый через проволочный пол. За опыт подавали 10 сочетаний условного и безусловного раздражителей с промежутком 30 - 40 с. В тесте “открытое поле” в течение 3 минут оценивали спонтанную двигательную активность: локомоторную активность (пересечение границ квадратов пола) и исследовательское поведение (по количеству поднятий на задние лапы).
Животные были разделены на группы, количество особей варьировало от 5 до 19, но обычно их было 6 - 8. Каждому из животных в область рострального отдела неостриатума под нембуталовым наркозом (40 - 60 мг/кг) по стереотаксическим координатам (ростральнее брегмы на 1,0 - 1,5 мм, латеральнее средней линии черепа на 2,0 - 2,5 мм и вентральнее его поверхности на 6,0 - 6,5 мм) вживляли гибкие микроинъекторы, заполненные раствором вещества на 10 - 15 инъекций (Якимовский, 1988). Объем одной инъекции – 0.75 – 1.0 мкл. Через 2 - 3 дня после операции и далее ежедневно в течение 14 - 15 дней производили микроинъекции. Тестирование поведения проводили с промежутком в 1 - 3 дня. Сразу после инъекции за животным устанавливали наблюдение для визуального контроля возможных моторных нарушений. Опыты начинали через 15 минут после очередной инъекции: вначале животных помещали в “открытое поле”, а затем проводили условнорефлекторное тестирование: оценивали успешность реализации рефлекса (отношение своевременных переходов на светлую половину камеры, к общему числу подаваемых условных раздражителей, в процентах) и его латентный период (время в секундах от момента подачи условного раздражителя до исполнения навыка). Данный план тестирования соблюдали, и при наличии у животных моторных нарушений. После прекращения микроинъекций эксперименты продолжали еще в течение двух недель - исследовалась возможная динамика восстановления нарушенного поведения.
Применялись следующие препараты:
1. ГАМК-ергические препараты: ГАМК 45 мкг, бикукуллин 5 мкг (конкурентный блокатор ГАМК А рецепторов), пикротоксин 1, 2 и 5 мкг (неконкурентный блокатор ГАМК А рецепторов).
- Глутаматергические препараты: глутамат 5 мкг, дизоцилпин (МК801) 5 мкг (неконкурентный блокатор NMDA рецепторов глутамата), МТЕР (2- methyl-6-(phenylethynil)-puridinе) 3 мкг (неконкурентный антагонист 5 типа метаботропных рецепторов глутамата), EMQMCM ([3-ethyl-2-methyl-quinolin-6-yl]-[4-methoxy-cyclohexyl]- methanone me-thanesulfonate) 3 мкг (неконкурентный антагонист 1 типа метаботропных рецепторов глутамата).
- Ионотропные препараты: фуросемид (4-хлор-N-(2-фурилметил)-сульфамоилантраниловая кислота) 1 мкг (инактиватор воротного устройства калий-хлорного котранспортера (КСС-2), верапамил 250 нг (блокатор медленных кальциевых каналов), ЭДТА 5 мкг (необратимо связывает ионизированный кальций внеклеточного пространства), хлорид цинка 1 и 3 М, ацетат цинка 3 М, хлорид магния 1 и 1,5 М.
Кроме того, использовали поливиниловый спирт (ПВС) (10%) - полимерный пролонгатор пикротоксина. В качестве контроля использовался стерильный изотонический апирогенный раствор хлорида натрия.
По окончании опытов проводился морфологический контроль локализации канюль. У всех животных кончики канюль располагались в области неостриатума (животные с иной локализацией канюль выбраковывались). При статистическом анализе рассчитывались средние арифметические значения по группе животных, стандартные ошибки и стандартные отклонения. Показатели в очередной день инъекций сравнивали с показателями той же группы животных до вживления канюль (фон) и с показателями в соответствующий день экспериментов у крыс контрольной группы, а также в ряде случаев производили сравнение показателей с таковыми у крыс, получавших микроинъекции 2 мкг пикротоксина. Значимость различий оценивали по критерию t Стьюдента, различия считались значимыми при р 0.05.
Результаты и их обсуждение
В группе крыс с введением физиологического раствора в неостриатум (контрольная группа) не было выявлено достоверных изменений показателей свободного и приобретенного (избегательного) (рис. 1) двигательного поведения. Латентный период условнорефлекторных реакций достоверно не менялся. Моторных нарушений у животных обеих групп не было выявлено.
Хронические микроинъекции 45 мкг ГАМК не вызывали достоверного изменения параметров спонтанной двигательной активности, а также реализации (рис. 1) и латентного периода УРАИ у этих животных. Была выявлена реакция замирания, т.е. удержание неподвижного (висячего) положения в течение 30 - 40 с. при взятии крысы в руки с фиксацией большим и указательным пальцем за грудную клетку (тест проводился каждые 10 мин после микроинъекции; у контрольных животных замирание не превышало 5 - 10 с.). Относительно слабый эффект ГАМК может быть объяснен ее метаболизмом в ткани мозга (участвует в цепях энергопревращений, служит субстратом для синтеза -аминокислот) и деградацией в канюле (Якимовский и др., 1996).
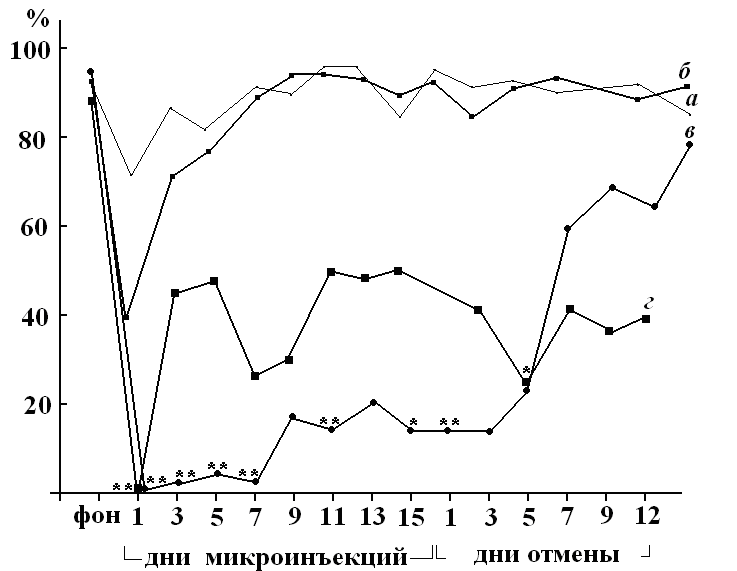
Рисунок 1. Динамика показателя точности реализации условного рефлекса активного избегания у крыс в челночной камере (средние значения по группе животных) на фоне хронического введения в ростральный неостриатум физиологического раствора (а), 45 мкг ГАМК (б), 5 мкг бикукуллина (в) и 1 мкг пикротоксина (г).
По оси абсцисс обозначены дни опытов (фон до начала микроинъекций, период введения препарата и период после его отмены); по оси ординат – количество выполненных условнорефлекторных актов к общему числу предъявленных за опыт условных раздражителей (в процентах). * - случаи достоверных отличий показателя в данный день опыта по сравнению с соответствующими значениями у животных контрольной группы, сравнение двух рядов по Стьюденту (а), p = 0.01-0.05; ** - p < 0.01.
У крыс с введением конкурентного блокатора ГАМК А рецепторов бикукуллина было выявлено снижение параметров спонтанной двигательной активности и нарушение реализации УРАИ (рис. 1), которая восстанавливалась после отмены микроинъекций. Моторных нарушений не было выявлено. При использовании неконкурентного блокатора ГАМК А рецепторов пикротоксина в дозе 1 мкг показатели свободного (табл. 1) и выученного избегательного (рис. 1) двигательного поведения снизились. Увеличение дозы пикротоксина (до 2 мкг) вызвало повышение показателей спонтанной двигательной активности и снижение реализации УРАИ, которая не восстановилась даже после отмены микроинъекций (рис. 2).
Таблица 1.
Изменение параметров локомоторной активности у крыс на фоне многократных микроинъекций ГАМК-ергических средств в область рострального неостриатума
| Дни опытов | Пикротоксин 1 мкг Бикукуллин 5 мкг | Пикротоксин 1 мкг ГАМК 45 мкг | Пикротоксин 1 мкг |
| Локомоторная активность | |||
| фон | 25.0±14.1 | 17.9±9.9 | 31.5±10.9* |
| Период | микроинъекций | ||
| 1 | 39.5±28.0 | 18.5±12.1 | 28.5±17.7 |
| 5 | 17.5±14.4 | 24.7±18.7 | 6.0±5.0++ |
| 9 | 22.4±20.9 | 17.8±12.1 | 7.5±9.9++ |
| 15 | 19.4±17.3 | 34.6±58.7 | 21.8±10.9 |
| Период | отмены | ||
| 1 | 18.0±19.9 | 18.0±2.0 | 17.8±20.9 |
| 5 | 23.6±2.5 | 27.5±5.5 | 22.0±12.4 |
| 9 | 15.8±11.2 | 18.5±8.5 | 11.6±9.9 |
| Поисковая активность | |||
| фон | 5.5±5.3 | 2.2±2.6 | 13.8±7.7 |
| Период микроинъекций | |||
| 1 | 7.1±6.9 | 2.4±2.1 | 4.1±5.8+ |
| 5 | 4.5±5.1 | 3.2±2.6 | 0.7±0.7++ |
| 9 | 3.6±4.0 | 2.5±2.7 | 1.0±1.1++ |
| 15 | 2.4±2.3 | 3.2±2.3 | 9.8±10.0 |
| Период отмены | |||
| 1 | 4.4±5.2 | 2.5±0.5 | 4.3±6.1+ |
| 5 | 9.8±3.9 | 13.5±5.5 ++ * | 3.8±4.1++ |
| 9 | 1.6±2.3 | 2.0±0.0 | 3.0±3.9++ |
Примечание. + - случаи достоверных отличий показателя в данный день опыта по сравнению с соответствующими значениями до начала микроинъекций, сравнение двух рядов по Стьюденту p = 0.01 - 0.05; ++ - p < 0.01. * - случаи достоверных отличий показателя в данный день опыта по сравнению с соответствующими показателями у контрольной группы животных с введением физиологического раствора, сравнение двух рядов по Стьюденту p = 0.01 - 0.05.
Латентный период реализации навыка достоверно увеличился, в среднем, до 4 - 6 с. (у контрольных животных - 2 с.). Аналогичное действие на показатели выученного поведения было у пикротоксина, введенного в дозе 5 мкг
Еще одним результатом при введении пикротоксина было наличие моторных нарушений в виде хореомиоклонического гиперкинеза, как проявление патологического двигательного поведения. Гиперкинез представляет собой неконтролируемые целостные ритмичные движения головы и/или конечностей. Распространение гиперкинеза на туловище обозначали стадией генерализации. По своим проявлениям он совпадал с описанным ранее (Якимовский, 1993; 1998). Экспериментальный гиперкинез аналогичен таковому у человека при хорее Гентингтона. Воспроизводимость гиперкинеза (отношение количества животных с проявлениями гиперкинеза к общему числу крыс, получивших микроинъекции, в процентах) при инъецировании 5 мкг пикротоксина составила 100 % (но у части этих крыс он переходил в судороги), 95% - при дозе 2 мкг и 75% - при дозе 1 мкг. Латентный период гиперкинеза (время от микроинъекции до первых проявлений) при применении дозы 1 мкг, в среднем по группе, продолжался 13 ± 4 минуты, при 2 мкг - 8,4 ± 2,7 минуты. Длительность гиперкинеза (время от первых до последних проявлений) при введении 1 мкг, в среднем по группе, составила 48 ± 6 минут, при 2 мкг - 88,4 ± 27,7 минут. Генерализация гиперкинеза в группе с введением 2 мкг пикротоксина была зарегистрирована у 54% животных, развивалась, в среднем, через 24,5 ± 12,0 минуты после очередной инъекции и продолжалась 60,0 ± 36,3 минуты. Для дальнейших экспериментов мы избрали в качестве рабочей дозы пикротоксина 2 мкг. Столь яркий поведенческий эффект пикротоксин оказывает за счет молекулярного механизма взаимодействия с ГАМК А рецептором. Пикротоксин, проникая в канал ГАМК А рецептора, лишает радикалы составляющих его аминокислот гидратной оболочки, в результате чего происходит значимое снижение входящего тока хлора в клетку (Zhorov et al., 2001). Пикротоксин нарушает электрохимическое состояние нейрона, которое неизбежно влечет за собой изменение восприятия любого рода импульсов.
Для более детального исследования пикротоксиновой модели хореомиоклонического гиперкинеза были проведены несколько экспериментальных серий, в которых животные были разделены на 3 группы. Первая группа крыс (6 особей) получала внутристриарные микроинъекции пикротоксина двусторонне через день, вторая группа (5 крыс) – односторонне в правый неостриатум, но ежедневно, животным третьей группы (6 крыс) инъецирование препарата производилось двусторонне ежедневно, но с 9 дня после операции. Результаты эксперимента не выявили достоверных отличий параметров спонтанной двигательной активности и гиперкинеза всех трех групп от таковых при использовании стандартного метода инъекций (табл. 2).
Была предпринята попытка модификации действия пикротоксина, для чего использовали полимерный носитель – поливиниловый спирт (ПВС). Введение ПВС не вызывало изменений параметров двигательного поведения(свободного и приобретенного). Однако при применении
Таблица 2
Параметры гиперкинеза лап, головы и туловища у крыс на фоне различных режимов введения 2 мкг пикротоксина в область рострального неостриатума крыс
| Параметры гиперкинеза | Стандартный метод введения | Введение через день | Односторонное введение | Введение с 9 дня |
| Воспроизводи-мость | 95 % | 98% | 98% | 100% |
| Латентный период | 8,4 ± 2,7 мин | 10 ± 2,3 мин | 10 ± 2,3 мин | 14 ± 3,4 мин |
| Длительность | 88,4 ± 27,7 мин | 104 ± 56 мин | 78 ± 45 мин | 61,3 ± 21 мин |
| Генерализация | 54% | 100% | 100% | 16,6 % |
Пикротоксина совместно с ПВС в одной канюле не было зарегистрировано достоверных отличий параметров свободного и условнорефлекторного двигательного поведения от таковых при инъецировании одного пикротоксина. Был зарегистрирован хореомиоклонический гиперкинез (воспроизводимость – 100%; латентный период - в среднем, 25 ± 3,4 минут; длительность - в среднем, 89 ± 27,7 минут). Приведенные данные свидетельствуют о стойкости и стабильности нейрофизиологического гиперкинезогенного эффекта пикротоксина вне зависимости от режима введения.
Для решения поставленных вопросов - исследования взаимоотношения ГАМК и глутаматергических систем в обеспечении деятельности стриатума и для изучения медиаторных механизмов развития нарушенного поведения, в том числе и в форме гиперкинеза, нами был использован метод совместного введения в одной канюле двух медиаторных средств. При хроническом введении в неостриатум пикротоксина одновременно с ГАМК не обнаружено отличий в параметрах УРАИ по сравнению с крысами, получавшими один пикротоксин. Параметры спонтанной двигательной активности не изменились (табл. 1), но воспроизводимость гиперкинеза снизилась до 33,3%. ГАМК-индуцированную реакцию замирания не наблюдали. Вероятно, в данном случае тормозные процессы в неостриатуме поддерживались за счет свободных ГАМК А рецепторов и метаболических ГАМК В рецепторов (Emson, 2007).
При одновременном внутристриарном введении бикукуллина и пикротоксина спонтанная двигательная активность достоверно не изменялась (табл. 1). Реализация УРАИ снижалась в меньшей степени, чем при введении каждого из блокаторов раздельно. Пикротоксиновый гиперкинез ослабился: воспроизводимость составила 63%, латентный период не изменился (11,2 ± 6,5 минуты), длительность сократилась (21,6 ± 14,3 минуты), генерализация отсутствовала. Ослабление эффектов обоих блокаторов можно объяснить различным механизмом воздействия на ГАМК А рецептор: бикукуллин, как конкурентный антагонист (Головко, 1999), препятствует действию пикротоксина (Zhorov, 2001).
В следующей серии опытов исследовали роль котранспортных систем в организации двигательного поведения. Введение фуросемида (инактиватора воротного устройства KCС-2) снизило исследовательскую активность в "открытом поле". Реализация УРАИ достоверно не изменялась, но латентный период рефлекса сократился до 2.0 - 2.5 с. (р = 0.01). Изменение других показателей свободного и приобретенного двигательного поведения не наблюдали. При инъецировании фуросемида совместно с ГАМК были получены такие же изменения параметров двигательного поведения (свободного и выученного), как и у животных с введением одного фуросемида. Реакцию замирания не наблюдали. При применении фуросемида совместно с пикротоксином спонтанная двигательная активность не изменялась. У большинства крыс этой группы (как и у крыс с введением одного пикротоксина) приобретенный навык был утерян, но примерно у трети особей он сохранился, и латентный период рефлекса у них достоверно укорачивался, в среднем, до 2,2 – 2,5 с.; р = 0.01 (т.е., так же, как у животных с введением фуросемида). У всех крыс наблюдался гиперкинез, параметры которого достоверно не отличались от таковых при инъецировании одного пикротоксина. Таким образом, эффекты фуросемида оказалось много слабее других исследовнных нами фармакологических препаратов. Вероятно, для зрелых нейронов роль котранспортеров в поддержании ионного гомеостаза не столь велика, чтобы их блокада могла модифицировать эффекты пикротоксина.
При вызываемой пикротоксином дисфункции стриатума, очевидно, нарушаются системы циклических связей между структурами головного мозга, страдают, прежде всего, корково-подкорковые взаимоотношения. Большинство эфферентной импульсации из коры в стриатум опосредовано глутаматергической медиаторной системой, вклад которой в генез вызванной пикротоксином дисфункции стриатума мы и исследовали в дальнейших экспериментах. Одновременное введение в неостриатум вместе с пикротоксином глутамата вызвало нарушение реализации свободного и выученного двигательного поведения, аналогичное таковому при инъецировании одного пикротоксина (рис. 2). Наблюдали усиление гиперкинеза (табл. 3), который у крыс данной группы сопровождались тоническими судорогами скелетной мускулатуры лап и туловища (проявления, характерные для больших доз пикротоксина). При введении блокатора NMDA рецепторов глутамата МК801 совместно с пикротоксином спонтанная двигательная активность не изменялась. Реализация УРАИ снизилась (рис. 2), латентный период рефлекса не удлинялся. Было зарегистрировано ослабление пикротоксинового гиперкинеза (табл. 3).
При инъецирование блокатора 5 типа метаботропных рецепторов глутамата (МРГ) вместе с пикротоксином не было зарегистрировано изменений показателей свободного двигательного поведения, характерных для введения
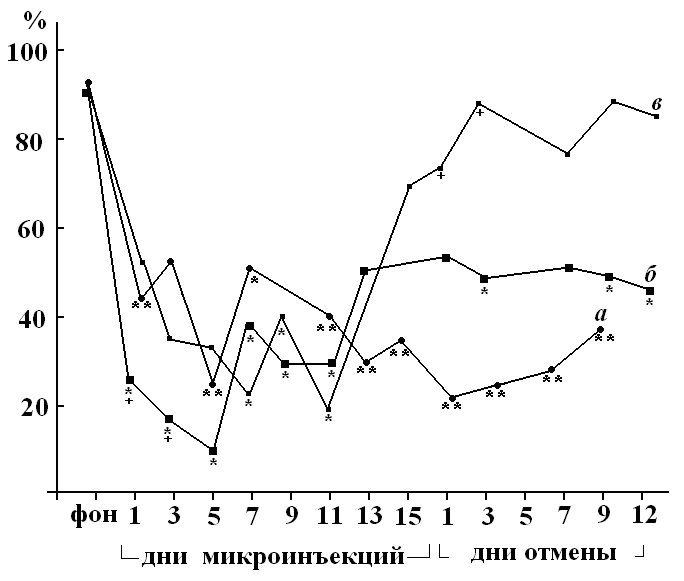
Рисунок 2. Динамика показателя точности реализации условного рефлекса активного избегания у крыс в челночной камере (средние значения по группе животных) на фоне хронического введения в ростральный неостриатум 2 мкг пикротоксина (а), 2 мкг пикротоксина совместно с 5 мкг глутамата (б) 2 мкг пикротоксина совместно с 5 мкг МК801 (в). Условные обозначения, как на рис. 1.
одного пикротоксина. Не было зарегистрировано нарушения реализации УРАИ, вызываемого пикротоксином (рис. 3), латентный период рефлекса достоверно укоротился до 2,5 – 3 с. Гиперкинез был зарегистрирован только у 55% животных. Латентный период гиперкинеза достоверно увеличился до 23 минут, его длительность сократилась, в среднем, до 83 минут. При добавлении EMQMCN к пикротоксину было зарегистрировано изменение параметров свободного и приобретенного двигательного поведения, характерных для введения одного пикротоксина. Гиперкинез воспроизводился в 85% случаев. Латентный период, в среднем по группе, составил 18 минут (статистически достоверно увеличился, по сравнению с таковым при введении одного пикротоксина), длительность гиперкинеза не отличалась от данного показателя при применении одного пикротоксина. Полученные результаты доказывают вовлечение глутаматеригической системы неостриатума в организацию двигательного поведения (свободного и условнорефлекторного), а также в генез пикротоксинового
Таблица 3
Параметры гиперкинеза у крыс на фоне микроинъекции медиаторных средств в область рострального неостриатума
| В 1 мкл раст-вора | Гиперкинез | Генерализация гиперкинеза | ||||
| Латен-тный период (мин) | Дли-тель-ность (мин) | Вос-производи-мость | Латент-ный период (мин) | Дли-тель-ность (мин) | Вос-производи-мость | |
| Пикро-токсин 2 мкг n=13 | 8.4 ± 2.8 | 88.4 ± 27.7 | 100% | 24.5 ± 12 | 60.0 ± 36.3 | 54% |
| Пикро-токсин 2 мкг Глута-мат 5 мкг n=11 | 5.4 ± 1.1 + | 97.6 ± 49.2 | 100% | 12.2 ± 6.0 | 33.8 ± 17.8 | 45% |
| Пикро-токсин 2 мкг МК-801 5 мкг n=11 | 11.2 ± 5.1 | 55 ± 22.7 + | 54% | Статисти-ческая обработка невозможна | Ста-тисти-ческая обра-ботка не- возможна | 27% |
| Пикро-токсин 2 мкг MTEP 5 мкг n=9 | 18.6 | 44.2 | 55% | Статисти-ческая обработка невозможна | Ста-тисти-ческая обра-ботка не- возможна | не зарегистри-рова-но |
| Пикро-токсин 2 мкг EMQMCN 5 мкг n=7 | 13 | 54.7 | 85% | Статисти-ческая обработка невозможна | Ста-тисти-ческая обра-ботка не-возможна | не зарегистрировано |
Условные обозначения: + - случаи достоверных отличий показателя в данный день опыта по сравнению с соответствующими значениями у животных с введением 2 мкг пикротоксина, сравнение двух рядов по Стьюденту, p = 0.01 - 0.05.
гиперкинеза. Ионотропные и метаботропные рецепторы глутамата обращаются к кальциевому гомеостазу нейрона. Это позволяет выдвинуть гипотезу о значимости кальциевого обмена для реализации двигательного поведения (свободного и приобретенного), а также для развития гиперкинеза.
Для проверки данной гипотезы нами был применен совместно с пикротоксином блокатор медленных кальциевых каналов верапамил. Спонтанная двигательная активность достоверно не изменилась. Реализация УРАИ снизилась, как и при введении одного пикротоксина, но восстановилась после отмены микроинъекций. Наблюдали усиление гиперкинеза: воспроизводимость составила 100%, латентный период, в среднем, составил 5,2 ± 3,1 мин, длительность колебалась от 50 мин до 133 мин. Стадия генерализации была зарегистрирована у 78 % животных. Усиление эффектов пикротоксина у животных данной группы, возможно, связано со способностью верапамила предотвращать гиперполяризацию
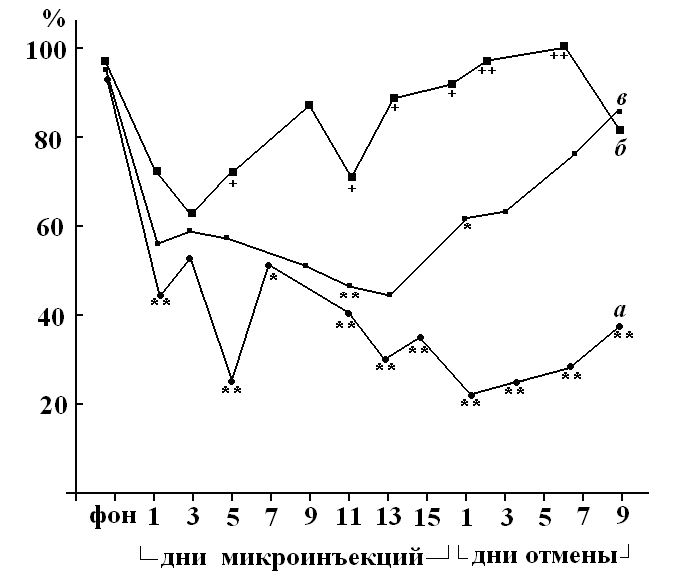
Рисунок 3. Динамика показателя точности реализации условного рефлекса активного избегания у крыс в челночной камере (средние значения по группе животных) на фоне хронического введения в ростральный неостриатум 2 мкг пикротоксина (а), 2 мкг пикротоксина совместно с 2 мкг МТЕР (б) и 2 мкг пикротоксина совместно с 2 мкг EMQMCM (в). Условные обозначения, как на рис. 1.
мембраны, вызванную активацией ГАМК А рецепторов. Это явление связано именно с блокадой входящего кальциевого тока, осуществляется независимо от пикротоксина и потенцирует его действие (Das et al., 2004).
Попытка инъецирования ЭДТА совместно с пикротоксином не оказало влияние на пикротоксин-индуцированное нарушение свободного и приобретенного двигательного поведения, а также на параметры гиперкинеза.
Роль модуляторов кальциевых каналов in vivo играют дивалентные катионы, роль некоторых из них (Zn2+ и Mg2+) в генезе стриарной дисфункции мы исследовали. При введении совместно с пикротоксином хлорида цинка в концентрации 1 М и 3 М не был полностью ликвидирован гиперкинез. Его воспроизводимость формально составила 30%. Латентный период и длительность не имели достоверных отличий от таковых при применении одного пикротоксина и составили соответственно: 12,6 и 86 мин. В действительности, из 180 произведенных в течение эксперимента инъекций, лишь 15 привели к развитию гиперкинеза. При использовании ацетата цинка параметры нормального и патологического двигательного поведения не отличались от таковых при введении одного пикротоксина. Оказываемый эффект цинка, вероятно, связан с тем, что в используемой концентрации (микрограммы) ионизированный цинк ингибирует NMDA и AMPA рецепторы глутамата (Dorofeeva, et al., 2006).
Многократные микроинъекции в неостриатум пикротоксина 1 молярного раствора MgCl2 не влияли на спонтанную двигательную активность. Уровень реализации УРАИ не снижался на протяжении всего цикла микроинъекций, латентный период рефлекса достоверно сократился до 2,0 - 2,4 с. Воспроизводимость гиперкинеза, в среднем, составила 33,3%, более детальный анализ показал, что из 150 произведенных за опыт инъекций только 5 привели к развитию гиперкинеза. Латентный период гиперкинеза увеличился до 37,2 минут, а длительность сократилась до 29,4 минут (рис. 4). Генерализация отсутствовала. Увеличение концентрации MgCl2 до 1,5 М также не изменило спонтанную двигательную активность. Воспроизводимость в целом по группе составила 62,5%. Латентный период увеличился до 42,3 мин, длительность – до 14 минут (рис. 4). Генерализации не было ни у одной крысы. Кроме того, использовали модификацию методики внутримозговых микроинъекций: в область рострального неостриатума вживляли не 2, а – 4 канюли, по 2 с каждой стороны (одна канюля из пары содержала раствор пикротоксина 2 мкг, другая – раствор MgCl2 1 М). Животные были разделены на 2 группы. Крысы первой группы получали сначала микроинъекции пикротоксина, а через 15 мнут – инъекции хлорида магния. Во второй группе порядок введения был противоположным. В первой группе ни в одном из параметров гиперкинеза не было зарегистрировано достоверных отличий от таковых при введении одного пикротоксина. Во второй группе животных воспроизводимость сократилась, латентный период удлинился, длительность не изменилась. Магний оказывает свое действие следующим образом. Во-первых, магний, блокируя кальциевые каналы, снижает исходный заряд мембраны (Kerr, Plenz, 2004). Во-вторых, за счет увеличения катионов в экстрацеллюлярном пространстве смягчает действие пикротоксина в отношении изменения заряда мембраны, т.к. потенциал на внутренней мембране непосредственно зависит от потенциала её внешней стороны. В-третьих, магний, как антагонист кальция, также способен связываться с кальмодулином (Haesleer, 2001). И, в-четвертых, магний способен влиять на канальный натриевый ток (Voetz et al., 2003). По-видимому, имеются еще механизмы действия ионов магния, но даже перечисленные пути влияния доказывают непосредственное вовлечение кальция в генез пикротоксин-индуцированного нарушения нормального (свободного и приобретенного) двигательного поведения и гиперкинеза, а также возможность его нивелирования магнием на начальных этапах – предотвращая развитие, а не блокируя. Таким образом, проведенные исследования доказывают критическую роль ионного гомеостаза для нормальной физиологии стриатума, а также значимость ионного дисбаланса в развитии нарушения условнорефлекторной деятельности и патологической формы двигательного поведения – гиперкинеза.
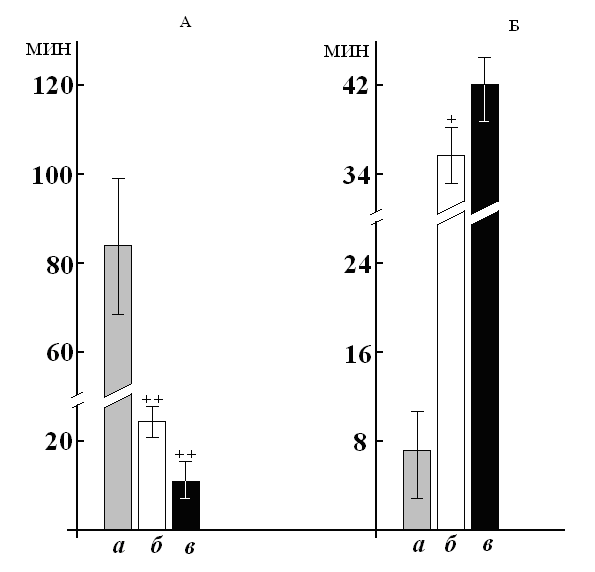
Рисунок 4. Длительность (А) и латентный период (Б) гиперкинеза на фоне хронических внутристриарных микроинъекций 2 мкг пикротоксина (а), 2 мкг пикротоксина совместно с 1 М MgCl2 (б) или с 1,5 М MgCl2 (в)
По оси ординат обозначено время (в минутах). + - случаи достоверных отличий показателя в данный день опыта по сравнению с соответствующими значениями у животных с введением 2 мкг пикротоксина (а), сравнение двух рядов по Стьюденту, p = 0.01 - 0.05; ++ - р < 0.01.
Проведенные эксперименты доказывают существенную роль неостриатума и его аминокислот – медиаторов в физиологии двигательного поведения, как в норме, так и при патологии. Функциональное (нейрональное, синаптическое, нейрохимическое) взаимодействие ГАМК- и глутаматергических систем неостриатума является важным, а иногда – ключевым в обеспечении организации нормального двигательного поведения, как свободного, так и условнорефлекторного. Практически любое воздействие на ГАМК-ергическую систему в наших экспериментах вызывало нарушение нормального двигательного поведения, как свободного, так и приобретенного. Одновременное фармакологическое влияние на глутамат-ергическую систему неостриатума модифицировало (ослабляло или усиливало) эти негативные влияния. Особенно четко такая взаимосвязь проявлялась на модели пикротоксинового гиперкинеза. Есть основания считать, что одним из элементов в деятельности двух исследуемых систем является кальциевый гомеостазис нейрона.
Гипотеза о вовлечении в генез пикротоксинового гиперкинеза кальция нашла свое подтверждение и в экспериментах с добавлением в инъецируемый раствор к пикротоксину препаратов, влияющих на кальциевый ток. Большинство используемых фармакологических агентов, так или иначе, влияющих на кальциевые процессы, оказало значимое влияние на параметры гиперкинеза. Причем, следует отметить, что препараты, стимулирующие входящий кальциевый ток, преимущественно, усиливали проявления гиперкинеза, а подавляющие – ослабляли независимо от типа каналов, на который оказывалось воздействие. Известно, что кальций участвует не только в поддержании нормального заряда клетки и создании возбуждающего постсинаптического потенциала, но также он является вторичным посредником многих рецепторных систем, кофактором многих ферментов, активным участником транспортных, синтетических и энергетических каскадов (Alvares et al., 1999). Пикротоксин, вероятно, не оказывает значимого воздействия на метаболическую роль кальция из-за короткого времени действия. Но изменяет его трансмембранный обмен, а, значит, увеличивает возбудимость нейронов. Однако следует учитывать, что добавление к инъецируемому раствору пикротоксина блокатора метаботропных рецепторов глутамата, действие которых обращено к обмену внутриклеточного кальция, нивелировало проявления гиперкинеза. Как именно меняются внутринейрональные кальциевые процессы в клетках стриатума при наших воздействиях сказать сложно. Данный вопрос требует детальных морфо-функциональных исследований.
При анализе полученных экспериментальных данных о роли кальциевого обмена необходимо учитывать целый ряд других факторов и обстоятельств, но главными из них остаются функциональные особенности самого объекта исследования – неостриатума. Хорошо известно, что он имеет сложную организацию межнейрональных связей (Graybel, 1998), деятельность которых главным образом обеспечивает тормозная ГАМК-ергическая медиаторная система. Ее принудительное выведение из состояния оптимальной активности с помощью пикротоксина результируется в появлении патологического двигательного поведения, аналогичного гиперкинезу человека при хорее Гентингтона. И в проявлениях нормальной деятельности неостриатума, и при ее сломе наблюдается отчетливая консервативность явлений, их многоплановость и этапность реализации.
Таким образом, полученные в нашей работе данные отражают исключительно важную и сложную организацию неостриарных ГАМК- и глутаматергических систем, демонстрируют роль данных медиаторных систем в поддержании баланса корково-подкорковых взаимоотношений, необходимых для организации двигательного поведения различной степени сложности, в норме и при патологии. Полученные результаты показывают, что нарушения реализации выученного поведения и моторные девиации в основе имеют изменения тормозных процессов, ведущих к нарушению кальциевого гомеостаза. Поддерживаемый мембранами, кальциевый гомеостазис в системе нейрон - глия, является основным нейро-молекулярным субстратом возбуждающих и тормозных процессов неостриатума, необходимых для выполнения важнейших регуляторных функций.
Выводы
1. ГАМК-ергическая медиаторная система неостриатума крыс участвует в организации нормального - свободного и приобретенного (избегательного) двигательного поведения. Фармакологическая блокада ГАМК А рецепторов неостриатума бикукуллином и пикротоксином нарушает реализацию условнорефлекторного избегательного поведения и изменяет спонтанную двигательную активность.
2. Избирательная блокада А типа рецепторов ГАМК, путем многократного введения в неостриатум крыс пикротоксина, приводит к дисфункции неостриатума, выражающегося в нарушении реализации нормального (свободного и условнорефлекторного - избегательного) двигательного поведения и в развитии хореомиоклонического гиперкинеза конечностей, головы и туловища. Фармакологическая блокада систем хлорных котранспортеров КСС-2 неостриатума фуросемидом не вызывает патологических изменений в поведении животных и не влияет на пикротоксин-индуцированные нарушения поведения.
3. За счет ионотропных и метаботропных рецепторов, глутаматергическая система принимает непосредственное участие в организации нормального свободного и условнорефлекторного (избегательного) двигательного поведения, а также вовлечена в генез, вызванного пикротоксином хореомиоклонического гиперкинеза. Глутамат усиливает, а антагонист NMDA рецепторов глутамата МК-801 (дизоцилпин) - ослабляет пикротоксиновый гиперкинез. Метаботропные рецепторы глутамата различны по своему влиянию на поведение крыс и проявления, вызванной пикротоксином двигательной патологии. Антагонист 5 типа метаботропных рецепторов глутамата МТЕР полностью предупреждал, вызванное пикротоксином нарушение реализации условнорефлекторного поведения и снизил воспроизводимость пикротоксинового гиперкинеза. У антагониста 1 типа метаботропных рецепторов глутамата (EMQMCM) такого влияния не обнаружено.
4. Введение в неостриатум ионов магния (до введения пикротоксина или одновременно с ним) предотвращает развитие пикротоксин-индуцированной дисфункции неостриатума в виде нарушения реализации нормального - свободного и приобретенного (избегательного) двигательного поведения и хореомиоклонического гиперкинеза. Применение ионизированного цинка не эффективно в предотвращении развития гиперкинеза, но способствует ослаблению его проявлений. Таким образом, насыщение среды неостриатума дивалентными катионами (антагонистами кальциевых каналов) не нарушает реализацию нормального свободного и условнорефлекторного двигательного поведения, но противодействует развитию гиперкинеза.
5. ГАМК- и глутаматергические системы неостриатума, взаимодействуя между собой, участвуют в организации двигательного поведения, а нарушение этих взаимодействий приводит к невозможности реализации стриатумом своих регуляторных функций и к появлению хореомиоклонического гиперкинеза, аналогичному гиперкинетическому синдрому при хорее Гентингтона. Нейро-молекулярной основой деятельности неостриатума является кальциевый гомеостазис, поддерживаемый как медиаторными системами, так и системами мембранных каналов.
Список работ, опубликованных по материалам диссертации.
1. Кутеева Е.Б., Шульман А.М., Бабичева М.А., Варшавская В.М. (Цверина В.М.) Реализация инструментального условного рефлекса у крыс на фоне гиперкинеза, вызываемого многократными микроиньекциями пикротоксина в неостриатум//Санкт-Петербургские научные чтения – 2001. Материалы межрегиональной научно-практической конференции с международным участием, СПб. 30-31 января 2001. тезисы докладов. С. 34-36.
2. Варшавская В.М. (Цверина В.М.), Иванова О.Н. Анализ влияния ГАМК и бикукуллина на двигательные и мнестические расстройства, вызываемые внутристриарным введением пикротоксина//Материалы 1-й международной научной интернет-конференции «Физиология человека и животных». Ставрополь. 2002. с.31-34
3. Варшавская В.М. (Цверина В.М.) Перспективы исследования ГАМКергической системы стриатума//Материалы 5-й всероссийской медико-биологической конференции молодых исследователей «Человек и его здоровье. 5-я. СПб. 21 апреля 2002 с. 31-32.
4. Варшавская В.М. (Цверина В.М.), Иванова О.Н., Якимовский А.Ф. Двигательное поведение крыс при раздельном и одновременном введении ГАМК-ергических препаратов в неостриатум//Российский Физиологический журнал им. Сеченова. 2002 Т. 88. N 10. C. 1317 – 1323.
5. Варшавская В.М. (Цверина В.М.), Иванова О.Г., Кабанов В.О., Москвин В.А., Кузнецова О.Г. Применение полимерного носителя - поливинилового спирта в моделировании нейродегенеративных заболеваний//Материалы конференции Санкт-Петербургский научный форум. 2003. Т. 1.с. 71-72.
6. Иванова О.Г., Изотова А.А., Варшавская В.М. (Цверина В.М.) Вклад ГАМК-ергической системы неостриатума в регуляцию двигательного поведения//Материалы конференции Санкт-Петербургский научный форум - 2003. Т. 1. с. 78-79.
7. Варшавская В.М. (Цверина В.М.), Кравцова И.А., Кузнецова О.Г. Применение полимерного носителя – поливинилового спирта – в моделировании симптома хореического гиперкинеза у крыс//Ученые записки СПбГМУ им акад. И.П.Павлова, 2003. Т. 4. Приложение, с. 11- 12.
8. Варшавская В.М. (Цверина В.М.), Кутеева Е.Б., Якимовский А.Ф. ГАМК- и дофаминергическая системы стриатума в регуляции двигательного поведения//Медицинский академический журнал. 2004. Т. 4. № 1 с. 21 – 28.
9. Якимовcкий A.Ф, Варшавская В.М. (Цверина В.М.) Глутаматергическая система неостриатума вовлечена в генез пикротоксинового хореомиоклонического гиперкинеза//Бюллетень экспериментальной биологии и медицины. 2004 Т. 138 N12 c. 604 – 607.
10. Варшавская В.М. (Цверина В.М.), Якубенко А. Роль кальциевого метаболизма в развитии стриарных гиперкинезов//Материалы XIХ съезда Всероссийского физиологического общества им. И.П.Павлова. Екатеринбург. 2004. с. 50 –51.
11. Варшавская В.М. (Цверина В.М.), Якимовcкий A.Ф. Верапамил усиливает гиперкинез, вызванный внутристриарным введением пикротоксина у крыс//Бюллетень экспериментальной биологии и медицины. 2005 Т. 140. N 11. c. 500 – 503.
12. Yakimovski A.F., Varszavskaja V.M. (Tsverina V.M.) The influence of calcium channels blockade on the rats picrotoxin-induced hyperkinesis//European neuropsycopharmacology. 2005. V. 15. P. 255.
13. Якимовский А.Ф., Варшавская В.М. (Цверина В.М.) Этиопатогенез хореи Гентингтона: итоги и перспективы экспериментального моделирования//Медицинский академический журнал. 2006. Т. 6. №2. С. 28 – 40.
14. Якимовский А.Ф., Варшавская В.М. (Цверина В.М.) Влияние фуросемида на сдвиги в поведении крыс, вызванные внутристриарным введением ГАМК и пикротоксина//Журнал высшей нервной деятельности. 2006. Т. 56. № 6. с. 782 - 787.
15. Якимовский А.Ф., Варшавская В.М. (Цверина В.М.) Ионы магния предотвращают развитие гиперкинеза. Вызванного введением пикротоксина в неостриатум крыс//Российский Физиологический журнал им. Сеченова. 2006 Т. 92. N 6. C. 723 – 731.

