Муниципальное образовательное бюджетное учреждение
« Сясьстройская средняя общеобразовательная школа №2 »
Научно-исследовательская работа
на тему:
«Качественный анализ мёда»
Автор: Вагичева Ксения 8 «А» класса
Руководитель: учитель химии
Бочкова Ирина Анатольевна
г. Сясьстрой
2012 год.
Содержание
Введение
Обоснование темы проекта и её актуальность
1. Аналитический обзор
1.1 История происхождения мёда
1.2 Древние мыслители о мёде
1.3 Химический состав мёда
1.4 Целебные свойства пчелиного мёда
1.5 Виды мёда
1.6 Физические свойства и сорта мёда
2.Экспериментальная часть
2.1 Физические свойства
2.2 Определение механических примесей
2.3 Определение крахмала или муки
3.4 Определение сахарного сиропа
3.5 Определение чистоты мёда
Результаты эксперимента
Выводы
Список литературы
Введение
Обоснование выбора темы проекта и ее актуальность:
«B мёде природа предоставила нам один из драгоценнейших своих даров, значение которого для человеческого организма в настоящее время слишком недостаточно познано или очень слабо познается».
Е. ЦАНДЕР
Натуральный мёд является не только ценным продуктом питания, но и обладает ярко выраженными лечебно-диетическими и профилактическими свойствами. Однако получение натурального пчелиного мёда связано со значительными материальными затратами. Высокие цены на натуральный мёд делают его весьма заманчивым объектом фальсификации (подделки). Поэтому определение качества мёда является очень актуальным.
Мне показалась очень интересной идея определения качества мёда, купленного недавно.
Цель работы: проверить качество меда.
Задачи:
1. Изучить литературу о способах добывания, свойствах и видах мёда.
2. Познакомится со способами определения качества мёда.
План работы над проектом
- Изучение литературы по темам:
- История происхождения мёда;
- Химический состав мёда;
- Виды мёда;
- Свойства и сорта мёда.
2. Выполнение практической части.
- Формулирование выводов.
- Оформление отчета о работе.
- Создание компьютерной презентации на основе полученных в работе материалов.
- Защита проекта.
1. Аналитический обзор
- История происхождения мёда
Мёд – продукт, собираемый пчелами с растений. Палеонтологические и археологические исследования показали, что пчелы существовали уже в третичном периоде, то есть примерно за 56 миллионов лет до появления первобытного человека.
На основании сохранившихся памятников древней культуры можно предположить, что первобытный человек охотился за медом как за вкусным и питательным продуктом. Наиболее древний памятник, изображающий добычу меда человеком, найден возле Валенсии (Испания), и он относится к каменному веку. На камне сохранилось изображение человека в окружении пчел, извлекающего мед. В египетских пирамидах были найдены сведения об использовании меда как продукта питания и лечебного средства.
В самом древнем медицинском папирусе, написанном 3500 лет назад, уже указывалось, что мед хорошо принимать в виде лекарства при ранах, «чтобы вызвать мочеиспускание» и «как средство для облегчения желудка». В этом же папирусе находятся описания изнурительных заболеваний, для лечения которых применялись лекарства, содержащие мед, а также примочки из меда. В другом древнеегипетском медицинском папирусе приводится много интересных сведений о лечении ран медом.
Добывание меда — старинный славянский промысел. Он назывался бортничеством, а люди, занимавшиеся им — бортниками.
Бортники берегли старые толстые деревья, в которых были дупла, и сами выдалбливали отверстия — борти, устраивая в них склады для медовых запасов.
Бортничество было нелегким занятием. Немало усилий, ловкости, труда требовалось от «древолаза». Ему приходилось забираться на высокие деревья, уметь «ладить» е пчелами, знать их нрав.
Торговля медом процветала в славянских землях так же, как и торговля мехами.
1.2 Древние мыслители о мёде
В Древней Греции мед считался ценнейшим даром природы. Греки полагали, что их боги бессмертны потому, что они питались так называемой пищей богов — амброзией, в состав которой входил мед. Они приносили богам в жертву фрукты, намазанные медом.
Около 3000 лет назад Гомер в «Илиаде» и «Одиссее» воспевал прекрасные свойства меда. В «Илиаде» он подробно рассказывает, как Агомеда готовила для греческих воинов освежающий медовый напиток — кикеон. Отец математики Пифагор утверждал, что достиг преклонного возраста — 90 лет — только потому, что постоянно употреблял в пищу мед.
Выдающийся философ Демокрит, употреблявший в пищу мед, прожил долгую жизнь. На вопрос, как нужно жить, чтобы сохранить здоровье, Демокрит обычно отвечал, что «для этого нужно орошать внутренность медом, а наружность маслом».
Гениальный врач и мыслитель древности Гиппократ, живший примерно 2500 лет назад, успешно применял мед при лечении многих заболеваний, а также сам употреблял его в пищу. Он говорил: «Мед, принимаемый с другой пищей, питателен и дает хороший цвет лица». Легенда гласит, что на могиле Гиппократа поселился рой пчел, который изготовлял мед особого качества. Это якобы вызвало массовое паломничество на могилу Гиппократа за целебным медом.
Аристотель утверждал, что мед обладает какими-то особыми свойствами, способствующими укреплению здоровья и продлению жизни человека.
Юлий Цезарь, присутствуя на обеде у сенатора Полия Румилия, праздновавшего столетнюю годовщину своего рождения, спросил, какое средство употреблял он для поддержания силы тела и духа, на что получил ответ: «Внутрь мед, наружно масло».
Авиценна рекомендовал употреблять в пищу мед для продления жизни. Он говорил: «Если хочешь сохранить молодость, то обязательно кушай мед». Авиценна считал, что людям в возрасте свыше 45 лет необходимо систематически употреблять мед, особенно с толченым грецким орехом, содержащим много жиров.
1.3 Химический состав мёда
Мёд представляет в основном смесь различных сахаров. Химический состав меда (в среднем) следующий:
- инвертированные сахара (глюкоза и фруктоза) - 75%,
- сахароза - 1,9%,
- декстрины - 5,2%,
- белковые вещества - 0,4%,
- органические кислоты - 0,1%,
- зольные вещества - 0,35%,
- вода – 16%.
1.4 Целебные свойства пчелиного мёда
Больше половины всей энергии, производимой в человеческом организме, образуется за счет вводимых с пищей сахаристых веществ. Однако различные сахара по-разному усваиваются нашим организмом. В то время как глюкоза поступает в кровь без всяких превращений (ее можно вводить непосредственно в кровь, что, как известно, широко практикуется при многих заболеваниях), обычный сахар (свекловичный, тростниковый) должен предварительно подвергнуться гидролизу (расщеплению) при помощи ферментов.
Плодовый сахар (фруктоза) усваивается значительно медленнее, чем глюкоза, но он в 2,5 раза слаще глюкозы и в 1,75 раза слаще тростникового или свекловичного сахара.
Мёд почти целиком состоит из смеси глюкозы и фруктозы и, кроме того, содержит ряд ферментов, необходимых для жизнедеятельности клеток, тканей и органов. В состав мёда входят: кальций, натрий, калий, магний, железо, хлор, фосфор, сера, йод, а некоторые сорта мёда содержат даже радий.
Интересно, что количество некоторых минеральных солей в мёде почти одинаково с содержанием их в сыворотке крови человека.
Есть в мёде и органические кислоты — яблочная, винная, лимонная, молочная, щавелевая, — а также белки и витамины. В мёде содержатся и биогенные стимуляторы, повышающие жизнедеятельность и сопротивляемость организма.
В мёде имеются витамины В2, В6, H, К, пантотеновая кислота, фолиевая кислота. И хотя перечисленных витаминов в меде очень мало, они имеют огромное значение, так как находятся в сочетании с другими весьма важными для организма веществами.
Очень большое значение имеют противобактериальные свойства мёда.
Есть основания предполагать, что древние египтяне и греки применяли пчелиный мёд для консервации трупов. Арабский врач и путешественник XII столетия Абдал-Латифа нашел в одной из Гизехских пирамид плотно закупоренный сосуд с медом, в котором находился вполне сохранившийся труп младенца.
Как известно, тело Александра Македонского, скончавшегося во время похода, при перевозке в столицу Македонии для погребения было погружено в мед, чтобы предотвратить разложение во время долгого пути. Такой же способ был применен при консервации трупов древних царей Агезиполиса и Агезилая и иудейского царя Аристобула.
Древние греки и римляне использовали пчелиный мед для консервирования свежего мяса. При этом мясо не только оставалось свежим, но даже не изменяло своего естественного вкуса. Только постепенно теряло воду, отдавая ее в мёд.
Противобактериальные свойства меда изучались на белых мышах, которых заражали стрептококком. Опыты показали, что прикладывание медовых повязок останавливает рост бактерий и убивает их.
Эти явления получили различные объяснения. Одни объясняют эти свойства высокой концентрацией сахара, другие полагают, что они зависят от сочетания в меде ферментов и сахара. Некоторые исследователи открыли в меде антибактериальные вещества — ингибиторы (от латинского слова «ингибио» — останавливать, угнетать), наличием которых и объясняют обеззараживающие свойства меда.
Интересно, что в отличие от многих пищевых продуктов мед никогда не плесневеет. Несмотря на то, что в состав меда входят белки и углеводы, витамины, минеральные и другие вещества, необходимые для жизни и развития любой живой клетки, плесневые грибки, которыми специально заражали мед, погибали в нем.
1.5 Виды мёда
По происхождению различают мед нектарный и падевый, по консистенции - жидкий и засахаренный. Нектарный (цветочный) мед пчелы собирают с цветов, падевый - с пади животного происхождения - слизистых выделений тли.
Цветочный мед имеет следующие отличия от падевого:
1. Ясно выраженный аромат цветков, с которых он получен;
2. Наличие пыльцевых зерен разных растений, с которых он получен;
3. Различные цвета от бесцветного до коричневого (с преобладанием желтых оттенков).
Падевый мёд отличается от цветочного мёда по следующим показателям:
1. Присутствие только ветроопыляемых растений;
2. Цвет от янтарного до темно-бурого и даже черного;
3. Консистенция вязкая тягучая, липкая в 2-3 раза превосходит показатели цветочного меда при той же температуре.
Падевый мед допускается к использованию в пищу, хотя питательные достоинства его ниже, чем цветочного меда. Для пчел мед с примесью значительного количества пади токсичен.
Жидкий мёд ценнее засахаренного, кристаллизация происходит при длительном хранении мёда. Подогревание мёда с целью растворения кристаллов разрушает ферменты и гормоны. Подогретый выше 62о мёд теряет лечебные свойства.
1.6 Физические свойства и сорта мёда
Цвет мёда зависит от растений, с которых он собран, времени года и высоты местности над уровнем моря.
Консистенция мёда сиропообразная. Мёд, собранный в сырую погоду, жиже мёда, собранного в сухую погоду. Свежий мёд прозрачен, при стоянии мутнеет и выкристаллизовывается.
Запах мёда ароматный, напоминает запах растений, с которых он собран. Старый мёд менее ароматен.
Вкус мёда сладкий со слабокислым привкусом. Некоторые сорта мёда имеют слабогорький привкус.
Сорт мёда можно точно определить по цвету, аромату и вкусу. Многие сорта мёда отличаются один от другого не только основной окраской, но и множеством самых разнообразных оттенков. Известны сорта мёда совершенно бесцветные — прозрачные как вода.
Светлый мёд принадлежит к лучшим сортам. Но вообще имеются данные, согласно которым мёд темной окраски содержит больше минеральных солей, главным образом железа, меди, марганца, и поэтому должен считаться более ценным для организма, чем светлый.
Для некоторых сортов мёда характерен исключительно приятный, нежный аромат (цитрусовый, акациевый, липовый мёд). Но встречаются сорта мёда с неприятным запахом (табачный мед и другие).
Из большого числа известных в настоящее время сортов пчелиного мёда приведу только несколько.
- Акациевый мёд — один из самых лучших сортов мёда. В жидком виде этот мёд прозрачен, и при засахаривании становится белым и кристаллическим, напоминает снег.
- Гречишный мёд темнее по цвету — от темно-желтого с красноватым оттенком до темно-коричневого, отличается своеобразным ароматом и специфическим вкусом. В гречишном мёде значительно больше белков и железа, чем в светлых сортах мёда. В связи с этим его рекомендуют принимать при малокровии.
- Липовый мёд принадлежит к одному из лучших сортов. Свежеоткачанный липовый мёд очень душист, обычно прозрачен, по цвету — светло-желтый или зеленоватый. В народной медицине липовый мёд широко применяют при простудных заболеваниях и особенно как потогонное средство.
- Малиновый мёд обладает нежным вкусом — он словно тает во рту. Этот мед светлого белого цвета, с очень приятным ароматом.
- Яблоневый мёд — светло-желтый, исключительно приятного аромата и нежной сладости.
2. Экспериментальная часть
2.1 Физические свойства
- Определила цвет
- Отметила консистенцию мёда
- Определила запах
- Попробовала мёд на вкус
2.2 Определение механических примесей
- Поместила в пробирку около 1 г мёда и добавила 6 мл воды.
- Раствор мёда прозрачен и не содержит взвешенных и осевших на дно посторонних частиц.
2.3 Определение крахмала или муки
- Поместила в пробирку около 1 г меда и добавила 2 мл воды. Слегка подогрела раствор.
- Добавила 4 капли раствора йода. Появления синей окраски не произошло.
2.4 Определение сахарного сиропа (реакция на фермент диастазу) (Чем больше этого фермента, тем большей биологической активностью обладает мёд)
- Поместила в пробирку около 2 г меда и добавила 10 мл воды.
- Добавила 1 мл 1%-ного раствора крахмала. Размешала жидкость.
- Выдержала смесь на водяной бане при температуре 40оС 1 час.
- Охладила раствор и добавила 10 капель йода.
2.5 Определение чистоты меда
- Растворила 2 г мёда в 10 мл воды. Смесь отфильтровала. Фильтрат разделила на 2 части. В одну часть фильтрата прилила раствор нитрата серебра, а в другую хлорида бария.
- Растворила 3 г меда в 10 мл воды. Раствор разделила на 2 части. В одну часть добавила немного нашатырного спирта, а в другую несколько капель концентрированной соляной кислоты.
Результаты
| Анализируемое свойство | Результат | Заключение |
| 1. Физические свойства: а) цвет б) консистенция в) запах г) вкус | а) желтый б) без посторонних включений, вязкая в) приятного аромата, без постороннего запаха г) приятный, без постороннего привкуса | Мёд нектарный (цветочный),свежий, собран в сухую погоду |
| 2. Механические примеси | Мёд прозрачен и не содержит взвешенных или осевших частиц | Механические примеси отсутствуют |
| 3. Крахмал или мука | Отсутствие синей окраски | Мёд не содержит крахмал или муку |
| 4. Сахарный сироп | Мёд окрасился в синий цвет | Значит, в нём нет диастазы |
| 5. Чистота меда: реакция с нитратом серебра реакция с хлоридом бария | Мед не дал осадков с этими реактивами | Мёд чистый |
| 6. Органические красители | Окраска не изменилась | В мёде нет примеси органических красителей |
Выводы
- В результате проделанной работы я пришла к выводу, что мёд натуральный.
- Отсутствие диастазы можно объяснить несколькими причинами:
- недобросовестный пчеловод активно закармливал пчёл сахаром;
- на показатель диастазы влияют условия хранения и расфасовки мёда. Так, например, при фасовке (обычно в стеклянную тару) мёд нагревают выше 50 °С. При этом диастаза частично или полностью деактивируется.
- диастаза (как и все ферменты) разлагается со временем: в мёде которому больше 5 лет диастаза практически не содержится
3. Мёд зрелый с нормальной влажностью, так как навёртывается на ложку и не стекает с нее (незрелый мёд с повышенным содержанием воды стекает, как бы быстро мы ни вращали ложку).
Список литературы
- Куприянова Н.С. Лабораторно-практические работы по химии. 10-11. – М.: Гуманитарный издательский центр ВЛАДОС, 2007
- http://supercook.ru/honey/honey-01.html: Из истории мёда
- http://ipchepurnoy.narod.ru/Expertize.html: Экспертиза качества пчелиного мёда
- http://ru.wikipedia.org/wiki/Мёд: Википедия
- http://www.youtube.com/watch?v=EBNIySWpig0&feature=player_embedded: Видеоролик «Биологическая активность мёда (показатель диастаза)»
Муниципальное образовательное бюджетное учреждение
« Сясьстройская средняя общеобразовательная школа №2 »
Научно-практическая работа
на тему:
Получение свекловичного сахара
Автор: Баклагина Дарья 8 «А» класса
Руководитель: учитель химии
Бочкова Ирина Анатольевна
г. Сясьстрой
2012 год.
Содержание
Введение
Обоснование темы проекта и её актуальность
1. Аналитический обзор
1.1 Распространение сахарозы в природе
1.2 Химическое строение и свойства сахарозы
1.3 История производства сахара
1.4 Развитие сахароварения в России
1.5 Технология процесса сахароварения
2.Экспериментальная часть
2.1 Получение свекловичного сока
2.2 Очистка свекловичного сока
2.3 Рафинирование сахара
Выводы
Список литературы
Введение
Обоснование выбора темы проекта и ее актуальность:
В самых древнейших источниках упоминается о питании медом. Александр Македонский со своей армией шел через Персию в Индию, и здесь греки обнаружили "камыш, который производит мед без помощи пчел". Это был уже тогда культивируемый в Индии сахарный тростник. Оттуда сахарный тростник распространился через Персию в Египет и стал вскоре известен всему миру. Арабы научились из сока сахарного тростника изготавливать кристаллический сахар и уже в ХVШ веке имели высокоразвитую сахарную индустрию. Они собирали горячую кристаллическую кашицу в кули из пальмовых листьев; так возникла проформа сахарных голов.
Мне показалась проблема получения сахара очень интересной, и я решила воспроизвести технологический процесс сахароварения, который проводится в той же последовательности, как на заводах.
Цель работы: получить сахар из красной свеклы.
Задачи:
1. Изучить литературу о выделении сахара из сахарной свеклы.
2. Воспроизвести процесс сахароварения в лаборатории.
План работы над проектом
- Изучение литературы по темам:
- История сахароварения;
- Развитие сахароварения в России;
- Рост потребления сахара в начале ХХ века;
- Научные основы технологического процесса сахароварения.
2. Выполнение практической части.
- Формулирование выводов.
- Оформление отчета о работе.
- Создание компьютерной презентации на основе полученных в работе материалов.
- Защита проекта.
1. Аналитический обзор
1.1 Распространение сахарозы в природе
Сахароза находится во многих растениях, в том числе в моркови, дыне, кукурузе, клене, пальме и т.д. Но больше всего ее в соке сахарного тростника и сахарной свеклы. Тростниковый сахар является одним из важнейших пищевых продуктов, обладает консервирующими свойствами, широко распространен в растительном мире. Листья и семена растений всегда содержат небольшие количества тростникового сахара. Он находится также в плодах, например, в абрикосах, персиках, грушах, ананасе и пр. В особенно большом количестве, он содержится в корнеплодах сахарной свеклы (до 27%, в среднем 16—20%), в стеблях сахарного проса (сорго) и сахарного тростника (в соке 14—26%), из которых он и добывается заводским способом.
- Химическое строение и свойства сахарозы
Сахароза - бесцветное кристаллическое вещество, хорошо растворимое в воде.
| Направления исследования | Результаты исследования | Уравнения реакций |
| 1. Образование сахарозы в природе | Образуется сахароза в листьях растений в процессе фотосинтеза | Фотосинтез: 6СО2 + 6Н2О = С6Н12О6 + 6О2 |
| 2. Строение молекулы сахарозы, ее физические свойства и биологическая роль | Сахароза образована остатками глюкозы и фруктозы, которые являются незаменимым источником энергии в обмене веществ живых организмов. Следовательно, и сахароза – источник энергии. Однако избыток потребления сахара является причиной диабета и кариеса, заболеваний сердечнососудистой системы | Молекулярная формула: С12Н22О11. Структурная формула:  |
Сахар, полученный из сахарного тростника и сахарной свеклы, имеет один и тот же состав – это сахароза. Несколько различный вкус свекловичного и тростникового сахара зависит от технологии изготовления и степени очистки.
1.3 История производства сахара
Люди еще до начала новой эры использовали сахар, полученный из сахарного тростника. Сахарный тростник раздавливали каменными валами, и добытый сок упаривали до кристаллизации сахара. Для очистки сахар растворяли в воде, добавляли молоко, упаривали, снимали пену и, охлаждая раствор, выделяли уже чистый сахар. Тем не менее, на протяжении всего Средневековья сахар считался более лакомством, чем продуктом питания. Только Фридрих Великий, Мария Терезия и Иосиф II - "просвещенные деспоты" Нового времени, облегчили ввоз сахара через таможни, и сахарная индустрия пережила неожиданный подъем. Тогда же стали рафинировать коричневый тростниковый сахар и вырабатывать из него белый кристаллический.
Немецкий химик, член Берлинской академии наук Андреас
Сигизмунд Маргграф (1709 – 1782) в 1747 году обнаружил, что в сахаристой свекле содержится сахар, аналогичный тростниковому. Ученик Маргграфа, француз по происхождению, Ашар в своем имении в Силезии под Берлином проводил опыты по выращиванию сахаристой свеклы. Весьма преуспев в этом, Ашар создал промышленный способ получения сахара из особой разновидности свеклы, которая содержала от 7 до 10% сахара и потому получила название сахарной свеклы. Однако это производство не получило развития из-за технических трудностей, вызвавших высокую себестоимость сахара.
И все же, несмотря на все остроумие немецких химиков и инженеров того времени, развитие сахарной индустрии не встало бы на тот пусть, на котором она находится сегодня, если бы не изменение международной обстановки. А именно, Наполеон подвергся континентальной блокаде, была прервана поставка тростникового сахара в Европу. Поэтому выращивание сахарной свеклы стало интенсивным, и уже в 1811 году существовало много сахарных фабрик в странах Европы. И развитие этого производства шло быстрыми темпами, т.к. применялись новые технологии, что в сравнении с примитивным производством тростникового сахара было явно шагом вперед.
Потребление сахара (в кг.) на душу населения

1.4 Развитие сахароварения в России
К концу XVIII века производством кристаллического сахара из свеклы заинтересовались всерьез и в России, о чем свидетельствует изданная в конце 1799 года Медицинской коллегией монография "Способ заменять иностранный сахар домашними произведениями".
Первые в России опыты получения свекловичного сахара проводил в 1799-1801 годах Яков Степанович Есипов, который в своем подмосковном имении Никольском разработал технологию и создал оборудование для переработки свеклы. Через год, в селе Алябьеве, Есипов на паях с генералом Е.И. Бланкеннагелем, построили первый в России завод, выпускающий сахар, способный конкурировать с тростниковым.
Бурное развитие сахарная промышленность получила с конца тридцатых годов Х1Х столетия. В 1860 - 1861 году в Российской Империи насчитывалось уже 399 действующих заводов.
Одновременно с ростом производства сахара велась работа по селекции сахарной свеклы, были получены сорта, содержащие 15-20% сахарозы. Для сравнения напомним, что в столовых сортах свеклы содержится в среднем 3% сахарозы.
Дальнейшая история отечественного сахароварения связана с именами двух династий:
Братья Терещенко в начале 80-х годов владели крупнейшими предприятиями России - Михайловским и Тульским сахарорафинадными заводами.
Сахар Боткиных отличался высоким качеством, был очень популярен внутри страны и экспортировался в европейские страны.
1.5 Технология процесса сахароварения
В промышленности тростниковый сахар получают из сахарной свеклы следующим образом:
- Сахарную свеклу разрезают на тонкие стружки и извлекают сахар и другие растворимые вещества горячей водой (диффузия).
- Получаемый раствор, содержащий 12—15% сахара, обрабатывают известью (дефекация). При этом нейтрализуются и частью осаждаются свободные кислоты (щавелевая, лимонная), а также фосфаты, белковые и красящие вещества свеклы.
- Раствор, содержащий избыток извести, обрабатывают углекислотой (сатурация).
- Образующийся карбонат кальция, адсорбировавший примеси, отделяют на вакуум-фильтре, после чего раствор подвергают повторной дефекации и сатурации.
- Очищенный раствор упаривают в вакуум-аппаратах. Сахар выделяется из охлажденного раствора в виде мелких кристаллов, которые центрифугированием отделяют от маточного раствора.
- Повторным сгущением и кристаллизацией маточного раствора
выделяют остаток сахара, после чего остается некристаллизующаяся густая масса, называемая кормовой патокой или мелассой. В мелассе содержится некоторое количество сахара, а также различные безазотистые и азотсодержащие примеси.
- Полученный таким образом сырой сахарный песок подвергают очистке (рафинированию). Для этого его растворяют в воде, раствор фильтруют через древесный активированный уголь и упаривают до кристаллизации.
| Схема промышленного способа получения сахара из сахарной свеклы | 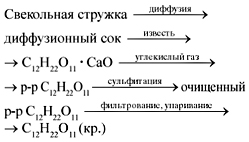 | СаСО3 = СаО + СО2, С12Н22О11 + СаО = С12Н22О11 • СаО, С12Н22О11 • СаО + СО2 = = С12Н22О11 + СаСО3 |
2. Экспериментальная часть
2.1 Получение свекловичного сока
- Вымыла и мелко нарезала свеклу.
- Собрала прибор для получения свекловичного сока.
- Налила в колбу 100 мл воды, и поместила в нее свеклу.
- Закрыла колбу пробкой с трубкой (в ней концентрировалась испаряемая вода). Прокипятила раствор в течение 30 минут на водяной бане (температура 70 – 75 0 С). Слила жидкость во вторую колбу.
2.2 Очистка сока
- К свекловичному соку добавила 1 г известкового молока и нагревала свекловичный раствор 10-15 минут на водяной бане (температура 60-700 С), все время, помешивая раствор. Добавление известкового молока называется дефекацией. Примеси кислот и белков, выпали в осадок при нагревании с известью. Сахар при действии извести перешёл в растворимый сахарат кальция.
- Слила сахарат с осадка и в горячий раствор пропустила углекислый газ. Пропускание углекислого газа называется сатурацией. Углекислый газ реагирует с известью; получается свободный раствор сахара и осадок карбоната кальция.
- Собрала прибор для фильтрования. Сатурацию проводила 3 раза, каждый раз отфильтровывала осадок карбоната кальция и снова пропускала углекислый газ. Получила очищенный сок, содержащий 5-10% сахара.
- Упарила раствор на водяной бане до уменьшения объёма сока в 5-6 раз. Получился густой сироп, содержащий 60-70% сахара
- Оставила сироп кристаллизоваться. Образовались неочищенные кристаллы сахара. Сироп кристаллизовался 6 суток.
- Слила раствор (патока) над кристаллами.
- Растворила кристаллы сахара в небольшом количестве воды. Фильтрат снова упарила на водяной бане и оставила кристаллизоваться. Получила очищенный сахар.
Выводы.
- В результате проделанной работы были получены кристаллы сахара. Сахар получали из обычной свеклы, поэтому количество его оказалось незначительным. На производстве из 1 кг сахарной свеклы можно получить 150г сахара, то есть с одной свеклы – 2 чайные ложки сахара. В нашей работе из одной красной свеклы было получено пол ложки сахара.
- Изучив теоретический материал, я узнала, что особенностью территориального размещения сахарных заводов является их жёсткая привязка к посевным площадям сахарной свеклы, поскольку перевозка свеклы на значительные расстояния экономически неэффективна.
- Сахарная свекла плохо храниться, около 3-4 месяцев. Поэтому российские заводы работают большую часть года на импортном тростниковом сырце, только осенью переходят на сахарную свёклу.
- Производство сахара – это полностью автоматизированное, непрерывное производство (работают в 3 смены), условия труда тяжёлые, т.к. на производстве большая влажность и высокая температура.
- Это безотходное производство - отходы сахарной промышленности (жом, патока (меласса), дефекационная грязь) могут быть использованы как удобрения, в некоторых случаях — и как корм для скота.
Список литературы
- http://www.xumuk.ru : Химическая энциклопедия;
- http://ru.wikipedia.org/wiki: Википедия;
- Куприянова Н.С. Лабораторно-практические работы по химии. 10-11. – М.: Гуманитарный издательский центр ВЛАДОС, 2007
- http://www.youtube.com/watch?v=qX95dhNtvAU: Видеоролик «Производство сахара из сахарной свеклы»
- http://www.youtube.com/watch?v=llr1foG5BZc: Видеоролик «Как это делается»
- http://www.youtube.com/watch?v=8Aumf8OaIdk: Видеоролик «Сахарная свекла»
Муниципальное образовательное бюджетное учреждение
« Сясьстройская средняя общеобразовательная школа №2 »
Научно-практическая работа
на тему:
«Выращивание кристаллов»
Автор: Кондратьев Филипп 8 «Б» класса
Руководитель: учитель химии
Бочкова Ирина Анатольевна
г. Сясьстрой
2012 год.
Содержание
Введение
Обоснование темы проекта и её актуальность
1. Аналитический обзор
1.1 Что такое кристалл
1.2 Формы кристаллов
1.3 Способы образования кристаллов
1.4 Применение кристаллов
2.Экспериментальная часть
2.1 Приготовление маточного раствора
2.2 Выращивание затравки
2.3 Выращивание монокристаллов
3.4 Сохранение кристаллов
Результаты эксперимента
Выводы
Список литературы
Введение
Обоснование выбора темы проекта и ее актуальность:
"Почти весь мир кристалличен. В мире царит кристалл и его твердые,
прямолинейные законы"
Академик Ферсман А.Е.
Из книг я узнал, что кристаллы получают в лаборатории, но бывают они и в природе. Например, снежинки, морозные узоры на стеклах окон и иней, украшающий зимой голые ветки деревьев. Многие кристаллы – продукты жизнедеятельности организмов. Способностью наращивать на инородных телах, попавших в раковину, перламутр, обладают некоторые виды моллюсков. Через 5-10 лет образуется жемчуг. Кристаллами являются алмазы, рубины, сапфиры и другие драгоценные камни. За сутки в лаборатории можно вырастить кристалл соли массой около 1 килограмма. Кристаллы широко применяются в науке, промышленности, оптике, электронике.
Меня очень заинтересовала эта тема, и я решил вырастить кристаллы солей в домашних условиях.
Цель работы: Научиться выращивать кристаллы.
Задачи:
1. Изучить литературу о кристаллах и способах их выращивания.
2. Вырастить монокристаллы различных солей.
План работы над проектом
- Изучение литературы по темам:
- Что такое кристаллы;
- Виды кристаллов;
- Значение кристаллов для человека;
- Выращивание кристаллов в домашних условиях.
- Применение кристаллов
2. Выполнение практической части.
- Формулирование выводов.
- Оформление отчета о работе.
- Создание компьютерной презентации на основе полученных в работе материалов.
- Защита проекта.
- Аналитический обзор
- Что такое кристалл
Кристалл — это твердое состояние вещества. Он имеет определенную форму и определенное количество граней вследствие расположения своих атомов. Все кристаллы одного вещества имеют одинаковую форму, хоть и могут отличаться размерами.
Каждому химическому веществу, находящемуся при данных термодинамических условиях в кристаллическом состоянии, соответствует определенная кристаллическая структура.
В природе существуют сотни веществ, образующих кристаллы. Вода — одно из самых распространенных из них. Замерзающая вода превращается в кристаллы льда или снежинки.
Минеральные кристаллы тоже образуются в ходе определенных породообразующих процессов. Огромные количества горячих и расплавленных горных пород глубоко под землей в действительности представляют собой растворы минералов. Когда массы этих жидких или расплавленных горных пород выталкиваются к поверхности земли, они начинают остывать.
Они охлаждаются очень медленно. Минералы превращаются в кристаллы, когда переходят из состояния горячей жидкости в холодную твердую форму. Например, горный гранит содержит кристаллы таких минералов, как кварц, полевой шпат и слюда. Миллионы лет тому назад гранит был расплавленной массой минералов в жидком состоянии. В настоящее время в земной коре имеются массы расплавленных горных пород, которые медленно охлаждаются и образуют кристаллы различных видов.
1.2 Формы кристаллов
Кристаллы могут иметь всевозможные формы. Все известные в мире кристаллы могут быть разделены на 32 вида, которые в свою очередь могут быть сгруппированы в шесть видов. Кристаллы могут иметь и разные размеры. Некоторые минералы образуют кристаллы, которые разглядеть можно только с помощью микроскопа. Другие же образуют кристаллы, вес которых составляет несколько сотен фунтов.
Кристаллическими считаются вещества, атомы которых расположены регулярно, так что образуют правильную трёхмерную решётку, называемую кристаллической. Кристаллам ряда химических элементов и их соединений присущи замечательные механические, электрические, магнитные и оптические свойства.
Русский учёный Е.С.Фёдоров установил, что в природе может существовать только 230 различных пространственных групп, охватывающих все возможные кристаллические структуры. Большинство из них (но не все) обнаружены в природе или созданы искусственно. Кристаллы могут иметь форму различных призм, основанием которых могут быть правильный треугольник, квадрат, параллелограмм и шестиугольник.

Примеры простых кристаллических решёток: 1 – простая кубическая; 2 – гранецентрированная кубическая; 3 – объёмно-центрированная кубическая; 4 – гексагональная
Кристаллические решётки металлов часто имеют форму гранецентрированного (медь, золото) или объёмно-центрированного куба (железо), а также шестигранной призмы (цинк, магний).

В основе классификации кристаллов и объяснения их физических свойств может лежать не только форма элементарной ячейки, но и другие виды симметрии, например, поворот вокруг оси. Осью симметрии называют прямую, при повороте вокруг которой на 360° кристалл несколько раз совмещается сам с собой. Число этих совмещений называют порядком оси. Существуют кристаллические решётки, обладающие осями симметрии 2-го, 3-го, 4-го и 6-го порядков. Возможна симметрия кристаллической решётки относительно плоскости симметрии, а также комбинация разных видов симметрии.
Большинство кристаллических тел являются поликристаллами, т.к. в обычных условиях вырастить монокристаллы достаточно сложно, этому мешают всевозможные примеси. Современная техника нуждается в кристаллах высокой степени чистоты, поэтому перед наукой встал вопрос о разработке эффективных методов искусственного выращивания монокристаллов различных химических элементов и их соединений.
Выращивание кристаллов - это хобби, приверженцы которого создают собственные клубы и участвуют в соревнованиях. Выращивание кристаллов - это сложный технологический процесс, поэтому, чем дольше ждёшь, тем более впечатляющими будут результаты.
1.3 Способы образования кристаллов
Существует три способа образования кристаллов: кристаллизация из расплава, из раствора и из газовой фазы. Примером кристаллизации из расплава может служить образование льда из воды (ведь вода – это расплавленный лёд), а также образования вулканических пород. Пример кристаллизации из раствора в природе – выпадение сотен миллионов тонн соли из морской воды. При охлаждении газа (или пара) электрические силы притяжения объединяют атомы или молекулы в кристаллическое твёрдое вещество – так образуются снежинки.
Наиболее распространёнными способами искусственного выращивания монокристаллов являются кристаллизация из раствора и из расплава. В первом случае кристаллы растут из насыщенного раствора при медленном испарении растворителя или при медленном понижении температуры.

Если твёрдое вещество нагреть, оно перейдёт в жидкое состояние – расплав. Трудности выращивания монокристаллов из расплавов связаны с высокой температурой плавления. Например, для получения кристалла рубина нужно расплавить порошок оксида алюминия, а для этого его нужно нагреть до температуры 2030 °С.
1.4 Применение кристаллов
Применения кристаллов в науке и технике так многочисленны и разнообразны. Приведу несколько примеров.
Кристаллы сыграли важную роль во многих технических новинках 20 в. Некоторые кристаллы генерируют электрический заряд при деформации. Применение изготовления генераторов радиочастоты со стабилизацией кварцевыми кристаллами. Заставив кварцевую пластинку вибрировать в электрическом поле радиочастотного колебательного контура, можно тем самым стабилизировать частоту приема или передачи.
Алмаз.
Самый твердый и самый редкий из природных минералов - алмаз. Благодаря своей исключительной твердости алмаз играет громадную роль в технике. Алмазными пилами распиливают камни. Колоссальное значение имеет алмаз при бурении горных пород, в горных работах. В граверных инструментах, делительных машинах, аппаратах для испытания твердости, сверлах для камня и металла вставлены алмазные острия. Алмазным порошком шлифуют и полируют твердые камни, закаленную сталь, твердые и сверхтвердые сплавы. Сам алмаз можно резать, шлифовать и гравировать тоже только алмазом. Наиболее ответственные детали двигателей в автомобильном и авиационном производстве обрабатывают алмазными резцами и сверлами.
Корунды.
Рубин и сапфир относятся к самым красивым и самым дорогим из драгоценных камней. Кроваво-красный рубин и лазорево-синий сапфир - это один и тот же минерал - корунд, оксид алюминия А12О3. Разница в цвете возникла из-за очень малых примесей.
Скромный, невзрачный бурый корунд, непрозрачный, мелкий - наждак, которым чистят металл, из которого делают наждачную шкурку. Корунд со всеми его разновидностями - это один из самых твердых камней на Земле, самый твердый после алмаза. Корундом можно сверлить, шлифовать, полировать, точить камень и металл. Из корунда и наждака делают точильные круги и бруски, шлифовальные порошки.
Вся часовая промышленность работает на искусственных рубинах. На полупроводниковых заводах тончайшие схемы рисуют рубиновыми иглами. В текстильной и химической промышленности рубиновые нитеводители вытягивают нити из искусственных волокон, из капрона, из нейлона.
Новая жизнь рубина - это лазер или оптический квантовый генератор (ОКГ). В 1960г. был создан первый лазер на рубине. Оказалось, что кристалл рубина усиливает свет. Лазер светит ярче тысячи солнц.
Мощный луч лазера громадный мощностью. Он легко прожигает листовой металл, сваривает металлические провода, прожигает металлические трубы, сверлит тончайшие отверстия в твердых сплавах, алмазе. Эти функции выполняет твердый лазер, где используется рубин, гранат с неодитом. В глазной хирургии применяется чаще всего неодиновые лазеры и лазеры на рубине.
Сапфир прозрачен, поэтому из него делают пластины для оптических приборов. Основная масса кристаллов сапфира идет в полупроводниковую промышленность.
Кварц.
Кремень, аметист, яшма, опал, халцедон — все это разновидности кварца. Мелкие зернышки кварца образуют песок. А самая красивая, самая чудесная разновидность кварца - это и есть горный хрусталь, т.е. прозрачные кристаллы кварца. Поэтому из прозрачного кварца делают линзы, призмы и др. детали оптических приборов.
Особенно удивительны электрические свойства кварца. Если сжимать или растягивать кристалл кварца, на его гранях возникают электрические заряды. Это - пьезоэлектрический эффект в кристаллах. Пьезоэлектрические кристаллы широко применяются для воспроизведения, записи и передачи звука.
Поляроид.
В технике также нашел своё применение поликристаллический материал поляроид.
Поляроид - это тонкая прозрачная пленка, сплошь заполненная крохотными прозрачными игольчатыми кристалликами вещества, двупреломляющего и поляризующего свет. Все кристаллики расположены параллельно друг другу, поэтому все они одинаково поляризуют свет, проходящий через пленку. Поляроидные пленки применяются в поляроидных очках. Поляроиды гасят блики отраженного света, пропуская весь остальной свет. Они незаменимы для полярников, которым постоянно приходится смотреть на ослепительное отражение солнечных лучей от заледеневшего снежного поля.
Поляроидные стекла помогут предотвратить столкновения встречных автомобилей, которые очень часто случаются из-за того, что огни встречной машины ослепляют шофера, и он не видит этой машины. Если же ветровые стекла автомобилей и стекла автомобильных фонарей сделать из поляроида, причем повернуть оба поляроида так, чтобы их оптические оси были смещены, то ветровое стекло не пропустит света фонарей встречного автомобиля, "погасит его".
Перечень применения кристаллов достаточно длинен и непрерывно растет.
2. Экспериментальная часть
2.1 Приготовление маточного раствора
Растворил соль в горячей воде до тех пор, пока не получил насыщенный раствор. Насыщенный раствор профильтровал. Оставил раствор медленно остывать.
Я выращивал кристаллы алюмокалиевых квасцов, сульфата алюминия-калия KAl(SO4)2, медного купороса, железного купороса.


2.2 Выращивание затравки
Через сутки на дне стакана образовались кристаллы соли. Раствор слил, кристаллы осторожно отделил друг от друга, выбрал из них самый крупный и правильный.

2.3 Выращивание монокристаллов
Приготовил новый насыщенный раствор. Привязал кристалл-затравку на нитку, закрепил на карандаше, опустил кристалл в раствор. Наблюдал за ростом кристаллов несколько недель.

- Сохранение кристаллов
Выращенные монокристаллы обсушил и для сохранения кристаллизационной воды покрыл бесцветным лаком.
Результаты эксперимента
Я вырастил друзы и монокристаллы медного купороса, и монокристаллы алюмокалиевых квасцов. Алюмокалиевые квасцы были подкрашены пищевыми красителями.

Выводы
- Форма кристалла определяется формой его кристаллической решетки.
- Примеси в растворе соли влияют на форму кристалла.
- Выращивание кристаллов - процесс занимательный, но требующий бережного и осторожного отношения к своей работе.
Список литературы
1. http://ru.wikipedia.org/wiki/кристаллы : Википедия
2. http://course-crystal.narod.ru/p31aa1.html : Мир кристаллов (дистанционный курс по физике)

