Электрохимическое окисление меди, серебра и сплавов серебро-медь в электролитных системах на основе серной кислоты
На правах рукописи
ПИМЕНОВА Анна Михайловна
ЭЛЕКТРОХИМИЧЕСКОЕ ОКИСЛЕНИЕ МЕДИ, СЕРЕБРА И СПЛАВОВ СЕРЕБРО-МЕДЬ В ЭЛЕКТРОЛИТНЫХ СИСТЕМАХ
НА ОСНОВЕ СЕРНОЙ КИСЛОТЫ
Специальность 05.17.03
Технология электрохимических процессов и защита от коррозии
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата технических наук
Иваново 2006
Работа выполнена в Институте химии растворов Российской академии наук, г.Иваново
Научный руководитель: доктор технических наук,
старший научный сотрудник
Гришина Елена Павловна
Официальные оппоненты: доктор технических наук,
профессор
Галанин Сергей Ильич
доктор химических наук,
профессор
Попова Светлана Степановна
Ведущая организация:
Институт физической химии и электрохимии им. А. Н. Фрумкина РАН (г. Москва)
Защита состоится «19» февраля 2007 г. в 10.00 часов в ауд. Г 205 на заседании диссертационного совета Д 212.063.02 ГОУ ВПО Ивановский государственный химико-технологический университет по адресу: 153000, г. Иваново, пр. Ф. Энгельса, 7.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Ивановский государственный химико-технологический университет по адресу: 153000, г. Иваново, пр. Ф. Энгельса, 10.
Автореферат разослан «19» января 2007г.
Ученый секретарь
диссертационного совета Е.П. Гришина
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Анодные процессы с участием металлов имеют большую практическую значимость для широкого круга электрохимических технологий: гальванотехники, гидрометаллургической технологии, электрохимической размерной обработки, определяют коррозионную устойчивость металлов, оказывают существенное влияние на стабильность устройств, работающих по электрохимическому принципу (химические источники тока, электролитические конденсаторы и т.д.). При их изготовлении используют, в частности, такие металлы, как серебро и медь. В ряду известных металлов серебро и медь выделяются наиболее высокой электро- и теплопроводимостью, пластичностью, а также удовлетворительной коррозионной стойкостью. Эти свойства, в основном, и определяют область их применения.
Известно, что при хранении и эксплуатации изделий, работающих по электрохимическому принципу, может происходить ухудшение параметров (снижение емкости, номинального напряжения и т.п.) и отказы, вызванные отложением солей, образованием дендритов металлов. Одной из причиной таких изменений являются коррозионные (анодные) процессы. Подобные процессы происходят в танталовых объемно-пористых электролитических конденсаторах, для изготовления корпусов которых применяют, в частности, серебро, медь и их сплавы. В процессе эксплуатации корпус конденсатора, контактирующий с рабочим электролитом 38 % H2SO4, испытывает знакопеременные токовые нагрузки, обусловленные процессами заряда-разряда конденсатора, переполюсовкой, работой в импульсных режимах. Анодные процессы в ТЭК с участием перечисленных металлов и сплавов зачастую непредсказуемы и требуют экспериментального изучения.
Совершенствование технологий, расширение возможностей управления технологическим процессом, определение режимов эксплуатации изделий, базируются на установлении закономерностей и стадийности процессов электрохимического окисления металлов и сплавов в традиционно применяемых растворах, а также создании новых электролитных систем снижающих риск коррозионного разрушения металла электрода.
Работа выполнена в рамках госбюджетных тем ИХР РАН (№ ГР 01980004698 и №ГР 01200202558).
Цель работы - установление кинетических закономерностей и механизма анодного окисления меди, серебра и сплавов серебро-медь в нестационарных условиях поляризации в электролитных средах на основе серной кислоты; выявление и количественная оценка влияния реакций образования и химического распада пассивирующих пленок на кинетику анодных процессов; разработка электролитных систем с улучшенными эксплуатационными свойствами.
В задачи исследования входило:
- изучение с помощью современных электрохимических методов исследования (циклическая вольтамперометрия, вольтамперометрия с изменяющимся анодным и катодным пределом развертки потенциала) влияния температуры и концентрации электролита на кинетические закономерности электрохимического окисления меди, серебра и сплавов серебро-медь в электролитных системах на основе серной кислоты (водные растворы H2SO4, а также электролитные композиции SiO2 – водный раствор H2SO4);
- интерпретация полученных данных в рамках основных кинетических моделей роста пористых анодных пленок; определение скорости и констант скорости химического распада пассивирующих пленок формирующихся при электрохимическом окислении исследуемых металлов и сплавов;
- разработка перспективных композитных электролитных систем на основе водных растворов H2SO4 и изучение их электропроводящих свойств.
Научная новизна. Предложена обобщенная схема окисления меди в водных растворах серной кислоты, включающая две последовательные одноэлектронные стадии образования оксидов меди и включенные химические стадии их распада.
Экспериментально показано, что первичным анодным продуктом электрохимического процесса окисления меди в водных растворах серной кислоты является оксид меди (I), образующий на поверхности металла резистивный пористый слой.
Установлены кинетические закономерности электрохимического окисления сплавов серебро-медь в водных растворах серной кислоты. Показано, что медь как компонент сплава повышает скорость электрохимического окисления серебра.
Впервые получены данные по кинетике потенциодинамического электрохимического окисления серебра, меди и сплавов серебро-медь в растворах серной кислоты, загущенных кремнеземом.
Впервые определены константы скорости химического распада первичных анодных продуктов, образующихся в процессе электрохимического окисления серебра и меди в электролитных средах на основе серной кислоты.
Практическая значимость. На основе предложенного механизма анодного окисления меди показаны пути практического управления процессами активации и пассивации медного электрода в электролитных средах на основе серной кислоты, включая гальванотехнические, гидроэлектрометаллургические процессы.
Результаты потенциодинамических исследований (поляризационные кривые сплавов серебро-медь в водных растворах серной кислоты, зависимости высоты анодного пика от содержания меди в сплаве) могут быть использованы для качественного и количественного анализа сплавов серебро-медь.
Оптимизирован состав композитной электролитной системы SiO2 – водный раствор H2SO4, представляющий собой высоко электропроводную рабочую среду с пониженной коррозионной активностью в отношении материала корпуса конденсатора. Композитный электролит может быть успешно применен в танталовых электролитических конденсаторах с серебряным, медным и другим корпусом.
Достоверность результатов исследований. Результаты диссертационной работы и ее выводы являются достоверными, научные положения аргументированы. Достоверность полученных результатов базируется на использовании современных физико-химических методов исследования и высокой воспроизводимости экспериментальных данных в пределах заданной точности.
Личный вклад автора. Автором лично получены все экспериментальные данные, приведенные в данной работе, проведена их обработка и систематизация. Постановка задач исследования осуществлялась совместно с научным руководителем, обсуждение экспериментальных данных проводилось совместно с руководителем и соавторами публикаций.
Апробация работы. Основные результаты диссертационной работы доложены и обсуждены на Международных конференциях «Проблемы сольватации и комплексообразования в растворах» (VIII, Иваново, 2001 г.; IX, Плес, 2004 г.), «Кинетика и механизм кристаллизации» (III, Иваново, 2004 г.; IV, Иваново, 2006 г.), «Электрохимикофизические методы обработки и покрытия» (Кострома, 2004 г.), III Конференции молодых ученых ИХР РАН (Иваново, 2004 г.), I Всероссийской школы - конференции. «Молодые ученые – новой России. Фундаментальные исследования в области химии и инновационной деятельности» (Иваново, 2005 г.), V Международном научно-практическом семинаре «Современные электрохимические технологии в машиностроении» (Иваново, 2005 г.).
Основное содержание диссертационной работы опубликовано в 13 работах, в том числе в 4 статьях в ведущих рецензируемых журналах, рекомендованных ВАК.
Структура диссертации. Диссертационная работа состоит из введения, литературного обзора, экспериментальной части, обсуждения результатов, итогов работы и выводов, списка цитируемой литературы (140 наименований), приложения. Материалы работы изложены на 150 страницах машинописного текста и содержат 19 таблиц, 35 рисунков.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во Введении дано обоснование актуальности темы, сформулирована цель исследования, научная новизна и практическая значимость работы.
В главе I (Литературный обзор) рассмотрены механизмы образования пассивных пленок на металлах и их влияние на скорость анодного процесса. Проведен критический анализ литературных данных по кинетике и механизму анодного окисления меди, серебра и их сплавов в водных растворах серной кислоты. Показано, что, взгляды на механизм электрохимического окисления меди в водных растворах серной кислоты противоречивы, отсутствует достаточная экспериментальная база, позволяющая обосновать этот механизм, что связано, главным образом, с высокой реакционной способностью промежуточных продуктов электродных реакций. Показана также перспективность практического использования загущенных электролитов в электротехнических устройствах, работающих по электрохимическому принципу (химические источники тока, электролитические конденсаторы). Сделан вывод об актуальности изучения анодных процессов в данных средах, сформулированы задачи исследования.
В главе II (Экспериментальная часть) приведены характеристики объектов исследования. Электроды изготавливали в виде пластин из серебра марки Ср 999, меди марки М0б (бескислородная), сплавов серебро-медь с содержанием меди 6, 9, 12.5, 25, 65 масс.%.
Электролитные системы - водные растворы серной кислоты (1 – 10 моль/л), концентрированные суспензии и гели кремнезема в водных растворах серной кислоты. В экспериментах с деаэрированной серной кислотой растворенный кислород удаляли током азота марки "хч" в течение 40 - 60 минут.
Поляризационные измерения проводили в термостатируемой стеклянной трехэлектродной ячейке ЯСЭ-3 с разделенными электродными пространствами при помощи потенциостата ПИ-50-1 в режиме циклической вольтамперометрии. Вспомогательный электрод – платина; электрод сравнения - ртутно-сульфатный. Скорость развертки потенциала (V) варьировалась от 0,002 до 0,200В/с. Температурный диапазон от 10 до 60°С, точность поддержания температуры ±0,1°С. Воспроизводимость основных параметров поляризационных кривых находилась в пределах 5% от среднего значения 3-5 параллельных измерений.
Обработка поляризационных кривых включала в себя: измерение плотности тока (jм) и потенциала (Ем) в анодном и катодном максимумах тока, расчет количества электричества (Q) методом графического интегрирования площади под анодным (![]() ) и катодным (
) и катодным (![]() ) максимумами тока, анализ данных в соответствии с диагностическими критериями механизма электродного процесса. Полученные данные обрабатывались в рамках модели сопротивления пористого слоя (МСПС) и ее модификации, учитывающей химический распад резистивного слоя продуктов анодной реакции (ММСПС).
) максимумами тока, анализ данных в соответствии с диагностическими критериями механизма электродного процесса. Полученные данные обрабатывались в рамках модели сопротивления пористого слоя (МСПС) и ее модификации, учитывающей химический распад резистивного слоя продуктов анодной реакции (ММСПС).
Измерения проводимости загущенных электролитов на основе серной кислоты проводили при помощи моста переменного тока P5021 в кондуктометрической ячейке с гладкими платиновыми электродами в диапазоне частот от 0,3 до 50 кГц. Значение сопротивления кондуктометрической ячейки находили путем экстраполяции частотной зависимости сопротивления на бесконечно большую частоту. Постоянную ячейки определяли с помощью 1М раствора КСl.
Фазовый состав поверхностной пленки на меди определяли с помощью рентгеновского дифрактомера ДРОН 2.0. Идентификацию пиков на рентгенограмме осуществляли с помощью картотеки ASTM.
В главе III (Результаты эксперимента и обсуждение) изложены результаты экспериментальных исследований, расчетов и их обсуждение.


Анодное окисление меди в водных растворах серной кислоты. Потенциодинамическое окисление меди в водных растворах серной кислоты описывается поляризационными кривыми с максимумами анодного тока, характеризующими процесс пассивации электрода (рис. 1–3). В 10М растворе кислоты анодный максимум тока имеет плечо в области более положительных потенциалов, что, как и наличие двух максимумов тока Iк и IIк на катодной ветви циклической поляризационной кривой, является подтверждением протекания двух анодных реакций и образования двух анодных продуктов.
| Рис.1. Поляризационные кривые меди в растворах H2SO4, М:1 – 1, 2 – 5, 3 – 10. Температура 25С, V = 0,1 В/с. | Рис.2. Поляризационные кривые меди в 5М H2SO4 при температурах, С: 1–4, 2–10, 3–25, 4–35, 5–45, 6–60. V = 0,05 В/с. |
Как видно из рис. 1-3, при изменении условий анодной поляризации меди (концентрации и температуры кислоты, скорости развертки потенциала, анодного предела развертки) происходит изменение высоты, формы и положения катодных максимумов тока.

Поляризационные измерения с изменяющимся анодным пределом развертки (рис.3.) показали, что возрастание тока на участке от стационарного потенциала Ест. до потенциала максимума ![]() на анодной ветви циклической поляризационной кривой сопровождается формированием соединения меди красно-коричневого цвета, которое в катодном полуцикле восстанавливается в области потенциалов первого максимума катодного тока и, по данным рентгенофазового анализа, идентифицируется как оксид меди (I). Количества электричества, пошедшие на образование и восстановление Cu2O (рис. 3б, точки 1 - 2) при потенциалах поляризации
на анодной ветви циклической поляризационной кривой сопровождается формированием соединения меди красно-коричневого цвета, которое в катодном полуцикле восстанавливается в области потенциалов первого максимума катодного тока и, по данным рентгенофазового анализа, идентифицируется как оксид меди (I). Количества электричества, пошедшие на образование и восстановление Cu2O (рис. 3б, точки 1 - 2) при потенциалах поляризации
| Рис.3.Влияние анодного предела развертки потенциала на форму катодной ветви поляризационной кривой (а) и отношение Qк/Qа (б) при поляризации меди в 10 М H2SO4 (раствор деаэрирован). Температура 35С, V = 0,05 В/с. | меньше, чем потенциал максимума тока, равны между собой. Это указывает на то, что первичный анодный продукт адсорбирован на поверхности электрода и не вступает в химическое взаимодействие с достаточно концентрированным деаэрированным раствором серной кислоты. |
При более положительных потенциалах, чем ![]() , на анодной ветви поляризационной кривой регистрируется плечо. В этой области потенциалов наблюдается изменение цвета поверхностной пленки на электроде с красно-коричневого на черный. Рентгенофазовый анализ показал, что пленка состоит из оксида меди (II). В этом случае на поляризационной кривой полностью исчезает первый катодный максимум тока Iк и регистрируется только второй IIк. Кулонометрический анализ показывает, что в этой области потенциалов отношение Qк/Qа начинает резко снижаться (рис. 3б, точки 4-7), а в точке (7) оно < 0,5. Это связано не только с электрохимической реакцией окисления Cu2O CuO, но и с протеканием процессов химического распада вещества пленки.
, на анодной ветви поляризационной кривой регистрируется плечо. В этой области потенциалов наблюдается изменение цвета поверхностной пленки на электроде с красно-коричневого на черный. Рентгенофазовый анализ показал, что пленка состоит из оксида меди (II). В этом случае на поляризационной кривой полностью исчезает первый катодный максимум тока Iк и регистрируется только второй IIк. Кулонометрический анализ показывает, что в этой области потенциалов отношение Qк/Qа начинает резко снижаться (рис. 3б, точки 4-7), а в точке (7) оно < 0,5. Это связано не только с электрохимической реакцией окисления Cu2O CuO, но и с протеканием процессов химического распада вещества пленки.
Таким образом, максимумы тока Iк и IIк связаны с восстановлением соответственно оксидов Cu2O и CuO, образовавшихся по электрохимическому механизму при анодной поляризации меди.
В отличие от 10М деаэрированной кислоты, в естественно аэрированных растворах H2SO4, даже при потенциалах формирования Cu2O отношение Qк/Qа <1, что связано с протеканием процессов химического распада этого оксида, усиливающихся по мере снижения концентрации кислоты. Химическое разложение Cu2O может протекать как при взаимодействии с растворенным кислородом (табл. 1), так и в результате реакции диспропорционирования (ДПП).
Согласно литературным данным и результатам нашего эксперимента (табл. 1), снижение концентрации кислоты (увеличение активности воды) дестабилизирует оксид меди (I) и увеличивает скорость химической реакции окисления Cu (I) Cu (II) и разложения Cu2O по механизму ДПП. Поэтому анодные токи, обусловленные протеканием реакции образования экранирующей поверхность пленки Cu2O, в 1М H2SO4 существенно выше, чем в крепких растворах кислоты (рис.1).
В табл. 1 приведены данные по влиянию растворенного кислорода на устойчивость первичного анодного продукта – оксида меди (I).
Таблица 1
Значения Qк/Qа при различных температурах и концентрациях H2SO4 в естественно аэрированных (е/а) и деаэрированных (д/а) растворах. V=0,01 В/с
| Температура, C | Концентрация H2SO4, М | |||||
| 1 | 5 | 10 | ||||
| е/а | д/а | е/а | д/а | е/а | д/а | |
| 15 20 25 35 | 0,04 0,02 - - | - 0,025 - - | 0,35 0,27 0,18 0,02 | 0,40 0,31 0,28 0,10 | 0,51 0,38 - - | 0,52 0,43 - - |
Из данных, приведенных в табл. 1, следует, что влияние растворенного кислорода возрастает при увеличении температуры, что свидетельствует об увеличении скорости химического процесса.
Плотность тока ![]() и величина
и величина ![]() (
(![]() =
=![]() -Ест.) при всех температурах и концентрациях H2SO4 линейно зависят от V0,5 (рис.4.). Это характерно для процессов образования резистивного пористого слоя продуктов анодной реакции по «электрохимическому» механизму.
-Ест.) при всех температурах и концентрациях H2SO4 линейно зависят от V0,5 (рис.4.). Это характерно для процессов образования резистивного пористого слоя продуктов анодной реакции по «электрохимическому» механизму.
(а) (б)
Рис.4. Зависимость ![]() (а) и
(а) и ![]() (б) от V0,5 при поляризации меди при 25С в растворах H2SO4 различной концентрации, М: 1 – 1, 2 – 5, 3 – 10.
(б) от V0,5 при поляризации меди при 25С в растворах H2SO4 различной концентрации, М: 1 – 1, 2 – 5, 3 – 10.
Отношение ![]() /
/![]() всегда меньше 1, а прямая в координатах
всегда меньше 1, а прямая в координатах ![]() – V0,5 отсекает на оси
– V0,5 отсекает на оси ![]() отрезок (в табл.2. обозначен как j0), пропорциональный суммарной скорости химического разложения Cu2O.
отрезок (в табл.2. обозначен как j0), пропорциональный суммарной скорости химического разложения Cu2O.
Таблица 2
Значения j0 (А/см2) в зависимости от температуры и концентрации
естественно аэрированной серной кислоты
| Температура, C | Концентрация H2SO4, М | ||
| 1 | 5 | 10 | |
| 15 20 25 35 45 60 | 0,079 0,116 0,139 0,184 0,185 - | 0,056 0,069 0,096 0,097 0,126 0,188 | 0,013 - 0,016 0,018 0,029 - |
Сопоставление величин j0 и ![]() (табл. 2, рис. 4) показывает, что образующаяся фазовая пленка значительно активнее взаимодействует с разбавленной, чем с концентрированной кислотой, и скорость взаимодействия возрастает с увеличением температуры.
(табл. 2, рис. 4) показывает, что образующаяся фазовая пленка значительно активнее взаимодействует с разбавленной, чем с концентрированной кислотой, и скорость взаимодействия возрастает с увеличением температуры.
Выявлены отклонения анодного поведения исследуемой системы Cu – водный раствор H2SO4 от МСПС, согласно которой Iм = (zFA02/М)(1-м)0,5·V0,5. Они выражаются в появлении отрезка j0. Модифицированная МСПС, в соответствии с которой Iм = а+(dV + a2)0,5, где a = k1Q0/2, d = (zFA02/М)·(1-м)0,5 дает возможность количественно оценить химическое взаимодействие образующейся поверхностной пленки с раствором (z - число электронов; F - постоянная Фарадея; A0 - геометрическая поверхность электрода; - удельная электропроводность электролита в порах; М, - соответственно молекулярная масса и плотность вещества пленки; м - степень заполнения поверхности пассивирующей пленки; k - константа скорости распада; Q0 - количество электричества, необходимое для заполнения всей поверхности анода продуктами реакции). Результаты расчетов константы скорости химического процесса приведены в табл. 3.
Таблица 3
Константы скорости (k) и эффективная энергия активации (Аэфф.)
процесса химического разложения пассивирующего слоя Cu2O
| Концентрация H2SO4, М | Температура, С | |||||||
| 4 | 10 | 15 | 20 | 25 | 35 | 45 | 60 | |
| 1 | - | - | 0,198 | 0,157 | 0,206 | 0,230 | 0,230 | - |
| Аэфф. = 5,65 кДж/моль | ||||||||
| 5 | 0,087 | 0,096 | 0,083 | 0,095 | 0,091 | 0,133 | 0,282 | 0,232 |
| Аэфф.= 16,94 кДж/моль | ||||||||
На основании зависимостей ln k – 1/Т и ln j0 – 1/Т рассчитаны значения эффективной энергия активации Аэфф. процесса химического разложения Cu2O в серной кислоте (табл. 3, 4). Очевидно, что распад Cu2O протекает при смешанном диффузионно-кинетическом контроле скорости процесса, причем роль кинетического фактора возрастает в деаэрированных растворах кислоты.
Таблица 4
Эффективная энергии активации Аэфф. (кДж/моль) процесса разложения
покрывающего слоя Cu2O в водных растворах серной кислоты
| Концентрация H2SO4, М | |||||
| 1 | 5 | 10 | |||
| е/а | д/а | е/а | д/а | е/а | д/а |
| 19,4 | - | 22,6 | 33,9 | 19,5 | 35,3 |
На основании физико-химических исследований и с учетом литературных данных о возможных путях химического превращения соединений меди, нами предложена обобщенная схема электродного процесса, протекающего на медном электроде в широком диапазоне концентраций серной кислоты:
ДПП, + О2
+Н2О +Н2О
Cu Cu2O CuO
-, -H+ -, -H+
+H2SO4
CuSO4
ДПП (разб.H2SO4)
Первая электрохимическая стадия (Е): 2Cu + H2O = Cu2O + 2H+ + 2 (1)
Вторая электрохимическая стадия (Е): Cu2O + H2O = 2CuO + 2H+ + 2 (2)
Возможные химические стадии (С) распада оксидов меди:
Cu2O + О2 = 2 CuO (3)
Cu2O = CuO + Cu (4)
в 1М H2SO4: Cu2O + H2SO4 = СuSO4+H2O + Cu (5)
Таким образом, в зависимости от условий поляризации электродный процесс может протекать по ЕЕС, ЕСС или ЕС механизмам. Первый реализуется в высоко концентрированных растворах серной кислоты при достаточно высоких анодных потенциалах, другие – в разбавленных аэрированных и горячих умеренно концентрированных растворах.
Анодное окисление сплавов серебро-медь в водных растворах серной кислоты
Потенциодинамические поляризационные кривые (ПК) окисления Ag, Cu -сплавов приведены на рис. 5. Cопоставление ПК для сплавов и металлов показывает, что ПК сплавов включают в себя хорошо выраженные максимумы тока анодного окисления меди (Iа и IIа), находящиеся в области потенциалов образования Cu2O и перехода Cu2O CuO, и максимум тока анодного окисления серебра (IIIa). Соответствие максимумов тока Iа и IIа реакциям (1) и (2) подтверждено в эксперименте с изменяющимся катодным пределом развертки потенциала: максимум IIа отсутствует на ПК, если катодный предел развертки > 0,5 В, то есть когда на поверхности электрода не сформирована Cu2O. Следовательно, электрохимические реакции при потенциодинамическом окислении меди как компонента сплава те же, что и при электрохимическом окислении компактной меди.
Зависимости ![]() – V0,5 для максимума тока Iа при экстраполяции на ось плотностей тока дают отрицательные значения j0, которые не имеют физического смысла. По-видимому, при анодном окислении сплавов медь не образует сплошного резистивного пористого слоя (рис.6).
– V0,5 для максимума тока Iа при экстраполяции на ось плотностей тока дают отрицательные значения j0, которые не имеют физического смысла. По-видимому, при анодном окислении сплавов медь не образует сплошного резистивного пористого слоя (рис.6).
Окислительно-восстановительному процессу с участием электроположительного компонента сплава – серебра соответствуют максимумы тока IIIа и IIIк, отвечающие, согласно литературным данным, протеканию реакций (6) и (7) соответственно:
2Ag + ![]() = Ag2SO4 + 2e (6)
= Ag2SO4 + 2e (6)
Ag2SO4 + 2e =2Ag + ![]() (7).
(7).
| Рис.5. Поляризационные кривые серебра (1) и Ag, Cu-сплавов с содержание меди, масс.%: 6 (2), 9 (3), 12.5 (4), 25 (5), 65 (6) в 5М H2SO4 при 20°С и V=0,02 В/с. | Таким образом, поляризационные кривые сплава включают все процессы, протекающие с участием каждого из ее компонентов. С увеличением содержания меди общий характер ПК изучаемых сплавов не изменяется, но, наряду с возрастанием анодного тока окисления меди, наблюдается также рост тока окисления серебра. |
На рис. 7. приведена зависимость высоты максимума тока Iа (процесс 1) от содержания меди в сплаве, которая линейна во всем исследованном диапазоне составов. Поэтому она может быть использована для количественного определения меди в Ag, Cu – сплавов.
Для максимумов тока IIIа зависимости ![]() (V0,5), как и в случае серебра, линейны и не экстраполируются в начало координат (рис.8). Величина j0 увеличивается при уменьшении содержания серебра в сплаве. Отношение
(V0,5), как и в случае серебра, линейны и не экстраполируются в начало координат (рис.8). Величина j0 увеличивается при уменьшении содержания серебра в сплаве. Отношение ![]() /
/![]() , характеризующее остаточное содержание Ag2SO4 на поверхности электрода, резко падает с увеличением доли меди в сплаве (рис.9, кривая 1).
, характеризующее остаточное содержание Ag2SO4 на поверхности электрода, резко падает с увеличением доли меди в сплаве (рис.9, кривая 1).
| Рис.6. Зависимость | Рис.7. Зависимость |
| Рис. 8. Зависимость | Рис.9. Зависимость отношения |
Ширина максимума тока IIIа (А) на половине его высоты, как следует из (рис. 9, кривая 2), увеличивается при снижении содержания серебра в сплаве. Согласно литературным данным, в интервале концентраций от 0,1 до 10 мольл-1 H2SO4, величина А коррелирует с удельной электропроводностью раствора, принимая наименьшее значение в растворе с наибольшей. Поэтому возрастание величины А может быть следствием снижения концентрации H2SO4 в приэлектродном слое раствора в результате химического взаимодействия оксида меди (II) с серной кислотой.
Снижение концентрации кислоты в приэлектродном слое раствора может приводить к повышению растворимости Ag2SO4 (разрушению пассивирующего слоя) и, следовательно, возрастанию тока окисления электроположительного компонента сплава.
Приведенные закономерности полностью соблюдаются при поляризации Ag,Cu - сплавов в 10 М водном растворе серной кислоты.
С применением ММСПС были рассчитаны скорости химического разложения пленки сульфата серебра, образованного по реакции (6) (табл. 5).
Таблица 5
Скорость химического разложения пассивирующего слоя Ag2SO4, образующегося
при анодном окислении Ag, Cu-сплавов в 5 М H2SO4 при 20С
| Содержание меди в сплаве, масс. % | 6 | 9 | 12,5 | 25 | 65 |
| j0, А/см2 | 0,042 | 0,046 | 0,061 | 0,056 | 0,055 |
Приведенные экспериментальные данные убедительно показывают, что импульсные режимы поляризации меди и ее сплавов с серебром в водных растворах серной кислоты неизбежно приводят к накоплению одноименных ионов в растворе вследствие химической неустойчивости пассивирующих слоев в данной электролитной среде.
Комплексное исследование электрохимических свойств системы
“металл – загущенный электролит на основе серной кислоты”
1. Свойства загущенного электролита на основе серной кислоты
Одно из перспективных направлений повышения качества танталовых электролитических конденсаторов - разработка загущенных электролитных систем. В качестве загустителя растворов H2SO4 используют кремнезем, введение которого дает возможность улучшить эксплуатационные характеристики изделия. Вместе с тем, информация об электропроводности таких композиций и поведении в них металлов ограничена.
При смешении водного раствора серной кислоты и SiO2 происходит формирование коллоидной системы, свойства которой зависят от размеров частиц дисперсной фазы (SiO2), т.е. от удельной поверхности наполнителя. Если размеры частиц составляют десятки микрон, то устойчивые не расслаивающиеся электролитные системы имеют высокое (20-35 масс.%) содержание кремнезема. Суспензии SiO2 в водных растворах серной кислоты обладают свойствами гелей, в частности, тиксотропией. Как показали исследования, такие суспензии имеют высокий коэффициент структурного сопротивления = 23, что соответствует снижению удельной электропроводности по сравнению с раствором кислоты равной концентрации ~ в 2 раза. Уменьшение размеров частиц кремнезема приводит к снижению содержания SiO2, необходимого для загущения, до значений, не превышающих 15 масс.%. Оптимизированный состав загущенного электролита содержит 6% SiO2.
Электропроводность загущенных электролитов зависит от размера частиц SiO2, но соизмерима с электропроводностью водных растворов серной кислоты (рис.10). Частицы SiO2 в суспензии образуют структуры с развитой системой пор и капилляров, которые оказывают заметное тормозящее влияние на скорость движения мигрирующих ионов и диффундирующих молекул воды, то есть снижению электропроводности.
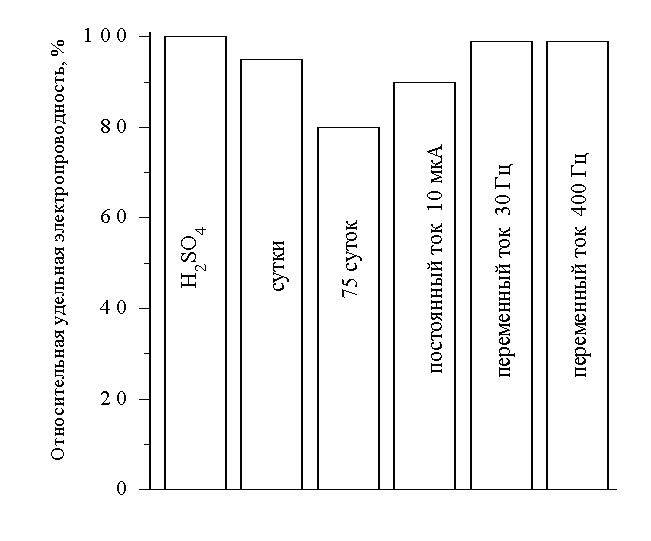

| Рис.10. Относительное изменение удельной электропроводности загущенных систем на основе H2SO4 по отношению к водному раствору H2SO4. | Рис.11.Влияние различных факторов на электропроводящие свойства загущенного электролита на основе H2SO4 (геля) по отношению к водному раствору H2SO4. |
Удельная электропроводность загущенного электролита снижается во времени на 10-20% (рис. 11.), что связано со структурообразованием в данной системе (возникновением водородных и силоксановых связей между гидратированными частицами SiO2). Проведено исследование воздействия постоянного и переменного тока на удельную электропроводность гелевого электролита. На рис. 11 показано, что действие постоянного тока (выдержка при силе тока на ячейке 10 мкА в течение 3 часов) вызывает снижение проводимости на 10 %, а действие переменного тока (30 Гц и 400 Гц в течение 3 часов) приводит к разрушению структуры геля, что выражено в увеличении электропроводности.
Сопоставление параметров танталовых электролитических конденсаторов при использовании раствора серной кислоты и загущенного электролита проведено при полупроизводственных испытаниях на ОАО “Элеконд” г. Сарапул, Удмуртская республика. Значения параметров конденсаторов приведены в табл. 6, 7.
Таблица 6
Температурная зависимость параметров танталовых объемно-пористых электролитических конденсаторов номинальной емкостью 70 мкФ
| t, C | C, мкФ | С, % | tg | Rэкв, Ом | Z, Ом | |||||
| 38 % H2SO4 | ГЭ | 38 % H2SO4 | ГЭ | 38 % H2SO4 | ГЭ | 38 % H2SO4 | ГЭ | 38 % H2SO4 | ГЭ | |
| -60 -55 -40 -30 +85 +125 | 59,2 59,7 61,1 62,0 75,8 77,5 | 57,4 59,1 60,9 61,8 77,8 80,2 | 18,3 17,7 15,1 14,0 - - | 19,5 17,3 14,8 13,6 - - | 29,5 20,3 9,2 7,2 2,2 2,7 | 32,7 23,3 10,3 8,0 2,5 3,7 | 8,0 5,5 2,5 2,2 0,5 0,5 | 9,4 6,5 2,8 1,8 0,5 0,7 | 25,1 25,5 26,1 27,3 20,5 19,8 | 25,0 25,5 27,1 28,5 20,0 19,5 |
Таблица 7
Частотная зависимость параметров танталовых объемно-пористых электролитических конденсаторов номинальной емкостью 70 мкФ
| f, Гц | C, мкФ | С, % | tg | Rэкв, Ом | Z, Ом | |||||
| 38 % H2SO4 | ГЭ | 38 % H2SO4 | ГЭ | 38 % H2SO4 | ГЭ | 38 % H2SO4 | ГЭ | 38 % H2SO4 | ГЭ | |
| 50 100 1000 10000 100000 | 71,5 70,2 65,1 49,4 11,4 | 71,9 70,4 65,3 54,4 12,1 | - -1,9 -9,0 -31,0 -84,0 | - -2,1 -9,2 -28,5 -83,2 | 4,4 6,0 17,0 85,0 102,0 | 1,9 5,9 16,0 84,0 110,0 | 2,0 1,3 0,4 0,3 0,1 | 2,2 1,3 0,4 0,3 0,1 | 46,5 22,4 2,4 0,4 0,2 | 46,5 23,0 2,4 0,4 0,2 |
Из представленных результатов испытаний следует, что значения параметров конденсаторов сравнительного изготовления, собранных с гелевым электролитом и 38 % раствором H2SO4, использующимся согласно действующей технологии для изделий серии К 52 [Конденсаторы : рекламный проспект ОАО “Элеконд”, Россия, Удмуртская республика. – Сарапул, 2002. - 58 с.], в нормальных условиях, при воздействии повышенных и пониженных рабочих температур, а также их значения при воздействии частот в диапазоне 50 – 100000 Гц, сопоставимы. Незначительные различия, выявленные в ходе работы, не являются существенными.
Применение загущенного электролита позволит повысить процент выхода годных изделий на операциях сборки конденсаторов за счет большего коэффициента вязкости раствора и уменьшения возможности его поднятия при нагреве во время указанных операций.
Таким образом, возможно получение загущенного электролита на основе серной кислоты, мало уступающего раствору кислоты по электропроводности, обладающего более высокой температурой кипения (115С), что позволит улучшить эксплуатационные характеристики и надежность конденсатора.
2. Анодное окисление меди, серебра и сплавов серебро-медь в загущенном электролите на основе серной кислоты
Помимо электропроводности электролита, большое значение имеет его коррозионная активность в отношении применяемых электродных материалов, поэтому нами изучена кинетика анодного окисления серебра, меди и Ag, Cu -сплавов в загущенных электролитах.
На рис.12 приведены поляризационные кривые серебра, меди и Ag, Cu-сплава в водном растворе серной кислоты и загущенном электролите с той же концентрацией кислоты. При электрохимическом окислении серебра, меди и сплавов-Ag, Cu в загущенном электролите общие закономерности электродных процессов, характерные для водных растворов серной кислоты, сохраняются, так как положение максимумов тока практически не меняется.
Это свидетельствует об идентичности анодных процессов, протекающих в водных и загущенных электролитах, что позволяет сравнить химическую устойчивость анодных пленок (Ag2SO4 на серебре и Cu2O на меди) в обеих электролитных системах. Кинетика образования поверхностных пленок на серебре и меди в загущенном электролите, как и в водном растворе кислоты, описывается моделью сопротивления пористого слоя (МСПС), но более корректно - ММСПС.

(а) (б) (в)
| Рис.12. Поляризационные кривые анодного окисления серебра (а), меди (б) и Ag, Cu -сплава (9 масс. % Cu) (в) в 30 % -ном растворе Н2SO4 (1) и в загущенном электролите на основе Н2SO4 (2). V = 0,02В/с, t = 20 °С. |
Рассчитанные значения скорости (j0) и константы скорости (k), полученные для серебра, меди и Ag, Cu -сплавов (для максимума тока IIIа) в различных электролитных средах на основе серной кислоты приведены в табл. 8, 9.
Таблица 8
Скорость (j0) и константа скорости (k) химического распада пассивирующих пленок Ag2SO4 и Cu2O в электролитных системах на основе Н2SO4
| t, C | j0, А/см2 (k, c-1) | |||
| 30 % Н2SO4 | Суспензия | 40 % Н2SO4 | Гель | |
| Пассивирующая пленка Ag2SO4 на серебре | ||||
| 15 20 25 35 45 60 | 0,021 | 0,015 0,016 (0,325) 0,017 0,019 0,021 | 0,018 (0,375) | 0,008 0,012 (0,123) 0,013 0,014 0,015 |
| Пассивирующая пленка Cu2O на меди | ||||
| 15 20 25 35 45 60 | 0,097 | 0,045 0,062 (0,054) 0,066 0,091 0,093 | 0,069 (0,091) | 0 0 - 0,010 0,012 0,020 |
[Носков, А. В. Кинетика анодного окисления металлов в условиях нестабильности продуктов электрохимической реакции /А. В. Носков, Е. П. Гришина // Защита металлов. - 2005. - Т. 41, № 2. - С.158 - 161.]
Таблица 9
Скорость химического распада (j0) пассивирующих пленок Ag2SO4 на
сплавах серебро-медь в электролитных системах на основе Н2SO4 при 20°С
| Содержание меди в сплаве, масс. % | 6 | 9 | 12,5 | |
| j0, А/см2 | 30 % Н2SO4 | 0,014 | 0,023 | 0,024 |
| Суспензия | 0,011 | 0,013 | 0,019 | |
Из табл. 8 и 9 следует, что скорость и константа скорости распада вещества пленки существенно снижается в загущенных электролитных системах, применение которых может обеспечить более высокую коррозионную стойкость металлов и сплавов в условиях эксплуатации и хранения конденсаторов. По-видимому, это связано со снижением активности воды в геле и суспензии по сравнению с водным раствором кислоты.
Скорость химического разложения пассивирующей пленки Ag2SO4 в загущенных электролитах возрастает при увеличении температуры и лимитируется диффузией, так как Аэфф. =13 кДж/моль (H2SO4) и 5,7 кДж/моль (SiO2 + H2SO4).
В случае разложения Cu2O Аэфф. составляет 17 и 20 кДж/моль для H2SO4 (рассчитано по j0 и k соответственно), для системы SiO2+H2SO4 - 13 и 20,75 кДж/моль (по j0 и k), что говорит о диффузионно-кинетических ограничениях скорости процесса.
Таким образом, наши исследования показали, что при использовании загущенного электролита, варьируя его состав, можно при незначительном снижении электропроводности электролита существенно снизить его реакционную активность в отношении вещества пассивирующей пленки на металлах.
Итоги работы
- В широком диапазоне температур и концентраций серной кислоты изучена кинетика анодного окисления меди и сплавов серебро-медь. Показано, что первичным анодным продуктом при окисление меди в водных растворах серной кислоты является оксид меди (I). Предложена схема электрохимического окисления меди в водных растворах серной кислоты, включающая как электрохимические, так и химические стадии процесса.
- Получены и оптимизированы по соотношению компонентов устойчивые гели и суспензии SiO2 в водных растворах серной кислоты. Изучена температурная и концентрационная зависимость электропроводности этих систем.
- В гелях и суспензиях оптимального состава проведены исследования анодного окисления серебра, меди и сплавов серебро-медь.
- Для интерпретации полученных результатов применена модель сопротивления пористого слоя и ее модификация, учитывающая химический распад первичных анодных продуктов. Показано, что модифицированная модель более корректно описывает экспериментальные данные. На ее основе рассчитаны скорости и константы скорости распада первичных продуктов анодных реакций. Установлено, что скорость химической реакции распада пленки Ag2SO4 на серебре лимитируется диффузией. Химическое разложение пленки Cu2O на медном электроде протекает со смешанным диффузионно-кинетическим контролем. Установлено, что скорость и константа скорости химического распада поверхностных пассивирующих пленок на изучаемых металлах в загущенном растворе серной кислоты существенно снижается по сравнению с ее водными растворами.
- ОАО «Элеконд» (г.Сарапул, Удмуртская республика) проведены полупроизводственные испытания оптимизированного по составу гелевого электролита на основе серной кислоты. Согласно результатам испытаний, применение загущенного электролита обеспечивает характеристики конденсатора, соответствующие таковым при использовании раствора серной кислоты.
Список публикаций по теме диссертации
- Гришина, Е. П. Анодное окисление меди в концентрированных растворах серной кислоты /Е. П. Гришина, А. М. Удалова (Пименова), Е. М. Румянцев // Электрохимия. -2002. -Т.38, № 9. - С.1155-1158.
- Гришина, Е. П. Анодное окисление сплавов серебра в концентрированных растворах серной кислоты /Е. П. Гришина, А. М. Удалова (Пименова), Е. М. Румянцев // Электрохимия. - 2003. - Т. 39, № 8. - С. 1003-1007.
- Гришина, Е. П. Характеристика электрической проводимости концентрированных суспензий кремнезема в водных растворах серной кислоты /Е. П. Гришина, А. М. Удалова (Пименова) // Журн. прикладной химии. - 2005. - Т. 78, № 7. - С.1106-1109.
- Носков, А. В. Кинетика химического разложения Cu2O при электрохимическом окислении меди в электролитных системах на основе серной кислоты /А. В. Носков, Е. П. Гришина, А. М. Пименова // Защита металлов. - 2006. - Т. 42, № 2. - С. 163-167.
- Удалова (Пименова), А. М. Анодное окисление меди в концентрированных растворах серной кислоты /А. М. Удалова (Пименова), Е. П. Гришина, Е. М. Румянцев // Проблемы сольватации и комплексообразования в растворах : тез. докл. VIII Междунар. конф. (Иваново, 8 – 11 октябрь, 2001). - Иваново, 2001. - С.127.
- Удалова (Пименова), А. М. Электрохимическое поведение серебра и меди в концентрированных суспензиях кремнезема в водных растворах серной кислоты /А. М. Удалова (Пименова), Е. П. Гришина // Проблемы сольватации и комплексообразования в растворах : тез. докл. IХ Междунар. конф. (Плес, 28 июня – 2 июля, 2004). - Плес, 2004. - С.413 - 414.
- Гришина, Е. П. Закономерности поверхностной электрокристаллизации Cu2O на сплавах серебро-медь при их анодной поляризации в растворах серной кислоты /Е. П. Гришина, А.М. Удалова (Пименова) // Кинетика и механизм кристаллизации : тез. докл. III Междунар. конф. (Иваново, 12-14 октября, 2004). – Иваново, 2004. - С.50.
- Носков, А. В. Количественная оценка процесса химического распада пленок Cu2O, кристаллизующихся на поверхности анодно поляризованного медного электрода в растворах серной кислоты /А. В. Носков, А. М. Удалова (Пименова), Е. П. Гришина // Кинетика и механизм кристаллизации : тез. докл. III Междунар. конф. (Иваново, 12-14 октября, 2004). – Иваново, 2004. - С.169.
- Гришина, Е. П. Кинетика анодного окисления серебра и его сплавов с медью в загущенном электролите на основе серной кислоты /Е. П. Гришина, А. М. Удалова (Пименова) // Электрохимикофизические методы обработки и покрытия : тез. докл. Междунар. науч. конф. (Кострома, 7-8 октября, 2004). – Кострома, 2004. - С.149.
- Удалова (Пименова), А. М. Электрохимическое окисление меди и ее сплавов с серебром в концентрированных растворах серной кислоты /А. М. Удалова (Пименова) // III Конф. мол. учен. ИХР РАН. (Иваново, 17-19 ноябрь, 2004). – Иваново, 2004. - С.28.
- Пименова, А. М. Комплексное исследование электрохимических свойств системы “металл - загущенный электролит на основе серной кислоты” /А.М. Пименова, Е.П. Гришина // Мол. учен. – новой России. Фундам. иссл. в обл. химии и инновац. деят. : тез. докл. I Всероссийск. шк.-конф. (Иваново, 26-29 сентября, 2005). – Иваново, 2005. - С. 25-26.
- Гришина, Е. П. Кинетика электрохимического окисления серебра и меди в системе H2O-H2SO4-SiO2 /Е. П. Гришина, А. М. Пименова // V Междунар. науч.-практич. семинар “Современные электрохимические технологии в машиностроении”. (Иваново, 28-29 ноября, 2005). - Иваново, 2005. - С. 193 – 195.
- Пименова, А. М. Кинетика формирования оксидно-солевых пассивирующих слоев при анодной поляризации сплавов серебро-медь в загущенном электролите на основе серной кислоты /А. М. Пименова, Е. П. Гришина // Кинетика и механизм кристаллизации : тез. докл. IV Междунар. конф. (Иваново, 19-22 сентября, 2006). – Иваново, 2006. - С.110.

