Фармакокинетическое исследование различных лекарственных форм хондроитина сульфата
На правах рукописи
ХУБИЕВА
Асият Юнусовна
ФАРМАКОКИНЕТИЧЕСКОЕ ИССЛЕДОВАНИЕ РАЗЛИЧНЫХ ЛЕКАРСТВЕННЫХ ФОРМ ХОНДРОИТИНА СУЛЬФАТА
15.00.02 – Фармацевтическая химия, фармакогнозия
Автореферат
диссертации на соискание ученой степени
кандидата фармацевтических наук
Москва - 2007
Работа выполнена в Федеральном государственном учреждении «Научный центр экспертизы средств медицинского применения» Росздравнадзора и ГОУ ВПО Московская Медицинская Академия им. И.М. Сеченова Росздрава
Научный руководитель:
доктор фармацевтических наук, профессор Раменская Галина Владиславовна
Официальные оппоненты:
доктор фармацевтических наук
ФГУП Центр по химии лекарственных средств
(ЦХЛС-ВНИХФИ) Чистяков Виктор Владимирович
кандидат фармацевтических наук
ФГУ «НЦЭСМП» Росздравнадзора Нечаева Екатерина Борисовна
Ведущая организация:
Государственное Учреждение Научно - исследовательский Институт Фармакологии им. В.В. Закусова РАМН
Защита состоится «22» октября 2007 г. в 1400 на заседании Диссертационного Совета Д.208.040.09 при ГОУ ВПО Московская Медицинская Академия им. И.М. Сеченова (119019, Москва, Никитский бульвар, 13).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Московская Медицинская Академия им. И.М. Сеченова, по адресу: 117998, Москва, Нахимовский проспект, 49.
Автореферат разослан «___» сентября 2007 г.
Ученый секретарь
Диссертационного Совета Д.208.040.09,
доктор фармацевтических наук,
профессор Наталья Петровна Садчикова
ОБЩАЯ ХАРАКТЕРИСТИКА ДИССЕРТАЦИИ
Актуальность темы
Остеоартроз (ОА) – широко распространенное заболевание, встречающееся примерно у 10 % населения земного шара. Среди лиц 50 лет и старше почти половина имеет признаки этого заболевания (В.А. Насонова, 2006; Л.И Алексеева, 2004; Е.Л. Насонов, 2001; Н.В. Чичасова, 2005).
ОА – гетерогенная группа дегенеративных заболеваний суставов различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями. Основным патологическим проявлением ОА является нарушение суставного хряща. Наряду с поражением хряща в патологический процесс при ОА вовлекаются другие компоненты сустава: субхондриальная кость, синовиальная оболочка, а также связки, капсула сустава, околосуставные мышцы.
Лечение ОА направлено на решение следующих задач: уменьшение боли и воспаления, снижение частоты обострений и поражения новых суставов, улучшения качества жизни, замедления прогрессирования и предотвращения инвалидности.
Новое направление в лечении ОА основано на применении хондропротекторов - естественных компонентов хрящевого межклеточного вещества (хондроитина сульфат, глюкозамина сульфат и гиалуроновая кислота).
В последние годы повышенный интерес вызывают новые генерические лекарственные препараты хондроитина сульфата. Оценка биоэквивалентности ("фармакокинетической эквивалентности") лекарственных препаратов является основным видом медико-биологического контроля качества воспроизведенных лекарственных препаратов, содержащих одно и то же лекарственное средство в дозе и лекарственной форме, аналогичным тем, которые соответствуют оригинальному лекарственному препарату (А.П. Арзамасцев, 2006; Г.В. Раменская, 2005). Исследования биоэквивалентности позволяют сделать обоснованные заключения о качестве сравниваемых препаратов по относительно меньшему объему первичной информации и в более сжатые сроки, чем при проведении клинических исследований.
Исследования биоэквивалентности не рассматриваются как альтернатива испытаниям фармацевтической эквивалентности воспроизведенных препаратов по качественному и количественному составу лекарственных средств, оцениваемому по фармакопейным тестам, поскольку фармацевтическая эквивалентность не гарантирует эквивалентности фармакокинетической (В.Г. Кукес, 2004; Г.В. Раменская, 2004; Ю.Б. Белоусов, 2003). Вместе с тем, исследования биоэквивалентности предполагают, что фармакокинетически эквивалентные (биоэквивалентные) оригиналу воспроизведенные препараты обеспечивают одинаковую эффективность и безопасность фармакотерапии, то есть, что они являются терапевтическими эквивалентами.
Основными исследованиями, подтверждающими эквивалентность (неэквивалентность) препаратов являются: определение «Растворение» in vitro, изучение биодоступности и фармакокинетики на людях и животных; сравнительные клинические исследования.
Таким образом, представляется актуальным изучение сравнительной биодоступности и биоэквивалентности различных лекарственных форм хондроитина сульфата.
Цель и задачи исследования
Целью исследования: изучение фармакокинетических параметров твердых дозированных лекарственных форм хондроитина сульфата.
Задачи исследования:
- Разработать методику количественного определения хондроитина сульфата методом СФ в растворах и сыворотке крови.
- Изучить хроматографическое поведение хондроитина сульфата методом ВЭЖХ и подобрать условия его количественного определения в растворах и сыворотке крови.
- Подобрать условия для проведения испытания «Растворение» твердых дозированных лекарственных форм, содержащих хондроитина сульфата.
- Изучить кинетику высвобождения in vitro хондроитина сульфата из твердых дозированных лекарственных форм с различным составом вспомогательных веществ.
- Определить относительную биодоступность различных лекарственных форм хондроитина сульфата у экспериментальных животных.
- Изучить относительную биодоступность и биоэквивалентность препаратов хондроитина сульфата у здоровых добровольцев.
Научная новизна
На основе комплексного изучения физико-химических свойств лекарственных средств, содержащих хондроитина сульфат, разработаны условия и методика количественного определения для проведения испытания «Растворение» для твердых дозированных лекарственных форм хондроитина сульфата отечественного производства.
Изучена сравнительная биодоступность и биоэквивалентность различных лекарственных форм с хондроитина сульфата отечественного производства. На основе биофармацевтической оценки выбран наиболее оптимальный состав вспомогательных веществ нового генерического отечественного препарата, содержащего хондроитина сульфата.
Впервые изучены особенности фармакокинетики и биодоступности нового отечественного препарата хондроитина сульфата на экспериментальных животных и здоровых добровольцах.
Практическая значимость и внедрение результатов исследования
Разработаны методики количественного определения глюкозаминогликанов методами СФ и ВЭЖХ в растворах и сыворотке крови.
Подобраны условия проведения теста «Растворение» для твердых дозированных форм хондроитина сульфата.
Определены значения фармакокинетических параметров хондроитина сульфата при однократном пероральном применении таблеток и капсул с хондроитина сульфата у лабораторных животных и здоровых добровольцев.
Методика количественного анализа хондроитина сульфата внедрена в работу ФГУ «НЦЭСМП» Росздравнадзора и рекомендована к использованию в работе территориальных управлений Федеральной службы по надзору в сфере здравоохранения и социального развития (акт внедрения от 16.04.2007 г.); а так же в Филиале «Клиническая фармакология» ГУ Научного Центра Биомедицинских Технологий РАМН при проведении фармакокинетических исследований (акт внедрения от 15.03.2007 г.).
Апробация диссертации
Апробация работы проведена на совместном заседании Ученого совета ФГУ «НЦЭСМП» Росздравнадзора и кафедры фармацевтической химии с курсом токсикологической химии ГОУ ВПО ММА им. И.М. Сеченова Росздрава (2 июля 2007 г.)
Основные положения и результаты работы докладывались и обсуждались:
- на научно-практической конференции «Клинико-фармакологические подходы в оптимизации фармакотерапии» (март 2006 г., г. Москва);
- на XIII и XIV Российском национальном конгрессе «Человек и лекарство» (апрель 2006 г., апрель 2007 г., г. Москва);
- на научно-практической конференции «Оптимизация фармакотерапии на основе изучения активности ферментов биотрансформации и транспортеров лекарственных средств» (декабрь 2006 г., г. Москва).
Связь исследований с проблемным планом фармацевтических наук
Диссертационная работа выполнена в соответствии с научным направлением кафедры фармацевтической химии с курсом токсикологической химии ММА им. И.М.Сеченова «Совершенствование контроля качества лекарственных средств» (номер государственной регистрации - 01.200.110545) и плановой темой НИР ФГУ «НЦЭСМП» Росздравнадзора «Разработка медицинской технологии по изучению биоэквивалентности лекарственных средств на животных и добровольцах».
Публикации
По результатам проведенных исследований опубликовано 8 печатных работ.
Основные положения, выносимые на защиту
- Обоснование возможности количественного определения хондроитина сульфата методом СФ в растворах и сыворотке крови.
- Условия количественного определения хондроитина сульфата методом ВЭЖХ в растворах и сыворотке крови.
- Оценка кинетики высвобождения in vitro хондроитина сульфата из твердых дозированных лекарственных форм.
- Оценка относительной биодоступности различных лекарственных форм хондроитина сульфата у экспериментальных животных и здоровых добровольцев.
Структура и объем диссертации
Диссертация изложена на 135 страницах машинописного текста и состоит из введения, 5 глав, выводов и приложений; включает библиографический указатель из 161 источника, в том числе 45 отечественных, 116 иностранных, иллюстрирована 43 таблицами, 25 рисунками.
Во введении обоснована актуальность проведенного исследования, сформулированы цель и задачи исследования, показаны научная новизна и практическая значимость работы, изложены основные положения, выносимые на защиту.
Первая глава диссертационной работы посвящена обзору данных литературных источников по теме диссертации. Описаны требования, предъявляемые к качеству воспроизведенных лекарственных препаратов в Российской Федерации. Описаны этапы биофармацевтического анализа лекарственных средств. Показана роль глюкозаминогликанов в лечении остеоартроза, основанное на применении хондропротекторов. Приведена характеристика хондроитина сульфата.
Вторая глава посвящена разработке методов количественного определения глюкозаминогликанов. Автором подобраны оптимальные условия количественного определения хондроитина сульфата методом спектрофотометрии и высокоэффективной жидкостной хроматографии. Приведены метрологические характеристики, а также выводы по применению разработанных методов.
Третья глава посвящена изучению кинетики высвобождения in vitro лекарственных форм хондроитина сульфата из твердых дозированных лекарственных форм. Подобраны условия анализа для определения профиля растворения различных препаратов хондроитина сульфата. Приведены результаты испытания теста «Растворение» различных твердых лекарственных форм хондроитина сульфата.
Четвертая глава посвящена изучению относительной биодоступности хондроитина сульфата из различных лекарственных форм у экспериментальных животных (in vivo). Описаны материалы и методы исследования, приведены результаты сравнительного изучения относительной биодоступности различных лекарственных форм хондроитина сульфата у экспериментальных животных.
Пятая глава посвящена изучению биоэквивалентности таблеток хондроитина сульфата и капсул Структум у здоровых добровольцев (in vivo). Описана тактика проведения исследования и приведены результаты сравнительного изучения относительной биодоступности различных лекарственных форм хондроитина сульфата у здоровых добровольцев.
Результаты исследования
Объекты исследования:
- таблетки хондроитина сульфата, 250 мг;
- капсулы хондроитина сульфата с микрокристаллической целлюлозой, 250мг;
- капсулы хондроитина сульфата с поливинилпирролидоном, 250 мг.
Изучение проводили в сравнении с оригинальным препаратом Структум, капсулы 250 мг производства «Пьер Фабр Медикамент Продакшн», Франция.
Анализ растворов хондроитина сульфата проводили на спектрофотометре BAUSCH & LOMB “SPECTRONIC 2000”. Полученные экспериментальные данные подвергали статистической обработке с помощью программы «Microsoft Office Excel 2003». Спектрофотометрический метод определения хондроитина сульфата в окрашенном растворе основан на развитии метахроматической реакции сульфатированных глюкозаминогликанов с красителем – 1,9 диметилметиленовым синим (1,9 – ДМС).
Для получения цветного реагента (раствора 1,9 - ДМС) 16 мг 1,9 – ДМС растворяли в 1000 мл воды очищенной, содержащей 3,04 г глицина, 2,37 г натрия хлорида и 95 мл 0,1 М раствора хлористоводородной кислоты; pH полученного раствора составила 3,0. Полученный раствор хранили при комнатной температуре в защищенном от света месте в течение 1 месяца.
По результатам измерения оптической плотности окрашенного раствора хондроитина сульфата с концентрацией 1 мкг/мл в диапазоне 340 520 нм была выбрана оптимальная длина волны – 500 нм (рис. 1).
Рис. 1. Спектр поглощения окрашенного раствора хондроитина сульфата с концентрацией 1 мкг/мл в видимой области
Поскольку в данном случае может наблюдаться отклонение от закона Бугерта – Ламберта – Бера, обусловленное процессом комплексообразования, для количественного определения хондроитина сульфата методом абсолютной калибровки строили калибровочный график зависимости оптической плотности от концентрации препарата в пробе в диапазоне концентраций 1–500 мкг/мл (рис. 2).
Рис. 2. График зависимости оптической плотности от концентрации хондроитина сульфата при длине волны 500 нм
Полученные данные показали, что калибровочная зависимость оптической плотности от концентрации хондроитина сульфата носила линейный характер в диапазоне от 1 мкг/мл до 300 мкг/мл.
Для оценки точности и воспроизводимости СФ метода количественного определения с 1,9-ДМС хондроитина сульфата были рассчитаны метрологические характеристики по результатам шести параллельных измерений трех концентраций определяемого вещества (табл. 1).
Таблица 1
Метрологические характеристики спектрофотометрического метода анализа хондроитина сульфата при = 500 нм (Р = 95%, t(р,f) = 2,57)
| µ | хср. | Ѕ | Ѕ | х-ср. ± х | ||
| 1 мкг/мл | 5 | 1,01 | 0,0008 | 0,0283 | 1,01 ± 0,07 | 7,20% |
| 150 мкг/мл | 5 | 148,8 | 12,1667 | 3,4881 | 148,8 ± 8,9 | 6,02% |
| 300 мкг/мл | 5 | 299,5 | 29,9000 | 5,4681 | 299,5 ± 14,1 | 4,69% |
Относительная ошибка результата для СФ метода количественного определения хондроитина сульфата с 1,9-ДМС находилась в диапазоне от 4,69 до 7,20%.
Количественное определение хондроитина сульфата в водном растворе ВЭЖХ методом проводили на высокоэффективном жидкостном хроматографе «Shimadzu» с УФ–детектором, интегратором «Shimadzu» и хроматографической колонкой µ-Bondapark фирмы Waters.

Исходя из УФ-спектра водного раствора хондроитина сульфата (рис. 3) для измерения методом ВЭЖХ была выбрана длина волны 200 нм.
Рис. 3. УФ-спектр водного раствора хондроитина сульфата с концентрацией 1 мкг/мл
Скорость потока 0,6 мл/мин.
Температура колонки – 20оС.
Подвижная фаза состояла из ацетонитрила, натриевая соль октансульфоновой кислоты, фосфатного буферного раствора и воды очищенной дегазированной.
Объем введения – 20 мкл.
Время регистрации хроматограммы – 10 минут.
Время удерживания хондроитина сульфата – около 1,3 минут.
Число теоретических тарелок (N) = 643,13.
С целью количественной оценки содержания хондроитина сульфата в образцах проб строили калибровочный график (рис. 4) зависимости площади пика от концентрации препарата в диапазоне концентраций 1 – 500 мкг/мл. В данном диапазоне калибровочная зависимость носила линейный характер.
Рис. 4. Калибровочный график зависимости площади пика от концентрации препарата в диапазоне концентраций 1 – 500 мкг/мл
Для оценки точности и воспроизводимости хроматографического метода количественного определения хондроитина сульфата были рассчитаны метрологические характеристики по результатам шести параллельных измерений трех концентраций определяемого вещества (табл.2).
Таблица 2
Метрологические характеристики ВЭЖХ метода определения хондроитина сульфата при = 200 нм (Р = 95%, t(р,f) = 2,57)
| µ | хср. | Ѕ | Ѕ | х-ср. ± х | ||
| 1 мкг/мл | 5 | 1,01 | 0,0009 | 0,0299 | 1,01 ± 0,08 | 7,59% |
| 150 мкг/мл | 5 | 150,8 | 12,9667 | 3,6009 | 150,8 ± 9,3 | 6,14% |
| 300 мкг/мл | 5 | 296,5 | 16,7000 | 4,0866 | 296,5 ± 10,5 | 3,54% |
Относительная ошибка результата для ВЭЖХ метода количественного определения хондроитина сульфата находилась в диапазоне от 3,54 до 7,59%.
Для сравнения двух методов анализа и решения вопроса о наличии или отсутствии систематической ошибки вычисляли критерий Стьюдента и систематическую ошибку (табл. 3).
Таблица 3
Сравнительная метрологическая характеристика СФ (при = 500 нм) и ВЭЖХ (при = 200 нм) методов анализа хондроитина сульфата (Р = 95%, t(р,f) = 2,57)
| №* п/п | µ (мкг/мл) | хср. | Ѕ | Ѕ | х | t выч | F(Р,f1,f2) P-95% | F выч | |||
| 1 2 | 1 | 5 | 1,01 1,01 | 0,0008 0,0009 | 0,0283 0,0299 | 0,0727 0,0768 | 7,20 7,59 | 0,8655 0,9585 | 10,97 | 0,8889 | - - |
| 1 2 | 150 | 5 | 148,8 150,8 | 12,1667 12,9667 | 3,4881 3,6009 | 8,9644 9,2543 | 6,02 6,14 | 0,8193 0,5668 | 10,97 | 0,9383 | - - |
*1 – СФ метод определения хондроитина сульфата;
2 – ВЭЖХ метод определения хондроитина сульфата
Так как рассчитанный коэффициент Стьюдента был меньше табличного значения как для СФ, так и для ВЭЖХ метода анализа (табл. 3), то полученные данными методами результаты не отягощены систематической ошибкой.
Для теста «Растворение» использовали прибор «ЛОРТС» производства АО «Гайот», Россия, аппарат «вращающаяся корзинка» и подобраны следующие условия: среда растворения - вода очищенная 1000 мл; температура 37оС; скорость вращения 75 об/мин; время растворения 45 минут. Пробы отбирали через 10, 15,20,30,45 минут.
Проводили шесть параллельных измерений каждой лекарственной формы.
Для выбора наиболее оптимального метода изучения кинетики высвобождения in vitro твердых дозированных лекарственных форм хондроитина сульфата сопоставлены результаты двух методов количественного определения высвобождения хондроитина сульфата из препарата «Структум» 250 мг: СФ и ВЭЖХ (рис. 5).
Рис. 5. Кинетика высвобождения хондроитина сульфата in vitro из капсул «Структум»
Поскольку СФ метод более прост в исполнении и требует меньших затрат времени, денежных средств, чем метод ВЭЖХ метод, то для дальнейшего исследования предпочли использование СФ метода при изучении высвобождения хондроитина сульфата из различных лекарственных форм.
Концентрацию хондроитина сульфата (%), высвободившегося из твердых дозированных лекарственных форм в среду растворения, рассчитывали по формуле:
Х (%) = Дстр.Vср.раств. ms 100%,
ДоLaVs
где Д0 - оптическая плотность стандартного раствора хондроитина сульфата;
Дстр. – оптическая плотность испытуемого раствора хондроитина сульфата;
ms – навеска стандартного образца хондроитина сульфата, мг;
Vs - объем воды очищенной, в которой растворили навеску стандартного образца хондроитина сульфата, мл;
Vср.раств – объем среды растворения, мл.
La – заявленное содержание хондроитина сульфата натрия в одной капсуле, мг.
Через 10 минут из таблеток хондроитина сульфата 250 мг в среду растворения высвободилось 81,0 ± 5,9%; из капсул хондроитина сульфата с микрокристаллической целлюлозой 250 мг – 55,7 ± 2,7%; из капсул хондроитина сульфата с поливинилпирролидоном 250 мг - 49,3 ± 3,0%; из препарата «Структум» 250 мг – 68,6 ± 6,7% (рис. 6).
Через 15 минут процент высвобождения таблеток хондроитина сульфата 250 мг и капсул «Структум» практически сравнялся: 84,4 ± 3,6% и 84,7 ± 5,3%; из капсул с микрокристаллической целлюлозой высвободилось 69,7 ± 9,1%; из капсул с поливинилпирролидоном – 64,9 ± 2,5%.
Через 20 минут из таблетированной лекарственной формы хондроитина сульфата в среду растворения перешло 88,2 ± 1,0%; из капсул с микрокристаллической целлюлозой – 74,7 ± 9,5%; из капсул с поливинилпирролидоном – 70,7 ± 4,9%; из капсул «Структум» в среднем – 91,6 ± 3,2%.
Рис. 6. Кинетика высвобождения хондроитина сульфата in vitro из различных лекарственных форм; 1 – таблетки хондроитина сульфата 250 мг, 2 – капсулы хондроитина сульфата с поливинилпирролидоном 250 мг, 3 – капсулы хондроитина сульфата с микрокристаллической целлюлозой 250 мг, 4 – капсулы «Структум» 250 мг
Через 30 минут от начала растворения были получены следующие показатели: из таблеток хондроитина сульфата 250 мг в среду растворения высвободилось 96,1 ± 4,4%; из капсул хондроитина сульфата с микрокристаллической целлюлозой 250 мг – 78,9 ±5,2%; из капсул хондроитина сульфата с поливинилпирролидоном 250 мг – 73,6 ± 1,1%; из препарата «Структум» 250 мг – 97,2 ± 2,5%.
Через 45 минут, в конечной точке растворения высвобождение из таблеток хондроитина сульфата и капсул «Структум» практически совпадает – около 100% (98,6% и 99,5%), из капсул с микрокристаллической целлюлозой высвободилось 81,1%, из капсул с поливинилпирролидоном - 73,0%.
Сопоставимость полученных профилей растворения оценивалась с помощью коэффициента различия и коэффициента подобия (табл. 4), методика определения которых была одобрена Center for Drug Evaluation and research (FDA) и Human Medicines Evaluation Unit of The European Agency for the Evaluation of Medicinal Products (EMEA), в качестве критериев оценки подобия профилей растворения «in vitro».
Таблица 4
Сопоставимость профилей растворения различных лекарственных форм хондроитина сульфата по отношению к препарату Структум
| Лекарственная форма | Коэффициент различия (f1) | Коэффициент подобия (f2) |
| Таблетки ХС, 250 мг | 4,0 | 61,6 |
| Капсулы ХС с МКЦ, 250 мг | 22,4 | 39,4 |
| Капсулы ХС с ПВП, 250 мг | 32,9 | 32,9 |
Учитывая, что различие между кривыми отсутствует, если фактор различия принимает значения от 0 до 15 и фактор подобия принимает значения от 50 до 100 видно, что таблетки хондроитина сульфата эквивалентны капсулам Структум (f1 = 4,0 и f2 = 61,6).
В результате сравнения профилей растворения таблеток хондроитина сульфата, капсул хондроитина сульфата с микрокристаллической целлюлозой, капсул хондроитина сульфата с поливинилпирролидоном с препаратом сравнения – капсулами «Структум» выявлено, что наиболее близким кинетике высвобождения хондроитина сульфата из препарата «Структум» является высвобождение из таблетированной формы.
Для выбора оптимальной твердой лекарственной формы хондроитина сульфата изучили относительную биодоступность хондроитина сульфата из различных лекарственных форм in vivo у экспериментальных животных.
Испытуемые животные: кролики породы шиншилла, массой 6,00 ± 0,25 кг, половозрелые, в спокойном состоянии. Фармакокинетическое исследование проводили по перекрестной схеме.
Были сформированы следующие статистические группы:
1 группа – таблетки хондроитина сульфата 250 мг, (n=6) и
препарат сравнения - капсулы «Структум» 250 мг;
2 группа - капсулы хондроитина сульфата с поливинилпирролидоном 250 мг, (n=6) и препарат сравнения - капсулы «Структум» 250 мг;
3 группа - капсулы хондроитина сульфата с микрокристаллической целлюлозой 250 мг, (n=6) и препарат сравнения - капсулы «Структум» 250 мг.
Животных из каждой группы методом простой рандомизации разделили на две равные подгруппы. В случайном порядке кроликам 1-й подгруппы вводили испытуемый препарат (250 мг, что соответствует 10 терапевтическим дозам), а затем спустя 14 дней – препарат сравнения. Другой подгруппе вводили препарат в обратном порядке. Решение, какой препарат (испытуемый или сравнения) будет вводиться первоначально, принималось случайно.
Препараты хондроитина сульфата вводили кроликам внутрижелудочно. Отбор крови осуществляли из ушной вены до введения, через 45 минут, 1,5, 3, 6, 10 часов после введения препарата. Кровь центрифугировали в течение 15 мин. Белки осаждали 5% трихлоруксусной кислотой и отделяли центрифугированием. Концентрацию глюкозаминогликанов в безбелковом экстракте сыворотки крови определяли СФ методом.
Предварительно определяли содержание в сыворотке крови эндогенных сульфатированных глюкозаминогликанов.
Установлено, что уровень глюкозаминогликанов в сыворотке крови животных достаточно высок и подвержен суточным колебаниям.
Также было проведено исследование содержания эндогенных сульфатированных глюкозаминогликанов у группы интактных животных на протяжении 10 часов, как и в экспериментальных сериях.
В дальнейших исследованиях уровень глюкозаминогликанов, регистрируемый в сыворотке, корректировался в соответствии с этими величинами. При этом концентрация эндогенных глюкозаминогликанов вычиталась из соответствующего значения, полученного после введения препаратов, содержащих хондроитина сульфата.
При введении кроликам таблеток хондроитина сульфата 250 мг, фармакокинетика глюкозаминогликанов носила сходный характер, с близкими значениями Cmax и tmax, при этом уровень глюкозаминогликанов в сыворотке во всем временном диапазоне (за исключением пробы, взятой через 10 часов от момента введения) был несколько ниже, чем у препарата сравнения.
Во второй статистической группе характер фармакокинетической кривой при введении капсул хондроитина сульфата с поливинилпирролидоном близок препарату сравнения, значения отклонений концентрации глюкозаминогликанов от эндогенного уровня достоверно ниже. Соответственно, расчетные значения фармакокинетических параметров Cmax и AUC600 в данной группе существенно ниже.
В третьей статистической группе фармакокинетическая кривая и значения основных расчетных параметров препарата сравнения капсул «Структум» близки к данным, полученным в остальных сериях экспериментов.
Проведенные исследования выявили у животных хорошую биодоступность всех исследованных лекарственных форм. Установлено, что все препараты сходным образом влияют на изменение концентрации сульфатированных ГАГ в сыворотке крови кроликов. Время достижения максимальной концентрации составляет 3 часа, значения максимальной концентрации варьируют от 48 до 68 мкг/мл для препарата сравнения и от 37 до 47 мкг/мл для исследованных новых лекарственных форм.
Поскольку на основании проведенных исследований in vitro и in vivo на животных наиболее близким к препарату сравнения оказались таблетки хондроитина сульфата, то для клинического исследования была выбрана указанная лекарственная форма.
Оценку относительной биодоступности и биоэквивалентности экспериментальных таблеток хондроитина сульфата и капсул «Структум» на здоровых добровольцах осуществляли открытым методом по перекрестной и рандомизированной схеме.
Добровольцы принимали внутрь натощак 3 таблетки хондроитина сульфата или 3 капсулы Структум (750 мг хондроитина сульфата). Отбор крови производился непосредственно перед и в течение 10 часов после приема препарата (по 10 образцов у каждого добровольца). Интервал времени между приемом двух исследуемых препаратов составлял 7 суток. Количественное определение глюкозаминогликанов в пробах сыворотки крови проводили методом ВЭЖХ, поскольку этот метод более чувствителен, с использованием хроматографического комплекса фирмы «Shimadzu».
В связи с тем, что в крови человека присутствуют эндогенные глюкозаминогликаны, концентрацию экзогенного хондроитина в пробах крови определяли, вычитая из общей концентрации глюкозаминогликанов, полученной после приема препарата, эндогенный уровень, установленный до приема каждого из препаратов у каждого добровольца.
Относительная степень всасывания хондроитина (относительная биодоступность - f) после приема препарата таблетки хондроитина сульфата и величина отношения максимальных концентраций препарата после приема испытуемого препарата и препарата сравнения (f) были близки к единице (в среднем 0,99 и 1,02 соответственно).
Дисперсионный анализ значений AUC10h, Сmax и Сmax/AUC10h, проведенный после их логарифмического преобразования, не выявил статистического значимого вклада различий между препаратами в наблюдаемую вариабельность (табл. 5).
Таблица 5
Результаты дисперсионного анализа значений фармакокинетических параметров хондроитина сульфата
| Параметр | Вариация | Число степеней свободы | Сумма квадратов отклонений | Средний квадрат отклонений | F | Вероятность | |
| AUC10h | Испытуемые | 17 | 1,9894 | 1,1702 | 62,9815 | 0,0000 | |
| Периоды | 1 | 5,7820 | 5,7820 | 3,1119 | 0,0968 | ||
| Последова- тельность | 1 | 2,2000 | 2,2000 | 1,9895 | 0,1775 | ||
| Препараты | 1 | 1,5538 | 1,5538 | 0,0836 | >0,30 | ||
| Остаток | 16 | 2,9728 | 1,8580 | - | - | ||
| Всего | 35 | 2,0250 | - | - | - | ||
| Остаточный коэффициент вариации 13,7% | |||||||
| Сmax | Испытуемые | 17 | 1,3242 | 7,7893 | 31,2259 | 0,0000 | |
| Периоды | 1 | 4,7924 | 4,7924 | 1,9212 | 0,1847 | ||
| Последова- тельность | 1 | 1,0012 | 1,0012 | 1,3087 | 0,2695 | ||
| Препараты | 1 | 3,4912 | 3,4912 | 0,1400 | >0,30 | ||
| Остаток | 16 | 3,9912 | 2,4945 | - | - | ||
| Всего | 35 | 1,3692 | - | - | - | ||
| Остаточный коэффициент вариации 15,9% | |||||||
| Сmax/AUC10h | Испытуемые | 17 | 1,3722 | 8,0717 | 2,7822 | 0,0233 | |
| Периоды | 1 | 1,3869 | 1,3869 | 0,0000 | >0,30 | ||
| Последова- тельность | 1 | 2,3654 | 2,3654 | 3,3325 | 0,0866 | ||
| Препараты | 1 | 5,7989 | 5,7989 | 0,1999 | >0,30 | ||
| Остаток | 16 | 4,6419 | 2,9012 | - | - | ||
| Всего | 35 | 1,8422 | - | - | - | ||
| Остаточный коэффициент вариации 17,2% | |||||||
Оценка биоэквивалентности по этим параметрам по критерию Schuirmanna позволяет сделать вывод о биоэквивалентности изученных препаратов, как по полноте, так и по скорости всасывания (табл. 6).
Таблица 6
Результаты оценки биоэквивалентности изученных препаратов по критерию Schuirmanna
| Параметр | Допустимые границы C.I. | Уровень значимости |
| AUC10h | Нижняя – 0,80 Верхняя – 1,25 | 0,0001 0,0000 |
| Сmax | Нижняя – 0,75 Верхняя – 1,33 | 0,0000 0,0001 |
| Сmax/AUC10h | Нижняя – 0,75 Верхняя – 1,33 | 0,0000 0,0002 |
Характер фармакокинетических кривых, полученных после приема препаратов таблетки хондроитина сульфата и Структум, в целом сходен, индивидуальная вариабельность концентраций препарата в обоих случаях статистически достоверно не отличались.
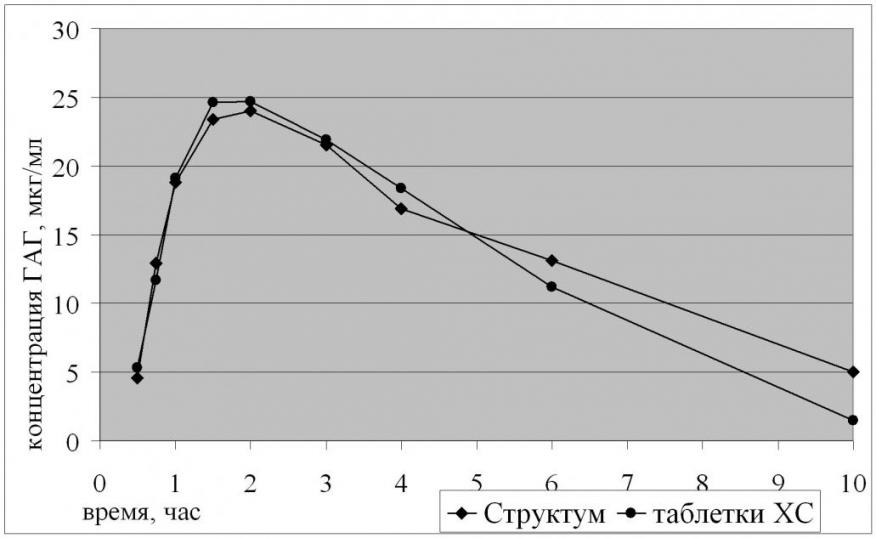
Как видно на рисунке 7, кривые характеризуются сходной формой, причем во всех временных точках различия между соответствующими значениями концентрации статистически недостоверны (р = 0,05).
Рис. 7. Усредненные фармакокинетические профили хондроитина сульфата в сыворотке крови добровольцев с учетом эндогенного уровня
Рассчитанные по усредненным данным параметры фармакокинетики хондроитина сульфата приведены в таблице 7.
Таблица 7
Фармакокинетические параметры хондроитина сульфата, рассчитанные по усредненным данным
| Препарат | Tlg, ч | tmax, ч | Cmax, мкг/мл | ka, ч | kel, ч | C10h, мкг/мл | AUC10h, мкгч/мл | AUC, мкгч/мл | |
| Таблетки ХС | 0,41 | 1,86 | 24,3 | 1,67 | 0,197 | 5,53 | 129 | 157 | 82 |
| Структум | 0,41 | 1,87 | 24,0 | 1,65 | 0,197 | 5,49 | 138 | 166 | 83 |
Как видно из представленных в таблице 7 данных, значения всех фармакокинетических параметров, рассчитанные по усредненным данным, для препаратов таблетки хондроитина сульфата и Структум отличаются незначительно. Сопоставление значений AUC48h с AUC – их отношение составляло более 80% (82% для таблеток хондроитина сульфата и 83% для препарата Структум), свидетельствую о том, что выбранный регламент фармакокинетического исследования обеспечивает необходимую надежность оценки биодоступности хондроитина.
Выводы
- Разработана точная, воспроизводимая методика количественного определения хондроитина сульфата методом СФ при длине волны 500нм. Зависимость оптической плотности от концентрации хондроитина сульфата носила линейный характер в диапазоне концентраций от 1 мкг/мл до 300 мкг/мл (r2 = 0,9939). Относительная ошибка СФ метода количественного определения хондроитина сульфата с 1,9-диметилметиленовым синим находилась в диапазоне от 4,69 до 7,20%.
- Разработана методика количественного определения хондроитина сульфата методом ВЭЖХ при длине волны 200 нм. Зависимость площади пика от концентрации раствора хондроитина сульфата носила линейный характер в диапазоне от 1мкг/мл до 500 мкг/мл (r2 = 0,999). Относительная ошибка результата для ВЭЖХ метода количественного определения хондроитина сульфата находилась в диапазоне от 3,54 до 7,59%.
- Подобраны оптимальные условия проведения испытания «Растворение» для препаратов хондроитина сульфата: среда растворения - вода очищенная, оборудование - аппарат «вращающаяся корзинка»; скорость вращения – 75об/мин., объем среды растворения – 1000 мл. Количественное определение – СФ при = 500 нм.
- Изучена кинетика высвобождения in vitro хондроитина сульфата из твердых дозированных лекарственных форм с различным составом вспомогательных веществ. В результате сопоставления профилей растворения различных твердых дозированных лекарственных форм хондроитина сульфата установлено, что наиболее близким кинетике высвобождения хондроитина сульфата из препарата «Структум» является высвобождение из таблетированной формы.
- Изучена относительная биодоступность различных лекарственных форм хондроитина сульфата у экспериментальных животных. Время достижения максимальной концентрации составляет 3 часа, значения параметра Cmax варьируют в пределах от 48 до 68 мкг/мл для препарата сравнения и от 37 до 47 мкг/мл для исследованных новых лекарственных форм отечественного производства. Установлено, что наиболее близкими к препарату сравнения – капсулам Структум являются таблетки хондроитина сульфата (100,6% от соответствующих значений этого параметра у препарата сравнения).
- Изучена относительная биодоступность и биоэквивалентность хондроитина сульфата у здоровых добровольцев. Выявлено, что таблетки хондроитина сульфата биоэквивалентны капсулам «Структум». Данная лекарственная форма рекомендована для медицинского применения.
Список работ, опубликованных по теме диссертации
- Хубиева А.Ю., Василенко Г.Ф., Раменская Г.В. Сравнительная биодоступность различных лекарственных форм хондроитина сульфата// Материалы XIII Российского национального конгресса «Человек и лекарство». – М., 2006. – С.602.
- Хубиева А.Ю., Красных Л.М., Василенко Г.Ф. Разработка методик высокоэффективной жидкостной хроматографии и спектрофотометрического определения для анализа лекарственных форм хондроитина сульфата// Материалы XIII Российского национального конгресса «Человек и лекарство». – М., 2006. – С.603.
- Хубиева А.Ю., Василенко Г.Ф., Красных Л.М. Сравнительная биодоступность различных лекарственных форм хондроитина сульфата// Материалы научно – практической конференции «Клинико–фармакологические подходы в оптимизации фармакотерапии» – М., 2006. – С.64.
- Хубиева А.Ю., Василенко Г.Ф. Изучение биодоступности лекарственных средств с хондроитина сульфатом// Биомедицина.- 2006.-№6. – С.48-49.
- Хубиева А.Ю., Ших Е.В., Раменская Г.В., Кукес В.Г. Исследование клинической эффективности и переносимости препарата Хондроитин-АКОС у больных остеоартрозом// Трудный пациент. – 2006. –Том 4. - №12. – С.-63-66.
- Хубиева А.Ю., Раменская Г.В. Кинетика высвобождения in vitro хондроитина сульфата из твердых дозированных лекарственных форм// Материалы XIV Российского национального конгресса «Человек и лекарство». – М., 2007. – С.35.
- Хубиева А.Ю., Раменская Г.В. Анализ различных лекарственных форм хондроитина сульфата методом высокоэффективной жидкостной хроматографии и спектрофотометрическим методом// Материалы XIV Российского национального конгресса «Человек и лекарство». – М., 2007. – С.893-894.
- Хубиева А.Ю., Раменская Г.В. Кинетика высвобождения хондроитина сульфата из твердых лекарственных форм// Фармация. – 2007. - №3. – С.25-27.

