Сигнальные пути ядерного транскрипционного фактора каппа в ( nf-b ) в чувствительных нейронах
На правах рукописи
Гущина Светлана Валентиновна
Сигнальные пути ядерного транскрипционного фактора каппа В (NF-B) в чувствительных нейронах
03.03.04. – клеточная биология, цитология, гистология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора биологических наук
Саранск – 2010
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Российский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию» и в Центре нейронаук Университета Лондона
Научные консультанты:
доктор медицинских наук
академик РАМН, профессор Волкова Ольга Васильевна
доктор биологических наук,
профессор Кругляков Павел Павлович
Официальные оппоненты:
доктор биологических наук,
профессор Ермолин Игорь Леонидович
доктор медицинских наук,
профессор Челышев Юрий Александрович
доктор медицинских наук,
профессор Швалев Вадим Николаевич
Ведущая организация: Научный центр неврологии РАМН
Защита состоится «_15_» октября 2010 года в 10.00 часов на заседании диссертационного совета Д 212.117.01 при ГОУ ВПО «Мордовский государственный университет имени Н.П. Огарева» (430000, Республика Мордовия, г. Саранск, ул. Большевистская, 68).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Мордовский государственный университет имени Н.П. Огарева» (430000, Республика Мордовия, г. Саранск, ул. Большевистская, 68).
Автореферат разослан «_______» ________________ 2010 года
Ученый секретарь диссертационного совета
доктор биологических наук, профессор В.П. Балашов
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Раскрытие молекулярных механизмов регуляции нейродегенеративных/нейрорегенеративных процессов при травмах головного и спинного мозга, а также различных повреждениях периферических нервов – одна из важнейших проблем современных нейронаук, решение которой связано с разработкой новейших подходов к лечению этих тяжелых состояний. Одним из важных направлений исследований в этой области остается изучение клеточных и молекулярных процессов, лежащих в основе регенерации периферического нерва, понимание которых поможет решить фундаментальные проблемы регенерации нервной ткани.
Выживание нейронов является ведущим фактором, обеспечивающим успешную регенерацию периферического нерва и восстановление функций иннервируемой ткани после его повреждения (Рагинов, Челышев, 2003). Известно, что выживание нейронов зависит от снабжения их нейротрофическими факторами, поставляемыми в том числе иннервируемой тканью. Зрелые чувствительные нейроны проявляют способность выживать после аксотомии и потери связи с иннервируемой тканью. Более того, эти клетки могут находиться in vitro при полном отсутствии в питательной среде нейротрофических факторов (Lindsay et al., 1994), в отличие от эмбриональных чувствительных нейронов, которым нейротрофическая поддержка необходима для выживания (Davies, 2000; Middleton et al., 2000), как и активация ядерного транскрипционного фактора NF-B.
Многочисленные молекулярные и клеточные изменения в спинномозговых ганглиях после повреждения периферического нерва изучены достаточно глубоко (Baldwin, 1996; Koliatsos, Price, et al., 1996). Особое внимание в настоящее время уделяется исследованию процессов, происходящих в клетках на молекулярном уровне и включающих индукцию транскрипционных факторов, регулирующих последующую активацию и транскрипцию специфических генов регенерации.
Было обнаружено, что стимулирующим фактором при регенерации периферического нерва может служить развитие воспалительной реакции вокруг перикарионов нейронов спинномозговых узлов (Lu, Richardson, 1991), молекулярные механизмы которой связаны в том числе с индукцией цитокинов, таких, как интерлейкин-6 (Murphy et al., 1999), фактор некроза опухоли альфа (TNF-) (Schafers et al., 2003) и др. Ядерный транскрипционный фактор NF-B является классическим мессенджером, регулирующим каскады реакций, связанные с различными цитокинами и клеточной гибелью.
Со времени открытия NF-B (Sen and Baltimore, 1986) и его роли медиатора апоптоза в клетках иммунной системы (Beg et al., 1995) ученые активно изучали его функции и в нервной системе. В последние годы наблюдается стремительный рост числа работ, посвященных его участию в процессах развития, пластичности, нейродегенерации и травмы (Mattson, Camandola, 2001). Однако его роль в выживании зрелых нейронов ЦНС оказалась противоречивой. Так, было обнаружено, что ингибирование NF-B в нейронах переднего мозга приводит к их апоптозу в результате нейротоксического поражения (Fridmacher et al., 2003), а в кортикальных нейронах может предотвратить апоптоз при экспериментальной ишемии мозга (Herrmann et al., 2005).
В нейронах спинномозговых ганглиев NF-B исследовали для выявления его потенциальной нейропротекторной роли после травмы периферического нерва (Doyle, Hunt, 1997; Fernyhough et al., 2005). Зрелые чувствительные нейроны по своей природе относительно устойчивы к апоптозу, вызванному перерезкой периферического нерва (Koliatsos, Price, 1996). В противоположность этому гибель нейронов происходит гораздо быстрее после травмы в эмбриональном или раннем постнатальном периоде (Whiteside et al., 1998). Нейропротекторная роль NF-B в зрелых чувствительных нейронах описана в экспериментах на культуре спинномозговых нейронов in vitro (Fernyhough et al., 2005). Однако сложность этого фактора обусловливает противоречивость заключений о сигнальных путях NF-B в поврежденных нейронах.
До настоящего времени все еще дискутируется (Memet, 2006) вопрос о роли NF-B в процессах контроля выживаемости и гибели нейронов после травмы периферического нерва в условиях in vivo. Это отчасти связано с тем, что сложно четко разграничить in vivo два не исключающих друг друга потенциальных механизма действия NF-B: непрямое влияние на нейроны, опосредованное активацией NF-B в глиальных клетках, или непосредственное участие этого фактора в регуляции активности нейрональных генов. В существующих генетических линиях нокаутных мышей не происходит инактивации гена NF-B в каком-то одном типе клеток, что делает невозможным разделение дейстия NF-B в глиальных клетках и нейронах (Pasparakis et al., 2006). В связи с этим возникла необходимость генерировать трансгенную линию мышей, в которых активность NF-B ингибирована исключительно в зрелых нейронах, для дальнейшего изучения функциональной роли нейрональной NF-B.
Цели исследования. Цель настоящей работы – изучить биологическую роль ядерного транскрипционного фактора NF-B и молекулярных механизмов, регулирующих его активность в зрелых нейронах спинальных ганглиев после травмы периферического нерва.
Задачи исследования. Для достижения поставленной цели необходимо было решить ряд конкретных задач.
1. Выяснить, повышается ли посттравматическая экспрессия NF-B-зависимых генов MCP-1 (monosyte chemoattractant protein-1) и IB (inhibitor of NF-B) в зрелых нейронах спинальных ганглиев in vivo и при стимуляции культуры чувствительных нейронов провоспалительными цитокинами (TNF-) in vitrо.
2. Провести анализ ДНК-связывающей активности NF-B в посттравматических нейронах in vivo и при стимуляции культуры чувствительных нейронов TNF- in vitro.
3. Создать трансгенную линию мышей с модифицированной активностью транскрипционного фактора NF-B in vivo специфически в зрелых нейронах и провести молекулярно-генетический анализ полученных линий.
4. Изучить на трансгенной модели животных биологический эффект ингибирования нейрональной активности NF-B, оказываемый на основные физиологические параметры и посттравматическую выживаемость зрелых чувствительных нейронов.
5. Выявить транскрипционную активность NF-B в зрелых чувствительных нейронах in vivo и in vitro с использованием трансгенной линии репортерных мышей NF-B/LacZ.
6. Определить регуляторное влияние процессов ацетилирования на активацию сигнальных путей NF-B в нейронах спинальных ганглиев трансгенных мышей репортерной линии NF-B/LacZ in vitro.
Основные положения, выносимые на защиту.
1. Посттравматические молекулярные изменения зрелых чувствительных нейронов крыс породы Вистар включают в себя изменения уровня экспрессии ряда NF-B –зависимых генов и ДНК –связывающей активности NF-B in vivo и in vitro.
2. Созданная генетически модифицированная линия мышей Thy*IB-SI проявляет специфическую нейрональную экспрессию суперингибитора NF-B.
3. Травма седалищного нерва in vivo и стимуляция культуры чувствительных нейронов TNF- in vitro вызывает транслокацию р65 иммунореактивности в ядро нейронов у мышей дикого типа, в то время как трансгенная линия Thy*IB-SI мышей проявляет пониженную способность NF-B к перемещению в ядро при повреждении периферического нерва in vivo и активации цитокинами in vitro.
4. Трансгенное ингибирование активности NF-B в зрелых нейронах модифицированных мышей не влияет на основные физиологические параметры и посттравматическую выживаемость зрелых чувствительных нейронов in vivo.
5. Мониторинг экспрессии репортерного гена в NF-B/LacZ трансгенной линии мышей, отражающей реальную транскрипционную активность NF-B, показывает ее отсутствие как в интактных, так и в посттравматических нейронах спинномозговых ганглиев in vivo, в отличие от нейронов ЦНС.
6. Активность сигнальных путей NF-B в чувствительных нейронах регулируется процессами ацетилирования/деацетилирования, и отсутствие влияния NF-B в зрелых нейронах спинальных ганглиев объясняется процессами деацетилирования, подавляющими транскрипционную активность ядерного фактора.
Научная новизна. Несмотря на обилие в мировой литературе данных, показывающих важную роль ядерного транскрипционного фактора B (NF-B) в процессах нейродегенеративных состояний нервной системы, публикации, посвященные практическим вопросам создания и экспериментального применения моделей животных с генетически модифицированной активностью NF-B специфически в зрелых нейронах, единичны. До настоящего времени это единственная трансгенная модель, в которой целенаправленно ингибируется активность NF-B в зрелых нервных клетках in vivo. Для создания модели Thy*IB-SI была использована мутантная форма ингибитора NF-B – IB-SI, которая не подвержена деградации и поэтому действует как супер-репрессор NF-B активности, удерживая и изолируя в цитоплазме каждый NF-B/RelA комплекс, предотвращая связывание с ДНК и активацию транскрипции. Результаты анализа показали, что ген мутантной формы ингибитора NF-B успешно экспрессируется исключительно в нейронах трансгенных мышей. Предложенная нами модель выгодно отличается тем, что Thy-1.2-промотор, под регуляторным действием которого находится ген суперингибитора NF-B, активируется строго специфически в зрелых нейронах трансгенных мышей на 8 день постнатального развития и не затрагивает механизмы нейронального развития.
С помощью созданной нами модели впервые показано, что трансгенное репрессирование NF-B не влияет на основные физиологические свойства чувствительных нейронов in vivo, а также на их количество в спинномозговых ганглиях в норме и не ведет к изменениям выживаемости нейронов после травмы периферического нерва in vivo.
В данной работе предлагается также новый подход к регистрации транскрипционной активности NF-B in vivo с использованием трансгенной репортерной линии мышей NF-B/LacZ. Полученные данные впервые показывают, что даже при активации NF-B-ДНК-связывающей активности в чувствительных нейронах, реальная транскрипционная активность может быть репрессирована действием гистоновых деацетилаз.
Практическое и теоретическое значение работы. Важность данной работы для фундаментальной науки и практической медицины обусловлена необходимостью понимания молекулярных и генетических программ, контролирующих процессы выживаемости нейронов и нейрональной регенерации. Результаты исследования позволяют расширить представления о сложноорганизованной системе регуляции транскрипционного фактора NF-B в чувствительных нейронах. Выявленный молекулярный механизм, опосредованный гистоновыми деацетилазами объясняет транскрипционную репрессию NF-B в нейронах спинномозговых ганглиев, что позволяет говорить об ограничении функций NF-B in vivo в зрелой ПНС в отличие от таковых в ЦНС.
Результаты наших исследований указывают на необходимость дальнейших изысканий в области раскрытия роли транскрипционных механизмов в нейрональной репарации. Так, необходимо более детально изучить процессы ацетилирования/деацетилирования гистонов в чувствительных нейронах, в частности их участие в регенерации.
Использование созданной линии мышей Thy*IB-SI в экспериментальных моделях травмы, стресса и др. дает широкую возможность для изучения биологической роли NF-B в зрелых нейронах как центральной, так и периферической нервной системы.
Внедрение результатов исследования. Результаты исследования внедрены в научно-исследовательскую работу и учебный процесс кафедры гистологии и эмбриологии педиатрического факультета Российского государственного медицинского университета, кафедры гистологии Московской медицинской академии им. Сеченова, и служат обоснованием для продолжения исследования молекулярных механизмов регуляции нейродегенеративных/нейрорегенеративных процессов при травмах периферического нерва, а также головного и спинного мозга.
Апробация работы. Материалы работы докладывались на различных отечественных и международных конференциях, в том числе на William Harvey Day Conference (Queen Mary’s School of Medicine and Dentistry, University of London (Великобритания, Лондон, 2003, 2004, 2005), международной конференции Society for Neuroscience, 34th Annual Meeting San Diego (США, Сан-Диего, 2004), Всероссийской конференции «Инновационные технологии в трансплантации органов, тканей и клеток» (Самара, 2008), международной конференции «Проблемы современной морфологии человека» (Москва, 2008), VI съезде ВНОАГЭ (Саратов, 2009)
Публикации. По теме диссертации опубликовано 20 научных работ в отечественной и зарубежной печати.
Структура и объем диссертации. Диссертация изложена на 253 страницах машинописного текста и состоит из введения, обзора литературы, описания материалов и методов исследования, глав собственных исследований, обсуждения полученных результатов, выводов, списка литературы, включающего 345 источников. Работа иллюстрирована 45 рисунками и 5 таблицами.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Экспериментальные животные. Животные содержались в виварии колледжа Queen Mary Университета Лондона (the Biological Service Unit (BSU) of Queen Mary), все эксперименты были проведены в соответствии с этическими правилами по защите позвоночных животных, используемых для экспериментальных и иных научных целей, установленными «the Home Office» (Великобритания). У зрелых мышей (возраст 2–5 месяцев) или зрелых крыс породы вистар (массой 200–250 г) под изофлюрановым наркозом в асептических условиях перерезали левый седалищный нерв на уровне середины бедра. Правый контралатеральный седалищный нерв не оперировали. Интактные (неоперированные) животные использовались как контроль. В подопытной группе через 6, 12, 24, 48 часов и 1 неделю после травмы нерва и у 10 интактных животных под изофлюрановым наркозом после ламинэктомии выделяли спинномозговые узлы на уровне LIV–LV с левой стороны для последующей экстракции РНК или фракции ядерных белков, а также гистологического анализа (X-gal, TUNEL, иммуногистохимия)
Экспериментальная модель воспаления периферического нерва. Воспаление периферического нерва моделировали на трансгенных репортерных мышах NF-B/LacZ в условиях изофлюранового наркоза путем введения полной формы адъюванта Фройнда (complete Freund’s adjuvant – CFA; «Sigma», Великобритания). Для этого анестезированным мышам были сделаны инъекции 200 мкл CFA в физиологическом растворе (1:1) в подошвенную область левой задней конечности. Контрольные животные получали инъекции 200 мкл физиологического раствора. У животных подопытной и контрольной групп через 24 часа после инъекции под изофлюрановым наркозом после ламинэктомии выделяли спинномозговые узлы на уровне LIV–LV с левой стороны для последующего X-gal-анализа.
Получение первичной культуры чувствительных нейронов. Спинномозговые узлы выделяли в стерильных условиях у взрослых крыс или зрелых трансгенных мышей на уровне LIV – LV и помещали в среду Хэнкса («Sigma», Великобритания) на льду. В дальнейшем диссоциацию и культивирование нейронов осуществляли, как описано Holmes с соавторами (2000). Плотность клеточной популяции составляла примерно 800 клеток на 1 плашку. Клетки инкубировали в среде роста в инкубаторе при 37 0С и 5 % СО2.
Индукция активности NF-B. Для стимуляции активности NF-B нейроны спинномозговых ганглиев культивировали 48 часов и затем подвергали действию TNF- (30 нг/мл), липополисахарида (10 мг/мл) или трихостатина А (5 M) (все производства «Sigma», Великобритания). В частности, нейроны культивировали в плашках в среде роста F-12 в течение 16 часов, после чего в среду добавляли TNF- («Sigma», Великобритания) (30 нг/мл), клетки инкубировали дополнительно 10, 20 и 30 минут и нейроны обрабатывали для последующего X-gal-анализа или собирали для дальнейшей экстракции РНК или ядерных белков.
Количественная полимеразная цепная реакция (ПЦР) в реальном времени. Для эксперимента in vivo оперированные крысы были убиты через 6, 12, 24, 48 часов и 1 неделю после перерезки седалищного нерва. Два пула LIV–LV спинномозговых ганглиев (оперированной и контралатеральной сторон) были собраны вместе для последующей экстракции РНК, которую в эксперименте in vitro осуществляли из первичной культуры чувствительных нейронов (контрольной и после соответствующей TNF--стимуляции).
Для экстракции РНК использовали метод с тризолом (The TRIzol protocol, «Life Technologies», США). Для определения количества выделенной РНК 1 мкл растворенной РНК брали для обработки на спектрофотометре (Biorad SMARTSPECTRUM 3000, CA, США). Оставшийся раствор РНК хранили при –70 оС до дальнейшего использования.
Обратную транскрипцию осуществляли в амплификаторе («Biometra», Дания) с использованием фермента обратной транскриптазы (The SuperScriptTM III RNAase H Reverse Transcriptase, «Life Technologies», США) следуя протоколу, предоставленному компанией-производителем. Режим инкубации: 5 мин при 25 оС, 60 мин при 50 оС, 15 мин при 70 оС После окончания реакции пробирки с реакционной смесью хранили при –70 оС.
Выбор праймеров для ПЦР проводили на основании данных GeneBank. Для дизайна праймеров были использованы известные последовательности генов: для гена IB крысы – номер в каталоге GeneBank XM_234230, для гена MCP-1 крысы – NM_031530. Праймеры и пробы для генов IB и MCP-1 были разработаны с помощью программы «Primer 3» в соответствии с требованиями, представленными компанией «Corbett research» (Австралия). Праймеры были изготовлены в компании «Invitrogen» (Великобритания), TaqMan-проба для гена IB – в компании «MWG-Biotech AG» (Великобритания) и для гена MCP-1 крысы – в компании «Applied Biosystems» (Великобритания). Нуклеотидные последовательности использовавшихся праймеров (прямой/обратный) в направлении 5’ – 3’ приведены ниже: IB – TGAGGAGAGCTATGACACGG (5`-primer) и TGGCCTCCAAACACACAGT (3’-primer) и TaqMan-пробы соответственно CACGGAAGATGAGTT-CCCTACGA; MCP-1 – CACTCACCTGCTGCTACTC (5’-primer) и CTGCTGCTGGTGATTCTCTT (3’-primer) и TaqMan-пробы соответственно TCCCAATGAGTCGGCTGGAGAA. 5’-конец каждой пробы и 18S-рРНК-контроля были помечены флуоресцентными метками FAM и VIC соответственно, тогда как 3’-концы – гасителем флуоресценции TAMRA.
Количественная ПЦР в реальном времени. Экспрессию генов IB и MCP-1 изучали в каждом пуле спинальных ганглиев: 1) относящихся к левому перерезанному седалищному нерву, 2) контралатерально располагающихся, 3) контрольных и 4) TNF--стимулированных пулах культуры чувствительных нейронов. Количественную ПЦР в реальном времени проводили одновременно для всех экспериментальных образцов с использованием одинаковых условий и компонентов. Все образцы загружали в трехкратном повторении. Для качественной оценки уровня экспрессии исследуемых генов в каждой реакции одновременно использовали сравнение с уровнем экспрессии референсного гена – 18S-рРНК-контроль.
Для построения контрольной стандартной кривой 5 разведений сDNA селезенки включали в каждую реакцию. Наиболее концентрированным считалось кДНК селезенки (1:0). Каждая последующая концентрация достигалась разведением 1:10 предыдущего стандарта. При этом во все серии реакций включали безматричный контроль, в котором экспериментальный образец заменяла вода. Все образцы, стандарты и безматричный контроль загружали в трехкратном повторении в каждой серии ПЦР в реальном времени. Для контроля каждой реакции использовали праймеры и пробы референсного гена 18S-рРНК.
2 мкл матрицы добавляли к следующей смеси: 1,5 мкл IB-праймера 1; 1,5 мкл IB-праймера 2; 1 мкл IB TaqMan-пробы; 0, 25 мкл 18S-рРНК-праймера 1; 0, 25 мкл 18S-рРНК-праймера 2; 0, 25 мкл 18S-рРНК TaqMan-пробы; 25 мкл TaqMan Universal PCR Master Mix No AmpErase UNG («Abgene», Германия) и 16,25 мкл очищенной от нуклеаз H2O. Образцы помещали в амплификатор в реальном времени (the Rotogene 3000 quantitative real-time PCR machine, «Corbett Research», Австралия) и задавали следующую программу нагрева: 10 мин при 95 оС (для активизации Hot-Start Tаq-фермента), 1 мин при 60 оС (для стимуляции и обнаружения флуоресценции), 15 с при 95 оС. Этот цикл повторялся 45 раз. По окончании эксперимента данные обрабатывали программой «Rotogene software. Version 4.6» («Corbett Research», Австралия). Рассчитанная концентрация образцов (число копий/мкл) была нормализирована к концентрации 18S-рРНК. Полученную относительную величину использовали для определения количества продукта исследуемых генов в каждом образце.
Метод сдвига электрофоретической подвижности (EMSA – electrophoretic mobility shift assay). Для приготовления клеточного экстракта первичную культуру нейронов спинномозговых ганглиев (в концентрации 2 – 4 х106) осаждали центрифугированием, отмывали охлажденным до 0 оС PBS и затем ресуспендировали в 200 мкл низкосолевого буфера (10 мМ HEPES, pH 7,9, 10 мМ KCl, 2 мМ MgCl2, 0,1 мМ EDTA, 10 мМ NaF, 10 мМ Na4P2O7, 2 мМ Na3VO4 с добавлением ингибиторов протеаз – 10 мкг/мл апротинина, 10 мкг/мл леупептина, 100 M AEBSF).
Для приготовления клеточного экстракта спинальных ганглиев 6 из них объединили, суспендировали в 200 мкл низкосолевого буфера и гомогенизировали с помощью стеклянного гомогенизатора 15 раз. Подобную процедуру провели и с другими образцами (селезенка крысы, зрелый мозг крысы, мозг новорожденных крысят). После 15-минутной инкубации на льду добавляли NP40 в конечной концентрации 0,6 % и в дальнейшем придерживались методике, описанной Yousaf с соавторами (2005).
Трансгенная линия мышей Thy*IB-SI
1. Генерация трансгенной линии мышей Thy*IB-SI. Для создания трансгенной линии мышей Thy*IB-SI был использован мощный трансдоминантный ингибитор NF-B (IB-SI) (Voll et al., 2000), являющийся мультимутантной формой ингибиторного протеина IB. Суперингибитор NF-B – IB-SI был включен в XhoI-участок специфической нейральной Thy-1.2-кассеты (Caroni, 1997), обеспечивающей экспрессию трансгена строго в зрелых нейронах трансгенных животных (tg). В частности, IB-IR-кодирующий участок был амплифицирован из плазмиды IBRR (Voll et al., 2000), с помощью прямой ПЦР, присоединивший фланкирующий сайт узнавания рестриктазы SalI к XhoI-участку Thy-1.2-кассеты. Праймеры для ПЦР: forward – 5’-gacgcgtcgacgcggccgccaccATGGACTACCCCTACGACGTC-CCCGACTAC-3’, reverse: 5’-gacgcgtcgacgcggccgcTCATAACGTCAGACGCTGGCC-TCCAAACAC-3’ (прописные буквы – последовательность, комплементарная кодирующему участку мутантной формы IB, подчеркнутые – сайт узнавания рестриктазы SalI, полужирные – сайт узнавания рестриктазы NotI). В реакции использовали фермент «Patinum Pfx DNA Polymerase» («Invitrogen», Великобритания). Режим ПЦР: 94 0C – 30 c, 50 0C – 30 c, 72 0C – 3 мин в течение 30 циклов.
Амплифицированный ДНК-фрагмент очищали с использованием набора «Qiagen-II agarose gel extraction method», разрезали с помощью SalI-эндонуклеазы и встраивали в комплементарный XhoI-участок Thy.1-кассеты. Полученную конструкцию Thy*IB-SI использовали для генерации трансгенных животных путем пронуклеарной микроинъекции генетической конструкции в зиготу гибридной линии CBAxC57BL/10. В поколении F1 обнаружили 7 позитивных животных, которых затем использовали для скрещивания с мышами линии СВА. 3 трансгенные линии были получены и зарегистрированы в FESA (Frozen Embryo & Sperm Archive, MRC Harwell) как Tg(Thy-mutIkB)74-3, -5 и -7.
2. Генотипирование мышей трансгенной линии Thy*IB-SI. Трансгенных животных генотипировали с помощью ПЦР, которая одновременно выявляла и трансген, и его эндогенный гомолог (см. рис. 16, Б). Геномную ДНК выделяли из образца ткани уха животного с помощью набора реагентов «Direct PCR Lysis Reagent» («Viagen Biotech, Inc», Великобритания) следуя протоколу компании, и подвергали амплификации методом ПЦР (Thermo-start High Performance PCR Master Mix («Abgene», Великобритания)) (праймеры: 5’-TTGCCTGTGAGCAGGGCTGCCT-3’ (Pr-1, forward) и 5’-GTCAGCTGGCCCAGCTGCTGCT-3’ (Pr-2, reverse), режим нагрева: однократно 95 0C в течение 15 мин и 30 циклов 95 оC – 30 с, 60 оC – 30 с и 72 оC – 90 с).
3. Анализ экспрессии трансгена.
3.1. Метод ПЦР с предварительным использованием обратной транскрипции (Reverse Transcription, RT–PCR). Экспрессию трансгена IB-SI выявляли в различных тканях методом ПЦР с предварительным использованием обратной транскрипции. Общую РНК выделяли методом с применением тризола (Trizol method, «Life Technologies», GibcoBRL), следуя протоколу производителя. В частности, 25 нг общей РНК подвергали обратной транскрипции с использованием фермента обратной транскриптазы (ImPromII Reverse Transcriptase) (протокол «Promega», Великобритания). В реакционную смесь вносили праймеры, специфические к последовательности человеческого IB-трансгена: 5’-GGGAGGGAGTCAGCTGACCG-3’ (прямой) и 5’-AGGGCTGCCTGGCCAGCTTG-3’ (обратный), режим ПЦР: 95 0C – 15 c, 60 0C – 30 c и 72 0C – 1 мин, 30 циклов. В качестве позитивного контроля использовали ген GAPDH (5’-TGAAGGTCGGTGTGAACGGAT-TTGGC-3’ (forward) и 5’-GCTAAGCAGTTGGTGGTGAC-3’ (reverse).
3.2. Метод гибридизации in situ ( in situ hybridization). Экспрессию трансгена IB-SI в нервной системе определяли методом гибридизации радиоактивно меченной пробы на криостатных срезах in situ (in situ hybridization), как описано Michael с соавторами (1997). Олигонуклеотидная проба 5’-AGGCGTAGTCGGGGACGTCGTAGGGGTA-GTCCAT-3’ была создана комплементарной к НА (гемагглютинин)-эпитопу tag (HA epitope tag) IB-SI-трансгена и была мечена по 3’-концу с помощью 35S-dATP (Dupont NEN, Wilmington) и фермента терминальной трансферазы (terminal transferase («Promega», Великобритания) со специфической активностью ~5000 Ci/ммоль.
После гибридизации срезы промывали 2 раза по 15 мин при комнатной температуре в 2х SSC, 2 раза при 50 0С в 1х SSC и 1 раз при 50 0С в 0,2х SSC, затем дополнительно в течение 2 часов в 1х SSC при комнатной температуре. После этого их дегидратировали в этаноле и погружали в авторадиографическую эмульсию (Amersham LM1) и экспонировали в течение 4–8 недель. После этого срезы окрашивали толуидиновым синим, дегидратировали и покрывали покровными стеклами.
3.3. Экспрессию IB-SI протеина в экстрактах спинного мозга определяли методом вестерн-блот-анализа, как описано Voll с соавторами (2000), используя антитела к IB (C21, «Santa Gruz», США) в разведении (1:100).
Анализ периферических сенсорных функций. Температурную чувствительность анализировали с применением теста Харгривса (the Hargreaves test). Тестируемую мышь помещали в индивидуальный пластиковый ящик с выдвигающимся пластиковым полом и оставляли акклиматизироваться в течение 30 минут перед тестом. Источник тепла помещали под пол ящика непосредственно под подошвенную область задней конечности мыши. Время, проходящее до того, как животное отдергивало конечность от источника тепла, измерялось с помощью цифрового таймера. Отсутствие рефлекса в течение 15 с и более расценивали как ошибку ответа вследствие перемещения источника.
Чувствительность к холоду анализировали методом нанесения капли ледяного ацетона на заднюю конечность и определения времени до ответной реакции. Каждую конечность тестировали 3 раза с интервалом 5 минут; затем рассчитывали среднюю величину времени латентного периода.
Тактильную чувствительность оценивали с помощью калиброванных волосков по методу фон Фрея (von Frey hairs – VFH). Тестируемую мышь помещали в индивидуальный прозрачный ящик с ячеистым полом, обеспечивающим свободный доступ к конечностям, и оставляли в покое на 30 минут для акклиматизации. Порог восприятия тактильного стимула определяли путем измерения величины приложенной силы, вызывающей отдергивание конечности тестируемого животного. Если ответа не наблюдалось, что силу VFH увеличивали до тех пор, пока животное не начинало реагировать. Каждую конечность тестировали 3 раза с интервалом 2 минуты, после чего расчитывали среднюю величину приложенной силы, вызывающей рефлекс отдергивания конечности.
Оценка численности нейронов спинномозговых узлов.
У животных после ламинэктомии выделяли спинальные ганглии на уровне LV, фиксировали в 10% нейтральном формалине, обезвоживали и заливали в парафин. Каждый восьмой серийный срез (толщина 4 мкм) окрашивали метиленовым синим, подсчитывали количество чувствительных нейронов с видимыми ядрышками, как описано в работе Holmes с соавторами (2000).
Tрансгенная линия репортерных мышей NF-B/LacZ
Tрансгенная линия репортерных мышей NF-B/LacZ была создана и любезно предоставлена профессором Филипом Баркером (Мак-Гил Университет, г. Монреаль, Канада) и описана ранее Bhakar с соавторами (2002). Данные трансгенные репортерные мыши показывали конститутивную активность NF-B в ЦНС как в период эмбрионального развития, так и в зрелом возрасте (Bhakar et al., 2002).
Для генотипирования NF-B/LacZ-мышей геномную ДНК выделяли из образцов хвостов трансгенных мышей по методике, предоставленной компанией–производителем набора для выделения ДНК («Sigma», Великобритания). Трансгенных мышей, несущих конструкцию, описанную выше, идентифицировали методом ПЦР. Для реакции использовали праймеры к определенным участкам гена lacZ и следующим нуклеотидным последовательностям: к участку 595-572 (CTTCCAGATAACTGCCGTCAC-TCC) и к участку 70-92 (CTTAATCGCCTTGCAGC ACATCC).
Определение -галактозидазы в тканях и первичной культуре чувствительных нейронов трансгенных репортерных мышей NF-B/LacZ проводили методом окраски с X-gal, используя протокол, описанный в работе Bhakar с соавторами (2002).
Гистохимический анализ спинномозговых ганглиев.
Спинальные ганглии LV анализировали для подсчета количества нормальных и апоптических нейронов методом TUNEL (the doxynucleotidyl transferase dUTP nick end-labelling), используя набор реактивов и методику компании «Promega» (Великобритания).
Для детекции нейрональных антигенных маркеров использовали антитела к NPY (Affiniti Na1233, разведение 1:2000) и к CGRP (Affiniti, CA1134, разведение 1:3000).
Для анализа ядерной локализации NF-B срезы спинальных ганглиев и культуру нейронов фиксировали с помощью параформальдегида (4%) и иммунногистохимию проводили согласно протоколу, описанному Herrmann с соавторами (2005), с использованием моноклональных специфических антител к субъединице p65 (Chemicon, MAB3026) и вторичных ослиных антимышиных антител, связанных с FITC (fluorescein isothiocyanate) (The Jackson Laboratory, Bar Harbor, ME). Для контроля специфичности антител одну серию срезов окрашивали в отсутствие первичных антител, которые были заменены раствором фосфатного буфера (PBS).
Статистическая обработка данных
Статистическую обработку данных проводили в парных выборках, применяя t-критерий Стьюдента или two way ANOVA (GraphPads Prism). Для анализа использовали данные 4–6 независимых экспериментов. Различия считали достоверными при р<0,05, n – число независимых экспериментов. В таблицах и на графиках данные представлены в виде М ± m, где М – среднее значение, m – ошибка среднего значения.
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
1. Анализ экспрессии NF-B-зависимых генов в спинномозговых ганглиях in vivo и in vitro
Наиболее распространенный метод изучения активности сигнального каскада NF-B – измерение уровней мРНК генов, содержащих NF-B-связывающие сайты на промоторах. Анализ экспрессии генов, которые регулируются данным транскрипционным фактором, позволит понять, как функционируют сигнальные пути NF-B и, возможно, обнаружить связи с другими сигнальными каскадами.
Методом количественной ПЦР в реальном времени была изучена экспрессия двух генов, которые известны как NF-B-зависимые в различных типах клеток. Один из генов – IB, цитоплазматический ингибитор, который играет значимую роль в регуляции активности NF-B. Другой ген – МСР-1 (monocyte chemoattractant protein-1 – протеин хемоаттракции моноцитов 1) – важный участник воспалительного процесса после травмы периферического нерва (Subang, Richardson, 2001).
Для анализа экспрессии данных генов экстракцию РНК производили из спинальных ганглиев LIV–LV взрослых крыс, взятых в период от 6 часов до 8 дней после перерезки периферического нерва, а также из чувствительных нейронов, культивированных в течение 16 часов и стимулированных добавлением в питательную среду TNF- в концентрации 10 нг/мл в течение от 10 минут до 2 часов. РНК была подвергнута обратной транскрипции, и число образованных копий мРНК IB и MCP-1 измеряли с помощью количественной ПЦР в реальном времени (quantitative Real-Time PCR). Контролем служила 18S-рибосомальная РНК (18S-рРНК).
Было обнаружено, что in vivo после травмы периферического отростка и in vitro после стимуляции TNF- – активатором NF-B в различных типах клеток нейроны спинальных ганглиев экспрессируют NF-B-зависимые гены, такие, как MCP-1 и IB. Однако профиль изменений экспрессии этих NF-B-зависимых генов и аккумуляции их мРНК в спинальных ганглиях был различен как после перерезки нерва in vivo, так и в культуре нейронов спинальных ганглиев после стимуляции их TNF- in vitro.
После перерезки седалищного нерва повышенный уровень экспрессии MCP-1 мРНК наблюдался в поврежденных спинномозговых узлах уже к первым 6 часам после травмы и достигал максимальной величины, в 5 раз превышающей уровень экспрессии в контралатеральных узлах через 12 часов после аксотомии. Однако лишь двукратное увеличение уровня экспрессии IB мРНК наблюдалось в узлах через 24 часа после аксотомии.
Синтез и аккумуляция МСР-1 мРНК при TNF--стимуляции культуры спинномозговых нейронов были также более быстрые и интенсивные, чем IB мРНК при тех же условиях. Инкубация чувствительных нейронов в течение 1 часа с TNF- повышала уровень IB мРНК в 5 раз, тогда как MCP-1 мРНК в 10 раз в сравнении с нестимулированными нейронами.
Таким образом, наши данные показывают, что изменения IB и MCP-1 мРНК имеют различную динамику в посттравматических спинальных ганглиях и в культуре чувствительных нейронов после TNF--стимуляции. Это отражает тот факт, что активирующиеся в клетке сигнальные каскады, которые регулируют экспрессию NF-B-зависимых генов, возможно, различаются в условиях in vivo и in vitro. В научной литературе отмечается, что временные промежутки до начала индукции разных NF-B-зависимых генов неодинаковы (Saccani et al., 2001). Это может отражать факт участия других транскрипционных факторов, кофакторов или изменений конформации хроматина, специфичных для активации каждого промотора.
2. Анализ ДНК-связывающей активности NF-B в зрелых чувствительных нейронах крысы в ответ на TNF--стимуляцию in vitro и после перерезки периферического нерва in vivo
Одновременно с изучением изменения экспрессии NF-B-зависимых генов был проведен анализ способности транскрипционного фактора NF-B соединяться с фрагментами ДНК, несущими специфическую консенсусную последовательность нуклеотидов, что характеризует активность транскрипционного фактора и рассматривается как потенциальная способность активизировать экспрессию зависимых генов.
Активация NF-B в зрелых чувствительных нейронах крысы в ответ на TNF--стимуляцию была исследована в экстракте ядерных белков методом сдвига электрофоретической подвижности фрагментов ДНК в геле (EMSA – electrophoretic mobility shift assay). Метод EMSA позволяет определить способность белков связываться с ДНК и характеризует их транскрипционную активность. Первоначально он использовался для кинетической характеристики очищенных прокариотических транскрипционных факторов (Garner, Revzin, 1981) и в последующем был значительно модифицирован для идентификации ДНК-связывающих белков, присутствующих в целом ядерном экстракте. В основе метода лежат 2 принципа электрофореза через низкомолекулярный полиакриламидный гель: во-первых, неприсоединенные фрагменты ДНК мигрируют быстрее, чем ДНК-белковые комплексы, и, во-вторых, последние стабилизируются при прохождении через гель, что позволяет отследить даже нестабильные комплексы с коротким периодом полураспада (half-lives).
Месторасположение комплекса радиоактивно меченной ДНК с присоединенным белком визуализируется путем авторадиографии. Если белок не присоединился к радиоактивно меченной пробе, последняя будет двигаться сквозь гель быстрее и определится внизу него. В случае если образовались ДНК-белковые комплексы, они будут выявляться ближе к верхней части геля ввиду их медленной миграции. Так как миграция комплексов в целом определяется мобильностью белка, многочисленные белковые комплексы из единого ядерного экстракта, которые присоединяются к одной пробе, могут быть разделены методом EMSA. Более того, компетитивный контроль (competition assays) позволяет определить специфичность присоединения белков к определенной нуклеотидной последовательности. Для этого в реакционную смесь добавляют избыток немеченых «холодных» олигонуклеотидов, к которым присоединяются белки, и радиоактивно меченный комплекс при этом не выявляется.
Для контроля и идентификации комплексов NF-B-ДНК был проведен EMSA селезенки и мозга зрелых крыс. NF-B имеется в цитоплазме в неактивной форме в большинстве клеток, однако его высокая конститутивная активность определяется в ядрах различных клеток иммунной системы и иммунокомпетентных органов (Baeuerle, Henkel, 1994; Li, Verma, 2002). Высокий уровень NF-B-активности также описан в нейронах различных регионов мозга, особенно гиппокампа, коры мозга, зернистого слоя мозжечка (Kaltschmidt et al., 1994), причем максимальный фиксировался в поздний пренатальный и ранний постнатальний периоды (Schmidt-Ullrich et al., 1996). Как и ожидалось, EMSA-анализ ядерного экстракта селезенки крыс выявил интенсивную полосу комплекса NF-B-ДНК (рис. 1, дорожка 1).
Мы также обнаружили более высокий уровень NF-B-ДНК-связывающей активности в экстракте коры мозга (рис. 1, дорожка 2), чем в экстракте интактных спинномозговых ганглиев (рис. 1, дорожка 4). Интересно, что профиль EMSA мозга 1-дневных крысят отличался от полученного для зрелой кортикальной ткани и выявил мощную экстраполосу комплекса NF-B-ДНК (рис. 1, дорожка 3). Этот комплекс был полностью нивелирован добавлени-ем в 25-кратном молярном избытке немеченых «холодных» консенсусных ДНК-олигонуклеотидов к NF-B (рис. 2, дорожка 9). Причем добавление немеченых ДНК-олигонуклеотидов к AP-1 при тех же условиях не оказало никакого эффекта на проявление NF-B-ДНК-комплекса (рис. 2, дорожка 10), что доказывает образование этого комплекса именно ДНК-олигонуклеотидами к NF-B.
В качестве позитивного контроля NF-B-ДНК-связывающей активности использовался экстракт ядерных белков, выделенных из культуры клеток линии 293Т, стимулированных TNF- в концентрациях 20 или 100 нг/мл (рис. 1, дорожки 5–7).
На следующем этапе изучался эффект перерезки седалищного нерва на NF-B-ДНК-связывающую активность в нейронах люмбальных спинальных ганглиев методом EMSA после 6 часов аксотомии. Для получения одного ядерного экстракта ганглии LIV–LV были выделены у крыс и объединены вместе следующим образом: 1 – шесть ганглиев, относящихся к перерезанному нерву (ипсилатеральные); 2 – шесть ганглиев относящихся к интактному нерву (контралатеральные); 3 – шесть ганглиев контрольных животных.
Сгруппированные ганглии подвергались гомогенизированию в низкосолевом буфере с помощью гомогенизатора. Клеточные гомогенаты ипсилатеральных, контралатеральных и контрольных ганглиев были лизированы с использованием ядерного экстракционного буфера и затем анализировались методом EMSA для выявления специфического присоединения NF-B к консенсусным ДНК-олигоуклеотидам.

Рис. 1. EMSA-анализ ДНК-связывающей активности NF-B в различных тканях крысы. Дорожка 1 – ядерный экстракт селезенки; 2 – коры мозга; 3 – мозга 1-дневных крысят; 4 – интактных спинномозговых узлов; дорожки 5–7 – EMSA-анализ ядерного экстракта культуры клеток линии 293Т, стимулированной TNF- in vitro 10 минут в указанной концентрации: дорожка 5 – нестимулированная культура, дорожка 6–20 нг/мл, дорожка 7 – 100 нг/мл. Позиция комплекса NF-B-ДНК обозначена стрелкой. Позиция TNF--индуцированного экстракомплекса NF-B-ДНК в культуре клеток 293Т обозначена треугольником

Рис. 2. Конкурентный анализ NF-B-ДНК-комплексов спинальных ганглиев крыс после аксотомии. Ядерный экстракт был выделен из спинальных ганглиев LIV –LV через 6 часов после перерезки седалищного нерва. ДНК-связывающая активность NF-B анализирована методом EMSA. Пробоспецифичность комплексов определялась путем инкубации реакционной смеси с консенсуснымпи «холодными» немечеными олигонуклеотидами к NF-B или AP-1, добавленными в соответствующие пробы в 25-кратном превышении концентрации. «холодные» олиго 25х - 25-кратный молярный избыток немеченых «холодных» NF-B или AP-1 олигонуклеотидов. Дорожка 1 – негативный контроль в отсутствии ядерного экстракта, дорожки 2 – 4 (СГ ипсилат) – ядерный экстракт спинальных ганглиев со стороны поврежденного нерва, дорожки 5 – 7 (СГ контра) – спинальные ганглии с неповрежденной контралатеральной стороны, дорожки 8 – 10 (мозг 1) – ядерный экстракт мозга новорожденных крысят. Позиция NF-B-ДНК-комплекса обозначена стрелкой
На полученных авторадиограммах проявилась достаточно выраженная полоса задержки в геле комплекса NF-B-ДНК в ядерных экстрактах как из ипсилатеральных, так и из контралатеральных ганглиев (рис. 3, дорожки 6, 7, 9, 10). Только очень бледная полоса визуализировалась на этой же позиции в экстрактах, полученных из ганглиев интактных животных (рис. 3, дорожки 5, 8).
Специфичность NF-B-ДНК-комплексов, образующихся после перерезки нерва (рис. 2, дорожки 2, 5), была подтверждена вытеснением радиоактивно меченных олигонуклеотидов и нивелированием специфической полосы задержки в геле комплекса NF-B-ДНК уже при 25-кратном молярном избытке немеченых «холодных» консенсусных ДНК-олигонуклеотидов к NF-B (рис. 2, дорожки 3, 6). Причем добавление немеченых ДНК-олигонуклеотидов к AP1 при тех же условиях не повлияло на проявление полосы NF-B-ДНК-комплекса (рис. 2, дорожки 4, 7).
Для изучения влияния TNF- на способность NF-B присоединяться к ДНК чувствительные нейроны зрелых крыс культивировали в течение 16 часов, как описано в прил. 2, и стимулировали добавлением в питательную среду TNF- в концентрации 30 нг/мл в течение 10, 20 и 30 минут. После этого нейроны вместе с питательной средой переносили в центрифужную пробирку и осаждали центрифугированием. Затем осадок промывали PBS, ресуспендировали в низкосолевом буфере и лизировали, используя ядерный экстракционный буфер. Полученный ядерный экстракт анализировали методом EMSA на специфическое присоединение NF-B к ДНК. Рис. 15 дорожка 1 иллюстрирует, что EMSA экстракта ядерных белков культуры чувствительных нейронов выявил одиночную полосу задержки в геле, сходную с той, что наблюдалась в интактных спинальных ганглиях in vivo, но большей интенсивности. Инкубация с TNF- значительно повысила ДНК-связывающую активность NF-B уже через 10 минут. Однако 20-минутная инкубация приводит к снижению интенсивности проявления полосы, а 30-минутная – к максимальному проявлению полосы задержки в геле NF-B-ДНК-комплекса (рис. 3, дорожки 2, 3, 4).
Таким образом, полученные нами результаты EMSA свидетельствуют о том, что зрелые чувствительные нейроны в интактных люмбальных спинальных ганглиях in vivo имеют очень низкую NF-B-ДНК-связывающую активность (Wood, 1995; Fernyhough et al., 2005). Это указывает на отсутствие необходимости участия NF-B во внутриклеточных механизмах, поддерживающих жизнеобес-печение нейронов в норме. В противоположность этому показано, что кортикальным нейронам и нейронам гиппокампа для выживания необходимо присутствие активного NF-B (Bhakar et al., 2002). Мы также определили более высокий уровень NF-B-ДНК-связывающей активности в интактной кортикальной ткани, чем в интактных спинальных ганглиях. В некоторых работах выявлено, что пик активности NF-B приходится на поздний постнатальный и ранний пренатальный периоды (Schmidt-Ullrich et al., 1996), что коррелирует с полученными нами данными EMSA мозга однодневных крысят.
Наши результаты показали, что уже через 6 часов после перерезки седалищного нерва ДНК-связывающая активность NF-B была заметно увеличена в поврежденном ганглии. Однако уже к этому времени выявлялась менее интенсивная полоса задержки в геле комплекса NF-B-ДНК в неповрежденном контралатеральном ганглии, что свидетельствует о паракринном эффекте. В отдельных работах также отмечены раннее повышение ДНК-связывающей активности NF-B в модели передавливания нерва и проявление паракринного эффекта к 24 часам после травмы (Fernyhough et al., 2005).

Рис. 3. ДНК-связывающая активность NF-B в культуре чувствительных нейронов и спинальном ганглии после перерезки периферического нерва. Дорожки 1–4: EMSA-анализ ДНК-связывающей активности NF-B в культуре чувствительных нейронов после обозначенного времени инкубации с TNF- (30 нг/мл). Ядерный экстракт был выделен из культуры спинномозговых нейронов, стимулированных TNF- в течение обозначенного времени (10–30 минут). Дорожка 1 – нестимулированная культура чувствительных нейронов; 1 мкг общего протеина использовался для EMSA. Дорожки 5–10: ДНК-связывающая активность NF-B через 6 часов после повреждения седалищного нерва. Ядерный экстракт был выделен из спинальных ганглиев LIV–LV через 6 часов после перерезки седалищного нерва, и ДНК-связывающая активность NF-B анализирована методом EMSA. Количество общего протеина ядерного экстракта, взятого для анализа: дорожки 5–7: 1 мкг, дорожки 8–10: 2 мкг. n – ядерный экстракт интактных неоперированных спинальных ганглиев, i – ипсилатеральных спинальных ганглиев со стороны поврежденного нерва, c – контралатеральных спинальных ганглиев с неповрежденной стороны. Позиция NF-B-ДНК-комплекса обозначена стрелкой
В ходе экспериментов мы обнаружили, что в экстракте ядерных белков чувствительных нейронов, культивируемых в течение 17 часов, полоса ДНК-связывающей активности NF-B характеризовалась более высокой интенсивностью, чем в интактных спинальных ганглиях. Последующая инкубация с TNF- повышала интенсивность полосы через 10 минут с максимумом проявления через 20 минут.
Выделение спинальных ганглиев и диссоциация нейронов во время процедуры культивирования могут имитировать в какой-то степени аксотомию и запускать сходные молекулярные процессы, включая изменение ДНК-связывающей активности NF-B в культуре чувствительных нейронов. Цитокин TNF- является потенциальным активатором NF-B в различных типах клеток (Baldwin, 1996; Barger et al., 2005). Показано, что после травмы периферического нерва IL-6 мРНК аккумулируется в популяциях средних и крупных нейронов с последующим выявлением в них же протеина TNF- (Murphy et al., 1995; Schafers et al., 2003). Более того, рецепторы к TNF – TNFR1 и TNFR2 – выявлялись на зрелых чувствительных нейронах интактных спинальных ганглиев (Shubayev, Myers, 2001).
Метод EMSA широко используется для изучения активности регуляторных элементов генов, которые распознаются и связываются специфическими транскрипционными факторами. Следует, однако, отметить, что этот метод не в состоянии показать, способен ли изучаемый фактор на самом деле активировать транскрипцию, так как большинство из них обычно подвергаются дополнительной модуляции уже после того, как связываются с ДНК, в том числе NF-B (Vermeulen et al., 2002).
Таким образом, полученные нами данные EMSA свидетельствуют, что ДНК-связывающая активность NF-B в ядерных экстрактах спинальных гангиев усиливается после перерезки седалищного нерва и TNF--стимуляции. Однако в связи с тем, что в последнее время появились работы, в которых говорится об изменении транскрипционной активности NF-B даже при неизменной способности связываться с ДНК, требуются дополнительные исследования функциональной роли NF-B в чувствительных нейронах. Результаты EMSA недостаточны для подтверждения способности NF-B активировать транскрипцию генов, так как для этого необходимы дополнительные модификации фактора(ов) как до, так и после присоединения к ДНК (Saha et al., 2007), а также взаимодействия NF-B с дополнительными протеинами – коактиваторами и корепрессорами (Ashburner et al., 2001).
Для того чтобы показать транскрипционную активность NF-B in vivo и выяснить его биологическую роль, необходимо создание экспериментальной генетически модифицированной модели для изучения сложнорегулируемого сигнального каскада NF-B.
3. Изучение роли NF-B в чувствительных нейронах на трансгенной линии мышей Thy*IB-SI
Для изучения функционального значения NF-B в зрелых чувствительных нейронах in vivo мы создали трансгенную линию мышей Thy*IB-SI, нейроны которых специфически экспрессируют суперингибитор NF-B – IB-SI, являющийся мультимутантной формой ингибиторного протеина IB (Voll et al., 2000) (рис. 4).

Рис. 4. Создание генетической конструкции Thy*IB-SI. А – схема полученной генетической конструкции Thy*IB-SI для генерации трансгенных животных. Мышиная Thy-1.2-трансгенная кассета содержит cis-действующий элемент для нейрон-специфической экспрессии после 8-го дня постнатального периода (Caroni, Becker, 1992). Двойными стрелками показаны замещенные аминокислоты в мутантной форме IB – IB-SI. HА – гемагглютинина tag; Б – генотипирование трансгенных мышей. Pr-1 и Pr-2 – праймеры, амплифицирующие фрагмент трансгена (369 п.н.) и мышиного геномного IB (733 п.н.)
Мощный трансдоминантный ингибитор IB-SI был использован для целенаправленной экспрессии в зрелых нейронах трансгенных животных (tg) и ингибирования в этих клетках активности NF-B. В мутантной форме IB серия аминокислот, чувствительных к сигналам для убиквитинирования, фосфорилирования и тирозин-фосфорилирования, замещена нечувстви-тельными аминокислотами (рис. 4, А). Эта форма протеина не подвержена деградации и действует как суперрепрессор NF-B-активности, удерживая и изолируя в цитоплазме каждый NF-B/RelA-комплекс, предотвращая связывание с ДНК и активацию транскрипции. NF-B-суперингибитор - IB-SI был включен в XhoI-сайт специфической нейральной Thy-1.2-кассеты (Caroni, 1997) для последующей генерации трансгенных мышей линии Thy*IB-SI.
Экспрессия Thy-1.2-кассеты, извлеченной из мышиного гена Thy-1.2 (Gordon et al., 1987) обнаруживает мощную экспрессию трансгена специфически в нейронах зрелых трансгенных животных. Мышиная трансгенная кассета Thy-1.2 (рис. 4, А) содержит cis-действующий элемент (cis-acting elements) для нейрон-специфической экспрессии после 8-го дня постнатального периода, и поэтому экспрессия трансгена начинается на 9 – 10-й день постнатального развития.
Известно, что интенсивность экспрессии трансгена под влиянием Thy-1.2-промотора может варьировать между несколькими трансгенными линиями мышей, вероятно, в результате воздействия ядерного генетического окружения на трансгенную конструкцию. Таким образом, по степени проявления экспрессии нейроны могут быть разделены на несколько групп. В одной группе значительная экспрессия трансгена наблюдалась во всех тестируемых линиях мышей, в другой – зависела от трансгенной линии. Однако в большинстве таких линий с использованием Thy-1.2-кассеты обнаруживается достаточно генерализованная экспрессия в нейронах. Эти свойства могут использоваться для изучения эффекта трансгена в нервной системе в позднем периоде развития и в зрелом состоянии. В том числе появляется возможность анализировать эффекты различных комбинаций экспрессирующих и неэкспрессирующих нейронов трансгенных животных, взятых от нескольких линий (Caroni, Becker, 1992).
Полученную конструкцию – Thy*IB-SI – использовали для генерации трансгенных животных путем пронуклеарной микроинъекции эмбрионов гибридной линии CBAxC57BL/10 (F1). Все эксперименты были проведены с линией Tg(ThymutIkB)74-3. Трансгенные животные определялись с помощью ПЦР, которая выявляла позитивных и негативных особей с использованием одной пары праймеров (рис. 4, Б). Эти праймеры амплифицировали фрагмент длиной 733 пар нуклеотидов (п.н.) мышиного эндогенного геномного IB-локуса, содержащего экзоны III и IV кодирующего участка, а также интроны. Эти же праймеры соответствовали кодирующему участку человеческого IB-SI-трансгена, в котором интроны были удалены, и поэтому у позитивных мышей амплифицируемый фрагмент был короче (369 п.н.).
3.1. Анализ экспрессии IB-SI в трансгенной линии мышей. Был проведен молекулярный анализ генерированных трансгенных животных линии Tg(Thy-mutIB)74-3 для того, чтобы определить, действительно ли трансген и его продукт (белок IB-SI) экспрессируются в нервной системе, в частности в зрелых нейронах спинномозговых ганглиев.
Во-первых, методом ПЦР с предварительным использованием обратной транскрипции (RT-PCR) было показано, что трансген экспрессируется только в нервной системе (головной мозг, мозжечок, спинной мозг и спинномозговые ганглии).
Затем методом вестерн-блот-анализа была изучена экспрессия продукта встроенного трансгена в экстрактах спинного мозга с использованием антител, специфичных к IB, позволяющие отличить эндогенную форму IB от ее мутантной формы (IB-SI). Результаты анализа показали, что протеин, соответствующий размеру IB-SI, выявлялся в экстрактах спинного мозга у животных трех трансгенных линий. Это доказывает, что данные животные несут активно экспрессирующийся трансген.
3.2. Гибридизация in situ (in situ hybridisation). Вестерн-блот-анализ и ПЦР с предварительным использованием обратной транскрипции (RT-PCR), подтвердившие экспрессию трансгена, проводились на гомогенатах целых органов трансгенных животных (головной мозг, спинной мозг, спинальный ганглий) и не позволяли выяснить, экспрессируется ли интересую-щий нас трансген строго в нейронах или также в других ненейрональных клетках. Для ответа на этот вопрос, а также для того, чтобы сравнить трансгенные линии и выбрать более подходящую для наших целей, была проанализирована экспрессия трансгена в нервной системе двух полученных трансгенных линий Tg(Thy-mutIB)74-3 и Tg(Thy-mutIB)74-5 методом гибридизации in situ (in situ hybridisation).
Гибридизация in situ была выполнена на криостатных срезах органов трансгенных животных двух полученных линий. Этот метод позволяет локализовать положение мРНК в цитоплазме клеток и дает возможность получить четкую морфологическую картину распределения продукта экспрессии трансгена (мРНК) в популяциях клеток этих трансгенных линий. Криостатные срезы нервной ткани (головной мозг, спинной мозг и спинальные ганглии) были подвергнуты гибридизации с 35S-дАТФ-радиоактивно меченной олигонуклеотидной пробой (35S-dATP radiolabelled oligonucleotide probe), специфичной к трансгену. Благодаря характеристикам трансгенной конструкции этот метод позволяет определить транскрипционную активность трансгена.
Гибридизация in situ показала, что обе линии имеют обширную экспрессию трансгена в нейронах, однако, с индивидуальными особенностями. В линии 5 отмечается высокая степень экспрессии в ограниченном количестве нейронов. Значительное сосредоточение гранул серебра было обнаружено в некоторых мотонейронах спинного мозга, в популяции крупных нейронов спинальных ганглиев (рис. 5), в CA1- и CA3-зонах гиппокампа и зубчатой извилине, а также в небольшом количестве нейронов коры мозга. В других нейронах экспрессия либо слабо проявлялась, либо полностью отсутствовала.
Линия 3 демонстрировала высокую экспрессию трансгена примерно одинаковой выраженности во всех типах нейронов. В частности, гранулы серебра были сосредоточены во всех нейронах головного и спинного мозга, а также во всех популяциях нейронов спинального ганглия (рис. 6). Большое значение имеет следующее наблюдение: в нервной системе не было обнаружено ненейрональной экспрессии трансгена. Негативные образцы включали клетки глии, входящие в состав периферического нерва, и клетки белого вещества ЦНС. Это доказывает, что экспрессия Thy*IB-SI-трансгена специфична и ограничена нейронами.
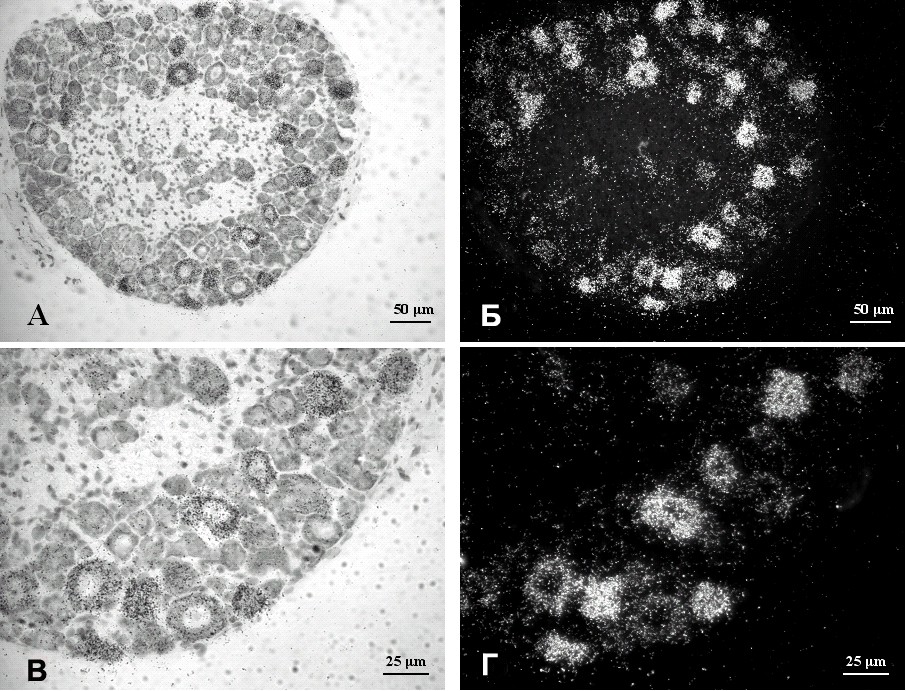
Рис. 5. Гибридизация in situ срезов спинномозгового ганглия мышей трансгенной линии Tg(Thy-mutIB)74-5. Криостатные срезы спинномозгового ганглия мышей были подвергнуты гибридизации с 35S-дАТФ-радиоактивно меченной олигонуклеотидной пробой, специфичной к трансгену. А, Б – срез спинномозгового ганглия в светлом поле (А) и (Б) поляризационной эпифлюоресценции. В, Г – увеличенный участок тела нейрона с гранулами серебра в светлом поле (В) и при поляризационной эпифлюоресценции (Г). Отмечается концентрация гранул серебра в ограниченной группе нейронов. Множество нейронов не показывают экспрессии трансгена
Для контроля результатов гибридизация in situ была выполнена на образцах ткани, взятой от линии мышей дикого типа (wt). В этом случае на препаратах отмечались лишь низкий радиоактивный фон и гомогенно распределенные гранулы серебра, которые не были связаны с конкретными клетками и покрывали равномерно весь образец ткани (рис. 7).
Основываясь на полученных результатах, все дальнейшие эксперименты были выполнены на трансгенной линии мышей Tg(Thy-mutIB)74-3 как наиболее отвечающей целям и задачам данной работы.
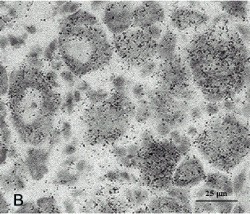

Рис. 6. Гибридизация in situ срезов спинномозгового ганглия мышей трансгенной линии Tg(Thy-mutIB)74-3. Криостатные срезы спинномозгового ганглия мышей были подвергнуты гибридизации с 35S-дАТФ-радиоактив-но меченой олигонуклеотидной про-бой, специфичной к трансгену. А, Б – срез спинномозгового ганглия при поляризационной эпифлюресценции (А) и светлопольной микроскопии (Б); В – увеличенный участок спинального ганглия с гранулами серебра в телах нейронов. Отмечается концентрация гранул серебра во всех группах нейронов. Практически все нейроны имеют высокий уровень экспрессии трансгена

Рис. 7. Гибридизация in situ срезов спинно-мозгового ганглия мышей дикого типа. Криостатные срезы спинномозгового ганг-лия мышей были подвергнуты гибриди-зации с 35S-дАТФ-радио-активно меченой олигонуклеотидной про-бой, специфичной к трансгену. А, Б – срез спинномозгового ганглия в светлом поле (А) и при поляризационной эпифлюоресценции (Б). Отмечается гомогенное распределение гранул серебра, не связанных с клетками
3.3. Влияние Thy*IB-SI трансгена на выживаемость и физиологические функции зрелых нейронов спинальных ганглиев
В данной части работы была проведена оценка численности нейронов спинальных ганглиев трансгенных животных в сравнении с диким типом. Был произведен подсчет общего количества нейронов в спинальном ганглии на уровне LV и выполнен иммуногистохимический анализ нейронов спинальных ганглиев с применением антител к широко распространенному белку CGRP для оценки CGRP+-нейронов у трансгеннных животных в сравнении с диким типом, как описано ранее (Holmes et al., 2000; Shi et al., 2001). Результаты подсчета показали, что количество чувствительных нейронов, экспрессируемых CGRP, общего количества нейронов в спинальном ганглии не были изменены у трансгенных животных.
В заключение были исследованы основные функции чувствительных нейронов, такие, как чувствительность температурная, к холоду и тактильная у взрослых мышей трансгенной линии и дикого типа. Было показано, что экспрессия суперингибитора NF-B в нейронах спинальных ганглиев не оказывает какого-либо эффекта на поддержание физиологических функций у мышей трансгенной линии Thy*IB-SI.
3.4. Ингибирование ядерной транслокации NF-B
в нейронах мышей Thy*IB-SI трансгенной линии
Активная форма NF-B локализуется в ядре, поэтому был произведен иммуногистохимический анализ с использованием моноклональных специфических антител к субъединице p65 для выявления внутриклеточной локализации NF-B в нейронах мышей трансгенной линии Thy*IB-SI. В задачу данного этапа экспериментов входило выяснение влияния трансгена IB-SI на внутриядерную локализацию NF-B в нейронах спинальных ганглиев после TNF--стимуляции in vitro и после перерезки седалищного нерва in vivо.
При иммуногистохимическом анализе культуры нейронов спинномозговых ганглиев внутриядерная локализация NF-B (p65) обнаруживалась в небольшом количестве чувствительных нейронов мышей дикого типа (5 %) уже после 1-го дня in vitrо и у 60 % нейронов спинальных ганглиев после TNF--стимуляции. Однако ядерное перемещение NF-B, стимулированное TNF-, подверглось значительному ингибированию в нейронах спинальных ганглиев трансгенных животных (до 92 % нейронов) (рис. 8).
На следующем этапе исследования был проведен иммуногистохимический анализ NF-B в спинальных ганглиях на уровне LV через 4 часа и 1 день после перерезки периферического нерва. Полученные результаты свидетельствуют о том, что р65 перемещается в ядра примерно у 25 % нейронов спинальных ганглиев через 4 часа после аксотомии и выявляется там же через 1 день после перерезки. Оценка численности нейронов с ядерной локализацией р65 у tg- и wt-мышей до и после перерезки периферического нерва показала, что вызванное аксотомией ядерное перемещение р65 значительно уменьшено (на 90 %) у мышей трансгенной линии (рис. 9).
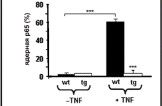
Рис. 8. Ингибирование ядерного перемещения NF-B в нейронах спинальных ганглиев трансгенных мышей линии Thy*IB-SI. Редукция ядерного перемещения р65 в культуре нейронов мышей трансгенной линии (tg) в сравнении с диким типом (wt) после стимуляции их TNF-.

Рис. 9. Редукция ядерной локализации NF-B в нейронах поврежденных спинальных ганглиев (ипсилат) у мышей трансгенной линии (tg). Контралат – контралатеральные (неповрежденные) ганглии. М ± m, где М - среднее значение, m - ошибка среднего значения, n=6 (число животных в группах), ***p<0,001 (two way ANOVA)
3.5. Выживание нейронов спинальных ганглиев
после перерезки периферического нерва у мышей трансгенной линии Thy*IB-SI
Выживаемость нейронов спинальных ганглиев в условиях травмы in vivo была изучена на модели экспериментальной перерезки седалищного нерва. TUNEL-анализ был выполнен на спинальных ганглиях LV через 2 и 14 дней после перерезки периферического нерва. Результаты анализа показали, что лишь единичные нейроны (4–5 в одном спинальном ганглии) были TUNEL-положительные. Не было выявлено значительных различий в количестве TUNEL+-нейронов в спинальных ганглиях между мышами дикого типа (wt) и трансгенными (tg) животными (рис. 10)
Выживаемость нейронов спинальных ганглиев также определяли путем оценки общего количества нейронов в спинальном ганглии. Через 2 дня после перерезки периферического нерва их число было одинаково в ганглиях, располагающихся со стороны как перерезанного, так и интактного нерва у мышей дикого типа (wt) и у трансгенных (tg) животных (рис. 11). Однако после двух недель аксотомии, общее количество нейронов уменьшилось на 25 % в спинальных ганглиях LV как у трансгенного, так и у дикого типа мышей.

Рис. 10. Анализ количества TUNEL-позитивных нейронов спинальных ганглиев LV через 2 и 14 дней после перерезки се-далищного нерва у мышей дикого типа и трансгенной линии Thy*IB-SI. аксот СГ – ганглии, располагающи-еся со стороны пе-ререзанного нерва, контр СГ– интактного нерва

Было также произведено сравнение процентного соотношения нейронов, экспрессирующих маркеры CGRP и NPY, в спинальных ганглиях мышей дикого типа (wt) и трансгенных (tg) животных после травмы нерва. Известно, что эти нейрональные маркеры имеют различную динамику экспрессии в чувствительных нейронах после аксотомии (Shi et al., 2001). Как и ожидалось, в поврежденном ганглии количество CGRP-экспрессирующих нейронов уменьшилось, а количество NPY- – увеличилось, причем не наблюдалось различий в распределении данных нейрональных популяций в ганглиях трансгенного (tg) и дикого типов мышей (wt) (рис.11).
Рис. 11. Анализ выживания чувствительных нейронов после травмы седалищного нерва у мышей дикого типа (wt) и трансгенной линии (tg) путем оценки общей численности нейронов спи-нального ганглия (СГ), процентного отношения субпопуляций CGRP- и NPY-экспрес-сирующих нейронов спинального ганглия. M ± S.E.M, n=6 (число животных в группах), *** –p<0.001, * – p<0,1 (two way ANOVA)
Таким образом, для изучения функционального значения NF-B в зрелых чувствительных нейронах in vivo мы создали и клонировали трансгенную линию мышей Thy*IB-SI, нейроны которых экспрессируют суперингибитор NF-B – IB-SI. До настоящего времени это единственная трансгенная модель, в которой целенаправленно угнетается активность NF-B строго в зрелых нервных клетках (Memet, 2006; Pasparakis et al., 2006). Была выявлена значительная редукция ядерной транслокации NF-B в зрелых нейронах спинального ганглия мышей этой трансгенной линии в ответ на такие известные сигналы-активаторы NF-B как TNF- (Fernyhough et al., 2005) и аксотомия (Doyle, Hunt, 1997b; Ma, Bisby, 1998). Хотя трансгенные мыши линии Thy*IB-SI показывали пониженную способность к активации NF-B в нейронах, подтвержденную уменьшением ядерной р65-иммунореактивности, основные физиологические свойства чувствительных нейронов и их количество не были изменены. Это указывает на то, что NF-B не является обязательным транскрипционным фактором для функционирования нейронов спинномозговых ганглиев в нормальных физиологических условиях.
В некоторых работах выдвинуты предположения о вовлечении NF-B в процессы, необходимые для выживания зрелых чувствительных нейронов после повреждения периферического нерва (Doyle, Hunt, 1997b; Fernyhough et al., 2005; Ma, Bisby, 1998). Полученные нами данные свидетельствуют о том, что перерезка седалищного нерва не вызывает апоптоза в чувствительных нейронах через 2 дня после травмы в спинальных ганглиях мышей ни дикого типа, ни линии Thy*IB-SI. В частности, мы показали, что одинаково небольшое количество нейронов спинномозговых ганглиев дает положительную окраску при использовании метода TUNEL как у животных дикого типа, так и у трансгенных мышей. Для контроля результатов TUNEL параллельно выполнялась окраска срезов спинного мозга, полученных после его компрессионного повреждения, которая выявила значительное количество TUNEL-положительных нейронов (Chew et al., 2008), что подтверждает достоверность реакции на срезах спинального ганглия.
Для оценки эффективности модели перерезки седалищного нерва в нашем эксперименте произведен подсчет субпопуляций нейронов спинальных ганглиев, экспрессирующих маркеры NPY или CGRP. Известно, что после периферической аксотомии количество нейронов, экспрессирующих NPY повышается, а CGRP – снижается (Holmes et al., 2000; Shi et al., 2001). Наши результаты также подтверждаются в работе, авторы которой отмечают минимальный уровень апоптической смерти нейронов в первые дни после травмы периферического нерва (Koliatsos, Price, 1996; Shi et al., 2001). Однако через 2 недели после аксотомии нами мы обнаружили значительный уровень гибели нейронов (25 %). Это несоответствие между отсутствием апоптических нейронов и уменьшением общей численности нейронов может объясняться, вероятно, очень коротким временным промежутком, в течение которого метод TUNEL способен регистрировать изменения в нейронах, или тем, что в гибели нейронов через 2 недели после аксотомии участвовали неапоптические механизмы. Вместе с тем эти изменения в количестве нейронов спинальных ганглиев были практически одинаково выражены как у трансгенных животных, так и у мышей дикого типа. В другой работе существенное снижение общей численности нейронов было зарегистрировано в более отдаленном периоде после травмы (30–90 дней) (Рагинов, Челышев, 2003), причем степень нейрональной гибели имела прямую зависимость от экспериментальных животных и используемой методологии (McKay et al., 2002; Pierucci, Oliveira, 2006).
Следовательно, полученные результаты не поддерживают нашу изначальную гипотезу о том, что трансгенное ингибирование ядерной транслокации NF-B может приводить к гибели нейронов спинальных ганглиев после аксотомии. Экспериментальные данные показывают, что NF-B не определяет внутреннюю устойчивость зрелых нейронов спинальных ганглиев к апоптической смерти в результате аксотомии, которая не изменилась, несмотря на трансгенное ингибирование внутриядерной транслокации NF-B в ответ на TNF--стимуляцию или травму нерва.
Наши данные косвенно подтверждаются в опубликованном в научном журнале «Nature» исследовании (Nickols et al., 2003), в котором показано, что в седалищном нерве крыс in vitro и в кокультуре шванновских клеток и чувствительных нейронов in vivo активация NF-B происходит параллельно с процессами миелинизации. Блокирование NF-B-активности в кокультуре c помощью ингибитора SN50 или использование клеток генетически модифицированных мышей p65-/- сильно ингибирует миелинизацию, но при этом не выявляется высокий уровень апоптоза (методом TUNEL) несмотря на полное отсутствие миелина. Более того, обратимость процессов блокирования миелинизации после удаления из среды SN50 может поставить под сомнение наличие апоптоза в нейронах и шванновских клетах. Авторами также показано одинаковое количество нейронов в кокультуре, полученной от генотипов p65+/+, p65+/-, p65-/-, что ис-ключает возможность объяснения дефектов миелинизации различиями в способности к выживанию между нейронами дикого типа и p65-/- (Nickols et al., 2003).
Предыдущие предположения о вовлечении транскрипцион-ного фактора NF-B в процесс выживания зрелых чувствительных нейронов были сделаны только на основе его ядерной транслокации методом иммуногистохимии и EMSA ядерного экстракта спинальных ганглиев в ответ на травму седалищного нерва (Doyle, Hunt, 1997; Fernyhough et al., 2005; Ma, Bisby, 1998). Однако в работах последних лет показано, что анализ лишь ядерной локализации NF-B и ее последующее связывание с фрагментами ДНК не обязательно отражают активацию именно транскрипционной активности NF-B. Другими словами, если NF-B находится в ядре и даже «села» на участок ДНК, необходимы другие компоненты и условия, чтобы этот фактор инициировал траскрипцию гена-мишени. Например, некоторые сигнальные каскады (p38MAPK) могут угнетать транскрипционную активность NF-B в культуре астроцитов даже без изменения его внутриядерной ДНК-связывающей активности, лишь регулируя ацетилирование р65-субчастицы путем модулирования ацетилтрансферазной активности р300 с помощью фосфорилирования (Saha et al., 2007). В других описанных случаях индуцированная цитокинами ДНК-связывающая активность NF-B может угнетать, а не активировать NF-B-зависимую транскрипцию (Campbell et al., 2004; Ho et al., 2005).
4. Выявление транскрипционной активности NF-B с использованием трансгенной линии репортерных мышей NF-B/LacZ
4.1. Tрансгенная линия репортерных мышей NF-B/LacZ. Мы оценивали транскрипционную активность NF-B в зрелых чувствительных нейронах, используя трансгенную линию репортерных мышей NF-B/LacZ. Эта линия обладает способностью экспрессировать ядерную форму фермента -галактозидазы E. сoli, кодируемую геном lacZ, находящимся под транскрипционным контролем NF-B. В качестве положительного контроля активности -галактозидазы производилась окраска срезов головного мозга, где нейроны проявляли конститутивную активность NF-B.
4.2. Отсутствие экспрессии -галактозидазы в нейронах спинномозговых ганглиев после травмы периферического нерва и при экспериментальном воспалении. Параллельно с контролем для выявления активности -галактозидазы окрашивали спинномозговые ганглии LV через 2 дня после перерезки седалищного нерва. -gal-позитивные нейроны не были обнаружены как в ганглиях, относящихся к поврежденному нерву, так и с контралатеральной (неповрежденной) стороны (рис. 12, A, Б). Тот же результат получен после анализа экспрессии гена lacZ через 7 дней после травмы.
Кроме этого, для выявления активности -галактозидазы мы исследовали образцы мышечной ткани, окружающей участок повреждения и проксимальный отрезок перерезанного нерва. На срезах образцов мышечной ткани, взятой на уровне верхней части бедра в участке повреждения, была выявлена яркая экспрессия репортерного гена lacZ (рис. 13, A, Б), в то время как в неповрежденной мышце на контралатеральной стороне она отсутствовала (см. рис. 13, В). -gal-позитивные клетки были также обнаружены в проксимальном отрезке рассеченного нерва (см. рис. 12, В).
На следующем этапе работы активность NF-B в нейронах спинномозговых ганглиев индуцировали путем экспериментально вызванного воспаления. Для этого в левую заднюю конечность мышей трансгенной линии NF-B/lacZ была сделана инъекция адъюванта Фройнда (complete Freund’s adjuvant). На срезах спинномозговых ганглиев и мышечной ткани задней части бедра через 2 дня после инъекции была визуализирована морфологическая картина воспаления, характеризующаяся массивной клеточной инфильтрацией. Однако даже в этом случае экспрессия репортерного гена lacZ не обнаружена в клетках спинального ганглия и в нерве. Только единичные -gal-позитивные ядра выявлялись в бедренной мышечной ткани конечности, в которую была сделана инъекция.
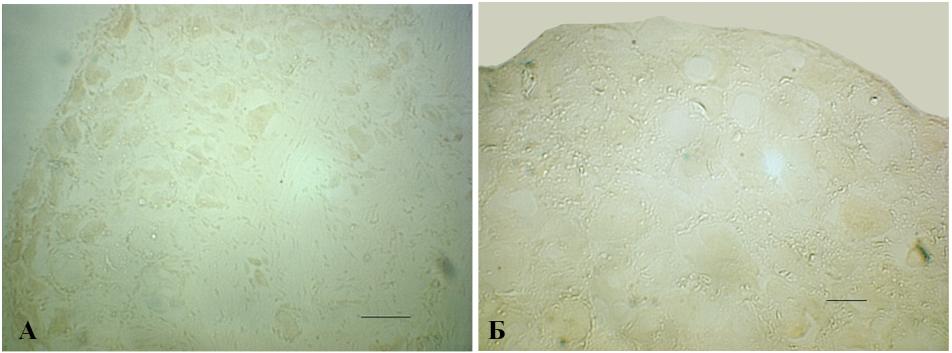

Рис. 12. Отсутствие экспрессии lacZ в спинномозговых ганглиях трансгенных NF-B/LacZ-репортерных мышей после травмы периферического нерва. Экспрессия репортерного гена lacZ отсутствует как в ганглии со стороны повреждения (Б), так и с контра-латеральной стороны (A). -gal-позитивные клетки выявляются в проксимальном сегменте поврежденного седалищного нерва (В); A, В – масштабная линия 50 мкм, Б – масштабная линия 25 мкм


Рис. 13. -gal-экспрессия в мышечной ткани нормальных и оперированных трансгенных мышей. А – мощная экспрессия репортерного гена lacZ в мышечной ткани, окружающей участок повреждения в верхней части бедра; масштабная линия 50m. Б – большое увеличение участка мышцы, показывающее яркое -gal-окрашивание в ядрах поврежденной мышечной ткани, обозначенной в рамке на A; масштабная линия 10 мкм. В – отсутствие экспрессии lacZ в мышце на контралатеральной (неповрежденной) стороне; масштабная линия 10 мкм
4.3. Трихостатин А способствует экспрессии -gal в культуре чувствительных нейронов, стимулированных TNF- и LPS. На данном этапе мы исследовали активность NF-B in vitro в культуре чувствительных нейронов, выделенных из спинальных ганглиев трансгенных мышей линии NF-B/lacZ. Необходимо было выяснить, активируется ли экспрессия репортерного гена в зрелых нейронах спинальных ганглиев in vitro при действии классических активаторов NF-B, таких, как TNF- и LPS. Для этого культуру трансгенных нейронов инкубировали в течение 16 часов на стерильных покровных стеклах, стимулировалали добавлением TNF- (30 нг/мл) или LPS (10 нг/мл) на следующие 24 часа инкубации и затем анализировали на -gal-аккумуляцию методом окрашивания с X-gal.
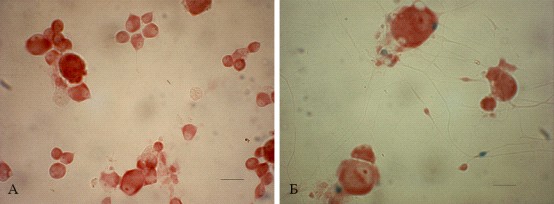
Рис. 14. Отсутствие экспрессии lacZ в культуре нейронов спинномозговых ганглиев NF-B/lacZ-репор-терных мышей. A – -gal-позитивные клетки не обнаружены в контрольной нестимулированной культуре чувствительных нейронов, масштабная лини 25 мкм; Б – культивируемые в течение 16 часов нейроны спинномозговых ганглиев были стимулированы TNF- (30 нг/мл). Отмечается экспрессия репортерного гена в большинстве ненейрональных клеток, окружающих нейроны, но не в самих чувствительных нейронах, масштабная линия 10 мкм
Как видно из рис. 14, транскрипционная активность NF-B в нейронах, культивируемых в нормальной среде роста, отсутствует. Отметим, что встречались единичные -gal-позитивные ненейрональные клетки, предположительно, клетки-сателлиты, которые были связаны с телами нейронов и могли попасть в культуру в результате неполного ресуспендирования гангиев. После TNF--стимуляции культуры чувствительных нейронов -gal-экспрессия выявлялась в большинстве ненейрональных клеток, окружающих тела нейронов. Эти клетки можно интерпретировать как клетки-сателлиты, основываясь на их морфологии и местоположении. Однако в нейронах спинномозговых ганглиев, культивируемых с добавлением TNF- (30 нг/мл), не обнаружено значительной транскрипционной активности NF-B (рис. 14, Б).
В ходе исследования мы выявили эффект трихостатина А (Trichostatin A – TSA) (5 M) на экспрессию репортерного гена lacZ в нейронах, одновременно стимулированных TNF-. Трихостатин А один из наиболее эффективных и хорошо изученных ингибиторов гистоновых деацетилаз (histone deacetylases – HDAC) (Yoshida et al., 1990; Yoshida et al., 1995).
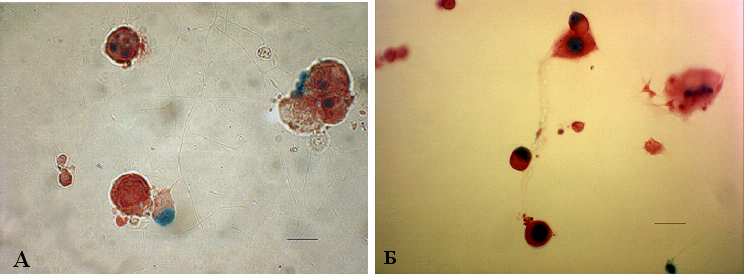

Рис. 15. Транскрипционная активность NF-B индуцируется трихостатином А в культуре нейронов спинномозговых ганг-лиев NF-B/lacZ-репортерных мышей. А – нейроны спинномозговых ганглиев зрелых мышей трансгенной репортерной линии NF-B/LacZ находились in vitro в течение 16 часов. Трихостатин А (5 M) был добавлен в культуральную среду на следующие 24 часа инкубации. Отмечается индукция lacZ-активности в ненейрональных клетках и в части чувствительных нейронов, масштабная лини 25 мкм. Б – нейроны спинномозговых ганглиев культивировали в течение 16 часов. TSA (5 M) одновременно с TNF- (30 нг/мл) (Б) или LPS (10 мкг/мл) (В) были добавлены в культуральную среду на следующие 24 часа инкубации. Обнаруживается усиление экспрессии репортерного гена в ненейрональных клетках и чувствительных нейронах. Б, В – масштабная линия 25 мкм
Так, при 24-часовой инкубации культуры нейронов с TSA только 3–5 % клеток проявляли -gal-активность (рис. 15, A). Однако у значительного количества чувствительных нейронов отмечалась положительная окраска, когда культуру нейронов инкубировали с добавлением одновременно TSA и TNF- (рис. 15, Б). Сходный эффект TSA наблюдался при стимуляции клеток LPS (10 мкг/мл) (рис. 15, В), другим известным стимулятором NF-B в различных типах клеток. Увеличение времени инкубации с TSA до 40 часов не привело к повышению количества -gal-положительных клеток.
Еще ярче эффект TSA проявлялся, когда культуру нейронов преинкубировали в присутствии TSA в течение 16 часов, а затем стимулировали TNF- или LPS (рис. 16). В этом случае практически у всех нейронов наблюдалась мощная ядерная -gal-активность.

Рис. 16. Экспрессия lacZ в культуре нейронов спинномозговых ганг-лиев, преинкубированных с TSA и стимули-рованных TNF- или LPS. Нейроны спинно-мозговых ганглиев зрелых мышей трансгенной репортерной линии NF-B/LacZ находились в культуре в течение 16 часов в присутствии TSA (5 M). Затем TNF- (30 нг/мл) (A) или LPS (10 мкг/мл) (Б) были добавлены к культуре на следующие 24 часа инкубации. Отмечается мощная экспрессия репортерного гена в большинстве чувствительных нейронов. A, Б – масштабная линия 25 мкм

Рис. 17. Процентное соотношение -gal-положительных нейронов при действии различных комбинаций моди-фикаторов (TSA, TNF-, LPS и SN50) активности NF-B in vitrо. TSA усиливает проявление индуцирующего действия TNF- и LPS на экспрессию NF-B-репортерного гена, и этот ответ блокируется SN50. Более того, мощная индукция транскрипционной активности NF-B выявляется, когда культура нейронов спинномозговых ганглиев преинкубируется с TSA в течение 16 часов перед действием TNF- и LPS, содержание -gal-положительных нейронов повышается до 90 %
Было также показано, что индуцированная экспрессия lacZ в чувствительных нейронах ингибируется при добавлении в среду олигопептида SN50 – специфического ингибитора ядерной транслокации NF-B в клетках. После проникновения в клетку SN50 блокирует систему импорта, необходимую для перемещения NF-B в ядро, не вступая во взаимодействие с цитоплазматическими процессами, ведущими к активации NF-B. Лишь единичные клетки были -gal-положительны (3 %), когда SN50 добавляли в среду одновременно с TSA и TNF-. Более того, экспрессия lacZ в чувствительных нейронах полностью исчезала, когда нейрональная культура была преинкубирована с SN50 в течение 16 часов перед добавлением TSA и TNF-.
На рис. 17 представлено процентное соотношение -gal-положительных чувствительных нейронов после действия in vitrо различных комбинаций TSA, TNF-, LPS и SN50.
4.4. Регуляция активности NF-B в чувствительных нейронах. Результаты, полученные в ходе экспериментов с использованием трансгенной репортерной линии мышей NF-B/LacZ, показали, что NF-B транскрипционно не активен как в норме, так и после повреждения периферического нерва, что было подтверждено неспособностью NF-B транскрибировать репортер-ный ген lacZ в нейронах спинномозговых ганглиев. Мы обнаружили, что NF-B не активен в чувствительных нейронах после экспериментально вызванного воспаления периферического нерва, хотя эта модель способна индуцировать молекулы NF-B сигнального каскада в других типах клеток (Inglis et al., 2005).
Мы показали, однако, что конститутивная транскрипционная активность NF-B выявляется в нейронах головного мозга, как было отмечено ранее (Bhakar et al., 2002). Это свидетельствует о том, что отсутствие активности NF-B в спинальных ганглиях регистрируется не вследствие неадекватного X-gal окрашивания в нашем эксперименте. Более того, мы выявили -gal-положительные ненейрональные клетки в месте повреждения седалищного нерва. Особенно ярко репортерный ген lacZ проявлялся в ядрах поврежденной мышечной ткани, вероятно, в результате индукции NF-B цитокинами воспаления и/или регенерации мышечной ткани.
Мы не исключали возможности, что отсутствие детекции транскрипционной активности в зрелых чувствительных нейронах связано с особенностями линии репортерных мышей, используемых в нашем эксперименте. Однако в исследованиях, проводимых с другими линиями трансгенных NF-B-репортерных мышей также не отмечалась активность NF-B в зрелых чувствительных нейронах (Memet 2006). В частности, сходная линия трансгенных репортерных мышей была генерирована с использованием промотора р105, который содержал NF-B-связывающий участок для экспрессии репортерного гена lacZ (Schmidt-Ullrich et al., 1996). Перерезка седалищного нерва приводила к активации транскрипционной активности NF-B в некоторых мотонейронах, которая не была показана в чувствительных нейронах (Pollock et al., 2005). Не была выявлена транскрипционная активность NF-B в периферической нервной системе и другой трансгенной линии мышей, в которой репортерный ген люциферазы находился под контролем NF-B (Carlsen et al., 2002).
Мы продемонстрировали, что отсутствие активности NF-B в зрелых нейронах спинальных ганглиев регистрируется в результате действия репрессионного механизма, регулируемого процессами ацетилирования и деацетилирования. В частности, мы показали, что трихостатин А, являющийся ингибитором гистоновых деацетилаз (Quivy, Van Lint, 2004), значительно усиливает индукцию NF-B-активности, вызванную TNF- и LPS в культуре спинномозговых нейронов. Подобные результаты отражены в работе Chen с соавторами (2001) на других типах клеток.
Согласно полученным нами данным, наблюдаемое действие TSA специфично для NF-B-активности, так как ингибитор ядерного перемещения NF-B – SN50 нивелирует дерепрессивный эффект TSA в культуре спинномозговых нейронов. Следовательно, полученные данные объясняют, что влияние NF-B в зрелых спинальных ганглиях не отмечается в результате процессов деацетилирования, подавляющих транскрипционную активность ядерного фактора.
Таким образом, появившиеся в последнее время сообщения о том, что процессы ацетилирования и деацетилирования на клеточном и молекулярном уровнях, в том числе в ядре, вовлечены в регуляцию транскрипционной активности NF-B (Natoli, 2006; Quivy, Van Lint, 2004), расширили наши представления о многоуровневой регуляции активности этого фактора. Во-первых, ацетилирование гистонов регулирует доступность NF-B-зависимых генов. Во-вторых, неидентифицированные процессы ацетилирования временно модулируют IKK-активность, а следовательно, длительность присутствия и ДНК-связывания NF-B в ядре. В-третьих, прямое ацетилирование р65- и р50-субъединиц регулирует различные функции NF-B, включая транскрипционную и ДНК-связывающую активность, а также присоединение IB. В заключение отметим, что ацетилтрансферазы и деацетилазы взаимодействуют напрямую с несколькими протеинами, вовлеченными в сигнальные каскады NF-B, в том числе с самим NF-B, другими транскрипционнми факторами и гистонами, ассоциированными с NF-B-регулируемыми генами (Quivy, Van Lint, 2004) (см. рис. 45).
Проведенный нами эксперимент с SN50 – ингибитором ядерной транслокации NF-B выявил зависимость степени экспрессии репортерного гена в культуре нейронов спинномозгового узла от продолжительности действия ингибитора. Это можно объяснить, если принять во внимание следующее: деацетилирование и конденсация хроматина, окружающего промотор репортерного гена lacZ, могут не допустить экспрессии этого гена в чувствительных нейронах, хотя сам транскрипционный фактор присутствует в клетках (Kaltschmidt et al., 1994). Когда нейроны подвергаются действию TSA, гистоновые деацетилазы ингибируются, что влечет за собой ацетилирование и деконденсацию (расслабление) хроматина. Это в свою очередь делает промотор доступным для NF-B и других кофакторов после стимуляции нейронов TNF-. В то же время IB входит в ядро и переносит NF-B в цитоплазму. Известно, что через 60–75 мин после начала стимуляции ни одного NF-B-комплекса не остается в ядре (Lipniacki et al., 2004), а так как новые молекулы NF-B не могут быть транслоцированы в него в связи с блокадой специфическим ингибитором SN50, ядерный пул NF-B исчерпывается.
При одновременном действии SN50, TSA и TNF- на нейроны in vitro молекулы NF-B, которые конститутивно представлены в ядре, связываются с промотором репортерного гена NF-B, и в результате мы наблюдаем небольшое количество клеток, экспрессирующих -gal в первые минуты стимуляции. В связи с присутствием ингибитора ядерная транслокация NF-B и соответственно экспрессия -gal прекращаются, но все еще регистрируются в отдельных клетках. Однако когда мы инкубируем клетки в присутствии SN50 в течение 16 часов, ядерный пул NF-B истощается вследствие ингибирования способности фактора транслоцироваться в ядро. Следовательно, даже после добавления в среду роста TSA и TNF- экспрессия -gal не наблюдается ни в нейронах, ни в клетках-сателлитах, потому что ни в ядре, ни в цитоплазме нет молекул NF-B, способных связаться с промотором.
Полученные данные подтверждают гипотезу о том, что гистоны в высшей степени деацетилированы в зрелых чувствительных нейронах, поэтому присутствующий в ядре комплекс NF-B не может связаться со специфическим промотором и активировать NF-B-зависимые гены.
Таким образом, механизм, с помощью которого p300/CBP и другие коактиваторы усиливают, а HDAC и остальные корепрессоры ингибируют транскрипционную активность NF-B, является многофакторным (см. рис. 45) и включает действие непосредственно на этот транскрипционный фактор и изменения в структуре хроматина. В общем роль деацетилирования гистонов заключается в ингибировании NF-B путем молекулярных механизмов, специфичных для конкретного стимула и отдельно взятого промотора.
Таким образом, полученные данные свидетельствуют о том, что NF-B не является обязательным внутренним нейропротекторным фактором в зрелых чувствительных нейронах в условиях перерезки периферического нерва. Более того, мы выявили молекулярный механизм, который опосредован гистоновыми деацетилазами и может объяснить транскрипционную репрессию NF-B в нейронах спинномозговых ганглиев. Это позволяет предположить, что in vivo функции NF-B ограничены в зрелой ПНС в отличие от таковых в ЦНС.
Результаты наших исследований указывают на необходимость дальнейших изысканий в области раскрытия роли транскрипционных механизмов в нейрональной репарации. Так, необходимо более детально изучить процессы ацетилирования/деацетилирования гистонов в чувствительных нейронах, в частности их участие в регенерации.
Выводы:
1. В спинномозговых ганглиях зрелых крыс происходит посттравматическое увеличение экспрессии NF-B –зависимых генов MCP-1 и IB in vivo и после стимуляции первичной культуры чувствительных нейронов TNF- in vitro. Динамика экспрессии и аккумуляции MCP-1 и IB мРНК различается как между MCP-1 и IB генами, так и для одного гена в зависимости от используемой модели in vivo и in vitro.
2. Интактные спинномозговые ганглии показывают низкую NF-B - ДНК-связывающую активность. Аксотомия нейронов спинномозговых ганглиев приводит к увеличению NF-B - ДНК-связывающей активности ядерных экстрактов поврежденных спинальных ганглиев крыс по сравнению с контрольными через 6 часов после травмы. Первичная культура чувствительных нейронов в норме проявляет заметную NF-B - ДНК-связывающую активность, которая значительно увеличивается после стимуляции нейронов TNF- in vitro.
3. После травмы периферического нерва внутриядерную р65 иммунореактивность через 24 часа проявляют 25% нейронов спинномозгового ганглия, что подтверждает активацию и перемещение NF-B комплекса в ядро. Первичная культура чувстивтельных нейронов на действие TNF- in vitro реагирует увеличением количества нейронов с внутриядерной р65 иммунореактивностью до 60 %.
4. Впервые созданная линия генетически модифицированных мышей Thy*IB-SI со специфическим нейрональным суперингибитором NF-B является достоверной моделью для изучения биологической роли сигнальных путей NF-B в зрелых нейронах. Животные Thy*IB-SI трансгенной линии демонстрирует экспрессию мутантной формы IB - IB-SI – исключительно в нейронах. Вызванное аксотомией ядерное перемещение р65 иммунореактивности после травмы периферического нерва мышей трансгенной линии Thy*IB-SI значительной снижено по сравнению с диким типом. Ядерное перемещение NF-B, стимулированное TNF- in vitro, также значительно ингибируется в нейронах спинальных ганглиев тансгенных животных.
5. Модель генетически модифицированных мышей Thy*IB-SI со специфическим нейрональным суперингибитором NF-B показывает отсутствие какого-либо эффекта на основные физиологические функции и выживаемость зрелых чувствительных нейронов in vivo после аксотомии.
6. Трансгенная линия репортерных мышей NF-B/LacZ демонстрирует отсутствие экспрессии NF-B-зависимого репортерного гена lacZ в нейронах спинномозговых ганглиев in vivo после аксотомии и in vitro после стимуляции TNF-.
7. Репрессия транскрипционной активности NF-B в зрелых чувствительных нейронах осуществляется на уровне регуляции внутриядерного ацетилирования/деацетилирования белков. Увеличение уровня ацетилирования с помощью блокатора гистоновых деацетилаз (HDAC) снимает репрессию репортерного гена и запускает экспрессию NF-B-зависимого гена.
8. NF-B не является жизненно необходимым внутренним нейропротекторным фактором зрелых первичных чувствительных нейронов при травме. Молекулярные механизмы, опосредованные гистоновыми деацетилазами, регулируют транскрипционную репрессию NF-B в этих нейронах, тем самым, ограничивая функции NF-B in vivo в нейронах ПНС в отличие от нейронов ЦНС.
Список работ, опубликованных по теме диссертации:
- Gushchina, S. Transgenic approaches for studying inflammatory signaling pathway in the nervous system: NF-B in neuronal repair after peripheral nerve injury / S. Gushchina, D Wu, G. Michael, P. Barker, P. Richardson, C. Magoulas // William Harvey Day Conference Materials, Barts and the London, Queen Mary’s School of Medicine and Dentistry, University of London – London, 2003 - p.9-10
- Gushchina, S.V. Nuclear factor kappa B signaling in injured neurons / S.V Gushchina, K. S. Karanth, C. Magoulas, P.M. Richardson // William Harvey Day Conference Materials, Barts and the London, Queen Mary’s School of Medicine and Dentistry, University of London – London, 2004 - Р.11-12.
- Gushchina, S.V. Nuclear factor kappa B signaling in injured DRG neurons. / S.V Gushchina, K. S. Karanth, C. Magoulas, P.M. Richardson // Program No 38.10.2004. Society for Neuroscience, 34th Annual Meeting San Diego, CA. Abstract Viewer Itinerary Planner, Washington, DC: Society for Neuroscience, 2004, Online.
- Gushchina, S.V. NF-B signaling in DRG neurons after sciatic nerve injury / S.V Gushchina, K. S. Karanth, C. Magoulas, P.M. Richardson // William Harvey Day Conference Materials, Barts and the London, Queen Mary’s School of Medicine and Dentistry, University of London – London, 2005 - Р.13-14.
- Ховряков, А.В. Ультраструктурные изменения нейроглиальных клеток некоторых отделов головного мозга экспериментальных животных при стрессе / А. В. Ховряков, В.П. Балашов, Е.П. Подрезова, С.В. Гущина, Н.В. Семибратова, Н.П. Шиханов, П.П. Кругляков, А.А. Сосунов // Морфология.– 2008.– Т. 133, №3.– С. 59-60.
- Шиханов, Н.П. Иммуногистохимическое исследование нейрогенеза в головном мозге генетически модифицированных мышей при экспериментальном перевозбуждении / Н.П. Шиханов, Е.П. Подрезова, С.В Гущина, А.В. Ховряков, Н.В. Семибратова, И.В. Уткина-Сосунова, Г-II МакКханн, П.П. Кругляков, А.А. Сосунов // Материалы Всероссийской конференции «Инновацион-ные технологии в трансплантации органов, тканей и клеток» Изд-во Офорт., Самара.– 2008. – С. 194-196
- Сосунов, А.А. Активация нейрогенеза в зубчатой извилине при экспериментальном перевозбуждении в головном мозге мышей / А.А. Сосунов, П.П Кругляков, Г-II МакКханн, Н.П Шиханов, Е.П. Подрезова, С.В Гущина, А.В. Ховряков, Н.В. Семибратова, И.В. Уткина-Сосунова // Материалы международной конференции «Проблемы современной морфологии человека». М.-2008.– С. 269-271
- МакКханн, Г-II. Нарушения митотического деления в реактивных астроцитах приводят к развитию полиплоидии / Г-II МакКханн, Е.П. Подрезова, С.В Гущина, А.В. Ховряков, Н.В. Семибратова, Н.П Шиханов, П.П Кругляков, А.А. Сосунов, // Морфология.– 2008.– Т.133, №2.– С. 70.
- Подрезова, Е.П. Активация m-TOR-ферментного каскада в нейронах и нероглии характерна для стрессорных поражений головного мозга / Е.П. Подрезова, А.А. Сосунов, Г-II МакКханн, Ч.Б Майкелл, А.В. Ховряков, С.В. Гущина, Н.П. Шиханов, П.П. Кругляков, А.В. Карпова // Морфология.– 2008.– Т. 133, №4.– С. 88-89
- Гущина, С.В. Сигнальные пути ядерного фактора каппа В (NF-B) в поврежденных нейронах / С.В. Гущина, П.П. Кругляков, К. Магулас, П.М. Ричардсон // Морфология.– Т.134, №5.– С. 65.
- Подрезова, Е.П. Иммуногистохимическое исследование реактивных изменений NG2-клеток при патологии головного мозга человека / Е.П. Подрезова, А.А. Сосунов, Г-II МакКханн, А.В. Ховряков, В.П. Балашов, Н.П. Шиханов, С.В. Гущина // Морфология.– 2008. – Т. 134, № 5.– С. 87.
- Gushchina, S. Observations on the function of nuclear factor kappa B (NF-kB) in the survival of adult primary sensory neurons after nerve injury / S. Gushchina, V. Leinster, A. Jasim, M. Demestre, L. Lopez de Heredia, G. Michael, P. Barker, P. Richardson, C. Magoulas // Molecular and Cellular Neuroscience. – 2009. – V.40, №2. – Р. 207-216.
- Гущина, С.В. Роль ядерного транскрипционного фактора каппа В (NF-B) в выживании зрелых чувствительных нейронов при повреждении периферического нерва / С.В Гущина, П.П. Кругляков, О.В. Волкова, П.М. Ричардсон, Б. Магоулас // Морфология. – 2009.– Т. 136, № 4.– С. 47
- Кругляков, П.П. NG2-клетки – особый тип макроглиальных элементов как возможный источник нейрональных предшественников в головном мозгу человека / П.П. Кругляков, Е.П. Подрезова, С.А. Сосунов, А.В. Ховряков, Н.П. Шиханов, С.В. Гущина, В.А. Нуянзина, Г-II МакКханн, А.А. Сосунов // Морфология.– 2009.– Т. 136, № 4.– С. 84.
- Гущина, С.В. Посттравматическая активность сигнальных путей ядерного фактора каппа В (NF-B) в зрелых чувствительных нейронах / С.В. Гущина, К. Б. Магоулас, Н. Юсаф, П.М. Ричардсон и О.В. Волкова // Бюллетень экспериментальной биологии и медицины.– 2010.– т.148, №4 – С. 460-465.
- Гущина, С.В. Транскрипционная активность ядерного фактора каппа В (NF-B) в посттравматических чувствительных нейронах (гистохимическое исследование) / С.В. Гущина, О.В. Волкова, П.П. Кругляков, К.Б. Магоулас // Морфология. – 2010.– Т. 137, № 2.– С. 18-22
- Гущина, С.В. Клеточные аспекты регуляции транскрипционной активности ядерного фактора каппа В (NF-B) в чувствительных нейронах in vitro / С.В. Гущина, О.В. Волкова, П.П. Кругляков, К.Б. Магоулас // Морфология. – 2010.– Т. 137, № 3.– С. 22-26
- Гущина, С.В. Кругляков П.П. К вопросу о морфогенетических перестройках в посттравматических чувствительных нейронах // Морфологические ведомости.– 2010. – №2. – С.88–92.
- Гущина, С.В. Создание и характеристика трансгенной линии мышей Thy*IB-SI / С.В. Гущина, Г. Майкл, О.В. Волкова и К. Б. Магоулас // Бюллетень экспериментальной биологии и медицины.– 2010.– т.150, №8.– С. 233–237
- Гущина, С.В. Транскрипционный фактор каппа В (NF-B) в посттравматических нейронах// С.В. Гущина, О.В. Волкова П.П. Кругляков, К. Б. Магоулас.- Саранск, 2010. - Изд-во Мордов. ун-та. - 144 с. (монография)

