Роль нейроиммуноэндокринных механизмов в развитии соматической патологии у людей пожилого возраста
- На правах рукописи
- ЗЕЗЮЛИН
Петр Николаевич
РОЛЬ НЕЙРОИММУНОЭНДОКРИННЫХ МЕХАНИЗМОВ
В РАЗВИТИИ СОМАТИЧЕСКОЙ ПАТОЛОГИИ
У ЛЮДЕЙ ПОЖИЛОГО ВОЗРАСТА
14.00.53 – геронтология и гериатрия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Санкт-Петербург – 2009
Работа выполнена в отделе биогеронтологии Санкт-Петербургского института биорегуляции и геронтологии СЗО РАМН
Научный консультант:
заслуженный деятель науки РФ,
член-корреспондент РАМН,
доктор медицинских наук, профессор
Хавинсон Владимир Хацкелевич
Официальные оппоненты:
заслуженный деятель науки РФ,
член-корреспондент РАМН,
доктор медицинских наук, профессор
Аничков Николай Мильевич
заслуженный деятель науки РФ,
доктор медицинских наук, профессор
Райхлин Натан Танфелевич
заслуженный деятель науки РФ,
доктор медицинских наук, профессор
Ткаченко Евгений Иванович
Ведущая организация:
ГОУ ВПО Военно-медицинская академия им. С.М. Кирова
Министерства обороны РФ
Защита состоится "_____" ________ 2009 года в ___ часов на заседании диссертационного Совета Д 601.001.01 при Санкт-Петербургском институте биорегуляции и геронтологии СЗО РАМН по адресу: 197110, Санкт-Петербург, пр. Динамо, 3.
С диссертацией можно ознакомиться в библиотеке Санкт-Петербургского института биорегуляции и геронтологии СЗО РАМН (197110, Санкт-Петербург, пр. Динамо, 3).
Автореферат разослан "____" ________ 2009 г.
Ученый секретарь диссертационного совета
доктор биологических наук, доцент Л.С. Козина
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
В последние два десятилетия появляются данные о том, что идентичные пептидные гормоны, биогенные амины и другие сигнальные молекулы, осуществляющие системные и локальные межклеточные взаимодействия, синтезируются нервными, иммунными и эндокринными клетками [Пальцев М.А., Кветной И.М., 2006, 2008, Black P.H., 1989]. Общность химических механизмов трех регуляторных систем организма – нервной, эндокринной и иммунной – стимулировала бурное развитие исследований в новой области знаний, названной нейроиммуноэндокринологией.
Английский патолог и гистохимик Э. Пирс был первым, кто объединил эндокринные клетки с пептидергическим и аминергическим типом метаболизма, локализованные в различных органах и системах организма, в единую APUD-серию, включающую в настоящее время более 60 типов эндокринных клеток (апудоцитов), расположенных в желудочно-кишечном тракте, дыхательной системе, поджелудочной железе, коже, плаценте, мочеполовой системе, тимусе и других органах [Кветной И.М. с соавт., 1998, 2000, 2004].
Применение иммуноцитохимических и радиоиммунологических методов позволило обнаружить синтез пептидов и биогенных аминов в нейронах, что позволило объединить пептидергические нейроны и апудоциты в единую диффузную нейроэндокринную систему [Кветной И.М., Манохина Р.П., 1989; Петров С.В., Райхлин Н.Т., 2004; Klimcakova E., et al., 2006]. Располагаясь практически во всех органах и продуцируя биологически активные вещества, клетки диффузной нейроэндокринной системы играют роль местных регуляторов гомеостаза, действуя через нейрокринные, эндокринные и паракринные механизмы [Шатаева Л.К. с соавт., 2003]. Тесные взаимосвязи трех регуляторных систем (нервной, эндокринной и иммунной) включают в себя их представительство в каждом висцеральном органе через пептид/аминергические нейроны [Корнева Е.А., Шхинек Э.К., 1988], иммунокомпетентные клетки и апудоциты. С учетом этого факта представилось возможным расширить понятие «диффузная нейроэндокринная система», заменив его понятием «диффузная нейроиммуноэндокринная система» (ДНИЭС), и рассматривать ее как единую функциональную биологическую систему [Пальцев М.А., Кветной И.М., 2006, 2008]. Именно ДНИЭС является областью исследований нейроиммуноэндокринологии как новой научной биомедицинской дисциплины, которая интегрирует наши знания о сигнальных механизмах регуляции гомеостаза.
Современные представления о механизмах старения не могут формироваться без учета огромного и важного вклада в этот биологический процесс межклеточных коммуникационных связей, обеспечиваемых гормонально активными сигнальными молекулами, продуцируемыми клетками ДНИЭС в желудочно-кишечном тракте, поджелудочной железе, селезенке, щитовидной железе, надпочечниках, мочеполовой системе и в других органах [Хавинсон В.Х. с соавт., 2003; Анисимов В.Н., 2004; Шабалин В.Н., 2005; Хавинсон В.Х., Коновалов С.С., 2008].
Особенно актуальным и значимым представляется изучение нейроиммуноэндокринных механизмов старения на примере желудочно-кишечного и мочеполового тракта ввиду максимальной концентрации в этих органах клеток ДНИЭС. Кроме того, патологические процессы в этих системах имеют геронтологическую значимость, поскольку язвенная болезнь желудка и двенадцатиперстной кишки и гиперпластические процессы в предстательной железе в наибольшей степени присущи именно пожилому возрасту и протекают с возрастными патогенетическими особенностями, требующими особых подходов к их диагностике и лечению [Анисимов В.Н., Соловьев М.В., 1999].
Цель и задачи исследования
Целью работы является изучение особенностей функционирования основных клеток диффузной нейроиммуноэндокринной системы при старении для оценки их вклада в возраст-ассоциированную патологию.
Для достижения поставленной цели были сформулированы и последовательно решены следующие задачи:
1) изучить структурно-функциональную организацию основных клеток диффузной нейроиммуноэндокринной системы, локализованных в желудочно-кишечном и мочеполовом трактах у людей различного возраста в норме и при патологии;
2) изучить поведение основных клеток диффузной нейроиммуноэндокринной системы пищеварительного тракта у пожилых пациентов с язвенной болезнью желудка и двенадцатиперстной кишки;
3) изучить роль нейроэндокринных клеток предстательной железы в развитии возраст-ассоциированных опухолей;
4) изучить состояние оксидативных процессов у пожилых и старых людей при патологии желудочно-кишечного и мочеполового трактов;
5) оценить регуляторные свойства основных гормонов диффузной нейроиммуноэндокринной системы – серотонина, мелатонина, хромогранина А и соматостатина по отношению к желудку и предстательной железе;
6) оценить значение возрастной гормональной дисфункции клеток диффузной нейроиммуноэндокринной системы в механизмах старения;
7) изучить влияние пептидов и биогенных аминов на старение культур различных тканей;
8) наметить подходы к оптимизации регуляции деятельности клеток диффузной нейроиммуноэндокринной системы в стареющем организме с целью профилактики преждевременного старения.
Научная новизна и практическая значимость работы
Проведенные исследования позволили детально изучить морфо-функциональные изменения основных клеток диффузной нейроиммуноэндокринной системы при старении. При этом впервые подробно проанализирована структурно-функциональная организация клеток диффузной нейроиммуноэндокринной системы, локализованных в желудочно-кишечном и мочеполовом трактах у людей пожилого возраста. Впервые изучена функциональная морфология основных клеток диффузной нейроиммуноэндокринной системы у пожилых людей при язвенной болезни желудка и двенадцатиперстной кишки, доброкачественной гиперплазии и раке предстательной железы. Показано, что оксидативные реакции у здоровых лиц пожилого возраста характеризуются большей выраженностью прооксидантных процессов и ослаблением антиоксидантной защиты. Впервые выявлено, что при ремиссии язвенной болезни двенадцатиперстной кишки наблюдаются позитивные нейроиммуноэндокринные сдвиги: увеличение продукции мелатонина, серотонина и снижение синтеза провоспалительных цитокинов и фактора некроза опухолей.
Впервые постулировано, что доброкачественная гиперплазия и рак предстательной железы могут быть расценены как первичные апудопатии, а паранеопластические реакции простаты должны рассматриваться как вторичная апудопатия, что сопровождается снижением локального синтеза ряда сигнальных молекул, в частности хромогранина А, соматостатина, гистамина и катехоламинов.
Проведенные исследования позволяют считать, что нейроэндокринные клетки, локализуясь в составе висцеральных органов в качестве основных компонентов диффузной нейроиммуноэндокринной системы, продуцируя жизненно важные сигнальные молекулы, играют ключевую роль в поддержании гомеостаза, а возрастные нарушения экспрессии гормонов являются важными звеньями патогенеза возраст-ассоциированной патологии. На основании проведенных исследований выяснено значение возрастной гормональной дисфункции клеток диффузной нейроиммуноэндокринной системы в механизмах старения, что позволяет наметить подходы гормонотропной регуляции деятельности этих клеток в стареющем организме при патологии желудочно-кишечной и мочеполовой систем.
Основные положения диссертации, выносимые на защиту
1. Пожилой возраст и ускоренное старение характеризуются морфологическими изменениями клеток диффузной нейроиммуноэндокринной системы, что заключается в гетерохромности ядра; уменьшении количества рибосом; увеличение количества лизосом; нарушении структуры миофибрилл; изменении строения митохондрий – гибель крист, набухание и разрушение отдельных органелл, что в совокупности приводит к снижению белково-синтетической и энергетической функций клеток.
2. Основные регуляторные функции диффузной нейроиммуноэндокринной системы в пожилом возрасте при отсутствии заболеваний аналогичны более ранним этапам онтогенеза - сосудодвигательная, антитромбоцитарная, антикоагулянтная, тромболитическая, противовоспалительная, антиоксидантная, антипролиферативная. Нарушения перечисленных функций клеток диффузной нейроиммуноэндокринной системы в пожилом возрасте, когда на фоне морфологических изменений формируются особенности его деятельности в норме, приводит к быстрому развитию и прогрессированию ряда заболеваний.
3. Основными тенденциями ускоренного старения диффузной нейроиммуноэндокринной системы является истощение гормональной функции клеток с прогрессированием продукции провоспалительных цитокинов и уменьшением синтеза гормональных молекул с саногенным эффектом; дистрофические изменения клеток.
4. Оксидативные реакции у здоровых лиц пожилого возраста характеризуются большей выраженностью прооксидантных процессов и ослаблением антиоксидантной защиты, в целом пожилой возраст является периодом усиления про- и ослаблением антиоксидантных систем при наличии клинически значимого заболевания.
5. Пептидные биорегуляторы, созданные на их основе, обладают тканеспецифическими эффектами по отношению к тканям, из которых они были выделены. Серотонин и мелатонин обладают цитогеропротекторными свойствами по отношению к эпителиальным клеткам желудка и предстательной железы. Эти гормоны также обладают способностью активно усиливать экспрессию сигнальных факторов дифференцировки эпителиоцитов желудка (протеина CDX1) и простаты (протеина RUNX3), синтез которых достоверно снижается в стареющих культурах.
6. Нейроэндокринные клетки, локализуясь в составе висцеральных органов в качестве основных компонентов диффузной нейроиммуноэндокринной системы, продуцируя жизненно важные сигнальные молекулы, играют ключевую роль в поддержании гомеостаза, а возрастные нарушения экспрессии гормонов являются важными звеньями патогенеза возраст-ассоциированной патологии.
Связь с научно-исследовательской работой института
Диссертационная работа является научной темой, выполняемой по основному плану НИР Санкт-Петербургского института биорегуляции и геронтологии СЗО РАМН.
Апробация и реализация результатов исследования
Результаты диссертации доложены и обсуждены на: XIII Российском национальном конгрессе «Человек и лекарство» (Москва, 2006); III Всероссийской научно практической конференции «Общество, государство и медицина для пожилых» (Москва, 2006); IX Всероссийской медико-биологической конференции молодых исследователей «Человек и его здоровье» (Санкт-Петербург, 2006); II научно-практической конференции с международным участием, посвященной памяти Э.С. Пушковой (Санкт-Петербург, 2006); XIII съезде сердечно-сосудистых хирургов (2007), очно-заочной конференции «Взаимодействие медицинской науки и практики» (2007), Всероссийской конференции «50 лет мелатонину» (Санкт-Петербург, 2008); XV Российском национальном конгрессе «Человек и лекарство» (Москва, 2008). Основные результаты исследования внедрены в научно-педагогическую и лечебную работу НИИ акушерства и гинекологии им. Д.О. Отта РАМН, Санкт-Петербургского института биорегуляции и геронтологии СЗО РАМН, Центра простатологии РАЕН, медицинского факультета Белгородского Государственного Университета.
Результаты исследования изложены в учебных изданиях «Руководство по нейроиммуноэндокринологии», рекомендованном Минздравсоцразвития в качестве учебника для медицинских вузов, и «Избранных лекциях по геронтологии», рекомендованном УМО при ММА им. И.М. Сеченова в качестве учебного пособия для системы послевузовского медицинского образования.
Публикации
По материалам диссертации опубликовано 36 работ, из них - 10 статей в журналах по перечню ВАК, 1 монография, 5 глав в руководствах, 1 статья в прочих изданиях и 19 тезисов докладов.
Структура и объем диссертации
Диссертация состоит из введения, обзора литературы, 6 глав результатов собственных исследований и их обсуждения, выводов, практических рекомендаций, указателя использованной литературы. Текст диссертации представлен на 241 странице и содержит 20 таблиц, 50 рисунков. Список литературы включает 426 источников, из них – 215 отечественных и 211 иностранных авторов.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследований
Методологией настоящего исследования явились системный подход и теория функциональных систем. Исследования проводились в трех основных направлениях: изучалась функциональная морфология и биохимия нейроиммуноэндокринных клеточных взаимоотношений у пациентов пожилого возраста; проводился анализ возраст-ассоциированных заболеваний у человека как апудопатий; изучались нейроиммуноэндокринные механизмы при искусственном моделировании старения.
В связи с тем, что наибольшее количество нейроэндокринных клеток находится в желудочно-кишечном тракте и предстательной железе, в качестве объекта исследования были избраны эти системы. В исследование были включены пожилые пациенты, страдающие язвенной болезнью (ЯБ) желудка и двенадцатиперстной кишки, с доброкачественной гиперплазией предстательной железы (ДГПЖ) и раком предстательной железы. Выбор этих нозологических форм обусловлен тем, что их потенциально можно расценивать как апудопатии.
Для изучения нейроиммуноэндокринных механизмов старения желудочно-кишечного тракта в настоящее исследование было включено 305 человек, при этом 204 пациента страдали ЯБ (при этом 150 больных имели ЯБ, ассоциированную с инфекцией Helicobacter pylori; у 54 указанная инфекция не была выявлена). Возраст больных ЯБ составил от 58 до 69 лет, средний возраст 62,3±2,4 года (106 мужчин, или 52,0%, 98 женщин, или 48,0%). В контрольную группу вошли 22 здоровых добровольца без каких-либо указаний на заболевания органов желудочно-кишечного тракта (возраст от 58 до 67 лет, средний возраст 63,7±4,3 года). Все пациенты дали согласие на участие в исследовании. Исследование проведено в соответствии с современными принципами биомедицинской этики и безопасности клинических исследований.
Для выполнения поставленных цели и задач обследования проводили: на стадии обострения до начала терапии; на стадии клинико-эндоскопической ремиссии (через 2 недели от начала терапии); на стадии истинной ремиссии (через 1-1,5 мес после окончания терапии). Всем пациентам перед включением их в ту или иную группу проводили общеклиническое обследование: сбор анамнеза жизни и заболевания, клинический и биохимический анализы крови, общий анализ мочи, копрограмма и анализ кала на скрытую кровь, рентгеноскопия органов грудной клетки, ЭКГ, УЗИ органов брюшной полости и почек.
Верификацию диагноза и стадии заболевания проводили с помощью фиброгастродуоденоскопии. Осуществляли морфологическую оценку состояния слизистой оболочки в биоптатах желудка, двенадцатиперстной кишки и оценкой степени обсемененности Helicobacter pylori (HР).
Для изучения предстательной железы в исследование были включены 52 человека в возрасте от 56 до 66 лет (средний возраст 60,3±1,9 года) с ДГПЖ первой (12), второй (14), третьей (26) стадиями. Аденокарциномой простаты страдало 27 больных в возрасте от 56 до 68 лет (средний возраст 61,8±2,7 года). Во всех случаях диагноз был подтвержден морфологически после пункционной биопсии предстательной железы.
Использовали следующие методы исследования:
1) иммуногистохимическое исследование. Проводили на биоптатах слизистой оболочки желудка и ткани простаты; изучали экспрессию маркеров с использованием антител к хромогранину А (фирма Dako, титр 1:100), соматостатину (фирма Novocastra, титр 1:200) и к мелатонину (фирма CID Research Inc., титр 1:150) с автоматизированным подсчетом количества иммунопозитивных клеток в 5 полях зрения при увеличении х400 с последующим пересчетом среднего количества клеток на 0,1 мм2 слизистой оболочки ткани. Также в простате определяли оптическую плотность и площадь экспрессии. Компьютерный анализ изображений проводился на системе цифровой микроскопии фирмы Nikon Eclipse 400 с применением программы Videotest Morphology 5;
2) гистологическое исследование биоптатов из слизистой оболочки желудка. Характер изменений слизистой оболочки желудка оценивали в соответствии с модифицированной классификацией хронического гастрита (Сиднейская система, 1990; Хьюстон, 1994); оценку степени обсемененности HР производили по Л.И. Аруину с соавт. (1993);
3) иммуноферментное исследование цитокинов и иммуноглобулинов в сыворотке крови больных с ЯБ и ДГПЖ. Определение сывороточных иммуноглобулинов классов A, M, G по методу Manchini G. et al. (1965) проводили с помощью антиглобулиновых сывороток производства фирмы ЗАО «Вектор-Бест», Россия; определение субклассов иммуноглобулинов G (G1, G2, G3, G4) осуществляли иммуноферментным методом с использованием тест-систем (CytElisa Human, CYTIMMUNE, США) с учетом на фотометре "Multiskan Plus" при длине волны 450 нм; определение фактора некроза опухоли- (TNF-), молекул sICAM, sVCAM осуществляли иммуноферментным методом с использованием тест-систем (CytElisa Human, CYTIMMUNE, США) с учетом на фотометре "Multiskan Plus" при длине волны 450 нм;
4) определение оксидативного гомеостаза, которое включало изучение концентрации малонового диальдегида как прооксидантного фактора, концентрации SH-групп как антиоксидантного компонента, а также интегрального показателя – соотношения SH/МДА.
Нейроиммуноэндокринные механизмы старения изучали при моделировании искусственного (радиационного) старения. Исследования выполнены на 40 самцах белых крыс линии Вистар (масса тела 120-130 г), из которых 16 животных составили контрольную группу. Подопытные крысы (24 особи) подвергались общему однократному облучению (радиационное моделирование преждевременного старения). Для моделирования изменений, сходных с процессами, возникающими в ходе старения, проводили общее однократное гамма-облучение животных в дозе 6 Гр на кобальтовом аппарате «ГУБ 20000» при мощности дозы 200 рад/мин. Гамма-облучение проводили с помощью установки «Эксперимент» (источник 137Cs; мощность поглощенной дозы в прямом пучке 5,32 мГр/час). После облучения животные были переведены в виварий и содержались в тех же условиях, как крысы контрольной группы. Через 7 суток после облучения у крыс подопытной и контрольной групп после декапитации были взяты органы для электронно-микроскопического исследования. Облучение и обработку экспериментального материала методом электронной микроскопии проводили в лаборатории радиационной патоморфологии МРНЦ РАМН (г. Обнинск). Автор выражает глубокую благодарность канд. мед. наук. В.В. Южакову и докт. мед. наук В.В. Попучиеву за консультации по данному разделу работы.
Изучение эффектов эпиталона и простамакса проводили на органотипических культурах различных тканей (коры и подкорковых структур головного мозга, печени, тимуса и селезенки) крыс. Забор тканей производили у животных на 1-е сутки жизни, а также у животных в возрасте 3-х недель и 24 месяцев. Эпиталон (Ala-Glu-Asp-Gly) и простамакс (Lys-Glu-Asp-Pro) вводили в культуру клеток в дозе 20-100 нг/мл. После окончания культивирования эксплантатов применяли морфологические и морфометрические методы: фазово-контрастная микроскопия, световая микроскопия, а также определение индекса площади эксплантатов.
Индекс площади рассчитывали как отношение площади всего эксплантата, включая периферическую зону роста, к исходной площади фрагмента эксплантируемой ткани. За условную единицу площади принимали квадрат окуляр-сетки микроскопа (сторона квадрата при увеличении 3,510 была равна 150 мкм). Для визуализации эксплантатов использовали микротеленасадку для микроскопа (серия 10, МТН-13 «Альфа-Телеком», Россия). Для расчета индекса площади эксплантатов использовали программу PhotoM 1.2.
Для выявления апоптоза применяли окраску 0,1% раствором акридинового оранжевого; флюоресцентное свечение визуализировали в люминесцентном микроскопе (Люмам-Р3, ЛОМО, Санкт-Петербург). В зоне роста каждого эксплантата подсчитывали количество клеток, находящихся в стадии апоптоза (клетки, погибающие путем апоптоза, окрашивались в красный цвет; интактные клетки имели зеленую окраску) в 10 полях зрения. Индекс апоптоза рассчитывали как среднее количество клеток, находящихся в стадии апоптоза, на 1 поле зрения. Значения индекса площади и индекса апоптоза выражали в процентах.
Объектом получения коммитированных эпителиоцитов желудка и предстательной железы служили органы эмбрионов 20-26 недель гестации. Клетки, извлеченные из соответствующих органов плода, культивировали в 24-луночных планшетах ("Costar") при 37оС в атмосфере с 5% СО2 в среде RPMI 1640 ("Flow") с добавлением 10 % сыворотки эмбрионов теленка ("Sigma"), L-глутамина (300 мкг/мл; "Flow"), HEPES-буфера (0,02 М; "Serva") и гентамицина (100 мкг/мл; "Фармахим"). Исходная концентрация составляла 106 клеток/мл. Каждую пробу ставили в двух параллельных исследованиях. Исследования проводились на культуре клеток тимуса человека, прошедших 1, 4 и 7 пассажей. Культуры клеток, прошедшие 1 пассаж, расценивали как молодые, 4 пассажа – как зрелые, 7 пассажей – как старые культуры.
Популяции клеток культивировали как без добавления гормонов, так и с серотонином или мелатонином (оба гормона фирмы “Sigma”) в течение 1 ч при 37оС в трех концентрациях – 2, 20 и 200 нг/мл.
Клетки помещали на стерильные предметные стекла. Пермеабилизацию производили в 0,1% Тритоне X-100 в течение 10 мин при комнатной температуре. Клетки фиксировали 4% нейтральным забуференным формалином (pH 7.2) в течение 15 мин. Инкубацию монослоя клеток в первичных моноклональных мышиных антителах к протеинам CDX1 и RUNX3 (оба антитела фирмы Mubio Products B.V., 1:50) проводили в течение 1 часа.
После промывания в фосфатном буфере монослой клеток инкубировали во вторичных антителах в течение 1 часа. В качестве вторичных антител использовали кроличий антимышиный Ig, коньюгированный с флюоресцеинизотиоцианатом (FITC, DAKO, 1:100,). После окончательного промывания в фосфатном буфере (pH 7.2) стекла с монослоем клеток покрывали средой, содержащей 90% глицерин, 0.02 M Tris–HCl (pH 8.0), 0.8% NaN3 и 2% 1,4-ди-азобицикло-(2,2,2)-октан (Merck).
Изучение препаратов с определением площади экспрессии проводили в микроскопе Leica TCS SP5 при увеличении х400, х600 и х1000 с использованием системы MRC-1024 (Bio-Rad).
Аргирофильные белки областей ядрышковых организаторов (ОЯОР) выявляли в клетках с помощью нитрата серебра. Метод избирательной импрегнации ядрышковых организаторов в модификации (Howell W.M., Black D.A., 1980):
Подсчет аргирофильных гранул проводили в 100 клетках при увеличении х1000 и рассчитывали среднее число гранул серебра на 1 ядро эпителиальной клетки, определяя среднее количество гранул в каждой исследованной группе.
Статистическая обработка материала включала в себя оценку полученных данных методом ANOVA, использование стандартных методов вариационной статистики (расчет средних значений (М), ошибки средних значений (m), t-критерия Стьюдента) и элементов непараметической статистики. Достоверными считали различия при р<0,05.
Результаты собственных исследований
и их обсуждение
Нейроэндокринные взаимодействия при соматической патологии
в пожилом возрасте
Нейроиммуноэндокринная система при язвенной болезни желудка и двенадцатиперстной кишки. Уровень TNF- в контрольной группе составил 130,2±56,8 пг/мл. При обострении язвенной болезни уровень TNF- был достоверно выше (395,2±39,7 пг/мл у больных с НР-ассоциированной язвенной болезнью и 299,2±20,1 пг/мл в группе пациентов, у которых язвенная болезнь не была ассоциирована с НР-инфекцией, р<0,05) (рис.1). На стадии клинико-эндоскопической ремиссии наблюдалось снижение уровня TNF-: недостоверное (p>0,05) у больных с НР-ассоциированной язвенной болезнью – до 274,7±58,0 пг/мл и достоверное в группе пациентов, у которых язвенная болезнь не была ассоциирована с НР-инфекцией – до 162,8±8,4 пг/мл(p<0,05).
На стадии истинной ремиссии наблюдалось достоверное (p<0,05) снижение уровня TNF- как у больных с НР-ассоциированной язвенной болезнью, так и в группе пациентов, у которых язвенная болезнь не была ассоциирована с НР-инфекцией – до 171,0±26,3 и 156,7±10,4 пг/мл, соответственно, и эти значения достоверно не отличались от таковых у пациентов контрольной группы. Таким образом, обострение язвенной болезни характеризуется выраженным повышением уровня провоспалительного цитокина TNF- в сыворотке крови, а в динамике ее течения наблюдается снижение TNF- до практически нормальных значений. Однако восстановление уровня TNF- происходит разными темпами.
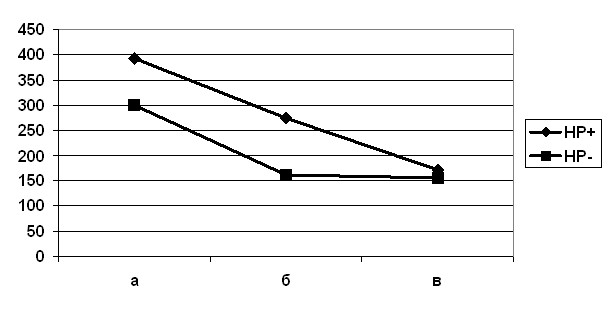 а – стадия обострения
а – стадия обострения
б – стадия клинико-эндоскопической ремиссии
в- стадия истинной ремиссии
Рис. 1. Динамика уровня TNF- в сыворотке крови в процессе лечения язвенной болезни у пожилых людей.
Следует подчеркнуть, что и при НР-ассоциированной язвенной болезни, и при язвенной болезни без НР-инфекции в период обострения, наблюдалось достоверное повышение уровня TNF- по сравнению с пациентами из группы контроля. Однако при НР-ассоциированной язвенной болезни повышение уровня TNF- настолько велико, что достоверно превышает даже увеличенный уровень TNF- в сыворотке крови у пациентов без НР-инфекции (394,1±38,9 пг/мл против 298,5±19,8 пг/мл, p<0,05). На стадии клинико-эндоскопической ремиссии такая же диспропорция в уровнях TNF- сохраняется (273,4±57,8 пг/мл у пациентов с НР-ассоциированной язвенной болезнью и 161,7±8,3 пг/мл у больных без НР-инфекции, р<0,05). И только на стадии истиной ремиссии наблюдается достижение нормальных значений TNF- в сыворотке крови (172,0±25,8 пг/мл у пациентов с НР-ассоциированной язвенной болезнью и 157,8±10,3 пг/мл у больных без НР-инфекции, р>0,05 для обеих групп по сравнению со значениями TNF- в контрольной группе -129,2±57,0 пг/мл).
Уровень IL-1 в контрольной группе составил 1,07±0,22 нг/мл, IL-6 - 3,06±0,17 пг/мл. При обострении язвенной болезни уровень IL-1 был достоверно выше (3,93±0,35 нг/мл у больных с НР-ассоциированной язвенной болезнью и 2,91±0,22 нг/мл в группе пациентов, у которых язвенная болезнь не была ассоциирована с НР-инфекцией, р<0,05). Уровень IL-6 был достоверно выше (15,21±2,71 пг/мл) у больных с НР-ассоциированной язвенной болезнью по сравнению с контрольной группой (р<0,05). В группе пациентов, у которых язвенная болезнь не была ассоциирована с НР-инфекцией, этот показатель составил 13,93±1,22 пг/мл (р>0,05). На стадии клинико-эндоскопической ремиссии наблюдалось снижение уровня IL-1: недостоверное (p>0,05) у больных с НР-ассоциированной язвенной болезнью – до 3,55±0,55 нг/мл и достоверное (p<0,05) в группе пациентов, у которых язвенная болезнь не была ассоциирована с НР-инфекцией – до 1,13±0,32 нг/мл. Уровень IL-6 снизился достоверно (p<0,05) в обеих группах пациентов: у больных с НР-ассоциированной язвенной болезнью – до 4,44±1,23 пг/мл и в группе пациентов, у которых язвенная болезнь не была ассоциирована с НР-инфекцией – до 4,24±1,12 пг/мл.
На стадии истинной ремиссии наблюдалось достоверное (p<0,05) снижение уровней IL-1 и IL-6 как у больных с НР-ассоциированной язвенной болезнью, так и в группе пациентов, у которых язвенная болезнь не была ассоциирована с НР-инфекцией – соответственно, до 1,22±0,34 нг/мл и 1,12±0,41 нг/мл для IL-1, до 3,12±0,22 пг/мл и 3,32±0,19 пг/мл для IL-6, и эти значения достоверно не отличались от таковых у пациентов контрольной группы. Таким образом, обострение язвенной болезни характеризуется выраженным повышением уровней IL-1 и IL-6 в сыворотке крови, а в динамике ее течения наблюдается снижение уровней этих сигнальных молекул до практически нормальных значений. Однако восстановление уровней интерлейкинов происходит различными темпами как в зависимости от типа интерлейкина, так и от наличия/отсутствия НР-инфекции. Восстановление уровня IL-6 наблюдается уже на стадии клинико-эндоскопической ремиссии, в то время как уровень IL-1, достоверно не отличающийся от такового в контрольной группе, достигается только к периоду истинной ремиссии (табл. 1).
Уровень молекул адгезии sICAM-1 и sVCAM-1 в сыворотке крови в контрольной группе составил, соответственно, 52,3±10,9 нг/мл и 511,6±42,1. При обострении язвенной болезни достоверного повышения уровней данных молекул не происходило: уровень sICAM составил 66,2±17,2 нг/мл у больных с НР-ассоциированной язвенной болезнью и 57,1±13,9 нг/мл в группе пациентов, у которых язвенная болезнь не была ассоциирована с НР-инфекцией.
Таблица 1
Уровни IL-1 (нг/мл) и IL-6 в сыворотке крови (пг/мл)
на различных стадиях язвенной болезни у пожилых пациентов
| Изучаемый показатель, группа больных | Контрольная группа (n=34 | Стадия язвенной болезни | |||
| Обострение | Клинико-эндоскопичес-кая ремиссия | Истинная ремиссия | |||
| IL-1, 1-я, НР+ (n=42) | 1,07±0,21 | 3,89±0,33* | 3,49±0,53* | 1,21±0,33** | |
| IL-1, 2-я, HP- (n=31) | 2,87±0,19* | 1,12±0,32** | 1,13±0,37** | ||
| IL-6, 1-я, НР+ (n=42) | 3,06±0,15 | 15,23±2,68* | 4,37±1,21** | 3,14±0,31** | |
| IL-6, 2-я, HP- (n=31) | 13,68±1,11* | 4,31±1,10** | 3,01±0,15** | ||
* - p<0,05 в сравнении с контрольной группой
** - p<0,05 в сравнении со стадией обострения
На стадии клинико-эндоскопической ремиссии уровень молекул адгезии также достоверно не отличался от такового в контрольной группе пациентов: у больных с НР-ассоциированной язвенной болезнью – 65,9±17,8 нг/мл и в группе пациентов, у которых язвенная болезнь не была ассоциирована с НР-инфекцией – 54,8±7,2 нг/мл для sICAM, для sVCAM – соответственно, 495,3±30,1 и 505,5±34,1 нг/мл. На стадии истинной ремиссии уровень молекул адгезии в сыворотке крови также не отличался от такового в контрольной группе: у больных с НР-ассоциированной язвенной болезнью и в группе пациентов, у которых язвенная болезнь не была ассоциирована с НР-инфекцией – для sICAM, соответственно, 57,1±9,3 и 52,8±9,1 для sVCAM - 497,5±28,1 и 505,5±16,9 нг/мл. Таким образом, достоверных изменений уровня молекул адгезии в сыворотке крови у пациентов как с НР-ассоциированной язвенной болезнью, так и у больных, не имеющих НР-инфекции, не наблюдалось ни в период ремиссии, ни в период обострения. Эти показатели оставались стабильными в весь период лечения пациентов.
При язвенной болезни, ассоциированной с НР-инфекцией, наблюдается угнетение гуморального иммунитета. Происходит достоверное снижение в сыворотке крови (р<0,05) уровня IgA – до 1,21±0,22 г/л (в контрольной группе этот показатель составил 2,53±0,18 г/л) и IgG – до 8,1±0,05 г/л (в контрольной группе - 13,4±0,03 г/л). Уровень IgM достоверно не изменялся (p>0,05): 1,72±0,29 г/л у больных и 1,23±0,32 в контрольной группе. Также обнаружены значительные изменения во фракциях IgG. Достоверно (p<0,05) снижается количество IgG1 до 3,11±0,12 г/л (в контрольной группе этот показатель составил 7,66±0,07 г/л), IgG2 – до 5,16±0,08 г/л (в контрольной группе - 5,87±0,04), IgG3 – до 0,21±0,02 г/л) (в контрольной группе - 1,1±0,02). Количество IgG4 достоверно не изменилось (p>0,05): 0,35±0,10 г/л при уровне 0,36±0,09 г/л в контрольной группе.
Также следует подчеркнуть, что нами выявлено низкое содержание специфического Ig G - 98,3±12,9 МЕ/мл (по данным Федоренко С.В. (2006) аналогичный показатель у больных с хроническим антральным гастритом составляет 174,66±8,5 МЕ/мл).
При язвенной болезни без НР-инфекции также наблюдается угнетение гуморального иммунитета. Происходит достоверное снижение (р<0,05) уровня IgA – до 1,32±0,05 г/л (в контрольной группе этот показатель составил 2,53±0,18 г/л) и IgG – до 9,23±0,34 г/л (в контрольной группе - 13,2±0,01 г/л). Уровень IgM достоверно не изменялся (p>0,05): 1,19±0,09 г/л у больных и 1,23±0,32 г/л в контрольной группе. Также обнаружены значительные изменения во фракциях IgG. Достоверно (p<0,05) снижается количество: IgG1 до 5,58±0,05 г/л (в контрольной группе этот показатель составил 7,66±0,07 г/л); IgG2 – до 3,94±0,03 г/л (в контрольной группе - 5,87±0,04 г/л); IgG3 – до 0,21±0,03 г/л (в контрольной группе - 1,1±0,02 г/л).
Количество IgG4 достоверно не изменилось (p>0,05): 0,33±0,10 г/л при уровне 0,36±0,09 г/л в контрольной группе.
Нейроиммуноэндокринные взаимосвязи при дисгормональной гиперплазии предстательной железы. Уровень TNF- в сыворотке крови в группе здоровых лиц составил 133,1±55,7 пг/мл. При наличии ДГПЖ уровень TNF- был достоверно выше (294,2±27,5 пг/мл у больных с ДГПЖ 1 стадии и 306,9±26,9 пг/мл в группе пациентов с ДГПЖ 2 стадии, р<0,05). Уровень IL-1 в сыворотке крови здоровых пожилых лиц составил 1,03±0,19 нг/мл, IL-6 - 3,2±0,12 пг/мл. При ДГПЖ 1 стадии уровень IL-1 был достоверно выше (3,52±0,19 нг/мл), при ДГПЖ 2 стадии - 2,79±0,18 нг/мл, р<0,05. Таким образом, по сравнению со здоровыми пожилыми людьми при ДГПЖ отмечается достоверное увеличение продукции провоспалительных интерлейкинов.
Молекулы адгезии при ДГПЖ. Уровень содержания молекул адгезии sICAM-1 и sVCAM-1 в сыворотке крови в контрольной группе здоровых пациентов без ДГПЖ составил, соответственно, 51,9±10,3 нг/мл и 521,0±21,3 нг/мл. При наличии ДГПЖ достоверного повышения уровней содержания данных молекул в сыворотке крови не происходило. Таким образом, нейроиммуноэндокринные сдвиги при ДГПЖ не отражаются на синтезе молекул адгезии. При ДГПЖ у лиц пожилого возраста отмечаются провоспалительные нейроиммуноэндокринные изменения, которые характеризуются увеличением концентрации провоспалительных интерлейкинов, TNF- при отсутствии динамики содержания молекул адгезии.
Оксидативный гомеостаз как индикатор возрастных
изменений нейроиммуноэндокринной регуляции
Для характеристики оксидативных процессов проведено определение МДА (малонового диальдегида), как промежуточного метаболита перекисного окисления, характеризующего долгосрочные оксидативные процессы.
В качестве маркера антиоксидантной защиты выбрано содержание SH-групп. Комплексная оценка оксидативного стресса дана по величине коэффициента SH/МДА. Результаты проведенного исследования приведены в таблице 2.
Таблица 2
Сравнительная характеристика оксидативного гомеостаза
у здоровых лиц среднего и пожилого возраста
| Показатель | Средний возраст | Пожилой возраст |
| МДА (мкмоль/л) | 32,1 ± 1,2 | 41,1 ± 1,0* |
| SH (мкмоль/л) | 317,5 ± 10,5 | 291,4 ± 7,3* |
| SH / МДА | 9,89 ± 0,2 | 7,09 ± 0,4* |
* - p<0,05 – по сравнению с пациентами среднего возраста.
Согласно полученным данным, в пожилом возрасте имеется тенденция к увеличению концентрации МДА с 32,1±1,2 мкмоль/л в среднем возрасте до 41,1±1,0 мкмоль/л, в пожилом возрасте, р<0,05. Это свидетельствует об увеличении прооксидантного потенциала в пожилом возрасте, по мере старения, несмотря на отсутствие заболеваний.
Также отмечена тенденция к снижению содержания маркеров прооксидантов SH-групп с 317,5±10,5 мкмоль/л в среднем возрасте до 291,4±7,3 мкмоль/л у пожилых, р<0,05. Соответственно происходит снижение суммарного коэффициента, характеризующего оксидативный стресс. Так, у здоровых лиц среднего возраста его значение составляет 9,89±0,2 мкмоль/л, у здоровых пожилых – 7,09±0,4 мкмоль/л, р<0,05.
Таким образом, у здоровых пожилых пациентов имеется достоверная тенденция к снижению маркеров антиоксидантной защиты и увеличению содержания малонового диальдегида как показателя течения оксидативных процессов.
Нами изучены особенности оксидативного гомеостаза у пожилых лиц с ДГПЖ различной степени выраженности. Результаты представлены в таблице 3.
Таблица 3
Зависимость выраженности оксидативного стресса от степени доброкачественной гиперплазии предстательной железы
| Группа пациентов | МДА (мкмоль/л) | SH (мкмоль/л) | SH /МДА |
| ДГПЖ 1 ст. | 43,1±0,7* | 259,4±8,2* | 6,01±0,2* |
| ДГПЖ 2 ст. | 45,1±1,2* | 255,2±5,4* | 5,65±0,3* |
| ДГПЖ 3 ст. | 51,5±1,1* | 201,3±8,9* | 3,93±0,1* |
| Здоровые пожилые пациенты | 41,5±1,2 | 292,5±7,1 | 7,04±0,2 |
* - p<0,05 – по сравнению со здоровыми пожилыми пациентами.
При изучении влияния степени ДГПЖ на состояние оксидативного гомеостаза выявлено, что наиболее благополучная картина складывается при поражении первой степени, так как имеет место достоверно меньшее содержание прооксидантных агентов и высокая концентрация SH-групп, р<0,05. По мере прогрессирования патологии предстательной железы состояние оксидативного стресса усугубляется, происходит накопление прооксидантных продуктов при одновременном ослаблении антиоксидантных механизмов защиты.
При этом, с нашей точки зрения, патогенетическое значение имеют не только локальные изменения предстательной железы, но и системные сдвиги на уровне целостного организма, в частности, присоединение хронической почечной патологии, артериальной гипертензии, нарушений азотистого и других видов обмена. Необходимо отметить, что по сравнению со здоровыми пожилыми пациентами оксидативный сдвиг наблюдается даже при ДГПЖ 1 степени, поскольку отмечена достоверная разность в уровне МДА, SH-групп, а также соотношения SH /МДА, р<0,05. Таким образом, нейроиммуноэндокринные изменения, развивающиеся при любой степени поражения предстательной железы при ДГПЖ, в том числе на начальных этапах, приводят к сдвигу оксидативного равновесия в прооксидантную фазу.
Соматическая патология в пожилом возрасте как апудопатии
Язвенная болезнь двенадцатиперстной кишки у пожилых больных как апудопатия. APUD-система подвергается патологическим изменениям при обострении ЯБ в пожилом возрасте, что проявляется изменением количества иммунопозитивных нейроэндокринных клеток в слизистой оболочке желудка и двенадцатиперстной кишки.
Таблица 4
Количественная характеристика эндокринных клеток желудка при язвенной болезни (М±m)
| Здоровые | Пациенты с ЯБ | |
| Стадия обострения | Стадия клинико-эндоскопической ремиссии | ||
| А | 2,47±0,15 | 1,2±0,11 | 1,73±0,1 |
| р | <0,05 | <0,05 | |
| НА- | 1,65±0,12 | 0,86±0,07 | 1,15±0,35 |
| р | <0,05 | >0,05 | |
| ЕС- | 6,26±0,21 | 9,3±0,24 | 9,8±0,46 |
| р | <0,05 | <0,05 | |
| ЕСL- | 2,17±0,07 | 7,26±0,45 | 7,6±0,8 |
| р | <0,05 | <0,05 | |
| J- | 10,75±0,32 | 14,3±0,4 | 11,8±3,33 |
| р | <0,05 | >0,05 | |
| э- | 4,29±0,11 | 6,23±0,15 | 6,41±0,17 |
| р | <0,05 | <0,05 | |
| М- | 0,74±0,03 | 0,56±0,01 | 0,67±0,2 |
| р | <0,05 | <0,05 | |
Примечание: р - по отношению к контрольной группе;. А-клетки - продуцируют глюкагон; НА-клетки - норадреналин; ЕС-клетки - мелатонин и серотонин; ECL-клетки - гистамин; э-клетки - эндорфины; М-клетки - мотилин.
Данные исследования в период обострения представлены следующими изменениями в антральном отделе желудка: гипоплазией А-, НА- и М-клеток; гиперплазией ЕС-, ECL. J- и клеток с -эндорфиноподобной иммунореактивностью. Количественные изменения эндокринных клеток (ЭК) в луковице двенадцатиперстной кишки носили более рельефный характер. O6paщала на себя внимание тотальная гипоплазия апудоцитов, продуцирующих катехоламин. Число М-клеток в луковице двенадцатиперстной кишки было в пределах нормы. Содержание же ЕС-, ECL- и -эндорфинпродуцирующих клеток в данном отделе кишечника было идентично их количеству в антральном отделе желудка (табл. 4, 5).
Таблица 5
Количественная характеристика эндокринных клеток двенадцатиперстной кишки у пожилых больных язвенной болезнью в зависимости от стадии заболевания (М ±m)
| Здоровые | Пациенты с ЯБ | |
| Стадия обострения | Стадия клинико-эндоскопической ремиссии | ||
| А | 1,28±0,12 | 0,5±0,11 | 0,66±0,22 |
| р | <0,05 | <0,05 | |
| НА- | 0,95±0,01 | 0,23±0,07 | 0,43±0,21 |
| р | <0,05 | >0,05 | |
| ЕС- | 3,8±0,14 | 5,78±0,16 | 5,87±1,3 |
| р | <0,05 | <0,05 | |
| ЕСL- | 1,3±0,02 | 4,23±0,21 | 4,1±1,63 |
| р | <0,05 | <0,05 | |
| э- | 0,55±0,02 | 0,75±0,03 | 0,78±0,02 |
| р | <0,05 | <0,05 | |
| М- | 0,52±0,04 | 0,66±0,17 | 0,61±0,02 |
| р | >0,05 | >0,05 | |
Примечание: р - по отношению к контрольной группе.

*- р<0,05 по сравнению с контрольными показателями у здоровых пожилых людей и пожилых больных с ДГПЖ.
Рис. 2. Площадь экспрессии хромогранина А и соматостатина (%) в предстательной железе лиц разного возраста.
Доброкачественная гиперплазия предстательной железы как апудопатия.. Площадь экспрессии хромогранина А в препаратах предстательной железы достоверно снижалась с увеличением возраста. Так, у здоровых пациентов среднего возраста величина площади экспрессии хромогранина А составила 5,33±0,03 у.е., что в 4 раза больше, чем в группе здоровых пожилых пациентов (1,35±0,04 у.е.), а площадь экспрессии соматостатина была равна 4,46±0,02 у.е., у пожилых больных – 3,01±0,01 у.е. (p<0,05). Таким образом, с увеличением возраста площадь экспрессии хромогранина А и соматостатина уменьшались (рис. 2). В то же время, при ДГПЖ у пожилых была отмечена выраженная экспрессия исследуемых маркеров: хромогранина А и соматостатина (рис. 2): площадь экспрессии хромогранина А составила 4,01±0,03 у.е., соматостатина - 3,86±0,03 у.е. (р<0,05 по сравнению с показателем у пожилых больных с ДГПЖ и p>0,05 по сравнению с показателем у здоровых пожилых людей).
Рак простаты как опухолевая апудопатия. Микроструктура рака предстательной железы в исследованных случаях характеризовалась полиморфизмом. В одной и той же опухоли обычно обнаруживалась различная дифференцировка раковых клеток. В отличие от очагов нодулярной гиперплазии, отмечался гиперхроматоз ядер, клеточный полиморфизм, исчезновение соединительнотканных сосочков в просвете желез. Амилоидные тельца в просвете раковых желез обнаруживались крайне редко. По периферии желез исчезали миоэпителиальные клетки.
Полученные данные свидетельствуют о достоверном снижении экспрессии хромогранаина А и соматостатина в нейроэндокринных (НЭ) клетках предстательной железы человека с увеличением возраста (p<0,05).
Образованные клетками железистые трубочки округлой, овальной или неправильной формы тесно прилежат друг к другу, стромы между ними почти нет. В просвете иногда содержатся гомогенные массы розового цвета. В строме опухоли вокруг сотовидных комплексов можно видеть группы разрозненных опухолевых клеток, нередко складывающихся в небольшие трубочки, тяжи, железистые структуры. Во всех случаях в аденокарциномах были обнаружены хромогранин А/соматостатин-продуцирующие НЭ клетки. При окраске гематоксилином-эозином они были крупнее обычных клеток, располагались в базальной части атипичных желез. Цитоплазма их была эозинофильна, ядро смещено в апикальный полюс. Обширные и множественные скопления нейроэндокринных клеток в основном обнаруживались в высокодифференцированных опухолях. При этом опухолевые нейроэндокринные клетки не демонстрировали признаков пролиферативной активности.

* - р<0,05 по сравнению с пациентами среднего возраста
Рис. 3. Площадь экспрессии хромогранина А и соматостатина в аденокарциноме предстательной железы пациентов разного возраста.
Площадь экспрессии хромогранина А в раковых опухолях достоверно снижалась с увеличением возраста (p<0,05). Для соматостатина отмечается тенденция к значительному увеличению показателей (2,34±0,01) (рис. 3).
Подобные изменения характерны и для оптической плотности этих показателей (рис. 4).

*- р<0,05 по сравнению с пациентами среднего возраста
Рис. 4. Оптическая плотность (усл. ед.) экспрессии хромогранина и соматостатина в аденокарциноме предстательной железы пациентов разного возраста.
При иммуногистохимическом исследовании раковых опухолей предстательной железы было обнаружено, что в 20 из 32 случаев аденокарциномы часть клеток, в которых была зарегистрирована положительная реакция с антисывороткой к соматостатину, вступала в положительную реакцию с антисыворотками против хромогранина А.
Нейроиммуноэндокринные взаимосвязи при моделировании искусственного (радиационного) старения
Желудочно-кишечный тракт. При светооптическом исследовании рельефа слизистой оболочки двенадцатиперстной кишки после воздействия облучения выраженных отличий по сравнению с рельефом двенадцатиперстной кишки интактных животных не обнаружено. Ворсинки различной высоты плотно прилегают друг к другу, имеют преимущественно пальцевидную и листовидную форму. В основании ворсинок находятся крипты, где локализуется основное количество эндокринных клеток двенадцатиперстной кишки.
При электронно-микроскопическом исследовании в эпителиоцитах обращает на себя внимание появление увеличенных в размерах митохондий с дезорганизацией крист. В некоторых клетках наблюдается небольшое расширение цистерн шероховатого эндоплазматического ретикулума. Со стороны апудоцитов выявляются ультраструктурные нарушения различной степени тяжести, но в целом более выраженные, чем в неэндокринных энтероцитах, локализованных в слизистой оболочке двенадцатиперстной кишки. В эндокринных клетках практически всех типов отмечается дезорганизация митохондрий, проявляющаяся в отеке и нарушении структуры крист, при этом внутренние и внешние мембраны митохондрий не повреждены. Многие эндокринные клетки имеют расширенные профили эндоплазматического ретикулума, в отдельных отмечается гиперплазия пластинчатого комплекса. Вакуолизация цитоплазмы в разных эндокринных клетках выражена неодинаково: от умеренной до очень слабой.
ЕС-клетки. Популяция энтерохромаффинных клеток представлена преимущественно ЕС2-клетками. После воздействия пролонгированного облучения выявляются выраженные нарушения ультраструктуры клеток данного типа. В ЕС-клетках обнаруживаются значительно увеличенные в размерах отечные просветленные митохондрии, с сильными повреждениями крист, на месте разрушения которых образуются вакуоли. В некоторых клетках наблюдается отслоение наружной ядерной мембраны и вакуолизация цитоплазмы разной степени выраженности. Наряду с этим, отдельные ЕС-клетки имеют незначительные ультраструктурные изменения, за исключением дезорганизации митохондрий. Во многих ЕС-клетках отчетливо выражен шероховатый и гладкий эндоплазматический ретикулум, цистерны которых плотно прилегают друг к другу, а некоторые имеют слабо выраженные профили эндоплазматической сети. Идентифицированный пластинчатый комплекс демонстрирует различную функциональную активность в разных ЕС-клетках. В цитоплазме ЕС-клеток идентифицируются характерные секреторные гранулы с высокой электронной плотностью, расположенные преимущественно вокруг ядра. Секреция гормонов осуществляется либо слабо выраженной дегрануляцией (преимущественно в клетках с выраженными ультраструктурными повреждениями), либо экзоцитозом (в клетках, близких к норме).
G-клетки. В немногочисленных G-клетках отмечается разная степень ультраструктурных нарушений. В G-клетках с выраженными ультраструктурными повреждениями обращает на себя внимание значительное расширение цистерн шероховатого эндоплазматического ретикулума и элементов пластинчатого комплекса. В эндокринных клетках данного типа идентифицируются отечные митохондрии, большинство которых содержат поврежденные кристы. На месте разрушения отдельных митохондрий образуются вакуоли различных размеров. G-клетки содержат разное количество секреторных гранул высокой электронной плотности, в некоторых клетках наблюдается слабая дегрануляция.
D-клетки. После воздействия пролонгированного облучения в большинстве D-клеток отмечается гиперплазия и дилятация элементов пластинчатого комплекса. Увеличенные в размерах митохондрии с просветленным матриксом имеют существенную дезорганизацию крист. В цитоплазме наблюдается расширение канальцев шероховатого эндоплазматического ретикулума с заполнением электронно-плотным содержимым. Отдельные D-клетки подвержены сильной деструкции, но при этом в них сохраняются секреторные гранулы разной электронной плотности. В цитоплазме идентифицируются лизосомы. Плазматическая мембрана разрушена. Границы между D-клетками и эпителиальными часто выглядят неотчетливыми из-за некробиотических изменений. В цитоплазме D-клеток идентифицируется большое количество секреторных гранул, имеющих преимущественно высокую электронную плотность. Встречаются небольшие округлые вакуоли, сопровождающие процесс дегрануляции.
ECL-клетки. Среди всей популяции апудоцитов редко встречающиеся ECL-клетки характеризуются хорошей ультраструктурной организацией после пролонгированного облучения. Цитоплазматические органеллы просматриваются слабо, за исключением митохондрий удлиненной формы, некоторые из которых имеют повреждения крист. Большое число везикул и рибосом равномерно распределено по всей цитоплазме ECL-клеток. В цитоплазме ECL-клеток идентифицируется большое количество характерных секреторных гранул
N-клетки. Немногочисленные N-клетки сохраняют ультраструктурную организацию в состоянии близком к контролю. Единственным проявлением повреждающего действия пролонгированного облучения являются набухшие митохондрии с дезорганизацией крист, которые встречаются в цитоплазме N-клеток наряду с мелкими неповрежденными митохондриями. В цитоплазме N-клеток присутствует большое количество рибосом, полисом и везикул. Иногда встречаются отдельные профили эндоплазматической сети и пластинчатого комплекса с признаками слабой функциональной активности. Небольшое количество круглых секреторных гранул высокой электронной плотности сконцентрировано вокруг ядра.
К-клетки. После воздействия пролонгированного облучения К-клетки, также как и N-клетки, демонстрируют почти неповрежденную ультраструктуру, но в отличие от N-клеток, они содержат большое количество секреторных гранул, обладающих преимущественно высокой электронной плотностью. В цитоплазме К-клеток идентифицируются небольшие митохондрии, хотя встречаются и отечные, содержащие частично поврежденные кристы. Другие цитоплазматические органеллы присутствуют в небольшом количестве и просматриваются слабо, за исключением небольших фрагментов пластинчатого комплекса с признаками различной функциональной активности.
L-клетки. Популяция L-клеток представлена как клетками, имеющими неповрежденную ультраструктуру, так и клетками с выраженными морфологическими повреждениями. Отмечается увеличение площади поверхности ядра и отслоение наружной ядерной мембраны. Как и в других эндокринных клетках, в L-клетках обнаруживаются отечные митохондрии с признаками деструкции. В клетках с выраженными повреждениями часто наблюдаются нарушения лимитирующей клеточной мембраны. В цитоплазме L-клеток присутствует разное количество секреторных гранул различного размера и электронной плотности. Наблюдается частичная дегрануляция отдельных L-клеток.
D1-клетки. После действия пролонгированного облучения D1-клетки имеют разные признаки нарушения ультраструктурной организации, сочетание которых в разных клетках выражено неодинаково. В цитоплазме D1-клеток присутствуют лизосомы, идентифицируется большое количество рибосом и полисом. Хорошо сохранившиеся митохондрии распределены между поврежденными, которые имеют разрушенные кристы. В отдельных D1-клетках наблюдается вакуолизация цитоплазмы, являющаяся следствием отслоения наружной ядерной мембраны, расширения профилей эндоплазматической сети и пластинчатого комплекса и разрушения митохондрий. Цитоплазма D1-клеток содержит разное количество секреторных гранул, при этом в клетках с выраженными ультраструктурными повреждениями количество секреторных гранул заметно снижено в результате дегрануляции.
Р-клетки. После воздействия пролонгированного облучения Р-клетки преимущественно имеют хорошую ультраструктурную организацию. Внутриклеточные органеллы просматриваются слабо. Изредка идентифицируются отдельные профили эндоплазматической сети и пластинчатого комплекса. В цитоплазме эндокринных клеток данного типа присутствует большое количество рибосом. На месте отдельных разрушенных митохондрий встречаются вакуоли. В цитоплазме Р-клеток выявляются секреторные гранулы разной электронной плотности, присутствующие в цитоплазме в умеренном количестве. Наблюдается дегрануляция Р-клеток.
S-клетки. После воздействия пролонгированного облучения в цитоплазме S-клеток обнаруживается большое количество митохондрий небольшого размера, в некоторых из них наблюдается небольшая дезорганизация крист. Ультраструктура S-клеток отличается хорошей организацией без существенных повреждений, вакуолизация не отмечается. В S-клетках содержится много рибосом и полисом, отчетливо просматриваются профили эндоплазматической сети. Большое количество секреторных гранул высокой электронной плотности равномерно распределено по цитоплазме. В отдельных S-клетках наблюдается снижение электронной плотности секреторных гранул. Дегрануляция выражена слабо.
Проведенные ультраструктурные исследования эндокринных клеток, локализованных в слизистой оболочке двенадцатиперстной кишки, после воздействия пролонгированного облучения показали, что среди одних типов апудоцитов (ЕС-, G-, D-, L- и D1-клетки) выявляются как клетки, имеющие хорошую ультраструктурную организацию без существенных повреждений и близкую к контролю, так и клетки с выраженными нарушениями. Причем в D-и L-клетках повреждения ультраструктуры значительно более выражены, чем в апудоцитах, продуцирующих другие гормоны. В других типах эндокринных клеток (ECL-, N-, К-, Р-, S-клетки) ультраструктурные нарушения практически полностью отсутствуют. Почти во всех типах апудоцитов, за исключением ECL и N-клеток, присутствуют признаки дегрануляции. Кроме того, в отдельных эндокринных клетках наблюдается экзоцитоз.
Предстательная железа. В простате у крыс при моделировании преждевременного старения хромогранин А-продуцирующие НЭ клетки встречались реже, чем в контрольной группе.
У животных подопытной группы через 7 дней после однократного облучения (модель преждевременного старения) в большинстве эпителиальных клеток обнаруживались набухшие митохондрии с просветленным матриксом. Профили шероховатого эндоплазматического ретикулума были расширены, число его структур увеличено, особенно много было везикул и вакуолей. Число свободных рибосом и полисом увеличено. Межклеточные щели расширены.
При электронно-микроскопическом исследовании НЭ клеток обращает на себя внимание увеличение количества и размеров митохондрий, изменений формы, с поврежденными кристами. В НЭ клетках выявлялось округлое или овальное крупное ядро, иногда видоизмененной формы с изрезанными контурами кариолеммы. В цитоплазме отмечалась вакуолизация, выраженная в разной степени в различных типах нейроэндокринных клеток; наблюдалось присутствие единичных лизосом и липофусциновых включений. Шероховатый и гладкий эндоплазматический ретикулум четко контурировался, часто с заметным расширением цистерн, пластинчатый комплекс был функционально активен и у некоторых типов эндокринных клеток гиперплазирован. В цитоплазме выявлялось различное количество секреторных гранул разной величины и формы.
В цитоплазме хромогранин А-продуцирующих НЭ клеток отмечалось функциональное напряжение органелл. Митохондрии были набухшие, с дезорганизацией крист, иногда причудливой формы. Пластинчатый комплекс был гиперплазирован и имел признаки различной функциональной активности, в нем идентифицировались везикулярные компоненты. В цитоплазме встречалось много свободных рибосом и полисом, ядра клеток имели неровные контуры. Нередко наблюдалось отслоение наружного листка кариолеммы. Цитоплазма была вакуолизирована за счет расширения канальцев шероховатого эндоплазматического ретикулума и разрушения митохондрий.
В базальной части клеток выявлялось разное количество полиморфных (округлых, почковидных, гантелеобразных, ракетообразных и бобовидных) секреторных гранул высокой электронной плотности, часто окруженных узким светлым ободком и тонкой мембраной. Многие клетки содержали умеренное число гранул, среди которых встречаются вакуоли. Ультраструктурные особенности позволили связать наличие секреторных гранул в клетках с экспрессией хромогранина А. Популяция нейроэндокринных клеток в предстательной железе у опытных крыс через 7 дней после однократного облучения сохраняла общую структуру, выявленную у животных контрольной группы. Однако имело место снижение числа хромогранин А-продуцирующих НЭ клеток по сравнению с контрольной группой.
Влияние синтетических пептидов на культуры тканей животных различного возраста
С целью оптимизации изучения серотонина и мелатонина в качестве возможных геропротекторов по отношению к эпителиоцитам желудка и предстательной железы было проведено пилотное исследование эффектов двух пептидов – эпиталона и простамакса на органотипические культуры различных тканей. Выбор указанных пептидов определялся возможной близостью эпиталона к эффектам мелатонина и серотонина, поскольку и эпиталон и биогенные амины имеют выраженное сродство к пинеальной железе, а простамакс был выбран для сравнения в качестве контрольного препарата.
Молодые животные. При культивировании фрагментов коры головного мозга молодых 1-дневных животных в зоне роста отмечалось появление мигрирующих нейронов с крупными центрально расположенныи ядрами, а также глиальных клеток и фибробластоподобных элементов. Из синтетических пептидов на эксплантаты коры молодых крыс стимулирующим образом действовал только эпиталон (рис. 5), ИП повышался на 28±7% (n=32, р<0,05), по сравнению с контрольными эксплантатами (n=24). Простамакс был неэффективен в отношении эксплантатов коры головного мозга.

Рис. 5. Влияние эпиталона и простамакса на эксплантаты коры головного мозга крысы.
При культивировании фрагментов подкорковых структур головного мозга, в которых зона роста состояла из клеточных элементов, аналогичных выявляемым в зоне роста эксплантатов коры, у молодых животных выраженная стимуляция развития эксплантатов происходила под влиянием только эпиталона (рис. 6), ИП повышался на 36±5% (n=28, р<0,05) по сравнению с контролем (n=34).

Рис. 6. Влияние эпиталона и простамакса на эксплантаты подкорковых структур головного мозга крысы.
В отношении эксплантатов печени стимулирующим действием обладал также только эпиталон в дозировке 20 нг/мл, при этом ИП повышался на 18±3% (n=24, p<0,05) по сравнению с ИП контрольных эксплантатов (n=21).
При культивировании ткани тимуса зона роста образовывалась за счет мигрирующих и пролиферирующих лимфобластов и некоторого количества фибробластов. При действии эпиталона в культуре ткани вилочковой железы молодых крысят зона роста уменьшалась на 35±5% (n=31, p<0,05), по сравнению с ИП контрольных эксплантатов (n=25). По-видимому, это связано с процессами апоптоза и селекции Т-клеток в тимусе в период неонатального развития, усиливающимися под действием эпиталона, так как уже у 3-недельных крыс эпиталон начинает стимулировать зону роста эксплантатов тимуса (рис. 7).

Рис. 7. Влияние эпиталона и простамакса на эксплантаты тимуса крысы.
Зрелые животные. При культивировании фрагментов коры головного мозга у этих животных зона роста также состояла из мигрирующих нейронов с крупными центрально расположенныи ядрами, глиальных клеток и фибробластоподобных элементов. Из синтетических пептидов на эксплантаты коры стимулирующим образом действовал эпиталон, при этом ИП повышался на 40±4% (n=39, р< 0,05) по сравнению с контрольными эксплантатами (n=28).
В эксплантатах подкорковых структур головного мозга, в которых зона роста состояла из клеточных элементов, аналогичных выявляемым в зоне роста эксплантатов 1-дневных животных, выраженная стимуляция развития эксплантатов происходила также под влиянием эпиталона, при этом ИП повышался на 27±3% (n=30, р<0,05), по сравнению с контролем (n=34). Простамакс не вызывал изменений ИП.
При культивировании ткани печени выявлено, что эпиталон в культуре ткани 21-дневных крысят усиливал развитие зоны роста на 21%±3 (n=20, p<0,05) по сравнению с ИП контрольных эксплантатов (n=25). Простамакс не оказывал влияния на развитие органотипической культуры печени.
При культивировании ткани тимуса выявлено, что эпиталон в культуре ткани вилочковой железы 21-дневных крысят усиливал развитие зоны роста на 15%±1 (n=30, p<0,05), по сравнению с ИП контрольных эксплантатов (n=25). Простамакс не оказывал влияния на развитие органотипической культуры вилочковой железы.
Старые животные. При культивировании коры головного мозга было обнаружено, что синтетические пептиды оказывали на кору головного мозга старых животных более сильное воздействие, чем это наблюдалось у молодых животных. Это выражалось в том, что эпиталон вызывал статистически достоверное увеличение ИП, который становился на 38±4% (n=30, р< 0,05) выше по сравнению с контрольными эксплантатами (n=24).
В культурах подкорковых структур головного мозга от старых животных эпиталон вызывал также статистически достоверное увеличение ИП, который становился на 20±2% (n=32, р< 0,05) выше по сравнению с контролем (n=25).
При культивировании ткани печени найдено, что эпиталон усиливал развитие зоны роста на 18%±1 (n=25, p<0,05) по сравнению с ИП контрольных эксплантатов (n=24).
При культивировании лимфоидной ткани вилочковой железы и селезенки старых крыс найдено, что у старых крыс простамакс угнетал зону роста эксплантатов тимуса на 25±3% (n=23, p<0,05) по сравнению с ИП контрольных эксплантатов тимуса крыс (n=22), что может быть связано с инволюционными процессами в вилочковой железе.
Полученные данные свидетельствуют о том, что эпиталон обладает стимулирующим действием в отношении различных тканей как молодых, так и старых животных и может рассматриваться в качестве геропротекторного средства.
Следующим этапом исследований явилась оценка возможного модулирующего и геропротекторного действия пептидов в культуре тканей.
Экспрессия сигнальных факторов дифференцировки при старении культур эпителиальных клеток желудка и предстательной железы
Ядерные белки
Культура эпителиоцитов желудка
Контроль. В эпителиоцитах желудка контрольной группы при инкубации в течение 10 мин среднее число гранул на ядро составляло 21,87±0,44 (табл. 6). При инкубации препаратов в течение 15 мин реакция в эпителиоцитах желудка была более интенсивная и гранулы серебра в ядрах эпителиальных клеток сливались в отдельные глыбки.
Действие серотонина. При всех концентрациях серотонина в эпителиоцитах желудка наблюдалось повышение содержания гранул серебра. Наибольшие изменения отмечались при концентрации серотонина 20 нг/мл и 200 нг/мл.
При концентрации серотонина 2 нг/мл среднее число гранул серебра на ядро эпителиоцита желудка составляло 25,2±0,43, что достоверно превышало контрольные значения на 9,5% (р<0,01).
При концентрации серотонина 20 нг/мл среднее число гранул серебра на ядро составляло 27,7±0,89, а при концентрации 200 нг/мл - 28,6±0,61 гранул на ядро. Эти показатели достоверно превышали контрольные значения, соответственно, на 22% (р< 0,001) и 26% (р<0,001) (табл. 6).
Таблица 6
Содержание гранул серебра в ядрах эпителиоцитов желудка при действии разных концентраций серотонина
| Контроль | Концентрация серотонина (нг/мл) | ||||||||
| 2 | 20 | 200 | |||||||
| М1±m1 (n=100) | M2±m2 (n=100) | M2>M1 (%) | р | М3±m3 (n=100) | M3>M1 (%) | р | М4±m4 (n=100) | M4>M1 (%) | р |
| 21,87±0,44 | 25,2±0,43 | 9,5 | <0,01 | 27,7±0,89 | 22 | <0,001 | 28,6±0,61 | 26 | <0,001 |
Действие мелатонина. В эпителиоцитах желудка наблюдалось снижение содержания гранул серебра. Оно было сходным при всех концентрациях мелатонина.
При концентрации мелатонина 2 нг/мл среднее число гранул серебра на ядро эпителиоцита составляло 20,5+0,51, что достоверно было ниже контрольных значений на 10% (р<0,001). При концентрации мелатонина 20 нг/мл среднее число гранул серебра на ядро эпителиальной клетки составляло 20,7+0,51, а при концентрации 200 нг/мл - 20,9+0,56, что было достоверно ниже контрольных значений, соответственно, на 9,6% и 8,6% (р<0,01 и р<0,02, соответственно).
Регистрируемые различия в содержании гранул серебра в ядрах клеток в зависимости от дозы мелатонина недостоверны (р<0,5).
Культура эпителиоцитов предстательной железы
Контроль. В контроле эпителиальные клетки простаты представляли однородную популяцию клеток, характеризующихся небольшими размерами и содержащие ядра с плотной структурой хроматина. В среднем число гранул на ядро составляло 3,15±0,08 (табл. 7). При инкубации в течение 10 мин реакция в тимоцитах практически отсутствовала.
Действие серотонина. При введении в культуральную среду серотонина в концентрации 2 нг/мл существенных изменений в клеточном составе эпителиальных клеток простаты зарегистрировано не было. В эпителиальных клетках простаты отмечалось лишь незначительное повышение числа гранул серебра по сравнению с контрольными значениями. Среднее число гранул серебра на ядро в этих условиях составляло 3,2+0,11, что недостоверно превышало контрольные значения на 4% (р<0,5) (табл. 7).
Увеличение в культуральной среде концентрации серотонина до 20 нг/мл и 200 нг/мл приводило к заметному повышению числа гранул серебра в эпителиальных клетках простаты. При концентрации серотонина 20 нг/мл количество гранул серебра составляло в среднем 3,76+0,12 на ядро; при концентрации 200 нг/мл - 3,89+0,10. Эти показатели достоверно превышали контрольные значения, соответственно, на 18% и 24% (р<0,001) (табл. 7). В то же время, существенных различий в содержании гранул серебра при концентрации серотонина 20 нг/мл и 200 нг/мл не выявлено (р<0,1) (табл. 7).
Таблица 7
Содержание гранул серебра в ядрах эпителиальных клеток простаты при действии разных концентраций серотонина
| Контроль | Концентрация серотонина (нг/мл) | ||||||||
| 2 | 20 | 200 | |||||||
| М1±m1 (n=100) | M2±m2 (n=100) | M2>M1 (в %) | P | М3±m3 (n=100) | M3>M1 (в %) | P | М4±m4 (n=100) | M4>M1 (в %) | P |
| 3,15±0,08 | 3,2±0,11 | 4 | <0,5 | 3,76±0,12 | 18 | <0,001 | 3,89±0,10 | 24 | <0,001 |
При концентрациях серотонина 20 нг/мл и 200 нг/мл отмечалась заметная морфологическая гетерогенность популяции эпителиальных клеток простаты. Среди эпителиальных клеток простаты обычных размеров и строения наблюдалось большое число крупных клеток с нежной структурой хроматина ядер. В таких клетках отмечалось более высокое содержание гранул серебра, чем в эпителиальных клетках простаты. В отдельных клетках число гранул серебра достигало 5-7 и более.
Действие мелатонина. Мелатонин подавлял экспрессию аргирофильных белков в эпителиальных клетках простаты. При этом действие препарата не зависело от его концентрации. Так, в эпителиальных клетках простаты количество гранул серебра при концентрации мелатонина 2 нг/мл составляло в среднем на ядро 2,42+0,09, что было достоверно ниже контрольных значений на 30% (р<0,001) (табл. 8).
- Таблица 8
Содержание гранул серебра в ядрах эпителиальных клеток простаты при действии разных концентраций мелатонина
| Контроль | Концентрация мелатонина (нг/мл) | ||||||||
| 2 | 20 | 200 | |||||||
| М1±m1 (n=100) | M2±m2 (n=100) | M2>M1 (%) | P | М3±m3 (n=100) | M3>M1 (%) | P | М4±m4 (n=100) | M4>M1 (%) | P |
| 3,15±0,08 | 2,42±0,09 | 30 | <0,001 | 2,52±0,09 | 25 | <0,01 | 2,47±0,13 | 27 | <0,001 |
Практически сходные изменения в содержании гранул серебра в эпителиальных клетках простаты были зарегистрированы при концентрациях мелатонина 20 нг/мл и 200 нг/мл. При концентрации мелатонина 20 нг/мл количество гранул серебра составляло в среднем 2,52+0,09 на ядро; при концентрации 200 нг/мл - 2,47+0,13. Эти показатели были достоверно ниже, чем в контроле, соответственно на 25% и 27% (р<0,001). Регистрируемые различия в содержании гранул серебра в эпителиальных клетках простаты в зависимости от концентрации мелатонина недостоверны (р<0,5) (табл. 8).
Цитоплазматические белки
Для изучения влияния серотонина и мелатонина на экспрессию сигнальных факторов дифференцировки эпителиоцитов желудка (протеина CDX1) и простаты (протеина RUNX3) при старении культур показало, что исследуемые гормоны обладают способностью активно усиливать экспрессию вышеуказанных маркеров, синтез которых достоверно снижается в стареющих культурах клеток (табл. 9).
Показатели экспрессии указанных факторов в старых культурах клеток (прошедших 7 пассажей) под действием гормонов значительно превышали соответствующие контрольные показатели как для старых, так и для молодых культур. При этом наибольшей активностью среди изученных гормонов обладает мелатонин (табл. 10).
Таблица 9
Морфометрические показатели экспрессии факторов дифференцировки эпителиоцитов желудка при действии пептидов в стареющих культурах клеток
| Количество пассажей ТЭК (монокультура) | CDX1 (площадь экспрессии) | RUNX3 (площадь экспрессии) | ||||
| КТР | СЕР | МЕЛ | КТР | СЕР | МЕЛ | |
| 1 пассаж (молодые культуры) | 2,31±0,08 | 2,46±0,06 | 2,71±0,05* | 1,75±0,06 | 1,95±0,20 | 2,63±0,09* |
| 4 пассажа (зрелые культуры) | 1,18±0,04 | 5,59±1,05* | 9,21±1,72* | 0,76±0,03 | 3,18±0,32* | 5,73±0,16* |
| 7 пассажей (старые культуры) | 0,72±0,01 | 2,71±0,09* | 2,78±0,20* | 0,33±0,01 | 4,56±0,31* | 5,28±0,21* |
КТР - контроль, СЕР- серотонин, МЕЛ-мелатонин
*- p<0,05 по сравнению с аналогичным показателем в контрольной культуре клеток.
Параллельно с усилением экспрессии сигнальных факторов дифференцировки, серотонин и мелатонин усиливают пролиферативную активность эпителиоцитов желудка и предстательной железы в монокультурах при их старении. Об этом свидетельствуют показатели количества эпителиальных клеток желудка и простаты в старых культурах (прошедших 7 пассажей), которые превышают контрольные показатели во всех исследуемых группах. Наибольшей активностью в этом отношении также обладает мелатонин (табл. 11).
Таблица 10
Количество эпителиоцитов желудка в культурах клеток
при действии гормонов
| Количество пассажей | Контроль | Серотонин | Мелатонин |
| 1 пассаж (молодые культуры) | 23263±1275 | 27501±1321* | 29065±1427* |
| 4 пассажа (зрелые культуры | 18673±1175 | 28467±1228* | 31988±1527* |
| 7 пассажей (старые культуры | 14248±924 | 23985±1254* | 30325±1471* |
*- p<0,05 по сравнению с аналогичным показателем в контрольной культуре клеток.
Таблица 11
Количество эпителиоцитов предстательной железы
в культурах клеток при действии гормонов
| Количество пассажей | Контроль | Серотонин | Мелатонин |
| 1 пассаж (молодые культуры) | 19471±934 | 24538±1006* | 27683±1182* |
| 4 пассажа (зрелые культуры | 16325±875 | 22349±873* | 29037±1056* |
| 7 пассажей (старые культуры | 10567±566 | 18793±822* | 29659±1173* |
*- p<0,05 по сравнению с аналогичным показателем в контрольной культуре клеток.
Заключение
Одной из основополагающих в современной биологии и медицине является концепция о существовании в организме диффузной эндокринной системы клеток, которые продуцируют биогенные амины и пептидные гормоны (APUD-система). При этом на современном уровне развития биологических и медицинских знаний термин APUD-система следует рассматривать как синоним термина «диффузная эндокринная система».
Методологией диссертационного исследования стал системный подход. Избрана совокупность клинических, биохимических, морфологических, иммунологических, инструментальных и математико-статистических методов, позволяющая оценить нейроиммуноэндокринный статус пациентов пожилого возраста с патологией желудочно-кишечного тракта и мочеполовой системы в период старения.
Иммуногистохимические и электронно-микроскопические исследования позволили обнаружить присутствие высокоактивных регуляторных веществ как в эндокринных клетках (апудоцитах) различных органов пищеварительного тракта, так и в структурных элементах предстательной железы.
Оксидативный стресс является важным патогенетическим фактором развития и прогрессирования патологии различных органов и систем в пожилом возрасте. В этой связи в нашем исследовании направлением научного поиска стало установление характера взаимоотношений между про- и антиоксидантными системами у пожилых больных в сравнении с пациентами молодого и среднего возраста, характера активации этих компонентов оксидативного гомеостаза в зависимости от нейроиммуноэндокринной регуляции.
Изучение выраженности оксидативного стресса проведено с учетом концентрации промежуточных продуктов перекисного окисления, в частности, малонового диальдегида, поскольку эти соединения отражают долговременные процессы протекания оксидативных процессов, что предоставит более объективные данные об их характере. Степень антиоксидантной защиты изучена при помощи биохимических реакций с тиобарбитуровой кислотой.
Выявлено, что уровень TNF- в сыворотке крови при обострении язвенной болезни в пожилом возрасте достоверно повышается как у пациентов с НР-ассоциированной язвенной болезнью, так и при язвенной болезни без НР-инфекции. Причем повышение этого провоспалительного цитокина более значимо при НР-инфекции. Нормализация показателя при отсутствии обсемененности НР происходит уже к стадии клинико-эндокопической ремиссии, а при наличии НР-инфекции – только к периоду истинной ремиссии. Уровень других провоспалительных цитокинов в сыворотке крови, в частности, IL-1, IL-6, также повышен. Вместе с тем, уровни молекул адгезии sICAM-1 и sVCAM-1 при язвенной болезни вне зависимости от ее стадии и наличия/отсутствия НР-инфекции меняются незначительно и достоверно не отличаются от таковых у здоровых пациентов.
Выявлено, что при язвенной болезни у пожилых пациентов (как с НР-инфекцией, так и без нее) имеются признаки депрессии иммунитета. Наблюдается снижение количества Ig G с достоверным снижением уровня специфических антигеликобактерных антител класса G у пациентов с НР-инфекцией. У этих же пациентов при наличии НР-инфекции наблюдается нарушение баланса противомикробных субклассов IgG1/IgG2. Депрессия специфического противоинфекционного IgG-зависимого иммунитета сопутствует язвенной болезни и создает предпосылки для выживания и персистенции HР с одновременным снижением возможностей контроля со стороны иммунной системы.
Восстановление уровня большинства сигнальных молекул нейроиммуноэдокринной системы происходит только к периоду истинной ремиссии, но не на стадии клинико-эндоскопической ремиссии. Это свидетельствует о напряженности нейроиммуноэндокринных взаимодействий как на стадии обострения, так и на стадии клинико-эндоскопической ремиссии, а также о провоспалительном нейрогормональном профиле у лиц пожилого возраста.
Оксидативный гомеостаз у здоровых лиц пожилого возраста характеризуется большей выраженностью прооксидантных процессов и ослаблением антиоксидантной защиты по сравнению с испытуемыми среднего возраста. Еще в большей степени происходит усиление про- и ослабление антиоксидантных систем при наличии клинически значимого заболевания.
На модели ускоренного старения показано достоверное снижение экспрессии хромогранина А и соматостатина в НЭ клетках предстательной железы.
В раковых опухолях предстательной железы содержатся опухолевые НЭ клетки, ответственные за синтез хромогранина А и соматостатина. В регуляции роста опухолей простаты активно участвуют хромогранин А, соматостатин и, по-видимому, другие гормоны, продуцируемые НЭ клетками через паракринные и аутокринные секреторные механизмы. При этом как при ДГПЖ, так и при аденокарциноме отмечается снижение продукции хромогранина А и соматостатина.
ВЫВОДЫ
1. Пожилой возраст характеризуется морфологическими изменениями клеток диффузной нейроиммуноэндокринной системы - гетерохромностью ядер; уменьшением количества рибосом; увеличением количества лизосом; нарушением структуры цитоплазматических филаментов; изменением строения митохондрий, набуханием и разрушением отдельных органелл, что в совокупности приводит к снижению белково-синтетической и энергетической функций клеток.
2. Основными тенденциями ускоренного старения диффузной нейроиммуноэндокринной системы являются дистрофические изменения клеток с истощением их гормональной функции с прогрессированием продукции провоспалительных цитокинов.
3. Оксидативные реакции у здоровых лиц пожилого возраста характеризуются большей выраженностью прооксидантных процессов и ослаблением антиоксидантной защиты по сравнению со здоровыми лицами среднего возраста. особенно при наличии клинически значимого заболевания.
4. Установлено, что при ремиссии язвенной болезни двенадцатиперстной кишки наблюдается снижение синтеза провоспалительных цитокинов и фактора некроза опухолей.
5. Уровень TNF- в сыворотке крови при обострении язвенной болезни в пожилом возрасте достоверно повышается как у пациентов с НР-ассоциированной язвенной болезнью, так и при язвенной болезни без НР-инфекции. Причем повышение этого провоспалительного цитокина более значимо при НР-инфекции. Нормализация показателя при отсутствии обсемененности НР происходит уже к стадии клинико-эндокопической ремиссии, а при наличии НР-инфекции – только к периоду истинной ремиссии.
6. Уровень IL-1, IL-6 в сыворотке крови при обострении язвенной болезни достоверно повышается как у пациентов с НР-ассоциированной язвенной болезнью, так и при язвенной болезни без НР-инфекции. Нормализация содержания IL-1 в сыворотке крови при отсутствии обсемененности НР происходит уже к стадии клинико-эндокопической ремиссии, а при наличии НР-инфекции – только к периоду истинной ремиссии. Уровень IL-6 нормализуется к стадии клинико-эндоскопической ремиссии.
7. При доброкачественной гиперплазии предстательной железы у лиц пожилого возраста отмечаются провоспалительные нейроиммуноэндокринные изменения, которые характеризуются увеличением концентрации провоспалительных интерлейкинов, TNF- при отсутствии динамики содержания молекул адгезии.
8. Доброкачественная гиперплазия и рак предстательной железы могут быть расценены как первичные апудопатии, а паранеопластические реакции простаты - как вторичная апудопатия, что сопровождается инверсией синтеза ряда сигнальных молекул, и в частности хромогранина А, соматостатина, гистамина, катехоламина и прочих, при этом в пожилом возрасте продукция этих сигнальных молекул имеет тенденцию к снижению.
9. Пептидные факторы, выделенные из различных тканей и созданные на их основе синтетические пептиды обладают выраженной тканеспецифичностью в отношении тканей органов как молодых, так и старых животных. Полученные в экспериментах данные о влияния эпиталона на культуры различных тканей, подтверждают его модулирующие функции.
10. Серотонин и мелатонин обладают цитогеропротекторными свойствами по отношению к эпителиальным клеткам желудка и предстательной железы. Установлено их участие в защите эпителиоцитов от апоптоза, обусловленное снижением экспрессии аргирофильных белков областей ядрышковых организаторов под их действием. Разработка конкретных рекомендаций по их применению требует продолжения детального изучения механизма действия различных доз данного гормона.
11. Серотонин и мелатонин обладают способностью активно усиливать экспрессию сигнальных факторов дифференцировки эпителиоцитов желудка (протеина CDX1) и простаты (протеина RUNX3), синтез которых достоверно снижается в стареющих культурах. Параллельно с усилением экспрессии сигнальных факторов дифференцировки эпителиоцитов желудка и предстательной железы в монокультурах при их старении, серотонин и мелатонин значительно усиливают пролиферативную активность эпителиоцитов в монокультуре и поднимают ее практически до уровня, свойственного молодым культивируемым клеткам.
12. Проведенные исследования позволяют считать, что нейроэндокринные клетки, локализуясь в составе висцеральных органов в качестве основных компонентов диффузной нейроиммуноэндокринной системы, продуцируя жизненно важные сигнальные молекулы, играют ключевую роль в поддержании гомеостаза, а возрастные нарушения экспрессии гормонов являются важными звеньями патогенеза возраст-ассоциированной патологии.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Динамика уровня TNF-, IL-1, IL-6 может служить критерием успешности терапии язвенной болезни у лиц пожилого возраста и прогноза ее эффективности.
2. Увеличение концентрации провоспалительных интерлейкинов и TNF- может служить показателем тяжести ДГПЖ в пожилом возрасте.
3. Изучение показателей оксидативного равновесия у пожилых пациентов
с ДГПЖ может служить для оценки тяжести патологического процесса
в геронтологической практике.
4. Определение количества иммунопозитивных нейроэндокринных клеток в слизистой оболочке двенадцатиперстной кишки может использоваться для оценки тяжести и стадии язвенной болезни у пациентов пожилого возраста.
5. Инверсия синтеза хромогранина А и соматостатина при ДГПЖ и раке предстательной железы может служить признаком неблагоприятного течения возраст-ассоциированной патологии предстательной железы.
6. Выявленные органо-геропротекторные свойства серотонина и мелатонина по отношению к желудку и предстательной железе свидетельствуют о целесообразности дальнейших исследований механизмов воздействия этих гормонов.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
Статьи в журналах, включенных в Перечень ВАК
Министерства образования и науки Российской Федерации:
- Возрастные особенности экспрессии сигнальных факторов дифференцировки эпителиальных клеток тимуса человека/В.О. Полякова, И.М. Кветной, С.С. Коновалов, П.Н. Зезюлин, И.В Князькин//Бюлл. экспер. биол. медицины – 2007 – Т. 144. - № 8. – С. 202-205.
- Изменения эндотелия при сердечно-сосудистой патологии у пожилых.
1. Сигнальные молекулы и функции эндотелия/ К.И. Прощаев, А.Н. Ильницкий, И.М. Кветной, И.В. Князькин, П.Н. Зезюлин, С.С. Коновалов, С.В. Филиппов// Клиническая медицина. – 2007. - Т. 85, № 11. - С. 9-13. - Изменения эндотелия при сердечно-сосудистой патологии у пожилых.
2. Сигнальные молекулы и патогенез атеросклероза/ К.И. Прощаев, А.Н. Ильницкий, И.М. Кветной, И.В. Князькин, П.Н. Зезюлин, С.С. Коновалов, С.В. Филиппов //Клиническая медицина. – 2007. - Т. 85, № 12. - С. 4-7. - Зезюлин П.Н. Интерлейкины при язвенной болезни в сочетании с неалкогольным с театогепатитом в пожилом возрасте/П.Н. Зезюлин//Успехи геронтологии. – 2009. – Т. 22, № 3. – С. 435-438.
- Медико-социальные проблемы геронтологии и гериатрии: осведомленность населения и медицинских работников/ К.И. Прощаев, А.Н. Ильницкий, П.Н. Зезюлин, С.В. Филиппов, А.А. Лукьянов, Н.И. Жернакова// Успехи геронтологии. – 2008. – Т.21, № 1. – С. 160-164.
- Развитие органотипической культуры селезенки крыс под действием аминокислот и антител к рецепторам фактора роста нервов/ Н.И. Чалисова,
А.Н. Закуцкий, А.И. Анискина, С.В. Филиппов, П.Н Зезюлин//Морфология. – 2007. – Т.131, № 2. – С.71-74. - Тканеспецифический эффект синтетических пептидов – биорегуляторов на органотипическую культуру молодых и старых крыс/А.Н. Закуцкий, Н.И. Чалисова, Г.А. Рыжак, А.И. Анискина, С.В. Филиппов, П.Н. Зезюлин // Успехи геронтологии. – 2006. - Т.19, № 1. – С. 93-96.
- Эффект аминокислот и антител к рецепторам факторой роста нервов на развитие органотипической культуры лимфоидной ткани/ Н.И. Чалисова, А.Н. Закуцкий, А.И. Анискина, С.В. Филиппов, П.Н Зезюлин// Бюлл. экспер. биол. мед. – 2007. – Т. 143, № 2. – С. 255-258.
- Эффект аминокислот на клеточную пролиферацию и апоптоз в органотипической культуре молодых и старых крыс / А.И. Анискина, Н.И. Чалисова, А.Н. Закуцкий, А.В. Комашня, С.В. Филиппов, П.Н. Зезюлин// Успехи геронтологии. – 2006. – Т.19, № 1. – С.55-59.
- Эффект аргинина и его метаболитов на миокард крыс в органотипической культуре ткани/Н.И. Чалисова, А.Н. Закуцкий, А.И. Анискина А.И., С.В. Филиппов, П.Н., П.Н. Зезюлин, А.Д. Ноздрачев//Докл. РАН. Биол. науки. – 2007. – Т. 415. – С. 257-260.
Монографии
- Нейроиммуноэндокринология мужской половой системы, плаценты и эндометрия/ И.В. Князькин, И.М. Кветной, П.Н. Зезюлин, С.В. Филиппов – СПб.: Деан, 2007. - 191 с.
Главы в учебниках и руководствах
- Нейроиммуноэндокринология предстательной железы и яичек/ М.А.Пальцев, И.М. Кветной, И.В. Князькин, В.Х. Хейфец, А.Т. Супиев, П.Н. Зезюлин,
С.В. Филиппов//В кн. Руководство по нейроиммуноэндокринологии. –
М.: Медицина, 2006. – С. 286-299. - Нейроиммуноэндокринология почек/М.А. Пальцев, И.М. Кветной, В.Х. Хейфец, В.О. Полякова, П.Н. Зезюлин, С.В. Филиппов // В кн. Руководство по нейроиммуноэндокринологии. – М.: Медицина, 2006. – С. 367-373.
- Нейроиммуноэндокринология предстательной железы и яичек/М.А. Пальцев, И.М. Кветной, В.Х. Хейфец, В.О. Полякова, П.Н. Зезюлин, С.В. Филиппов //
В кн. Руководство по нейроиммуноэндокринологии. – 2 изд. – М.: Медицина, 2008. – С. 346-359. - Нейроиммуноэндокринология почек/ М.А. Пальцев, И.М. Кветной, В.Х. Хейфец, И.В. Князькин, В.О. Полякова, П.Н. Зезюлин, С.В. Филиппов // В кн. Руководство по нейроиммуноэндокринологии. – 2 изд. – М.: Медицина, 2008. – С. 483-489.
- Предстательная железа и старение: роль локальной нейроэндокринной регуляции/ В.Х. Хавинсон, С.С. Коновалов, А.Т. Супиев, С.В. Филиппов, И.В. Князькин, П.Н.. Зезюлин//В кн.: Избранные лекции по геронтологии. – СПб.: Прайм-Еврознак, 2009. – С. 267-289.
Статьи в других изданиях
- Доброкачественная гиперплазия простаты - новые аспекты терапии/ А.А. Сморчков, И.В. Князькин, П.Н. Зезюлин, Г.И. Гурко // Эффективная фармакотерапия в урологии. - 2008. - № 2. - С. 30-32.
Тезисы
- Возрастная динамика экспрессии гормонов в тимусе человека /Е.В. Чернышова, В.О. Полякова, А.Ю. Чебракова, Е.С. Федорова, П.Н. Зезюлин// Матер. конф. «Перспективы фундаментальной геронтологии». – Санкт-Петербург, 2006. – С. 157-158.
- Возрастная динамика экспрессии NO-синтазы и CD35 в тучных и дендритных клетках тимуса человека/ В.О. Полякова, Е.С. Федорова, Е.В. Чернышова, А.Ю. Чебракова, И.В. Князькин, П.Н Зезюлин// Матер. II научно-практической конференции с международным участием, посвященная памяти Э.С. Пушковой. – Санкт-Петербург, 2006. – С. 180-181.
- Возрастные изменения экспрессии вазоактивных гормонов и факторов апоптоза в тимусе человека/В.О. Полякова, Е.В. Чернышова, А.Ю. Чебракова, П.Н. Зезюлин, Е.С. Федорова// Медицинская иммунология. – Т. 8, № 2-3. – 2006. –
С. 380-381. - Геропротекторное действие мелатонина на клетки тимуса/ В.О. Полякова, И.В. Князькин, П.Н. Зезюлин, Ю.А Тафеев//Тез докл. III Всероссийской научно- практической конференции «Общество, государство и медицина для пожилых». – Москва, 2006. - С. 75-76.
- Ильницкий А.Н. Динамика медико-социальных показателей течения язвенной болезни двенадцатиперстной кишки с дебютом в пожилом возрасте под влиянием одно- и трехэтапных немедикаментозных мероприятий/ А.Н. Ильницкий, Н.И. Жернакова, П.Н. Зезюлин// Взаимодействие медицинской науки и практики: Матер. очно-заочной конф. – Белгород – Смоленск – Новополоцк, 2007. – С. 15.
- Компьютерный анализ микроскопических изображений и его значение в объективизации геронтологических исследований/А.В., Трофимов Ю.А. Тафеев, П.Н. Зезюлин, С.В. Филиппов//Тез. докл. Всерос. конфер. «Перспективы фундаментальной геронтологии». - Санкт-Петербург, 2006. - С. 136-137.
- Мелатонин в иммунокомпетентных клетках: синтез, депонирование, биологическая роль/И.М. Кветной, Т.В. Кветная, В.О. Полякова, А.В., Трофимов И.В. Князькин, П.Н. Зезюлин, С.В. Филиппов//Матер. XIII Российского национального конгресса «Человек и лекарство». – Москва, 2006. – С.161.
- Мелатонин в решении вопросов кардиопрофилактики у пожилых больных/А.Н. Ильницкий, К.И. Прощаев, П.Н. Зезюлин, С.В. Филиппов, И.В. Князькин,
С.С. Коновалов//Сердечно-сосудистые заболевания: Бюлл. НЦССХ им. А.Н. Бакулева. – 2007. – Т. 8, № 6, прил. (Тез. XIII съезда сердечно-сосудистых хирургов). – С. 287. - Мелатонин: структурно-функциональное единство пинеальной железы и тимуса в нейроиммуноэндокринной регуляции гомеостаза/ И.М. Кветной, В.О. Полякова, С.С. Коновалов, И.Н. Костючек., П.Н. Зезюлин, Е.С. Сопова//
XV Российский национальный конгресс «Человек и лекарство». – Москва, 2008. – С. 633. - Нейроиммунноэндокринные механизмы старения /И.В. Князькин, Т.В. Кветная, П.Н. Зезюлин, С.В. Филиппов//Тез. VII Междун. симпозиума "Биологические механизмы старения". – Харьков, 2006. - С. 13.
- Особенности экспрессии гормонов в иммунокомпетентных клетках при старении in vitro / В.О. Полякова, С.С. Коновалов, И.В. Князькин, П.Н. Зезюлин, М.В. Терземан, Ю.А. Тафеев//Матер. конф. «Перспективы фундаментальной геронтологии». – Санкт-Петербург, 2006. – С. 104-105.
- Перспективы использования экзогенного мелатонина в лечении и реабилитации пациентов с сердечной недостаточностью/ А.Н. Ильницкий, К.И. Прощаев, П.Н. Зезюлин, С.В. Филиппов, С.С. Коновалов, И.В. Князькин//Сердечно-сосудистые заболевания: Бюлл. НЦССХ им. А.Н. Бакулева. – 2007. – Т. 8, № 6, прил. (Тез. XIII съезда сердечно-сосудистых хирургов). – С. 287.
- Полякова В.О. Гормоны в иммунокомпетентных клетках: иммуноцитохимическая локализация/ В.О. Полякова, Е.С. Федорова, П.Н. Зезюлин//9-я Всероссийская медико-биологическая конференция молодых исследователей «Человек и его здоровье».- Санкт-Петербург, 2006. - С. 266.
- Полякова В.О. Пептидергическая профилактика старения тимуса/ В.О. Полякова, А. В. Трофимов, П.Н. Зезюлин//В сб. научных трудов «Актуальные вопросы внутренних болезней» – Санкт-Петербург, 2006. – С. 50-51.
- Стимулирующее влияние биорегуляторных пептидов на различные ткани при культивировании/Н.И. Чалисова, А.Н. Закуцкий, А.И. Анискина, С.В. Филиппов, П.Н. Зезюлин // Тез. докл. Всерос. конфер. «Перспективы фундаментальной геронтологии». - Санкт-Петербург, 2006. - С. 153-154.
- Чебракова А.Ю. Возрастные изменения экспрессии P53 и MCL-1 в структурах нелимфоидного компонента тимуса человека/А.Ю. Чебракова, П.Н. Зезюлин//
9-я Всероссийская медико-биологическая конференция молодых исследователей. - Санкт-Петербург, 2006. - С. 378-379. - Экстрапинеальный мелатонин: место и роль в нейроиммуноэндокринной регуляции гомеостаза/ И.М. Кветной, С.С. Коновалов, В.О. Полякова, Т.В. Кветная, И.В. Князькин, А.В. Трофимов, П.Н. Зезюлин, С.В. Филиппов, В.А. Сливкин, И.Н. Костючек, М.А. Клещев, Е.С. Сопова, Ю.А. Тафеев // Тез. докл. Всероссийской научно-практич. конф. «50 лет мелатонину: итоги и перспективы исследований». - Санкт-Петербург, 2008. - С. 22-23.
- The amino acids effect on the apoptosis in the lymphoid tissue culture/ N. Chalisova, G. Haase, A. Zakutskii, A. Anisimova, S. Filippov, P. Zezulin //1st Workshop on “The Immune Response Against Dying Tumor Cells”. - Villejuif, France, 2006. - P. 38-39.
- Age-related expression of serotonin and endothelin-1 in human thymus E.V. / Chernishova, I.V. Knyazkin, P.N. Zezulin // Adv. in Gerontology. - Saint-Petersburg, Russia, 2007. - Vol. 20, № 3. - P.27.

