Морфологические и молекулярно-биологические особенности патологии легких, развившейся в условиях повышенной радиации /
На правах рукописи
Сагиндикова
Гульмира Елеусиновна
МОРФОЛОГИЧЕСКИЕ И МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ
ПАТОЛОГИИ ЛЕГКИХ,
РАЗВИВШЕЙСЯ В УСЛОВИЯХ ПОВЫШЕННОЙ РАДИАЦИИ
/14.00.15. – «Патологическая анатомия»/
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Москва – 2007
Работа выполнена в ГОУ ВПО Московская Медицинская Академия имени И.М. Сеченова Росздрава
Научный консультант: доктор медицинских наук, профессор Евгения Алтаровна Коган
Официальные оппоненты:
Член-корреспондент РАМН
доктор медицинских наук, профессор,
директор ГУ НИИ
морфологии человека РАМН Лев Владимирович Кактурский
доктор медицинских наук, профессор,
руководитель лаборатории
экспериментальной патоморфологии
ММА им. И.М.Сеченова Анатолий Борисович Шехтер
доктор медицинских наук, профессор,
заведующий кафедрой
патологической анатомии РГМУ Олег Вадимович Зайратьянц
Ведущая организация:
Научный Исследовательский Институт Пульмонологии МЗ РФ
Защита диссертации состоится «___»___________ 2007 г. в ____ часов на заседании диссертационного совета Д.208.040.01 при ГОУ ВПО Московская Медицинская Академия имени И.М. Сеченова Росздрава (119991 Москва, Трубецкая ул., д. 8, стр. 2).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Московская Медицинская Академия имени И.М. Сеченова Росздрава (117998, Москва, Нахимовский пр., д. 49).
Автореферат диссертации разослан «____» _____________________2007 г.
Ученый секретарь диссертационного совета,
доктор медицинских наук,
профессор Владимир Анатольевич Варшавский
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы.
Широкое распространение ядерных технологий ведет за собой и повышение риска загрязнения окружающей среды, а также неизбежное расширение круга лиц, подвергавшихся воздействию радиационных факторов [Ференц В.Б., 1992, Цыб А.Ф., 1990, Чайжунусова Н.Ж., 1993, Василенко И.Я., 1991].
Изучение отдаленных последствий воздействия малых доз ионизирующего излучения на здоровье человека представляет собой наиболее быстро развивающийся раздел радиобиологии и радиационной медицины [Москалев Ю.И., 1999, Черникова СБ., 1993]. Исследования в данном направлении особенно актуальны для Республики Казахстан, так как в связи с многолетним функционированием Семипалатинского и других испытательных ядерных полигонов, значительная часть ее территории контаминирована радиоактивными изотопами, а проживающее население в прошлом подвергалось воздействию внешнего и внутреннего облучения в дозах, значительно превышающих естественный фон радиоактивности [Бозтаев К.Б., 1992; Ибраев С.С., 1992; Гусев Б.И., 1993, Атчабаров Б.А., 1999, Bersimbaev R.I., 2000, Rosenson R., 1996].
Проведенные исследования показывают, что, несмотря на прекращение в 1989 году ядерных испытаний, радиоактивное облучение населения региона продолжается до настоящего времени, и, по-видимому, связано с наличием радиоактивных веществ в воде и продуктах питания [Чайжунусова Н.Ж., 1993]. Кроме того, в современном обществе интенсивно используются в мирных целях радиоактивные изотопы в промышленности, энергетике и в медицинской практике [Голутвина М.М., 1989, Журавлев В.Ф., 1989; Пинаев А.К., 1991, Cragle D.L., 1988,Сиваченко Т.С., 1991; Peters A.M., 1991].
Проблема патологии легких, развившейся в условиях повышенной радиации в настоящее время интенсивно изучается. Однако, остаются пока спорными и недостаточно изученными многие вопросы, касающиеся роста заболеваемости и смертности отдельными заболеваниями легких в Семипалатинском регионе Казахстана с повышенным радиоактивным фоном, а также характеристика их морфологических и патогенетических особенностей (хронической обструктивной болезни легких (ХОБЛ), бронхоэктатической болезни (БЭБ), фиброзирующего альвеолита (ФА) и радиационного фиброза легких, туберкулеза, предраковых и дисрегенераторных процессов в эпителии и рака легкого (РЛ)).
Изучению молекулярных механизмов патогенеза перечисленных заболеваний, возникших на радиоактивно-загрязненных территориях, посвящены единичные исследования [Коган Е.А., 1999, Yamamoto T., 1986], в которых отмечается роль «радиационного» фиброза и дисрегенераторных изменений эпителия. Особая роль в развитии данных процессов отводится матриксным металлопротеиназам (MMPs), их активаторам и тканевым ингибиторам (TIMP) [Zhou Y., 2005]. Роль системы ММР в развития предрака и РЛ практически не изучена, поскольку в большинстве работ исследовался РЛ [Coussens L.M., 2002, Gonzales-Avila G., 1998, Kawano N., 1997, Zhou Y., 2005]. В то же время известно, что в легком эти процессы нередко развиваются на фоне фиброза, в том числе радиационного, на чем основана концепция «рака легкого в рубце».
Целью настоящей работы явилось изучение эпидемиологических, морфологических и молекулярно-биологических особенностей патологии легких, развившейся у населения Семипалатинского региона Казахстана, длительное время проживавших на радиоактивно-загрязненных территориях.
Для реализации цели были поставлены следующие задачи:
1) изучить нозологический спектр легочной патологии, развившейся у лиц в условиях повышенной радиации Семипалатинского региона;
2)охарактеризовать особенности морфологических проявлений легочной патологии, развившейся у лиц в условиях повышенной радиации Семипалатинского региона;
3) изучить роль MMPs и их ингибиторов в пато- и морфогенезе хронических диффузных заболеваний легких (ХДЗЛ), туберкулеза, предрака и РЛ, развившихся у лиц в условиях повышенной радиации Семипалатинского региона;
4) изучить процессы ангиогенеза и фиброза при ХДЗЛ, туберкулезе, предраке и РЛ, развившихся у лиц в условиях повышенной радиации Семипалатинского региона;
5) изучить дисрегенераторные процессы в эпителии при ХДЗЛ, туберкулезе, предраке и РЛ, развившихся у лиц в условиях повышенной радиации Семипалатинского региона.
Научная новизна
Новизна диссертационной работы связана с тем, что охарактеризованы эпидемиологические, морфологические и морфогенетические особенности легочной патологии, развившейся у лиц, длительное время проживавших в условиях повышенной радиации Семипалатинского региона.
Автором установлены тенденции к снижению показателей заболеваемости ХДЗЛ в период 1992-2003 г.г. после прекращения ядерных испытаний, что может подтверждать значение радиации как этиопатогенетического фактора. При этом структура заболеваемости и смертности от ХДЗЛ с преобладанием хронической обструктивной эмфиземы легких (ХОЭЛ) и фиброзирующего альвеолита у населения Семипалатинского региона подтверждает патогенетическую роль радиации в повреждении сосудов, интерстиция и эпителия легких.
Впервые обнаружены морфологические отличия ХДЗЛ у лиц, проживавших на радиоактивно-загрязненных территориях Семипалатинской области Казахстана по сравнению с контрольной группой, заключающиеся в более выраженном фиброзе, неоангиогенезе и дисрегенераторных изменениях эпителия, что сочеталось с высокой экспрессией MMP-1, -2, -9, TIMP-1, TGF, VEGF.
Впервые выявлены особенности дисрегенераторных изменений эпителия, которые чаще встречались при ХДЗЛ у лиц, проживавших на радиоактивно-загрязненных территориях Семипалатинской области Казахстана, и отличались более высокой экспрессией эпителием MMP-1, -2, -9, TIMP-1, TGF, VEGF, а также хромогранина по сравнению с контрольной группой.
Найдены особенности морфологических проявлений фиброзно-кавернозного туберкулеза (ФКТ) у лиц, длительное время проживавших на радиоактивно-загрязненных территориях Семипалатинской области, заключающимися в большей выраженности деструктивных и фибротических изменений, снижении частоты выявляемости гранулематозного воспаления и наличии слабой местной лимфоидной инфильтрации, что косвенно может свидетельствовать о низком уровне развития клеточного иммунитета на фоне воздействия ионизирующего излучения. Выраженность деструктивных процессов и фиброзирования при ФКТ зависит от активности MMPs, их ингибиторов, факторов ангиогенеза, множества факторов роста и других цитокинов, содержание которых значительно выше у больных ФКТ, проживавших в условиях повышенной радиации. Клетки гранулем и СD68+ макрофаги воспалительного инфильтрата являются основным тканевым источником ММР-1, -2, -9 и TIMP-1 в очагах ФКТ.
Научная новизна работы также связана с установлением молекулярно-биологических особенностей предрака и рака легкого, развившихся в условиях повышенной радиации. Предрак легкого, возникший в условиях повышенной радиации, отличается наличием высокого потенциала к инвазивному росту за счет дисбаланса между экспрессией металлопротеиназ и их ингибиторов, а также активацией механизмов антибластомной защиты; усиленным ангиогенезом в строме подлежащих тканей, что также создает благоприятные условия для инвазивного роста трансформированного эпителия; повышением уровня пролиферации эпителия за счет возможной активации факторов роста под действием ММРs и их усиленной продукции.
Рак легкого, возникший в условиях повышенной радиации развивается в более молодом возрасте по сравнению с контрольной группой и обладает высоким потенциалом к инвазивному росту за счет дисбаланса между экспрессией металлопротеиназ и их ингибиторов, подавления механизмов антибластомной защиты, усиления ангиогенеза в строме и в подлежащих тканях. Кроме того, предрак и РЛ, развившиеся в условиях повышенной радиации характеризуются частым развитием нейроэндокринной дифференцировки (НЭД) раковых клеток.
Практическая и теоретическая значимость работы
Полученные данные могут быть использованы в системе здравоохранения для проведения профилактики и дифференциальной диагностики ХДЗЛ, туберкулеза, а также предрака и РЛ, развившихся у лиц, длительное время проживавших на радиоактивно загрязненных территориях, прогнозировании течения патологического процесса и разработке новых методов таргетной терапии. Исследование вокруг Семипалатинского полигона может быть полигоном для других подобных территорий в России, странах СНГ и во всем мире.
Материалы диссертации используются в практической работе при анализе биопсийного и аутопсийного материала, а также в преподавании - при чтении лекций и проведении практических занятий со студентами по теме «Заболевания легких», «Патология, вызванная факторами окружающей среды», «Опухолевый рост» на кафедре патологической анатомии ММА имени И.М. Сеченова, на кафедре патологической анатомии Казахской Государственной медицинской Академии, Актюбинского медицинского университета в Казахстане, а также в работе биопсийной лаборатории.
Теоретическая значимость полученных данных связана с тем, что показана роль радиации в развитии не только предрака и рака легкого, но также ХДЗЛ и туберкулеза легких. Радиационное воздействие вносит вклад в патогенетические и морфологические особенности ХДЗЛ за счет фиброгенного, ангиогенного и канцерогенного воздействия на легочный эпителий, что сопровождается высокой экспрессией легочным эпителием и СD68+ макрофагами ММР-1, -2, -9 и TIMP-1. При этом легочная патология, развившаяся в условиях повышенной радиации отличается дисбалансом между ММРs и TIMPs, выраженным в разной степени при различных заболеваниях.
Основные положения, выносимые на защиту
- Радиационное воздействие может считаться одним из этиопатогенетических факторов хронической легочной патологии, что подтверждается, во-первых, высокими показателями заболеваемости и смертности хронической обструктивной болезнью легких, бронхоэктатической болезнью, фиброзирующим альвеолитом в Семипалатинском регионе, во-вторых, выявленной тенденцией к снижению показателей заболеваемости и смертности после прекращения ядерных испытаний на Семипалатинском полигоне, начиная с 1992 г.
- Радиационное воздействие вносит вклад в патогенетические и морфологические особенности ХДЗЛ за счет фиброгенного, ангиогенного и канцерогенного воздействия на легочный эпителий, что сопровождается высокой экспрессией легочным эпителием и СD68+ макрофагами ММР-1, -2, -9 и TIMP-1.
- Фиброзно-кавернозный туберкулез у лиц, длительное время проживавших на радиоактивно-загрязненных территориях Семипалатинской области отличался большей выраженностью деструктивных и фибротических изменений, снижением частоты выявляемости гранулематозного воспаления и наличием слабой местной лимфоидной инфильтрации, а также высокой экспрессией клетками специфических гранулем, СD68+ макрофагами, легочным эпителием ММРs и TIMP-1.
- Дисрегенераторные и предраковые изменения эпителия чаще встречались при хронической обструктивной болезни легких, бронхоэктатической болезни, фиброзирующем альвеолите у лиц, проживавших на радиоактивно-загрязненных территориях Семипалатинской области Казахстана, и отличались более высокой экспрессией эпителием ММР-1, -2, -9, TIMP-1, TGF, VEGF, а также хромогранина по сравнению с контрольной группой. Предрак легкого, возникший в условиях повышенной радиации, отличается рядом молекулярных особенностей: наличием высокого потенциала к инвазивному росту за счет дисбаланса между экспрессией металлопротеиназ и их ингибиторов, усиленным ангиогенезом в подлежащих тканях, повышением уровня пролиферации и нейроэндокринной дифференцировкой эпителия.
- Рак легкого, возникший в условиях повышенной радиации, характеризовался рядом особенностей по сравнению с контрольной группой: развитием рака легкого в более молодом возрасте; наличием высокого потенциала опухолевых клеток к инвазивному росту за счет дисбаланса между экспрессией металлопротеиназ и их ингибиторов, усилением ангиогенеза в строме подлежащих тканей, развитием нейроэндокринной дифференцировки в раковых клетках.
Апробация работы
Апробация работы проведена на кафедре патологической анатомии ММА им. И.М.Сеченова 25 апреля 2007 г. Результаты исследования докладывались и обсуждались на научных конференциях кафедры патологической анатомии ММА имени И.М. Сеченова, на обществе патологоанатомов г. Москвы (ноябрь 2006), на XIII, XIV и XVI Национальных конгрессах по болезням органов дыхания (Санкт-Петербург, 2003, Москва, 2004, Санкт-Петербург, 2006), на ХХ и ХХI Европейских Конгрессах по патологии (Париж, Франция, 2005, Стамбул, Турция, 2007), на XII, XIV, XV и XVII Конгрессах Европейского респираторного общества (Стокгольм, Швеция, 2002, 2007, Глазго, Шотландия, 2004 г., Копенгаген, Дания, 2005), на XII Интернациональном конгрессе гисто- и цитохимии (Сан-Диего, Калифорния, 2004), на XXIV Интернациональном конгрессе интернациональной Академии патологов (Амстердам, Нидерланды, 2002, на Всемирной конференции по раку (Дублин, Ирландия, 2004), на Интернациональном конгрессе патологов (Игуассу, Бразилия, 2004), на V Интернациональном симпозиуме по терапии рака (Амстердам, Нидерланды, 2007), на II и III конгрессах Евроазиатского Респираторного общества (Санкт-Петербург, 2006, Астана, Казахстан, 2007).
Публикации.
По результатам исследования опубликовано 31 работа, из них 2 монографии, 12 публикаций в центральной печати РФ по медицине, 17 публикаций в международных медицинских журналах.
Объем и структура диссертации
Диссертация состоит из введения, обзора литературы, описания материалов и методов исследования, главы о результатах собственного исследования и их обсуждения, общего заключения, выводов и списка использованной литературы. Текст диссертации изложен на 261 страницах машинописного текста, иллюстрирован 27 таблицами и 26 рисунками, включая монтажи из микрофотографий. Библиографический указатель включает 383 литературных источника, в том числе 228 отечественных.
СОДЕРЖАНИЕ РАБОТЫ.
Материал и методы исследования.
Ретроспективно проанализированы данные отчетов органов здравоохранения по распространенности, смертности и заболеваемости органов дыхания у жителей Семипалатинского региона за период 1969-2003 г.г. Также было проведено скрининг-анкетирование 7274 жителей Семипалатинского региона. Скрининг-анкета была составлена с учетом климато-экологических особенностей обследуемого региона и состоит из двух частей: паспортные и клинические данные. Изучен 631 протокол вскрытий патологоанатомического бюро г. Семипалатинска с 1969 по 2003 г.г. с диагнозами ХДЗЛ.
Кроме того, проведено морфологическое (гистологическое) исследование архивного аутопсийного, операционного (удаленные легкие и их части) и биопсийного материала от 300 больных с ХДЗЛ, с детских лет до 2003 г. проживавших вблизи полигона и в течение длительного времени подвергавшихся воздействию радиации. В качестве контрольной группы использовался операционный и аутопсийный материал от 56 больных ХДЗЛ, из которых 22 человека проживали на территориях Казахстана с неизмененным радиационным фоном, а 34 – в Москве.
В иммуногистохимической части работы использовался архивный операционный (удаленные легкие и их части) и биопсийный материал от больных с хроническими диффузными заболеваниями легких (231 пациент), фиброзно-кавернозным туберкулезом (75), предраковыми процессами в легких (118), раком легкого (87). В качестве основной группы использовался материал от пациентов с детских лет до 2003 г. проживавших вблизи полигона и в течение длительного времени подвергавшихся воздействию радиации (годовая доза облучения превысила 0,1 бэр) (I группа). В качестве контрольной группы (II группа) использовался материал от пациентов, которые проживали на территориях Казахстана с неизмененным радиационным фоном и оперированных в клиниках Московской медицинской академии имени И.М. Сеченова в 1993 – 2006 гг.
Таблица 1. МАТЕРИАЛ ИССЛЕДОВАНИЯ.
| ГРУППЫ | НОЗОЛОГИИ | М | Ж | ВСЕГО |
| I группа Семипалатинск | ХДЗЛ | 93 | 6 | 99 |
| Туберкулез легких | 47 | 7 | 54 | |
| Рак легких | 31 | 2 | 33 | |
| II группа Контроль | ХДЗЛ | 111 | 21 | 132 |
| Туберкулез легких | 16 | 5 | 21 | |
| Рак легких | 50 | 4 | 54 | |
| ВСЕГО | 348 | 45 | 393 |
Изучен операционный (удаленные легкие и их части) и биопсийный материал от 393 пациентов с хроническими заболеваниями легких и раком легкого, с детских лет до 2003 г. проживавших вблизи полигона (Табл. 1). У 118 пациентов данной группы были обнаружены предраковые изменения.
Использовались гистологические, гистохимические, иммуногистохимические методы. Проводилась статистическая обработка результатов исследования.
Гистологические и гистохимические методы исследования. Использованы залитые в парафин, предварительно фиксированные в 10% забуференном формалине кусочки опухолевой ткани. С каждого блока делались серийные срезы толщиной 3 мкм. Срезы окрашивали гематоксилином и эозином, альциановым синим, пикрофуксином по Ван Гизону, по Вейгерту на эластику, ставилась PAS-реакция и реакция Перлса на железо по общепринятым методикам. Диагноз заболеваний помимо автора, определялся 2 независимыми экспертами – патологоанатомами (Казахстана и ММА им. И.М.Сеченова).
Иммуногистохимические методы. Проводились на депарафинированных срезах толщиной 4-5 мкм. Демаскировка антигена осуществлялась путем инкубации срезов в течение 20 минут в микроволновой печи при мощности 600 Вт в растворе 10 mM цитратного буфера с pH 6.0. В качестве первичных антител использовались моно- и поликлональные антитела мыши и кролика к хромогранину А (DAKO), ММР-1; ММР-2; ММР-9, TIMP-1 (Lab Vision, США), TGF- (Biosource international, Калифорния, США), VEGF (DAKO), CD34 (DAKO), CD68 (DAKO), Ki-67 (DAKO). В качестве вторичных антител использовались биотинилированные антимышиные и антикроличьи иммуноглобулины (DAKO, LSAB+KIT, PEROXIDASE). В качестве фонового докрашивания использовался гематоксилин. Ставились контрольные реакции: позитивный контроль – тканевые срезы плаценты – NM-784A (Lab Vision), негативный контроль – без первичных антител.
Результаты иммуногистохимических реакций для MMPs, TIMP-1, TGF- и VEGF оценивались в баллах: (от 1 до 6) методом полуколичественного анализа с учетом количества окрашенных клеток (n): 20% – 2 балла; 20% < n 50 % – 4 балла; n > 50 % - 6 баллов. Уровень ангиогенеза рассчитывался по средней плотности новообразованных сосудов в 10 полях зрения при увеличении х 400 по общепринятой методике. В случае ядерной локализации продукта реакции (Ki-67, СД68, хромогранин) подсчитывался процент окрашенных ядер на 300 клеток одного типа из разных участков препарата.
Статистический анализ. Использовались методы непараметрической статистики - для сравнения выраженности активности изучаемых маркеров в основной и контрольной группах - U-тест Манна-Уитни; для сравнения частоты встречаемости маркеров – точный критерий Фишера (для четырехпольных таблиц сопряженности), Хи-квадрат Пирсона и Крамера (для многопольных таблиц). Статистический анализ был выполнен с использованием стандартного пакета статистических программ SPSS 13.0 for Windows [Бююль А., Цефель П., 2002], а также стандартного пакета программ «MS Excell» с использованием программы Statistica for Microsoft Windows, version 5.0., StatSoft Inc., США [Гланц С., 1999, Боровиков В.П., 1998]. Критический уровень значимости различий между группами был принят равным р=0,05. Во всех случаях использовались двусторонние статистические критерии.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ.
1. Заболеваемость и смертность населения при хронических диффузных заболеваниях легких.
По данным скрининг-анкетирования выявлено, что показатели заболеваемости ХОБЛ, БЭБ, ФА в Семипалатинском регионе значительно (в десятки раз) превышают среднестатистические данные по России (Рис. 1, 2).


Рис. 1. Заболеваемость ХДЗЛ на 100 тыс. Рис. 2. Заболеваемость ХДЗЛ на 100 тыс.
населения (Семипалатинский регион), 2003 г. населения (Россия)*
*Здоровье населения России и деятельность учреждений здравоохранения в 1999 г. // Статистические материалы / Министерство Здравоохранения Российской Федерации. – Москва, 2000 г.
Анализ отчетов показал, что в период с 1992 по 2003 г.г. прослеживается тенденция к снижению заболеваемости ХДЗЛ, что может быть связано с прекращением взрывов с
1989 г. (Рис. 3).
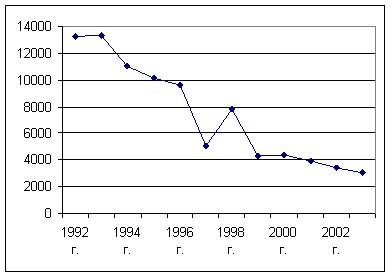
Рис. 3. Заболеваемость ХДЗЛ с 1992 по 2003 гг. в Семипалатинском регионе.
Из анкетированных людей 5910 человек являлись практически здоровыми людьми, что составляет 81,25% опрошенных. Среди них 3520 человек имели факторы повышенного риска развития болезни, т.е. 59,56% анкетированных лиц были в стадии предболезненного состояния. ХДЗЛ наблюдались у 1364 человек, что составило 18,75% опрошенных. Таким образом, общее количество больных ХДЗЛ и лиц предболезненного состояния с повышенным риском составило 4884 человек или 78,31% анкетированных людей. Скрининг-анкетирование показало, что при анализе частоты ХДЗЛ среди городского и сельского населения удельный вес больных хроническими заболеваниями легких больше среди городских жителей - 24,58%, а сельских - 16,24%. Наиболее частыми ХДЗЛ среди опрошенных жителей Семипалатинского региона оказались: ХОБЛ - 86,0%, бронхиальная астма -10,56%, а также наблюдались БЭБ - 2,13% и врожденные пороки развития органов дыхания (чаще гипоплазия долей легкого) с признаками хронического воспаления -1,31%.
Анализ смертности и изучение протоколов вскрытий и гистологических препаратов показал, что удельный вес различных ХДЗЛ как причин смерти различен и не совпадает с показателями заболеваемости (Рис. 4). Смертность есть и в молодом возрасте, но пик ее наступает после 50 лет. Показатели смертности у мужчин выше показателей смертности у женщин. Выявлена тенденция к снижению показателей заболеваемости и смертности хроническими диффузными заболеваниями легких в Семипалатинском регионе после прекращения ядерных испытаний начиная с 1992г., что может подтверждать значение радиации как этиопатогенетического фактора в развитии легочной патологии (Рис.5).
 |  |
| Рис. 4. Смертность от заболеваний легких 1969-2003 г.г. (Семипалатинск). Условные обозначения: ХОЭЛ – хроническая обструктивная эмфизема ХА – хронический абсцесс | Рис. 5. Смертность от заболеваний легких 1969-2003 г.г. по данным 631 вскрытия (Семипалатинск). |
В целом, течение ХДЗЛ у населения Семипалатинского региона длительное время проживавших на радиоактивно-загрязненных территориях отличает: хронизация воспаления, повышенный фиброз, увеличение дисплазии.
Резюмируя результаты исследования заболеваемости и смертности ХДЗЛ населения Семипалатинского региона с повышенным радиационным фоном следует отметить следующее: показатели заболеваемости ХОБЛ, БЭБ, ФА в Семипалатинском регионе значительно превышают среднестатистические данные по России; выявлена тенденция к снижению показателей заболеваемости и смертности ХДЗЛ в Семипалатинском регионе после прекращения ядерных испытаний, начиная с 1992г., что может подтверждать значение радиации как этиопатогенетического фактора в развитии легочной патологии.
2. Морфологические и молекулярно-биологические особенности хронических диффузных заболеваний легких населения Семипалатинского региона Казахстана с повышенным уровнем радиации.
На I этапе исследования изучали морфологическую и иммуногистохимическую характеристику ХОБЛ, БЭБ, ФА у лиц, проживавших на радиоактивно-загрязненных территориях Семипалатинского региона и у лиц, проживавших на территориях Казахстана с неизмененным радиационным фоном и Москвы. Кроме того, в качестве контроля исследовалась легочная ткань без патологических изменений от пациентов, оперированных по поводу рака легкого.
Морфологическими особенностями основной группы пациентов можно считать более выраженные проявления неоангиогенеза, фиброза, накопление пылевых частиц, а также наличие разнообразных дисрегенераторных изменений эпителия, включая очаги нейроэндокринной гиперплазии (НЭГ).
ХОБЛ характеризовался развитием хронического катарального или гнойного бронхита с гиперплазией слизистых желез и бокаловидных клеток, выраженной лимфоплазмацитарной инфильтрацией с примесью палочкоядерных лейкоцитов (ПЯЛ), разрастанием грануляционной ткани с неоангиогенезом в собственной пластинке слизистой. Отмечались склероз и атрофия мышечного слоя в стенке бронха, явления хронической обструктивной центроацинарной эмфиземы легких. Основная группа пациентов отличалась от контрольной более выраженными явлениями неоангиогенеза, перибронхиального и интерстициального фиброза, отложениями пыли. Кроме того, было отмечено более частое обнаружение дисрегенераторных и предраковых изменений эпителия, включающих фокусы НЭГ. При окраске хромогранином НЭГ была выявлена в 5 случаях ХОБЛ I группы.
При БЭБ наблюдались цилиндрические и мешотчатые бронхоэктазы, часто напоминавшие крупные бронхогенные кисты, выраженный перибронхиальный и периваскулярный склероз с отложениями пыли. Микроскопически в полости бронхоэктаза обнаруживался экссудат и слущенный эпителий. В прилежащей легочной паренхиме - очаги обструктивной эмфиземы легких, выраженный перибронхиальный, периваскулярный и интерстициальный фиброз, неоангиогенез, отложения пыли. Однако в I группе пациентов преобладали перибронхиальный и периваскулярный фиброз с отложениями пыли, а также разнообразные дисрегенераторные, а в ряде случаев и предраковые изменения бронхиального эпителия, атрофические изменения желез с кистозной трансформацией бронхов. При окраске хромогранином – НЭГ в 2 случая БЭБ основной группы.
При ФА наблюдались экссудативно-продуктивное воспаление и интерстициальный фиброз на уровне респираторных отделов легких. В альвеолярных перегородках - явления отека, воспалительная инфильтрация, неоангиогенез и проявления склероза в разной степени выраженного, вплоть до формирования сотового легкого. В контрольной группе в просветах альвеол обнаруживались десквамированный эпителий, CD68+ альвеолярные макрофаги (МФ), лимфоидные элементы, а в очагах выраженного фиброзирования - миофибробластические фокусы, а также очаги аденоматозной гиперплазии эпителия, что позволило поставить диагноз обычной интерстициальной пневмонии. В основной группе пациентов выраженный интерстициальный фиброз сочетался со слабовыраженной лимфоплазмоцитарной инфильтрацией альвеолярных перегородок и отложениями пыли. В большинстве случаев легочный интерстиций был расширен, представлен фиброзной гиалинизированной тканью, содержащей сосуды со склерозированными стенками, очагами гемосидероза и антракоза, а также небольшими скоплениями лимфоцитов, плазматических клеток и МФ. При окраске по Ван Гизону обнаруживались грубые коллагеновые волокна красного цвета. Миофибробластические фокусы отсутствовали. К описанной картине можно добавить наличие многоядерных клеток как в эпителиальной выстилке альвеол и бронхиол, так и среди альвеолярных МФ. Нередко обнаруживались очаги с выраженными признаками атипической аденоматозной гиперплазии (ААГ). Описанные изменения не укладывались в картину известных идиопатических интерстициальных пневмоний. Анамнез заболевания, проживания на радиационно-загрязненных территориях, а также морфологические особенности в виде наличия многоядерных клеток позволили предположить диагноз радиационного фиброза легких.
На II этапе методом иммуногистохимии исследовались матриксные металлопротеиназы (ММРs) и их ингибиторы (TIMP-1), что позволило установить дисбаланс между ними в наибольшей степени выраженный в основной группе пациентов. Основным генератором ММРs и TIMP-1 при ХДЗЛ в обеих группах являлись CD68+ альвеолярные и интерстициальные МФ, а также ПЯЛ, эндотелий сосудов и, в меньшей степени, эпителий. ММРs во всех клетках в основной группе были значительно выше чем ММРs во всех клетках контрольной группы (р 0,001) (Рис. 6а,б). MMPs и TIMP-1 при иммуногистохимическом исследовании выявлялись в цитоплазме клеток.
ММР-1. При ХДЗЛ обнаружено отличие в экспрессии данного фермента как по уровню, так и по локализации в двух исследуемых группах. В тканях больных I группы отмечалось повышение уровня экспрессии ММР-1 в МФ и ПЯЛ, эпителии, а также в эндотелии сосудов и фибробластических элементах стромы по сравнению со II группой (р 0,05). Кроме того, в основной группе были найдены особенности экспрессии ММР-1 при различных вариантах ХДЗЛ. При ХОБЛ наибольшие значения экспрессии фермента обнаруживались в CD68+ МФ, ПЯЛ и бронхиальном эпителии (р 0,001); при БЭБ - в CD68+ МФ и ПЯЛ; при ФА – в CD68+ альвеолярных МФ (р 0,05) (см. рис. 6а,б).
ММР-2. В тканях больных ХДЗЛ основной группы отмечалось повышение уровня экспрессии ММР-2 по сравнению с контрольной группой практически во всех изученных клетках (р 0,05). Кроме того, в основной группе были найдены особенности экспрессии ММР-2 при различных вариантах ХДЗЛ. При ХОБЛ наибольшие значения экспрессии фермента обнаруживались в бронхиальном эпителии (р 0,01); при БЭБ - в CD68+ МФ и ПЯЛ; при ФА – в CD68+ альвеолярных МФ и эндотелии сосудов, в очагах неоангиогенеза (р 0,05) (см. рис. 6а,б).
 а. а. |
 б. б. |
  в. г. в. г. |
Рис. 6. Гистограмма экспрессия ММРs, TIMP-1, VEGF и TGF при ХДЗЛ.
*-эпителий бронхиальный
**-эпителий бронхиальный и альвеолярный
Условные обозначения: эпит. - эпителий; ФБ – фибробласты; сос. – сосуды; МФ - макрофаги инфильтрата.
ММР-9. В основной группе пациентов с ХДЗЛ все показатели экспрессии фермента были достоверно выше, чем в контрольной группе (р 0,001). При этом, в основной группе фермент экспрессировался во всех изученных клетках, в то время как в контрольной группе – только в CD68+ МФ и в эндотелии сосудов. При ХОБЛ и БЭБ I группы наибольшие и, практически, одинаковые уровни экспрессии фермента обнаружены в эпителии, МФ и ПЯЛ (р 0,05); при ФА основным источником являлись альвеолярные МФ и эндотелий сосудов (р 0,01) (см. рис. 6а,б).
TIMP-1. МФ и ПЯЛ являются основными продуцентами TIMP-1 при ХДЗЛ (р 0,01). В тканях больных I группы отмечалось повышение уровня экспрессии TIMP-1 в МФ, эпителии, эндотелии сосудов и в фибробластах стромы по сравнению со II группой (р 0,001). При ХОБЛ и БЭБ I группы наибольшие уровни экспрессии фермента обнаружены в бронхиальном эпителии, МФ и ПЯЛ (р 0,01); при ФА основным источником являются альвеолярные МФ и эндотелий сосудов (р 0,01), что ведет к ремоделированию стромы с развитием интерстициального фиброза (см. рис. 6а,б).
На III этапе изучался ангиогенез. Ангиогенез в легочном интерстиции оценивался нами по относительной плотности новообразованных сосудов, эндотелий которых экспрессировал CD34, экспрессии VEGF и MMP-2, участвующих в ангиогенезе.
VEGF выявлялся в цитоплазме клеток. Установлена экспрессия фактора роста как эпителиальными, так и стромальными клетками очагов. Основным источником VEGF являлись CD68+ МФ, эндотелий сосудов и фибробласты стромы. В основной группе VEGF экспрессировался в бронхиальном, бронхиолярном и альвеолярном эпителии, уровень экспрессии был выше, чем в контрольной (р 0,001).
При ХОБЛ и БЭБ основными источниками VEGF являлись альвеолярные МФ, эндотелий сосудов, а также фибробласты стромы и бронхиальный эпителий; при ФА – альвеолярные МФ и эндотелий сосудов, и в значительно меньшей степени, альвеолярный эпителий и фибробласты стромы (Рис. 6в, г).
CD34 экспрессировался эндотелиальными клетками сосудов капиллярного типа в очагах неоангиогенеза, что позволило рассчитывать нам среднюю плотность новообразованных сосудов. В основной группе средняя плотность сосудов в целом была выше, чем в контрольной группе при всех нозологиях (р 0,05). Наиболее высокие цифры получены при ФА основной группы.
TGF в основной группе был больше чем в контрольной (р 0,01). Основными источниками являлись фибробласты стромы, МФ и эпителий. При ХОБЛ - МФ и ПЯЛ, строма, эпителий; при БЭБ – строма, МФ и ПЯЛ, эпителий; при ФА – МФ, эпителий, фибробласты стромы. Особенности экспрессии TGF и объясняют морфологическую специфику фиброза при разных ХДЗЛ, а именно при ХОБЛ и БЭБ – перибронхиальный и периваскулярный фиброз, а при ФА - интерстициальный фиброз. Подтверждением сделанных выводов являются данные по ММР-2 (см. рис. 6в, г).
На IV этапе мы изучали варианты дисрегенераторных процессов в эпителии при ХДЗЛ: очаги бокаловидноклеточной трансформации (БКТ), базальноклеточную гиперплазию (БКГ) без атипии и с атипией - АБГ, плоскоклеточную метаплазию (ПМ), дисплазию III бронхиального эпителия (ДIII), атрофию, атипическую аденоматозную гиперплазию (ААГ) без/на фоне фиброза и гиперплазию нейроэндокринных клеток (ГНК), раздельно в клетках эпителия, стромы, сосудах и клетках воспалительного инфильтрата.
Гиперплазия нейроэндокринных клеток обнаружена в основном у больных первой группы и на светооптическом уровне имела сходство с базальноклеточной гиперплазией. Дифференциальная диагностика нейроэндокринной гиперплазии с базальноклеточной гиперплазией на светооптическом уровне была возможна лишь при реакции на выявление хромогранина-А. При этом в клетках иммуногистохимически выявлялся хромогранин-А. Ki-67-положительные клетки, как правило, экспрессировали хромогранин и располагались в базальных и парабазальных зонах.
При атипической аденоматозной гиперплазии, обнаруженной нами только в сотовом легком, отмечается пролиферация разнообразных клеток: цилиндрических (клетки Клара), кубических (альвеолоциты 2-го типа), слизистых, нейроэндокринных клеток, выстилающих альвеолы, чаще в очагах пневмосклероза в сотовом легком в исходе ИФА и вокруг абсцесса с формированием тубулярных, альвеолярных и сосочковых структур, иногда с явлениями плоскоклеточной метаплазии, что также описывается в литературе [Коган Е.А., Парамонова Н.Б., 2003], увеличение размеров клеток, появление признаков клеточного и ядерного полиморфизма, в пролифератах появляются многорядные и сосочковые структуры. Ki-67-положительные клетки выявлялись в значительно большем количестве и соответствовали, преимущественно, слизьпродуцирующим, нейроэндокринным, безреснитчатым цилиндрическим клеткам и альвеолоцитам 2-го типа.
При БКТ, БКГ, атрофии и ПМ экспрессия ММР-1, -2, -9, TIMP-1, а также Ki-67 была низкой и не отличалась достоверно от контроля (неизмененного бронхиального эпителия) (Рис. 7). При этом, наиболее высокий уровень экспрессии ММР-1 в эпителиальных клетках отмечался при АБГ и ДIII (р 0,001). Наиболее высокий уровень экспрессии ММР-2 в ДIII, а ММР-9 отмечался при АБГ и ПМ (р 0,001). Наиболее высокий уровень экспрессии TIMP-1 отмечался при ДIII (р 0,01).
 а. а. |  б. б. | |
 в. в. |  г. г. | |
 д. д. |  е. е. | |
 ж. ж. |  з. з. | |
Рис. 7. Гистограмма экспрессия ММРs, TIMP-1, VEGF, TGF, СD34, СD68, хромогранина и Ki-67 в дисрегенераторных изменениях эпителия при ХДЗЛ.
Процентное содержание CD68 положительных клеток среди клеток инфильтрата при ДIII составляло 9 и 10% в исследованных группах пациентов (р 0,05). Отмечался относительный рост процентного содержания CD68 положительных клеток до 31% и до 17% среди клеток инфильтрата в основной группе пациентов с АБГ (р 0,001) и ГНК (р 0,001) по сравнению с контрольной группой, где он составил по 3%. При ААГ процентное содержание CD68 положительных клеток среди клеток инфильтрата составляло 8 и 15% в I и во II группах пациентов (р 0,001). Высокий уровень экспрессии VEGF в АБГ и ГНК коррелировал с высокой плотностью новообразованных сосудов (р 0,001).
Плотность сосудов уменьшалась в очагах от АБГ, ГНК, ДIII, БКТ до ААГ. В образцах ткани контрольной группы больных, проживавших на территориях с неизмененным радиационным фоном, плотность сосудов была ниже в АБГ (р 0,01) и ГНК (р 0,001) по сравнению с основной группой (см. рис. 7). По вновь изученным маркерам АБГ, ГНК, ДIII и ААГ были близки по нашим данным к раку легкого [Сагиндикова Г.Е., Коган Е.А., 2007].
Резюмируя полученные данные исследования по морфологическим и молекулярно-биологическим особенностям ХДЗЛ у лиц, проживавших длительное время на радиационно-загрязненных территориях Семипалатинской области Казахстана, следует подчеркнуть наличие у них выраженного фиброза легочного интерстиция, поражения микрососудов, приводящего к неоангиогенезу, выраженной макрофагальной реакции и дисрегенераторных изменений эпителия, включая НЭГ эпителия.
Как показало проведенное нами исследование, в процесс фиброзирования и неоангиогенеза вовлекаются разнообразные клетки, прежде всего, альвеолярные и интерстициальные макрофаги, ПЯЛ, эндотелий сосудов, фибробластические элементы стромы, а также бронхиальный, бронхиолярный и альвеолярный эпителий, продуцирующие факторы, способствующие новообразованию сосудов и склерозу: VEGF, TGF, MMP-2. Нами установлена тенденция к росту экспрессии TIMP-1 параллельно с ростом экспрессии ММР-1, -2, -9. Однако, судя по доминированию процессов фиброзирования над распадом, что обнаруживается при морфологическом исследовании, можно предположить, что, в целом, в основной группе экспрессия TIMP-1 клетками преобладает над продукцией MMPs. Данное предположение подтверждается экспериментальными данными [Kolb M., 2002, Suga M., 2000], показывающими повышение экспрессии TIMP1, 2 при пневмосклерозе у мышей. Таким образом, следует сделать вывод, что развитие фиброза связано не столько с продукцией компонентов экстрацеллюлярного матрикса, сколько с интенсивностью его деградации. Выявленное нами значительное усиление экспрессии TGF эпителиальными и макрофагальными элементами у пациентов основной группы имеет особое регуляторное значение в развитии фиброза, поскольку не только стимулирует коллагеногенез, но и способствует активации ингибиторов металлопротеиназ [Suga M., 2000]. Особенности экспрессии TGF разными клетками и объясняют морфологическую специфику фиброза при разных ХДЗЛ, а именно при ХОБЛ и БЭБ – перибронхиальный и периваскулярный фиброз, а при ФА - интерстициальный фиброз. Подтверждением сделанных выводов являются данные по экспрессии ММР-2.
Следует отметить, что MMPs играют важнейшую роль в развитии и прогрессировании ХДЗЛ, таких как ХОБЛ, БЭБ, ФА. При этом, основным источником MMPs являются макрофаги и палочкоядерные клетки - триггерные клетки при ХОБЛ и БЭБ, а также альвеолярные МФ и эндотелий сосудов при ФА, что отчасти определяет различные структурные перестройки в легочной ткани; ХОБЛ, БЭБ, ФА у лиц, проживавших на радиоактивно-загрязненных территориях Семипалатинской области Казахстана, отличались от контрольной группы более выраженным фиброзом, неоангиогенезом и дисрегенераторными изменениями эпителия, что сочеталось с высокой экспрессией MMP-1, -2, -9, TIMP-1, TGF, VEGF; дисрегенераторные изменения эпителия чаще встречались при ХОБЛ, БЭБ, ФА у лиц, проживавших на радиоактивно-загрязненных территориях Семипалатинской области Казахстана, и отличались более высокой экспрессией эпителием MMP-1, -2, -9, TIMP-1, TGF, VEGF, а также хромогранина.
Сочетание выраженного ангиогенеза и фиброза легких не случайно в нашей группе больных. Более того, можно предположить, что неоангиогенез предшествует склеротическим изменениям. Ранее было установлено, что в условиях радиационного поражения фиброз начинается с поражения мелких сосудов (капилляры и артериолы) в различных тканях [Hasleton P.S. 1996, Anderson R.E., 1996]. Наши данные подтверждаются данными других исследований, в которых выявлена сосудистая патология, индуцированная радиацией. Авторы показали, что в регионе Семипалатинского испытательного полигона длительное воздействие ионизирующих излучений существенно изменяет деятельность сосудистой стенки, при этом нейроциркуляторная дистония сохраняется даже через 15-30 лет после прекращения облучения [Гусев Б.И., 1994, Чайжунусова Н.Ж., 1993].
В развитие дисрегенераторных процессов в легких безусловную роль вносит и иммунодепрессия, наведенная радиацией. Иммунная система организма человека – главный механизм противоопухолевой защиты и, в то же время, одна из основных мишеней для воздействия различных патогенных факторов внешней среды. Среди последних в настоящее время ведущую роль играют воздействия лучистой энергии различных диапазонов и интенсивности – от радиоволн до жесткого гамма-излучения, оказывающих угнетающее действие как на механизмы регуляции иммунитета от субклеточного до центрального уровня, так и непосредственное – на иммунокомпетентные клетки и их предшественников [Чайжунусова Н.Ж., 1993, Журова М.В., 1991].
3. Морфологические и молекулярно-биологические особенности фиброзно-кавернозного туберкулеза легких населения Семипалатинского региона Казахстана с повышенным уровнем радиации.
Результаты проведенного исследования свидетельствуют о существовании морфологических и иммуногистохимических особенностей ФКТ у больных Семипалатинского района, длительно проживавших на радиоактивно загрязненных территориях.
К морфологическим особенностям ФКТ больных основной группы следует отнести большую выраженность деструктивных и фибротических изменений, снижение частоты выявляемости гранулематозного воспаления и наличие слабой местной лимфоидной инфильтрации по сравнению с контрольной группой, что косвенно может свидетельствовать о низком уровне развития клеточного иммунитета у лиц, проживавших на радиоактивно-загрязненных территориях [Пузик В.И., 1984].
При окраске по Цилю-Нильсену микобактерии туберкулеза выявляются в 25% случаев как основной, так и контрольной групп. Процентное содержание CD-68 положительных макрофагов среди клеток мононуклеарного инфильтрата при ФКТ выше в основной группе (74%) по сравнению с контрольной группой (60%). Полученные данные подтверждаются исследованиями иммунного статуса больных туберкулезом Семипалатинского региона, у которых установлено наличие иммунодефицита, обусловленного, как полагают авторы, туберкулезом и воздействием ионизирующего излучения [Igembaeva K.S., 2001]. Выраженный фиброз в очагах ФКТ также можно связать с совместным эффектом туберкулезного и радиационного повреждения. Кроме того, в группе пациентов из Семипалатинского региона хромогранин был значительно выше и составлял в среднем 11% среди эпителиальных клеток. В контрольной группе больных хромогранин выявлялся в отдельных случаях ФКТ в единичных клетках бронхиального эпителия.
Изменения бронхиального эпителия в очагах ФКТ как в основной, так и в контрольной группах, включали в себя разнообразные дисрегенераторные изменения, которые рассмотрены нами в разделе по предраку легкого. При этом среди прочих дисрегенераторных процессов при ФКТ преобладала ПМ.
Помимо морфологических были обнаружены иммуногистохимические особенности ФКТ, развившегося у лиц в течение длительного времени проживавших в Семипалатинской области и подвергавшихся воздействию радиации I группы.
Как было установлено нами ранее, основную часть легочного интерстиция в условиях хронического воспаления и фиброза составляют коллагены III и IV типа, которые могут деградироваться матриксными металлопротеиназами определенного типа [Taylor JL, 2006, Rivera-Marrero CA, 2000, Chang JC, 1996], локализующимися в цитоплазме клеток.
Проведенное исследование показало, что основным тканевым источником ММР-1, -2, -9 и TIMP-1 в очагах ФКТ являются клетки гранулем и СD68+ макрофаги воспалительного инфильтрата (Рис. 8).
Обнаруженная высокая активность MMPs в клетках гранулемы и макрофагальном инфильтрате может обеспечивать с одной стороны миграцию клеток в очаг воспаления, что приводит к образованию гранулем [Taylor J.L., 2006], а с другой – деструкцию экстрацеллюлярного матрикса и базальных мембран и развитию казеозного некроза. Судя по тому, что в основной группе преобладали деструктивные изменения и реже развивались гранулемы, по сравнению с контрольной группой, а уровни активности MMPs в их клетках были значительно выше, можно предположить, что при различных уровнях ММРs может смещаться баланс между этими процессами. Так, при меньшей активности MMPs доминируют процессы формирования гранулем, при более высокой – казеоза.
ММР-1 расщепляет интерстициальные коллагены. В основной группе наибольшее количество ММР-1 зарегистрировано нами в цитоплазме эпителиоидных и гигантских многоядерных клеток Пирогова-Лангханса гранулем, CD68+ макрофагах инфильтрата, а, кроме того, в бронхиальном эпителии вблизи гранулем (Рис.8а). В контрольной группе ММР-1 обнаруживается только в клетках гранулемы и на достоверно более низком уровне (р 0,001).
ММР-2. В тканях больных основной группы отмечалось повышение содержания ММР-2 в цитоплазме клеток. Основным источником ММР-2 при ФКТ является эндотелий сосудов в очагах поражения, и в меньшей степени фибробласты, эпителиоидные и гигантские многоядерные клетки Пирогова-Лангханса гранулем, макрофаги инфильтрата, а, кроме того, бронхиальный эпителий вблизи гранулем (Рис.8б). В контрольной группе обнаруживается только в фибробластах и на более низком уровне (р 0,01).
ММР-9. Источником ММР-9 основной группы в очагах ФКТ являются эпителий, эпителиоидные и гигантские многоядерные клетки Пирогова-Лангханса гранулем, CD68+ макрофаги инфильтрата (Рис.8в). В контрольной группе ММР-9 выявляются только в цитоплазме клеток гранулемы и клетках инфильтрата на более низком уровне (р 0,001).
 а. а. |  б. б. |
 в. в. |  г. г. |
 д. д. |  е. е. |
Рис. 8. Матриксные металлопротеиназы (MMP-1,-2,-9), их ингибитор TIMP-1 и маркеры ангиогенеза (VEGF) и фиброза (TGF-) в клетках различных очагов фиброзно-кавернозного туберкулеза.
Условные обозначения: (см. рис. 6.);
эп. Кл, П-Л - эпителиоидные клетки и клетки Пирогова-Лангханса гранулем.
ТIMP-1 при иммуногистохимическом исследовании выявляется также в цитоплазме клеток. В основной группе ТIMP-1 низкий, встречается в эпителии и в следовых количествах в гигантских многоядерных клетках Пирогова-Лангханса гранулем и CD68+ макрофагах инфильтрата (Рис.8г). В контрольной группе ТIMP-1 обнаруживаются только в клетках гранулем и на более низком уровне (р 0,01).
Проведенное исследование показало, что основным тканевым источником ММР-1, -2, -9 и TIMP-1 в очагах ФКТ являются клетки гранулем и СD68+ макрофаги воспалительного инфильтрата. Обнаруженная высокая активность MMPs в клетках гранулемы и макрофагальном инфильтрате может обеспечивать с одной стороны миграцию клеток в очаг воспаления, что приводит к образованию гранулем, а с другой – деструкцию экстрацеллюлярного матрикса и базальных мембран и развитию казеозного некроза. Судя по тому, что в основной группе преобладали деструктивные изменения и реже развивались гранулемы, по сравнению с контрольной группой, а уровни активности MMPs в их клетках были значительно выше, можно предположить, что при различных уровнях ММРs может смещаться баланс между этими процессами. Так, при меньшей активности MMPs доминируют процессы формирования гранулем, при более высокой – казеоза. Наши данные совпадают с результатами исследований, в которых показано, что образование каверн напрямую связано с активацией экспрессии генов ММР-1 и ММР-7. При этом установлено, что усиление образования MMP-2 и ММР-9 в моноцитах гранулемы стимулируется рядом цитокинов, прежде всего TNF-. Ингибиторы MMPs, такие как ВВ-94, стимулируют фиброзирование и подавляют миграцию моноцитов в ходе образования гранулем. В макрофагальном инфильтрате основной группы обнаруживается экспрессия MMPs и TIMP-1 в отличие от контрольной группы, где выявлена активность только MMP-1 и -9.
Как показало проведенное исследование, активность MMP- 2 связана не только с деструкцией тканей при ФКТ, но и с процессами неоангиогенеза и фиброза, что подтверждается наиболее высокими показателями ММР-2 в эндотелии сосудов и в фибробластах стромы. При этом в основной группе эти процессы выражены достоверно выше, что может указывать на воздействие, потенциирующее фиброз как туберкулезного, так и радиационного факторов у пациентов Семипалатинского региона.
В бронхиальном эпителии очагов плоскоклеточной метаплазии (ПМ) основной группы наблюдается высокая экспрессия MMPs и их ингибитора TIMP-1, что отчасти может быть связано с активирующим воздействием на эпителий цитокинов, выделяемых CD68+ макрофагами и клетками гранулем. В контрольной группе эпителий очагов ПМ не экспрессирует металлопротеиназ. Как было показано в экспериментальных исследованиях, секреция MMPs бронхиальным эпителием при туберкулезе индуцируется цитокинами, выделяющимися активированными макрофагами, которые также способны снижать секрецию эпителием ингибиторов металлопротеиназ [Price N.M., 2003]. MMP-2, ММР-9 и ММР-1 экспрессируются при ФКТ в эпителиальных клетках, что крайне опасно, поскольку может приводить к злокачественной трансформации и началу инвазивного роста. Инвазивному росту также может способствовать усиление ангиогенеза в подлежащих тканях, судя по повышенной экспрессии VEGF и CD34.
Ангиогенез и фиброзирование в очагах ФКТ оценивались нами по относительной плотности новообразованных сосудов, эндотелий которых экспрессирует CD34, содержанию VEGF и TGF- в клетках очагов. VEGF выявляется в цитоплазме клеток. Установлена экспрессия фактора роста как эндотелием сосудов, так и стромальными клетками вблизи гранулем (см. рис. 8д). При этом в контрольной группе основными источниками VEGF являются клетки гранулем, макрофаги инфильтрата, а в основной группе – эпителиоидные и гигантские клетки гранулем и макрофаги инфильтрата, а также эндотелий сосудов. Высокий уровень экспрессии VEGF в ФКТ коррелировал с высокой плотностью новообразованных сосудов (р 0,01).
При CD34 плотность сосудов значительно варьировала в зависимости от выраженности воспалительной реакции. Однако, в целом, обнаружено относительное увеличение плотности сосудов в очагах вблизи гранулем. В образцах ткани контрольной группы больных, проживавших на территориях с неизмененным радиационным фоном, плотность сосудов была ниже по сравнению с основной группой (р 0,001).
Таким образом, ангиогенез в ФКТ в целом повышается. Усиление ангиогенеза наиболее выражено вблизи гранулем с нейроэндокринной и базальной дифференцировкой эпителиальных клеток, продуцирующих VEGF.
TGF-b в основной группе выявляется как в клетках бронхиального эпителия вблизи гранулем, так и эпителиоидными и гигантскими клетками гранулем и макрофагами инфильтрата (см. рис. 8е). В контрольной группе TGF- выявляется лишь эпителиоидными и гигантскими клетками гранулем и макрофагами инфильтрата (р 0,001).
В основной группе имеются молекулярные предпосылки для ангиогенеза, фиброзных изменений (активации TIMP-1, TGF-, VEGF), что совпадает с данными других авторов [Shimouchi A, 2003, Hrabec E, 2002, Rivera-Marrero CA, 2000].
Резюмируя выше изложенное, можно отметить следующие особенности ФКТ у лиц, длительное время проживавших на радиоактивно-загрязненных территориях Семипалатинской области: большая выраженность деструктивных и фибротических изменений; снижение частоты выявляемости гранулематозного воспаления и наличие слабой местной лимфоидной инфильтрации, что косвенно может свидетельствовать о низком уровне развития клеточного иммунитета на фоне воздействия ионизирующего излучения; выраженность деструктивных процессов и фиброзирования при ФКТ зависит от активности MMPs, их ингибиторов, факторов ангиогенеза, множества факторов роста и других цитокинов, содержание которых значительно выше у больных ФКТ, проживавших в условиях повышенной радиации; клетки гранулем и СD68+ макрофаги воспалительного инфильтрата являются основным тканевым источником ММР-1, -2, -9 и TIMP-1 в очагах ФКТ.
4. Морфологические и молекулярно-биологические особенности предраковых процессов легких населения Семипалатинского региона Казахстана с повышенным уровнем радиации.
На I этапе исследования изучали морфологию и иммуногистохимическую характеристику предрака легкого. Мы исследовали очаги АБГ, ДIII бронхиального эпителия, ААГ без/на фоне фиброза и ГНК, раздельно в клетках эпителия, стромы, сосудах и клетках воспалительного инфильтрата. Кроме того, в качестве контроля исследовались бронхи без патологических изменений в участках сохранного легкого.
Дисплазия Ш бронхиального эпителия выявлена у 26 (12 - основной группы, 14 – контрольной группы) больных в бронхах разного калибра в виде очагов, состоящих из атипичных клеток плоского эпителия, обнаруживаемых во всех его слоях. Подлежащая базальная мембрана утолщена, гиалинизирована. В подлежащих тканях отдельные сосуды капиллярного типа и лимфоплазмацитарные и макрофагальные инфильтраты.
Атипическая базальноклеточная гиперплазия обнаружена у 43 (12 и 31) пациентов в бронхах разного калибра в виде очагов гиперплазии и атипии базальных клеток. Базальная мембрана в фокусах АБГ утолщена, гиалинизирована, в подлежащих тканях имеется инфильтрация лимфоидно-плазматическими клетками и макрофагами, а также сосуды капиллярного типа с гиалинизированными стенками.
Гиперплазия нейроэндокринных клеток обнаружена у 4 больных основной группы и 2 пациентов контрольной группы. Обращает на себя внимание утолщение базальной мембраны в фокусах ГНК, множество сосудов капиллярного типа с гиалинизированными стенками и лимфоплазмацитарная и макрофагальная инфильтрация в подлежащих тканях.
Атипическая аденоматозная гиперплазия найдена у 38 (13 и 25) пациентов, как правило, локализуется в субплевральных отделах легкого или в легочной паренхиме и не связана с бронхами. ААГ представлена аденоматозными альвеолярными, тубулярными и сосочковыми структурами, выстланными полиморфными эпителиальными клетками, наслаивающимися друг на друга. В большинстве случаев строма в этих участках расширена, представлена фиброзной гиалинизированной тканью, содержащей единичные сосудистые структуры, большое количество пылевых частиц, и небольшие скопления лимфоцитов, плазматических клеток и макрофагов. При окраске по Ван Гизону обнаруживаются грубые коллагеновые волокна красного цвета.
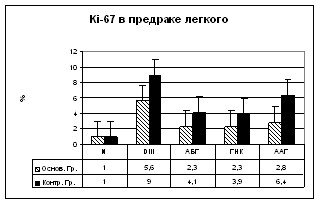
Ki-67-положительные клетки в основном локализуются в базальной и парабазальной областях, а при выраженной пролиферации и атипии базальных клеток – на всех уровнях эпителиального пласта. Уровень экспрессии Ki-67 в эпителиальных клетках основной и контрольной групп при ДIII составляет в среднем 9%, при АБГ 4,1% (р0,05), при ААГ 6,4% (р0,01), при ГНК в нейроэндокринных клетках в среднем достигает 3,9% (Рис. 9а).
Хромогранин. В контрольной группе больных хромогранин выявлялся в отдельных случаях ДIII, ААГ и АБГ в единичных клетках эпителиального пласта. В группе пациентов из Семипалатинского региона хромогранин был значительно выше и составлял в среднем 30% при ДIII и ААГ (р0,001), 35% при АБГ (р0,001) (Рис. 9б).
При окраске гематоксилином и эозином ГНК первоначально была диагностирована нами как АБГ, а в одном случае - как плоскоклеточная метаплазия бронхиального эпителия. Диагноз ГНК ставился нами после выявления нейроэндокринных клеток при реакции на хромогранин А.
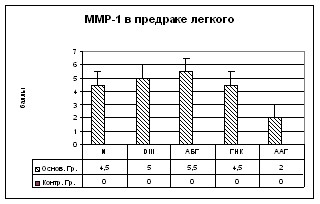
На II этапе исследовались матриксные металлопротеиназы (ММРs) и их ингибиторы. ММР-1 при иммуногистохимическом исследовании выявляется в цитоплазме клеток. В очагах предраковых изменений в легком обнаружено отличие в экспрессии данного фермента как по уровню, так и по локализации в двух исследуемых группах. В тканях больных I группы отмечалось повышение уровня экспрессии ММР-1 в эпителии предраковых очагов, а также в эндотелии сосудов и фибробластических элементах стромы. При этом, наиболее высокий уровень экспрессии ММР-1 в эпителиальных клетках отмечается при АБГ и ДIII (р0,001) (Рис. 9в).
ММР-2 и ММР-9 при иммуногистохимическом исследовании выявляется также в цитоплазме клеток. В тканях больных основной группы отмечалось повышение уровня экспрессии ММР-2 и ММР-9. Продукт реакции обнаружен также и в эпителии предраковых очагов, и в фибробластических элементах стромы. При этом, наиболее высокий уровень экспрессии ММР-2 в ДIII, а ММР-9 отмечается при АБГ (р0,001) (Рис. 9г,д).
 а. а. |  б. б. |
 в. в. |  г. г. |
 д. д. |  е. е. |
 ж. ж. |  з. з. |
Рис. 9. MMP-1,-2,-9, TIMP-1, VEGF, CD34, хромогранин А и Ki-67 при предраке легкого.
Условные обозначения смотри по тексту.
TIMP-1 при иммуногистохимическом исследовании выявляется также в цитоплазме клеток. В тканях больных I группы отмечалось повышение уровня экспрессии TIMP-1 в эпителии предраковых очагов, эндотелии сосудов и в фибробластических элементах стромы. Наиболее высокий уровень экспрессии TIMP-1 отмечается при ДIII (р0,01) (Рис. 9е).
В образцах ткани контрольной группы больных, проживавших на территориях с неизмененным радиационным фоном, выявлена низкая экспрессия протеазы ММР-1, как правило, клетками воспалительного инфильтрата стромы, прежде всего макрофагами – СД68+ клетками.
В образцах ткани II группы больных выявлена низкая экспрессия ММР-2 и -9. В эпителиальных клетках продукт реакции не обнаруживался. Небольшие количества ММР-2 и -9 определялись в эндотелии сосудов и в клетках воспалительного инфильтрата стромы.
Экспрессия TIMP-1 в образцах ткани контрольной группы больных обнаружена в основном в клетках воспалительного инфильтрата, прежде всего макрофагами – СД68+ клетками в сочетании с низкой экспрессией клетками эпителия и эндотелия сосудов.
В дополнение к имеющимся литературным данным об участии ММРs и TIMP в процессах инвазии и метастазирования рака легкого (РЛ), в первую очередь мелкоклеточного РЛ [Zhou Y., 2005, Coussens L.M., 2002, Gonzales-Avila G., 1998], нами установлено усиление экспрессии данных молекул и в предраковых очагах, что может свидетельствовать о подготовке клеток таких очагов к инвазивному росту. Кроме того, повышение активности ММРs приводит к активации факторов роста (эпидермоидного фактора роста, фактора роста фибробластов, фактора роста эндотелия сосудов и др.), которые в свою очередь, могут способствовать пролиферации эпителия и неоангиогенезу. Полученные нами данные могут быть использованы для разработки методов таргетной терапии предраковых процессов в легких, направленных на подавление процессов пролиферации и ангиогенеза путем ингибирования ММРs и активации TIMP. Можно предположить, что данный подход к лечению заболеваний на стадии предраковых изменений в легких будет более эффективен по сравнению с терапией РЛ [Zhou Y., 2005].
Выявлены различия в содержании металлопротеиназ и их ингибитора в идентичных очагах контрольной и основной групп, которые характеризуются появлением экспрессии ММР-1, -2 и -9 и относительным увеличением экспрессии TIMP-1 в эпителиальных клетках основной группы. Злокачественный потенциал предраковых процессов легкого в плане инвазивного роста значительно выше в I группе, что вероятно и определяет худший прогноз радиационного рака [Yamamoto T., 1986]. Онкогенный эффект при воздействии малых доз радиации изучен давно и не вызывает сомнений [Бабешко В.Г., 1991, Латарне Р., 1990, Hill C, 1990, Hoel D.G., 1990, Shimuzu G., 1991].
Высокие показатели экспрессии ММРs в основной группе могут быть связаны с нейроэндокринной дифференцировкой клеток предраковых очагов [Gonzales-Avila G., 1998].
CD68. Процентное содержание CD68 положительных клеток среди клеток инфильтрата при ДIII составляет 9 и 10% в исследованных группах пациентов (р0,05). Отмечается относительный рост процентного содержания CD68 положительных клеток до 31% и до 17% среди клеток инфильтрата в основной группе пациентов с АБГ (р0,001) и ГНК (р0,001) по сравнению с контрольной группой, где он составил по 3%. При ААГ процентное содержание CD68 положительных клеток среди клеток инфильтрата составляет 8 и 15% в I и во II группах пациентов (р0,001).
На III этапе изучался ангиогенез. Ангиогенез в легочном интерстиции, прилежащем к предраковым очагам, оценивался нами по относительной плотности новообразованных сосудов, эндотелий которых экспрессирует CD34 и экспрессии VEGF.
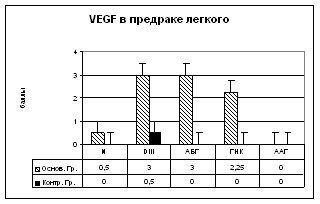
VEGF выявляется в цитоплазме клеток предраковых очагов. Установлена экспрессия фактора роста как эпителиальными, так и стромальными клетками очагов. При этом в контрольной группе основными источниками VEGF являются клетки воспалительного инфильтрата, а в основной группе – клетки эпителия и воспалительного инфильтрата. Высокий уровень экспрессии VEGF в АБГ и ГНК коррелировал с высокой плотностью новообразованных сосудов (р0,001) (Рис. 9ж).
При CD34 плотность сосудов значительно варьировала в зависимости от выраженности воспалительной реакции. Однако, в целом, обнаружено относительное увеличение плотности сосудов в очагах предрака по сравнению с нормой. Плотность сосудов уменьшалась в очагах от АБГ, ГНК, ДIII до ААГ. В образцах ткани контрольной группы больных, проживавших на территориях с неизмененным радиационным фоном, плотность сосудов была ниже в АБГ (р0,01) и ГНК (р0,001) по сравнению с основной группой (Рис. 9з).
Таким образом, ангиогенез в предраковых очагах в целом повышается по сравнению с нормой. Усиление ангиогенеза наиболее выражено в предраковых очагах с нейроэндокринной и базальной дифференцировкой эпителиальных клеток, продуцирующих VEGF, что сопоставимо с данными литературы [Gonzales-Avila G., 1998, Kawano N., 1997].
В результате проведенного исследования установлена высокая частота экспрессии хромогранина в эпителиальных клетках, что совпадает с данными, опубликованными ранее [Коган Е.А., Парамонова Н.Б., 2003]. Предрак легкого, возникший в условиях повышенной радиации, отличается высоким потенциалом к инвазивному росту, судя по повышению уровня экспрессии ММР-1, -2 и -9 в эпителиальных клетках, а также усиления ангиогенеза в подлежащих тканях при АБГ, ГНК. Полученные данные совпадают с данными литературы о высоком риске развития РЛ при высокой активности и наличии генетического полиморфизма ММР-2 и ММР-9 [Zhou Y., 2005]. При этом компенсаторно происходит активация механизмов антибластомной защиты путем усиления выработки TIMP-1 и высокого процентного содержания CD68+ макрофагов среди клеток инфильтрата, сдерживающих прорастание эпителия через базальную мембрану. Относительно высокий уровень металлопротеиназ в радиационном предраке может быть косвенным подтверждением возникновения предрака в условиях радиационного фиброза и свидетельством его высокого злокачественного потенциала.
Особенностью предрака легкого семипалатинского региона является также большой процент молодых пациентов. Возраст больных колебался с 18 до 69 лет, в то время как в контрольной группе возраст больных составлял 47-81год.
MMP-2, ММР-9 и ММР-1 экспрессируются в предраке легкого в эпителиальных клетках, что крайне опасно, поскольку может приводить к началу инвазивного роста. Инвазивному росту также может способствовать усиление ангиогенеза в подлежащих тканях, судя по повышенной экспрессии VEGF и CD34 при АБГ и ГНК.
MMP-2, ММР-9 и ММР-1 экспрессируются в предраке легкого в эпителиальных клетках, что крайне опасно, поскольку может приводить к началу инвазивного роста. Инвазивному росту также может способствовать усиление ангиогенеза в подлежащих тканях, судя по повышенной экспрессии VEGF и CD34 при АБГ и ГНК.
Таким образом, предрак легкого, возникший в условиях повышенной радиации, отличается рядом молекулярных особенностей: наличием высокого потенциала к инвазивному росту за счет дисбаланса между экспрессией металлопротеиназ и их ингибиторов, а также активацией механизмов антибластомной защиты; усиленным ангиогенезом в строме подлежащих тканей, что также создает благоприятные условия для инвазивного роста трансформированного эпителия; повышением уровня пролиферации эпителия за счет возможной активации факторов роста под действием ММРs и их усиленной продукции.
Относительно высокий уровень металлопротеиназ в предраке основной группы может быть косвенным подтверждением возникновения предрака в условиях радиационного фиброза и свидетельством его высокого злокачественного потенциала.
5. Морфологические и молекулярно-биологические особенности рака легкого населения Семипалатинского региона Казахстана с повышенным уровнем радиации.
В результате проведенного исследования установлено, что ММР-1 и ММР-9 при иммуногистохимическом исследовании выявляются в цитоплазме опухолевых клеток, а также фибробластических элементов, эндотелия сосудов и макрофагов воспалительного инфильтрата стромы. Уровни экспрессии ферментов в раковых клетках, как правило, были сопоставимы с таковыми в макрофагах (Рис.10а-г). При этом, наиболее высокие уровни экспрессии ММР-1 и ММР-9 в раковых клетках отмечаются при аденокарциноме (АК) и мелкоклеточном РЛ (МРЛ) обеих групп. Обнаружены отличия в экспрессии данных ферментов, как по уровню, так и по локализации в двух исследуемых группах.
В опухолевых клетках больных I группы отмечались наибольшие уровни экспрессии ММР-1 и ММР-9 по сравнению с контрольной группой (р 0,001). При этом раковые клетки больных I группы содержали большее количество ферментов по сравнению со стромальными элементами, в то время как в контрольной группе уровни экспрессии ММР-1 и ММР-9 в паренхиматозных и стромальных элементах были примерно на одном уровне (см. рис. 10а-г).
ММР-2 при иммуногистохимическом исследовании выявляется также в цитоплазме клеток стромы, эндотелия сосудов, макрофагов и лишь в небольших количествах, опухолевых клеток, в основном АК и плоскоклеточного РЛ (ПРЛ). Наибольший уровень экспрессии фермента обнаруживался в эндотелии сосудов обеих групп (Рис. 10д,е). Выявлено усиление экспрессии данного фермента в эндотелии сосудов ПРЛ с нейроэндокринной дифференцировкой (НЭД) в основной группе по сравнению с контрольной (р 0,001) (см. рис. 10д,е).
TIMP-1 при иммуногистохимическом исследовании выявляется в небольшом количестве в цитоплазме опухолевых клеток, а также фибробластических элементов, эндотелия сосудов и макрофагов воспалительного инфильтрата стромы. В тканях больных I группы отмечалась тенденция к повышению уровня экспрессии TIMP-1 в паренхиме опухоли по сравнению с контрольной группой, оставаясь при этом на низком уровне (р 0,001) (Рис. 10ж,з).
Процентное содержание CD68 положительных клеток среди клеток инфильтрата составляет от 31 до 53% в основной группе, и от 30 до 52% в контрольной (Рис. 11а). При этом макрофагальная инфильтрация стромы наиболее выражена в АК по сравнению с другими гистологическими типами РЛ и сопоставима в обеих группах.
 а. а. |  б. б. |
 в. в. |  г. г. |
 д. д. |  е. е. |
 ж. ж. |  з. з. |
Рис. 10. Гистограммы MMP-1,-2,-9 и их ингибитор TIMP-1 в клетках различных гистологических типов РЛ.

а.
 б. б. |  в. в. |
 г. г. |  д. д. |
Рис. 11. Гистограммы CD68, VEGF, CD34 и хромогранин А в клетках различных гистологических типов рака легкого.
В МРЛ больных I группы отмечается выраженное снижение процентного содержания CD68 положительных клеток в строме опухоли до 31% среди клеток инфильтрата по сравнению с контролем (42%). Ангиогенез в строме опухоли оценивался нами по относительной плотности новообразованных сосудов, эндотелий которых экспрессирует CD34 и VEGF.
VEGF выявляется в цитоплазме клеток паренхимы и стромы опухоли. При этом в основной группе отмечено усиление экспрессии VEGF опухолевыми клетками МРЛ и ПРЛ с НЭД (р 0,05). В АК уровень экспрессии VEGF был одинаков в обеих группах (Рис. 11б,в). Уровень экспрессии фактора роста коррелировал с высокой плотностью новообразованных сосудов, судя по CD34 (Рис. 11г). В целом, обнаружено относительное увеличение плотности сосудов в РЛ больных основной группы по сравнению с контрольной (р 0,01).
Таким образом, ангиогенез в опухолях основной группы повышается по сравнению с контрольной, что совпадает с данными по усилению экспрессии ММР-2. Усиление ангиогенеза наиболее выражено в РЛ с НЭД.
Хромогранин-А выявлялся в цитоплазме и ядрах опухолевых клеток МРЛ, а в опытной группе и во всех случаях НМРЛ, что позволяет их считать НМРЛ с НЭД. При этом процент хромогранин+ клеток в ПРЛ с НЭД в среднем составил 30%, а в АК с НЭД – 70%. В контрольной группе хромогранин+ клетки среди НМРЛ выявлялись только в ПРЛ и составляли в среднем 2,5% (Рис. 11д).
В результате проведенного исследования установлено, что подавляющее большинство больных из семипалатинского региона имели мелкоклеточный РЛ. В случаях немелкоклеточного РЛ (НМРЛ) в опухолевых клетках также выявлялась нейроэндокринная дифференцировка, что было показано нами ранее при выявлении хромогранина. По данным других авторов известно, что РЛ, связанный с радиационным воздействием, обладает некоторыми особенностями. Так, L. Kreyberg [1967] первым отметил, что наиболее часто такой рак имеет нейроэндокринную дифференцировку, однако в последнее время описывают учащение среди радиационных карцином легкого опухолей с железистой дифференцировкой. По данным литературы, считается, что у работников урановых рудников и радиохимических производств чаще возникают нейроэндокринные центральные карциномы легких [Чучалин А.Г., 1998, Коган Е.А., 1999, Кутьков В. А., 1993]. При изучении РЛ у шахтеров урановых рудников установлено, что особую опасность по химическому составу представляют пыли, содержащие радионуклиды в малых дозах [Али-Риза А., 1999; Archer V. E., 1964, Abid S., 2001, Шпагина Л.А., 2003].
Особенностью РЛ семипалатинского региона является также большой процент молодых пациентов. Возраст больных колебался с 13 до 69 лет, в то время как в контрольной группе возраст больных составлял 47-81год.
Полученные данные отражают общую тенденцию, обнаруженную за десятилетия функционирования ядерного испытательного полигона в Семипалатинском регионе Республики Казахстан [Балмуханов С.Б., 1998, Бозтаев К.Б., 1992]. Особенно тревожными является неуклонный рост общей онкозаболеваемости у жителей города Семипалатинска и высокая заболеваемость у детей, рожденных от облученных родителей и молодых людей [Капитульский В.Б., 1995, Жангелова М.Б., 1994].
Сопоставление экспрессии ММРs и других изученных нами факторов в различных гистологических типах РЛ сравниваемых группах было бы не корректным, так как в основной группе во всех изученных опухолях обнаруживалась НЭД. В то же время выявлены некоторые особенности в экспрессии ММРs и VEGF в некоторых гистологических типах РЛ обеих групп: ММР-2 практически не экспрессировалась в опухолевых клетках МРЛ, ММР-9 была выше в НМРЛ по сравнению с МРЛ, а VEGF был самым низким в АК (см. рис. 10в-е, 11б, в).
Рак легкого, возникший в условиях повышенной радиации, отличается высоким потенциалом к инвазивному росту, судя по повышению уровня экспрессии ММР-1, -2 и -9 в эпителиальных клетках, а также усиления ангиогенеза в строме. При этом компенсаторно происходит активация механизмов антибластомной защиты путем усиления выработки TIMP-1, что может сочетаться с местной иммунодепрессией, индуцированной радиационным воздействием по данным литературы [Игембаева К. С., 2002]. Относительно высокий уровень металлопротеиназ в радиационном РЛ может быть косвенным подтверждением возникновения рака в условиях радиационного фиброза.
Таким образом, установлено, что злокачественный потенциал РЛ в плане инвазивного роста значительно выше у пациентов I группы, что вероятно и определяет худший прогноз течения их заболевания. Данное предположение основывается на обнаруженном нами усилении экспрессии ММР-1, -2 и -9 в раковых клетках основной группы по сравнению с контрольной.
Ангиогенез в строме семипалатинского рака легкого, как правило, был более выраженным, судя по экспрессии VEGF и плотности новообразованных сосудов по сравнению с контрольной группой. РЛ, возникший в условиях повышенной радиации отличается более высоким уровнем ангиогенеза в строме, а также инвазивными свойствами опухолевой ткани, что обеспечивается более высоким уровнем экспрессии металлопротеиназ и факторов роста. MMP-2 экспрессируется в РЛ в основном в очагах ангиогенеза стромы на значительно более высоком уровне в РЛ I группы по сравнению с контролем. Относительно высокий уровень металлопротеиназ в радиационном раке может быть косвенным подтверждением роста опухоли в условиях радиационного фиброза и ее высокого злокачественного потенциала.
Таким образом, пневмосклероз и злокачественные опухоли являются наиболее тяжелыми последствиями не только внешнего облучения, но и ингаляционного поступления радионуклидов в дыхательные пути. В эксперименте доказано, что чаще всего подобные изменения вызывают изотопы урана, радона, полония, плутония, америция, церия, технеция, бария, фосфора, рутения, причем бластомогенный эффект более выражен именно при ингаляции радионуклидов, а не «горячих» частиц, поскольку последние за счет высоких доз вызывают массовую гибель окружающих клеток и тем самым препятствуют накоплению клеток с мутациями и признаками злокачественной трансформации [Иванов А.Е., 1981]. Кроме того, инкорпорированные радионуклиды, оставаясь источниками внутреннего облучения ликвидаторов в течение многих лет, могут служить причиной образования мелкоочагового фиброза легочной ткани и последующего развития злокачественных опухолей органов дыхания.
ММРs и TIMP оказывают воздействие на процессы инвазии, метастазирования РЛ и ангиогенеза. При этом ММР-2 наиболее активно экспрессируется в очагах новообразования сосудов в опухолях. РЛ, возникший в условиях повышенной радиации, отличается высоким потенциалом к инвазивному росту за счет дисбаланса между экспрессией металлопротеиназ и их ингибитора, а также инактивацией механизмов антибластомной защиты. Ангиогенез в строме подлежащих тканей также создает благоприятные условия для инвазивного роста эпителия. Перечисленные факторы могут обуславливать плохой прогноз РЛ у лиц, проживавших на радиоактивно-загрязненных территориях.
Таким образом, рак легкого, возникший в условиях повышенной радиации, отличается рядом молекулярных особенностей, которые заключаются в следующем: развитие рака легкого в более молодом возрасте; наличие высокого потенциала к инвазивному росту за счет дисбаланса между экспрессией металлопротеиназ и их ингибиторов, а также активацией механизмов антибластомной защиты; усиленный ангиогенез в строме подлежащих тканей, что также создает благоприятные условия для инвазивного роста раковых клеток; относительно высокий уровень экспрессии металлопротеиназ в РЛ, возникшем в условиях повышенной радиации, что может быть косвенным подтверждением роста опухоли в условиях радиационного фиброза и ее высокого злокачественного потенциала; характерное развитие нейроэндокринной дифференцировки в раковых клетках.
В результате проведенного исследования можно предложить гипотезу о роли металлопротеиназ в развитии фиброза, предрака и рака легкого при хроническом радиационном воздействии (Рис. 12, 13).


Рис. 13. Патогенез радиационного предрака и рака легкого.
Радиационное повреждение вызывает ремоделирование экстрацеллюлярного матрикса, что приводит к фиброзу через снижение активности металлопротеиназ и усиление активности их ингибиторов. В условиях фиброза и гипоксии, а также стимуляции продуктами деградации экстрацеллюлярного матрикса дисрегенераторные процессы могут превращаться в предраковые, для которых характерно усиление активности металлопротеиназ, но еще в большей степени их ингибиторов, а также дисбаланса в процессах ангиогенеза, что еще больше способствует фиброзу, гипоксии и злокачественной трансформации эпителия.
ВЫВОДЫ.
- Показатели заболеваемости хронической обструктивной болезнью легких, бронхоэктатической болезнью, фиброзирующим альвеолитом в Семипалатинском регионе значительно превышают среднестатистические данные по России.
- Выявлена тенденция к снижению показателей заболеваемости и смертности хроническими диффузными заболеваниями легких в Семипалатинском регионе после прекращения ядерных испытаний, начиная с 1992г., что может подтверждать значение радиации как этиопатогенетического фактора в развитии легочной патологии.
- При хронических диффузных заболеваниях легких помимо известных морфологических особенностей следует отметить: выраженный склероз стенок бронхов и интерстиция, сосудистая патология с развитием гемосидероза, накопление пыли как косвенный показатель отложения радионуклидов, гиперплазия нейроэндокринных клеток, дисплазии бронхиального, бронхиолярного и альвеолярного эпителия.
- Хроническая обструктивная болезнь легких, бронхоэктатическая болезнь, фиброзирующий альвеолит у лиц, проживавших на радиоактивно-загрязненных территориях Семипалатинской области Казахстана отличались от контрольной группы более высокой экспрессией MMP1, 2, 9, TIMP-1, TGF, VEGF, основными источниками которых являются макрофаги, палочкоядерные лейкоциты, эндотелий сосудов, фибробласты и эпителий дисрегенераторных очагов.
- Дисрегенераторные изменения эпителия чаще встречались при хронической обструктивной болезни легких, бронхоэктатической болезни, фиброзирующем альвеолите у лиц, проживавших на радиоактивно-загрязненных территориях Семипалатинской области Казахстана, и характеризовались более высокой экспрессией эпителием MMP1, 2, 9, TIMP-1, TGF, VEGF, а также хромогранина.
- Морфологическими особенностями фиброзно-кавернозного туберкулеза у лиц, длительное время проживавших на радиоактивно-загрязненных территориях Семипалатинской области являются: большая выраженность деструктивных и фибротических изменений, снижение частоты выявляемости гранулематозного воспаления и наличие слабой местной лимфоидной инфильтрации.
- Выраженность деструктивных процессов и фиброзирования при фиброзно-кавернозном туберкулезе основной группы зависит от активности MMPs, их ингибиторов, факторов ангиогенеза, ростовых факторов. Клетки гранулем и СD68+ макрофаги воспалительного инфильтрата являются главным тканевым источником ММР-1, -2, -9 и TIMP-1 в очагах фиброзно-кавернозного туберкулеза.
- Предрак легкого, возникший в условиях повышенной радиации, отличается высоким потенциалом к инвазивному росту за счет дисбаланса между экспрессией металлопротеиназ и их ингибиторов, повышением уровня пролиферации эпителия, усиленным ангиогенезом в строме подлежащих тканей, что также создает благоприятные условия для инвазивного роста трансформированного эпителия.
- Рак легкого, возникший в условиях повышенной радиации, характеризуется развитием в более молодом возрасте; высокой экспрессией раковыми клетками потенциала к инвазивному росту за счет дисбаланса между экспрессией ММР-1, -2, -9 и TIMP-1, TGF, VEGF, а также хромогранина, что обеспечивает его высокий злокачественный потенциал.
- Рак легкого, возникший в условиях повышенной радиации характеризуется усиленным ангиогенезом в строме, что также создает благоприятные условия для инвазивного роста раковых клеток.
- Гиперплазия нейроэндокринных клеток в очагах дисрегенераторных и предраковых изменений эпителия, а также нейроэндокринная дифференцировка опухолевых клеток при раке легкого являются характерной чертой легочной патологии, возникшей у лиц Семипалатинского региона, длительное время проживавших в условиях повышенной радиации.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ.
- Коган Е.А., Сагиндикова Г.Е., Секамова С.М., Жак Г. Морфологические, цитогенетические и молекулярно-биологические особенности рака легкого, развившегося у лиц, длительное время проживавших на радиоактивно загрязненных территориях Семипалатинской области Казахстана. // Архив патологии, 2002, №5. с.13-18.
- Сагиндикова Г.Е., Коган Е.А. Патология легких, возникшая в условиях повышенной радиации семипалатинского региона. // Пульмонология. 2003. Доп. Выпуск. 13 национальный конгресс по болезням органов дыхания. Санкт-Петербург. c.363.
- Сагиндикова Г. Е. IGF система и биомолекулярные маркеры рака легкого. // Монография. Актюбинск, 2004. ISBN 9965-706-34-4. 101 стр.
- Сагиндикова Г. Е. Рак легкого и радиация. // Монография. Актюбинск, 2004. ISBN 9965-706-35-2. 132 стр.
- Самсонова М.В., Сагиндикова Г. Е., Черняев А.Л., Коган Е. А. Рак легкого, развившийся у лиц, работавших на радиационных производствах и проживавших на загрязненных территориях России: гистологические и молекулярно-генетические особенности. // Пульмонология, 2004, №6. с. 30-34.
- Сагиндикова Г.Е., Коган Е.А., Жак Г. Особенности рака легкого, развившегося у лиц, длительное время проживавших на радиоактивно-загрязненных территориях Семипалатинской области Казахстана. // Медицина, международный профессиональный журнал. Казахстан. 2004. №4. с. 25-30.
- Сагиндикова Г.Е., Коган Е.А., Сатбаева Э.Б. Ангиогенез и инвазивный рост рака легкого, развившегося у лиц, длительно проживавших на радиоактивно-загрязненных территориях Семипалатинской области Казахстана. // Пульмонология. 2006. Доп. Выпуск. Сборник трудов конгресса. XVI национальный конгресс по болезням органов дыхания. II конгресс евроазиатского респираторного общества. Санкт-Петербург. c.242.
- Сагиндикова Г.Е, Коган Е.А., Сатбаева Э.Б., Парамонова Н.Б. Предрак легких, развившийся у лиц, длительно проживавших на радиоактивно-загрязненных территориях Семипалатинской области Казахстана. // Пульмонология. 2006. Доп. Выпуск. Сборник трудов конгресса. XVI национальный конгресс по болезням органов дыхания. II конгресс евроазиатского респираторного общества. Санкт-Петербург. c. 241.
- Сагиндикова Г.Е., Коган Е.А. Заболеваемость и смертность от хронических забролеваний легких у населения Семипалатинского региона и их морфологические проявления. // Пульмонология. 2006. Доп. Выпуск. Сборник трудов конгресса. XVI национальный конгресс по болезням органов дыхания. II конгресс евроазиатского респираторного общества. Санкт-Петербург. c.241.
- Сагиндикова Г.Е, Коган Е.А., Сатбаева Э.Б., Парамонова Н.Б. Матриксные металлопротеиназы, процессы ремоделирования экстрацеллюлярного матрикса и ангиогенеза при различных морфологических вариантах предрака легкого. // Astana Medical Journal. 2006. N4 (36). c. 125-129.
- Сагиндикова Г.Е, Коган Е.А., Флигель Д.М., Телеуов М.К. Морфологические и иммуногистохимические особенности фиброзно-кавернозного туберкулеза легких у лиц, длительное время проживавших на радиоактивно загрязненных территориях Семипалатинской области Казахстана. // Astana Medical Journal. 2007. N1 (37), c.85-90.
- Сагиндикова Г.Е., Коган Е.А., Шаханов Т.Е.. Заболеваемость и смертность от хронических заболеваний легких у населения Семипалатинского региона и их морфологические проявления. // Медицина Казахстана. 2007. №3, с. 32-35.
- Сагиндикова Г.Е, Коган Е.А., Флигель Д.М., Телеуов М.К. Роль матриксных металлопротеиназ в патогенезе и морфогенезе фиброзно-кавернозного туберкулеза легких у лиц, длительное время проживавших на радиоактивно загрязненных территориях Семипалатинской области Казахстана. // Архив патологии, 2007, №3, стр.34-37.
- Сагиндикова Г.Е, Коган Е.А., Сатбаева Э.Б., Парамонова Н.Б. Матриксные металлопротеиназы и их ингибиторы в процессах ангиогенеза, фиброза и дисрегенерации эпителия при хронических заболеваниях легких у лиц, длительное время проживавших на радиоактивно-загрязненных территориях Семипалатинской области Казахстана.// Российский Биомедицинский журнал Medline.ru. 2007. том 8. статья №44. с. 476-489.
- Сагиндикова Г.Е., Коган Е.А., Шаханов Т.Е. Характеристика заболеваемости и смертности от хронических заболеваний легких у населения Семипалатинского региона и их морфологические проявления. // Пульмонология, 2007, №3. с. 87-92.
- Сагиндикова Г.Е., Е.А. Коган, Сатбаева Э.Б., Парамонова Н.Б. Различные морфологические варианты предрака легкого у лиц, длительное время проживавших на радиоактивно-загрязненных территориях Семипалатинской области Казахстана и роль матриксных металлопротеиназ. III Конгресс Евроазиатского Респираторного Общества. // Сборник трудов конгресса. Астана. 6-8 мая, 2007. с. 78.
- Сагиндикова Г.Е., Коган Е.А., Сатбаева Э.Б. Различные морфологические варианты рака легкого развившегося у лиц, длительно проживавших на радиоактивно-загрязненных территориях Семипалатинской области Казахстана и иммуногистохимия матриксных металлопротеиназ. III Конгресс Евроазиатского Респираторного Общества. // Сборник трудов конгресса. Астана. 6-8 мая,2007. с.78.
- Сагиндикова Г.Е., Коган Е.А. Морфо- и патогенез фиброзно-кавернозного туберкулеза легких у лиц, длительное время проживавших на радиоактивно-загрязненных территориях Семипалатинской области Казахстана. III Конгресс Евроазиатского Респираторного Общества. // Сборник трудов конгресса. Астана. 6-8 мая, 2007. с. 138.
- Sagindikova G., Kogan E. Lung carcinoma in persons lived for long time at radioactive contaminated of Semipalatinsk region (Kazakhstan). // European Respiratory Journal. 12-th ERS Annual Congress. Stockholm, Sweden, September 14-18, 2002. - Vol. 20. p.14.
- Sagindikova G., Kogan E. Lung cancer in persons lived at radioactive-polluted territories of Semipalatinsk region (Kazakhstan). // Histopathology. XXIVth International Congress of the International Academy of Pathology. Amsterdam, The Netherlands, October 5-10, 2002. – Vol. 41, Supplement 1.– P. 192.
- Sagindikova G., Kogan E. Lung cancer and background disease in persons lived at radioactive-polluted territories of Semipalatinsk region (Kazakhstan). // Journal of Histochemistry and Cytochemistry. V. 52. Sup.1 24-28 July 2004. р. 33. 12th International Congress of Histochemistry and Cytochemistry. San-Diego La Jolla California (ICHC)
- Sagindikova G., Kogan E. Lung cancer in Semipalatinsk region of Kazakhstan with high radiation level. UICC World Conference for Cancer Organisation. Dublin. Ireland. November 17-19 2004. V. 21. р. 38.
- Sagindikova G., Kogan E. Imunohistochemistry of IGF family members in lung cancer in persons lived in the radioactive-polluted Semipalatinsk territories of Kazakhstan. // European Respiratory Journal. 14-th ERS Annual Congress. Glasgow. Scotland, September 4-8, 2004. - Vol. 24. p.47.
- Sagindikova G., Kogan E. Morphology of the lung cancer in persons lived at radioactive-polluted territories of Semipalatinsk region (Kazakhstan). // Пульмонология. 2004. Доп. Выпуск. Russian respiratory Society. 14-th National Congress on Lung Diseases; International Union against Tuberculosis and Lung Diseases (IVATLD); 3-rd Congress of European Region. Moscow. p.161.
- Sagindikova G., Kogan E. Chronic bronchitis in persons lived at radioactive-polluted territories of Semipalatinsk region (Kazakhstan). // Пульмонология. 2004. Доп. Выпуск. Russian respiratory Society. 14-th National Congress on Lung Diseases; International Union against Tuberculosis and Lung Diseases (IVATLD); 3-rd Congress of European Region. Moscow. p.161.
- Sagindikova G., Kogan E. Pulmonary tuberculosis in persons lived at radioactive-polluted territories of Semipalatinsk region (Kazakhstan). // Пульмонология. 2004. Доп. Выпуск. Russian respiratory Society. 14-th National Congress on Lung Diseases; International Union against Tuberculosis and Lung Diseases (IVATLD); 3-rd Congress of European Region. Moscow. p.25.
- Sagindikova G., Kogan E. Clinicomorphological peculiarities of chronic bronchitis in persons lived at radioactive-polluted territories of Semipalatinsk region (Kazakhstan). Intercontinental Congress of Pathology. June 9-13. 2004. Iguassu. Brazil 2004. p. 353.
- Sagindikova G., Kogan E. Clinicomorphological peculiarities of Pulmonary tuberculosis in persons lived at radioactive-polluted territories of Semipalatinsk region (Kazakhstan). Australia 2004. proc. Natl. acad. Sci. USA. Vol. 100. N4. p. 244.
- Sagindikova G., Kogan E. Particularity of chronic diffuse lung disease in patients lived at radioactiv-polluted territories of Semipalatinsk region.//Virchovs Archiv. Vol. 447. N2. 2005. 20-th European Congress of Pathology. Paris, September 3-8, 2005. p.387-388.
- Sagindikova G., Kogan E. Diseases, mortality and morphology of the chronic diffusion lung diseases in persons lived at radioactive-polluted territories of Semipalatinsk region over a long period of time. // European Respiratory Journal. 15-th ERS Annual Congress. Copenhagen, Denmark, September 17-21, 2005. - Vol. 26. p.96.
- E.Kogan, G.Sagindikova. Matrix metalloproteinases and angiogenesis in various morphological types of precancer of the lung in patients from Semipalatinsk region of Kazakhstan with high radiation level. 5-th International Symposium on Targeted Anticancer Therapies (TAT). Amsterdam, The Netherlands, March 8-10, 2007. р.501.
Список используемых сокращений
ААГ - атипическая аденоматозная гиперплазия
АБГ – атипическая базальноклеточная гиперплазия
АК - аденокарцинома
БКГ - базальноклеточная гиперплазия без атипии
БКТ - бокаловидноклеточная трансформация
БЭБ – бронхоэктатическая болезнь
ГНК – гиперплазия нейроэндокринных клеток
DIII - дисплазия III бронхиального эпителия
МРЛ – мелкоклеточный рак легкого
МФ - макрофаги
НМРЛ – немелкоклеточный рак легкого
НЭГ – нейроэндокринная гиперплазия
НЭД – нейроэндокринная дифференцировка
ПМ - плоскоклеточная метаплазия
ПРЛ – плоскоклеточный рак легкого
ПЯЛ - палочкоядерные лейкоциты
РЛ – рак легкого
ФА – фиброзирующий альвеолит
ФКТ – фиброзно-кавернозный туберкулез
ХДЗЛ – хронические диффузные заболевания легких
ХОБЛ - хроническая обструктивная болезнь легких
MMPs - матриксные металлопротеиназы
TIMP - тканевой ингибитор MMPs
TGF – трансформирующий фактор роста
VEGF – сосудистый эндотелиальный фактор роста

