Планирование исследований и анализ зависимостей доза-эффект токсичных и лекарственных веществ
На правах рукописи
ПОПОВА Елена Борисовна
Планирование исследований и анализ зависимостей «доза-эффект» токсичных и лекарственных веществ
14.03.04 – токсикология
14.03.06 – фармакология, клиническая фармакология
Автореферат диссертации на соискание ученой степени
доктора медицинских наук
Санкт-Петербург - 2010
Работа выполнена в научно-исследовательской лаборатории лекарственной и экологической токсикологии научно-исследовательского центра Военно-медицинской академии им. С.М. Кирова
Научные консультанты:
доктор медицинских наук профессор академик РАМН Г.А.Софронов
доктор медицинских наук профессор С.В.Криштопенко
Официальные оппоненты:
доктор медицинских наук профессор
доктор медицинских наук профессор
Ведущее учреждение:
Зашита состоится «22» октября 2010 г. В 10-00 на заседании на заседании совета по защите докторских и кандидатских диссертаций Д 215.002.11 в ФГОУ ВПО «Военно-медицинския академия им. С.М. Кирова» Министерства обороны Российской Федерации (194044, Санкт-Петербург, ул. акад. Лебедева, дом 6)
С диссертацией можно ознакомиться в фундаментальной библиотеке ФГОУ ВПО «Военно-медицинския академия им. С.М. Кирова» Министерства обороны Российской Федерации
Автореферат разослан « ____ » ____________2010 г.
Ученый секретарь совета
доктор медицинских наук профессор
ГОЛОВКО Александр Иванович
Актуальность проблемы. Проблема исследования степени проявления регистрируемого эффекта при воздействии заданной дозы токсичного вещества, лекарственного препарата, проникающей радиации или любого иного агента (фактора), определяемая как зависимость «доза-эффект» (или функция эффективности), является основополагающей в токсикологии, фармакологии, радиобиологии, биохимии, микробиологии и в других областях медицины и биологии. Она уже в течение многих десятилетий удостоена пристального внимания как в плане теоретического понимания ее сущности, так и поисков практических способов адекватного решения путем разработки приемлемых методов построения зависимости «доза-эффект» по результатам выполненных исследований на основе имеющихся реальных возможностей математической статистики и компьютерной техники. В современных проектах токсикологических исследований и разработки новых лекарственных средств установление зависимости между дозой и эффектом имеет определяющее значение. Основу решения этой проблемы составляет способ планирования исследований, построения и анализа зависимости «доза-эффект» (функции эффективности), поскольку зависимость «доза-эффект» содержит информацию о проявлениях индивидуальной чувствительности к исследуемому агенту, и служит отражением общих механизмов его токсического и фармакологического взаимодействия с живым организмом или его отдельными субстанциями. По функции эффективности вычисляется средне-эффективная доза (ЕД50). Особое значение этот показатель приобрел по причине его использования для решения экспертных вопросов, преимущественно, в области токсикологии, экспериментальной фармакологии и радиобиологии. Именно поэтому средне-эффективная доза как статистическая величина должна в полной мере отвечать максимально жестким метрологическим критериям корректности, надежности, адекватности и состоятельности с сохранением допустимости ее определения при минимально возможном объеме экспериментальных исследований, особенно в плане привлечения пациентов, использования лабораторных животных и иных объектов.
До настоящего времени для построения зависимости «доза-эффект» и расчета ЕД50 применяется методология пробит-анализа преимущественно в модификациях Литчфилда-Вилкоксона (Беленький М.Л., 1963) и Финни (Finney D.J., 1979, 1985; Debanne S.M., Haller H.S., 1985), которая по своей сути предназначена исключительно для оценки линейных дозовых моделей и выдвигает ряд граничных условий в виде создания для каждой испытанной дозы установленной численности (не менее 6 наблюдений) по возможности однородных групп тест-объектов, что существенно сужает возможности анализа широкого спектра проявлений нелинейных зависимостей «доза-эффект», в частности целого направления, получившего в токсикологии название «парадоксальной токсичности».
В существующих пробит-методах проблема количественной оценки влияния погрешностей исходных данных на проявление зависимости «доза-эффект» не рассматривается, что приводит к метрологической неопределенности и полному отсутствию контроля качества искомых конечных показателей.
Отдельную проблему в оценке зависимости «доза-эффект» составляет разработка способов построения общей функции эффективности при одновременном воздействии двух и более исследуемых агентов. Разработка проблемы исследования одновременного действия нескольких разных агентов на биологические объекты считается наиболее актуальной и трудной уже только по той простой причине, что в процессе жизнедеятельности биологические объекты постоянно находятся под воздействием физических, химических или биологических факторов. Практически вся лекарственная терапия основана на принципах одновременного действия (взаимодействия) нескольких лекарственных препаратов для достижения лечебного эффекта. Особо важное значение проблеме взаимодействия веществ придается в токсикологии при разработке антидотов и изучении механизмов токсичности.
Построение функций эффективности, на основании которых можно было бы находить оптимальные эффективные и безопасные дозы лекарственных препаратов должно стать основой всей системы клинических исследований новых лекарственных средств. Но до настоящего времени в клинических исследованиях попытки установить зависимость «доза-эффект» ограничиваются только испытаниями двух или в очень редких случаях трех отдельных доз лекарственного препарата. Ни для одного лекарственного препарата так и не построена зависимость «доза-эффект» в допустимом для применения диапазоне доз. Соответственно, неизвестны математически и метрологически доказанные оптимальные клинически эффективные дозы, а количественный показатель общей погрешности проведения клинического исследования до настоящего времени не вошел в практику.
Таким образом, следует объективно признать, что на современном этапе развития токсикологии и клинической фармакологии проблема построения и анализа зависимости «доза-эффект» не имеет адекватного и практически приемлемого решения, что существенно сказывается на достоверности и качестве разносторонних оценок токсичных и лекарственных веществ.
Анализ современных методов математической статистики и прикладной теории вероятностей позволил предположить о возможности применения для решения проблемы нового метода ядерной оценки регрессии, адаптированного для возможности построения функций эффективности в работах М.С.Тихова (1993), С.В.Криштопенко, М.С.Тихова (1997).
Цель состоит в создании новой комплексной системы планирования исследований, построения и анализа функций эффективности (зависимостей «доза-эффект») токсичных и лекарственных веществ, основанной на применении метода ядерной оценки регрессии для определения вероятностей эффектов по результатам независимых единичных испытаний.
Для достижения указанной цели было необходимо решить следующие основные задачи:
1. Разработать комплексную систему планирования исследований и способ построения функции эффективности токсичных и лекарственных веществ по результатам независимых единичных испытаний на основе ядерной оценки регрессии.
2. Провести исследование влияния ошибок введенных доз на вид зависимости «доза-эффект» и результаты оценок конечных показателей.
3. Обосновать алгоритм определения средне-эффективной дозы (ЕД50) при минимально возможном числе испытаний.
4. Разработать систему планирования исследований и анализа зави-симостей «доза-эффект» при взаимодействии двух и более веществ.
5. Обосновать применение зависимостей «доза-эффект» в клинических исследованиях лекарственных средств.
Положения, выносимые на защиту:
1. Разработанная комплексная система оценки зависимости «доза-эффект» на основе ядерной оценки регрессии позволяет проводить построение и анализ любых видов функций эффективности токсичных и лекарственных веществ по результатам независимых единичных испытаний.
2. Разработанный посредством моделирования ситуаций на основе ядерной оценки регрессии алгоритм предназначен для определения средне-эффективной дозы (ЕД50) при минимально возможном числе испытаний на 10-12 объектах.
3. Система планирования исследований на основе ядерной оценки регрессии позволяет проводить построение и анализ зависимостей «доза-эффект» при взаимодействии двух веществ.
4. Новый показатель – оптимальная клинически эффективная доза (ОКЭД), определяемый по зависимости «доза-эффект», построенной по результатам клинических испытаний, рекомендуется в качестве критерия оценки оптимальной дозы лекарственного препарата, предназначенной для применения в клинической практике.
5. Разработанные теоретические положения и практический алгоритм системы планирования и анализа зависимостей «доза-эффект» позволяют существенно повысить качество и сократить объем проведения токсикологических и клинических исследований, обеспечивая высокий уровень надежности и достоверности искомых показателей.
Научная новизна работы заключается в теоретическом обосновании новой комплексной системы планирования исследований и способа построения функции эффективности токсичных и лекарственных веществ по результатам независимых единичных испытаний на основе ядерной оценки регрессии. Она отличается от существующих методов (пробит-анализа в модификациях Литчфилда-Вилкоксона и Финни, методов Фишера, Прозоровского, Фрумина и других) строгой статистической обоснованностью и адекватностью, что обеспечивает требуемый уровень надежности конечных оценок, и позволяет определять статистически состоятельные оценки искомых показателей эффективных доз и вероятностей эффектов (среднее значение, стандартную ошибку средней и доверительный интервал) в любой точке функции эффективности, которые применяются для выполнения последующих сравнений между различными показателями (проведение оценки достоверности различий, вычисление коэффициентов и других). При этом алгоритм построения функции эффективности не предполагает использование изначальной (априорной) математической модели, как того требуют существующие методы, основанные на стандартных моделях, таких как линейные, экспоненциальные, логистические, распределение Вейбулла и других.
Вид зависимости «доза-эффект» определяется не только индивидуальной чувствительностью тест-объектов к каждой отдельно испытанной дозе, которая формируется путем реализации механизмов фармакокинетики и фармакодинамики исследуемого агента, но и величиной погрешности исходных данных (введенных доз и регистрируемых эффектов).
При статистическом сравнении двух доз и вычислении коэффициентов обосновано применение показателя трансгрессии.
Получила дальнейшее развитие теория построения и анализа функций изоэффективности при одновременном воздействии на организм двух веществ.
Обосновано новое направление в системе планирования и выполнения клинических испытаний лекарственных препаратов, включающее построение и анализ зависимостей «доза-эффект».
Практическая значимость работы. Предложен к практическому применению комплекс статистико-биометрических методов, составляющих новую систему, позволяющую при минимальных граничных условиях, на минимально возможном числе испытаний с учетом погрешностей вводимых доз выполнять построение зависимостей «доза-эффект» (функций эффективности) любых видов, в том числе и парадоксальных, проводить их классификацию, и определять любые категории эффективных доз, обладающие свойствами случайных величин, пригодных для сравнительных оценок, нахождения коэффициентов и других параметров доз при сокращении объема исследований в 2-5 раз.
Разработан на основе ядерной оценки регрессии алгоритм определения средне-эффективной дозы (ЕД50) при минимально возможном числе испытаний на 10-12 объектах. Для его практического применения создана специальная таблица, устанавливающая правила последовательного испытания доз.
Разработана система планирования исследований, построения и анализа зависимостей «доза-эффект» (функций изоэффективности) при взаимодействии двух веществ.
Предложен и обоснован для практического использования новый показатель – оптимальная клинически эффективная доза (ОКЭД), в качестве критерия оценки оптимальной дозы лекарственного препарата, предназначенной для применения в клинической практике.
Апробация работы. Основные положения работы доложены и обсуждены на Всероссийской научно-практической конференции «Диагностика, лечение и профилактика артериальной гипертензии и ишемической болезни сердца у военнослужащих» (Нижний Новгород, 2000); Всеармейской научно-практической конференции «Медицинские последствия экстремальных воздействий на организм» (Санкт-Петербург, 2000); Научно-практической конференции, посвященной столетию со дня рождения академика РАМН В.А. Рязанова «Теоретические основы и практические решения проблем санитарной охраны атмосферного воздуха» (Москва, 2003); Научно-практической конференции, посвященной 130-летию создания госсанэпидемслужбы Московской области (Москва, 2003); II съезде токсикологов (Москва, 2003); Научно-практической конференции «Актуальные вопросы радиационной гигиены» (Санкт-Петербург, 2004); II Всемирном конгрессе по иммунопатологии и аллергии (Москва, 2004); II Международной научно-практической конференции «Экология: образование, наука, промышленность и здоровье» (Белгород, 2004); VIII Республиканской научно-практической конференции с международным участием, посвященной 60-летию Рязанского государственного медицинского университета им. акад. И.П. Павлова «Социально- гигиенический мониторинг здоровья населения» (Рязань, 2004); Первом всероссийском научном форуме «Инновационный технологии медицины XXI века. Медицинские компьютерные технологии» (Москва, 2005).
Реализация результатов исследования. Основные научные положения и выводы нашли отражение в педагогическом процессе и научной работе на кафедре военной токсикологии и медицинской защиты Военно-медицинской академии им. С.М. Кирова, в исследовательской работе НИИ профилактической медицины ГОУ ВПО «Нижегородской государственной медицинской академии» и ФГУН «Нижегородский научно-исследовательский институт гигиены труда и профессиональных заболеваний» Роспотребнадзора, а также в компьютерной программе «Доза-эффект» (Свидетельство об официальной регистрации программы для ЭВМ № 2003611598).
Публикации. По теме диссертации изданы в соавторстве с С.В.Криштопенко и М.С.Тиховым монографии «Парадоксальная токсичность» (изд-во Нижегородской государственной медицинской академии, 2001) и «Доза-эффект» (изд-во «Медицина», 2008), опубликовано 12 статей в центральных изданиях, одна статья принята к публикации в «Токсикологическом вестнике» в феврале 2010 г. и 17 работ в научных сборниках.
Структура и объем диссертации. Диссертация состоит из введения, 6 глав, заключения, выводов, практических рекомендаций, списка литературы и приложений. Объем работы – 254 страницы машинописного текста. Иллюстративная часть включает 32 рисунка и 13 таблиц. Список литературы включает 395 наименования, из которых 208 работ на русском языке и 187 на иностранном.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования.
Исследования, направленные на решения поставленных задач, выполнялись по трем направлениям. Первое направление включало проведение лабораторных исследований на белых крысах с целью получения исходных данных для построения зависимостей «доза-эффект» по технологии ядерной оценки регрессии и расчета средне-эффективных доз при помощи пробит-метода по заданным признакам применительно к конкретным задачам.
Эксперименты выполнялись на беспородных белых крысах обоего пола массой тела 0.180...0.260 кг. Животные содержались в стандартных условиях вивария на общепринятом пищевом рационе в соответствии с международными требованиями, предъявляемыми к содержанию животных.
Для получения исходных данных с целью построения разных функций эффективности ацетилхолина йодида (АХ) препарат вводился животным подкожно в водном растворе в интервале доз от 0.3 до 0.7 мг/кг. В зависимости от введенной дозы АХ у белых крыс в течение первых 5 минут достоверно и точно распознаются два эффекта: хромодакриорейный и кардиотоксический. Эффекты регистрировались в альтернативной форме (0 – нет эффекта, 1 – есть эффект).
Феномен хромодакриореи (ХДР) у белых крыс учитывался по истечению капли слезной жидкости из глаза (появление жидкости на ватном тампоне).
Оценка кардиотоксического эффекта у белых крыс проводилась путем регистрации ЭКГ с использованием полианализатора ПА 3-01 с модифицированной нами системой электродов для ввода кардиосигнала. Было применено отведение электрических потенциалов сердца, при котором активные игольчатые электроды вводились животным подкожно в области шейного и поясничного отделов позвоночника, а нулевой электрод вводился в область грудного отдела. При таком отведении все элементы ЭКГ чётко записывались на ленту. В качестве кардиотоксического эффекта АХ принималось урежение частоты сердечных сокращений. Чтобы определить параметры физиологической нормы параметры ЭКГ были определены на 279 белых крыс и приведены в таблице 1.
Таблица 1
Границы вероятностных диапазонов физиологических колебаний показателей ЭКГ у интактных белых крыс (Р=0.01 —критерий односторонний)
| Показатели функций сердца | Значения левых границ диапазонов | Значения правых границ диапазонов |
| PQ, мс | 36.8 | 51.8 |
| QT, мс | 61.1 | 84.9 |
| RR-80, мс | 3.4 | 14.6 |
| ЧСС | 416 | 575 |
С учетом одного сигмального отклонений от середины распределения можно выделить диапазон, включающий 68% всех членов исследованной выборки. Этот диапазон можно расценивать как физиологическую норму. Например, у белых крыс для показателя ЧСС он составляет 416...575, значения ниже найденного уровня следует рассматривать как проявление патологических воздействий, в частности, кардиотоксические эффекты
В экспериментальную группу для построения зависимостей «доза-эффект» АХ по ядерной оценки регрессии по эффекту воспроизведения хромодакриореи было включено 18 и по кардиотоксическому эффекту – 23 белые крысы.
В экспериментальную группу для построения зависимостей «доза-эффект» пилокарпина по ядерной оценки регрессии по эффекту воспроизведения хромодакриореи и по кардиотоксическому эффекту было включено по 23 белые крысы.
При определении средне-эффективной дозы по кардиотоксическому эффекту АХ при минимально возможном числе испытаний было использовано 10 белых крыс, а при параллельной оценке такой дозы пробит-методом было использовано 24 животных.
Оценка средне-эффективной дозы по феномену ХДР методом двух точек по технологии ядерной оценки регрессии была выполнена на 12 белых крысах.
Для определения средне-эффективной дозы при помощи пробит-метода по эффекту ХДР было использовано 24 белые крысы.
Экспериментальные исследования проявления эффекта хромодакриореи у белых крыс при одновременном воздействии ацетилхолина (как основного агента) и атропина (как модулирующего агента) выполнялись следующим образом. Водные растворы препаратов в разных дозах вводились животным подкожно. Атропин вводился за 30 минут до введения ацетилхолина. Появление эффекта ХДР учитывалось в течение 5 минут после введения ацетилхолина. В опытах было использовано 207 белых крыс. Дозы препаратов подбирались с учетом необходимости равномерного перекрытия поддиапазонов доз основного агента (ацетилхолина) дозами модулирующего агента (атропина).
Второе направление включало исследование влияния ошибок исходных данных на вид зависимости «доза-эффект». Для изучения данной проблемы было спланировано и выполнено две серии исследований, в которых изначально предполагалось существование как погрешностей введенных доз, так и погрешностей регистрации заданных эффектов.
В первой серии исследований изучалась зависимость «доза-эффект» по тестам индивидуальной чувствительности человека к адреналину. Исследования были выполнены при участии 354 добровольца: мужчины в возрасте от 18 до 24 лет.
Чувствительность определялась по результатам накожной капельной адреналиновой пробы, методика проведения которой изложена в методических рекомендациях «Лекарственный шок (клиника, патоморфология, лечение и профилактика)», утвержденных начальником Главного управления лечебно-профилактической помощи МЗ СССР 24.11.87 г. № 10-11/153.
Эффекты оценивали по появлению или отсутствию белого пятна на коже предплечья в течение 5 минут после нанесения раствора адреналина гидрохлорида заданной концентрации, которую получали путем разведения официнального 0.1% раствора (серия № 50297) в физиологическом растворе.
Вторая серия исследований включала изучение влияния погрешностей исходных данных на зависимость «доза-эффект» комплексного кремнийсодержащего состава по критерию восстановления психосоматического статуса у лиц с хронической алкогольной интоксикацией после купирования абстинентного состояния и была выполнена в соавторстве с А.М.Семонюк.
Для коррекции психосоматического статуса организма у лиц с хронической алкогольной интоксикацией в постабстинентном периоде был применен комплексный состав кремнийсодержащих препаратов «Симетикон» и «Энтеросгель», который готовили путем смешивания их равных весовых частей непосредственно перед употреблением внутрь. Этот состав получил название «Си-Эн».
Комплексный кремнийорганический состав «Си-Эн» назначали в диапазоне разовых доз от 0.10 до 1.00 г/кг (3 раза в сутки) как дополнительное средство лечения хронической алкогольной интоксикации на фоне стандартной (базовой) терапии в течение 14 дней с момента купирования симптомов абстинентного состояния. Для каждого пациента назначенная доза оставалась неизменной в течение всего периода наблюдения.
В качестве конечной точки регистрации эффекта использовался интегральный показатель психосоматического статуса организма (ИППСС), разработанный для практического применения А.М.Семонюк (2005).
В исследуемую группу включали пациентов, у которых исходный интегральный показатель психосоматического статуса (ИППСС) находился в пределах от 40 до 100%. Критерием эффективности коррекции психосоматического статуса организма составом «Си-Эн» являлось увеличение уровня ИППС до 200%. Эффект по истечению срока наблюдения регистрировался в альтернативной форме (0 – нет эффекта, 1 – есть эффект). В исследование для построения зависимости «доза-эффект» было включено 50 пациентов (40 мужчин и 10 женщин в возрасте от 21 до 54 лет) с хронической алкогольной интоксикацией после купирования абстинентного состояния.
Третье направление включало построение и анализ зависимости «доза-эффект» по данным клинического анализа архивных историй болезни пациентов с целью подбора репрезентативных групп больных по изучаемой патологии.
Задачей первого блока исследований в данном направлении являлось определение оптимальных доз реактиватора ацетилхолинэстеразы аллоксима, используемого в качестве модификатора гемосорбента в комплексном лечении острых бытовых отравлений фосфорорганическими инсектицидами (ФОИ). Исследование выполнено в соавторстве с Курышевой М.А.
Эта задача решалась путем планирования исследований и получения исходных данных для построения и анализа зависимости «доза-эффект» исследуемого препарата и ее сравнения с уровнем стандартной терапии по технологии ядерной оценки регрессии.
Было проанализировано 75 пациентов с интоксикацией ФОИ в период от 2 до 24 ч с момента отравления. Всем больным на догоспитальном этапе проводилось промывание желудка с последующим введением активированного угля. На фоне форсированного диуреза использовались холинолитики, реактиваторы холинэстеразы, гемокарбоперфузия и симптоматические средства.
По лечению в стационаре пациенты были разделены на две сопоставимые и однородные группы. В первую группу вошли 40 больных, которым на фоне стандартной терапии была проведена обычная гемокарбоперфузия (контрольная группа). Второй группе (35 больным) гемокарбоперфузия выполнялась через гемосорбент, модифицированный аллоксимом (основная группа). Гемосорбент перед проведением гемокарбоперфузии предварительно обрабатывали (модифицировали), пропуская через него в течение 20-40 мин изотонический раствор натрия хлорида, содержащий 0.15-0.30 г/л аллоксима. Гемокарбоперфузию проводили путем вено-венозного способа подключения больного к аппарату с использованием центральных вен (подключичной и бедренной).
До и после гемокарбоперфузии оценивалось клиническое состояние больных, определялись активность ацетилхолинэстеразы, лейкоцитарный индекс интоксикации, индекс сдвига нейтрофилов. Клинический эффект учитывался в альтернативной форме.
Задачей второго блока исследований являлась оценка антиангинального эффекта совместного применения метопролола (препарата с гемодинамическим эффектом) и триметазидина (препарата с метаболическим эффектом) в комплексной антиангинальной терапии больных стабильной стенокардией. Исследования были выполнены в соавторстве с М.А.Шаленковой. Эта задача решалась путем построения и анализа на одном графике двух функций эффективности (исследуемого и контрольного препарата) и их сравнения по эффектам в комплементарных точках (в равных дозах) по технологии ядерной оценки регрессии.
Для решения поставленной задачи в течение 30 дней наблюдались 108 больных стабильной стенокардией II-III клинико-функционального класса. Диагноз ИБС, стабильной стенокардии установлен клинически и подтвержден перенесенным ранее инфарктом миокарда, данными велоэргометрической пробы, селективной коронароангиографии (у части больных). Больные были разделены на две группы, приблизительно одинаковые по тяжести стабильной стенокардии, выраженности хронической сердечной недостаточности и сопутствующим заболеваниям. Больные основной группы (59 человек) получали дополнительно к стандартной терапии стабильной стенокардии триметазидин в фиксированной дозе 70 мг в сутки. Больные контрольной группы (49 человек) получали только стандартную терапию, которая согласно рекомендациям по лечению стабильной стенокардии (Gibbons R.J. et al., 1999, 2003), включала метопролол 25-150 мг в сутки, нитраты (нитроглицерин, нитроспрей, нитросорбид, кардикет) по требованию при болях за грудиной, аспирин 75 мг в сутки, ингибитор АПФ эналаприл 2.5-20 мг в сутки.
Положительная динамика регистрировалась в течение 1 месяца в виде снижения частоты приступов стенокардии (не менее, чем на 50% от исходного уровня), уменьшения потребности в короткодействующих нитратах (не менее, чем на 50% от исходного уровня), снижения систолического и диастолического артериального давления, урежения частоты сердечных сокращений, уменьшения клинико-функционального класса стабильной стенокардии, уменьшения функционального класса хронической сердечной недостаточности и увеличения толерантности к физической нагрузке. Общий объем выполненных исследований приведен в табл. 2.
Таблица 2
Общий объем выполненных исследований
| Виды исследований | Число объектов | |
| Пациенты | Белые крысы | |
| 1 | 2 | 3 |
| Определение границ физиологической нормы показателей ЭКГ | 279 | |
| Построение зависимости «доза-эффект» АХ по эффекту ХДР по технологии ядерной оценки регрессии | 18 | |
| Продолжение табл. 2 | ||
| 1 | 2 | 3 |
| Определение ЕД50 АХ по эффекту ХДР пробит-методом | 24 | |
| Построение зависимости «доза-эффект» АХ по кардиотоксическому эффекту по технологии ядерной оценки регрессии | 23 | |
| Определение ЕД50 АХ по кардиотоксическому эффекту при минимальном числе испытаний | 10 | |
| Определение ЕД50 АХ по кардиотоксическому эффекту пробит-методом | 24 | |
| Построение зависимости «доза-эффект» пилокарпина по эффекту ХДР по технологии ядерной оценки регрессии | 23 | |
| Построение зависимости «доза-эффект» пилокарпина по кардиотоксическому эффекту по технологии ядерной оценки регрессии | 23 | |
| Построение зависимости «доза-эффект» АХ и атропина по эффекту ХДР по технологии ядерной оценки регрессии | 207 | |
| Построение зависимости «доза-эффект» по результатам накожной капельной адреналиновой пробы | 354 | |
| Построение зависимости «доза-эффект» состава «Симетикон-Энтеросгель» у больных в постабстинентном периоде хронической алкогольной интоксикации | 50 | |
| Построение зависимости «доза-эффект» аллоксима в комплексном лечении острых отравлений ФОИ | 75 | |
| Построение зависимости «доза-эффект» метопролола и метопролола в сочетании с триметазидином у больных стабильной стенокардией | 108 | |
| Всего | 587 | 631 |
Планирование исследования и статистическая обработка исходных данных проводилась с использованием методов одномерного и многомерного статистического анализов.
Основанием применения методов параметрической статистики для обработки экспериментальных данных является соответствие распределения исследуемого показателя нормальному закону (Н.А.Плохинский,1970; Лакин Г.Ф.,1980; Львовский Е.Н., 1982).
Одномерный статистический анализ включал определение средних значений показателей, величин их варьирования (среднего квадратического отклонения, стандартной ошибки и коэффициента вариации), а также оценку достоверности их различия при помощи параметрического t-критерия Стьюдента (Лакин Г.Ф., 1990). Основанием применения методов параметрической статистики для обработки исходных данных было принято соответствие распределения выборки исследуемого показателя нормальному закону (Плохинский Н.А., 1970; Лакин Г.Ф., 1990).
Планирование исследований и построение функции эффективности токсичных и лекарственных веществ осуществлялось на основе методологии, разработанной в соавторстве с С.В.Криштопенко и М.С.Тиховым.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Для обоснования положений, выносимых на защиту, были выполнены два блока исследований, из которых первый был предназначен для теоретической разработки многофункционального алгоритма математического построения и анализа зависимостей «доза-эффект», а второй блок включал практические исследования возможностей применения разработанной новой технологии для решения конкретных типовых задач экспериментальной токсикологии и клинических исследований.
Теоретические основы новой технологии построения и анализа зависимости «доза-эффект» заключаются в следующих положениях.
Получение исходных данных и правила планирования исследований определяются, в основном, двумя факторами: реальными возможностями изучения явления и математическим способом получения конечных оценок. С этих позиций и рассмотрим исходные предпосылки проблемы изучения зависимости «доза-эффект» (функции эффективности).
После воздействия некоторой дозы исследуемого агента у тест-объекта объективно может быть зарегистрировано либо наличие эффекта, либо его отсутствие. Таким образом, соотношение «доза-эффект» на уровне биологического объекта является некоторым аналогом так называемого «черного ящика», у которого есть «вход» (введенная доза) и «выход» (эффект). Понятие «черный ящик» довольно широко применяется в математической статистике и других областях для обозначения неизвестных процессов внутри исследуемого объекта. Действительно, процессы фармакокинетики и фармакодинамики, происходящие в биологическом объекте после воздействия некоторой дозы исследуемого агента абсолютно до конца не могут быть определены. Реально фиксируется только конечный результат реализации этих процессов к заданному периоду наблюдения, то есть эффект.
Как результаты выполненных исследований по оценке зависимости «доза-эффект» предлагается использовать в качестве исходных данных пары показателей: испытанные (введенные) дозы и регистрируемые эффекты, выраженные в альтернативной форме (1 – есть эффект, 0 – нет эффекта). При этом ставилась цель не предъявлять граничных условий в отношении формирования однородных по дозам групп тест-объектов. Основным являлся принцип: каждый тест-объект выступает в качестве исходного элемента для построения функции эффективности и может не включаться в состав каких-либо однородных групп. В этом смысле и применяется термин «независимые единичные испытания».
На этом основании можно сделать весьма простой, но единственно истинный вывод о том, что для каждого тест-объекта существует некая единственная «индивидуальная доза», определяющая порог «индивидуальной чувствительности» к исследуемому агенту и напрямую связанная с проявлением эффекта (рис. 1).
![]()
. ..
РДД ИД РД
Рис. 1. Соотношения доз (РДД – реально действующая доза, ИД - индивидуальная доза, РД – расчетная доза), приводящее к «искажению» ожидаемого эффекта при больших величинах погрешности введенной дозы
Совершенно очевидно, что введенная доза подвергается внутри биологического объекта существенным и, как правило, неизвестным изменениям в результате процессов фармакокинетики. Реальный эффект вызывает совершенно иная доза, непосредственно воздействовавшая на органы-мишени и названная нами реально действующая доза (РДД). Если РДД окажется равной (или большей) индивидуальной дозе, то заданный эффект проявится. В противном случае, эффект наблюдаться не будет. Естественно, что напрямую количественно найти индивидуальную и реально действующую дозы для каждого тест-объекта практически невозможно. Кроме того, у каждого тест-объекта существует определенные соотношения между введенной и реально действующей дозами в соответствии с механизмами реализации элементов фармакокинетики и фармакодинамики. Обычно введенная в организм доза исследуемого агента несколько больше реально действующей дозы, так как имеют место ряд превращений (связываний с другими субстанциями организма) в соответствии с механизмами детоксикации ядов или деактивации лекарственных веществ. В отдельных случаях прослеживаются и более сложные превращения введенных доз. Например, в токсикологии для ряда токсичных веществ (метанол, этиленгликоль, отдельные фосфорорганические соединения и другие) известен феномен «летального синтеза», в результате реализации которого исходное вещество превращается в более токсичное и формирует конечный исход воздействия изначально введенной дозы.
Следовательно, в реальной ситуации происходит «смещение» (изменение) введенной дозы на некоторую неизвестную величину и ее трансформация в реально действующую дозу. Величина такого «смещения» у каждого тест-объекта для каждой введенной дозы исследуемого агента (это и есть истинный механизм реализации явления индивидуальной чувствительности) может быть как относительно постоянной, так и совершенно различной, что и лежит в основе формирования вида зависимости «доза-эффект» («кривой индивидуальной чувствительности»).
Поэтому положительный эффект является своеобразным индикатором факта равенства или превышения расчетной (введенной) дозы (с учетом ее превращения в реально действующую дозу) уровня индивидуальной чувствительности.
Естественно, что любая доза ![]() измеряется с ошибкой S0, причем относительная погрешность не должна превышать 33% согласно свойствам нормального распределения. Инструментально измерить суммарную ошибку нельзя, поскольку она формируется и погрешностью введенной дозы, и особенностями метаболизма агента, и ошибками регистрации эффекта. Пусть
измеряется с ошибкой S0, причем относительная погрешность не должна превышать 33% согласно свойствам нормального распределения. Инструментально измерить суммарную ошибку нельзя, поскольку она формируется и погрешностью введенной дозы, и особенностями метаболизма агента, и ошибками регистрации эффекта. Пусть ![]() нижняя граница, с которой начинается фиксируемый отклик организма (эффект - W). Эта и есть истинная гипотетическая индивидуальная доза, действующая на органы-мишени и отражающая индивидуальную чувствительность. В реальных исследованиях возможно только фиксировать факт отсутствия эффекта, если веденная доза после превращения в организме окажется меньше индивидуальной
нижняя граница, с которой начинается фиксируемый отклик организма (эффект - W). Эта и есть истинная гипотетическая индивидуальная доза, действующая на органы-мишени и отражающая индивидуальную чувствительность. В реальных исследованиях возможно только фиксировать факт отсутствия эффекта, если веденная доза после превращения в организме окажется меньше индивидуальной ![]() , или наоборот наличие эффекта, если
, или наоборот наличие эффекта, если ![]() .
.
Сущность метода ядерной оценки регрессии заключается в определении вероятности эффекта в середине заданного диапазона доз («окна просмотра» или ядра) по базовой формуле при нахождении в нем не менее 9 наблюдений (рис. 2). Последовательное передвижение «окна просмотра» по всему интервалу испытанных доз позволяет сформировать зависимость «доза-эффект» и определять статистические параметры любой дозы.
Рис. 2. Схема математического построения функции эффективности по результатам независимых единичных испытаний при помощи ядерной оценки регрессии (1 – основной диапазон, 2 – вспомогательный диапазон).
Посредством ядерной оценки регрессии в каждом основном диапазоне доз (рис. 2) определяется значение вероятности эффекта, соответствующее дозе в середине этого диапазона.
Если в основном диапазоне находится n значений доз (Xi) из общей выборки с соответствующими индикаторами альтернативного эффекта (Wi), то оценка вероятности эффекта в середине диапазона может быть найдена по формуле:
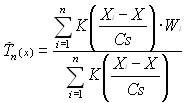 , (1)
, (1)
где Cs — величина (константа), задающая ширину «окна просмотра»;
X — значение эффективной дозы, находящейся в середине заданного диапазона испытанных доз;
n — число испытанных в заданном диапазоне доз.
Эта формула является базовой в методе ядерной оценки регрессии, так как она предназначена для определения вероятности эффекта в середине диапазона доз. Образно ее можно сравнить с тем кирпичиком, который является строительным материалом для функции эффективности. Константа Cs задает ширину «окна просмотра», и таким образом ограничивает основной диапазон, в котором производится оценка вероятности эффекта. По абсолютному значению эта константа равна половине ширины основного диапазона. Этот диапазон иллюстрируется на рис.2 под цифрой 1. Значение константы с определяет конечные оценки эффективной дозы. Константа Cs задает ширину «окна просмотра», и ограничивает основной диапазон, в котором производится оценка вероятности эффекта. При увеличении интервала доз в 2 раза необходимо провести не менее 12 испытаний.
Оптимальное значение константы Cs, формирующее размер основного диапазона доз, выбирается методом последовательных итераций по критериям адекватности и надежности искомой эффективной дозы, исходя из принципа минимальной достаточности.
Функция ядра K(v) определена в интервале 1 v 1 и равна
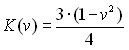 . (2)
. (2)
K((v–x)/Cs) полностью определена в допустимом интервале
xCs v x+Cs. Это и объясняет смысл константы Cs как ширины «окна просмотра», которое ограничивает основной диапазон (рис. 2).
Функция (2) в математической статистике называется ядром Епанечкова (Хардле В., 1993).
Оценка ![]() определяется как взвешенное среднее переменных отклика в фиксированной окрестности точки
определяется как взвешенное среднее переменных отклика в фиксированной окрестности точки ![]() . Оценка k-ближайших соседей представляет собой среднее взвешенное в изменяющейся окрестности. Эта окрестность определяется только теми значениями переменной х, которые являются k-ближайшими к
. Оценка k-ближайших соседей представляет собой среднее взвешенное в изменяющейся окрестности. Эта окрестность определяется только теми значениями переменной х, которые являются k-ближайшими к ![]() по евклидову расстоянию.
по евклидову расстоянию.
Технически данный алгоритм выполняется при помощи специальной компьютерной программы «Доза-эффект», разработанной С.В.Криштопенко и М.С.Тиховым.
Построение и анализ функции эффективности осуществляется независимо от ее вида (линейного или нелинейного) и обеспечивает адекватность, объективность, надежность, оптимальность и максимальное правдоподобие конечных искомых параметров.
При построении зависимости «доза-эффект» основной проблемой является выбор между испытанными дозами («шага»), который обеспечивал бы статистически адекватное определение эффективных доз (рис. 3).
Если интервал между испытанными дозами будет большой, например, больше 2, то перекрытие их распределений (показатель трансгрессии) будет незначительное, либо вообще не будет иметь место. В таких случаях значение ЕД50 будет определено как бы «на пустом месте», что не всегда исключалось при использовании пробит-анализа.
При малом интервале между испытанными дозами (при их различии меньше чем в 1.3 раза), будет наблюдаться взаимное проникновение распределений двух испытанных доз, что обеспечит достаточную точность показателя ЕД50. Только в этом случае расчетные эффективные дозы будут содержать биологическую информацию об уровне индивидуальной чувствительности в заданной точке функции эффективности.
Д1 ЕД50 Д2
а) Д2/Д1 > 2
Д1 ЕД50 Д2
б) Д2/Д1 < 1.3
Рис. 3. Соотношение распределений средне-эффективной дозы (ЕД50) и введенных доз (Д1 и Д2) при разных интервалах между ними
Преимуществом технологии ядерной оценки регрессии является построение функции эффективности с учетом ошибок исходных данных. Как уже было продемонстрировано, в исследовательской практике напрямую определить истинную величину ошибки дозы невозможно.
Величину этой ошибки можно установить косвенно по виду функции эффективности, которая будет иметь вид плавной возрастающей или убывающей линий при малых или допустимых величинах погрешностей доз.
В качестве примера приведем исследования индивидуальной чувствительности людей к адреналину. Для оценки воспроизводимости результатов в течение трех дней было выполнено 3 независимых исследования на однородных одинаковых по численности группах добровольцев. Каждую последующую испытанную концентрацию раствора увеличивали в 1.1 раза.
При задании нулевой погрешности доз зависимость «доза-эффект» имеет вид ломаной линии и практически не идентифицируется, что свидетельствует о ее нестабильности на всем диапазоне испытанных доз (рис. 4). Такое явление может наблюдаться только по причине существования значительно большей погрешности введенных доз, чем изначально заданная (в виде 0%) при построении зависимости «доза-эффект».
Зависимость «доза-эффект» при заданной 15% погрешности введенных доз по тем же исходным данным уже явно идентифицируется, но также

Рис. 4. Вид зависимости «доза-эффект» адреналина у людей по эффекту появления белого пятна на коже предплечья после нанесения одной капли раствора заданной концентрации при нулевой погрешности введенных доз.
не имеет стабильности, что свидетельствует о недостаточной величине заданной погрешности (рис. 5).
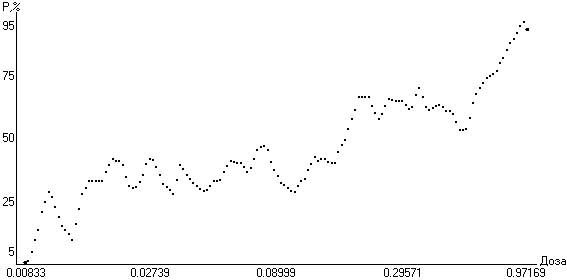
Рис. 5. Зависимость «доза-эффект» адреналина у людей по эффекту появления белого пятна на коже предплечья после нанесения одной капли раствора заданной концентрации при 15% погрешности введенных доз.
И только при величине погрешности введенных доз в 30% зависимость «доза-эффект» приняла вид относительно плавной линии (рис. 6), что подтверждает адекватность заданной величины погрешности исходных данных.

Рис. 6. Зависимость «доза-эффект» адреналина у людей по эффекту появления белого пятна на коже предплечья после нанесения одной капли раствора заданной концентрации при 30% погрешности введенных доз.
Для того, чтобы вывод о достоверном изменении эффективных доз в заданных точках функции эффективности был достаточно надежным, необходимо статистически доказать не только гипотезу о различиях этих доз, но и факт их действительного увеличения. Решение этой задачи предлагается проводить путем вычисления коэффициента отношения указанных доз:
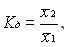 (3)
(3)
где ![]() — эффективные дозы в критических точках на функции эффективности.
— эффективные дозы в критических точках на функции эффективности.
Поскольку сами эффективные дозы являются статистическими случайными величинами, то частное от деления выборочных средних также имеет собственную ошибку. Ошибка отношения двух эффективных доз в математической статистике рассматривается как ошибка частного от деления выборочных средних с их ошибками (Лакин Г.Ф., 1990):
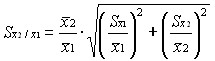 , (4)
, (4)
где ![]() — эффективные дозы;
— эффективные дозы; ![]() — ошибка эффективной дозы.
— ошибка эффективной дозы.
Для коэффициента отношения доз как случайной величины можно определить доверительный интервал заданного уровня надежности (=0.95):
![]() (5)
(5)
В том случае, если левая граница доверительного интервала для коэффициента отношения доз окажется больше 1, то это означает, что имеет место достоверное (Р0.05) увеличение второй (большей) дозы по сравнению с первой (меньшей) дозой. Данное условие гарантирует, что возрастание вероятности эффекта в заданном диапазоне доз на функции эффективности действительно связано с увеличением дозы и не является случайным.
Для адекватного и надежного применения экспертных оценок важно не только статистически доказать достоверность различия между двумя эффективными дозам и выявить достоверное увеличение одной дозы по сравнению с другой, но и установить абсолютную независимость распределений этих доз, которая позволяет гарантировать, что эффекты при воздействии одной дозы не связаны с возможным воздействием другой (сравниваемой) дозы. Количественно определить абсолютную независимость распределений двух эффективных доз возможно при помощи показателя трансгрессии, который и устанавливает степень расхождения распределений. Под трансгрессией понимается неполное разобщение двух распределений, при котором часть вариант оказывается общими, несмотря на то, что между средними арифметическими разница может быть статически достоверной (Лакин Г.Ф., 1990).
На рис. 7 показано, как правая сторона графика функции нормального распределения одной выборки и левая сторона другой взаимно проникают друг в друга, образуя часть общей площади, которая и называется трансгрессией.
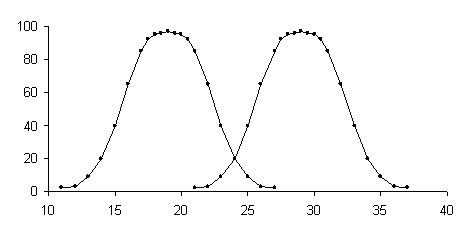
Рис. 7. Трансгрессия распределений двух выборок (заштрихована общая площадь распределений – трансгрессия)
Величина трансгрессии для нормально распределенных выборок рассчитывается по следующему алгоритму (Лакин Г.Ф., 1990):
 , (6)
, (6)
где n1 и n2 – объемы выборок; Р1 = 0.5 + 0.5Ф(t1) и Р2 = 0.5 + 0.5Ф(t2).
Значения функции Ф(t) находятся по таблицам интегралов вероятностей для разных значений t (Лакин Г.Ф., 1990), причем их следует брать с отрицательным знаком, если ![]() и
и ![]() .
.
Показатели нормированных отклонений t1 и t2 определяются как
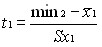 и
и 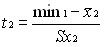 (7)
(7)
Если в качестве критического значения показателя трансгрессии для оценки абсолютной независимости распределений эффективных доз принять 5%, то крайние величины распределений min2 и min1 следует определить как ![]() и
и ![]() , где Sx – среднеквадратическое отклонение. При таких значениях крайних величин не более 5% площади одного распределения будет проникать в другое распределение, что можно расценивать как абсолютную независимость распределений выбранных эффективных доз.
, где Sx – среднеквадратическое отклонение. При таких значениях крайних величин не более 5% площади одного распределения будет проникать в другое распределение, что можно расценивать как абсолютную независимость распределений выбранных эффективных доз.
Предлагается для практического применения способ определения средне-эффективной дозы при минимально возможном числе испытаний.
Для получения достоверной и надежной оценки вероятности эффекта, близкой к 50% достаточно проверять одностороннюю гипотезу достоверности различий при Р0.05. В этом случае при числе наблюдений больше 7 возможно получать достоверную оценку вероятности эффекта 50% в середине заданного диапазона испытанных доз. А надежную средне-эффективную дозу (ЕД50), отвечающую условию нормального распределения, можно получить на 10-12 наблюдениях, соответствующим образом расположенных в заданном интервале испытанных доз.
Алгоритм определения ЕД50 включает 2-3 этапа в зависимости от проявления эффектов. На первом (предварительном) этапе необходимо найти диапазон доз, в котором происходит резкий переход эффектов от 0 к 1. При этом испытанные дозы необходимо увеличивать в 2 раза. Например, пусть при испытаниях доз 5, 10, 20 и 40 мг/кг получены соответствующие им эффекты 0, 0, 1, 1. Ясно, что ЕД50 вероятнее всего находится в диапазоне доз 10…20 мг/кг. Если же происходит чередование 0, 1, 0, 1 в этом диапазоне доз, то существует большая вероятность парадоксальной функции эффективности, так как при возрастании испытанной дозы в 4 раза эффекты остаются равными. В таких условиях определить средне-эффективную дозу на минимальном числе наблюдений невозможно, и необходимо провести полное построение и анализ функции эффективности для решения вопроса об особенностях фармакодинамики исследуемого агента.
На втором этапе, увеличивая или уменьшая в 1.1 раза вводимые дозы, необходимо добиться воспроизведения следующих 14 возможных последовательностей эффектов.
0 0 - 0 0 0 1 - 1 1
0 0 - 0 0 1 0 - 1 1
0 0 - 0 0 1 1 - 1 1
0 0 - 0 1 0 0 - 1 1
0 0 - 0 1 0 1 - 1 1
0 0 - 0 1 1 0 - 1 1
0 0 - 0 1 1 1 - 1 1
0 0 - 1 0 0 0 - 1 1
0 0 - 1 0 0 1 - 1 1
0 0 - 1 0 1 0 - 1 1
0 0 - 1 0 1 1 - 1 1
0 0 - 1 1 0 0 - 1 1
0 0 - 1 1 0 1 - 1 1
0 0 - 1 1 1 0 - 1 1
При этом потребуется еще 6 тест-объектов, с учетом уже испытанных доз на границах заданного диапазона. Изменение дозы в 1.1 раза обеспечивает равномерное перекрытие диапазона.
Третий этап включает дополнительные испытания доз в определенных точках в зависимости от полученной комбинации эффектов. В данном случае необходимо провести по 2 испытания доз 13.3 и 14.6 мг/кг. При двух эффектах 0/2 (строка 1.2 таблицы 1) необходимо провести еще одно испытание дозы 22.0 мг/кг с обязательным эффектом 1/1. Полученные таким образом исходные данные являются достаточными для определения ЕД50 при помощи метода ядерной оценки регрессии.
Для примера была определена ЕД50 ацетилхолина по кардиотоксическому эффекту у белых крыс (рис. 8): 47.57 ± 3.60 (39.27 55.86) мг/кг (N = 10).
Параллельно была определена ЕД50 по результатам полного построения функции эффективности: 45.77 ± 2.45 (40.38 51.16) мг/кг.
Таблица 3
Порядок введения доз для определения средне-эффективной дозы (ЕД50)
при минимально возможном числе испытаний (первая часть таблицы)
| № п/п | Наблюдавшиеся эффекты (0, 1) при испытаниях доз, мг/кг | N | |||||||||
| 9.09 | 10.0 | 11.0 | 12.1 | 13.3 | 14.6 | 16.1 | 17.8 | 20.0 | 22.0 | ||
| 1 | 0/1 | 0/1 | 0/1 | 0/1 | 0/1 | 1/1 | 1/1 | 1/1 | |||
| 1.1 | 0/2 | 1/2 | 10 | ||||||||
| 1.2 | 0/2 | 0/2 | 1/1* | 11 | |||||||
| 1.3 | 1/2 | 0/2 | 10 | ||||||||
| 1.4 | 1/2 | 1/2 | 10 | ||||||||
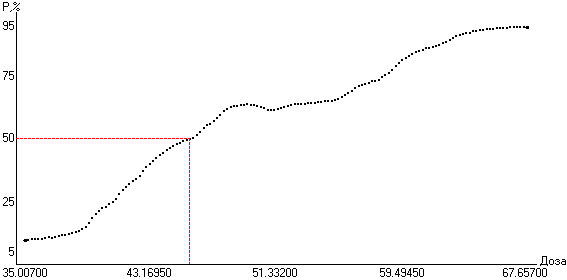
Рис 8. Координаты ЕД50 на функции эффективности ацетилхолина по кардиотоксическому эффекту у белых крыс по исходным данным, представленным в табл. 1
Таким образом, для практического использования предлагается простой, удобный и статистически адекватный способ определения ЕД50 при минимально возможном числе испытаний 10-12, что является отражением второго положения, выносимого на защиту и выполнением третьей задачи исследования.
При построении и анализе функций изоэффективности двух веществ за основу была принята идея Леве (Loewe S., 1927, 1928) построения поверхности отклика в системе координат в виде изоэффективной линии (изоболы). Принципиальное отличие от метода Леве состоит в построении общей функции эффективности путем идентификации ядрами («окнами просмотра») каждой точки в заданных диапазонах доз, а не поиска коэффициентов по заранее известным (стандартным) функциям
Вначале необходимо определить фармакодинамические соотношения между исследуемыми агентами и выбрать из них первый (основной) агент, который формирует регистрируемый признак, и второй агент, являющийся по своей сути модулирующим (изменяющим) силу действия первого агента. В качестве простого и понятного примера такого фармакодинамического соотношения приведем известные холинергические препараты ацетилхолин и атропин. Ясно, что при изучении на животных (например, белых крысах) холиномиметических эффектов в качестве основного препарата будет выступать ацетилхолин. Атропин способен изменять (модулировать) воздействие ацетилхолина по принципу фармакологического антагонизма.
Алгоритм математического построения общей функции изоэффективности двух агентов при помощи технологии ядерной оценки регрессии основан на поиске оценки эффекта для заданных исходных данных.
Примером практической реализации приведенного алгоритма построения общей функции изоэффективности двух агентов по технологии ядерной оценки регрессии может служить специально спланированное и выполненное нами исследование по оценке проявления эффекта хромодакриореи у белых крыс при одновременном воздействии ацетилхолина (как основного агента) и атропина (как модулирующего агента). Исследования возрастающих доз проводили до момента полного «насыщения» признака, когда дальнейшее увеличение доз ацетилхолина на фоне больших доз атропина уже не вызывало проявления эффекта.
По полученным исходным данным с учетом предельной относительной погрешности испытанных доз агентов 5% была построена общая функция изоэффективности ацетилхолина и атропина для вероятности эффекта 50% (рис. 9).

Рис. 9. Общая функция изоэффективности ацетилхолина и атропина по признаку хромодакриореи у белых крыс для вероятности эффекта 50%.
В каждой точке функции изоэффективности возможна оценка соотношения доз агентов. Если доза атропина составит 0.5 мг/кг, то ЕД50 ацетилхолина увеличится до 49.108±3.301 (42.376 55.840) мг/кг, и в 11.55±0.95 (9.9613.15) раза (P<0.05) превысит уровень ЕД50 у интактных животных.
Возможно построение такой же функции изоэффективности и по другой вероятности эффекта.
Таким образом, разработкой нового способ построения и анализа общей функции изоэффективности для двух агентов обосновано третье положение, выносимое на защиту.
Рассмотрим истинную адекватность и доказательность существующей системы клинических испытаний.
Действие любого лекарственного препарата в отношении ожидаемого клинического эффекта теоретически характеризуется типичной зависимостью «доза-эффект» (рис. 10). Назначение малых (неэффективных) доз приведет к сохранению ожидаемого клинического эффекта на уровне плацебо или стандартной терапии.
При дальнейшем увеличении дозы препарата, и в случае его реальной эффективности, частота положительных клинических эффектов будет возрастать и достигнет величины, достоверно отличающейся от уровня плацебо или стандартной терапии. Доза, соответствующая этой частоте (или вероятности) эффекта, может быть объективно и адекватно названа «минимальной клинически эффективной дозой (МКЭД)».
Последующее увеличение доз будет вызывать возрастание частоты эффекта, но до определенного уровня, соответствующего предельным (максимальным) возможностям клинической эффективности лекарственного препарата в отношении изучаемой патологии. На рисунке он обозначен как «уровень максимального клинического эффекта (плато)».
Р, %
90
50
10
МЭД ОКЭД ТД Дозы
Рис. 10. Схематичное изображение типичной зависимости «доза-эффект» лекарственного препарата: МЭД – минимальная эффективная доза, вызывающая частоту эффекта достоверно большую уровня стандартной терапии, и ограничивающая диапазон неэффективных доз; ОКЭД – оптимальная клинически эффективная доза; ТД – токсичная доза, вызывающая побочные эффекты.
Начальная доза диапазона, определяющего этот уровень, и будет являться искомой оптимальной клинически эффективной дозой (ОКЭД), которую и следует рекомендовать для клинического применения.
За уровнем ОКЭД возрастает вероятность появления (или увеличения) побочных эффектов лекарственного препарата. Достижение уровня токсичных доз приведет к существенному уменьшению частоты положительных клинических эффектов.
Построив зависимость «доза-эффект» лекарственного препарата, можно наглядно, объективно, адекватно и надежно определить параметры его клинической эффективности, и уже с позиций действительно доказательной медицины рекомендовать его к практическому применению.
Предлагается планировать, проводить построение и анализ зависимостей «доза-эффект» лекарственных препаратов на основе технологии ядерной оценки регрессии, тем самым, можно наглядно, объективно, адекватно и надежно определить параметры его клинической эффективности, и уже с позиций действительно доказательной медицины рекомендовать его к практическому применению.
Зависимость «доза-эффект» уже сама по себе содержит достаточную и надежную информацию об эффективности лекарственного препарата, и по сути связана с показателем плацебо или стандартной терапии на своем начальном участке. На этом основании появляется реальная возможность отказаться в ходе клинических испытаний от использования специальных параллельных групп пациентов, получающих плацебо или стандартную терапию, что существенно ускорит и снизит стоимость проведения клинических испытаний без ущерба их качеству и доказательной базе.
Сравнение клинической эффективности исследуемых лекарственных препаратов предлагается выполнять двумя способами.
Первый способ заключается в построении одной функции эффективности исследуемого препарата, и последующем сравнении полученных эффектов в разных участках этой функции с уровнем стандартной терапии (контрольной группой).
Задачей исследования являлось определение оптимальных доз реактиватора ацетилхолинэстеразы аллоксима, используемого в качестве модификатора гемосорбента в комплексном лечении острых отравлений ФОИ по данным клинического анализа архивных историй болезни.
После построения и анализа функции эффективности аллоксима были выявлены диапазоны эффективных доз (рис. 11). Дозу 0.19±0.01(0.180.21) г/кг можно рассматривать как оптимальную клинически эффективную дозу (ОКЭД) аллоксима для модификации гемосорбента, потому что при дальнейшем увеличении дозы от 0.19 до 0.31 г/кг клинический эффект оставался на уровне 80-85%.
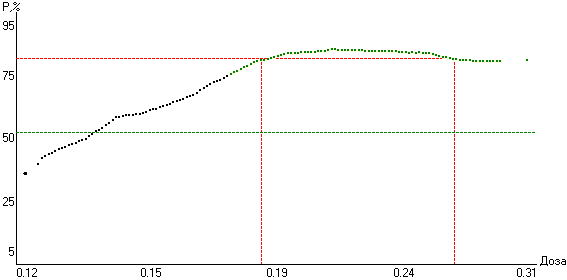
Рис. 11. Зависимость «доза-эффект» аллоксима в комплексном лечении острых отравлений фосфорорганическими инсектицидами с погрешностью доз 25% (прямыми пунктирными линиями обозначены уровень эффективности стандартной терапии, равный 52.4%, и диапазон клинически эффективных доз).
Второй способ состоит в построении и анализе на одном графике двух функций эффективности (исследуемого и контрольного препарата). В этом случае производится сравнение эффектов в комплементарных точках (в равных дозах) функций эффективности.
Задачей данного клинического исследования являлась оценка антиангинального эффекта совместного применения метопролола (препарата с гемодинамическим эффектом) и триметазидина (препарата с метаболическим эффектом) в комплексной антиангинальной терапии больных стабильной стенокардией. Для решения поставленной задачи в течение 30 дней наблюдались 108 больных стабильной стенокардией II-III клинико-функционального класса. Больные основной группы (59 человек) получали дополнительно к стандартной терапии стабильной стенокардии триметазидин в фиксированной дозе 70 мг в сутки. Больные контрольной группы (49 человек) получали только стандартную терапию.
Динамика состояний пациентов регистрировалась через 1 месяц в альтернативной форме по «конечной точке» в виде снижения частоты приступов стенокардии (не менее, чем на 50% от исходного уровня), уменьшения потребности в короткодействующих нитратах (не менее, чем на 50% от исходного уровня), снижения систолического и диастолического артериального давления, урежения частоты сердечных сокращений, уменьшения клинико-функционального класса стабильной стенокардии, уменьшения функционального класса хронической сердечной недостаточности и увеличения толерантности к физической нагрузке.
Функции эффективности в обеих группах строились на основе разных доз метопролола (рис. 12). Суточные дозы метопролола рассчитывались на 1 кг массы тела. Они оставались постоянными в течение всего периода лечения и находились в диапазоне от 0.17 до 1.94 мг/кг.
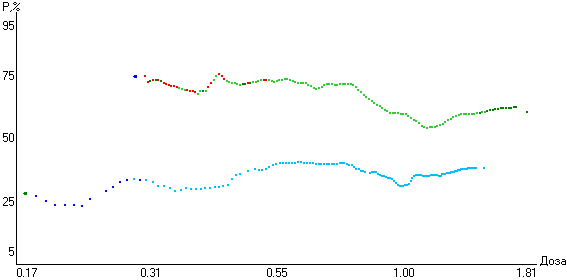
Рис. 12. Зависимость «доза-эффект» метопролола (1 - контрольная) и метопролола в сочетании с триметазидином (2 - основная) для антиангинального лечения больных стабильной стенокардией.
В качестве контрольной была принята функция эффективности метопролола как препарата в составе других лекарственных средств стандартной (фоновой) терапии. Основной являлась функция эффективности метопролола, построенная с учетом применения триметазидина в фиксированной дозе на фоне стандартной терапии больных стабильной стенокардией.
Средняя вероятность эффекта метопролола на контрольной функции эффективности в исследованном диапазоне доз оказалась практически одинаковой и составила 25-30%.
При комбинации метопролола и триметазидина достигнута вероятность положительного клинического эффекта более 50% во всех диапазонах доз. Наиболее эффективным был диапазон доз 0.27-0.50 мг/кг, где вероятность эффекта составила более 75%.
Технология построения функции эффективности в зависимости от задач клинического испытания позволяет в 2-5 раз сократить объем получения исходных данных, то есть включенных в исследование пациентов, и на порядок уменьшить стоимость проведения клинического испытания, и при этом обеспечить качественно новый уровень доказательности эффективности и безопасности лекарственного препарата.
ВЫВОДЫ
1. На основе проведенных научно-теоретических обоснований и их практического доказательства разработана комплексная система планирования исследований и построения зависимостей «доза-эффект» токсичных и лекарственных веществ по результатам независимых единичных испытаний на основе технологии ядерной оценки регрессии, позволяющая существенно повысить качество и сократить объем проведения токсикологических и клинических исследований, обеспечивая высокий уровень надежности и достоверности искомых показателей.
2. При планировании исследований для построения зависимости «доза-эффект» допустимым является увеличение интервала (шага) между испытанными дозами не более чем в 1.3 раза, что определяется свойствами нормального распределения доз как случайных величин. В диапазоне доз, различающихся в 2 раза, необходимо провести не менее 12 испытаний при равномерном заполнении всего диапазона. При статистическом сравнении двух доз и вычислении коэффициентов необходимо учитывать величину показателя трансгрессии.
3. Проведены исследования влияния ошибок введенных доз на вид зависимости «доза-эффект» и результаты оценок конечных показателей доказывающие, что зависимость «доза-эффект» определяется не только индивидуальной чувствительностью тест-объектов к каждой отдельно испытанной дозе, но и величиной погрешности исходных данных (введенных доз и регистрируемых эффектов). Исходя из закона нормального распределения, предельная величина погрешности введенных доз не может превышать 33%.
4. Разработан алгоритм определения средне-эффективной дозы (ЕД50) при минимально возможном числе испытаний на основе ядерной оценки регрессии. Посредством моделирования типовых ситуаций создана специальная таблица, устанавливающая правила последовательного испытания доз для получения достоверной величины ЕД50 с использованием 10-12 тест-объектов.
5. Разработана система планирования исследований, построения и анализа зависимости «доза-эффект» при взаимодействии двух веществ на основе ядерной оценки регрессии. Построена функция изоэффективности по 50% вероятности эффекта взаимодействия ацетилхолина и атропина у белых крыс по эффекту хромодакриореи.
6. Обосновано новое научно-практическое направление планирования исследований, построения и анализа зависимостей «доза-эффект» в клинических испытаниях лекарственных средств. Предложен к практическому использованию новый показатель – оптимальная клинически эффективная доза (ОКЭД), который рекомендуется в качестве критерия оценки оптимальной дозы лекарственного препарата, предназначенной для применения в клинической практике. По результатам модельных клинических испытаний построены зависимости «доза-эффект» энтеросорбентов у лиц с хронической алкогольной интоксикацией, аллоксима в комплексном лечении отравлений фосфорорганическими инсектицидами и метопролола в сочетании с триметазидином для антиангинального лечения больных стабильной стенокардией.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Рекомендуется оценивать зависимости «доза-эффект» токсичных и лекарственных веществ с использованием комплексной системы планирование исследований, построения и анализа любых видов функции эффективности по результатам независимых единичных испытаний на основе ядерной оценки регрессии при допустимом увеличении интервала (шага) между испытанными дозами не более чем в 1.3 раза. При статистическом сравнении двух доз и вычислении коэффициентов необходимо учитывать величину показателя трансгрессии.
2. Рекомендуется применять разработанный на основе ядерной оценки регрессии алгоритм для определения средне-эффективной дозы (ЕД50) при минимально возможном числе испытаний на 10-12 объектах.
3. Рекомендуется при решении исследовательских задач пользоваться системой планирования исследований по принципу ядерной оценки регрессии для построения и анализа зависимостей «доза-эффект» при взаимодействии двух веществ.
4. Рекомендуется планировать проведение клинических испытаний и получение исходных данных для последующего построения и анализа зависимостей «доза-эффект» с определением оптимальной клинически эффективной дозы (ОКЭД), которая является критерием оценки оптимальной дозы лекарственного препарата, предназначенной для применения в клинической практике.
5. Предлагается рассмотреть вопрос о принятии комплексной системы планирования исследований и способа построения функции эффективности токсичных и лекарственных веществ по результатам независимых единичных испытаний на основе ядерной оценки регрессии в качестве стандарта для оценки зависимостей «доза-эффект».
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. О возможности количественной оценки клинической эффективности антидотных средств // Матер. Всеарм. науч.-практич. конф., посвященной 200-летию Российской ВМедА, «Актуальные проблемы клинической токсикологии». – С.-Петербург, 30-31 марта 1999 г. - С. 198 (соавт. С.В. Криштопенко, М.С. Тихов).
2. Проблема парадоксальных эффектов в медицине // Матер. XXXIII итоговой науч.-практич. конф. Военно-медицинского института ФПС России при НГМА. – Н.Новгород, 1999. – С. 165-166.
3. Выбор диапазона эффективных доз капотена у больных острым инфарктом миокарда с симптомами сердечной недостаточности // Российский кардиологический журнал, 1999, № 4 (приложение). – С. 81 (соавт. С.В. Криштопенко, О.П.Алексеева, М.А.Курышева).
4. Проблема «парадоксальности» фармакологических эффектов // Нижегород. мед. журнал. – 1999. – № 3. – С. 61-63.
5. Определение эффективной дозы капотена для лечения сердечной недостаточности у больных острым инфарктом миокарда в госпитальном периоде // Острый коронарный синдром: современные принципы диагностики и лечения: Материалы науч.-практ. конф. – М.: ГВКГ им. Н.Н. Бурденко, 1999. – С. 57- 59 (соавт. О.П.Алексеева, М.А.Курышева, С.В. Криштопенко).
6. Применение парадоксальных функций эффективности для оценки клинической адекватности лекарственной терапии // Тезисы конференции молодых ученых Поволжья и Северного Кавказа 15-17 февраля 2000 г. – Н.Новгород: Изд-во НГМА, 2000. – С. 161 – 162 (соавт. М.А.Курышева).
7. Классификация парадоксальной токсичности // Медицинские последствия экстремальных воздействий на организм: Материалы Всеармейской научно-практической конференции, 28-29 марта 2000 года. - С.-Петербург: ВМедА, 2000. – С. 244-245 (соавт. С.В. Криштопенко, М.С. Тихов).
8. Применение эффективных доз капотена для лечения сердечной недостаточности при остром инфаркте миокарда // Диагностика, лечение и профилактика артериальной гипертензии и ишемической болезни сердца у военнослужащих: Материалы Всероссийской научно-практической конференции, 6 апреля 2000 года. – Н.Новгород, 2000. – С. 11-13 (соавт. О.П. Алексеева, С.В. Криштопенко, М.А. Курышева).
9. Новые возможности экспериментальной оценки клинической эффективности лекарственных препаратов // Нижегород. мед. журнал. – 2000. – № 3. – С. 110-112 (соавт. М.А. Курышева).
10. Новая научная методология определения эффективных доз лекарственных препаратов // Паллиатив. мед. и реабил. – 2000. – № 1-2. – С. 144 (соавт. С.В. Криштопенко, М.С. Тихов).
11. Парадоксальная токсичность. – Н.Новгород: Изд-во НГМА, 2001. – 164 с (соавт. С.В. Криштопенко, М.С. Тихов).
12. К вопросу о кумулятивном действии пестицидов // Гигиеническая наука и практика в решении вопросов обеспечения санэпидблагополучия населения в центральных регионах России: Сб. науч. труд. ФНЦГ им. Ф.Ф. Эрисмана. – Липецк, 2003. – вып. 8. – С. 241-242.
13. Использование метода «накопленных частот» для расчета показателей токсичности // Гигиеническая наука и практика в решении вопросов обеспечения санэпидблагополучия населения в центральных регионах России: Сб. науч. труд. ФНЦГ им. Ф.Ф. Эрисмана. – Липецк, 2003. – вып. 8. – С. 172-174 (соавт. Е.Г. Чхвиркия).
14. Оценка кривых летальности фосфорорганических пестицидов // Проблемы гигиенической безопасности и здоровье населения в регионах России: Сб. науч. трудов ФНЦГ им. Ф.Ф. Эрисмана, посвящ. 130-лет. создания госсанэпидслужбы Моск. обл. – М., 2003. – вып. 9. – С. 148-150.
15. Оптимизация токсикологических исследований при помощи метода ядерной оценки регрессии // Токсикол. вестн. – 2003. – № 4. – С. 35-38.
16. Классификация функций эффективности токсичных веществ // Тез. докл. II съезда токсикологов России, 10-13 ноября 2003: Росс. Регистр потенц. опас. хим. и биол. веществ Минздрава России, 2003. – М., 2003. – С. 202-204.
17. Парадоксальные функции эффективности в токсикологии // Теоретические основы и практические решения проблем санитарной охраны атмосферного воздуха: Мат. науч.-практ. конф., посвящ. 100-лет. со дня рождения академика РАМН В.А. Рязанова. – М., 2003. – С. 343-346.
18. Комбинированное действие фунгицидов и гербицидов // Региональные гигиенические проблемы и стратегия охраны здоровья населения: Сб. науч. трудов ФНЦГ им. Ф.Ф. Эрисмана. – старй Оскол, 2004. – вып. 10. – С. 183-185 соавт. В.Н. Ракитский).
19. Об определении параметров физиологической нормы в санитарно-гигиенических исследованиях // Факторы риска и здоровье населения в регионах России: Сб. науч. трудов ФНЦГ им. Ф.Ф. Эрисмана. – Липецк, 2004. – вып. 13. – С. 184-187 (соавт. В.Н. Ракитский, Е.Г. Чхвиркия).
20. О механизме комбинированного действия пестицидов различного производственного назначения // Факторы риска и здоровье населения в регионах России: Сб. науч. трудов ФНЦГ им. Ф.Ф. Эрисмана. – Липецк, 2004. – вып. 13. – С. 187-189 (соавт. В.Н. Ракитский).
21. К вопросу о статистической обработке результатов исследований // Экология: образование, наука, промышленность и здоровье: Сб. II Междунар. науч.-практ. конф. – Белгород: Вест. БГТУ им. В.Г. Шухова, 2004. – № 8, ч. 2. – С. 147-149.
22. Бимодальное действие иммуномодуляторов // Аллергол. и иммунол. – 2004. – Т. 5, № 1. – С. 91.
23. К вопросу о количественной оценке комбинированного действия двух и более веществ // Социально- гигиенический мониторинг здоровья населения: Мат. VIII Респ. науч.-практ. конф. с междунар. участием, посвящ. 60-лет. Рязанского гос. мед. университета им. акад. И.П. Павлова. – Рязань, 2004. – Ч. 2. – С. 325.
24. Применение метода ядерной оценки регрессии при оценке исходных данных, имеющих большую степень неопределенности // Актуальные вопросы радиационной гигиены: Сб. тез. науч.-практ. конф. – СПб., 2004. –С. 109-110.
25. Парадоксальные эффекты в промышленной токсикологии // Современные проблемы профилактической медицины, среды обитания и здоровья населения промышленных регионов России: Сб. науч. трудов, посвящ. 75-лет. организации Екатеринбургского мед. науч. центра проф. и охраны здоровья рабочих промпредптиятий. – Екатеринбург, 2004. – С. 298-301.
26. К вопросу о патогенезе воздействия феноксисоединений на организм теплокровных // Усп. Совр. Бол. – 2004. – Т.124, № 5. – С. 461-467 (соавт. В.Н. Ракитский, Е.Г. Чхвиркия).
27. Оценка зависимости «доза-эффект» кремнийсодержащего состава (симетикона и энтеросгеля) по критерию восстановления психосоматического статуса у лиц с хронической алкогольной интоксикацией после купирования абстинентного состояния // Инновационные технологии медицины XXI века. Медицинские компьютерные технологии: Сб. мат. I Всеросс. науч. форума, 12-15 апр., 2005. – М., 2005. – С. 375-377 (соавт. А.М. Семонюк).
28. Оценка зависимости «доза-эффект» кремнийорганических сорбентов у лиц с хронической алкогольной интоксикацией после купирования абстинентного состояния // Нижегор. мед. журнал. – 2005. – № 3. – С.138-140 (соавт. С.В. Криштопенко, А.М. Семонюк).
29. Построение и анализ функции эффективности (зависимости «доза-эффект») лекарственных и токсичных веществ на основе ядерной оценки регрессии // НЦНТИ, Информационный листок № 11-015-05. – 2005 г. - 3 с. (соавт. С.В. Криштопенко, А.М. Семонюк).
30. Применение гемокарбоперфузии через сорбент СКН, модифицированный эффективными дозами аллоксима, в комплексном лечении острых отравлений фосфорорганическими инсектицидами // Общ. реаниматол. – 2006. – Т. II, №4/1. – С. 87-89 (соавт. М.А. Курышева, С.В. Криштопенко, С.А. Мудрова, Е.А. Рязанцев).
31. Доза-эффект. – Москва: Изд-во «Медицина», 2008. – 288 с. (соавт. С.В. Криштопенко, М.С. Тихов).
32. Построение и анализ зависимости «доза-эффект» двух и более веществ // Принята к публикации в Токс. вестнике в 2010. (соавт. Г.А. Софронов, С.В. Криштопенко).

