Химиолучевая терапия в комплексном лечении злокачественных глиом головного мозга
На правах рукописи
ОСИНОВ
ИВАН КОНСТАНТИНОВИЧ
ХИМИОЛУЧЕВАЯ ТЕРАПИЯ В КОМПЛЕКСНОМ ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ГЛИОМ ГОЛОВНОГО МОЗГА
14.01.12 – онкология
14.01.13 – лучевая диагностика, лучевая терапия
АФТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Томск-2010
Работа выполнена в Учреждении Российской академии медицинских наук Научно-исследовательский институт онкологии Сибирского отделения РАМН
Научные руководители:
доктор медицинских наук,
профессор, член-корр. РАМН Чойнзонов Евгений Лхамацыренович
доктор медицинских наук,
профессор Мусабаева Людмила Ивановна
Официальные оппоненты:
доктор медицинских наук,
профессор Дыхно Юрий Александрович
доктор медицинских наук,
профессор Завадовская Вера Дмитриевна
Ведущая организация: ГУ Российский онкологический научный центр имени Н.Н. Блохина РАМН
Защита состоится «___»____________2010 года в _____ часов, на заседании диссертационного совета Д 001.032.01 при Учреждении Российской академии медицинских наук Научно-исследовательский институт онкологии Сибирского отделения РАМН (63409, г. Томск, пер. Кооперативный, 5)
С диссертацией можно ознакомиться в библиотеке НИИ онкологии СО РАМН, по адресу: г. Томск, пер. Кооперативный,5.
Автореферат разослан «___»___________ 2010 г.
Ученый секретарь диссертационного совета
Доктор медицинских наук, профессор Фролова И.Г.
Актуальность проблемы. Заболеваемость опухолями головного мозга в России составляет от 7,42 до 13,9 на 100 000 населения (Олюшин В.Е. 2005). При этом злокачественные глиомы встречаются в 5-8 случаях на 100 000 и составляют 60-80% всех злокачественных новообразований ЦНС (Смолин А.В. 2007).
За последние годы наметилась тенденция к увеличению заболеваемости злокачественными глиомами в разных возрастных группах, особенно в пожилом возрасте. Частота этих заболеваний неуклонно растет, увеличиваясь на 1,2% в год, достигая плато после 70 лет (Олюшин В.Е. 2005; Смолин А.В. 2007.)
Злокачественные глиомы (мультиформная глиобластома (Grade IV), анапластическая астроцитома (Grade III)), являются наиболее часто встречающимися первичными опухолями головного мозга у взрослых. Проблема лечения данного заболевания является актуальной и ей посвящено большое количество работ, как в России, так и за рубежом (Greenlee R.T., et al. 2000, Central Brain Tumor Registry of the United States - 2004).
Ведущие позиции в современной тактике лечения злокачественных глиом занимает комплексный подход, включающий в себя операцию, лучевую терапию и химиотерапию (Heideman R.L., et al. 1997; DeAngelis L.M., et al. 2001; Selker R.G., et al. 2002)
Во многих работах зарубежных авторов (Kreth F.W., et al. 1999; Lacroix M., et al. 2001; Stark A.M., et al. 2005; Boon Chuang-Pang, et al. 2007) было показано, что существенное увеличение общей выживаемости больных злокачественными глиомами связано с максимальным объемом резекции опухолевой ткани. Однако в самостоятельном варианте хирургическое лечение не приводит к полному выздоровлению больных. Так рецидивы и продолженный рост опухоли после операции наблюдается в 70-80% случаев (Mohan D.S. et al. 1998; Hentschel S.J. et al. 2003).
Проведение в послеоперационном периоде курса дистанционной лучевой терапии на ложе удаленной опухоли или на остаточный объем опухоли в СОД – 60 Гр незначительно увеличивало общую выживаемость, медиану выживаемости до прогрессирования и снижало частоту рецидивов у больных злокачественными глиомами (Laperriere N. et al. 2002; Nieder C. et al. 2004; Синайко В.В., 2006; Карташев А.В., 2008). Несмотря на определенные успехи в хирургии и лучевой терапии злокачественных глиом, существенных изменений в результатах лечения данных опухолей за последнее десятилетие не произошло: трехлетняя выживаемость после традиционного лечения (операция и лучевая терапия) не превышает 27,3% при анапластических формах глиом (Grade III) и 4,3% при глиобластоме (Grade IV) (Олюшин, В.Е. 2005, Синайко В.В. 2006).
Улучшить результаты традиционной терапии стало возможным после включения в схему лечения различных цитостатических препаратов (Mason W. et al. 1997; Rajkumar S.V. et al. 1999; Stewart L.A. 2002). Еще в 90-х годах XX века проведение химиолучевой и последующей химиотерапии производными нитрозомочевины (ломустин, кармустин) на 15-20% позволило повысить эффективность лечения больных с глиомами высокой степени злокачественности. В целом ряде рандомизированных исследований (EORTC Brain Tumor Group 1991; Hildedrand J. et al. 1994; Cairncross J.G. 1998; Perry J. et al. 2004) было доказано преимущество химиолучевого лечения препаратами ломустин, кармустин, цисплатин, прокарбазин по сравнению с одной лучевой терапией.
Последние десять лет в комплексном лечении глиом активно используется Темодал (темозоломид), который был синтезирован в 1984 г. в Великобритании группой ученых, возглавляемых M.F. Stevens. В сравнительных рандомизированных многоцентровых клинических исследованиях, у больных с рецидивами мультиформной глиобластомы при применении препарата Темодал разовой дозой 200 мг/м2/день в течение 5 дней, каждые 4 недели в сравнении с прокарбазином была получена высокая частота объективных ответов – 21% и 8% соответственно (Yung W.K., et al. 2000; Stupp R., et al. 2002; Newlands E.S., et al. 2003). Больные жили без прогрессирования на 1,5 мес. дольше, общая выживаемость была выше на 6 месяцев (60% против 40%, р=0,019).
Помимо этого достоинством препарата является возможность его применения перорально и проведение химиотерапии в амбулаторных условиях. Преимущества сочетания лучевой терапии (СОД – 60 Гр) с препаратом Темодал в дозе 75 мг/м2, ежедневно, в течение 6 недель лучевой терапии показано в исследовании P.Cypro et. al. (2001) и R. Stupp et al. (2005). Комбинированная химиолучевая терапия в 2 раза снизила риск прогрессирования болезни по сравнению с монотерапией Темодалом (57% и 29% соответственно). Общая эффективность составила 58% по сравнению с 14%, частота полных ремиссий также была значительно выше (29% и 7% соответственно). Поэтому, появление нового противоопухолевого препарата Темодал и применение его в комбинации с лучевой терапией у больных злокачественными глиомами явилось важнейшим событием в онкологии, хотя исследования в клинической практике продолжаются до настоящего времени.
В России широкого клинического исследования при злокачественных глиомах головного мозга, оценивающего в сравнительном аспекте эффективность двух режимов препарата Темодал, в условиях нерадикального оперативного вмешательства (субтотальное или парциальное удаление опухоли) не выполнялось. Во многом это обусловлено ограниченной доступностью препарата Темодал из-за высокой стоимости курса лечения.
В отделении радиологии и опухолей головы и шеи НИИ онкологии СО РАМН с 2005 по 2009 годы проводились клинические испытания препарата Темодал в двух дозовых режимах в сочетании с дистанционной гамма-терапией (60Со) в послеоперационном периоде у больных злокачественными глиомами головного мозга. Клинический материал представлен больными с мультиформной глиобластомой, анапластической астроцитомой.
Необходимость изучения непосредственной эффективности и переносимости химиолучевой терапии в условиях применения двух режимов препарата Темодал, а так же определение гематологической и общей токсичности очевидна.
Изменения, выявленные у больных злокачественными глиомами в процессе лечения и после его окончания, не всегда могут достоверно определяться традиционными методами лучевой диагностики. Применение магнитно-резонансной томографии, спиральной компьютерной томографии, энцефалосцинтиграфии с туморотропным препаратом 99mTc - Технетрил дает возможность получить дополнительную информацию, и решить вопросы дифференциальной диагностики изменений тканей головного мозга в ранние и поздние сроки наблюдения. Уточненная информация определит показания для проведения повторной операции и возможности продолжения химиолучевого лечения с другими препаратами. Изучение общей и безрецидивной выживаемости, выживаемости без прогрессирования у больных злокачественными глиомами при химиолучевой терапии, а так же токсичности применяемых препаратов, определяет научную новизну и практическую значимость настоящего исследования.
Цель исследования
Улучшение результатов комбинированного лечения больных злокачественными глиомами головного мозга с применением химиолучевой терапии.
Задачи исследования
1.Изучить непосредственную эффективность комплексного лечения у больных злокачественными глиомами головного мозга с препаратом Темодал в двух режимах и ломустин (CCNU) на фоне применения стандартного курса дистанционной лучевой терапии.
2.Оценить профиль общей и гематологической токсичности в зависимости от применяемых режимов химиолучевого лечения у больных со злокачественными глиомами.
3.Определить возможности энцефалосцинтиграфии с РФП 99mTc-Технетрил (ОЭКТ) и магниторезонансной томографии (МРТ) в оценке эффективности комплексного лечения больных злокачественными глиомами головного мозга.
4.Изучить общую выживаемость и выживаемость до прогрессирования с учетом факторов прогноза, у больных злокачественными глиомами головного мозга после комплексного лечения с применением Темодала и ломустина.
5.Оценить влияние повторного оперативного и химиолучевого лечения у больных злокачественными глиомами при прогрессировании или рецидиве заболевания после комплексного лечения, на общую выживаемость и частоту поздних лучевых повреждений.
Научная новизна. Впервые проведено клиническое исследование по сравнительной оценке эффективности применения Темодала (Темозоломид) в двух режимах в сочетании с лучевой гамма-терапией у больных злокачественными глиомами головного мозга после нерадикального оперативного лечения.
Впервые дана оценка эффективности химиолучевой терапии препаратом ломустин (CCNU) в монорежиме в сравнительном аспекте с химиолучевой терапией препаратом Темодал в двух режимах.
Впервые представлены преимущества учета факторов прогноза для дифференцированного подхода к определению тактики лечения у больных злокачественными глиомами головного мозга.
Дана сравнительная оценка возможностей энцефалосцинтиграфии (ОЭКТ) с 99mTc-Технетрилом в сопоставлении с данными МРТ головного мозга при мониторинге эффективности комплексного лечения злокачественных глиом.
Практическая значимость. Разработанный способ химиолучевой терапии с Темодалом в режиме 200 мг/м2/сут и 75 мг/м2/сут у больных злокачественными глиомами головного мозга внедрен в практику лечения клинических отделений: опухолей головы и шеи, химиотерапии, радиологии НИИ онкологии СО РАМН.
По результатам данного исследования сформированы показания для проведения послеоперационного химиолучевого лечения больных злокачественными глиомами головного мозга с учетом факторов прогноза и будет предложена новая медицинская технология.
Материалы исследования могут быть использованы в лекционном материале для студентов кафедр онкологии, лучевой диагностики и лучевой терапии медицинских ВУЗов.
Основные положения, выносимые на защиту
1. Применение в комплексном лечении Темодала в двух режимах и ломустина в сочетании с послеоперационной гамма-терапией в сравнении с контрольной группой лучевой терапии в два раза увеличило показатели общей выживаемости и выживаемости до прогрессирования больных злокачественными глиомами головного мозга.
2. Использование стратификации больных злокачественными глиомами головного мозга по RPA классам, позволяет сформировать показания к назначению варианта послеоперационного химиолучевого лечения.
3. Химиолучевая терапия с Темодалом в двух режимах и не приводит к увеличению общей и гематологической токсичности у больных злокачественными глиомами головного мозга. Частота осложнений связанных с токсичностью препарата не более 5%, в отличие от больных, получавших лучевую терапию в сочетании с ломустином, где частота осложнений 10%.
Апробация. Основные положения диссертационной работы были доложены на заседании областного общества онкологов (2009), на ежегодной конференции молодых ученых, Томск (2007-2010), на III конгрессе по опухолям головы и шеи с международном участием, Сочи (2009), на III Евразийском конгрессе по медицинской физике и инженерии “Медицинская физика 2010” в Москве (2010).
Публикации. Результаты исследования опубликованы в 15 печатных работах, отражающих основные положения диссертации, из них 1 в центральной печати.
Структура и объем работы. Диссертационная работа изложена на 148 страницах машинописного текста, состоит из введения, трех глав, заключения, выводов, списка литературы, включающего 171 источников, в том числе 29 отечественных и 142 зарубежных авторов. Работа иллюстрирована 21 таблицей и 56 рисунками.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В НИИ онкологии СО РАМН пролечено 111 больных злокачественными глиомами головного мозга, которым в плане комплексного лечения в послеоперационном периоде проводилась дистанционная лучевая терапия фотонами 1,25 МэВ на область остаточной опухоли на аппарате: Рокус-М и Theratron Equinox MDS Nordion.
Всем больным с клинико-рентгенологическим диагнозом злокачественная глиома головного мозга на первом этапе комплексного лечения была выполнена операция в объеме субтотального удаления опухоли у 82 (73,9 %) больных и парциального удаления опухоли у 29 (26,1 %) пациентов.
Средний возраст больных составил 45±1,3 лет. Средний балл по шкале Карновского – 70%, по ECOG – 2 балла.
В зависимости от применяемых методик комплексного лечения все 111 больных были разделены на 4 группы. Данные по группам представлены на рис. 1.
I группа (основная) – 35 (31,5%) больных (20 мужчин и 15 женщин) с диагнозом злокачественная глиома головного мозга, состояние после субтотального или парциального удаления опухоли, которым в плане комплексного лечения была проведена химиолучевая терапия с Темодалом в режиме разовой дозы 200 мг/м2/сут на курс 5 дней (Tmz – 200).
II группа (основная) – 20 (18,1%) больных (17 мужчин, 3 женщины) с диагнозом злокачественная глиома головного мозга после субтотального или парциального удаления опухоли, которым в плане комплексного лечения проводилась химиолучевая терапия с Темодалом в режиме радиосенсибилизации разовой дозой 75 мг/м2/сут (Tmz – 75) в течение всего курса лучевой терапии 42 дня, включая выходные дни.
III группа (сравнения) - состояла из 21 (19%) пациента (12 мужчин, 9 женщин) с диагнозом злокачественная глиома, состояние после субтотального или парциального удаления опухоли, которым в плане комплексного лечения проводилась химиолучевая терапия с ломустином (CCNU) в режиме 100 мг/м2 на курс, один прием каждые 6 недель.
IV группа (исторического контроля) – 35 (31,5%) больных (19 мужчин и 16 женщин) с диагнозом злокачественная глиома головного мозга, состояние после оперативного лечения в объеме субтотального или парциального удаления опухоли, которым в плане комбинированного лечение проводилась только лучевая терапия (ЛТ) в период с 1995 по 2005 годы.
С учетом прогностических факторов (возраст, объем резекции, статус по шкале Карновского, морфология) все больные были распределены в соответствии с RPA (recursive partitioning analysis) классификацией по Curran W.J. 1998 г (табл 1.).

Рис. 1. Дизайн клинического исследования
Таблица 1.
Распределение больных по RPA классам в зависимости от диагноза
| RPA класс | I1 | II1 | III1,2 | IV2,3 | V3 | VI3 |
| АА | 18 (34,6%) | 9 (17,3%) | 6 (11,5%) | 6 (11,5%) | 17 (32,6%) | 3 (5,7%) |
| МГБ | 0 | 0 | 3 (5%) | 23 (38,9%) | 23 (38,9%) | 3 (5%) |
| Всего | 18 (16,2%) | 9 (8,1%) | 9 (8,1%) | 29 (26,1%) | 40 (36%) | 6 (5,4%) |
RPA I-III1- благоприятный прогноз для АА
RPA III-IV2- благоприятный прогноз для МГБ
RPA IV-VI3 – неблагоприятный прогноз для АА
RPA V-VI3 – неблагоприятный прогноз для МГБ
Из таблицы 1 видно, что у больных с анапластической астроцитомой преобладают RPA классы I (благоприятный прогноз) и V (неблагоприятный прогноз)– 18 и 17 больных соответственно. У больных с МГБ в равной степени представлены IV (благоприятный прогноз) и V (неблагоприятный прогноз) классы по 23 пациента. В целом, из 111 пациентов у 52 больных прогноз заболевания оценивался как неблагоприятный.
Методика дистанционной лучевой и химиолучевой терапии
Методика дистанционной лучевой терапии
Дистанционная гамма-терапия на аппарате «Рокус-М» и «Theratron Equinox» с энергией фотонов 1,25 МэВ проводилась всем 111 больным со злокачественной глиомой головного мозга. Лучевая терапия назначалась больным в среднем на 14 сутки после операции.
Гамма-терапия проводилась в 35 случаях ротационным способом (секторное облучение) полями 6х6 и 8х8 см. В остальных случаях использовались два или три статических поля размерами от 6х6 до 10х10 см. Режим облучения: разовая очаговая доза 2,0 Гр, 5 дней в неделю. Суммарная очаговая доза составила 54,0 – 60,0 Гр. Курс лечения - 42 дня с учетом выходных.
Методика химиолучевой терапии
Во всех исследуемых группах химиотерапию назначали с первого дня лучевой терапии.
В I группе 35 больным назначался Темодал per os из расчета разовой суточной дозы 200 мг/м2/сут (280-400 мг) в течение 5 дней, циклами каждые 28 дней, суммарная доза на курс составляла 1400 - 2000 мг. Всего за курс лучевой терапии проводили 2 курса ХТ Темодалом. В постлучевом периоде прием Темодала продолжали по той же схеме до 6 курсов.
Во II группе - 20 больным назначали препарат Темодал per os из расчета разовой суточной дозы 75 мг/м2/сут (120-140 мг) ежедневно, за час до проведения ДГТ в течение 42 дней. Курсовая доза составляла 5040 – 5880 мг. Далее в постлучевом периоде больные получали до 6 курсов ХТ Темодалом по схеме 200 мг/м2/сут (280-400 мг) в течение 5 дней, циклами каждые 28 дней суммарная доза на курс составляла 1400 – 2000 мг.
У 21 больного III исследуемой группы проводилась ХЛТ с ломустином (СCNU) из расчета курсовой дозы 100 мг/м2, по схеме один прием раз в 6 недель. Суммарная доза на курс составляла от 140 до 200 мг. Всего было проведено 6 курсов ХТ ломустином.
Основными критериями оценки эффективности комплексного лечения больных злокачественными глиомами головного мозга являлись: непосредственная эффективность проводимого лечения, частота и сроки возникновения рецидивов (продолженного роста), показатели общей выживаемости и время до прогрессирования, уровень общей и гематологической токсичности, а так же частота местных лучевых реакций и поздних лучевых повреждений окружающих нормальных тканей (кожа, критические органы).
Данные о непосредственной эффективности лечения были получены при анализе СКТ и МРТ снимков в контрольные сроки (1, 3, 6 и 12 месяцев.), которые дополнялись данными энцефалосцинтиграфии головного мозга (ОЭКТ) с 99mTc-Технетрил в дозе 600 МБк. Размеры опухоли оценивались по двум взаимно перпендикулярным диаметрам на наибольшем по площади срезе на СКТ и/или на МРТ с контрастным усилением “Омнисканом” и динамике изменения накопления РФП в остаточной опухоли по данным ОЭКТ. Эффективность лечения оценивалась при условии снижающихся или стабильных доз кортикостероидов в течение проводимого лечения (критерий Макдональда). Анализ непосредственной эффективности лечения проводился по критериям ВОЗ 1991 г.
Ранние лучевые реакции и поздние лучевые повреждения оценивались по шкале лучевых повреждений RTOG/EORTC (1995).
Анализ токсичности проводимого лечения проводился с использованием шкалы токсичности по критериям CTC-NCIC.
Статистическая обработка полученных результатов исследования проводилась с помощью пакета «STATISTICA for Windows» фирмы «StatSoft Inc.» версия 6.0, путем вычисления непараметрического критерия U – тест Манна-Уитни и показателя соответствия 2 Пирсона. Показатели выживаемости больных рассчитывались с помощью моментного метода Kaplan – Meier и с применением log – rank теста. Статистически значимыми считались различия при p < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ переносимости химиолучевого лечения показал, что частота общих симптомов (общая слабость, повышенная утомляемость) и симптомов со стороны пищеварительного тракта (тошнота, рвота) и ЦНС (головные боли, судороги) выше в группе больных, получавших ХЛТ с ломустином. Однако статистически значимых различий между группами ХЛТ получено не было (р>0.05). В группах I, II и III значительно чаще, чем в контрольной, наблюдались симптомы со стороны пищеварительной системы, при равной встречаемости симптомов со стороны ЦНС. Различия статистически значимы (р<0.05).
Проведенный анализ гематологической токсичности показал, что максимальное снижение абсолютного числа лейкоцитов до 2,0-2,5х109/л и тромбоцитов до 80-150х103/л в исследуемых группах наблюдалось в основном к 4-5 курсу ХТ. Изменения показателей красной крови (гемоглобин, число эритроцитов) оставались в пределах норм во всех исследуемых группах.
Гематологическая токсичность комплексного лечения по критериям CTC-NCIC представлена в таблице 2. Как следует из таблицы 2 в группах больных, получавших ХТ препаратом Темодал, гематологическая токсичность I и II степени наблюдалась реже (Gr I– 23-25% и Gr II- 5 %), чем у больных, получавших препарат CCNU (Gr I- 40 % и Gr II– 25%). Различия статистически значимы (р<0.05). Гематологическая токсичность IV степени встречалась в 5% случаев у больных принимавших Темодал независимо от режима ХЛТ, и в 10% случаев у больных, принимавших ломустин.
Клинически гематологическая токсичность IV степени у больных получавших Темодал и ломустин, проявлялась: повышенной кровоточивостью, полименорреей, тромбоцитопенической пурпурой. Данные осложнения потребовали коррекции дозы препарата и назначения специализированного лечения.
Таблица 2.
Гематологическая токсичность комплексного лечения у больных по группам
| Степень (Grade) | Лейкопения | Тромбоцитопения | ||||
| I-группа | II-группа | III-группа | I-группа | II-группа | III-группа | |
| Gr – I | 8 (23%)* | 5 (25%)* | 8 (40%) | 2 (5,7%)* | 1 (5%)* | 6 (30%) |
| Gr – II | 2 (5,7%)* | 1 (5%)* | 5 (25%) | 1 (2,8%)* | 1 (5%)* | 5 (25%) |
| Gr – III | 0 | 0 | 3 (15%) | 0 | 0 | 1 (5%) |
| Gr – IV | 0 | 0 | 2 (10%) | 2 (5,7%) | 1 (5%) | 2 (10%) |
Примечание: *- различия статистически значимы p<0.05
У больных злокачественными глиомами головного мозга частота осложнений связанных с токсичностью ХТ Темодалом не превышала 5%, а у больных получавших CCNU она составила 10%. Отмена химиотерапии ломустином потребовалась у одного больного, ввиду развившейся тяжело корригируемой лейкопении.
Местные лучевые реакции кожи 1 и 2 степени по шкале RTOG/EORTC (1995) в области полей облучения наблюдались с одинаковой частотой у больных исследуемых групп. В основном они были представлены – эритемой, эпиляцией и сухим эпидермитом. Общие лучевые реакции после сеансов гамма-терапии были умеренно выраженными. Переносимость больными комплексного лечения была удовлетворительной.
Непосредственная эффективность ХЛТ у больных АА и МГБ, получавших Темодал, была выше по частоте объективного эффекта (полная регрессия + частичная регрессия) в сравнении с больными, принимавшими CCNU и в группе контроля. Так, у больных с АА в I группе объективный эффект составил 67%, во II группе - 75%, против 41% в III группе больных и 5,5% в контроле. У больных с МГБ объективный эффект на ХЛТ в I группе составил 41%, а во II группе - 55%, против 25% в III группе больных. В контроле объективного эффекта не отмечено (табл. 3.). Однако статистически значимые различия получены только по сравнению с контролем (р<0.05). Данные представлены на рисунке 2 (а,б)
Рис. 2. Непосредственная эффективность ХЛТ у больных: А – анапластической астроцитомой; Б – мультиформной глиобластомой.
Контроль роста опухоли (полная регрессия + частичная регрессия + стабилизация) после химиолучевого лечения у больных АА в I и II группе составил 100% и 91% соответственно, а у больных III группы – 58% (табл. 3). Это было связано с низкой частотой прогрессирования заболевания в группах больных АА, получающих Темодал. Так, частота прогрессирования после ХЛТ в I и II группах не превышала 9%, а в III группе она составила 42%, по сравнению с контрольной группой, в которой частота прогрессирования после ЛТ не превышала 34% (рис. 2.).
Контроль роста опухоли после ХЛТ у больных МГБ исследуемых групп был сопоставим. В I группе больных контроль роста опухоли составил 76%, во II группе – 88%, а в III группе - 75% (табл. 3.). Однако в III группе высокая частота контроля роста опухоли 75% была связана с большей частотой стабилизаций процесса, а у больных, получавших Темодал, с полной и частичной регрессией опухоли. При этом частота прогрессирования у больных МГБ II группы, получавших ХЛТ Темодалом в режиме радиосенсибилизации, составила всего 11%, а в группах I и III – 24% и 25% соответственно (рис. 2.).
Таблица 3.
Объективный эффект и контроль роста опухоли у больных АА и МГБ после ХЛТ
| Группы больных с АА | Объективный эффект (ПР+ЧР) | Контроль роста опухоли (ПР+ЧР+СБ) | ||
| I | Tmz – 200 (n - 18) | 14 (66,7%) | 18 (100%) | |
| II | Tmz – 75 (n - 12) | 8 (74,9%) | 11 (91,5%) | |
| III | CCNU (n - 12) | 5 (41,6%) | 7 (58,2%) | |
| IV | ЛТ (n - 18) | 1 (5,5%) | 12 (66,6%) | |
| Группы больных с МГБ | Объективный эффект (ПР+ЧР) | Контроль роста опухоли (ПР+ЧР+СБ) | ||
| I | Tmz – 200 (n - 17) | 6 (41,0%) | 13 (76,0%) | |
| II | Tmz – 75 (n - 9) | 5 (55,2%) | 7 (88,2%) | |
| III | CCNU (n - 8) | 2 (25%) | 5 (75,0%) | |
| IV | ЛТ (n - 17) | 0 (0%) | 3 (18,0%) | |
Примечание: n – число больных в группе
Оценка непосредственной эффективности комплексного лечения препаратом Темодал у больных АА показала преимущества режимов 200 мг/м2/сут и 75 мг/м2/сут в сочетании с лучевой терапией в сравнении с ломустином и самостоятельной лучевой терапией, что связано с большей частотой объективных эффектов при исследуемых режимах ХТ. Наибольшая частота объективного эффекта наблюдалась у больных анапластической астроцитомой II группы – 50%, у больных I группы она составила 44,3% у больных III группы - 41,6%, а в контроле только - 5,5%. Однако контроль роста опухоли у больных АА, получавших какой-либо вариант химиотерапии, был сопоставим и составил 58-60%, что было в два раза выше по сравнению с контролем – 33,2%.
У больных МГБ после комплексного лечения с Темодалом наблюдалась большая частота объективного эффекта на проводимое лечение по сравнению с ломустином и контролем. Так, в I группе больных объективный эффект составил 23,4%, во II группе - 22,5%, а в III группе – 12,5%. В группе контроля объективный эффект не зарегистрирован.
Контроль роста опухоли, при проведении ХТ у больных МГБ в I группе составил 35,1%, во II группе – 45,0%, и в III группе больных 50%. Во многом это было связано с большей частотой стабилизаций процесса в группе больных, получающих ХТ ломустином (CCNU), а в группах больных, принимавших Темодал, за счет частоты полных и частичных регрессий. Данные представлены на рисунке 3 и в таблице 4.
Рис. 3. Непосредственная эффективность комплексного лечения больных: А- анапластической астроцитомой; Б – мультиформной глиобластомой.
Таблица 4.
Объективный эффект и контроль роста опухоли у больных АА и МГБ после комплексного лечения (ХЛТ + ХТ)
| Группы больных с АА | Объективный эффект (ПР+ЧР) | Контроль роста опухоли (ПР+ЧР+СБ) | |
| I | Tmz – 200 (n - 18) | 8 (44,3%) | 11 (60,9%) |
| II | Tmz – 75 (n - 12) | 6 (50%) | 7 (58,3%) |
| III | CCNU (n - 12) | 5 (41,6%) | 7 (58,2%) |
| IV | ЛТ (n - 18) | 1 (5,5%) | 6 (33,3%) |
| Группы больных с МГБ | Объективный эффект (ПР+ЧР) | Контроль роста опухоли (ПР+ЧР+СБ) | |
| I | Tmz – 200 (n – 17) | 4 (23,4%) | 6 (35,1%) |
| II | Tmz – 75 (n – 9) | 2 (22,5%) | 7 (45,0%) |
| III | CCNU (n – 8) | 1 (12,5%) | 4 (50,0%) |
| IV | ЛТ (n – 17) | 1 (5,8%) | 5 (29,0%) |
Примечание: n – число больных в группе
В оценке непосредственной эффективности химиолучевой терапии у 34 больных злокачественными глиомами в качестве дополнительного метода диагностики была проведена энцефалосцинтиграфия с туморотропным РФП 99mTc-Технетрил в дозе 600 МБк.
Из 34 больных до начала ХЛТ у 13 (АА-7, МГБ-6) было выявлено накопление РФП в остаточной опухоли в диапазоне от 67% до 863% (медиана - 375,2%). После ХЛТ гиперфиксация РФП в остаточной опухоли зарегистрирована у 16 больных (АА-8, МГБ-8) в диапазоне от 83% до 763% (медиана – 205%), и в 7 (АА–4, МГБ-3) случаях она была достоверно ниже показателей до ХЛТ (р<0.05). Данные изменений показателей накопления РФП в динамике в остаточной опухоли представлены на рисунке 4.
Гиперфиксацию РФП в опухоли в значениях менее 200% у 6 больных (АА-2, МГБ-4) следовало дифференцировать с посттерапевтическими изменениями (ишемия зоны облучения, постлучевой отек, ранний радионекроз и другие), что потребовало повторения исследования в динамике.
В контрольный срок - через 6 месяцев после ХЛТ ОЭКТ с 99mTc-Технетрил было проведено 29 больным (АА-15, МГБ-14) из них у 16 (55%) больных по данным энцефалосцинтиграфии гиперфиксация РФП в остаточной опухоли варьировала от 220% до 745% (медиана – 342%), что свидетельствовало о прогрессировании заболевания. У остальных 13 (46%) больных (АА–7, МГБ-6) по данным ОЭКТ признаков продолженного роста опухоли или рецидива не наблюдалось.

Примечание: - различия статистически значимы
Рис. 4. Изменения показателей накопления РФП в остаточной опухоли в динамике.
Проведенный в нашем исследовании сравнительный анализ выживаемости до прогрессирования и общей выживаемости у больных АА и МГБ в зависимости от прогноза, показал значимые различия в данных показателях между больными с благоприятным и неблагоприятным прогнозом.
Так, медиана выживаемости до прогрессирования в I группе больных АА с RPA I-III (благоприятный прогноз) составила 14,0±6,0 месяцев, а во II – 10,0±4,2 месяца по сравнению с больными тех же групп, но с RPA IV-VI (неблагоприятный прогноз) – 4,0±1,5 и 5,0±0,5 месяцев соответственно. Различия были статистически значимы (р<0.05).
Для больных с МГБ RPA IV (благоприятный прогноз) первой и второй групп получены аналогичные результаты: медиана выживаемости до прогрессирования в I группе – 35,5±9,8 мес; во II группе - 10,0±2,3 месяца в сравнении RPA V-VI (неблагоприятный прогноз) – 6,0±0,8 и 4,5±1,0 соответственно. Различия статистически достоверны (р<0.05).
В группе III различия общей выживаемости и выживаемости до прогрессирования в зависимости от прогноза были значимы только для больных с АА. Так, медиана выживаемости до прогрессирования у больных АА с благоприятным прогнозом (RPA I-III) составила 12,0±2,2 месяца, а у больных с неблагоприятным набором прогностических факторов (RPA IV-VI) – 3,0±0,2 мес. Различия статистически значимы (р<0.05). У пациентов с МГБ, несмотря на двукратную разницу по медиане выживаемости до прогрессирования, между больными с благоприятным (13±0,8 мес.) и неблагоприятным (6,0±0,5 мес.) прогнозом статистически значимых различий получено не было (р>0.05). Данные представлены в таблице 5.
Таблица 5.
Медиана выживаемости до прогрессирования у больных АА и МГБ в зависимости от RPA класса
| Медиана выживаемости до прогрессирования (мес.) | ||||||||
| Диагноз | Благоприятный прогноз | Неблагоприятный прогноз | ||||||
| RPA класс I-III | RPA класс IV-VI | |||||||
| I группа | II группа | III группа | IV группа | I группа | II группа | III группа | IV группа | |
| АА | 14,0±6,0* | 10,0±4,2* | 12,0±2,2 * | 5,5±3,8 | 4,0±1,5 | 5,0±0,1 | 3,0±0,2 | 4,0±0,9 |
| RPA класс IV | RPA класс V-VI | |||||||
| МГБ | 35,5±9,8* | 10,0±2,3 * | 13,0±0,8 | 4,0±3,4 | 6,0±0,8 * | 4,5±1,0 | 6,0±0,5 | 1,5±1,1 |
Примечание: * - различия статистически значимы по сравнению с контролем и между группами благоприятного и неблагоприятного прогноза.
В IV группе больных АА и МГБ значимых различий в показателях общей выживаемости и выживаемости до прогрессирования в зависимости от факторов прогноза получено не было (р>0.05).
При сравнении показателей общей выживаемости и выживаемости до прогрессирования у больных АА и МГБ с благоприятным прогнозом (RPA I-III/ IV) между I, II исследуемыми группами и контролем получены статистически значимые различия (Рис. 5.).

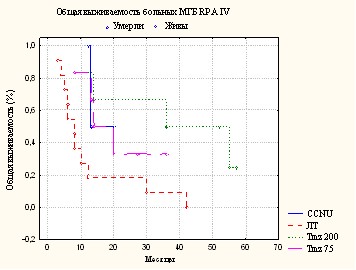
Рис. 5. Общая выживаемость (А, В) и 6 – месячная выживаемость до прогрессирования (В, Г) у больных АА и МГБ
У больных III группы с благоприятным прогнозом общая выживаемость статистически значимо различалась по сравнению с контролем только при АА.
Однако значимых различий в общей выживаемости у больных АА и МГБ с благоприятным прогнозом между группами I, II и III у получено не было (р>0.05).
У больных анапластической астроцитомой с неблагоприятным прогнозом (RPA IV-VI), ни один вариант химиолучевого лечения не позволил увеличить показатели шестимесячной выживаемости, а так же медиану выживаемости до прогрессирования.
У больных мультиформной глиобластомой с неблагоприятным набором клинических факторов прогноза (RPA V-VI) проведение ХЛТ с Темодалом в I исследуемой группе, статистически значимо увеличило показатели выживаемости до прогрессирования и общей выживаемости больных в сравнении с контролем (р<0.05). Аналогичных результатов не было получено во II и III группах при сравнении с контролем.
При анализе результатов комплексного лечения больных злокачественными глиомами головного мозга без учета факторов прогноза были получены следующие результаты. Показатели общей выживаемости и выживаемости до прогрессирования в I и II группах больных с АА и МГБ, получавших комплексное лечение с препаратом Темодал, были статистически значимо выше по сравнению с контрольной группой, где лучевая терапия проводилась в самостоятельном варианте (рис. 6.). В I группе одногодичная выживаемость до прогрессирования у больных АА составила 38,8±11,4% у больных МГБ – 29,4±11,5% в группе контроля аналогичные показатели были значимо ниже 22,2±9,7% и 11,7±7,8% соответственно (р<0.05), что указывает на эффективность сочетания ХТ с Темодалом с ЛТ в избранном режиме. Пятилетняя общая выживаемость больных АА составила 16,0±10,0%, а у больных МГБ достигнуты показатели трехлетней общей выживаемости – 17,6±9,7%. В группе контроля показатель общей пятилетней выживаемости у больных АА был 5,5±5,3%, а у больных с МГБ трехлетняя общая выживаемость 5,8±5,7%. Различия статистически значимы (р<0.05).
В группе II у больных АА и МГБ были получены следующие показатели одногодичной выживаемости до прогрессирования при АА – 50,0±12,6% и при МГБ – 40,0±15,4%. Различия статистически значимы с контрольной группой больных, где одногодичная выживаемость до прогрессирования 22,2±9,7% и 11,7±7,8% соответственно (р<0.05). При этом общая трехлетняя выживаемость у больных АА составила 31,1±12,3%, а у больных МГБ достигнуты показатели двухгодичной общей выживаемости – 20,0±12,4%. В группе контроля трехлетняя выживаемость больных АА составляет – 16,6±8,7%, двухгодичная общая выживаемость больных с МГБ – 11,7±7,8%. Различия статистически значимы (р<0.05).






Рис. 6. Выживаемость до прогрессирования (А, Б) и общая выживаемость (В, Г) больных АА и МГБ в исследуемых группах по сравнению с контролем.
В III группе одногодичная выживаемость до прогрессирования у больных АА составила 59,8±11,0%, у больных МГБ – 22,8±9,8%. Различия с контролем статистически значимы только для больных с АА (р<0,05). В группе сравнения достигнуты показатели только общей одногодичной выживаемости больных, которая составляет для больных с АА 59,6±14,6%, для больных МГБ – 50,0±13,6% по сравнению с контролем 22,2±9,7% и 17,6±9,2% соответственно. Различия статистически значимы (р<0.05).
Сравнения результатов комплексного лечения больных АА и МГБ представлены в таблице 6 и 7.
Таблица 6.
Сравнение показателей выживаемости до прогрессирования между исследуемыми группами больных АА и МГБ
| Диагноз | Одногодичная выживаемость до прогрессирования (%) | Медиана выживаемости до прогрессирования (месяцы) | ||||||
| Группа I | Группа II | Группа III | Группа IV | Группа I | Группа II | Группа III | Группа IV | |
| АА | 38,8±11,4 * | 50,0±12,6 * | 59,8±11,0 * | 22,2±9,7 | 10,0±4,9 * | 10,0±3,1 * | 8,0±2,1 * | 5,0±3,0 |
| МГБ | 29,4±11,5 * | 40,0±15,4 * | 22,8±9,8 | 11,7±7,8 | 6,0±4,6 * | 8,0±2,1 * | 6,0±1,2 | 3,0±2,0 |
Примечание: * - различия статистически значимы по сравнению с контролем
Таблица 7.
Сравнение показателей общей выживаемости между исследуемыми группами больных АА и МГБ
| Диагноз | Одногодичная выживаемость (%) | Медиана общей выживаемости (месяцы) | ||||||
| Группа I | Группа II | Группа III | Группа IV | Группа I | Группа II | Группа III | Группа IV | |
| АА | 60,0±11,4 * | 77,0±11,2 * | 57,6±14,6 * | 22,2±9,7 | 14,0±5,1 * | 14,5±4,3 * | 12,0±2,0 * | 7,0±3,8 |
| МГБ | 52,9±11,5 * | 50,0±13,7 * | 50,0±13,6 * | 18,0±7,8 | 13,0±4,3 * | 11,5±2,9 * | 12,0±1,5 * | 6,0±2,5 |
Примечание: * - различия статистически значимы по сравнению с контролем
Проведенный анализ рецидивов после полного ответа на комплексное лечение показал, что в I группе из 7 (20%) больных (АА – 5, МГБ – 2), у 4 пациентов с АА (22,2%) возник рецидив в зоне полей облучения в срок до 5 лет: на 2 году - один, и на 4 году - 3 рецидива. У 2 больных с МГБ рецидивы возникли на первом году наблюдения.
Во II группе из 3 (20%) больных АА, имевших полный ответ на проводимее лечение, рецидивов в настоящее время нет.
В III группе полный ответ на комплексное лечение был у 3 (15,7%) больных с АА. В настоящее время признаков рецидива у больных нет.
У больных с прогрессированием или с рецидивом заболевания после комплексного лечения (ХЛТ+ХТ), при возможности было проведено повторное оперативное лечение с последующим курсом лучевой или химиолучевой терапии (табл. 8.).
Таблица 8.
Частота повторного оперативного и химиолучевого лечения при прогрессировании после комплексного лечения (ХЛТ+ХТ).
| Группа | Диагноз | Повторная операция | Повторная ХЛТ |
| I - Темодал 200 мг/м2 | АА n - 18 | 2 (11,1%) | 2 (11,1%) |
| МГБ n - 17 | 4 (23,5%) | 3 (17,6%) | |
| II - Темодал 75 мг/м2 | АА n - 12 | 3 (25%) | 2 (16,6%) |
| МГБ n - 8 | 4 (50%) | 3 (37,5%) | |
| III - CCNU 100 мг/м2 | АА n - 12 | 2 (16,6%) | 1 (8,3%) |
| МГБ n - 9 | 0 | 0 |
Как следует из таблицы 8, при прогрессировании болезни после комплексного лечения у 15 (19,7%) из 76 пациентов было выполнено повторное оперативное лечение, после которого лишь 11 (14,4%) больным проводилась повторная химиолучевая терапия. Четверо больных погибли в срок до 3 месяцев после оперативного лечения.
В контрольной группе больных повторные курсы лучевой терапии были проведены 3 (17,6%) больным с АА и 4 (22,2%) больным с МГБ при прогрессировании до одного года.
Повторное оперативное и химиолучевое лечения больных злокачественными глиомами головного мозга после прогрессирования или рецидива заболевания увеличило общую выживаемость. Однако проведение повторного комплексного лечения (операция+ЛТ/ХЛТ) ассоциировалось с большей частотой поздних лучевых повреждений головного мозга и зависело от сроков проведения. У больных I группы, частота поздних радионекрозов составила - 5,7%, однако в данной группе повторные курсы лучевой терапии проводились не ранее года после первого курса ХЛТ. Частота поздних радионекрозов в контрольной группе составила 8,5% ввиду того, что повторный курс ЛТ чаще всего проводился на первом году наблюдения.
ВЫВОДЫ
- Комплексное лечение у больных анапластической астроцитомой (АА) и мультиформной глиобластомой (МГБ) с применением препарата Темодал в двух режимах - 200 мг/м2/сут и 75 мг/м2/сут и препарата ломустин в режиме 100 мг/м2 позволяет получить большую частоту объективных эффектов: при АА - 44,3%, 50,0%, 41,1%; при МГБ - 23,4%, 22,5% и 12,5% соответственно, по сравнению с лучевой терапией в самостоятельном варианте - 5,5% и 0% соответственно.
- Профиль общей и гематологической токсичности по критериям CTC–NCIC у больных злокачественными глиомами головного мозга в условиях применения препарата Темодал в двух режимах при сочетании с лучевой терапией был удовлетворительный, осложнения связанные с гематологической токсичностью препарата не превышали 5%. У больных, получавших лучевую терапию в сочетании с ломустином, уровень токсичности был значимо выше, а частота осложнений составила 10%.
- Проведение энцефалосцинтиграфии с РФП 99mTc-Технетрил (ОЭКТ) в качестве дополнительного метода диагностики к магниторезонансной томографии (МРТ) позволяет оценить непосредственную эффективность комплексного лечения и более точно отражает динамику патологического процесса на контрольных этапах наблюдения больных злокачественными глиомами головного мозга.
- Общая выживаемость и выживаемость до прогрессирования у больных АА и МГБ с благоприятным и неблагоприятным прогнозом имела существенные различия. У больных с благоприятным прогнозом общая одногодичная выживаемость при АА в I группе составила 76,4±11,0%, во II – 100±0,2% и в III группе 75,0±9,6%; при МГБ - 83,0±12,4%, 80,0±17,6% и 50,0±13,4% соответственно в сравнении с контролем: при АА – 35,7±9,8%, при МГБ – 27,0±10,7% (р<0,05). У больных АА и МГБ с неблагоприятным прогнозом проведение комплексного лечения не улучшило показатели выживаемости больных в сравнении с контролем, кроме одной группы больных МГБ, получавших ХЛТ и ХТ в режиме Темодал 200 мг/м2/сут.
- Показатели выживаемости до прогрессирования у больных АА и МГБ I и II групп были значимо выше по сравнению с контролем. В III группе выживаемость до прогрессирования была значимо выше только у больных АА. Общая одногодичная выживаемость у больных злокачественными глиомами после комплексного лечения с препаратами Темодал в двух режимах и ломустин статистически значимо не различалась между избранными режимами химиотерапии, но была значимо выше по сравнению с контролем. В I группе больных были достигнуты показатели пятилетней выживаемости при АА – 16,0±10% (р<0,05) и четырехлетней выживаемости при МГБ – 8,8±4,2% (р<0,05).
- У больных с рецидивами злокачественных глиом или прогрессированием заболевания после комплексного лечения проведение повторной операции с химиолучевой или одной лучевой терапией увеличивает общую выживаемость, но ассоциируется с большей частотой поздних лучевых повреждений тканей головного мозга и критических органов. У больных I группы в срок до 5 лет частота поздних радионекрозов составила - 5,7%, а в контроле - 8,5%.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1.При благоприятном и неблагоприятном прогнозах у больных МГБ с первичной или рецидивной опухолью в послеоперационном периоде следует проводить ХЛТ с Темодалом в режиме 200 мг/м2/сут или 75 мг/м2/сут, с последующей ХТ до 6 курсов суммарно.
2.Больным АА с неблагоприятным прогнозом рекомендована лучевая терапия в самостоятельном варианте, так как ХЛТ с препаратами Темодал и ломустин у данной категории больных не имеет существенных преимуществ.
3.Энцефалосцинтиграфию с РФП 99mTc-Технетрил (ОЭКТ) следует включать в план обследования больных злокачественными глиомами головного мозга в качестве дополнительного метода диагностики к магниторезонансной томографии (МРТ), так как данные ОЭКТ позволяют более полно отразить динамику патологического процесса на контрольных этапах наблюдения больных.
СПИСОК ПУБЛИКАЦИЙ
- Осинов И.К. Контрастированная МРТ и ОЭКТ с 99mTc-Технетрилом в оценке лечения злокачественных глиом головного мозга Темодалом [текст] / О.Б. Величко, М.Н. Нечитайло, Л.И. Мусабаева, И.Ю. Ефимова, И.К. Осинов, В.П. Григорьев, В.Ю. Усов // Сибирский онкологический журнал. – 2006. - Прил.№ 1. - С. – 25.
- Осинов И.К. Переносимость лучевой терапии у больных с первичным поражением головного мозга в сочетании с химиотерапией Темодалом [текст] / И.К. Осинов, Л.И. Мусабаева, М.Н. Нечитайло // Сборник материалов научно-практической конференции: “Лучевое и химиолучевое лечение в онкологии”. – Египет, 2007. - С. – 52.
- Осинов И.К. Переносимость химиолучевой терапии у больных с глиальными опухолями головного мозга [текст] / И.К. Осинов, М.Н. Нечитайло // Сборник материалов II региональной конференции молодых ученых им. Академика РАМН Н.В. Васильева: ”Актуальные вопросы экспериментальной и клинической онкологии”.– Томск, 2007 - С. – 72.
- Осинов И.К. Лучевая терапия с Темодалом у больных злокачественными глиомами головного мозга [текст] / И.К. Осинов, М.Н. Нечитайло // Сборник материалов III региональной конференции молодых ученых им. Академика РАМН Н.В. Васильева ”Актуальные вопросы экспериментальной и клинической онкологии” Сибирский онкологический журнал.– Томск, 2008. Прил. № 1. - С. – 100-101.
- Осинов И.К. Химиолучевая терапия злокачественных глиом [текст] / И.К. Осинов, М.Н. Нечитайло, Л.И. Мусабаева, О.Б. Величко // Сборник материалов V съезда онкологов и радиологов СНГ. – Ташкент, 2008 - С. 55.
- Осинов И.К. Химиолучевое лечение у больных злокачественными глиомами головного мозга [текст] / И.К. Осинов, М.Н. Нечитайло // Сборник материалов Всероссийской научно-практической конференции молодых ученых: “Актуальные вопросы клинической и экспериментальной медицины”. - Санкт-Петербург, 2008. - С. 142-144.
- Осинов И.К. Комбинированное лечение злокачественных глиом головного мозга [текст] / И.К. Осинов, М.Н. Нечитайло, Л.И. Мусабаева, О.Б Величко, Н.Г. Катаева, И.Н. Удинцева, И.Г. Синилкин // Сборник материалов V региональной конференции посвященной 120-летию лечебного факультета СибГМУ: «Достижения современной лучевой диагностики в клинической практике”. – Томск, 2008.- С. 262-264.
- Осинов И.К. Лучевая терапия в сочетании с Темодалом в лечении опухолей ЦНС [текст] / И.К. Осинов, Л.И. Мусабаева // Сборник материалов XII Российского онкологического конгресса. – Москва. - С. 144.
- Осинов И.К. Комбинированное лечение злокачественных глиом [текст] / И.К. Осинов, М.Н. Нечитайло, Л.И. Мусабаева // Сборник материалов X конгресса с международным участием: “Паллиативная медицина и реабилитация в здравоохранении”. - Турция, 2008. - С. 121.
- Осинов И.К. Химиолучевая терапия с Темодалом злокачественных глиом головного мозга [текст] / И.К. Осинов, М.Н. Нечитайло, Л.И. Мусабаева // Сборник материалов III конгресса с международным участием: “Опухоли головы и шеи”. – Сочи, 2009. С – 55.
- Осинов И.К. Химиолучевая терапия мультиформной глиобластомы [текст] / И.К. Осинов, Л.И Мусабаева, М.Н. Нечитайло // Сборник материалов Всероссийской научно-практической конференции с международным участием: «Проблемы современной онкологии”. – Барнаул, 2009 – С. 181.
- Осинов И.К. Результаты химиолучевой терапии злокачественных глиом головного мозга [текст] /И.К. Осинов, Л.И. Мусабаева, Е.Л. Чойнзонов, М.Н. Нечитайло // Сборник материалов Российской научно-практической конференции с международным участием посвященной 30-летию НИИ онкологии СО РАМН: “Современная онкология: достижения и перспективы развития». - Томск, 2009 – С. 33.
- Осинов И.К. Новая технология лечения злокачественных новообразований головного мозга с применением химиолучевой терапии [текст] /И.К. Осинов, Л.И. Мусабаева, Е.Л. Чойнзонов, М.Н. Нечитайло // Сборник материалов III научно-практической конференции с международным участием: “Инновационные технологии в медицине”.– Хургада, 2009. – С. 178.
- Осинов И.К. Химиолучевое лечение злокачественных глиом головного мозга с применением Темодала [текст] / И.К. Осинов, Л.И. Мусабаева, Е.Л. Чойнзонов, М.Н. Нечитайло // Сибирский онкологический журнал – 2009. - № 6.- С. 5-12.
- Осинов И.К. Химиолучевая терапия злокачественных глиом головного мозга [текст] / И.К. Осинов, Л.И. Мусабаева, Е.Л. Чойнзонов, М.Н. Нечитайло // Сборник материалов III Евразийского конгресса по медицинской физике и инженерии: “Медицинская физика 2010”.– Москва, 2010. – С. 87.
СПИСОК УСЛОВНЫХ СОКРАЩЕНИЙ
АА – анапластическая атроцитома
ЛТ – лучевая терапия
МГБ – мультиформная глиобластома
МРТ – магниторезонансная томография
ОЭКТ – однофотонная эмиссионная компьютерная томография
РОД – разовая очаговая доза
СОД – суммарная очаговая доза
ХТ – химиотерапия
ХЛТ – химиолучевая терапия
CTC-NCIC – Clinical Trial Center of National Cancer Institute Canada
RPA – recursive partitioning analysis

