Совершенствование лабораторной диагностики онихомикозов на основе метода полимеразной цепной реакции
На правах рукописи
Сергеев Василий Юрьевич
Совершенствование лабораторной диагностики онихомикозов на основе метода полимеразной цепной реакции
14.00.11.- кожные и венерические болезни
Автореферат
диссертации на соискание ученой степени кандидата медицинских наук
Москва – 2008
Работа выполнена в ГОУ ВПО Московская медицинская академия им. И.М.Сеченова
Научный руководитель:
Доктор медицинских наук, профессор Иванов Олег Леонидович
Официальные оппоненты:
Доктор медицинских наук, профессор Баткаев Эдгем Абдулахатович
Доктор медицинских наук, профессор Гладько Виктор Владимирович
Ведущая научная организация:
ГОУ ВПО Российский Университет Дружбы Народов
Защита диссертации состоится «____» ____________ 2008 г.
на заседании диссертационного совета Д 208.040.10 ГОУ ВПО Московская медицинская академия им. И.М. Сеченова
(119991, Москва, ул. Трубецкая, д. 8, строение 2).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Московская медицинская академия им. И.М. Сеченова
(117997, Москва, Нахимовский проспект, д. 49).
Автореферат разослан «____» ____________ 2008 г.
Ученый секретарь Диссертационного совета Д.208.040.10
доктор медицинских наук, профессор Эрдес Светлана Ильинична
Актуальность проблемы.
Дерматомикозы относятся к числу наиболее распространенных инфекций человека. В международных исследованиях установлено, что грибковые инфекции ногтей обусловливают до 25% обращаемости к дерматологу [Haneke E., Roseeuw D., 2001]. Данные сплошной диспансеризации в России показали, что онихомикоз может быть выявлен у 5% взрослого городского населения [Сергеев А.Ю. и соавт., 2002].
До настоящего времени диагностика микозов кожи и ногтей включала методы, требующие существенных временных и материальных затрат (микробиологическая, реже гистологическая и иммунологическая диагностика), или недостаточно чувствительные и зависящие от субъективного мнения врача-лаборанта (световая микроскопия) [Lawry M. et al., 2000; Weinberg J. et al., 2003; Lilly K. et al., 2006]. Для того чтобы преодолеть эти недостатки в повседневной практике, приходится выполнять повторные или множественные исследования [Kane J. et al. 1997; Суколин Г.И. и соавт., 2005]. До сих пор существуют разногласия в интерпретации результатов микологического исследования, оценки роли разных видов и групп грибов в этиологической структуре онихомикоза [Степанова Ж.В., 2003; Summerbell R. et al., 2005]
Новое развитие лабораторная диагностика микозов получила с появлением молекулярно-генетических методов, позволяющих выделить ДНК возбудителей [Verweij P. et al., 2000]. В данной области появляется возможность разрабатывать эффективные, применимые на практике, организационно и экономически приемлемые методики. Возможность использования одношагового подхода к диагностике (в частности, ПЦР), доступного во многих лабораториях и не требующего переподготовки персонала, не нуждающегося в дополнительной обработке материала или особых предосторожностях по сбору образцов, делает разработку этого метода перспективной для врачей общей практики [Tietz H., 2005; Feuilhade de Chauvin M., 2005].
Вплоть до настоящего времени за рубежом не удалось внедрить и на достаточном числе больных показать эффективность и практическую применимость какой-либо одношаговой технологии по определению возбудителей дерматомикозов непосредственно в клиническом материале [Kardjeva V. et al., 2006; Monod M. et al., 2006; Brillowska-Dabrowska A. et al., 2007; Gupta A. et al., 2007; Savin C. et al., 2007]. Внедрение нового метода, претендующего на роль золотого стандарта в диагностике онихомикозов, требует тщательной оценки точности, чувствительности и специфичности, для чего необходимы повторные обследования значительных контингентов, катамнестические наблюдения.
Учитывая перечисленные выше факты, разработка и внедрение микологической ПЦР диагностики представляет актуальную задачу современной дерматологии, решение которой будет способствовать эффективному выявлению и совершенствованию терапии онихомикозов.
Цель исследования.
Оценить точность и возможности клинического использования метода полимеразной цепной реакции при онихомикозах для совершенствования на этой основе диагностики, лечения и профилактики заболевания.
Задачи исследования.
- Провести сравнительный анализ результатов регламентированных методов диагностики онихомикозов и ПЦР на различных стадиях заболевания и в различных группах обследованных.
- Изучить точность, специфичность и чувствительность ПЦР как метода лабораторного подтверждения диагноза онихомикоза.
- Изучить возможности ПЦР как метода контроля излеченности и оценки результатов лечения онихомикоза в динамике.
- Изучить современную этиологию онихомикозов с помощью видоспецифичной генодиагностики.
- Разработать алгоритм современной диагностики онихомикозов на основе применения полимеразной цепной реакции.
Научная новизна исследования.
Впервые на большом клиническом материале изучены результаты использования отечественной диагностической ПЦР системы с использованием пары видоспецифичных праймеров T. rubrum и T. mentagrophytes var. interdigitale. Показаны высокая точность, специфичность и чувствительность нового метода.
Впервые на основе методов высокоточной видоспецифической молекулярной диагностики уточнена современная этиологическая картина онихомикозов, выявившая увеличение доли дерматофитов.
На основе полученных данных предложена новая концепция диагностики онихомикозов (выделяющая ПЦР-позитивный и ПЦР-негативный онихомикоз) и разработан эффективный диагностический алгоритм.
Основные положения, выносимые на защиту.
- Изученная методика ПЦР – высокоточный диагностический тест, результаты которого достоверно соответствуют результатам регламентированных методов диагностики онихомикозов. По выявляемости заболевания ПЦР превосходит регламентированные методы.
- Применение ПЦР в изучении этиологии онихомикозов позволяет достоверно уточнять значение и роль дерматофитов в этиологической структуре заболевания.
- Внедрение ПЦР позволяет повысить качество лабораторной диагностики онихомикозов и совершенствовать лечебно-профилактические мероприятия.
Практическая значимость.
В клиническую практику предложен новый метод диагностики, позволяющий устанавливать диагноз онихомикоза с точностью, достоверно превосходящей существующие регламентированные методы.
Разработан новый диагностический алгоритм лабораторной диагностики онихомикозов, позволяющий резко сократить экономические и временные затраты на дорогостоящие микробиологические исследования у более 96% больных онихомикозами.
Метод ПЦР позволяет проводить экспресс-диагностику онихомикозов с одновременной видовой идентификацией главных возбудителей, что обеспечивает своевременную этиотропную терапию. Методика сбора материала не требует специальной подготовки и ПЦР можно рекомендовать для массовых обследований.
Метод ПЦР делает возможной раннюю оценку микологической излеченности и эффективности терапии онихомикозов в динамике, что позволит сократить сроки наблюдения больных.
Материалы исследования легли в основу «Инструкции по применению набора реагентов для определения ДНК Трихофитон рубрум (Trichophyton rubrum) и Трихофитон ментагрофитес, вар. интердигитале (Trichophyton mentagrophytes var. interdigitale) методом полимеразной цепной реакции ТрифАм», утвержденной Приказом Росздравнадзора от 16.07.2007г № 1563-Пр-07.
Внедрение в практику.
Результаты исследования внедрены и используются в практической работе Клиники кожных и венерических болезней ММА имени И.М. Сеченова, Института аллергологии и клинической иммунологии, Лечебно-реабилитационного центра «МедикоС», кафедры дерматовенерологии и микологии РМАПО.
Апробация работы.
Основные положения диссертации представлены и обсуждались на заседаниях 2 международной конференции Trends in medical mycology (Берлин, 2005), V Всероссийского конгресса по медицинской микологии (г. Москва, 2007 г.) и Московского научного общества дерматовенерологов имени А.И. Поспелова (г. Москва, 2007 г.), Областной научно-практической конференции врачей дерматовенерологов (г. Тула, 29.11.2007 г.), Юбилейной XXV научно-практической конференции с международным участием «Рахмановские чтения. Современная дерматовенерология: от истории к инновациям», Москва 2008, II Съезде микологов России, Москва 2008. Диссертация апробирована на научной конференции кафедры кожных и венерических болезней лечебного факультета Московской медицинской академии имени И.М. Сеченова.
Публикации.
По теме диссертации опубликовано в печати 13 научных работ, в том числе глава в монографии «Грибковые инфекции. Руководство для врачей», изд. 2-ое, М.: Бином-пресс, 2008.
Структура диссертации.
Работа изложена на 159 страницах компьютерного текста, состоит из введения, обзора литературы и глав, содержащих изложение материалов и методов исследования, результатов собственных исследований, заключения, выводов и указателя литературы. Указатель литературы включает 29 отечественных и 137 зарубежных работ. Диссертация иллюстрирована 15 рисунками и 43 таблицами.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования.
Работа выполнена за период с 2006 по 2008 год на кафедре Кожных и венерических болезней лечебного факультета ММА имени И.М. Сеченова. Клинической базой служили Лечебно-реабилитационный центр «Медико-С» и ФГУ «Поликлиника №1» УД Президента РФ. Микробиологические исследования проводились в Межклинической микробиологической лаборатории ЦКБ ГМУ УД Президента РФ. Молекулярно-генетические исследования проводились в лаборатории ООО «Диасан». Исходные работы по созданию праймеров для данного исследования выполнялись совместно с НПФ «Гентех» и Институтом молекулярной генетики РАН.
Общая характеристика группы наблюдения
Материалом для настоящего исследования служила сплошная выборка пациентов численностью 4259 человек, обращавшихся к дерматологу по поводу изменений ногтей в 2005-2007 гг. Обследование проходили как больные с онихомикозом, так и пациенты с подозрением на онихомикоз, в том числе с ониходистрофиями.
Все пациенты обращались по поводу поражения ногтевых пластин пальцев кистей и стоп. Среди обследованных пациентов мужчин было 56,1%, женщин – 43,9%; в возрасте от 18 до 69 лет, средний возраст составил 39 лет.
В особую группу рандомизировано 300 больных с клиническим диагнозом онихомикоза, подтвержденным регламентированными методами. Клиническая оценка тяжести онихомикоза проводилась по специально разработанной форме, включающей локализацию поражения и количество пораженных ногтей. Оценивалась клиническая форма заболевания, выраженность гиперкератоза, а также степень вовлеченности ногтевой пластины от края ногтя до его проксимальной части. Оценивалось предшествующее системное лечение. Всем больным проводили комплексное обследование, включавшее, при необходимости, общий клинический и биохимический анализ крови, мочи, функциональные пробы печени, при необходимости проводились инструментальные методы обследования. Критериями исключения из исследования были состояния, сопровождающиеся соматической патологией.
Из 300 обследованных особой группы больных мужчин было 58%, женщин 42% в возрасте 22–61 лет, средний возраст 40 лет. Локализация поражения на стопах встречалась у 92,7% больных, поражение ногтей на пальцах руки – у 19,7%, причем изолированное поражение ногтей пальцев рук – только у 7,3%. Длительность заболевания варьировала от 1 месяца до 30 лет, в среднем – 7,8 лет. Ранее получали системную противогрибковую терапию 18% больных. Клиническая форма онихомикоза была представлена дистально-латеральной у 294 больных, проксимальной – у 1 и белой поверхностной – у 5.
У больных с дистально-латеральной клинической формой онихомикоза выраженность подногтевого гиперкератоза была слабой (или отсутствовала) у 23% больных, умеренной (1-2 мм) у 46% и выраженной (более 2 мм) у 31%. При этом степень вовлеченности ногтевой пластины, считая от свободного края, составляла до 1/3 длины у 22% больных, от 1/3 до 2/3 у 48% и более 2/3 у 30%. Индекс КИОТОС у больных онихомикозом в этой группе принимал значения от 1 до 30 и в среднем равнялся 14 баллам.
В особую подгруппу вошло 408 больных, наблюдавшихся динамически в процессе лечения онихомикоза. Продолжительность наблюдения составляла 32-912 дней, средний срок наблюдения 198 дней. Данная подгруппа использовалась для катамнестического анализа эффективности первичной диагностики и результатов повторного обследования.
Методы исследования
В рамках данной работы при проведении ПЦР за основу была взята методика, использующая последовательности ДНК-топоизомеразы II, специфичные для отдельных видов дерматофитов [Сергеев А.Ю., Щербо С.Н., Богуш П.Г. и соавт., 2004].
Выделение ДНК из клинических образцов для ПЦР-анализа проводили на наборе «Реамикс» с предварительной инкубацией в течение 2 ч при 37 С в лизирующем растворе. Амплификацию проводили на диагностическом наборе «ТрифАм» НПФ «Гентех» (Москва).
В наборе «ТрифАм» применяется мультипраймерная полимеразная цепная реакция (ПЦР) с двумя парами олигонуклеотидных праймеров: одна пара праймеров специфична для фрагмента генома Trichophyton rubrum размером 925 пар нуклеотидов (п.н.), вторая пара праймеров специфична для фрагмента генома Trichophyton mentagrophytes var. interdigitale, 392 п.н.
Процесс амплификации заключался в повторяющихся циклах температурной денатурации ДНК, отжига праймеров с комплементарными последовательностями и последующей достройки полинуклеотидных цепей с этих праймеров ДНК-полимеразой.
Детекцию продуктов ПЦР проводили методом электрофореза в агарозном геле. Окрашенную этидиум бромидом ДНК в геле просматривали под ультрафиолетовым излучением. По наличию в образцах специфических фрагментов амплификации размером 925 п.н. и 392 п.н. судили о результатах ПЦР-анализа. Регистрацию результатов проводили визуально, с помощью гель-документирующей системы.
Постановку реакций проводили в соответствии с Инструкцией по применению набора реагентов для определения ДНК Трихофитон рубрум (Trichophyton rubrum) и Трихофитон ментагрофитес, вар. интердигитале (Trichophyton mentagrophytes, var.interdigitale) методом полимеразной цепной реакции ТрифАм (Приказ Росздравнадзора от 16 июля 2007 г. №1563-Пр-07).
Видоспецифичность праймеров в отношении T. rubrum и Trichophyton mentagrophytes подтверждена тестированием с культурами 7 видов дерматофитов, с использованием в контроле плазмид, содержащих искомые последовательности.
Исходная оценка точности изучаемого метода получена в слепом исследовании (n=44). Исходная чувствительность ПЦР-диагностики дерматофитии ногтей составила 94,4%, а специфичность – 95,2%, общая расчетная точность 94,8%. В качестве положительного контроля использовали культуру T. rubrum.
На основе полученных данных был разработан мультипраймерный (дуплекс) тест для диагностики онихомикоза, использующий 2 праймера, специфичные для T. rubrum и T. mentagrophytes. Данный тест выполнялся как стандартная методика ПЦР диагностики в настоящем исследовании.
Комплекс регламентированных методов диагностики онихомикозов в настоящей работе включал:
1) непосредственное изучение патологического материала в светооптическом микроскопе. Предварительную обработку материала производили в растворе щелочи (20% KOH) с часовой экспозицией.
2) посев на питательную среду (Сабуро с добавками антибиотиков) с последующей идентификацией полученной культуры путем оценки ее макро- и микроморфологических свойств. Пробирки со средой выдерживали в термостате при 25 С, максимальный срок инкубации 4 нед. При необходимости для нужд идентификации производили пересев на специальные питательные среды или изучение в зимо-ауксанографической системе «BBL MycoTube» («Becton Dickenson», США), в случае выделения Candida spp.
Методика сбора материала для ПЦР и регламентированных методов была стандартной и включала взятие фрагментов ногтевой пластины маникюрными ножницами или кусачками, соскобов из-под ногтевой пластины или с ее поверхности с помощью скальпеля или лезвия бритвы, с предварительной обработкой поверхности ногтя раствором 70 % медицинского спирта.
Статистическая обработка результатов проводилась с использованием описательных методов вариационной статистики, дисперсионного и корреляционного анализа, элементов дискриминантного анализа и байесовой статистики. Использовались прикладные статистические пакеты «SPSS 11», MedCalc, а также программы ввода и экспорта баз данных, табличный и текстовый процессоры.
Результаты исследований.
Оценка соответствия результатов ПЦР и регламентированных методов лабораторной диагностики онихомикозов.
С помощью ПЦР теста на T. rubrum и T. mentagrophytes var. interdigitale было обследовано 3257 пациента с патологией ногтей. Результат ПЦР оказался положительным у 1704 (52,3%), отрицательным – у 1553 (47,7%) пациентов.
С помощью KOH микроскопии было обследовано 3212 пациентов с патологией ногтей. Результат KOH микроскопии оказался положительным у 1745 (54,3%), отрицательным – у 1467 (45,7%) пациентов.
Посев патологического материала с выделением и идентификацией культуры гриба был проведен у 865 пациентов с патологией ногтей. Результат культивирования оказался положительным (рост любого гриба) у 538 (62,2%), отрицательным (нет роста) – у 327 (37,8%) пациентов. Выявляемость дерматофитии ногтей по данным посева составила 27,4%.
Среди пациентов с положительным результатом ПЦР, результат KOH микроскопии оказался положительным у 1118 (86,5%). Среди всех выделенных культур грибов от больных с положительным результатом ПЦР, доля культур дерматофитов составила 91,4%, при общей выделяемости культур в 65,4%.
Выявляемость онихомикоза с помощью ПЦР была изучена на фоне положительных и отрицательных результатов регламентированных методов. На фоне положительных результатов КОН микроскопии выявляемость дерматофитии ногтей с помощью ПЦР на 7,5% превышала выявляемость дерматофитов в посеве. На фоне положительных результатов посева выявляемость онихомикоза в ПЦР на 9% превышала выявляемость с помощью КОН микроскопии. Прирост выявляемости онихомикоза с помощью ПЦР на фоне отрицательных результатов микроскопии составил 18%. Прирост выявляемости онихомикоза с помощью ПЦР на фоне отрицательных результатов посева составил 50%. Прирост выявляемости с помощью ПЦР на фоне отрицательных результатов каждого из регламентированных методов (при тройном сопоставлении) составляет 32,7%.
Таким образом, использование ПЦР обеспечивает существенный прирост выявляемости онихомикоза, по сравнению с регламентированными методами.
Для оценки статистической достоверности соответствий результатов ПЦР и регламентированных методов диагностики онихомикозов были построены таблицы сопряженности. В табл. 1 представлено соответствие результатов 2532 случаев парного обследования с помощью ПЦР и КОН микроскопии.
Таблица 1. Соответствие результатов ПЦР и КОН микроскопии
| Результат ПЦР | Результат КОН микроскопии | Всего | |
| Положительный | Отрицательный | ||
| Положительный | 1118 | 174 | 1292 |
| % от результата ПЦР | 86,5% | 13,5% | 100% |
| % от результата KOH микроскопии | 72,6% | 17,6% | 51% |
| % от всех результатов | 44,2% | 6,9% | 51% |
| Отрицательный | 423 | 817 | 1240 |
| % от результата ПЦР | 34,1% | 65,9% | 100% |
| % от результата KOH микроскопии | 27,4% | 82,4% | 49% |
| % от всех результатов | 16,7% | 32,3% | 49% |
| Всего | 1541 | 991 | 2532 |
| % от результата ПЦР | 60,9% | 39,1% | 100% |
В табл. 2 представлено соответствие результатов 291 случая парного обследования с помощью ПЦР и посевов материала из ногтей.
Таблица 2. Соответствие результатов ПЦР и посевов материала из ногтей
| Результат ПЦР | Результат культивирования | Всего | |
| Положительный | Отрицательный | ||
| Положительный | 117 | 62 | 179 |
| % от результата ПЦР | 65,4% | 34,6% | 100% |
| % от результата культивирования | 70,1% | 50% | 61,5% |
| % от всех результатов | 40,2% | 21,3% | 61,5% |
| Отрицательный | 50 | 62 | 112 |
| % от результата ПЦР | 44,6% | 55,4% | 100% |
| % от результата культивирования | 29,9% | 50% | 38,5% |
| % от всех результатов | 17,2% | 21,3% | 38,5% |
| Всего | 167 | 124 | 291 |
| % от результата ПЦР | 57,4% | 42,6% | 100% |
Критерий выявил достоверное соответствие для пар результатов ПЦР и КОН микроскопии (при P<0,001), ПЦР и посевов с выделением любой культуры (при P=0,01). Достоверность соответствий была подтверждена также в тестах корреляции Спирмана и Мантеля-Хентцля.
Дискриминантный анализ с построением классифицирующей схемы показал, что доля положительных результатов ПЦР является достоверным дискриминирующим фактором, ассоциированным с положительными результатами регламентированных методов. Результаты ПЦР показывают высокую конкордантность с данными КОН микроскопии и посева.
Положительный результат ПЦР отмечается в 95,6% случаев онихомикоза, подтвержденного обоими регламентированными методами, а при дерматофитии ногтей вероятность отрицательного результата ПЦР не выходит за рамки показателя статистической погрешности (=0,05).
Катамнестическая оценка точности ПЦР.
Катамнестическая оценка точности ПЦР проведена в группе из 180 пациентов с онихомикозом. Критерием, дополнительно подтверждающим диагноз онихомикоза, был выбран факт наблюдения врачом клинического излечения или улучшения после назначения системной противогрибковой терапии.
В данной группе положительных результатов ПЦР оказалось 154, отрицательных – 26, в том числе – у 12 больных с зарегистрированной эффективностью системной терапии. Ложноположительных результатов ПЦР не отмечено. Таким образом, по данным катамнеза, чувствительность ПЦР в диагностике онихомикозов любой этиологии составляет 92,7%, а специфичность – 100%, общая точность – 93,3%. Эти показатели выше, чем у регламентированных методов, даже без поправки на вероятную этиологическую неоднородность онихомикоза.
Использование ПЦР в оценке эффективности лечения онихомикозов.
Для определения возможностей ПЦР в оценке эффективности терапии онихомикозов была изучена динамика результатов лабораторных анализов в группе из 149 больных онихомикозом. Из них мужчин было 87, женщин – 62, средний возраст больных 40,5±10 лет. У всех больных диагноз онихомикоза был установлен на основании типичной клинической картины, при этом у всех обследованных больных наблюдалась дистальная форма онихомикоза, индекс КИОТОС составлял 16±6,8 баллов. В группу обследования вошли больные с поражением ногтей стоп, при давности заболевания 9,2±7 лет. Обследованным больным ранее не проводилась системная терапия противогрибковыми средствами.
Диагноз онихомикоза подтвержден положительными результатами KOH микроскопии и ПЦР. Все больные получили стандартные трехмесячные курсы системной терапии итраконазолом (пульс-терапии). При клинико-лабораторных исследованиях больные не имели противопоказаний к ее назначению. После проведения адекватного лечения у всех больных повторно были проведены KOH микроскопия и ПЦР. Дополнительно проанализирована группа из 185 пациентов с однократным выполнением ПЦР или КОН микроскопии в ходе лечения. Введение результатов повторной КОН-микроскопии как дополнительного критерия оценки подтвердило точность исходных результатов ПЦР.
Были изучены сроки негативации результатов ПЦР и КОН микроскопии при их повторном назначении в ходе лечения онихомикоза. Среднее время, прошедшее от начала лечения пациентов, у которых не была выявлена динамика результатов КОН микроскопии и ПЦР, составило 136±84дней, в группе с негативацией одного из анализов – 123±58дней, а в группе пациентов с негативацией и КОН микроскопии и ПЦР – 151±103дней. При этом исходная тяжесть онихомикоза достоверно не влияла на эти различия.
В среднем на 4 месяце лечения негативация результатов ПЦР отмечалась в 2 раза чаще, чем негативация результатов KOH микроскопии. Негативация половины результатов ПЦР наступала в более ранние сроки по сравнению с КОН микроскопией. Для ПЦР медиана по времени негативации составляет 134,56 дней, а для КОН микроскопии – 172,4 дня. Таким образом, разница в сроках негативации результатов между ПЦР и КОН микроскопией в ходе лечения составляет, 37,8 дней (более 5 недель).
Основываясь на чувствительности метода ПЦР диагностики дерматофитий, предусматривающей не более 1000 копий/мл генома T. rubrum и T. mentagrophytes var. interdigitale, мы можем заключить о новом подходе в оценке эффективности терапии онихомикозов – количественной оценке копий генома возбудителей в ногтевой пластине. По нашим данным, контрольные лабораторные исследования с помощью ПЦР можно проводить уже на 4 месяце от начала лечения.
Изучение этиологии онихомикозов c помощью ПЦР.
Среди 1704 положительных результатов ПЦР генетический материал T. rubrum был обнаружен у 1541 (90,4%), T. mentagrophytes var. interdigitale – у 121 (7,1%), а генетический материал двух этих видов у 42 (2,5%) больных.
На фоне положительных результатов микроскопии доля положительных результатов ПЦР составляет 72,6%, а на фоне положительных результатов культивирования – 70,1%.
Видовая и родовая идентификация произведена для 357 из 538 посевов, давших рост культуры. До уровня вида идентифицированы 237 культур дерматофитов, 26 культур грибов рода Candida и 29 культур плесневых грибов. Из остающихся культур плесневых грибов 17 идентифицированы до уровня рода (Alternaria – 2; Aspergillus – 5, Ulocladium – 2) или порядка (Mucorales – 8), а среди дрожжей 48 культур идентифицированы как Candida spp. Видовая и родовая этиология онихомикоза по числу выделенных культур представлена в табл. 3.
Таблица 3. Видовая и родовая этиология онихомикоза по числу выделенных культур
| Виды и роды грибов | Идентифицированные культуры | |
| Число культур | % | |
| Trichophyton rubrum | 231 | 64,7 |
| Trichophyton mentagrophytes var. interdigitale | 6 | 1,7 |
| Candida albicans | 21 | 5,9 |
| Candida glabrata | 5 | 1,4 |
| Candida spp. | 48 | 13,4 |
| Aspergillus fumigatus | 12 | 3,4 |
| Aspergillus flavus | 4 | 1,1 |
| Aspergillus niger | 13 | 3,6 |
| Прочие виды Aspergillus | 5 | 1,4 |
| Alternaria spp. | 2 | 0,6 |
| Ulocladium spp. | 2 | 0,6 |
| Грибы из порядка Mucorales | 8 | 2,2 |
| Всего | 357 | 100% |
Среди идентифицированных видов, в порядке убывания, выделялись Trichophyton rubrum (64,7%), Candida albicans (5,9%), Aspergillus niger (3,6%), Aspergillus fumigatus (3,4%), Trichophyton mentagrophytes var. interdigitale (1,7%), Candida glabrata (1,4%), Aspergillus flavus (1,1%).
На фоне положительных результатов ПЦР дерматофиты выделялись в 89,8%, плесневые грибы и Candida spp. – с равной частотой в 5,04%. На фоне отрицательных результатов ПЦР выделялись грибы рода Aspergillus (14, в том числе 9 – A. fumigatus и 3 – A. niger), Candida albicans (13), C. glabrata (1), а также Ulocladium sp. (1), Alternaria sp. и зигомицеты Mucorales (2).
На фоне положительных результатов KOH микроскопии, рост T. rubrum наблюдался у 137 пациентов (79,4%), T. mentagrophytes var. interdigitale – у 4 (2,3%), Candida spp. – у 13 (7,4%), а рост плесневого гриба – у 19 (10,9%) пациентов.
Для перекрестной оценки этиологии по данным всех методов обследования (ПЦР, КОН микроскопии и культивирования) были изучены результаты выборки, в которой выполнялись все три метода и при этом была произведена видовая или родовая идентификация (рис. 1).

Рисунок 1. Распределение основных этиологических групп при онихомикозе в зависимости от результатов КОН микроскопии (по горизонтали) и ПЦР (по вертикали)
Для изучения возможностей ПЦР как потенциальной замены микологическому исследованию было проанализировано количество случаев ПЦР и культивирования, дающих этиологически значимые ответы. Для этого была построена таблица сопряженности результатов ПЦР, КОН микроскопии и случаев выделения культур дерматофитов (на выборке из 214 случаев, когда обследование проводилось всеми тремя методами и были установлены этиологические группы).
При положительном результате КОН микроскопии рост культуры дерматофитов отмечен в 63,8% (90) случаев, а положительный результат ПЦР в 60,9% (86). В целом, ПЦР способна заменить культивирование как минимум в 91% случаев (положительные результаты ПЦР на фоне роста культур дерматофитов).
Дискриминантный анализ с построением классифицирующей статистической схемы показал, что результаты ПЦР наилучшим образом были способны достоверно предсказать распределение случаев онихомикоза по этиологическим группам. Положительный результат ПЦР являлся дискриминирующим фактором этиологии и предсказывал выделение дерматофитов в культуре в 92,2%. При этом, по сравнению с ПЦР, результат КОН микроскопии позволял предсказать дерматофитию ногтей только в 67,1% случаев. Таким образом, результаты ПЦР являются наиболее достоверными предикторами выделения дерматофитов в культуре, что позволяет в течение 48 часов ставить этиологический диагноз онихомикоза.
Анализ соответствия результатов ПЦР и регламентированных методов на большой выборке больных с онихомикозом позволил по-новому оценить удельный вес различных этиологических групп при онихомикозе. На основе этой оценки впервые предложена концепция ПЦР негативного онихомикоза. К ПЦР-негативному онихомикозу относятся случаи верифицированного онихомикоза, при которых результат ПЦР-теста отрицателен, независимо от истинной или предполагаемой этиологии инфекции.
Концепция ПЦР-негативного онихомикоза предполагает, что положительный ответ в ПЦР как видоспецифичного и высокоточного метода диагностики дерматофитии ногтей однозначно подтверждает диагноз дерматофитии, а дополнительные диагностические мероприятия могут потребоваться только при отрицательном ответе (ПЦР-негативность).
Данная концепция позволяет определить истинный удельный вес недерматофитного онихомикоза. С учетом данных ПЦР и концепции ПЦР-негативного онихомикоза доля грибов недерматофитов в общей этиологии онихомикоза, может, включая смешанные инфекции, составлять 8,2%. Эти данные позволяют переоценить сложившиеся представления о значении разных этиологических групп возбудителей онихомикоза, и тем самым – способствовать уточнению и перепрофилированию терапевтического арсенала, совершенствовать планирование закупок противогрибковых препаратов.
Новый алгоритм диагностики онихомикозов.
Сложный многоступенчатый анализ результатов ПЦР и регламентированных методов, данных катамнеза, повторного обследования и изучения этиологии позволил рассчитать точность и определить диагностическую ценность ПЦР. Данный метод показал себя наиболее точным из всех методик сравнения относительно результатов повторного тестирования и данных катамнеза. На основе множественных (от предельно строгих до относительно свободных) оценок интервал расчетной чувствительности ПЦР при онихомикозе любой этиологии составляет 74,4–93,4%, а специфичности – 52,0–80,1%. Для диагноза дерматофитии ногтей (В35.1) эти показатели составят, соответственно, 87,3–97,1% и 73,4–79,6%.
Прогностическая ценность положительного результата ПЦР при оценке общепринятыми методами составляет не менее 80% при онихомикозе в целом, или более 91% при дерматофитии ногтей, при отношении вероятности более 3 к 1. Прогностическая ценность отрицательного результата ПЦР для диагноза дерматофитии ногтей составляет не менее 95%, что практически исключает случаи заболевания, пропущенные при обследовании данным методом.
Анализ этих данных позволил предложить новый алгоритм лабораторной верификации онихомикоза на основе данных генодиагностики (рис. 2). Данный алгоритм впервые в мировой практике позволяет в течение 24 часов установить этиологический диагноз онихомикоза и начать специфическое лечение в 95% случаев дерматофитии ногтей и 80% случаев онихомикоза любой этиологии.
Одновременное использование ПЦР и КОН микроскопии при этом в 96,2% случаев исключает необходимость культурального исследования, сокращая общий срок обследования до 24 часов с немедленным назначением специфической терапии. При этом одновременно отрицательные результаты ПЦР и микроскопии в течение 24 часов с 97,3% вероятностью исключают диагноз онихомикоза любой этиологии.
Высокая прогностическая ценность отрицательного результата ПЦР для диагноза дерматофитии ногтей (код В35.1 по МКБ-10) имеет значение не только для выбора системной противогрибковой терапии, но и для определения противоэпидемических мероприятий. Исключение диагноза дерматофитии в течение 24 часов означает неконтагиозность больного, что снимает с повестки дня экстренные меры общественной и личной, первичной (в том числе профессиональной) и вторичной профилактики, оформление соответствующей документации, сокращает сроки наблюдения.
Дополнительное обследование больного в рамках данного алгоритма может потребоваться не более чем в 7% случаев патологии ногтей.
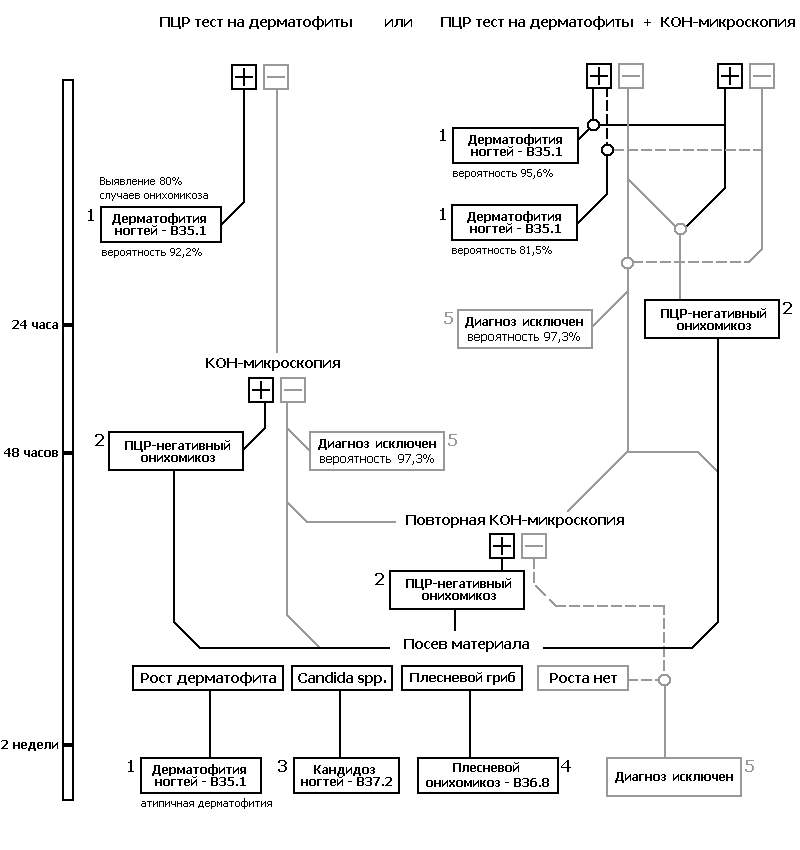 Рисунок 2. Новый алгоритм лабораторной диагностики онихомикозов
Рисунок 2. Новый алгоритм лабораторной диагностики онихомикозов
Таким образом, по совокупности оценок ПЦР представляется наиболее точным из существующих методов лабораторной диагностики онихомикоза, и может претендовать на роль нового золотого стандарта диагностики данного заболевания.
Выводы.
- Впервые проведены расширенные клинические испытания российской системы генодиагностики онихомикозов, позволяющей определять главных возбудителей (T. rubrum, T. mentagrophytes var. interdigitale) непосредственно в клиническом материале.
- Проведена комплексная оценка соответствия результатов ПЦР и регламентированных методов лабораторной диагностики онихомикозов. Использование ПЦР существенно повышает выявляемость онихомикоза по сравнению с регламентированными методами (18% для микроскопии и более 50% для посева), что подтверждается данными катамнеза и повторного обследования. Доказана высокая специфичность и чувствительность ПЦР, установлено достоверное соответствие результатов ПЦР и регламентированных методов.
- Показана возможность использования ПЦР в контрольной оценке эффективности лечения онихомикозов. В ходе системной терапии онихомикоза негативация результатов ПЦР наступает в достоверно более короткие сроки, по сравнению с КОН микроскопией. Результаты ПЦР могут быть использованы в оценке эффективности лечения онихомикозов, начиная с 4 месяца.
- На основании результатов ПЦР дана новая оценка этиологической структуры онихомикозов. Установлена ведущая роль грибов-дерматофитов, при падении доли плесневых и дрожжевых возбудителей онихомикоза ниже 10%. На основании данных генодиагностики уточнена роль Trichophyton rubrum в структуре дерматофитии ногтей, составившая более 90,4%. Предложена концепция ПЦР-негативного онихомикоза, представляющая новый подход к этиологической диагностике.
- Проведенные исследования послужили основой нового алгоритма лабораторной диагностики онихомикозов. Данный подход отличается высокой экономичностью, исключая необходимость микробиологических исследований более чем у 96% больных, и сокращая срок окончательного этиологического диагноза 80% случаев онихомикоза любой этиологии до одних суток.
Практические рекомендации.
- Российская система ПЦР диагностики дерматофитии рекомендуется к широкому использованию на практике, наряду с регламентированными методами верификации лабораторного диагноза онихомикоза.
- Целесообразна замена ПЦР культивирования как стандартного метода этиологической диагностики онихомикоза, что может быть осуществлено в большинстве лечебно-профилактических учреждений дерматовенерологического профиля, имеющих ПЦР лаборатории.
- Положительный результат ПЦР может быть использован как руководство к назначению системной терапии онихомикозов, специфичной для дерматофитии (тербинафин), а отрицательный результат ПЦР – к назначению системной терапии расширенного спектра действия (итраконазол).
- Рекомендуется внедрение ПЦР в систему контроля микологической излеченности онихомикозов.
Список опубликованных работ по теме диссертации.
- Сергеев В.Ю., Сергеев А.Ю. Гены, молекулярные методы и новые концепции в диагностике грибковых заболеваний. // Проблемы медицинской микологии, 2006 – Т. 8 – № 2 – С. 85.
- Сергеев А.Ю., Щербо С.Н., Богуш П.Г., Сергеев В.Ю., и соавт. Исследование точности нового метода ПЦР-диагностики онихомикозов. // Проблемы медицинской микологии, 2006 – Т. 8 – № 2 – С. 84-85.
- Сергеев А.Ю., Жарикова Н.Е., Сергеев В.Ю., и соавт. Генодиагностика и новый взгляд на этиологию онихомикозов. // Проблемы медицинской микологии, 2006 – Т. 8 – № 2 – С. 83-84.
- Сергеев А.Ю., Щербо С.Н., Богуш П.Г., Сергеев В.Ю. Приоритеты России в генодиагностике онихомикозов. // Материалы IV Научно-практической конференции памяти профессора Машкиллейсона А.Л., 2006 – С. 154-156.
- Сергеев В.Ю., Щербо С.Н., Богуш П.Г., и соавт. Чувствительность и специфичность российской системы ПЦР-диагностики онихомикозов. // Материалы IV Научно-практической конференции памяти профессора Машкиллейсона А.Л., 2006 – С. 164-165.
- Сергеев В.Ю., Сергеев А.Ю. Прогресс молекулярно-генетических технологий и новые концепции в диагностике наиболее распространенных микозов в дерматологии. // Материалы IV Научно-практической конференции памяти профессора Машкиллейсона А.Л., 2006 – С. 160-161.
- Сергеев В.Ю., Шербо С.Н., Богуш П.Г., Сергеев А.Ю. К истории зарубежных попыток построения систем генодиагностики онихомикозов. // Материалы IV Научно-практической конференции памяти профессора Машкиллейсона А.Л., 2006 – С. 162-163.
- Сергеев В.Ю., Маликов В.Е., Жарикова Н.Е. К вопросу о точности традиционных методов лабораторной диагностики онихомикозов: далеко ли им до «золотого стандарта»? // Материалы IV Научно-практической конференции памяти профессора Машкиллейсона А.Л., 2006 – С. 158-159.
- Сергеев В.Ю, Щербо С.Н., Сергеев А.Ю., Богуш П.Г. Российская система ПЦР-диагностики онихомикозов и новые лечебно-диагностические алгоритмы. // Успехи медицинской микологии. – Т. 10. – М.: Национальная академия микологии, 2007 – С. 163-165.
- Сергеев В.Ю. Молекулярная диагностика онихомикозов: опыт внедрения отечественной ПЦР-системы обнаружения возбудителей дерматофитии ногтей. // Иммунопатология, аллергология, инфектология, 2007 – № 3 – с. 17-24
- Сергеев В.Ю. Соответствие результатов ПЦР-теста и регламентированных методов диагностики при онихомикозе. // Современная микология в России. Том 2. Материалы 2-го Съезда микологов России. М.: Национальная академия микологии, 2008. – c. 450-451
- Сергеев В.Ю. Новый метод ПЦР в оценке результатов лечения онихомикоза. // Современная микология в России. Том 2. Материалы 2-го Съезда микологов России. М.: Национальная академия микологии, 2008. – c. 451
- Сергеев В.Ю. Иммунологическая и молекулярная диагностика. В кн. «Грибковые инфекции. Руководство для врачей», изд. 2-ое, М.: Бином-пресс, 2008. – Гл. 1, р. 1.4., с. 52-59.
Принятые в тексте сокращения.
ДНК дезоксирибонуклеиновая кислота
КИОТОС клинический индекс оценки тяжести онихомикозов
МКБ-10 международная классификация болезней 10 пересмотра
п.н. пар нуклеотидов
ПЦР полимеразная цепная реакция

