Анестезия и интенсивная терапия при трансплантации печени
На правах рукописи
Журавель Сергей Владимирович
АНЕСТЕЗИЯ И ИНТЕНСИВНАЯ ТЕРАПИЯ ПРИ ТРАНСПЛАНТАЦИИ ПЕЧЕНИ
14.01.20 - Анестезиология и реаниматология
14.01.17 - Хирургия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Москва - 2010
Работа выполнена в Научно-исследовательском институте скорой помощи им. Н.В. Склифосовского Департамента здравоохранения г. Москвы.
Научные консультанты:
доктор медицинских наук, профессор Тимербаев Владимир Хамидович
доктор медицинских наук, профессор Чжао Алексей Владимирович
Официальные оппоненты
доктор медицинских наук,
профессор Свиридов Сергей Викторович
доктор медицинских наук,
профессор Вишневский Владимир Александрович
доктор медицинских наук Кожевников Владимир Андреевич
Ведущая организация:
Российский научный центр хирургии им.Б.В.Петровского Российской академии медицинских наук
Защита диссертации состоится «__»_________2010 года в___ часов на заседании диссертационного совета Д.850.010.01 при Научно-исследовательском институте скорой помощи им. Н.В. Склифосовского по адресу: 129090, Москва, Б. Сухаревская пл., д.3.
С диссертацией можно ознакомиться в библиотеке Научно-исследовательского института скорой помощи им. Н.В. Склифосовского по адресу: Москва, Б. Сухаревская пл., д.3.
Автореферат разослан «__»____________2010г.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор А.А. Гуляев
СПИСОК ИСПОЛЬЗОВАННЫХ СОКРАЩЕНИЙ
АВСК - активированное время свертывания крови (сек);
АДс – систолическое артериальное давление;
АДср – среднее артериальное давление;
АДд – диастолическое артериальное давление;
АЧТВ – активированное частичное тромбопластиновое время;
АЭМ - аутологичная эритроцитарная масса;
БЭН - белково-энергетическая недостаточность;
ВВШ – вено-венозное шунтирование;
ГРС – гепаторенальный синдром;
ГЭК – гидроксиэтилкрахмалы;
ДЗЛА – давление заклинивания легочной артерии;
ДЛА – давление в легочной артерии;
ЗПТ – заместительная почечная терапия;
ИВЛ – искусственная вентиляция легких;
ИМТ – индекс массы тела;
ИТТ – инфузионно-трасфузионная терапия;
КОС – кислотно-основное состояние;
ЛСС – легочное сосудистое сопротивление;
ОМТ - окружность мышц плеча;
ОПСС – общее периферическое сосудистое сопротивление;
ОПН – острая почечная недостаточность;
ОТП – ортотопическая трансплантация печени;
ОЦК – объем циркулирующей крови;
МАК – минимальная альвеолярная концентрация;
МНО - международное нормализованное отношение;
МОС – минутный объем сердца;
ПБЦ – первичный билиарный цирроз;
РКФМ – растворимые комплексы фибринмономера;
РФ VIIa – VII активированный рекомбинантный фактор;
СВ – сердечный выброс;
СИ – сердечный индекс;
СЗП – свежезамороженная плазма;
ЦВД – центральное венозное давление;
ЦиПГ – центральная и периферическая гемодинамика;
УО – ударный объем;
ЧСС – частота сердечных сокращений;
SpO2 - насыщение артериальной крови кислородом;
SVO2 – насыщение смешанной венозной крови кислородом.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ.
АКТУАЛЬНОСТЬ ПРОБЛЕМЫ.
В настоящее время трансплантация печени является единственным радикальным методом лечения больных с конечной стадией диффузных заболеваний печени. Вместе с тем, в оперативном лечении заболеваний печени остаются нерешенные проблемы, как с позиций хирургов, так и анестезиологов-реаниматологов [Mandell M 2003].
Прогресс хирургической техники, улучшение качества консервирующих растворов донорской печени и разработка лекарственных средств, позволяющих эффективно проводить иммуносупрессию, привели к значимому улучшению исхода трансплантации печени - 80-90% реципиентов выживают в течение года после операции. Обращает на себя внимание, что большинство летальных случаев регистрируется интраоперационно и первую неделю после трансплантации печени.
Цирроз печени приводит к нарушению микроциркуляторной функции с формированием артериовенозных шунтов, увеличению сердечного выброса и снижению общего периферического сопротивления, что в ходе операции повышает вероятность развития гемодинамических нарушений вследствие как исходных системных нарушений, так и хирургических манипуляций и массивной кровопотери. Следует отметить, что переливание донорских компонентов крови является небезопасным для больного в связи с возможной передачей вирусных гепатитов (В, С, D), цитомегаловируса, а также возможностью тромбоза артериального анастомоза [Hendriks H.G. 2002]. Кроме того, массивная трансфузионная терапия опасна развитием полиорганной недостаточности в раннем послеоперационном периоде, что, в свою очередь, непосредственно влияет на возможное увеличение летальности [Ress R 2000].
В связи с этим, актуальными остаются вопросы изучения и коррекции изменений показателей центральной гемодинамики, изучения интраоперационного гемостаза, выбора объема и компонентов инфузионно-трансфузионной терапии.
Отдельного внимания заслуживает проведение нутриционной терапии. Особенно актуальным это становится в свете последних результатов, свидетельствующих о возможностях адекватной нутриционной терапии в снижении количества бактериальных осложнений в послеоперационном периоде [Попова Т.С. 2008].
Классическая техника выполнения трансплантации печени предполагает пережатие нижней полой вены, что может вызвать выраженные изменения системной гемодинамики. Экспериментальные работы послужили причиной внедрения техники вено-венозного обходного шунтирования с целью поддержания венозного возврата во время «беспеченочного» периода трансплантации печени. Альтернативной является техника гепатэктомии с сохранением ретропеченочного отдела нижней полой вены, при которой кровоток по нижней полой вене сохраняется во время всего беспеченочного периода. При этом выполняется боковое отжатие нижней полой вены при наложении каво-кавального и порто-портального анастомозов, что позволяет не использовать вено-венозное шунтирование [Reddy K.S. 2005]. К настоящему времени единого мнения о преимуществах и недостатках обсуждаемых методов не сложилось.
По данным разных авторов, острая почечная недостаточность развивается в 5-50% после трансплантации печени. Наиболее высокий риск развития почечной недостаточности отмечен при тяжелой дисфункции печени, как правило, являющейся следствием тяжелого гипоксического повреждения трансплантата. До настоящего времени в литературе встречаются неоднозначные сведения об эффективности диализных методов лечения острой почечной недостаточности (ОПН) после ортотопической трансплантации печени (ОТП). Так, по мнению ряда авторов, необходимость проведения заместительной почечной терапии (ЗПТ) после ОТП является плохим прогностическим признаком выживаемости реципиента [Thomas A. 2001, Restuccia T. 2004]. Дискутабельным остается вопрос о влиянии ЗПТ на остаточную функцию почек, в связи с чем, отсутствует однозначное мнение об оптимальном времени начала его проведения, поэтому нередко в клинической практике применяется отсроченный принцип начала гемодиализа.
Изложенное определило цель и задачи настоящего исследования.
ЦЕЛЬ ИССЛЕДОВАНИЯ: совершенствование тактики периоперационного ведения пациентов при трансплантации печени.
Задачи исследования:
- Изучить в эксперименте изменения показателей гемодинамики животных при трансплантации печени и выявить наиболее травматичные этапы оперативного вмешательства.
- Определить наиболее важные факторы, влияющие на гемодинамику больных при аллотрансплантации печени, а также тактику коррекции этих изменений.
- Оценить эффективность использования различных схем инфузионно-трансфузионной терапии у пациентов во время трансплантации печени.
- Определить преимущества и недостатки проведения вено-венозного шунтирования (ВВШ) при трансплантации печени.
- Разработать тактику нутриционной поддержки пациентов, которым проведена трансплантация печени.
- Разработать тактику ведения больных с развившейся острой почечной недостаточностью в послеоперационном периоде.
НАУЧНАЯ НОВИЗНА
Изучены основные параметры центральной гемодинамики в эксперименте на собаках при трансплантации печени.
Определены основные предпосылки интраоперационных нарушений гемодинамики при трансплантации печени.
Установлена эффективность и внедрено в практику использование эритроцитарной массы от трупного донора при трансплантации печени.
Исследована эффективность аVII рекомбинантного фактора при трансплантации печени.
Острая почечная недостаточность у больных с гепаторенальным синдромом после трансплантации печени имеет благоприятный прогноз при своевременном использовании методов заместительной почечной терапии.
Экстракорпоральные методы оказывают выраженный лечебный эффект по детоксикации организма и коррекции гомеостаза, являются средствами неотложной помощи после трансплантации печени.
Проведен анализ результатов применения глутамина после трансплантации печени.
ПРАКТИЧЕСКОЕ ЗНАЧЕНИЕ РАБОТЫ
Применение результатов исследования позволило прогнозировать особенности проведения анестезии в зависимости от исходных нарушений у пациентов с декомпенсированным циррозом печени.
Внедрение в практику умеренной гемодилюции и применение отмытых эритроцитов полученных от донора печени обеспечило оптимизацию инфузионно-трансфузионной терапии при трансплантации печени.
Выявлены преимущества выполнения трансплантации печени без применения вено-венозного обхода.
Внедрение унифицированной схемы питательной терапии, разработанная в результате исследования тактика заместительной почечной терапии позволили снизить риск развития осложнений в послеоперационном периоде и улучшить результаты лечения.
Результаты исследования позволили повысить качество анестезии и интенсивной терапии при трансплантации печени.
ВНЕДРЕНИЕ В ПРАКТИКУ
Основные положения настоящей диссертационной работы внедрены в клиническую практику ведения пациентов в периоперационном периоде при трансплантации печени, которые используются в НИИ СП им. Н.В. Склифосовского. Результаты исследования включены в программу последипломного обучения ординаторов, аспирантов и стажеров отделения трансплантации печени.
ПУБЛИКАЦИИ
По теме диссертации опубликованы 34 печатные работы, в том числе 14 статей в центральной печати.
АПРОБАЦИЯ ДИССЕРТАЦИИ
Основные положения и материалы диссертации доложены и обсуждены на следующих съездах и конференциях:
3-ей Сессии Московского научного общества анестезиологов и реаниматологов, Голицыно, 22 марта 2002 г.
9 Гастронеделе. Москва. 22.10.2003г.
IY Межрегиональной научно-практической конференции «Искусственное питание и инфузионная терапия больных в медицине критических состояний» Санкт-Петербург 21-22 апреля 2004 г.
4 Всероссийском съезде «Экстракорпоральные технологии». Дмитров 1-3 октября 2004 года.
Конференции в РНЦХ «Клиническая трансплантация органов» Москва. 14 апреля 2005.
9-ом международном конгрессе «Парентеральное и энтеральное питание» Москва. 2005 г
19-ом Европейском ежегодном конгрессе общества интенсивной терапии, Барселона, Испания. 24-26 сентября 2006 г.
1 конференции Межрегиональной общественной организации «Общество трансплантологов» Москва 18 апреля 2009г.
YII ассамблее «Здоровье столицы» Москва 2009г.
11-ой Сессии Московского научного общества анестезиологов и реаниматологов, Голицыно, 26 марта 2010 г
13-ом международном конгрессе «Парентеральное и энтеральное питание». Москва 2010 г.
Диссертация апробирована на заседании проблемно-плановой комиссии №8 «Реаниматология, анестезиология и интенсивная терапия»
Научно исследовательского института скорой помощи им. Н.В. Склифосовского 24 ноября 2009 года.
СТРУКТУРА И ОБЪЕМ ДИССЕРТАЦИИ
Диссертация изложена на …. страницах машинописного текста, состоит из введения, 6 глав, выводов, практических рекомендаций и списка литературы. Библиографический указатель включает 223 литературных источника. В работе содержится 41таблица и 25 рисунков.
СОДЕРЖАНИЕ РАБОТЫ.
Настоящая работа включает экспериментальное и клиническое исследование.
Экспериментальные наблюдения и методы исследования.
В основу экспериментального исследования были положены наблюдения, проведенные у 12 беспородных собак, которым выполнялась ортотопическая аллотрансплантация печени.
В премедикацию включали: реланиум 1мг/кг, кетамин 10мг/кг, дроперидол 0,25мг/кг. Индукцию в анестезию проводили внутривенным введением тиопентала 3мг/кг, фентанила 5мкг/кг, листенона 2мг/кг. После интубации трахеи начинали ИВЛ в режиме нормовентиляции. Анестезию поддерживали внутривенным болюсным введением калипсола, реланиума, фентанила. Инфузионно-трансфузионную терапию осуществляли растворами электролитов, коллоидами и свежей цельной кровью. В ходе исследования у собаки донора осуществляли забор крови в объеме 600±70 мл, которую использовали у собаки реципиента после венозной реперфузии печени. Правую наружную яремную вену и правую бедренную вену канюлировали и в дальнейшем использовали для проведения обходного шунтирования. Катетер Свана-Ганца устанавливали в легочную артерию через левую наружную яремную вену. Артериальное давление (АД) измеряли прямым методом. С этой целью катетеризировали селезеночную артерию после выполнения лапаротомии. Контроль интраоперационного состояния животного включал измерение частоты сердечных сокращений (ЧСС), АД, концентрации О2, СО2 в подаваемой воздушно-кислородной смеси и в конце выдоха. Минутный объем сердца (МОС) определяли методом термодилюции с помощью катетера Свана-Ганца. Остальные показатели центральной гемодинамики рассчитывали в автоматическом режиме. При этом использовали монитор СS-3 (Datex, Финляндия). Свертывающую систему контролировали, определяя активированное время свертывания крови (АВСК) на аппарате ACT II (Medtronic, США). В ходе исследования осуществляли регистрацию параметров центральной и периферической гемодинамики. 1- после выполнения лапаротомии, 2 -перед началом обходного шунтирования, 3 -при подключении вспомогательного кровообращения, 4 -перед окончанием агепатического периода, 5 -после венозной реперфузии пересаженной печени, 6 -после включения артериального кровоснабжения печени.
Характеристика клинических наблюдений и методы исследования.
В основу работы положены клинические наблюдения и исследования, проведенные у 96 взрослых пациентов, которым были выполнены 100 трупных пересадок печени, из них 4 ретрансплантации печени.
Ортотопическая трансплантация печени была выполнена по поводу различных диффузных поражений печени. Все операции проводились в экстренном режиме. Наиболее частым показанием для трансплантации печени являлся цирроз печени в исходе вирусного гепатита В или С (35%), цирроз вирусной этиологии в сочетании с гепатоцеллюлярным раком (16%), первичный билиарный цирроз (ПБЦ) (16%). Кроме того, первичный склерозирующий холангит (ПСХ), болезнь Вильсона-Коновалова, этанолиндуцированный, аутоиммунный, вторичный билиарный, криптогенный циррозы и синдром Бадда-Киари являлись показаниями для выполнения ОТП. Показанием для ретрансплантации печени (4%) являлось формирование вторичного билиарного цирроза трансплантата, вследствие билиарных осложнений.
Интраоперационный мониторинг показателей гемодинамики и венозный доступ.
После премедикации катетеризировали периферическую вену катетером 18G или 20G. После индукции в анестезию и интубации трахеи всем пациентам осуществляли пункцию и катетеризацию подключичной вены справа, а также внутренней яремной вены справа. В подключичную вену устанавливали 2-х или 3-х просветный катетер. Внутреннюю яремную вену катетеризировали интродьюсером размером 8 French (с дополнительным портом для проведения инфузионной терапии) через который в легочную артерию устанавливали термодилюционный катетер размером 7,5F фирмы Baxter или Edwards Lifesciences. Таким образом, 4 или 5 венозных доступа позволяли быстро и эффективно проводить ИТТ. Кроме того, при массивной кровопотере применяли устройство с возможностью создавать давление на пластиковый контейнер до 200 мм рт.ст для быстрой инфузии трансфузионных сред.
Премедикацию у пациентов осуществляли путем внутримышечного введения мидазолама (5-10 мг). Всем пациентам проводили деконтаминацию кишечника. С этой целью перорально назначали дифлюкан 150мг и гентамицин 160мг. Перед индукцией в анестезию внутривенно вводили Н2 блокаторы. Все операции были проведены в условиях сбалансированной общей анестезии: индукция - пропофол (1,4±0,3 мг/кг), фентанил (2,85±0,52 мкг/кг); миорелаксация: атракуриум бесилат (тракриум) (85,7 ± 12,63 мкг/кг) или цис-атракуриум (нимбекс) (0,55 ± 0,12 мг/кг). После индукции в анестезию начинали ингаляцию (0,8-1,5 об%) изофлюрана или севофлюрана (1,0-2,5 об%).
При выполнении вено-венозного шунтирования применяли магистрали Medtronic (США), оснащенные теплообменником.
Искусственную вентиляцию легких кислородно-воздушной смесью проводили с помощью наркозного аппарата ADU фирмы Datex (Финляндия) по методике «Low Flow». Закись азота не использовали. Суммарный поток свежих газов составлял 0,8-1,2 л/мин, с фракцией кислорода на вдохе - 40%. Дополнительно к изофлюрану или севофлюрану использовали болюсные введения фентанила и мидазолама 0,05-0,1 мг и 5мг соответственно. По ходу операции средняя потребность в фентаниле составила 2,7 ± 0,5 мкг/кг/ч, мидазолама 0,06 мг/кг/час. Атракуриум или нимбекс вводили с помощью дозатора 0,03 ± 0,01 мг/кг/ч и 0,14 ±0,02 мг/кг/час соответственно.
В интраоперационном и послеоперационном периодах регистрировали неинвазивным методом АД, ЭКГ, ЧСС, SpO2. С целью прямого контроля артериального давления катетеризировали лучевую артерию артериальным катетером (Ohmeda, США). С помощью катетера в легочной артерии контролировали в непрерывном режиме ДЛА, ЦВД.
Сердечный выброс измеряли термодилюционным методом путем трехкратного введения 0,9% раствора NaCL комнатной температуры. Были измерены и рассчитаны следующие показатели: СИ, ОПСС, ИОПСС, ЛСС, ДЗЛК определяли каждый час, а также на основных этапах операции. При этом использовали монитор СS-3 (Datex, Финляндия). Были измерены и рассчитаны показатели транспорта кислорода - доставка кислорода и потребление кислорода. Насыщение смешанной венозной крови кислородом SPO2 измеряли аппаратом (Vigileo, США).
КЩС артериальной и смешанной венозной крови, электролиты определяли аппаратом Сyron-348 (Великобритания). Контролировали уровень гемоглобина, гематокрита, натрия, калия, ионизированного кальция, рН, ВЕ.
В послеоперационном периоде проанализированы причины развития острой почечной недостаточности и исследована эффективность заместительной почечной терапии в лечении этого состояния, а также проводилась оценка питательной терапии. Определяли уровень креатинина, мочевины в плазме крови, суточную экскрецию креатинина и мочевины (анализ мочи), индекс резистентности на уровне междолевых ветвей почечной артерии (УЗИ), а также рассчитывали скорость клубочковой фильтрации (СКФ) по формуле:
СКФ=К мочи х объем мочи (сутки)/ К плазмы х время (мин).
Адекватность нутриционной терапии оценивали при исследовании уровня альбумина, преальбумина, лимфоцитов, холинэстеразы. Контролировали эффективность и осложнения при проведении парентерального и назоеюнального питания, а также при назначении сбалансированных питательных смесей. Энергозатраты определяли методом непрямой калориметрии в автоматическом режиме с помощью монитора CS 3 Datex. Иммунологический мониторинг включал исследование лимфоцитов периферической крови, а также их популяций CD3, CD4, CD8, CD16, CD56, пациентов методом проточной цитометрии в четырехпараметрическом анализе. Определяли фагоцитарную активность нейтрофилов в спонтанном и индуцированном НСТ – тесте, фагоцитоз латекса, иммуноглобулинов трех классов, циркулирующих иммунных комплексов трех фракций (ЦИК). Исследования проводились на цитофлуориметре FACSCalibur и МКАТ фирмы Becton Dickinson (CША) и нефелометре BN Pro Spec фирмы Behring (США).
Статистический анализ.
Статистическая обработка цифровых величин производилась с использованием программы «Статистика 7» (Stat Soft, США). Результаты представлены в формате М± (М - средняя арифметическая, - стандартное отклонение) при нормальном распределении и в формате М (медиана) (25-75 перцентили) при ненормальном распределении. Количественные результаты оценивали с помощью t-теста, если они имели нормальное распределение. Коэффициент Фишера применяли, когда частота явления была невелика. Непараметрические методы статистики использовали при выявлении ненормального распределения. Тест Манна-Уитни применяли для двух независимых выборок, критерий Уилкоксона использовали для выявлений внутригрупповых различий. Корреляционный анализ Спирмена применяли для установления взаимосвязи между различными выборками. Различия считали достоверными при р<0,05.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТАЛЬНОГО ИССЛЕДОВАНИЯ
Показатели гемодинамики в ходе добеспеченочного периода определялись стабильными, при этом объем инфузионной терапии составлял 8- 10 мл/кг/час. Кратковременные снижения АДсис. от 100 до 65 мм рт.ст. и ДЗЛК от 8 до 2 мм рт.ст регистрировались в 3 (25%) случаях во время мобилизации печени и сопровождались тахикардией 160-180 уд/мин. Причиной являлось пережатие нижней полой вены в ходе мобилизации печени, что сопровождалось снижением венозного возврата. Эти эпизоды не требовали назначения симпатомиметиков или увеличения объема инфузионной терапии.
Перед началом беспеченочного периода мы подключали аппарат Biopamp, с помощью которого осуществляли вено-венозное обходное шунтирование. Вспомогательное кровообращение продолжали в ходе всего беспеченочного периода и прекращали после венозной реперфузии печени.
Как видно из таблицы 1, при сравнении показателей гемодинамики перед началом обходного шунтирования и при подключении вспомогательного кровообращения АДсис. и ЧСС достоверно не изменялись и регистрировались стабильными без проведения дополнительной поддерживающей терапии. АД и ЧСС находились в пределах нормальных значений и к окончанию беспеченочного периода. Вместе с тем, подключение обходного шунтирования сопровождалось значимыми изменениями исследуемых показателей центральной гемодинамики.
Венозная реперфузия печени являлась этапом, выполнение которого сопровождалось наиболее выраженными изменениями показателей гемодинамики. Снятие зажимов с нижней полой и воротной вен и пуск кровотока через трансплантат приводил к следующим изменениям показателей системной гемодинамики:
АДсис. снижалось со 108±15 мм рт.ст. до 70±7 мм рт.ст. (р<0.05); ДЛАср. снижалось с 14±3 мм рт ст. до 7±2 мм рт.ст. (р<0,05); СИ снижался с 3,5±0,4 до 2,2±0.5; отмечено снижение расчетных показателей ИОПСС и ИЛСС.
Таблица 1
Динамика показателей ЦиПГ при ОТП в эксперименте.
| Показатели / Этап | Лапаротомия | Перед началом обходного шунти-рования | Начало ВВШ | Окончание беспеченочного периода | Реперфузия | После наложения артериального анастомоза |
| АДсис. мм рт ст. | 101±6 | 116±9 | 119±7 | 110±6 | 70±4* | 114±7* |
| ЧСС уд/ мин | 150±9 | 140±8 | 145±7 | 130±6 | 155±15 | 130±9 |
| ДЛАср мм рт ст. | 9±3 | 9±2,6 | 16±1,3* | 14±3 | 7±2* | 15±3* |
| ДЗЛА мм рт ст. | 4±0,8 | 8±1,8* | 11±2,5 | 7±1,1* | 5±2 | 8±2 |
| ЦВД мм рт ст. | 3±0,9 | 7±1,1* | 10±2,5 | 6±1,1* | 4±2 | 7±2 |
| ОПСС дин•с/см5хм2 | 2169±187 | 1783±117 | 2658±202* | 2383±185 | 1500±145* | 2588±240* |
| ЛСС дин•с/см5хм2 | 228±35 | 206±46 | 280±33* | 310±30 | 90±34* | 258±28* |
| СИ л/мин/м2 | 3,0±0,4 | 4,0±1.0 | 3,3±0,3 | 3,5±0,4 | 2,2±0.5* | 3,6±0,8 |
Примечание. * - р<0,05 при сравнении значений с предыдущим этапом. ** - р<0,05 при сравнении значений с исходными значениями.
В 6 (50%) экспериментах АД восстанавливалось в течение нескольких минут без применения дополнительной поддерживающей терапии. В 6 других случаях стабилизация показателей гемодинамики после венозной реперфузии была достигнута с помощью применения симпатомиметиков. Болюсное введение 2-3мл 0,1% мезатона разведенного в 20мл физиологического раствора приводило к повышению АД ср., СВ и ОПСС. При этом в 4 экспериментах (33%) после кратковременной стабилизации показателей гемодинамики регистрировалось снижение АД ср., ИОПСС, что потребовало назначение постоянной инфузии допмина в дозе 6-10мкг/кг/мин в течение последующих 2-3 часов оперативного вмешательства.
Полученные результаты свидетельствуют, что ИОПСС после венозной реперфузии в среднем снижалось на 38%, ИЛСС на 69% при сравнении с предыдущим этапом и именно эти изменения сосудистого тонуса приводили к падению системного АД. Восстановление сосудистого тонуса регистрировалось на фоне применения симпатомиметиков, инфузионной терапии и согревания животных. При этом сравнение показателей гемодинамики после восстановления артериального кровоснабжения печени с предыдущими измерениями показало значимые увеличения Адсис., ДЛАср., ИОПСС, ЛСС. Формирование желчеотводящего анастомоза, дренирование брюшной полости и ушивание операционной раны осуществлялось в условиях стабильных показателей гемодинамики.
Результаты клинических исследований.
Интраоперационная кардиовазотропная терапия при трансплантации печени.
Мы проанализировали показатели, которые могли влиять на назначение симпатомиметиков в добеспеченочном и беспеченочном периоде. В связи с этим ретроспективно выделили 1 группу пациентов (n=28), у которых применяли вазопрессоры и сравнили со 2 группой (n=72), которым не требовалось назначения симпатомиметиков в ходе добеспеченочного и беспеченочного этапов операции.
В добеспеченочном и беспеченочном периоде у 28 (28%) пациентов для поддержания показателей гемодинамики в нормальных значениях требовалось использование допмина в дозе 5-10мкг/кг/мин. У 11 (11%) из этих пациентов, когда поддерживающая доза допмина превышала 12мкг/кг/мин, дополнительно применяли норадреналина в дозе 5-10нг/кг/мин (таблица 2). Показанием для назначения кардиотоников являлось снижение системного АД ср.<60мм рт. ст. При этом снижение АД не было связано с гиповолемией, о чем свидетельствовали регистрируемые в нормальных пределах показатели ЦВД и ДЗЛК. В ходе добеспеченочного и беспеченочного этапов операции отмечались эпизоды гипотонии, обусловленные как блокированием венозного возврата при хирургических манипуляциях, так и развивающейся гиповолемией в результате кровопотери. При этом регистрировали снижение ЦВД и ДЗЛК ниже нормальных значений, и коррекция этих изменений успешно осуществлялась проведением инфузионной терапии.
При анализе дооперационных и интраоперационных показателей (таблица 3) выявили, что определялась высокая степень корреляции (r=0,68) (р<0,05) между назначением симпатомиметиков в добеспеченочном и беспеченочном периоде и гепаторенальным синдромом. Следует отметить, что гепаторенальный синдром определялся у 26 (26%) пациентов в предоперационном периоде и проявлялся снижением скорости клубочковой фильтрации<50 мл/мин, увеличением уровня креатинина в плазме крови и индекса резистентности на ветвях почечных артерий выявляемого при выполнении ультразвуковой доплерографии, а также резистентным асцитом. Корреляционный анализ не показал зависимости между назначением вазопрессоров, возрастом пациентов, кровопотерей в интраоперационном периоде, полом, этиологией заболевания, использованием вено-венозного обхода во время операции.
Таблица 2
Симпатомиметическая терапия при трансплантации печени (n=100).
| Этапы операций | ||||||
| До- и беспеченочный этапы | Реперфузия | Послебеспеченочный этап | ||||
| Частота назначения % | Доза | Частота назначения % | Доза | Частота назначения % | Доза | |
| Допамин мкг/кг/мин | 28 | 7,4±1,2 | 50 | 9±2* | 17 | 4±2 |
| Норадреналин мкг/кг/мин | 11 | 0,5±0,1 | 20 | 0,5±0,1 | 7 | 0,5±0,1 |
| Мезатон мг | 70 | 5 (2-7) | 0 | |||
Венозная реперфузия печени сопровождалась значимыми изменениями показателей гемодинамики как в 1, так и во 2 группах. При восстановлении кровоснабжения трансплантата отмечали снижение АДсис. в среднем до 60 мм.рт.ст. в 1 группе и до 65 мм.рт.ст. во 2 группе. В 70% наблюдений стабилизация показателей гемодинамики после венозной реперфузии была достигнута с помощью применения мезатона в средней дозе 5 (2-7) мг. При этом в 1 группе у 24 пациентов из 28 (88%) и у 46 из 72 (76%) пациентов во 2 группе. Без использования мезатона этап венозной реперфузии благополучно перенесли 30 (30%) пациентов.
В 1 наблюдении у пациента 1 группы развилась кратковременная асистолия после венозной реперфузии. Массаж сердца через диафрагму, введение атропина и адреналина привели к восстановлению сердечной деятельности и стабилизации системной гемодинамики.
Таблица 3
Корреляция между до- и интраоперационными показателями реципиентов и назначением вазопрессоров в ходе до- и беспеченочного этапов оперативного вмешательства.
| Коэффициент корреляции Спирмена | |
| Возраст | 0,32 |
| Гепаторенальный синдром | 0,68* |
| Кровопотеря | 0,35 |
| Этиология заболевания | 0,3 |
| Пол | 0,2 |
| Уровень билирубина | 0,3 |
| Вено-венозный обход | 0,1 |
Примечание. * корреляционная зависимость достоверна с уровнем значимости p<0,05.
Таблица 4
Симпатомиметическая терапия в ходе венозной реперфузии и постбеспеченочного периода.
| Венозная реперфузия (n, %) | Постбеспеченочный период (n, %) | |||
| 1 группа | 2 группа | 1 группа | 2 группа | |
| Мезатон | 15 (88%) | 55 (76%) | 0 | 0 |
| Допмин | 28 (100%) | 22 | 10 | 7 |
| Допмин+норадреналин | 11 | 9 | 4 | 3 |
Постоянное введение допмина в постбеспеченочном периоде осуществлялось у 10 пациентов 1 группы и у 7- 2 группы. В конце операции терапия симпатомиметиками осуществляли у 7 пациентов (4 и 3 в 1 и во 2 группах соответственно) и продолжалась после перевода пациента в палату интенсивной терапии.
Влияние вено-венозного шунтирования на интра- и послеоперационный период.
После удаления печени реципиента вместе с печеночными венами и ретропеченочным отделом нижней полой вены начинается беспеченочный период. При этом нижняя полая вена пережимается на уровне диафрагмы, а также выше почечных вен. Снижение артериального давления при пережатии нижней полой вены, которое регистрировалось в экспериментальных работах на животных, явилось причиной внедрения техники вено-венозного обходного шунтирования с целью поддержания венозного возврата во время беспеченочного периода трансплантации печени. Вено венозное порто-феморальное-аксилярное обходное шунтирование подключается до выполнения гепатэктомии. Эта методика нередко приводила к неконтролируемым кровотечениям у пациентов, вследствие необходимости системной гепаринизации. После внедрения в клинику систем с гепариновым покрытием для проведения шунтирования появилась возможность обходиться без назначения гепарина в интраоперационном периоде, и методика стала безопасной с точки зрения влияния на систему гемостаза пациента.
В то же время существует альтернативная техника операции, при которой гепатэктомия выполняется с сохранением ретропеченочного отдела нижней полой вены, при этом кровоток по нижней полой вене не прекращается во время всего беспеченочного периода, что позволяет выполнять операцию без использования вено венозного обходного шунтирования.
До настоящего времени не существует унифицированного подхода к выбору той или иной техники операции. Исходя из этого, нами были проанализированы результаты выполнения трансплантации печени с ВВШ и сохранением ретропеченочного отдела нижней полой вены.
В 1 группе (n=30) ортотопическая трансплантация печени (ОТП) выполнялась без использования ВВШ. Во 2 группе (n=30) ОТП в процессе беспеченочного периода возврат крови к сердцу осуществлялся путем принудительного порто-бедренно-аксилярного шунтирования с помощью центробежного насоса «Biopump» (Biomedicus, США).
Результаты нашего исследования свидетельствуют о том, что ВВШ обеспечивает стабильное перфузионное давление, которое позволяет удлинять беспеченочный период, при этом, функции почек и сердца сохраняются стабильными. В то же время, увеличение времени беспеченочного периода увеличивает время холодовой ишемии трансплантируемой печени, при этом, несомненно, возрастает риск дисфункции трансплантата в послеоперационном периоде (таблица 5).
Снижение температуры тела отрицательно влияет на систему гемостаза и функцию сердечно-сосудистой системы. Как показали наши результаты, ВВШ с теплообменником позволяет согреть пациента до нормальной температуры в течение короткого промежутка времени. При этом снижение температуры тела у пациентов без использования ВВШ составляет 0,5-1,5 градусов от начала операции к моменту венозной реперфузии печени, несмотря на применение водяных матрасов и термообдува. Снижение температуры у пациентов в группе без применения ВВОШ являлось одной из причин большего количества брадиаритмий во время венозной реперфузии печени.
Таблица 5
Основные интраоперационные показатели в исследуемых группах.
| ВВШ | Без ВВШ | |
| Время операции час | 10,5±1,9 | 12,5±2,1** |
| Время беспеченочного периода мин | 59 ±19 | 100 ± 25** |
| Диурез в агепатическом периоде мл/час | 46±30 | 53±38 |
| Применение вазопрессоров в беспеченочном периоде | 7 (28%) | 6 (24%) |
| Температура тела перед венозной реперфузией | 34,8±0,2 | 36,4±0,1** |
| Кровопотеря | 2200 (1600- 2400) | 2700 (1900-2900) |
| Тромбоциты до опер | 108±15 | 140±19 |
| Тромбоциты после опер | 65±18* | 79±23* |
* - р<0,05 при сравнении динамики тромбоцитов в группах
** - р<0,05 при сравнении показателей между группами
Нами не было зарегистрировано интраоперационной летальности вследствие сердечной недостаточности у исследованных пациентов. Также не было выявлено различий в частоте нарушения функции почек при применении ВВШ и без него.
Наиболее серьезные осложнения при проведении искусственного кровообращения – воздушная эмболия и тромбоэмболия ветвей легочной артерии. В нашем исследовании в 1случае (4%) зарегистрирован тромбоз системы шунта, вероятной причиной которого являлась канюля возврата крови диаметром 12F (4 мм), которая не обеспечивала адекватного потока крови. Это не повлияло на исход операции, которая удачно завершилась без вспомогательного кровообращения. ВВШ с потоком крови 1,5-4 л/мин является адекватным для поддержания кровотока в течение беспеченочного периода длительностью от 80 до 300мин. При этом адекватный кровоток обеспечивают канюли диаметром16 F (5,3 мм) и больше.
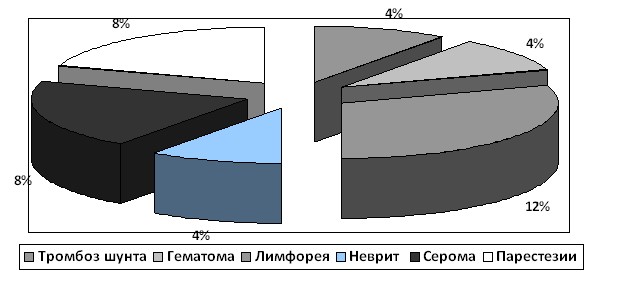
Рисунок 1. Осложнения при проведении вено-венозного шунтирования.
Осложнения, связанные с пункцией и канюляцией сосудов, развиваются только при использовании ВВОШ. Так, в нашем исследовании мы регистрировали образование гематом, сером, истечение лимфы, а также нарушения чувствительности в конечностях, которые регрессировали в течение месяца после операции (рисунок 1). Эти осложнения задерживали выздоровление больных и способствовали удлинению времени пребывания пациентов в стационаре, но не влияли на общий исход оперативного вмешательства.
Техника гепатэктомии с сохранением ретропеченочного отдела нижней полой вены является прогрессивной в виду снижения времени беспеченочного периода, а также оперативного вмешательства, отсутствием возможных осложнений как общих, так и местных, связанных с канюляцией сосудов и вспомогательным кровообращением. Не мало важным является тот факт, что снижаются общие затраты на трансплантацию печени.
Использование гиперволемической гемодилюции при трансплантации печени.
Одной из задач инфузионной терапии является снижение потребностей в трансфузии аллогенных компонентов крови. В настоящее время предоперационная гиперволемическая гемодилюция находит свое применение при различных оперативных вмешательствах. При этом в литературе нет четких клинических данных о применении ГГД при трансплантации печени. Исходя из этого, нами было изучено влияние гемодилюции проводимой после вводной анестезии в объеме 15мл/кг и 7мл/кг раствором гидроксиэтилкрахмала.
Результаты нашего исследования показали, что гемодилюция гидроксиэтилкрахмалом 7мл/кг является более эффективным объемом для снижения потребности в аллогенных эритроцитах. Гемодилюция 15 мл/кг увеличивает общий объем кровопотери, потребность в назначении эритроцитарной массы при сравнении с гемодилюцией в объеме 7 мл/кг (таблица 7). Согласно полученным данным ЦВД и ДЗЛК, зарегистрированные во второй группе после минимальной гемодилюции, являлись более оптимальными для поддержания стабильных показателей гемодинамики и профилактики интраоперационной кровопотери. ЦВД и ДЗЛК в группе с большим объемом гемодилюции способствовали повышению кровоточивости на этапе гепатэктомии и влияли на общую кровопотерю и потребность в назначении аллогенных эритроцитов. При этом следует подчеркнуть, что исследованные режимы инфузионной терапии не влияли на гемодинамическую стабильность пациентов на этапе мобилизации и удаления печени реципиента.
Следует отметить, что при нормальных исходных показателях гемостаза гиперволемическая гемодилюция не приводит к клинически проявляющейся повышенной кровоточивости. В тоже время, исходные нарушения в системе гемостаза, у реципиентов печени усугубляются с большим объемом гиперволемической гемодилюции (рисунок 1).
Таблица 6
ИТТ и кровопотеря при трансплантации печени.
| Гемодилюция | ||
| 15мл/кг (n=20) | 7мл/кг (n=20) | |
| Коллоиды | 2800 (1800-3500) | 2000 (1000-2500) |
| Кристаллоиды | 4200 (2200-6500) | 3000 (2000-5500) |
| Эр масса | 709±200 | 203±70* |
| Аппаратная реинфузия | 1221 (750-1800) | 741 (240-920)* |
| Кровопотеря | 3736 (1000-8500) | 2221 (600-5500)* |
| СЗП | 1738 (900-2000) | 1081 (400-1200) |
* р<0,05 при сравнении показателей между группами.
** достоверные изменения показателей в группе р<0,05
В большинстве случаев показания к назначению СЗП возникали в беспеченочном периоде и на этапе реперфузии печени. Дефицит факторов свертывания, который определялся до операции (МНО - 1,85±0,6, АЧТВ- 48,3±17,9 сек, тромбиновое время (23,9±9,8)) углублялся в беспеченочном периоде, вследствие операционной кровопотери и развития дилюционной коагулопатии. Отсутствие синтетической функции печени также оказывало неблагоприятное влияние на систему свертывания крови (например, период полувыведения фактора VII составляет 100-300 мин).
Трансфузия СЗП производилась только при значительных коагулопатиях, для восстановления плазменных факторов свертывания. При этом СЗП не рассматривалась в качестве плазмозамещающего средства и источника белка. Показания для трансфузии СЗП определяли по уровню АВСК и интраоперационной кровопотери. При показаниях СЗП назначалась в объеме 15мл/кг (в среднем 1000мл) и трансфузировалась через лейкоцитарный фильтр.
Трансфузия плазмы как в 1, так и во 2 группах позволяла поддерживать концентрацию факторов коагуляции в интраоперационном периоде выше критического уровня. На это указывало нормализация АВСК и отсутствие диффузного кровотечения в интраоперационном периоде (рисунок 2).
В 5 случаях (5%) из 100 трансплантаций СЗП не применяли в периоперационном периоде. Следует отметить, что у этих 5 пациентов показанием для трансплантации являлся первичный билиарный цирроз, тяжесть состояния по классификации Чайлда-Пью - В и интраоперационная кровопотеря не превышала 1000мл.
Таблица 7
Показатели ЦВД, ДЗЛК и СВ до и после гемодилюции.
| Показатель | Гемодилюция | |
| 15мл/кг (n=20) | 7 мл/кг (n=20) | |
| ЦВД | 5±1 | 4±2 |
| ЦВД после гемодилюции | 10±2* | 5±1 |
| ДЗЛК | 7±2 | 8±2 |
| ДЗЛК после гемодилюции | 12±3* | 9±2 |
| СВ | 8,5±1,8 | 9,0±1,1 |
| СВ после гемодилюции | 8,6±1,6 | 9,1±1,7 |
* р<0,05 при сравнении показателей между группами.
Аппаратная реинфузия крови позволила снизить использование аллогенных эритроцитов и не сопровождалась какими-либо осложнениями. Анализ 100 трансплантаций показал, что реинфузия крови применялась в 98 (98%) случаев. При этом объем реинфузированной крови составил 939 мл (345-1245). Полученные результаты свидетельствуют о том, что аппаратная реинфузия крови является необходимым методом обеспечения трансплантации печени. При этом в отличие от переливания донорской крови не было опасности развития осложнений, связанных с несовместимостью, с переносом инфекционных и вирусных заболеваний, с риском аллоиммунизации и развитием синдрома массивных трансфузий.
Рисунок 2. Динамика АВСК на этапах операции.
Однако, как свидетельствуют наши результаты, использование аппаратной реинфузии не во всех наблюдениях позволяло полностью компенсировать кровопотерю, что требовало альтернативных способов компенсации кровопотери. На наш взгляд, причины снижения эффективности аппаратной реинфузии были следующие:
- исходная анемия у реципиентов (уровень гемоглобин <90 г/л до начала операции выявлялся у 25 реципиентов в нашем исследовании (25%)). При этом даже небольшая потеря крови, аспирация которых не представлялась возможной в аппарат для реинфузии («элиминация» в операционные салфетки), приводила к снижению гемоглобина <60 г/л, что являлось показанием для трансфузии донорских эритроцитов;
- массивная кровопотеря >3000 л (33 из 100 наблюдений 33%), при которой происходят значительные потери крови, не попадающие в вакуумный отсос;
- низкая резистентность эритроцитов реципиента, что не позволяет получить достаточное количество аутоэритроцитов для компенсации кровопотери.
Использование отмытых эритроцитов донора печени при ортотопической трансплантации трупной печени.
40 (40%) реципиентам в интраоперационном периоде переливали эр массу, полученную от донора печени.
Заготовку аутологичной эритроцитарной массы (АЭМ) осуществляли во время операции мультиорганного изъятия органов у донора со смертью мозга. После мобилизации печени канюлировали нижнюю полую вену, ниже почечных вен, накладывали зажим на аорту и кровь из дистального отдела нижней полой вены аспирировали в аппарат Cats (Fresenius), где по программе проводилась сепарация и отмывание эритроцитов. Полученная эритроцитарная масса являлась аутологичной (АЭМ) трансплантируемому органу. Перед назначением АЭМ ее совмещали по общепринятой методике. Отмытые эритроциты переливались реципиенту после венозной реперфузии донорской печени.
Результаты нашего исследования свидетельствуют, что эритроцитарная масса донора печени эффективна при коррекции кровопотери и также позволяет значительно снизить использование аллогенных эритроцитов. ЭМ, полученная от донора органа, сохраняет терапевтическую эффективность, переливаемые эритроциты жизнеспособны и выполняют кислородтранспортную функцию (таблица 8). Кроме того, с момента внедрения трансплантации печени в клинику большое внимание уделяется вопросам моделирования иммунотолерантности у пациентов после трансплантации солидных органов. Так, известно, что количество кризов острых отторжений в пересаженной почке меньше при симультантной трансплантации печени и почки при сравнении с пересадками одного органа. Это связывают с протективными свойствами печени, в которой в большом количестве содержатся лейкоциты «пассажиры», и возможно, они являются индукторами микрохимеризма и последующей иммунотолерантности.
Таблица 8
Кровопотеря и потребность в аллогенной эритроцитарной массе при трансплантации печени.
| АЭМ (n=40) | Контрольная группа (n=40) | P | |
| кровопотеря | 2600 (1900-3200) | 2800 (1950-3400) | >0.05 |
| ЭМ мл | 4500 мл | 12447 мл | |
| Без аллогенной эм | 73% | 33 % |
ЭМ – суммарное количество аллогенной эритроцитарной массы.
Предполагают, что миграция этих клеток в лимфатические ткани реципиента после трансплантации приводит к угнетению T- клеток хозяина, при этом активизируются Т- клетки донора, создавая, таким образом, устойчивое равновесие. В результате иммунный ответ цитотоксических T-клеток хозяина может быть ослаблен вплоть до развития иммунной толерантности. Таким образом, индуцирование толерантности связано с миграцией донорских лейкоцитов. Переливание эритроцитарной массы донора печени, вероятно, может влиять на развитие этого феномена, вследствие присутствия в составе лейкоцитов и других клеток гемопоэза. Донорские «клетки пассажиры», попадающие в русло реципиента во время трансфузии, представляют собой мобильный антиген донора, который способен влиять на иммунную систему хозяина. Подтверждением этого положительного влияния является количество острых кризов отторжения при схожей иммуносупрессивной терапии в раннем послеоперационном периоде в исследуемых группах (таблица 9).
Таблица 9
Острый криз отторжения в течение первого месяца после ОТП.
| Группа n=40 | группа n=40 | |
| Острый криз отторжения в 1 месяц после ОТП | 3 (7,5%) | 6 (15%)* |
* - р<0.05
Почечная недостаточность в послеоперационном периоде.
Заместительная почечная терапия выполнялась у 36 пациентов (36%) в послеоперационном периоде. У 23 из них (63,8% от числа пациентов, которым выполнялась ЗПТ) в предоперационном периоде выявили гепаторенальный синдром (ГРС), который проявлялся снижением СКФ < 50 мл/мин, увеличением уровня креатинина в плазме крови и индекса резистентности на почечных артериях, а также резистентным асцитом. ОПН в послеоперационном периоде у этих пациентов развилась на фоне предшествующего ГРС в сочетании с циркуляторными нарушениями в интраоперационном периоде (преренальный механизм) и применением нефротоксичных кальциневриновых лекарственных средств (ренальный механизм). В группе 1 чаще применяли вазопрессоры для поддержания гемодинамики в течение оперативного вмешательства, при этом не было достоверных отличий в кровопотере, времени операции, холодовой ишемии и времени беспеченочного периода (таблица 10). Исходя из этого, ГРС в дооперационном периоде являлся основным предвестником развития почечной недостаточности в послеоперационном периоде.
Кроме того, выделены следующие состояния, приведшие к ОПН в послеоперационном периоде: печеночно-почечная недостаточность на фоне плохо функционирующего трансплантата – 5 пациентов (13,8%), бактериальный сепсис – 6 пациентов (16,6%), ренальное повреждение (циклоспориновый некроз почечных канальцев) – 1 (2,7%), ОПН в результате повреждения эритроцитов при проведении вено-венозного шунтирования – 1 (2,7%).
Показаниями к проведению ЗПТ являлись клинически значимая гипергидратация (особенно легких), гиперкалиемия, а также резистентный к инфузионной коррекции декомпенсированный метаболический ацидоз (pH 7,1), выраженная дизнатриемия. Неотложными показаниями к проведению ЗПТ являлись отек легких, гиперкалиемия 6 ммоль/л. В 75% наблюдений плановое диализное лечение начинали при нарастании азотистых шлаков (мочевины > 30 ммоль/л) в сочетании с олигурией (количество мочи < 200 мл/12 час) или анурией (мочи < 50 мл /12 час) и гипергидратацией. В 15% наблюдений ЗПТ применяли при сочетании азотемии и гипергидратации, в 5% - азотемии, гипергидратации, анурии, декомпенсированного метаболического ацидоза и в 5% - азотемии, гипергидратации, анурии, гиперкалиемии (выше 6,6 ммоль/л).
Следует отметить, что при выявлении дисфункции почек в послеоперационном периоде проводилась интенсивная медикаментозная нефропротекция, целью которой являлось устранение гипоксии канальцевого эпителия. Для восстановления объема циркулирующей крови и улучшения притока крови к почкам проводили инфузионную терапию под контролем ЦВД до достижения значений 9-12 мм рт. ст. с применением 20% альбумина 200-400 мл в сутки и растворов гидроксиэтилкрахмала 500 мл в сутки. Органную перфузию потенциировали применением осмотически активных веществ (20% раствор глюкозы в количестве 400–800 мл в сутки, использовали допмин, не превышая «почечных» доз - 2-3 мкг/кг/мин в течение 2 послеоперационных суток.
Таблица 10
Интраоперационные показатели.
| Группа | Кровопотеря, мл | Время операции, часов | Холодовая ишемия, мин | БП, мин | Вазопрессоры (ГЭ, БП) | Вазопрессоры (ПБП) |
| Группа 1 (n=36) | 3701 (2800-3900 | 11,2 ± 2,3 | 535 ± 76 | 98 ± 25 | 45% | 20% |
| Группа 2 (n=64) | 1981 (1600-2300) | 12,2 ±2,1 | 555 ± 60 | 112 ± 28 | 23% | 5% |
Примечание: ГЭ – гепатэктомия,
БП – беспеченочный период,
ПБП – послебеспеченочный период.
Кратковременная отмена на 1-3 дня кальциневриновых иммуносупрессивных лекарственных средств также способствовала диуретическому эффекту и дальнейшей стабилизации почечной функции, снижению концентрации азотистых метаболитов крови. При этом не отмечено увеличения количества острых кризов отторжения трансплантата. Восстановление кровоснабжения канальцев создает условия для эффективного использования петлевых диуретиков, одним из эффектов которых является блокада Na+-K+ АТФазы, что опосредованно позволяет значительно уменьшить кислородный долг в почке, улучшить переносимость органом гипоксии. Применение интенсивной «нефропротективной» терапии имело существенное положительное действие у 13 (20%) больных 2 группы с развитием полиурии и снижением концентраций азотистых метаболитов крови.
Критерием завершения диализного лечения было восстановление выделительной функции почек (темп диуреза >50 мл/час), уровень мочевины < 30 ммоль/л, нет признаков гипергидратации легких, увеличение скорости клубочковой фильтрации.
У 21 пациентов из 36, нуждавшихся в проведении ЗПТ (58,3 %) на фоне проводимого лечения функция почек восстановилась, и они были выписаны из клиники. При этом лечение ОПН было успешным у 16 из 23 пациентов с гепаторенальным синдромом.
У этих больных в результате проведенного лечения отмечена стабилизация состояния, разрешение ОПН произошло в течение 12,7±6,2 суток. Среднее количество проведенных процедур необходимых для восстановления функции почек, составило 8,8 (3-14). Только у одного больного исходом лечения оказался кортикальный некроз, что потребовало продолжения хронического гемодиализа.
Анализ 30-суточной летальности показал, что в 1 группе 10 (27,7%) пациентов умерли в результате септических осложнений и полиорганной недостаточности на фоне ОПН, 90 суточная летальность составила 14 пациентов (38,8%), во 2 группе все пациенты выжили. Из 14 умерших пациентов у 5 регистрировалась плохая функция трансплантата (у 3 из них - первично нефункционирующий трансплантат (ПНФ), у 2 пациентов плохая функция трансплантата связана с нарушением кровоснабжения печени). Все больные с первично нефункционирующим трансплантатом умерли в ранние сроки, несмотря на проведение заместительной почечной и печеночной терапии.
Питательная терапия после трансплантации печени.
Установлено, что энергетические потребности после оперативного вмешательства составляли 1800±150кал/сутки и не превышали расчетных на идеальную массу тела по формуле Харриса-Бенедикта.
При детальном анализе установлено, что у больных с тяжелой степенью недостаточности питания 8 (8%) энергозатраты составили 2160± 120 и были достоверно выше, при сравнении с пациентами нормального статуса питания (рис 3).

* р<0.05
Рисунок 3. Энергетические потребности в 1 послеоперационные сутки в зависимости от степени недостаточности питания.
Парентеральное питание должно быть сбалансировано по количеству, и качеству ингредиентов, включать азотсодержащие - растворы аминокислот и энергетические вещества (углеводы, жировые эмульсии), электролиты и витамины. Одним из критериев адекватности парентерального питания является достижение положительного азотистого баланса – снижение катаболических реакций и обеспечение пластических процессов в послеоперационном периоде. Следует подчеркнуть качественный состав аминокислотных растворов с необходимым содержанием преимущественно аминокислот с разветвленной цепью. Необходимость их применения в раннем послеоперационном периоде обусловлено дисфункцией трансплантата разной степени тяжести, которая возникает вследствие холодовой ишемии, реперфузионного синдрома, интраоперационных эпизодов гипотонии, жирового гепатоза трансплантата и пр. Результатом является регистрация признаков печеночной энцефалопатии и как следствие необходимость применения специальных растворов аминокислот.
Использование в раннем послеоперационном периоде жировых эмульсий со среднецепочечными триглицеридами позволяет значимо снизить инфузию растворов глюкозы для компенсации энергетических затрат пациента и снизить риск развития гипергидратации. МСТ/ЛСТ жировые эмульсии являются безопасным компонентом парентерального питания.
Раннее питание сбалансированными питательными смесями позволяет поддержать метаболизм энтероцитов, пластический обмен которых во многом зависит от наличия внутрипросветных питательных веществ, интенсивности мембранного пищеварения и всасывания, скорейшее разрешение моторных и секреторных нарушений кишечника, посредством пищевой стимуляции, частичное обеспечение потребностей организма в белках, жирах и углеводах.
Наш опыт показывает хорошую переносимость сбалансированных питательных смесей в раннем послеоперационном периоде и возможность полностью обеспечить энергозатраты пациента. При этом парентеральное и энтеральное питание не являются конкурирующими методами. Они используются дифференцировано и при комбинации успешно дополняют друг друга. При оценке пациентами вкусовой гаммы выявлены преимущества в наличии различных вкусовых свойств питательных смесей, что позволяет в большинстве случаев подобрать пациенту сбалансированную питательную смесь с подходящим для него вкусом.
Проведение назоэнтерального питания у пациентов имеющих показания, в комплексе с другими лечебными мероприятиями, позволяет улучшить результаты лечения. Отдается предпочтение специальному зонду с дополнительном грузом в дистальном отрезке, который способствует миграции зонда из желудка в кишку, также применяется специальный 3-х просветный зонд, который проводится под контролем и с помощью гастроскопа. Необходимость в проведении еюнального зондового питания регистрировалась у 16 (16%) пациентов в послеоперационном периоде. В большинстве случаев НЭП проводили при большом объеме аспирации желудочного содержимого, во время проведения продленной ИВЛ. Кроме того, показаниями для проведения указанного искусственного питания являлись тяжелый сепсис, анорексия, тяжелая недостаточность питания.
Таблица 11.
Схема искусственного питания при не осложненном течении послеоперационного периода.
| Компоненты ИП (мл) | Сутки п/о | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| Сбалансированные питательные смеси | 0 | 0 | 200 | 300 | 800 | 1000 |
| Аминокислоты | 500 | 800 | 800 | 500 | 500 | 500 |
| МСТ/ЛСТ жировые эмульсии | 500 | 500 | 300 | 250 | - | - |
| Глюкоза 20% | 800 | 1000 | 800 | 400 | 400 | |
| Диетическое питание | + | + | ||||
Глутамин после трансплантации печени.
В состоянии гиперкатаболизма, связанном с большим объемом оперативного вмешательства, сепсисом и другими критическими состояниями, у пациента резко возрастает потребление глутамина. Дефицит глутамина может привести к нарушению обменных процессов, репаративных процессов, к нарушениям функции иммунной системы пациента. Синтез глутамина у пациента, находящегося в тяжелом состоянии не обеспечивает возросшие потребности организма в этой аминокислоте.
15 пациентам (1 группа) назначали 20% раствор L-аланина - L-глутамина («Дипептивен») - 100 мл в течение 10 послеоперационных суток. Введение Дипептивена осуществлялось внутривенно в течение 30-60минут. В контрольной 2 группе (15пациентов) L-аланин - L-глутамин не назначали.
Как показали результаты нашего исследования, добавление глутамина в схему парентерального питания приводит к более быстрому синтезу преальбумина (рис.3). Механизм быстрого восстановления уровня преальбумина можно объяснить более быстрым изменением метаболических процессов с катаболизма на анаболизм при парентеральном введении глутамина. Известно, что глутамин является одной из самых распространенных аминокислот и обладает свойствами, которые придают ему уникальное значение в условиях катаболизма как компонента различных метаболических процессов. Поступление достаточного количества глутамина в печень служит анаболическим сигналом для синтеза белков. Глутамин является источником азота для синтеза азотистых оснований, входящих в состав дезоксирибонуклеиновой и рибонуклеиновых кислот, необходимых для синтеза белков. Глутамин используется непосредственно для синтеза белка и служит предшественником для синтеза других аминокислот. Кроме того, аминогруппа, которая образуется при гидролизе глутамина до глутамата, используется при различных реакциях трансаминирования, включая синтез аланина из пирувата, синтез аспарагиновой кислоты из оксалацетата. Глутамат в дальнейшем может подвергаться дезаминированию с образованием серина.
 Рисунок 4. Динамика преальбумина в послеоперационном периоде.
Рисунок 4. Динамика преальбумина в послеоперационном периоде.
Глутамин положительно влияет на течение послеоперационного периода у больных с трансплантированной печенью. Так, количество бактериальных осложнений зарегистрировано меньше в группе, в которой использовали глутамин. Это могло быть связано с тем, что назначение глутамина в составе дипептивена приводило к усилению фагоцитарной активности нейтрофилов, спонтанной окислительной активности нейтрофилов и кислородного метаболизма нейтрофилов, что способствовало адекватному иммунному ответу и стабилизации клеточного иммунитета. Результаты исследования фагоцитарной активности нейтрофилов показали, что активация фагоцитоза латекса была достоверно выше на 3, 7 14 сутки после операции в 1 группе при сравнении со 2 группой (табл. 12, 13).
Эффект глутамина может проявляться на уровне процессов дегрануляции, образования свободных радикалов, и других продуктов перекисного окисления, или образования энергии. Глутамин уменьшает проницаемость слизистой и поддерживает нормальную структуру слизистой кишечника, что приводит к улучшению синтеза иммуноглобулина А, поддерживает уровень продукции иммуноглобулинов всех классов и сохраняет структуру и функцию ассоциированной с кишечником лимфоидной ткани, вследствие чего улучшается функция иммунной системы.
Глутамин способствует усилению пролиферации клеток, в том числе, лимфоцитов. При этом, как показали результаты нашего исследования, абсолютное количество лимфоцитов регистрировалось ниже нормы как в 1, так и во 2 исследуемых группах после трансплантации печени. Достоверное увеличение общего количества лимфоцитов, которое было отмечено на 7 сутки после операции в 1 группе при сравнении со 2 группой соответственно р<0,05 (рис. 4).
Такие же результаты были получены при детальном анализе субпопуляций лимфоцитов (рис.5). Следовательно, назначение глутамина не снижало эффективность проводимой медикаментозной иммуносупрессивной терапии. Подтверждением этому является тот факт, что в послеоперационном периоде не были зарегистрированы кризы острого отторжения трансплантата в группе пациентов, получавшей глутамин.
Таблица 12
Функциональная активность нейтрофилов у пациентов после ОТП.
| Фагоцитоз (%) норма-40-50% | ||||
| Сутки | 1 | 3 | 7 | 14 |
| 1 группа | 31,3±,2 | 38,1±4,0* | 48,25±3,5* | 53±8,5* |
| 2 группа | 29,5±6,9 | 30,6±2,6 | 41,2±4,6 | 44±6,0 |
| сп. -НСТ-тест (%) норма 10-15 % | ||||
| Сутки | 1 | 3 | 7 | 14 |
| 1 группа | 17,9 ± 4,9 | 16,1± 3,5* | 17,8 ± 8,7* | 17,6 ± 4,6 |
| 2 группа | 9,4 ± 1,6 | 9,2 ± 1,1 | 12,9 ± 4,3 | 18 ± 9,3 |
| инд. НСТ-тест (%) норма 20--40% | ||||
| Сутки | 1 | 3 | 7 | 14 |
| 1 группа | 24,1±2,8 | 26,7±14,8* | 25,2±1,4 | 38,6± 8,5 |
| 2 группа | 15,5±6,5 | 17,8±2,5 | 24,6±9,7 | 25,75±6,0 |
* - р<0,05
Такие же результаты были получены при детальном анализе субпопуляций лимфоцитов (рис.5). Следовательно, назначение глутамина не снижало эффективность проводимой медикаментозной иммуносупрессивной терапии. Подтверждением этому является тот факт, что в послеоперационном периоде не были зарегистрированы кризы острого отторжения трансплантата в группе пациентов, получавшей глутамин.
Таблица 13
Бактериальные осложнения.
| Бактериальные осложнения | 1 группа (n=15) | 2 группа (n=15) |
| Пневмония | 3 | |
| Нагноение раны | 1 | 1 |
| Холангит | 1 | |
| Всего | 1 (6%) | 5 (33%) |


Рисунок 5. Динамика общей популяции лимфоцитов в послеоперационном периоде.


Рисунок 6. Динамика СD8-лимфоцитов в послеоперационном периоде.
ВЫВОДЫ.
- В эксперименте на животных установлено, что при трансплантации печени наиболее значимые нарушения показателей гемодинамики наблюдаются в период венозной реперфузии трансплантата. Нестабильность гемодинамики обусловлена резким снижением сосудистого тонуса и производительности сердца.
- Гепаторенальный синдром в дооперационном периоде является фактором, влияющим на интраоперационные изменения показателей системной гемодинамики, для коррекции которых требуется применение вазопрессоров в добеспеченочном и беспеченочном периоде оперативного вмешательства.
- Сравнение результатов трансплантации печени с сохранением ретропеченочного отдела нижней полой вены и в условиях вено-венозного шунтирования не выявило различий в количестве осложнений и исходах оперативного вмешательства.
- Техника операции с сохранением ретропеченочного отдела нижней полой вены позволяет снизить время беспеченочного периода и всего оперативного вмешательства, а также расходы на операцию.
- Умеренная гемодилюция, проведенная после вводного наркоза, и аппаратная реинфузия крови в течение всего оперативного вмешательства являются эффективными средствами профилактики и восполнения кровопотери при трансплантации печени.
- Эритроцитарная масса, полученная от донора органа, является эффективным средством коррекции анемии и не оказывает отрицательного влияния на иммунологический статус реципиента.
- Острая почечная недостаточность у больных после трансплантации печени возникает в 36% случаев и имеет благоприятный прогноз. В 63,8% случаев она обусловлена исходным гепаторенальным синдромом. Раннее использование экстракорпоральных методов детоксикации оказывает выраженный лечебный эффект и улучшает исход операции.
- При первично нефункционирующем трансплантате экстракорпоральные методы имеют низкую эффективность и играют роль только поддерживающей терапии до ретрансплантации печени.
- В раннем послеоперационном периоде после трансплантации печени проведение комплексной терапии, включающей парентеральное и энтеральное питание сбалансированными питательными смесями, улучшает показатели питательного статуса и результаты лечения. Глутамин положительно влияет на течение послеоперационного периода у больных с трансплантированной печенью.
- Необходимость в зондовом (назоэнтеральном питании) после трансплантации печени возникает в 16% случаев, показаниями являются продленная ИВЛ, гнойно-септические осложнения, тяжелые нарушения в питательном статусе.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ.
- Эффективными средствами коррекции гипотонии в интраоперационном периоде являются введение допмина или допмина в сочетании с норадреналином при условии нормоволемии в добеспеченочном, беспеченочном и послебеспеченочном периодах трансплантации печени. Мезатон является препаратом выбора для коррекции гипотонии после венозной реперфузии печени.
- Аппаратная реинфузия аутокрови является обязательным методом кровосбережения при трансплантации печени.
- Свежезамороженная плазма назначается только при массивной кровопотере и выраженном дефиците факторов свертывания. Увеличение активированного времени свертывания крови>180 сек. является ориентиром для назначения свежезамороженной плазмы в интраоперационном периоде.
- Вспомогательное кровообращение следует использовать в случае, когда выполнение гепатэктомии невозможно без полного перерыва кровообращения в системе нижней полой вены.
- Парентеральное питание следует начинать с первых послеоперационных суток. Питание сбалансированными питательными смесями следует начинать со 2-3 послеоперационных суток при отсутствии осложнений. Тяжелая недостаточность питания служит показанием для проведения зондового питания в послеоперационном периоде.
- При проведении парентерального питания после трансплантации печени следует применять глутамин в сочетании с аминокислотными растворами.
- Гипергидратация в сочетании с олигурией/анурией и азотемией (мочевина> 30ммоль/л) являются показаниями для проведения заместительной почечной терапии после трансплантации печени.
СПИСОК ПУБЛИКАЦИЙ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Experience of combination of hemofiltration and plasmapheresis in patient after liver transplantation / A.S. Ermolov, S.G. Musselius, S.V. Juravel, N.K. Kuznetzova, A.O. Chugunov, A.V. Zhao // XXXYIII Congress of the European Dialysis and Transplant Association (ERA-EDTA), Austria, Vienna, 24-27 June 2001.- Vienna, 2001.-P.284.
- Трансплантация печени при первичном билиарном циррозе и парциальной красноклеточной аплазии кроветворения (клиническое наблюдение) / Е.Н. Широкова, О.А. Бокерия, Е.А. Лукина, В.Т. Ивашкин, О.И. Андрейцева, С.В. Журавель, М.С. Новрузбеков, А.В. Чжао // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.-2001.-№4.-С.85-88.
- Изменение показателей центральной и периферической гемодинамики при ортотопической трансплантации печени в эксперименте у собак / С.В. Журавель, Н.К. Кузнецова, К.Н. Луцык, К.Б. Шадрин [Материалы 2-й сессии МНОАР]// Альманах анестезиологии и реаниматологии.-2001.-№1.-С.33-34.
- Вено-венозное обходное шунтирование при трансплантации печени в эксперименте / С.В. Журавель, А.В. Чжао, А.О. Чугунов, В.А. Гуляев, О.И. Андрейцева, К.Н. Луцык // Вестник трансплантологии и искусственных органов.-2002.-№2.-С.38-41.
- Первый опыт трансплантации печени в НИИ скорой помощи имени Н.В. Склифосовского / А.С. Ермолов, А.В. Чжао, С.Г. Мусселиус, В.Б. Хватов, И.Е. Галанкина, Л.Н. Зимина, Е.Н. Кобзева, М.А. Годков, С.В. Журавель, В.А. Гуляев, К.Р. Джаграев, А.О. Чугунов, О.И. Андрейцева, И.В. Погребниченко, М.С. Новрузбеков, Н.К. Кузнецова, К.Н. Луцык, А.В. Козлова, Л.В. Донова // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.-2002.-№1.-С.38-46.
- Особенности парентерального питания после операций на печени / С.В. Журавель, Н.К. Кузнецова, В.В. Киселев, А.В. Чжао // Вестник интенсивной терапии.-2002.-№2.-С.14-17.
- Журавель, С.В.Оптимальные подходы к питанию пациентов после трансплантации печени / С.В. Журавель, В.В. Киселев, Н.К. Кузнецова, Ю.Н. Лященко, А.В. Чжао : [Материалы Девятой Рос. гастроэнтерол. недели, 20-23 окт. 2003 г., Москва] // Рос. журн. гастроэнтерол., гепатол., колопроктол.-2003.-№ 5.-Прил. № 21.-С.86.- № 319.
- Какие из показателей дооперационного обследования пациента являются прогностическими для интраоперационного переливания компонентов крови при ортотопической аллотрансплантации печени? / А.В. Чжао, С.В. Журавель, Н.К. Кузнецова, А.О. Чугунов, О.И. Андрейцева [Материалы 4-й сессии МНОАР 28 марта 2003г.] // Альманах анестезиологии и реаниматологии.-2003.-№3.-С.49.
- Бескровная хирургия печени / А.В. Чжао, С.В. Журавель, А.О. Чугунов, К.Р. Джаграев, Е.Н. Кобзева // Анналы хирургической гепатологии.-2003.- №2.-С.366-367.
- Принципы «бескровной» хирургии при операциях на печени / А.В. Чжао, А.О. Чугунов, К.Р. Джаграев, С.В. Журавель, Н.К. Кузнецова, Е.Н. Кобзева // Анналы хирургической гепатологии.-2004.-№1.-С.20-24.
- Журавель, С.В. Острая печеночная недостаточность / С.В. Журавель // Consilium medicum.-2004.-№6.-С.421-423.
- Журавель, С.В. Современные методы коррекции нарушений гемостаза при ортотопической трансплантации печени / С.В. Журавель, Н.К. Кузнецова, А.В. Чжао // Проблемы снижения кровопотери при трансплантации и резекциях печени: материалы гор. науч.-практ. конф.- М.: НИИ СП им Н.В. Склифосовского, 2004.- (Труды института, Т.171).-С.22-24.
- Использование гепаринизированных систем с термообменником для обходного вено-венозного шунтирования при трансплантации печени / К.Н. Луцык, А.О. Чугунов, С.В. Журавель, А.В. Чжао // Материалы 4 Всероссийского съезда по экстракорпоральным технологиям, г. Дмитров, 1-3 октября 2004 г.-М., 2004.-С.16-17.
- Обходное вено-венозное шунтирование при ортотопической аллотрансплантации печени / К.Н. Луцык, А.О. Чугунов, С.В. Журавель, К.Р. Джаграев, А.В. Чжао // Анналы хирургической гепатологии.-2005.-№1.-С.33-39.
- Прогнозирование и трансплантация печени при острой печеночной недостаточности / С.В. Журавель, О.И. Андрейцева, М.С. Новрузбеков А.В. Чжао // Consilium medicum=Хирургия.- 2005.- Т.7.- Приложение № 1.- С.80-82.
- Нарушение гемостаза и его коррекция при операциях на печени / В.А.Гуляев, С.В. Журавель, Н.К.Кузнецова, М.А.Годков, А.В. Чжао // Анналы хирургической гепатологии.-2005.-№1.-С.122-130.
- Активные методы детоксикации у больных после трансплантации печени / С.В. Журавель, И.В. Александрова, Н.К. Кузнецова, В.В. Киселев, А.О. Чугунов, А.В. Чжао // Клиническая трансплантация органов: материалы конф., г. Москва, 14-15 апреля 2005г.-М., 2005.-С.129-130.
- Трансплантация печени как радикальный метод коррекции портальной гипертензии при циррозах печени / А.С. Ермолов, А.В. Чжао, А.О. Чугунов, К.Р. Джаграев, В.А. Гуляев, С.В. Журавель: [Актуальные проблемы хирургической гепатологии: материалы XII междунар. конгр. хирургов-гепатологов России и стран СНГ и Х науч.-практ. конф. «Вахидовские чтения – 2005», г.Ташкент, Узбекистан, 28-30 сент. 2005 г.] // Анн. хирургич. гепатологии.-2005.-№ 2.-С.77.
- Кровесберегающие технологии при операциях на печени / А.В. Чжао, Е.Н. Кобзева, А.О. Чугунов, К.Р. Джаграев, С.В. Журавель, Н.К. Кузнецова, Е.Н. Дорофеева // Вестн. РУДН. Сер. Медицина.-2005.-№ 3 (31).-С.68-71.
- Гепаторенальный синдром и трансплантация печени / В.А. Гуляев, И.В. Александрова, В.В. Киселев, И.В. Погребниченко, С.В. Журавель, Е.Н. Дорофеева, М.С. Новрузбеков, А.В. Чжао // Анн. хирургич. гепатологии.-2006.-№ 4.-С.82-89.
- Zhuravel, S.V. Recombinant activated factor VII in liver transplantation / S.V. Zhuravel, N.K. Kuznetzova, A.V. Zhao // 19th Annual Congress European Society of Intensive Care Medicine, Barselona, Spain, 24-26 September 2006.- Barselona, 2006.-P.61. S.0224.
- Возможности использования инфицированных трупных доноров для выполнения трансплантации печени / А.С. Ермолов, А.В. Чжао, В.А. Гуляев, О.И. Андрейцева, С.В. Журавель, К.Р. Джаграев, И.В. Погребниченко, М.Г. Минина // Хирургия.-2006.- № 3.- С.72-77.
- Трансфузия компонентов крови при ортотопической трансплантации печени / С.В. Журавель, Н.К. Кузнецова, А.В. Чжао, В.Х. Тимербаев // Общая реаниматология.-2007.-№4.-С.28-30.
- Значение ультразвуковой допплерографии в оценке функции почек при ортотопической трансплантации печени / Л.В. Донова, А.В. Чжао, И.В. Александрова, О.И. Андрейцева, С.В. Журавель, М.С. Наврузбеков // Российский журнал гастроэнтерологии, гепатологии, колопроктологии.-2007.-№4.-С.43-46.
- Особенности подготовки и обследования пациентов перед трансплантацией печени / С.В. Журавель, О.И. Андрейцева, А.О. Чугунов, А.В. Чжао // Consilium medicum.-2007.-Хирургия: прил.-№2.-С.68-72.
- Преимущества и недостатки применения вено венозного обходного шунтирования при трансплантации печени / С.В. Журавель, А.О. Чугунов, К.Н. Луцык, В.Х. Тимербаев, А.В. Чжао // Общая реаниматология.-2008.-№5.-С.70-74.
- Кузнецова, Н.К. Тромбоцитопения после трансплантации печени / Н.К. Кузнецова, С.В. Журавель // Актуальные вопросы трансплантации органов: материалы городской науч.-практ. конф. / под ред. М.Ш. Хубутия- М.: Триада, 2008.-С.56-57.
- Трансплантация печени при первичном раке / О.И. Андрейцева, С.В. Журавель, А.О. Чугунов, А.В. Чжао // Здоровье столицы-2008: прогр., тез. докл., каталог участников выставки VII Моск. ассамблеи, 18-19 дек. 2008 г.-М.:ГЕОС,2008.-С.203-204.
- Использование отмытых эритроцитов донора печени при трансплантации трупной печени / М.Ш. Хубутия, С.В. Журавель, Н.К. Кузнецова, В.А. Гуляев, Е.Н. Кобзева, А.В.Чжао, Е.А. Сахарова // Тез. докл. IV Всерос. съезда трансплантологов памяти акад. В.И. Шумакова, г.Москва, 9-10 нояб. 2008 г.-М., 2008.-С.214.
- Результаты ортотопической трансплантации печени с использованием обходного вено-венозного шунтирования и без него / А.В. Чжао, К.Р. Джаграев, А.О. Чугунов, С.В. Журавель, К.Н. Луцык // Сб. тез. Первой междунар. конф. по торако-абдоминальной хирургии, г.Москва, 5-6 июня 2008 г.-М., 2008.-С.186-187.
- Применение глутамина после трансплантации печени / С.В. Журавель, В.П. Никулина, А.А. Рык, В.В. Киселев, А.В. Чжао // Вестник службы крови России.-2009.-№1.-С.31-35.
- Применение заместительной почечной терапии после трансплантации печени / С.В. Журавель, Е.Н. Дорофеева, Н.К. Кузнецова, А.О. Чугунов, В.В. Киселев, А.М. Талызин, Л.В. Донова, А.В. Чжао // Трансплантология.-2009.-№1.-С.49-53.
- Трансплантация печени, осложненная острым тромбозом воротной вены / С.В. Журавель, А.О. Чугунов, А.А. Салиенко, Л.В. Донова // Вестник интенсивной терапии.-2009.-№3.-С.69-71.
- Современные возможности снижения кровопотери при трансплантации печени / М.Ш. Хубутия, С.В. Журавель, Н.К. Кузнецова, А.О. Чугунов, К.Р. Джаграев, Е.Н. Кобзева, А.В. Чжао // Материалы 1-й конф. Межрегион. общ. орг. «Общество трансплантологов», г. Москва, 18 апр. 2009 г.-М., 2009.-С.19-20.

