Внутримолекулярные реакции фурановых соедин е ний с изотиоцианатной группой
На правах рукописи
Циунчик Фатима Алексеевна
Внутримолекулярные реакции фурановых
соединений с изотиоцианатной группой
Специальность 02.00.03 – “Органическая химия”
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Краснодар – 2007
Работа выполнена в ГОУ ВПО
“Кубанский государственный технологический университет”
Научный руководитель: доктор химических наук,
старший научный сотрудник
Бутин Александр Валерианович
Официальные оппоненты: доктор химических наук,
профессор
Косулина Татьяна Петровна;
доктор химических наук,
профессор
Боровлёв Иван Васильевич
Ведущая организация: Южный Федеральный
Университет, г. Ростов-на-Дону
Защита состоится “ 29 ” мая 2007 г. в 14-40 часов на заседании
диссертационного совета Д 212.100.01 в Кубанском государственном технологическом университете по адресу: 350072 г. Краснодар, ул. Красная, 135, ауд. 174
С диссертацией можно ознакомиться в библиотеке Кубанского
государственного технологического университета по адресу: 350072 г. Краснодар, ул. Московская, 2, корпус А
Автореферат разослан “ 27 ” апреля 2007 г.
Учёный секретарь
диссертационного совета,
кандидат химических наук, доцент Кожина Н.Д.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Среди известных пятичленных гетероциклов, пожалуй, трудно найти большего разнообразия химических свойств, чем у фурана. Поскольку химическое поведение фурановых соединений зависит одновременно и от их структуры, и от условий превращений, предсказать направление той или иной реакции зачастую просто не возможно, что делает химию фурана особенно интересной.
Среди многообразия свойств фурана особого внимания заслуживают внутримолекулярные реакции с участием электрофильного атома углерода. Известно три типа подобных превращений: внутримолекулярные циклизации, реакции электрофильного раскрытия фурана и миграции фуранового цикла или, так называемые, перегруппировки. Реакции первого и второго типа описаны в научной литературе достаточно подробно. При этом сведения о перегруппировках весьма скудны. Так, в 1997 г. [А. В. Бутин, В. Т. Абаев, Т. А. Строганова, А. В. Гутнов // Molecules. – 1997. - Vol. 2. – P. 62–68] на двух примерах была показана возможность перегруппировки 2-изотиоцианоарилдифурилметанов в производные 2,4-дифурил-4Н-3,1-бензотиазина в присутствии кислоты. В данной реакции изотиоцианатная группа выступает как С-электрофил, а превращение сопровождается миграцией одного из фурановых циклов.
Несмотря на биологическую активность, применение в технике некоторых производных 4Н-3,1-бензотиазинов и возможность использования их в синтезе других классов соединений, химию 4Н-3,1-бензотиазинов вряд ли можно считать хорошо изученной. Таким образом, разработка новых методов синтеза производных 4Н-3,1-бензотиазина весьма актуальна, а всестороннее изучение упомянутой выше перегруппировки представляет практический интерес. Поскольку же внутримолекулярные взаимодействия фурановых соединений с изотиоцианатной группой как С-электрофилом ранее описаны не были, установление зависимости между направлением реакции и строением фуранового субстрата имеет и фундаментальное значение.
Работа выполнена в соответствии с планом НИР кафедры органической химии и НИИ ХГС Кубанского государственного технологического университета, проводимой по тематическому плану Министерства науки и образования Российской Федерации: «Создание теории и разработка новых методов направленного синтеза O-, N-, S-содержащих полифункциональных соединений, перспективных для химии биологически активных веществ с избирательными свойствами», а также по грантам «Развитие общей методологии построения бензаннелированных гетероциклов на основе реакции рециклизации фуранового кольца» (грант РФФИ 03-03-32759) и «Трансформации фуранов в синтезе гетероциклических систем» (грант фирмы BAYER AG Synthon B006).
Целью работы является детальное изучение перегруппировки 2-изотиоцианоарилдифурилметанов, определение возможности ее распространения на тиофеновые и ароматические аналоги; изучение направленности внутримолекулярных реакций изотиоцианатной группы и фуранового цикла в присутствии кислотного катализатора на других фурановых субстратах, таких как 2-(2-изотиоцианоарил)фураны и 1-(2-изотиоцианоарил)-2-фурилэтаны.
Для реализации поставленных целей были сформулированы следующие задачи исследования:
– изучить влияние условий и структурных факторов на реакцию перегруппировки 2-изотиоциноарилдифурилметанов в производные 2,4-дифурил-4Н-3,1-бензотиазина;
– разработать методы синтеза и изучить направленность реакций в присутствие кислотного катализатора ароматических аналогов 2-изотиоцианоарилдифурилметанов – 2-изотиоцианотриарилметанов;
– исследовать направленность реакции в условиях кислотного катализа 2-изотиоцианодиарилметанов;
– изучить направленность реакций в присутствие кислоты изотиоцианатов фуранового ряда с С-0 и С-2 мостиком между фурановым и ароматическим циклами.
Научная новизна. Показано, что перегруппировка 2-изотиоцианоарилдифурилметанов, протекающая с миграцией одного из фурановых циклов, в производные 2,4-дифурил-4Н-3,1-бензотиазина является общей и может быть применена для синтеза 2,4-тиенил- и 2,4-диарил-4Н-3,1-бензотиазинов.
Изучена направленность внутримолекулярной реакции изотиоцианатной группы и фуранового кольца в присутствии кислотного катализатора в зависимости от строения фуранового субстрата.
Найдено, что внутримолекулярная реакция 2-(2-изотиоцианоарил)фуранов в присутствии хлористого алюминия протекает по механизму электрофильного раскрытия фуранового цикла и приводит к труднодоступным производным 8Н-тиено[2,3-b]индола.
Изучена реакция производного 1-(2-изотиоцианоарил)-2-фурилэтана в присутствии хлористого алюминия и установлено, что в этом случае изотиоцианатная группа выступает в роли N-нуклеофила, а превращение сопровождается отщеплением серы и приводит к неописанному ранее производному 5,6-дигидропирроло[1,2-a]хинолина.
Практическая значимость работы. Разработаны методы синтеза широкого ряда производных 2-нитроарилдифурилметана, 2-изотиоцианоарилдифурилметана, 2-нитротриарилметана, 2-аминотриарилметана, 2-изотиоцианотриарилметана, 2-изотиоцианодиарилметана 2-(2-изотиоцианоарил)фурана и 2,4-арил(гетарил)-4Н-3,1-бензотиазина.
Разработаны методы синтеза 2-(2-нитроарил)-5-алкилфуранов, 2-(2-аминоарил)-5-алкилфуранов, 2-(2-изотиоцианоарил)-5-алкилфуранов и труднодоступных 8Н-тиено[2,3-b]индолов.
Предложен новый методологический подход к синтезу 5,6-дигидропирроло[1,2-a]хинолинов.
Апробация работы. Основные результаты диссертации доложены на международной конференции по химии гетероциклических соединений, посвященной 90-летию со дня рождения профессора Алексея Николаевича Коста (Москва, 2005); III Евро-Азиатской конференции, посвященной химии гетероциклов “Гетероциклы в органической и комбинаторной химии (Новосибирск, EAHM-2004 ).
Публикации. По материалам диссертации опубликованы 2 статьи и тезисы 2 докладов.
Структура и объём работы. Диссертационная работа состоит из введения, литературного обзора, обсуждения результатов, экспериментальной части, выводов, списка цитируемой литературы и приложений. Работа изложена на 144 страницах машинописного текста, содержит 73 схемы и 47 таблиц. Список цитируемой литературы включает 99 ссылок.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
- Перегруппировка 2-изотиоцианоарилдифурилметанов
- Синтез исходных 2-изотиоцианоарилдифурилметанов
Стартовыми соединениями в синтезе 2-изотиоцианоарилдифурилметанов являются соответствующие 2-нитроарилдифурилметаны, которые получали конденсацией 2-нитробензальдегидов с 2-алкилфуранами в хлористом метилене с использованием в качестве катализатора силилового эфира полифосфорной кислоты (схема 1.1).
Схема 1.1

| Соединение | R1 | R2 | R3 | R4 | R5 | X | Время реакции, мин | Т, °С |
| 3а | H | OCH2O | H | Мe | O | 20-25 | rt | |
| 3б | H | OCH2O | H | Et | O | 30-35 | 35 | |
| 3в | H | OCH2O | H | t-Bu | O | 35-40 | - // - | |
| 3г | H | OCH2O | H | 4-BrPh | O | 60 | rt | |
| 3д | H | OCH2CH2O | H | Мe | O | 30 | - // - | |
| 3е | H | OМe | OМe | H | Мe | O | 25 | - // - |
| 3ж | H | H | Br | H | Мe | O | 40 | - // - |
| 3з | H | H | H | H | Мe | O | 30 | - // - |
| 3и | H | H | H | H | Мe | S | 90 | - // - |
| 3к | OМe | H | H | OМe | Мe | O | 25 | 35 |
| 3л | OМe | Мe | H | OМe | Мe | O | 20 | rt |
| 3м | OМe | OМe | H | Мe | Мe | O | 15-20 | - // - |
| 3н | OМe | OМe | H | Cl | Мe | O | 40-45 | 35 |
| 3о | OМe | OМe | H | Br | Мe | O | 30-35 | rt |
| 3п | H | OH | OМe | H | Мe | O | 40 | 35 |
| 3р | OМe | OH | OМe | H | Мe | O | 50 | - // - |
2-Нитроарилдифурилметаны 3а-и восстанавливали до соответствующих аминов 4а-и гидразингидратом в присутствии никеля Ренея при кипячении в этаноле (схема1.2). 2-Изотиоцианоарилдифурилметаны 5а-и получали обработкой аминов 4а-и раствором тиофосгена в хлористом метилене в присутствии водного раствора гидрокарбоната натрия.
Схема 1.2

| Соединения 3, 4, 5 | R1 | R2 | R3 | X |
| а | OCH2O | Мe | O | |
| б | OCH2O | Et | O | |
| в | OCH2O | t-Bu | O | |
| г | OCH2O | p-BrC6H4 | O | |
| д | OCH2CH2O | Мe | O | |
| е | OМe | OМe | Мe | O |
| ж | H | Br | Мe | O |
| з | H | H | Мe | O |
| и | H | H | Мe | S |
- Превращение 2-изотиоцианоарилдифурилметанов в производные 4Н-3,1-бензотиазина
Превращение 2-изотиоцианоарилдифурилметанов в производные 2,4-дифурил-4Н-3,1-бензотиазина в присутствии кислотного катализатора мы изучили на ряде исходных соединений (схема 1.3). Реакцию проводили в 1,4-диоксане в присутствии хлорной кислоты при комнатной температуре, при этом средняя продолжительность реакции составила 5 часов, а выходы конечных продуктов – 30-60 %.
Схема 1.3
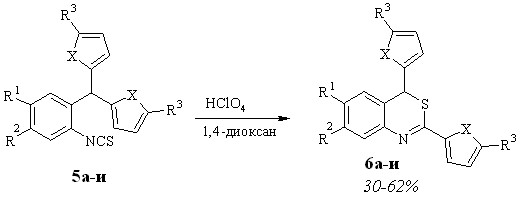
Для изучения влияния заместителей в положении 5 фуранового кольца на протекание трансформации арилдифурилметанов в производные бензотиазина мы выбрали ряд метанов 5, содержащих в фурановом кольце различные алкильные (Me, Et, t-Bu) и ароматический (p-Br-C6H4 - изотиоцианат 5г) заместители. Оказалось, что характер заместителя не оказывает существенного влияния на ход реакции. Она протекает по одному и тому же пути в сопоставимых интервалах времени. Замена алкильного заместителя на ароматический также не влияет на ход реакции. В результате также образуется бензотиазин 6г (30%). Единственное отличие в данном случае - большая длительность реакции: 3 суток при комнатной температуре.
Для доказательства универсальности разработанного метода синтеза производных бензотиазина из арилдигетарилметанов мы изучили трансформацию метана 5и, в котором фурановые циклы заменены на тиофеновые. Оказалось, что и в этом случае образуется соответствующий бензотиазин 6и (40%). Реакционную смесь выдерживали при 80–85 °С 8 часов.
Одной из причин относительно невысокого выхода соединений 6а-и является осмоление реакционной смеси, которое, по-видимому, вызывается длительным контактом исходного вещества и продуктов его превращения с кислотным катализатором в присутствии следов воды (70%-ная HClO4). Учитывая это, мы решили осуществить трансформацию метанов 5а-и в безводных условиях, используя в качестве катализатора кислоту Льюиса.
Мы установили, что проведение этой реакции в дихлорэтане при комнатной температуре в присутствии полуторократного избытка безводного хлористого алюминия не приводит к существенному увеличению выходов бензотиазинов 6а-и, а вот время реакции значительно снижается и составляет для 5а-в,д-и 10 мин. - 1ч. 20 мин., а для 5г - 4 ч. 20 мин.
Структура и пространственное строение соединения 6д исследованы методом рентгеноструктурного анализа (рисунок 1).
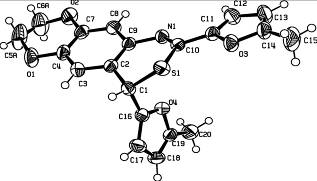
Рисунок 1
Предполагаемый механизм реакции представлен на схеме 1.4. Активация изотиоцианогруппы протоном инициирует электрофильную атаку атома углерода этой группы по -положению фуранового (тиофенового) цикла, что приводит к разрыву углерод-углеродной связи и образованию карбокатиона. Последующая нуклеофильная атака атома серы тиоамидной группы по электрофильному атому углерода этого катиона дает замыкание тиазинового цикла.
Схема 1.4

Разработанный нами метод синтеза 2,4-дизамещенных бензотиазинов ранее описан не был. Изученная реакция представляет собой новый пример внутримолекулярного взаимодействия фурана с электрофильным углеродом, приводящего к миграции фуранового цикла.
- Реакции 2-изотиоцианотриарилметанов в присутствии безводного хлористого алюминия
Для расширения границ применимости разработанного метода синтеза 2,4-дизамещенных 4Н-3,1-бензотиазинов мы изучили реакции ароматических аналогов 2-изотиоцианоарилдигетарилметанов – 2-изотиоцианотриарилметанов.
Поскольку целью дальнейших исследований было изучение возможности использования в синтезе бензотиазинов 2-изотиоцианотриарилметанов, легко получаемых из соответствующих аминов, одной из первоначальных задач стала разработка синтеза 2-аминотриарилметанов. Для синтеза этих соединений мы использовали три различных подхода.
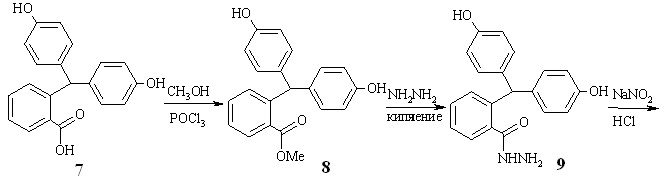
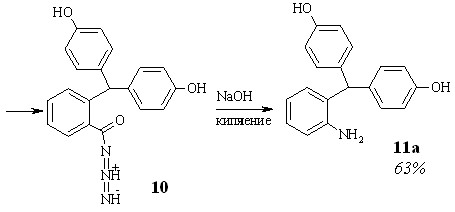
Первый представлен на схеме 2.1. На начальной стадии в результате взаимодействия 2-бис-(4-гидроксифенил)метилбензойной кислоты 7 с метанолом и хлорокисью фосфора образуется соответствующий метиловый эфир 8, который при кипячением в 80%-ном гидразингидрате дает гидразид 9. Обработка соединения 9 водным раствором нитрита натрия в присутствии HCl приводит к азиду 10, из которого в условиях перегруппировки Курциуса получен 2-бис-(4-гидроксифенил)метиланилин 11а.
Схема 2.5
2-Аминотриарилметаны 11б-д (второй подход) получены в две стадии (схема 2.2). На первой стадии конденсацией 2-нитробензальдегидов 12 с 1,2-дизамещенными бензолами 13 синтезировали 2-нитротриарилметаны 14б-д. Нитрогруппы восстанавливали гидразингидратом в присутствии никеля Ренея по методу, предложенному ранее для соединений 4а-и.
Схема 2.6

| R1 | R2 | R3 | R4 | Выходы, % | ||
| 14 | 11 | |||||
| б | H | H | OCH2CH2O | 76 | 75 | |
| в | H | H | OMe | OMe | 57 | 84 |
| г | OMe | OMe | OMe | OMe | 27 | 91 |
| д | OMe | OMe | OEt | OEt | 50 | 78 |
Для синтеза 2-аминотриарилметанов 11е-з (третий подход) на первой стадии взаимодействием метилантранилата с арилмагнийбромидами получены 2-аминофенилдиарилкарбинолы 16е-з (схема 2.3). Восстановление последних цинком в уксусной кислоте приводит к 2-ацетаминофенилдиарилметанам 17е-з. В результате щелочного гидролиза амидов 17е-з получены свободные основания – 2-аминотриарилметаны 11е-з.
Схема 2.7
| R | Выходы, % | |||
| 16е,ж,з | 17е,ж,з, | 11е,ж,з | ||
| е | H | 66 | 83 | 83 |
| ж | Me | 70 | 82 | 86 |
| з | OMe | 61 | 79 | 75 |
Изотиоцианаты 18 получали согласно методу, использованному ранее для синтеза изотиоцианатов фуранового ряда 5а-и (схема 2.4).
Схема 2.8
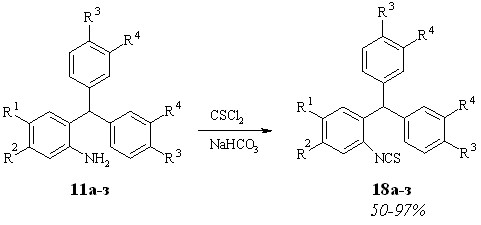
- Перегруппировка 2-изотиоцианотриарилметанов
Попытка провести реакцию перегруппировки изотиоцианотриарилметанов 18 в условиях, использованных для метанов 5 оказалась безуспешной. Для проведения перегруппировки нами проведен подбор реакционных условий и в качестве оптимальных выбраны следующие: растворители - 1,1,2,2-тетрахлорэтан или 1,2-дихлорэтан, катализатор - безводный хлористый алюминий.
Выходы ожидаемых бензотиазинов 19а-з составляют 9-61%. Наряду с соединениями 19а-з в ходе реакции мы наблюдали образование продуктов 20 – дибензоазепинтионов, которые выделены и идентифицированы только в реакциях соединений 18в,д,ж (схема 2.5). Исключение составляет перегруппировка изотиоцианата 18е, в ходе которой бензотиазин 19е получен в качестве единственного продукта реакции.
Схема 2.9

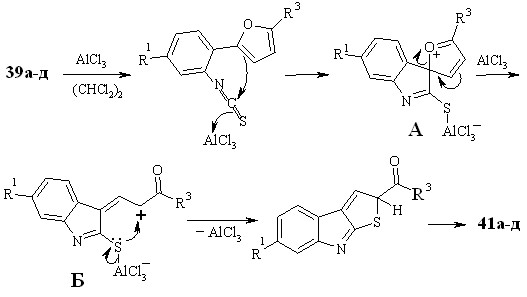
Механизм этих превращений представлен на схеме 2.6. Реакция начинается с активации изотиоцианогруппы соединения 18 хлористым алюминием с последующей электрофильной атакой одного из ароматических колец. Ипсо-замещение по связи Сsp3-CAr - основное направление реакции, в результате которого образуется бензгидрильный катион А. Последующая атака катиона А атомом серы приводит к формированию тиазинового цикла соединений 19. Внутримолекулярная атака атома углерода изотиоцианогруппы по орто-положению ароматического кольца - конкурирующий процесс, приводящий к образованию дибензоазепинтионов 20 (выходы от 3 до 25%).
Схема 2.10

Неожиданным оказалось выделение бензотиазина 21 (схема 2.7) в результате трансформации изотиоцианата 18з. Соединение 21 представляет собой продукт деметилирования одной из метоксигрупп.
Схема 2.11

Структуры соединений 21 и 20д исследованы методом рентгеноструктурного анализа. Как видно из рисунка 2, реакции деметилирования подверглась метоксигруппа в ароматическом ядре, связанном по положению 2 с бензотиазином.
Структура и пространственное строение соединения 20д представлены на рисунке 3.

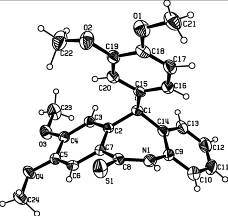
Рисунок 2 Рисунок 3
Таким образом, не смотря на конкурирующий процесс образования азепинтионов, катализируемая безводным хлористым алюминием трансформация 2-изотиоцианотриарилметанов с успехом может быть применена для синтеза 2,4-диарил-4Н-3,1-бензотиазинов, а предложенный нами метод синтеза соединений этого класса является общим.
- Реакции 2-изотиоцианодиариметанов в присутствии безводного хлористого алюминия
Очевидно, что в исследуемой нами реакции для формирования тиазинового каркаса необходимо образование стабильного карбокатиона в качестве интермедиата. В случае изотиоцианатов триарилметанового ряда образующийся карбокатион относится к бензгидрильному типу. Мы предположили, что при снижении стабильности карбокатиона направленность изучаемой реакции можно менять в сторону предпочтительного образования азепинтионовой структуры. Для этого мы изучили превращение 2-изотиоцианодиарилметанов в присутствии безводного хлористого алюминия, поскольку для их трансформации в соответствующие производные бензотиазина реакция должна протекать через промежуточное образование катиона бензильного типа, стабильность которого существенно ниже бензгидрильного.
Соединения 25а-в синтезировали восстановлением карбонильной группы аминокетонов 24а-в боргидридом натрия в присутствие безводного хлористого алюминия при кипячении в тетрагидрофуране (схема 2.8). Изотиоцианаты 26а-в получены по методу, примененному для синтеза соединений 5а-и.
Схема 2.12

| R | Выходы, % | ||
| 25а-в | 26а-в | ||
| а | H | 59 | 72 |
| б | Cl | 60 | 84 |
| в | Me | 76 | 85 |
Реакцию проводили в условиях, подобранных для 2-изотиоцианотриарилметанов - в абсолютном дихлорэтане в присутствие безводного хлористого алюминия. При использовании в реакции изотиоцианатов 26а,б образуется смесь нестабильных продуктов, что не позволяет выделить какой-либо продукт для идентификации. Объяснить этот факт нам пока не удалось. Тем не менее, в случае изотиоцианата 26в нам удалось выделить азепинтион 27 (38 %) в качестве единственного продукта реакции (схема 2.9).
Схема 2.13
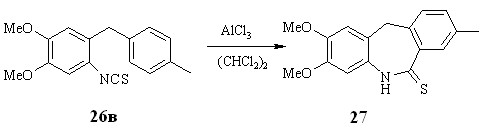
Структура соединения 27 подтверждена двумерными спектрами ЯМР.
- Изучение влияния длины углеродного мостика между ароматическим кольцом, содержащим в орто-положении изотиоцианатную группу, и фурановым циклом на направление реакции
Поскольку генерирование стабильного карбокатиона - необходимое условие для формирования тиазинового цикла, следующей задачей стало изучение поведения изотиоцианатов фуранового ряда, для которых формирование такого карбокатиона невозможно. Последнее достигается при использовании изотиоцианатов с одним фурановым циклом. При этом фурановый цикл должен быть связан с ароматическим ядром непосредственно, либо цепочкой, содержащей больше одного атома углерода.
- Синтез 3,4-дигидрохинолина
Первым шагом в этом направлении стал синтез фуранового субстрата с С2-мостиком. Последовательность всех стадий синтеза требуемого изотиоцианата представлена на схеме 3.1.
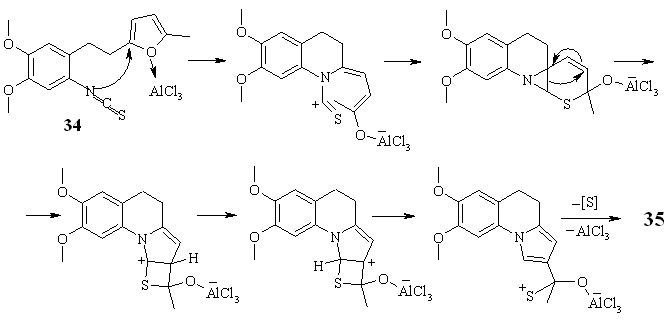
Взаимодействием гомовератровой кислоты с трет-бутилфураном при комнатной температуре в хлороформенном растворе силилового эфира полифосфорной кислоты получен кетон 30. Нитрование последнего азотной кислотой в уксусной кислоте привело к образованию нитропроизводного 31. Этан 32 синтезирован восстановлением карбонильной группы согласно методу, используемому для синтеза соединений 24. Амин 33 и изотиоцианат 34 получены по методикам, разработанным для синтеза соединений 4 и 5 соответственно.
Схема 3.14

Трансформацию изотиоцианата 34 проводили при комнатной температуре в 1,2-дихлорэтане в присутствии хлористого алюминия. В результате данного превращения с выходом 89 % образуется неописанное ранее производное 3,4-дигидрохинолина 35 (схема 3.2).
Схема 3.15

Возможный механизм превращения изотиоцианата 34 в производное дигидрохинолина 35, представленный на схеме 3.3, однозначно не выяснен. Предположительно реакция включает стадию активации хлористым алюминием фурана и последующую нуклеофильную атаку атома азота по -положению фуранового цикла, что приводит к его раскрытию и далее к формированию структуры 35.
Схема 3.16
Для подтверждения структуры выполнен рентгеноструктурный анализ монокристалла дигидрохинолина 35 (рисунок 4).

Рисунок 4
- Катализируемая кислотным катализатором трансформация 2-алкил-5-(2-изоитоцианоарил)фуранов
Следующими объектами исследования стали 2-алкил-5(2-изотиоцианоарил)фураны, в которых ароматический и фурановый циклы соединены напрямую, без углеродного мостика. В качестве исходных соединений мы использовали 2-нитрофенилацетилфуран и 2-нитроарилфурфуролы.
2-Нитроарилфурфуролы 36а,в-д и 2-нитрофенилацетилфуран (36б) получены арилированием фурановых субстратов соответствующими солями диазония (схема 3.4). 2-Алкил-5-(2-нитроарил)фураны 37а-д - восстановлением карбонильной группы соединений 36а-д методом, использованным для синтеза соединений 24. Амины 38а-д и изотиоцианаты 39а-д синтезированы согласно методам, разработанным для 4а-и и 5а-и.
Схема 3.17

| Соединение 36-39 | а | б | в | г | д |
| R1 | H | H | Cl | Me | ОMe |
| R2 | Н | Ме | Н | Н | Н |
Кислотно-катализируемую трансформацию 2-алкил-5-(2-изотиоцианоарил)фуранов 39а-д в тиеноиндолы 41а-д проводили в дихлорэтане в присутствии хлористого алюминия (схема 3.5), при температуре от 40 до 50 °С, время реакции – 15-40 минут.
Схема 3.18
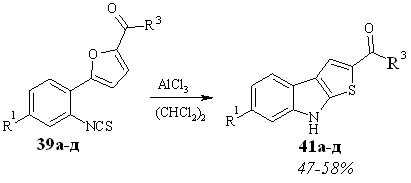
Очевидно, реакция протекает по механизму электрофильного раскрытия фуранового цикла (схема 3.6) и включает стадию образования катиона А в результате электрофильной ипсо-атаки атома углерода изотиоцианогруппы, активированной хлористым алюминием, по -положению фурана. Последующее раскрытие фуранового цикла дает новый катион Б. Последний подвергается нуклеофильной атаке атома серы по катионному центру, приводящей к формированию тиофенового цикла.
Схема 3.19
Структура и пространственное строение тиеноиндола 41а исследованы методом рентгеноструктурного анализа (рисунок 5).
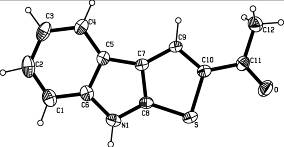
Рисунок 5
Таким образом, мы изучили влияние строения исходного фуранового субстрата на направленность внутримолекулярных реакций изотиоцианатной группы с фурановым циклом в присутствие кислотного катализатора. Как показано на схеме 3.7, в зависимости от исходного фурана результатом ее могут быть совершенно разные продукты.
Схема 3.20

Структуры всех исходных соединений подтверждены 1Н ЯМР спектроскопией, а при наличии карбонильной и изотиоцианатной групп – в комплексе с ИК спектроскопией. Структуры всех конечных продуктов подтверждены методами ЯМР1Н, 13С, ИК спектроскопии и масс-спектрометрии. Проведен рентгеноструктурный анализ соединений 6д, 21, 20д, 33а, 28.
ВЫВОДЫ
- Изучены превращения 2-изотиоцианоарил-ди-(2-алкил-5-фурил)метанов, 2-алкил-5-(2-изотиоцианоарил)фуранов и 1-(2-изотицианоарил)-2-(5-алкил-2-фурил)этана в присутствии кислотных катализаторов. Показано, что направление реакции внутримолекулярного взаимодействия изотиоцианатной группы и фурана существенным образом зависит от количества углеродных атомов, связывающих фурановое и ароматическое кольца.
- Разработан общий метод синтеза производных 2,4-диарил(гетарил)-4Н-3,1-бензотиазина, основанный на реакции миграции ароматического (гетероциклического) кольца при обработке кислотным катализатором 2-изотиоцианатов триарил- и арилдигетарилметанов.
- Найден новый подход к синтезу труднодоступных производных 8Н-тиено[2,3-b]индола, основанный на реакции электрофильного раскрытия фуранового цикла 2-(2-изотиоцианоарил)фуранов в присутствии хлористого алюминия.
- Установлено, что обработка хлористым алюминием производного 1-(2-изотиоцианоарил)-2-фурилэтана приводит к 5,6-дигидропирроло[1,2-a]хинолину, а изотиоцианатная группа в этом случае выступает в роли N-нуклеофила.
- Найдены оптимальные условия получения 2-нитроарилдифурилметанов - удобных предшественников в синтезе гетероциклов различных типов - проведение реакции 2-нитробензальдегидов и 2-алкилфуранов в силиловом эфире полифосфорной кислоты.
Основное содержание диссертации изложено в следующих работах:
- Ф. А. Циунчик, В. Т. Абаев, А. В. Бутин, Новый синтез 2-нитроарилдифурилметанов // Химия гетероцикл. соединений. – 2005. – № 12. – С. 1796-1799.
- V. T. Abaev, F. A. Tsiunchik, A. V. Gutnov, A. V. Butin, Aromatic ring transfer – a new synthesis of 2,4-diaryl-4H-3,1-benzothiazines // Tetrahedron Lett. – 2006. – Vol. 47. – P. 4029-4032.
- Ф. А. Циунчик, В. Т. Абаев, А. В. Бутин, Внутримолекулярная миграция ароматических колец в синтезе 2,4-диарил(гетарил)-4Н-3,1-бензотиазинов // Международная конференция по химии гетероциклических соединений, посвященная 90-летию со дня рождения профессора Алексея Николаевича Коста: тез. докл. 17-21 сентября 2005 г. – Москва, 2005. – С. 345.
- V. T. Abaev, F. A. Tsiunchik, A. V. Butin, New type of intramolecular interaction between electrophilic carbon and furan ring // 3rd EuroAsian HeterocyclicMeeting “Heterocycles in organic and combinatorial chemistry” (EAHM-2004) September 12-17 Novosibirsk 2004.: Тез. докл.-Новосибирск. – 2004. – P. 127.
Подписано в печать ______________ Зак. № ______ Тираж _____
Лиц. ПД № 10-47020 от 11.09.2000
Типография КубГТУ, 350058, Краснодар, ул. Старокубанская, 88/4

