Реакция биджинелли в ряду амидов ацетилуксусной кислоты
На правах рукописи
![]()
Замараева Татьяна Михайловна
РЕАКЦИЯ БИДЖИНЕЛЛИ В РЯДУ АМИДОВ АЦЕТИЛУКСУСНОЙ КИСЛОТЫ
02.00.03 – Органическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Пермь – 2010
Диссертационная работа выполнена в ГОУ ВПО «Пермская государственная фармацевтическая академия Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель: Гейн Владимир Леонидович
доктор химических наук, профессор
| Официальные оппоненты: | Масливец Андрей Николаевич, доктор химических наук, профессор, Пермский государственный университет | |
| Машевская Ирина Владимировна доктор химических наук, профессор, ФГОУ ВПО «Пермская государственная сельскохозяйственная академия имени Д.Н. Прянишникова» | ||
| Ведущая организация: | ГОУ ВПО «Саратовский государственный университет имени Н.Г. Чернышевского» | |
| Защита состоится 8 октября 2010 г. в 15 часов на заседании диссертационного совета Д 004.016.01 в Институте технической химии УрО РАН по адресу: 614013, г. Пермь, ул. Академика Королёва, 3 Факс (342) 237-82-62, e-mail: [email protected] С диссертацией можно ознакомиться в библиотеке ИТХ УрО РАН. Отзывы на автореферат просим направлять на адрес ИТХ УрО РАН, в диссертационный совет Д 004.016.01. Автореферат разослан 8 сентября 2010 г. Автореферат размещён на сайте ИТХ УрО РАН www.itch.perm.ru 8 сентября 2010 г. | ||
| Учёный секретарь диссертационного совета, кандидат химических наук |  Горбунов А.А. Горбунов А.А. | |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Многокомпонентные реакции являются современным методом получения биологически активных соединений. Одним из примеров таких реакций является известная реакция построения пиримидинового цикла – реакция Биджинелли. Продукты реакции Биджинелли привлекают внимание исследователей как класс органических веществ с широким спектром биологической активности и как высокоэффективные ключевые соединения для модификации уже существующих биологически активных матриц. Согласно литературным данным к настоящему времени среди веществ данного класса найдены вещества, проявляющие антистафилококковую, противовирусную, противотуберкулезную, противогрибковую, антигипертензивную, антиаритмическую активности, выделен новый класс в медицине – блокаторы кальциевых каналов. Принимая во внимание значительный практический интерес к указанным гетероциклическим соединениям, следует отметить, что в данной реакции в качестве -дикарбонильного соединения в основном применяют ацетоуксусный эфир и его простейшие производные. Использование N-алкил(арил)амидов ацетилуксусной кислоты в трехкомпонентной реакции Биджинелли практически не рассматривалось в литературе. Поэтому, представляло интерес изучить взаимодействие амидов ацетоуксусной кислоты со смесью ароматического альдегида и мочевины. Исследовать какое влияние на протекание трехкомпонентной реакции окажет замена мочевины на тиомочевину, аминоазолы, а также замена альдегида на формил-поданд.
Цель работы. Целью данного исследования является изучение возможности использования N-замещенных амидов ацетилуксусной кислоты в реакции Биджинелли, что открывает перспективы синтеза соединений пиримидинового ряда и конденсированных гетероциклических систем, содержащих в своем составе амидную группу.
Задачи исследования. Для достижения поставленной цели были сформулированы следующие задачи:
1. Изучить трехкомпонентную реакцию N-арил(алкил)амидов ацетилуксусной кислоты, ароматических альдегидов с мочевиной и тиомочевиной.
2. На основе трехкомпонентной реакции N-арил(алкил)амидов ацетилуксусной кислоты, ароматических альдегидов с NH2,NH-гетероциклами исследовать возможность образования конденсированных систем из гетероциклов.
3. Провести анализ результатов исследований противомикробной активности синтезированных соединений в сравнении с препаратами эталонами с целью выявления взаимосвязи «структура - антимикробное действие».
Научная новизна работы. Впервые изучено взаимодействие N-арил(алкил)амидов ацетилуксусной кислоты со смесью ароматического альдегида и мочевины(тиомочевины). Подробно исследована реакция трехкомпонентной конденсации аминоазолов с ароматическими альдегидами и амидами ацетилуксусной кислоты. Осуществлен синтез ранее неизвестных гетероциклических систем производных амидов 4,7-дигидротетразоло[1,5-а]пиримидина, 4,7-дигидро-1,2,4-триазоло[1,2-а]пиримидина, 2-оксо(тиоксо)-1,2,3,6-тетрагидропиримидина, бензимидазоло-1,4-дигидропиримидина.
Проведен анализ данных по противомикробной активности вновь синтезированных соединений в сравнении с препаратами эталонами и установлены некоторые закономерности взаимосвязи «структура-антимикробное действие».
Практическая ценность. Предложены простые и удобные однореакторные методы синтеза N,6-диарил-4-метил-2-оксо(тиоксо)- и N,N-диэтил-4-метил-2-оксо(тиоксо)-6-фенил-1,2,3,6-тетрагидропиримидин-5-карбоксамидов, N,7-диарил-5-метил- и 7-арил-N,N-диметил(диэтил)-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамидов, N,7-диарил-5-метил-4,7-дигидро-1,2,4-триазоло[1,2-а]пиримидин-6-карбоксамидов, 2-амино-7-арил-5-метил-N-2-метилфенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидин-6-карбоксамидов, 4-арил-2-метил-N-2,4-диметилфенил-бензимидазоло-1,4-дигидропиримидино-3-карбоксамидов, N,6-диарил-4-метил-2-тиоксо-3-фенил-1,6-дигидропиримидин-5-карбоксамидов, подандов функционализированных фрагментами 4,7-дигидротетразоло[1,5-а]пиримидина и 2-оксо(тиоксо)-1,2,3,6-тетрагидропиримидина, которые могут быть использованы как препаративные при синтезе новых биологически активных соединений.
В процессе работы синтезировано 112 неописанных в литературе соединений, 53 из них было изучено на наличие противомикробной активности.
Публикации. По теме диссертационной работы опубликовано 15 работ: 4 статьи в центральной печати, 3 статьи в научно-практическом журнале Вестник ПГФА, 8 тезисов-докладов на конференциях различного уровня.
Апробация. Материалы исследований доложены и обсуждены на Российской научно-практической конференции, посвященной 70-летию ПГФА (Пермь, 2007); Российской научно-практической конференции ПГФА, проводимой в рамках 14-ой международной выставки «Медицина и здоровье» (Пермь, 2008); на конференции «Фармация и общественное здоровье» (Екатеринбург, 2008); научно-практической конференции «Фармация из века в век» (СПб., 2008); «Фармация и общественное здоровье» (Екатеринбург, 2009); молодежной научно-практической школы-конференции «Химия поликарбонильных соединений» (Пермь, 2009); на V международной конференции по органической химии для молодых ученых «Вклад университетского образования в органическую химию» (СПб., 2009).
Структура и объем диссертации. Диссертационная работа общим числом 108 страниц машинописного текста состоит из введения, 4 глав, выводов, библиографического списка, включающего 94 наименования работ отечественных и зарубежных авторов. Работа содержит 16 таблиц. Глава первая посвящена обзору литературы по синтезу, химическим свойствам и биологической активности производных дигидропиримидина. Во второй и третьей главах обсуждаются результаты собственных исследований. Четвертая глава содержит результаты противомикробной активности полученных соединений.
Благодарность. Автор выражает глубокую благодарность доценту, к.х.н. Ворониной Э.В. (Пермская государственная фармацевтическая академия) за проведение исследований по противомикробной активности, Федоровой О.В. (Институт органического синтеза Уральского отделения Российской академии наук, г. Екатеринбург) за предоставление исходного компонента (формил-поданда) для реакции.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Глава 1. Синтез, свойства и биологическая активность продуктов реакции Биджинелли
В главе приводятся обобщенные данные литературы по способам синтеза, химическим превращениям и биологической активности производных дигидропиримидина.
Глава 2. Реакция Биджинелли в ряду амидов ацетилуксусной кислоты
В главе представлены результаты собственных исследований по изучению возможности использования N-замещенных амидов ацетилуксусной кислоты в реакции Биджинелли, рассмотрена вероятность образования конденсированных систем из гетероциклов на основе трехкомпонентной реакции N-арил(алкил)амидов ацетилуксусной кислоты, ароматических альдегидов с NH2,NH-гетероциклами.
- Синтез N,6-диарил-4-метил-2-оксо-1,2,3,6-тетрагидропиримидин-5-карбоксамидов
Синтез N,6-диарил-4-метил-2-оксо-1,2,3,6-тетрагидропиримидин-5-карбоксамидов проводился по реакции трехкомпонентной конденсации ацетоацетанилидов, мочевины и ароматических альдегидов, взятых в эквимолярном соотношении в отсутствии растворителя без катализатора при температуре 120-150°С в течение 5-7 мин.
Вероятно, на первой стадии происходит присоединение мочевины к ароматическому альдегиду с образованием аминокарбинола с последующей его дегидратацией. На второй стадии предполагается взаимодействие ароматического амида ацетилуксусной кислоты с N-бензальмочевиной с образованием незамкнутого уреида, который в последствии циклизуется до целевого продукта (I а-х).
Схема 1
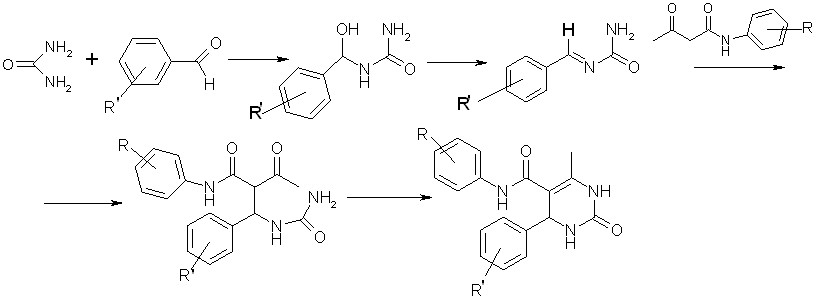
I а-х (47-92 %)
I: R = H, R= H (а), 4-NO2 (б), 4-Cl (в), 3-NO2 (г), 2-Cl (д), 4-C(CH3)3 (е),
4-N(CH3)2 (ж), 4-Br (з); R = 2-Me, R = H (и), 3-NO2 (к), 2-CH3O (л), 4-Cl (м); R = 2,4-(Me)2, R = H (н), 4-Cl (о), 2-F (п), 3-F (р), 3-NO2 (с); R = 2-MeО, R = H (т), 4-Cl (у), 4-HO (ф), 2-CH3O (х).
Соединения (I а-х) представляют собой бесцветные кристаллические вещества, растворимые в хлороформе, ДМФА, ДМСО, при нагревании – в этиловом спирте, ледяной уксусной кислоте, нерастворимые в воде.
В ИК спектрах соединений (I а-х) наблюдаются полосы, обусловленные валентными колебаниями амидных групп (1660-1680 см-1), полоса С=С в области 1600-1620 см-1, а также NH связей (3150-3200 см-1).
Характерным для спектров ЯМР 1Н соединений (I а-х) является наличие наряду с сигналами ароматических протонов и связанных с ними групп синглета протонов группы СН3 в области 1.79 - 2.21 м.д., дублета протона Н-6 в области 5.20 - 6.45 м.д. J1,6 = 1.80 - 2.48 Гц, два сигнала протона Н-3 в области 7.79 - 8.98 м.д. и дублета протона Н-1 7.05 – 7.84 м.д. J1,6 = 1.80 - 2.48 Гц пиримидинового кольца, синглета протона группы NH боковой цепи в области 8.74 - 10.08 м.д. Положение сигнала протона Н-1 было установлено в серии экспериментов с подавлением сигнала NH протонов боковой цепи, в Н-1 и Н-3 положениях пиримидинового цикла.
В масс-спектре соединения (I н) присутствуют пик молекулярного иона с m/z (Iотн, %) 335 [М]+ (14.55), пики фрагментных ионов с m/z 121 [(СН3)2С6Н3NH]+ (100.00), [Ph] + m/z 77 (46.25), подтверждающие данную структуру.
2.2 Синтез N,6-диарил-4-метил-2-тиоксо-1,2,3,6-тетрагидропиримидин-5-карбоксамидов
Было установлено, что сплавление смеси N-ариламидов ацетилуксусной кислоты, ароматического альдегида и тиомочевины при температуре 120-150°С в течение 5-7 мин приводит к образованию N,6-диарил-4-метил-2-тиоксо-1,2,3,6-тетрагидропиримидин-5-карбоксамидов (II а-ф).
Выявлено, что время протекания реакции меньше, а выходы продуктов реакции выше по сравнению с классическим методом Биджинелли: 20-30 % целевого продукта образуется при длительном (2-3 суток) перемешивании реагентов в EtOH в присутствии HCl, либо их кипячение в течение 3-4 ч. Достаточно высокие выходы соединений (II а-ф), по-видимому, объясняются малой реакционноспособностью амидной группы, что исключает возможность протекания побочных реакций.
Схема 2

II а-ф (39-89 %)
II: R=H R’=H (а), 3-NO2 (б), 4-Cl (в), 2-Cl (г), R’C6H4=2-пиридил (д), 4-C2H5 (е); R=2-СH3 R’=H (ж), 4-CH3O (з), 4-HO-3-C2H5O (и), 3-F (к); R=2,4-(СH3)2 R’=H (л), 4-CH3O (м), 4-HO-3-C2H5O (н), 4-C(CH3)3 (о), 4-C2H5O (п), 3-HO (р), 4,3-(CH3O)2 (с), 2,5-(CH3O)2 (т); R=4-Cl R’=H (у), 4-OH (ф)
Структура синтезированных соединений II а-ф подтверждена методами ИК, ЯМР 1Н и 13С спектроскопии, масс-спектрометрии.
В спектре ЯМР 13С соединения (II в) проявляются сигналы атомов углерода метильной группы при 16.40 м.д., СН группы – 54.49 м.д., амидной группы при 164.74 м.д., С2 при 174.28 м.д., ароматических колец при 119.74 – 138.81 м.д.
В масс-спектре соединения (II л) присутствуют пик молекулярного иона с m/z (Iотн, %) 351 [M]+, пики фрагментных ионов 231 [М-(СН3)2С6Н3NH]+ (2.48), 121 [(СН3)2С6Н3NH2]+ (100.00), 77 [Ph]+ (19.83), подтверждающие данную структуру.
На выход образующихся соединений (IIа-ф) оказывает влияние характер заместителя: повышение электроноакцепторных свойств, как в амиде, так и альдегиде способствует увеличению выхода целевых соединений.
В спектрах ЯМР 1Н соединений ряда I и II наблюдается два сигнала протона Н-3, что показывает возможность существования соединений в двух таутомерных формах (А, В) и обусловлено наличием двух близко расположенных сигналов протонов групп ОН (SH) и NH.
Схема 3

2.3 Синтез N,N-диэтил-4-метил-2-оксо(тиоксо)-6-фенил-1,2,3,6-тетрагидропиримидин-5-карбоксамидов
Было обнаружено, что сплавление при более высокой температуре 150 -170°С без растворителя в течение 10-15 мин N,N-диэтиламида ацетилуксусной кислоты, мочевины (тиомочевины) и бензальдегида, приводит к образованию N,N-диэтил-4-метил-2-оксо(тиоксо)-6-фенил-1,2,3,6-тетрагидропиримидин-5-карбоксамидов (III а,б).
Схема 4
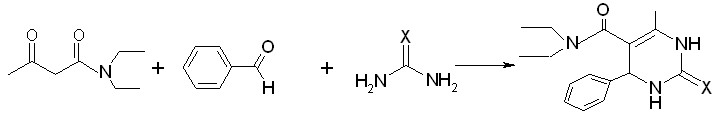
III а,б
X = O (а) (74%), S (б) (67%)
В спектрах ЯМР 1Н полученных соединений присутствуют наряду с сигналами ароматических протонов синглет протонов группы СН3 в области 1.61 – 1.67 м.д., дублет протона Н-6 в области 4.94 – 4.97 м.д., два сигнала протона Н-3 в области 8.26 – 9.65 м.д. и дублет протона группы Н-1 8.11 – 8.92 м.д. пиримидинового кольца. В спектрах соединений проявляются мультиплеты протонов групп (СН3СН2)2NСО в области 0.75-0.76 м.д. и (СН3СН2)2NСО в области 3.09-3.14 м.д.
2.4 Синтез N,6-диарил-4-метил-2-тиоксо-3-фенил-1,6-дигидропиримидин-5-карбоксамидов
С целью изучения влияния заместителя в тиомочевине на протекание исследуемой реакции было впервые изучено взаимодействие фенилтиомочевины с ароматическими альдегидами и 2-метил(2,4-диметил)ацетоацетанилидом. Реакция проводилась при выдерживание смеси реагентов при 160-180 °С в течение 20-30 минут.
Полученные соединения представляют собой желтые кристаллические вещества, растворимые в ДМСО, уксусной кислоте, нерастворимые в воде.
Схема 5
R = 2,4-(CH3)2 , R1 = 4-NO2 (а) (42%); R = 2-CH3, R1 = 4-Cl (б) (54%)
Характерным для спектров ЯМР 1Н соединений (IV а,б) является присутствие помимо сигналов ароматических протонов и связанных с ними групп, синглета группы СH3-4 в области 1.87 - 1.88 м.д., дублета протона NH-1 в области 8.20 - 9.70 м.д., дублета протона CH-6 в области 5.37 - 5.40 м.д., сигнала NH группы боковой цепи в области 9.08 - 9.86 м.д. Расщепление сигналов протонов в 1 и 6 положениях пиримидинового цикла свидетельствует о том, что структура B не образуется.
Понижение выходов продуктов реакции (IV а,б) по сравнению с (II а-ф), вероятно, связано с затруднениями при циклизации, возникающих из-за присутствия фенильного заместителя в фенилтиомочевине.
2.5 Синтез N,7-диарил-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамидов
Нами впервые было обнаружено, что в исследуемой реакции Биджинелли в качестве изостеров мочевины могут выступать аминоазолы. Как показали проведенные исследования при выдерживании в отсутствии растворителя при температуре 120-150С в течение 5-15 мин ацетоацетанилидов со смесью ароматического альдегида и 5-аминотетразола моногидрата образуются N,7-диарил-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамиды (V а-я).
По-видимому, на первой стадии реакции образуется непредельное соединение А, с которым взаимодействует 5-аминотетразол с образованием соединений структуры В (V а-я). Изомерная структура С не образуется в следствие меньшей термодинамической устойчивости 1,2-дигидропроизводных по сравнению с 1,4-дигидропроизводными.
Схема 6
 V а-я
V а-я
V: R= H R1= H (а), 4-Cl (б), 2-NO2 (в), 3-NO2 (г), 2-Cl (д), 4-HO-3-CH3O (е), 3-F (ж), 4-F (з), 2,4-Cl2 (и); R= 2-CH3 R1= H (к), 4-HО (л), 4-F (м), 2-F (н), 2,4-Cl2 (о), 4-Cl (п), 4-HO-3-CH3O (р), 2-Сl (с); R= 2,4-(CH3)2 R1= H (т), 4-F (у), 2,4-Cl2 (ф), 2-Cl (х), 4-HO-3-CH3O (ц), 4-Cl (ч); R=2-CH3O R1= H (ш), 4-HO-3-CH3O (щ), 4-CH3О (ы); R= 4-Cl R1= H (э), 4-NO2 (ю), 4-HО (я).
В спектрах ЯМР 1Н N,7-диарил-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамидов кроме сигналов ароматических протонов и связанных с ароматическим кольцом групп наблюдается синглет протонов группы СН3 в области 1.73-2.25 м.д., синглет протона группы СН в области 6.62-6.98 м.д., два синглета протонов групп NH в области 8.84-9.42 м.д. и 10.46-10.81 м.д.
В спектре ЯМР 13С соединения (V ю) присутствуют химические сдвиги атомов углерода амидной группы при 164.01 м.д., метильной группы при 17.48 м.д., СН группы – 58.74 м.д., С4а при 149.12 м.д., а также группа линий ароматических сигналов при 121.25-147.66 м.д.
В масс-спектре соединения (V л) присутствуют пики фрагментных ионов с m/z 228 [М-СН3С6Н4NHCO]+, 120 [СН3С6Н4СО]+, 77 [Ph]+, что полностью подтверждает предполагаемую структуру.
2.6 Синтез 7-арил-N,N-диметил(диэтил)-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамидов
Установлено, что в результате трехкомпонентной реакции с участием N,N-диметил(диэтил)амидов ацетилуксусной кислоты, ароматических альдегидов, 5-аминотетразола образуются 7-арил-N,N-диметил(диэтил)-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамиды (VI а,б, VII а-р).
Схема 7
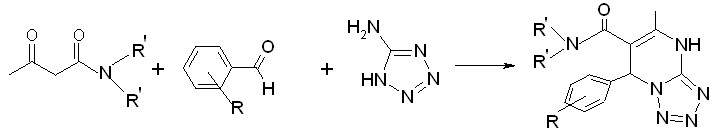
VI а,б
VII а-р
VI: R’=CH3 , R=H (а) (21 %), 3-NO2 (б) (30 %)
VII: R’=C2H5, R= H (а), 4-Cl (б), 3-F (в), 4-C2H5 (г), 4-CH(CH3)2 (д), 4-COOCH3 (е), 4-CH3 (ж), 4-F (з), 3-CH3O (и), RC6H4=3-пиридил (к), 4-CH3O (л), 4-NO2 (м), 4-Br (н), 3-NO2 (о), 2-CH3O (п), 2-NO2 (р) (40-71 %)
В спектрах ЯМР 1Н соединений (VI а,б) и (VII а-р) кроме сигналов ароматических протонов наблюдается синглет протонов группы СН3 в области 1.75-1.92 м.д., синглет протона группы СН в области 6.26-6.66 м.д., синглет протона группы NH в области 10.30-10.68 м.д. В спектрах соединений (VI а, б) проявляются сигналы протонов групп (СН3)2NСО в виде синглета в области 2.70 м.д., в спектрах соединений (VII а-р) - мультиплеты протонов групп (СН3СН2)2NСО в области 0.75-0.91 м.д. и (СН3СН2)2NСО в области 3.03-3.15 м.д.
В масс-спектре соединения (VI б) присутствуют пики фрагментных ионов с m/z: 301 [М-СO]+, 260 [М-СON(Me)2]+, 285 [М-N(Me)2]+, 77 [Ph]+, что подтверждает данную структуру.
Данные масс-спектра соединения (VII а) соответствуют структуре соединения, о чем свидетельствуют молекулярный ион с m/z (Iотн, %) 312 [M]+ (6.52), а также пики фрагментных ионов 72 [(CH3CH2)2N]+ (100.00), 212 [М-(CH3CH2)2NCO]+ (45.65), 284 [М-CO]+ (6.52), что соответствует предполагаемой структуре.
2.7 Синтез N,7-диарил-5-метил-4,7-дигидро-1,2,4-триазоло[1,2-а]пиримидин-6-карбоксамидов
Ближайшим структурным аналогом 5-аминотетразола и изостером мочевины является 3-амино-1,2,4-триазол.
Нами было показано, что сплавление при 120-150°С N-ариламидов ацетоуксусной кислоты со смесью ароматического альдегида и 3-амино-1,2,4-триазола в течение 5-10 мин приводит к образованию N,7-диарил-5-метил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидин-6-карбоксамидов (VIII а-н). В отличие от 5-аминотетразола, 3-амино-1,2,4-триазол имеет два неравноценных атома азота в положении 2 и 4 гетероцикла, что позволяет рассматривать два наиболее вероятностных продукта реакции. Однако, более основный и нуклеофильный характер атома азота в положении 2 гетероцикла, по-видимому, обуславливает протекание реакции в направлении преимущественно образования структуры А.
Схема 8

VIII а-н (62-86 %)
VIII: R=H, R1=3-NO2 (а), 2-CH3O (б); R=2-CH3, R1=HO (в), 3-NO2 (г), R=2,4-(CH3)2 R1= 2-CH3O (д), 4-NO2 (е), 3-NO2 (ж), 4-C(CH3)3 (з), 4-C2H5O (и), 4-HO (к), R= 4-Cl R1=2-CH3O (л), 3-NO2 (м), H (н)
Спектры ЯМР 1Н синтезированных соединений VIII а-н аналогичны спектрам соединений V а-я. В отличие от последних в них присутствует сигнал СН в положении 2 при 7.50 м.д.
В масс-спектре соединения (VIII и) присутствуют пики фрагментных ионов m/z (Iотн, %): 135 [М-(СН3)2С6Н3NHCO-С2Н5OC6H4]+ (100.00), 121 [(СН3)2С6Н3NH]+ (3.68), 77 [Ph]+ (7.35), 256 [М-(СН3)2С6Н3NHCO]+ (30.15), подтверждающие данную структуру.
2.8 Синтез 2-амино-7-арил-5-метил-N-2-метилфенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидин-6-карбоксамидов
Введение второй аминогруппы в молекулу 3-амино-1,2,4-триазола повышает нуклеофильность данного реагента и исключает возможность образования изомерных продуктов. Это подтверждается проведением реакции 2-метилацетоацетанилида с ароматическим альдегидом и 3,5-диамино-1,2,4-триазолом в отсутствии растворителя при температуре 150-170°С в течение 5-7 мин, приводящей к образованию 2-амино-7-арил-5-метил-N-2-метилфенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидин-6-карбоксамидов (IX а,б).
Схема 9
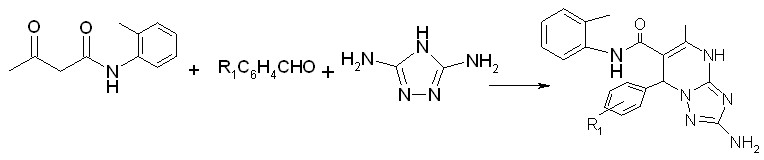
IX а,б
R1=H (а), 3-NO2 (б)
Соединения (IX а,б) представляют собой бесцветные кристаллические вещества, растворимые в ДМФА, ДМСО, нерастворимые в воде, бензоле, толуоле.
В спектрах ЯМР 1Н полученных соединений проявляются помимо сигналов ароматических протонов и связанных с ароматическим кольцом групп, синглет протонов CH3 группы в области 1.73 - 1.90 м.д., два синглета групп NH в области 8.90 - 9.11 м.д. и 9.65 - 9.93 м.д., протоны группы NH2 прописываются в области 7.53 - 7.57 м.д. совместно с ароматическими протонами, о чем свидетельствует интегральная интенсивность.
В масс-спектре соединения (IX а) наблюдаются пики фрагментных ионов с m/z (Iотн, %): 150 [М-СН3С6Н4NHCO-Ph]+ (100.00), 77 [Ph]+ (9.56), 212 [М-СН3С6Н4NHCO-NH2]+ (3.68), 227 [М-СН3С6Н4NHCO]+, подтверждающие образование данной структуры.
2.9 Синтез 4-арил-2-метил-N-2,4-диметилфенил-бензимидазоло[1,2-а]-1,4-дигидропиримидино-3-карбоксамидов
С целью получения конденсированных бензогетероциклических систем нами была изучена трехкомпонентная реакция 2,4-диметилацетоацетанилида с ароматическим альдегидом и 2-аминобензимидазолом.
Мы установили, что сплавление эквимолярных количеств указанных реагентов при 130-150°С в отсутствие растворителя в течение 8-10 мин приводит к образованию 4-арил-2-метил-N-2,4-диметилфенил-бензимидазоло[1,2-а]-1,4-дигидропиримидино-3-карбоксамидов (X а,б).
Схема 10

X а,б
R1 = H (а) (78%), 3-NO2 (б) (82%)
В масс-спектре соединения (X а) присутствуют пики фрагментных ионов с m/z (Iотн, %): 261 [М-(CH3)2C6H3NHCO] (37.23), 184 [М-(CH3)2C6H3NHCO-Ph] (100.00), 77 [Ph] (8.03), подтверждающие данную структуру.
2.10 Синтез подандов функционализированных фрагментами
4,7-дигидротетразоло[1,5-а]пиримидина и 2-оксо(тиоксо)-1,2,3,6-тетрагидропиримидина
Нами исследована возможность использования в качестве альдегидного компонента в исследуемой реакции Биджинелли формил-поданда.
Установлено, что сплавление при более высокой температуре 170-180°С 2-метилацетоацетанилида, формил-поданда и мочевины (тиомочевины, 5-аминотетразола моногидрата) в мольном соотношении 2:1:2 приводит к образованию подандов функционализированных фрагментами 4,7-дигидротетразоло[1,5-а]пиримидина (XIII) и 2-оксо(тиоксо)-1,2,3,6-тетрагидропиримидина (XI, XII).
Выделенные продукты представляют собой желтоватые кристаллические вещества растворимые в ДМФА, ДМСО, хлороформе, при нагревании в этаноле, ацетонитриле, нерастворимые в воде.
Структура полученных соединений установлена на основании данных ЯМР 1Н спектроскопии.
Схема 11

41%(36%) 64%
Глава 3. Экспериментальная часть
В третьей главе приведены методы синтеза полученных соединений, результаты спектральных методов анализа, указана используемая хроматографическая система для ТСХ, с помощью которой определялась чистота полученных соединений.
Глава 4. Биологическая часть
Синтезированные вещества исследовались на противомикробную активность. Исследования проводились на кафедре микробиологии с курсом гигиены и экологии Пермской государственной фармацевтической академии доцентом, к.х.н. Ворониной Э.В. под руководством зав. кафедрой проф., д.ф.н. Одеговой Т.Ф.
4.1 Противомикробная активность
Противомикробная активность была исследована у 53 соединений. Для всех исследуемых соединений были определены МПК в отношении фармакопейных штаммов: Гр + S. аureus АТСС 6538 – Р, Гр – E. Coli ATCC 25922.
Бактериостатический эффект исследуемых соединений сравнивали с действием диоксидина и хлорамина Б, чьи установленные значения МПК находятся в пределах 62,5-1000 мкг/мл в отношении указанных штаммов. Все испытанные соединения показали наличие антимикробной активности.
Анализ результатов исследований показал, что из соединений ряда N,6-диарил-4-метил-2-оксо-1,2,3,6-тетрагидропиримидин-5-карбоксамидов наибольшую активность проявили соединения I к, I н, I т, I у, минимальная подавляющая концентрация (МПК) которых составила 500 мкг/мл в отношении St.aureus и E.coli. Установлено, что наличие в молекуле остатков 2,4-диметилацетоацетанилида и о-ацетоацетанизида увеличивает антибактериальную активность.
N,6-диарил-4-метил-2-тиоксо-1,2,3,6-тетрагидропиримидин-5-карбоксамиды также показали наличие антимикробной активности. Наибольшую активность проявили соединения II г, II л, II ф. Их МПК составила 500 мкг/мл в отношении обоих штаммов.
Среди исследуемых соединений ряда N,7-диарил-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамидов соединение V о показало наибольшую противомикробную активность, его МПК составила 250 мкг/мл в отношении St.aureus и E.coli.
В ряду 7-арил-N,N-диэтил-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамидов выявлены вещества, проявляющие антимикробное действие только в отношении St.aureus (VII б, VII в, VII е, VII з, VII н). Их МПК составила 500 мкг/мл.
При введении в качестве альдегидного компонента формил-поданда наблюдается увеличение противомикробной активности в отношении обоих штаммов. В присутствие циклической системы тетразоло[1,5-а]пиримидина наблюдается увеличение активности в 4 раза по отношению к кишечной палочке.
В результате проведенных исследований найдены соединения, обладающие противомикробной активностью близкой к эффектам эталонных растворов (диоксидин, хлорамин Б), что свидетельствует о перспективности поиска среди синтезированного ряда соединений веществ с выраженной противомикробной активностью.
ВЫВОДЫ
- Впервые изучено взаимодействие N-ариламидов ацетилуксусной кислоты с ароматическими альдегидами и мочевиной, приводящее к образованию N,6-диарил-4-метил-2-оксо-1,2,3,6-тетрагидропиримидин-5-карбоксамидов.
- Обнаружено, что трехкомпонентная реакция N-ариламидов ацетилуксусной кислоты с ароматическими альдегидами и тиомочевиной, протекает легче и с высокими выходами, чем в случае использования эфиров ацетилуксусной кислоты, с образованием N,6-диарил-4-метил-2-тиоксо-1,2,3,6-тетрагидропиримидин-5-карбоксамидов, аналогичным образом протекает реакция с фенилтиомочевиной.
- Показано, что N,N-диэтил-4-метил-2-оксо(тиоксо)-6-фенил-1,2,3,6-тетрагидропиримидин-5-карбоксамиды образуются в результате взаимодействия N,N-диэтиламида ацетилуксусной кислоты, бензальдегида и мочевины (тиомочевины).
- Установлено, что в исследуемой реакции Биджинелли в качестве изостеров мочевины могут выступать аминоазолы, так трехкомпонентная реакция ацетоацетанилидов со смесью ароматического альдегида и 5-аминотетразола моногидрата протекает с образованием N,7-диарил-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамидов.
- При использовании в качестве аминогетероцикла в аналогичных реакциях 3-амино-1,2,4-триазола и 3,5-диамино-1,2,4-триазола образуются N,7-диарил-5-метил-4,7-дигидро-1,2,4-триазоло[1,2-а]пиримидин-6-карбоксамиды и 2-амино-7-арил-5-метил-N-2-метилфенил-4,7-дигидро-1,2,4-триазоло[1,5-а]пиримидин-6-карбоксамиды; использование 2-аминобензимидазола приводит к образованию гетероциклической системы бензимидазоло-1,4-дигидропиримидина.
- Установлено, что участие в исследуемой реакции Биджинелли формил-поданда в качестве альдегидного компонента приводит к образованию подандов функционализированных фрагментами 4,7-дигидротетразоло[1,5-а]пиримидина и 2-оксо(тиоксо)-1,2,3,6-тетрагидропиримидина.
- В результате исследований противомикробной активности 53-х соединений обнаружены вещества с противомикробной активностью, сравнимой с хлорамином Б и диоксидином.
Основное содержание диссертации опубликовано в следующих работах:
1. Синтез N,N-диметил(диэтил)-7-арил-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамидов / В.Л. Гейн, Т.М. Замараева, А.А. Зорина [и др.] // Журн. органич. химии. - 2009. - Т.45, вып. 6. - С. 954 – 955.
2. Синтез N,6-диарил-4-метил-2-тиоксо-1,2,3,6-тетрагидропиримидин-5-карбоксамидов / В.Л. Гейн, Т.М. Замараева, А.А. Зорина [и др.] // Журн. органич. химии. - 2009. - Т.45, вып. 10. - С. 1591 – 1592.
3. Синтез и противомикробная активность N,7-диарил-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамидов / В.Л. Гейн, Т.М. Замараева, А.А. Курбатова [и др.] // Хим.-фарм. журн. -2010. – Т. 44, № 7. – С. 27 - 29.
4. Трёхкомпонентный синтез N,6-диарил-4-метил-2-оксо-1,2,3,6-тетрагидропиримидин-5-карбоксамидов / В.Л. Гейн, Т.М. Замараева, А.А. Курбатова [и др.] // Химия гетероцикл. соединений. – 2010. – № 7. – С. 1058 – 1061.
5. Замараева, Т.М. Синтез N,6-диарил-2-оксо-4-метил-1,2,3,6-тетрагидропиримидин-5-карбоксамидов / Т.М. Замараева, В.Л. Гейн // Вестник Пермской государственной фармацевтической академии: науч. - практ. журн. - Пермь, 2009. – № 5. – С. 92-93.
6. Замараева, Т.М. Синтез 2-метоксифенил-7-арил-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамидов / Т.М. Замараева, О.В. Белая, В.Л. Гейн // Вестник Пермской государственной фармацевтической академии: науч.-практ. журн. - Пермь, 2009. – № 5. – С. 94-95.
7. Замараева, Т.М. Трёхкомпонентный синтез N,N-диэтил-6-арил-4-метил-2-тиоксо(оксо)-1,2,3,6-тетрагидропиримидин-5-карбоксамидов / Т.М. Замараева, В.Л. Гейн // Вестник Пермской государственной фармацевтической академии: науч.-практ. журн. - Пермь, 2010. – № 6. – С. 82 - 83.
8. Синтез N,N-диэтил-7-арил-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамидов / Т.М. Ковина, А.А. Зорина, Е.Б. Левандовская [и др.] // Синтез новых биологически активных соединений: материалы Рос. науч.-практ. конф., посвящ. 70-летию ПГФА. – Пермь, 2007. – С. 51-53.
9. Синтез и противомикробная активность N-замещенных-7-арил-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамидов / В.Л. Гейн, Т.М. Ковина, А.А. Зорина [и др.] // Материалы конф. «Фармация и общественное здоровье» - Екатеринбург, 2008. – С. 67 - 68.
10. Синтез и противомикробная активность 2,4-диметил(4-хлор)фенил-7-арил-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамидов / Т.М. Замараева, А.А. Зорина, В.Л. Гейн // Современное состояние и пути оптимизации лекарственного обеспечения населения: материалы Рос. науч.-практ. конф. ПГФА, проводимой в рамках 14-ой междунар. выставки «Медицина и здоровье». - Пермь, 2008. – С. 253 - 255.
11. Синтез N-фенил(2-метилфенил)-7-арил-5-метил-4,7-дигидротетразоло[1,5-а]пиримидин-6-карбоксамидов / В.Л. Гейн, Т.М. Замараева, А.А. Зорина [и др.] // Фармация из века в век: труды науч.-практ. конф. – СПб., 2008. – С. 65-66.
12. Синтез N,6-диарил-2-оксо-4-метил-1,2,3,6-тетрагидропиримидин-5-карбоксамидов / Т.М. Замараева, А.А. Зорина, В.Л. Гейн [и др.] // Фармация и общественное здоровье: материалы ежегод. конф. – Екатеринбург, 2009. – С. 101- 102.
13. Синтез N,7-диарил-5-метил-4,7-дигидротриазоло[1,5-а]пиримидин-6-карбоксамидов / В.Л. Гейн, Т.М. Замараева, А.А. Курбатова [и др.] // Химия поликарбонильных соединений: материалы регион. науч.-практ. молодеж. шк.-конф. – Пермь, 2009. – С. 26.
14. Получение производных пиримидинотетразолов / В.Л. Гейн, Т.М. Замараева, А.А. Курбатова [и др.] // Современные проблемы науки и образования : материалы 69-й ежегод. конф. студен. науч. о-ва Кубан. гос. мед. ун-та. – 2008. – С. 54-56.
15. Замараева, Т.М. Модификация классического синтеза Биджинелли // Молодежная наука Прикамья-2010 : сб. материалов конф. – Пермь, 2010.

