Синтез полиядерных соединений на основе нитрования производных перимидина
На правах рукописи
ЧЕРЕДНИЧЕНКО Татьяна Сергеевна
Синтез полиядерных соединений на основе нитрования производных перимидина
02.00.03 – органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Астрахань - 2011
Работа выполнена в Ставропольском государственном университете
| Научный руководитель: | доктор химических наук, профессор Аксенов Александр Викторович | |
| Официальные оппоненты: | доктор химических наук, профессор Великородов Анатолий Валериевич кандидат химических наук, с.н.с. Лукьянов Борис Сергеевич | |
| Ведущая организация: | Южно-Российский государственный технический университет (НПИ) |
Защита диссертационной работы состоится «14» октября 2011 года в 1400 часов на заседании объединенного диссертационного совета по защите докторских и кандидатских диссертаций ДМ 307.001.04. при Астраханском государственном техническом университете (АГТУ) по адресу: 414025, г. Астрахань, ул. Татищева, 16, АГТУ, 2-ой учебный корпус, ауд. 201
С диссертацией можно ознакомиться в библиотеке АГТУ (ул. Татищева, 16, АГТУ, главный учебный корпус).
Автореферат разослан « » сентября 2011 г.
Ученый секретарь
диссертационного совета,
кандидат химических наук, доцент Шинкарь Е. В.
Общая характеристика работы
Актуальность проблемы. пери-Аннелированные полиядерные ароматические и гетероароматические соединения обладают рядом полезных свойств. Их производными являются многие органические люминофоры, красители, найдены эффективные лекарственные препараты. В последнее время возрос интерес к подобным структурам, в первую очередь как люминесцентным интеркаляторам, а также в связи с конструированием, так называемых, «молекулярных машин».
Несмотря на многообразие возможных структур азапиренов и других пери-аннелированных гетероциклов, в настоящее время синтезированы лишь некоторые представители, как правило, не содержащие функциональных групп. Это связано, в первую очередь, с отсутствием удобных методов пери-аннелирования гетероциклических ядер к феналенам и азафеналенам.
В нашей лаборатории накоплен большой опыт в разработке методов пери-аннелерования. Так, например, ряд таких методов был создан на основе ацилирования перимидинов найденной нами системой реагентов 1,3,5-триазины/ПФК. Эти исследования позволили разработать простые, одностадийные методы пери-аннелирования различных циклов к феналенам и азафеналенам, которые, как показали последующие исследования носят общий характер. Были разработаны методы пери-аннелирования карбоциклического, [c,d]пиридинового и пиридазинового ядра. В последнем случае найденные методы, как выяснилось, не носят общего характера. Ряд методов пери-аннелирования был создан на основе электрофильного аминирования аренов азидом натрия в ПФК. Недостатками этих методов является токсичность азидоводородной кислоты и неудобство работы с большими количествами ПФК. Кроме того, имеющиеся методы не позволяют аннелировать все варианты пяти-, шести- и семичленных гетероциклов.
Эти обстоятельства послужили толчком для дальнейшего развития методологии пери-аннелирования. Так, очевидно, что оптимизация методов нитрования перимидинов и поиски таковых для альдегидов и кетонов перимидинового ряда, позволит ввести в пери-положение нафталиновой системы атом азота. Это открывает перспективы для создания ранее неизвестных методов пери-аннелирования, о которых говорилось выше.
Работа выполнена в рамках федеральной целевой программы "Научные и научно-педагогические кадры инновационной России" на 2009 - 2013 годы" (грант № 2010-1.2.1-102-020-013) и при поддержке Российского Фонда Фундаментальных Исследований (гранты № 10-03-00193а).
Цель работы: оптимизация условий нитрования производных перимидина и разработка на его основе новых методов пери-аннелирования пяти- и шестичленных циклов, содержащих атомы азота, связанные с пери-положением нафталинового фрагмента.
Научная новизна и практическая значимость.
Установлено, что нитрование перимидинов, а также перимидинов, содержащих в пери-положении карбонильную группу нитритом натрия в муравьиной кислоте приводит к смеси продуктов нитрования по положению 6(7) и 4(9)- с преобладанием первых. Выяснено, что при использовании азотной кислоты (d=1.4) в уксусной в присутствии мочевины нитрование перимидинов осуществляется, в основном, в положение 4(9). Разработаны методы синтеза 6(7)- и 4(9)- нитроперимидинов, в том числе содержащих карбонильную и ацетаминогруппу в положении 6(7).
Разработан метод динитрования перимидинов, основанный на их последовательном взаимодействии с нитритом натрия и азотной кислотой в муравьиной кислоте. Показано, что в этом случае образуется смесь 6,7- и 6,9-динитроперимидинов. Основываясь на нем, разработаны методы пери-аннелирования различных азотсодержащих пяти- и шестичленных циклов.
Так восстановлением 6,9-динитроперимидинов в щелочной среде были получены 1,2,5,7-тетраазациклопента[c,d]феналены. Восстановление 6,7-динитропроизводных цинковой пылью в муравьиной кислоте и последующее кипячение реакционной смеси или обработка реакционной смеси уксусным ангидридом (хлористым бензоилом) приводит к 1,3,6,8-тетраазапиренам. Обработка после восстановления нитритом натрия приводит к неизвестным ранее 1,2,3,6,8-пентаазапиренам.
Показано, что восстановление нитроперимидинов цинковой пылью в кислой среде приводит к соответствующим аминам, тогда как при наличие в соседних пери-положениях нитро- и карбонильной групп образуются 1H-1,5,7-триазациклопента[c,d]феналены.
Выяснено, что нагревание 6-ацетил(бензоил)-7- нитроперимидинов с раствором щелочи приводит к 1-окса-5,7-диазациклопента [c,d]феналенам. С гидразин-гидратом образуются 1,2,6,8-тетраазапирены.
Разработан метод синтеза неизвестных ранее 1,3,6-триазапиренов, основанный на реакции 6(7)-аминоперимидинов с 1,2-дикарбонильными соединениями или -бромкетонами в кислой среде.
В ходе выполнения работы разработаны методы пери-аннелирования всех возможных гетероколец, содержащих атом азота, связанный с пери-положением перимидина, синтезированы представители двух неизвестных ранее классов гетероциклических соединений.
Апробация работы. Отдельные результаты работы докладывались на Всероссийской научной конференции с международным участием, посвященной всемирному году химии «Успехи синтеза и комплексообразования» (Москва, 2011), Второй Международной научной конференции «Новые направления в химии гетероциклических соединений» (Железноводск, 2011), XIV-й молодежной конференции по органической химии (Екатеринбург, 2011), 54-56 научных конференциях преподавателей и студентов Ставропольского государственного университета, 2009-2011 г.г.
Публикации[1] . Основное содержание работы опубликовано в 3 статьях перечня ВАК и 5 статьях в сборниках и тезисах докладов конференций.
Достоверность полученных результатов. Строение полученных соединений подтверждено с помощью 1H, 13С ЯМР (в том числе COSY и HMQC) и ИК-спектроскопии, данными элементного анализа, в ряде случаев встречным синтезом.
Структура и объем диссертации. Диссертация состоит из введения, трех глав, выводов и списка литературы. Работа изложена на 152 странице, иллюстрирована 105 схемами, 24 таблицами и 11 рисунками. Библиография содержит 157 литературных ссылок.
В первой главе (литературный обзор) рассмотрены данные по реакциям пери-аннелирования пяти- и шестичленных циклов. Вторая глава – обсуждение полученных результатов, третья – экспериментальная часть.
Основное содержание работы
1. Нитрование перимидинов и кетонов перимидинового ряда
Ранее сообщался метод синтеза 6(7)-нитроперимидинов основанный на нитровании перимидина (1a) и 2-метилперимидина (1b) азотной кислотой (d=1.5) в уксусной кислоте (i=НNO3/AcOH). Недостатком метода является невысокий выход 6(7)-нитроперимидинов (2) 9% в случае 2a и 46% в случае 2b. Выход 4(9)-нитроперимидинов (3) составил соответственно 23 и 18%. Восстановлением 2-метил-6(7)-нитроперимидина гидразином на никеле Ренея был получен 6(7)-амино-2-метилперимидин. Тем не менее, перимидины, содержащие в пери-положении аминогруппу, оставались малодоступными соединениями. Это обстоятельство сдерживало создание методов пери-аннелирования к перимидинам циклов, содержащих атом азота, связанный с пери-положением перимидина.
В нашей лаборатории был разработан метод прямого электрофильного аминирования перимидинов 1a-c азидом натрия в ПФК. Недостатком этого метода является неудобство работы с большими количествами ПФК и токсичность азидоводородной кислоты.
Поэтому мы решили оптимизировать реакцию нитрования перимидинов.
Более эффективным из описанных в литературе методов нитрования перимидинов, является метод, основанный на использовании нитрита натрия в уксусной кислоте. В этом случае выход 2a составляет 33%, 3a – 26%, 2b – 40% 3b – 23% (i=NaNO2/AcOH).

1-3a: R=H; b: R=Me; c: R=Ph;
То обстоятельство, что замена в случае перимидина (1a) азотной кислоты на нитрит натрия снижает выход 4(9)-нитропроизводного 3a и увеличивает выход 6(7)-нитропроизводного 2a позволило нам предположить, что образование 4(9)-изомера 3 связано с образованием комплекса с участием атома азота.
Это подтверждается тем, что замена 98%-ной азотной кислоты на 63%-ную, которая содержит меньшее количество оксидов азота, приводит к увеличению выхода соединений 3a-c до 56-62%.
Замена, которая уменьшает вероятность образования комплекса по атому азота, азотной кислоты на нитрат аммония приводит к увеличению выхода 6(7)-нитропроизводного 2.
Так же препятствовать образованию комплексов может использование в качестве растворителя более сильной кислоты. Действительно замена уксусной кислоты на муравьиную в случае нитрата аммония (i=NН4NO3/HCOOH) приводит к увеличению выхода 6(7)- нитропроизводных 2a-с до 42-51%.
Но наиболее эффективной системой для синтеза этих нитропроизводных оказалось использование нитрита натрия в муравьиной кислоте (i=NaNO2/HCOOH). Выход 6(7)-нитропроизводных составил 64% (2a), 62% (2b), 58% (2c). Выход 4(9)-нитропроизводных составил 23% (3a), 25% (3b), 21% (3c).
Если ряд нитроперимидинов 2 и 3 до начала наших работ был известен, то нитропроизводные альдегидов и кетонов перимидинового ряда 5-7 описаны не были. Поэтому мы решили перенести полученную методологию нитрования перимидинов 1 на нитрование карбонильных соединений 4a-i. Оказалось, что нитрование этих веществ нитратом аммония в муравьиной кислоте приводит к образованию смеси нитропроизводных 5, 6 и 7 практически в равных количествах:

4-7a: R= R1 = H; b: R = Me, R1 = H; c: R = Ph, R1 = H; d: R = H, R1 = Me;
e: R = R1 = Me; f: R = Ph, R' = Me; g: R = H, R1 = Ph; h: R = Me, R1 = Ph;
i: R = R1 = Ph;
Соединения 5a-i можно легко очистить от о-изомеров 6a-i и 7a-i экстракцией хлороформом. При этом последние переходят в хлороформный раствор, 6(7)-нитропроизводные 5a-i остаются в водной муравьиной кислоте. Соединения 6a-i и 7a-i в ряде случаев удалось разделить, обработав смесь после отгонки хлороформа, ацетоном. При этом в осадке остаются нитропроизводные 7.
Более эффективным для синтеза 6(7)-нитропроизводных 5a-i, как и в случае перимидинов, оказалось использование нитрита натрия в муравьиной кислоте (i=NaNO2/HCOOH). Реакция, как и с нитратом аммония, протекает в течение 5 мин при комнатной температуре. Выход искомых веществ составляет 46-72%. От побочных веществ легко можно отделиться экстракцией хлороформом.
Динитрование перимидинов 1a-c, используя нитрита натрия в муравьиной кислоте осуществить, не удается. Поэтому мы реализовали двухстадийный one pot процесс. Сначала перимидины 1a-c пускали в реакцию с нитритом натрия в муравьиной кислоте, а через 5 мин добавляли 63%-ную азотную кислоту и реакционную смесь нагревали до кипения. По охлаждению разделяли хлороформом смесь 6,7-динитропроизводных 8 и 6,9-динитропроизводных 9:
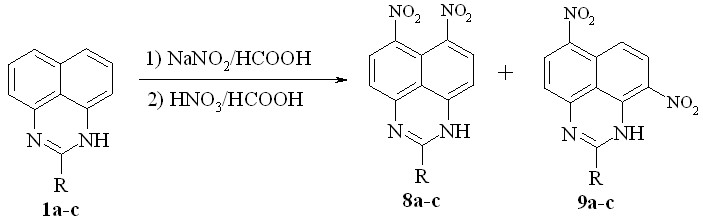
1,8,9a: R=H; b: R=Me; c: R=Ph;
Изомеры образуются приблизительно в равных количествах. Выход составил: 29% (8a), 34% (9a), 25% (8b), 39% (9b), 32% (8c), 35% (9c).
Таким образом, нам удалось разработать эффективные методы моно и динитрования перимидинов и мононитрования альдегидов и кетонов перимидинового ряда.
2. Синтез аминоперимидинов и пери-аннелирование пиррольного кольца
В процессах пери-аннелирования важную роль играют амины. Поэтому в следующей части работы мы разработали методы восстановления полученных в предыдущем разделе нитросоединений.
Так как реакция нитрования осуществляется в кислой среде, то наиболее подходящими для восстановления являются металлы. В качестве такого восстановителя мы использовали цинковую пыль.
Оказалось, реакция перимидинов 1a-c с нитритом натрия в муравьиной кислоте и далее с цинковой пылью приводит к смеси 6(7)- и 4(9)-аминоперимидинов:

1,10,11a: R=H; b: R=Me; c: R=Ph;
Эту смесь удалось разделить с помощью тонкослойной хроматографии. Выход составил 21% (11a), 69% (10a). Оказалось более удобным после нитрования разделить смесь изомерных нитросоединений экстракцией соединений 3a-c из водного раствора муравьиной кислоты. Оставшиеся в растворе нитросоединения 2a-c, не выделяя можно восстановить в соответствующие амины, а орто-изомер после отгонки хлороформа можно восстановить гидразином на никеле Ренея, как это было описано в литературе для синтеза 2-метил-4(9)-аминоперимидина. Выход в этом случае существенно не меняется.
Аналогичным образом можно получить 6,7-диаминоперимидины 12a-c. Для этого, как отмечалось выше, перимидины 1a,b последовательно вводят в реакцию с нитритом натрия в муравьиной кислоте, азотной кислотой, после чего из реакционной смеси хлороформом экстрагируют нитропроизводные 9a,b, затем реакционную смесь восстанавливают цинковой пылью.

1,8,9,12a: R=H; b: R=Me;
Выход составил: 32% (12a), 36% (12b).
Трудно переоценить значение производных индола среди биологически активных веществ. Не являются исключением и бенз[cd]индолы, структурная аналогия которых с алкалоидами индольного ряда и пирролохинолинами делает их перспективными для поиска соединений, обладающих противоопухолевой активностью. Среди таких соединений найдены эффективные ингибиторы тимидилат синтезы, например AG 331.

Glucuronate (AG 331)
Поэтому мы изучили восстановление нитропроизводных 5a-i. Оказалось, что взаимодействие этих соединений с цинковой пылью в уксусной или муравьиной кислоте приводит с количественным выходом к 1H-1,5,7-триазациклопента[c,d]феналенам (15a-i):

5, 13-15a: R= R1 = H; b: R = Me, R1 = H; c: R = Ph, R1 = H; d: R = H, R1 = Me;
e: R = R1 = Me; f: R = Ph, R' = Me; g: R = H, R1 = Ph; h: R = Me, R1 = Ph;
i: R = R1 = Ph;
Вероятно, образующиеся в ходе восстановления амины 13a-i в результате нуклеофильной атаки аминогруппы на карбонильную образуют промежуточные соединения 14a-i, которые, теряя молекулу воды, образуют индолы 15a-i.
Реакцию можно осуществить как one pot превращение. Для чего карбонильные соединения 4a-i сначала нитруют нитритом натрия в муравьиной кислоте, затем к реакционной смеси добавляют цинковую пыль и перемешивают 1 ч.

4, 15a: R= R1 = H; b: R = Me, R1 = H; c: R = Ph, R1 = H; d: R = H, R1 = Me;
e: R = R1 = Me; f: R = Ph, R' = Me; g: R = H, R1 = Ph; h: R = Me, R1 = Ph;
i: R = R1 = Ph;
Выход составил 45-71%.
В случае индолов 15a-i достаточно легко отделиться от побочных продуктов, но не менее удобным оказалось разделение смеси изомерных нитросоединений после нитрования экстракцией смеси соединений 6a-i и 7a-i из водного раствора муравьиной кислоты. Оставшиеся в растворе нитросоединения 5a-i, не выделяя, можно превратить в соответствующие индолы 15a-i. Выход в расчете на исходный кетон 4a-i существенно не меняется.
Таким образом, на основе реакции нитрования перимидинов был разработан метод синтеза аминов перимидинового ряда, альдегидов и кетонов перимидинового ряда - 1H-1,5,7-триазациклопента[c,d]феналенов.
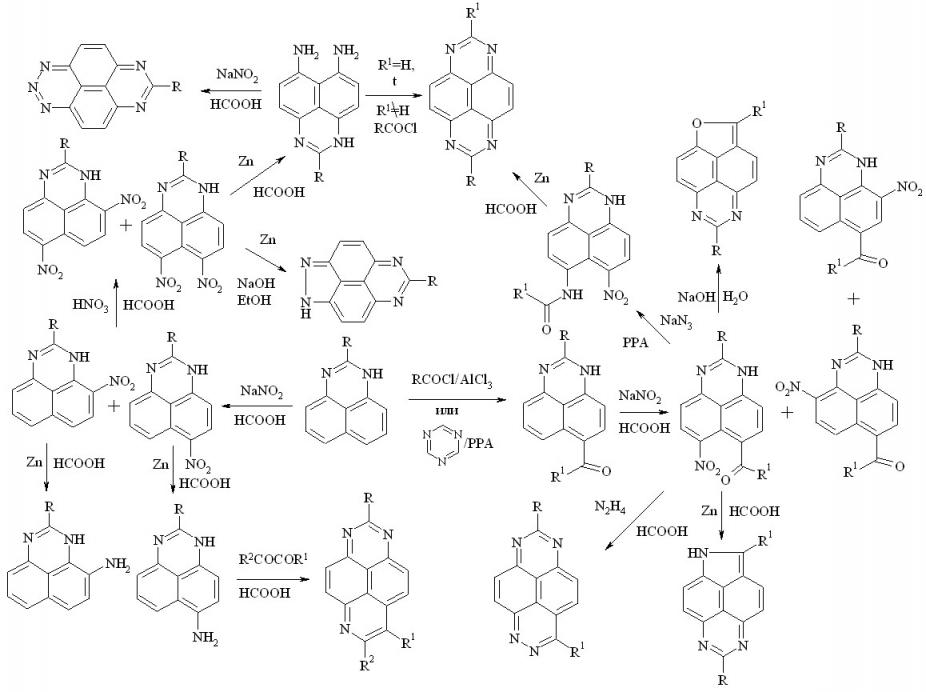
3. Синтез 1,3,6,8-тетра- и 1,2,3,6,8-пентаазапиренов
Ранее, были разработаны методы синтеза 1,3,6,8-тетраазапирена (16a), основанный на реакции 1,4,5,8-тетрааминонафталина с муравьиной кислотой и 2,7-диметил-1,3,6,8-тетраазапирена (16b), основанный на реакции 2-метил-6,7-диаминоперимидина (12b) с уксусным ангидридом, реакции Шмидта кетонов 4d-i. Методы включают или использование малодоступных исходных соединений, или не являются универсальными, или не позволяют нарабатывать большие количества тетраазапиренов. Поэтому мы решили разработать способ получения таких соединений, исходя из перимидинов 1a-c.
Как было показано выше, перимидины 1a-c легко могут быть превращены в 6,7-динитропроизводные 8a-c, которые легко можно отделить от изомерных нитросоединений экстракцией хлороформом. Основываясь на этом, мы разработали one pot метод синтеза 1,3,6,8- тетраазапиренов 16a-f. Как обсуждалось выше, перимидины 1a-с последовательно вводят в реакцию с нитритом натрия в муравьиной кислоте, азотной кислотой, затем из реакционной смеси хлороформом экстрагируют нитропроизводные 9a-с, после чего реакционную смесь кипятят цинковой пылью в течение 5 ч:
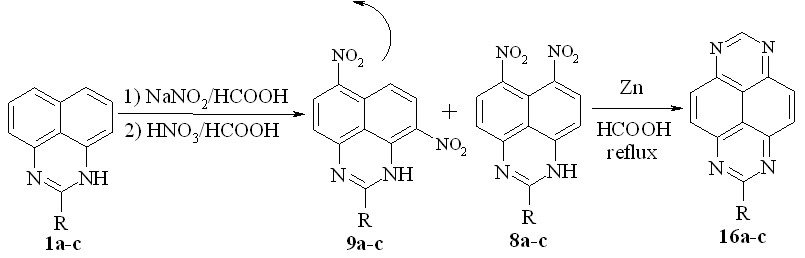
1,8,9,16a: R = H; b: R = Me; c: R = Ph;
B этом случае образуются тетраазапирены без заместителя в положении 7. Выход: 31-34%. Для получения замещенных в это положение тетраазапиренов реакционную смесь не кипятят, а перемешивают с цинковой пылью при комнатной температуре 1 ч, затем добавляют уксусный ангидрид или бензоилхлорид:

1,8,9,12a: R = H; b: R = Me; c: R = Ph; 16-18d: R = R1 = Me; e: R = Me, R1 = Ph;
f: R = R1 = Ph;
В этом случае выход так же близок 30%, что соответствует региоселективности динитрования.
Другой подход к синтезу 1,3,6,8- тетраазапиенов 16a-f основывается на реакции Шмидта нитрокетонов 5d-i. Мы показали, что эти соединения легко вступают в реакцию Шмидта. В качестве реагента используется найденная ранее в нашей лаборатории система: азид натрия в полифосфорной кислоте (ПФК). Выход нитроамидов 19d-i близок количественному.
После обработки реакционной смеси водой соединения 19d-i можно восстановить цинковой пылью в фосфорной кислоте с образованием интермедиатов 17d-i, которые спонтанно циклизуются в 18d-f. В результате окисления последних, вероятно, кислородом воздуха образуются тетраазапирены 16a-f.

5,17,19d: R = H, R1 = Me; e: R = R1 = Me; f: R = Ph, R' = Me; g: R = H, R1 = Ph;
h: R = Me, R1 = Ph; i: R = R1 = Ph; 16,18 b: R = H, R1 = Me; d: R = R1 = Me;
e: R = Me, R1 = Ph; f: R = R1 = Ph;
Выход при восстановлении и гетероцикизации близок количественному. Очевидно, что как в предыдущем, так и в этом случае суммарный выход определяется региоселективностью нитрования.
Если среди 1,3,6,8-тетраазапиренов 16 до начала наших работ были известны отдельные представители, то 1,2,3,6,8-пентаазапирены 20a-c не были известны вообще. Поэтому в следующей части работы, основываясь на методологии синтеза соединений 16, мы разработали методы синтеза пентаазапиренов 20a-c.
Для получения пентаазапиренов 20a-c, перимидины 1a-с последовательно вводят в реакцию с нитритом натрия в муравьиной кислоте, азотной кислотой, затем из реакционной смеси хлороформом экстрагируют нитропроизводные 9a-с, после чего реакционную смесь перемешивают с цинковой пылью в течение 1 ч при комнатной температуре и добавляют нитрит натрия:

1,8,9,12,20,21a: R = H; b: R = Me; c: R = Ph;
Окисление дигидропроизводных 21a-c осуществляется или кислородом воздуха, как в случае тераазапиренов 16, или избытком азотистой кислоты. Выход 18-22%, что связано с высокой растворимостью пентаазапиренов 20a-c в воде и не высокой региоселективностью динитрования перимидинов 1a-c в положения 6 и 7.
Таким образом, в этой части работы на примере перимидинов были продемонстрированы два новых подхода к пери-аннелированию пиримидинового ядра к азафеналенам и 1,2,3-триазинового.
4. Синтез 1,2,5,7-тетраазациклопента[c,d]феналенов
Хорошо известно, что нитросоединения при восстановлении в щелочной среде образуют продукты димеризации. Основываясь на этом и методе 6,7-динитрования перимидинов 1a-c, было решено разработать метод пери-аннелирования пятичленного диазакольца.
Оказалось, что последовательное взаимодействие перимидинов 1a-с с нитритом натрия и 63%-ной азотной кислотой в муравьиной кислоте, с последующей экстракцией хлороформом из реакционной смеси нитропроизводных 9a-с, отгонки муравьиной кислоты и последующая реакция динитропроизводных 8a-c с цинковой пылью в спиртовом растворе щелочи приводит к 1,2,5,7-тетраазациклопента[c,d]феналенам с выходом 32-37%, в расчете на исходный перимидин:

1,8,9,22a: R = H; b: R = Me; c: R = Ph;
Таким образом, в результате выполнения этой части работы мы разработали метод синтеза ранее неизвестных 1,2,5,7-тетраазациклопента[c,d] феналенов.
5. Методы пери-аннелирования на основе нуклеофильного замещения нитрогруппы
В литературе известен ряд примеров нуклеофильного замещения нитрогруппы. К таким реакциям относятся: открытый ранее в нашей лаборатории метод синтеза 1,2-диазафеналенов, основанный на взаимодействии нафталинов, содержащих в соседних пери-положениях карбонильную и нитрогруппу с гидразином, а также метод синтеза 1,2,6,8-тетраазапиренов 24, включающий нитрование карбонильных соединений 4 нитритом натрия в ледяной уксусной кислоте и кипячение образующейся смеси нитропроизводных с гидразингидратом в этиленгликоле.
Недостатком последнего метода является низкий выход (около 20%) 1,2,6,8-тетраазапиренов 24 и, как следствие, трудности их выделения. Мы предположили, что метод можно модифицировать, используя приведенный выше метод нитрования альдегидов и кетонов 4a,d,g.
Действительно, нитрование соединений 4a,d,g нитритом натрия в муравьиной кислоте, с последующей экстракцией хлороформом из реакционной смеси нитропроизводных 6a,d,g и 7a,d,g и кипячением после добавления к реакционной смеси гидразин-гидрата в течение 6 ч позволяет получить 1,2,6,8-тетраазапирены 24a-c с выходом 42-63%:
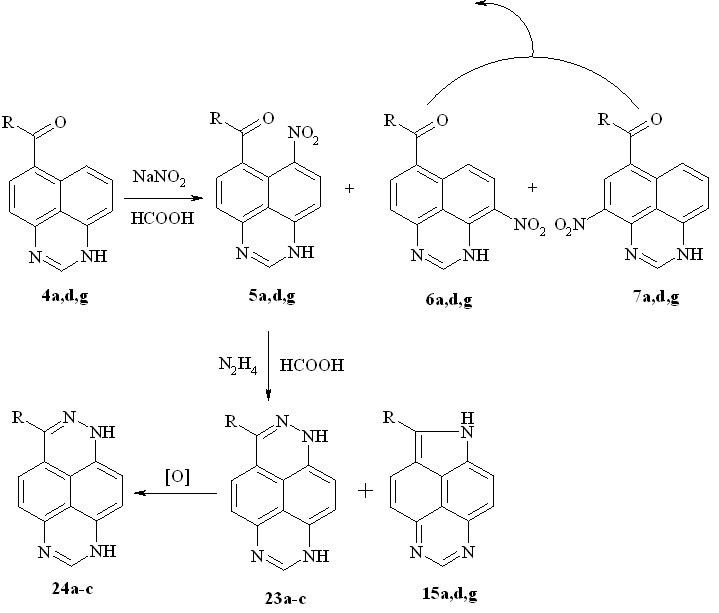
23, 24a: R = H; b: R = Me; c: R = Ph;
В качестве побочного продукта в незначительных количествах (5-7%) образуются индолы 15a,d,g. Это, вероятно, связано с частичным восстановлением нитрогруппы гидразин-гидратом. Промежуточные дигидропроизводные 15a,d,g, вероятно, окисляются кислородом воздуха.
Мы предположили, что замещение нитрогруппы можно осуществить не только с помощью внешнего нуклеофила, но и реализовать внутримолекулярный вариант замещения. Для этого полученный после экстракции хлороформом раствор кетонов 5d-i в водной муравьиной кислоте упаривают, добавляют раствор поташа и кипятят в течение 16 ч. При этом с высоким выходом образуются 1-окса-5,7-диазациклопента[c,d]феналены 27d-i :
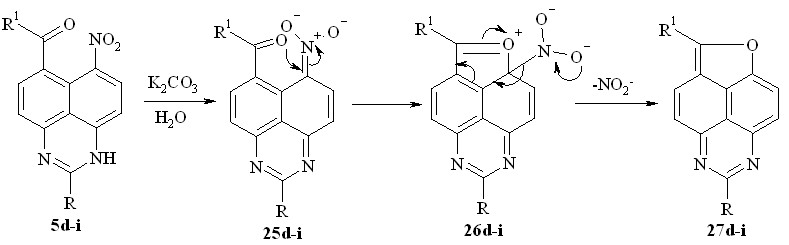
5, 25-d: R = H, R1 = Me; e: R = R1 = Me; f: R = Ph, R' = Me; g: R = H, R1 = Ph;
h: R = Me, R1 = Ph; i: R = R1 = Ph;
Реакция, вероятно, протекает согласно схеме, приведенной выше. На первой стадии в результате отрыва протона от нитросоединений 5d-i образуются соли аци-формы 25d-i. Далее, в результате нуклеофильной атаки атомом кислорода карбонильной группы образуются промежуточные 26d-i, которые, теряя нитрит-ион, превращаются в фураны 27d-i. Выход близок количественному.
Таким образом, в результате выполнения этой части работы, исходя из кетонов перимидинового ряда, были разработаны методы синтеза 1,2,6,8-тетраазапиренов и 1-окса-5,7-диазациклопента[c,d]феналенов.
6. пери-Аннелирование к перимидинам пиридинового цикла
До начала наших работ 1,3,6-триазапирены 30a-f известны не были. Поэтому в последней части нашей работы мы разработали методы синтеза этих соединений.
В качестве исходных соединений использовались 6(7)- аминоперимидины 10a-c. Установлено, что нагревание этих соединений с глиоксалем или фенилглиоксалем в 60%-ной серной кислоте приводит к образованию неизвестных ранее 1,3,6-триазапиренов 30a-f:

28-30a: R = R1 = H; b: R = Me, R1 = H; c: R = Ph, R1 = H; d: R = H, R1 = Ph;
e: R = Me, R1 = Ph; f: R = R1 = Ph;
Вероятно, реакция протекает, как представлено на схеме выше. На первой стадии образуются основания Шиффа по альдегидной группе 28a-f. Далее, в результате внутримолекулярного электрофильного замещения образуются промежуточные 29a-f. Последние, теряя молекулу воды, превращаются в триазапирены 30a-f.
Вместо дикарбонильных соединений можно использовать галогенкетоны, но при этом образуется смесь изомерных триазапиренов:
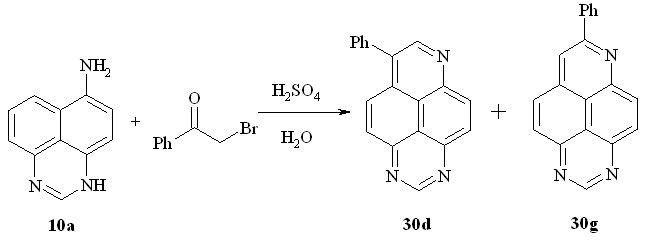
Недостатком методов является относительно низкая стабильность аминов 10a-c. Оказалось, что в качестве исходных соединений можно использовать 6(7)-нитроперимидины 2a-c. При этом их восстановление и гетероциклизацию можно реализовать как one pot процесс. Так, перемешивание при комнатной температуре смеси нитросоединений 2a-c с избытком цинковой пыли в разбавленной серной кислоте в течение 15 мин и далее после добавления дикарбонильного соединения кипячение еще в течение 5 ч приводит к 1,3,6-триазапиренам 30a-f с выходом 37-53%:
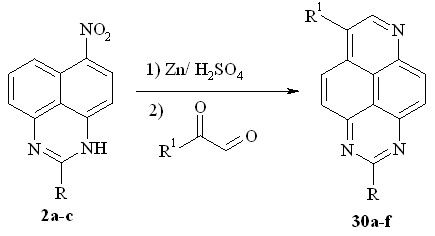
30a: R = R1 = H; b: R = Me, R1 = H; c: R = Ph, R1 = H; d: R = H, R1 = Ph;
e: R = Me, R1 = Ph; f: R = R1 = Ph;
Последний подход, который мы применили для синтеза триазапиренов 30a,b, основан на нитровании перимидинов 1a,b нитритом натрия в муравьиной кислоте, экстракции хлороформом 4(9)-нитроперимидинов 3a,b, последующее без выделения восстановление 6(7)-нитроперимидинов 2a,b и гетероциклизация с глиоксалем в муравьиной кислоте:
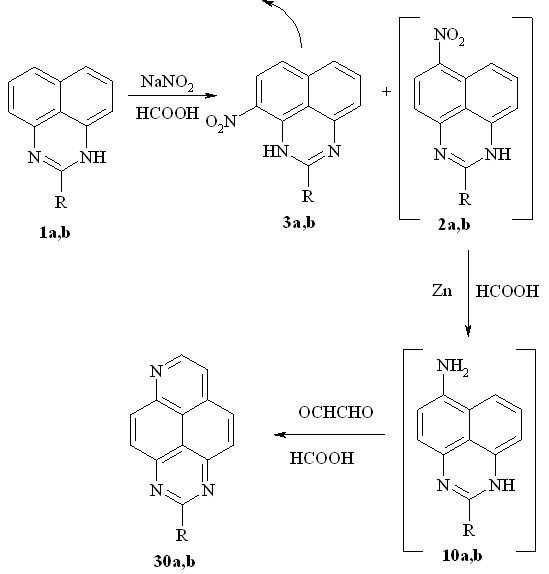
1-3, 10, 30a: R=H; b: R=Me;
В этом случае выход в расчете на исходный перимидин 1a,b составили 23-28%.
Таким образом, в результате выполнения этой части работы были разработаны методы синтеза ранее неизвестных 1,3,6-триазапиренов.
***
В ходе выполнения работы найдены оптимальные условия нитрования перимидинов, их нитро-, формильных, ацетильных- и бензоильных производных.
На основе нитрования перимидина разработаны one pot методы пери-аннелирования различных пяти- и шестичленных азотсодержащих циклов к перимидинам.
Выводы
- Установлено, что нитрование перимидинов, а также перимидинов, содержащих в пери-положении карбонильную группу нитритом натрия в муравьиной кислоте приводит к смеси продуктов нитрования по положению 6(7) и 4(9)- с преобладанием первых, тогда как при использовании азотной кислоты (d=1.4) в уксусной в присутствии мочевины нитрование осуществляется, в основном, в положение 4(9), на основании чего разработаны методы синтеза 6(7)- и 4(9)- нитроперимидинов, в том числе содержащих карбонильную группу в положении 6(7).
- Разработан метод динитрования перимидинов, основанный на их последовательном взаимодействии с нитритом натрия и азотной кислотой в муравьиной кислоте. Показано, что в этом случае образуется смесь 6,7- и 6,9-динитроперимидинов.
- Показано, что восстановление нитро- и динитропроизводных перимидина цинковой пылью в кислой среде приводит к соответствующим аминам, тогда как восстановление перимидинов, содержащих в соседних пери-положениях нитро- и карбонильную группу, приводит к образованию 1H-1,5,7-триазациклопента[c,d]феналенов. 6,7-Динитропроизводные в щелочной среде образуют 1,2,5,7-тетраазациклопента[c,d]феналены.
- Выяснено, что нагревание 6-ацетил(бензоил)-7- нитроперимидинов с раствором щелочи в результате внутримолекулярного нуклеофильного замещения нитрогруппы приводит к 1-окса-5,7-диазациклопента [c,d]феналенам. С гидразин-гидратом образуются 1,2,6,8-тетраазапирены.
- Показано, что восстановление 6,7-динитропроизводных цинковой пылью в муравьиной кислоте и последующее кипячение реакционной смеси или обработка реакционной смеси уксусным ангидридом (хлористым бензоилом) приводит к 1,3,6,8-тетраазапиренам. Обработка после восстановления нитритом натрия приводит к неизвестным ранее 1,2,3,6,8-пентаазапиренам.
- Разработан метод синтеза неизвестных ранее 1,3,6-триазапиренов основанный на реакции 6(7)-аминоперимидинов с 1,2-дикарбонильными соединениями или -бромкетонами в кислой среде.
Основное содержание работы изложено в следующих публикациях:
Статьи:
1. Аксенов А.В., Ляховненко А.С., Перлова (Чередниченко) Т.С., Аксенова И.В. Новый one pot метод синтеза 1H-1,5,7-триазациклопента[c,d]феналенов. // ХГС. – 2010. – № 12. – С. 1906-1908.
2. Аксенов А.В., Ляховненко А.С., Перлова (Чередниченко) Т.С., Аксенова И.В. Нитрат аммония в уксусной кислоте – эффективный реагент для нитрования перимидинов и one pot синтез 6(7)-аминоперимидинов. // ХГС. – 2011. – № 2. – С. 304-306.
3. Аксенов А.В., Ляховненко А.С., Перлова (Чередниченко) Т.С., Аксенова И.В. One pot синтез 1,3,6,8-тетраазапиренов. // ХГС. – 2011. – № 7. – С. 1111 - 1112.
Статьи в сборниках и тезисы докладов.
4. Аксенов А.В., Перлова (Чередниченко) Т.С., Ляховненко А.С., Аксенова И.В. Нитрование производных перимидина и синтез аминоперимидинов на его основе. // Успехи синтеза и комплексообразования: Тезисы докладов Всероссийской научной конференции с международным участием, посвященной всемирному году химии. – М: РУДН, – 2011. – С. 197.
5. Аксенов А.В., Ляховненко А.С., Лобач Д.А., Перлова (Чередниченко) Т.С., Аксенова И.В. Реакции с участием N-электрофильных реагентов в синтезе пери-аннелированных гетероциклов. // Новые направления в химии гетероциклических соединений: Материалы второй Международной научной конференции. – Ставрополь: Графа, – 2011. – С. 65.
6. Перлова (Чередниченко) Т.С., Аксенов А.В., Ляховненко А.С., Аксенова И.В. Нитрование перимидинов и синтез 1-окса-5,7-диазациклопента [c,d] феналенов на его основе. // Новые направления в химии гетероциклических соединений: Материалы второй Международной научной конференции. – Ставрополь: Графа, – 2011. – С. 208.
7. Перлова (Чередниченко)Т.С., Ляховненко А.С., Аксенов А.В., Аксенова И.В. Новый метод синтеза 6(7)-аминоперимидинов. // Новые направления в химии гетероциклических соединений: Материалы второй Международной научной конференции. – Ставрополь: Графа, – 2011. – С. 209.
8. Аксенов А.В., Ляховненко А.С., Перлова (Чередниченко)Т.С., Аксенова И.В. Новый метод нитрования производных перимидина и пери-аннелирование пиррольного цикла на его основе. // Материалы XIV молодежной конференции по органической химии, Екатеринбург: ИОС РАН. – 2011. – С. 206-207.
Чередниченко Татьяна Сергеевна
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Подписано в печать. 29.06.2011 г.
Формат 60х84 1/16. Бумага офсетная.
Гарнитура Times New Roman. Печать трафаретная.
Усл. печ. л. 1,17. Уч. изд. л. 1,01.
Заказ 806. Тираж 100 экз.
Отпечатано с оригинал-макета, предоставленного заказчиком.
Государственное учреждение здравоохранения
«Ставропольский краевой клинический центр специализированных видов
медицинской помощи».
355030, г. Ставрополь, ул. Семашко 1, (ул. Лермонтова, 208).
[1] Автор выражает благодарность своему научному консультанту к.х.н. Ляховненко А.С.

