Синтез бактерицидов и ингибиторов сероводородной коррозии
На правах рукописи
Никонорова Наталья Ильинична
СИНТЕЗ БАКТЕРИЦИДОВ И ИНГИБИТОРОВ
СЕРОВОДОРОДНОЙ КОРРОЗИИ
Специальность 02.00.13 - Нефтехимия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Работа выполнена в Стерлитамакской Государственной Педагогической Академии им.Зайнаб Биишевой
Научный руководитель: доктор химических наук, профессор
Левашова Вера Ивановна
Официальные оппоненты: доктор технических наук, профессор
Лыков Олег Петрович
доктор химических наук, профессор,
Фахретдинов Риваль Нуретдинович
Ведущая организация: ООО «РН-УфаНИПИНефть» г.Уфа.
Защита состоится «13»_апреля_2010 г. в _10_ч, в ауд. 202_на заседании диссертационного совета Д.212.200.12 в Российском государственном университете нефти и газа им И.М. Губкина по адресу 119991, ГСП-1, г.Москва, Ленинский проспект, 65
С диссертацией можно ознакомиться в библиотеке Российского государственного университета нефти и газа им И.М.Губкина
Автореферат разослан «___»___марта__ 2010 года.
Ученый секретарь
Диссертационного совета
к.т.н. Иванова Л.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Практика эксплуатации стального оборудования нефтяных скважин, емкостей, нефтепроводов показывает, что одним из основных факторов аварий (около 80%) и преждевременного выхода оборудования из строя является коррозия наружных и внутренних стенок труб нефтепромыслового оборудования. Коррозия, имеющая место при контакте поверхности стали со смесью жидких и газообразных углеводородов, особенно интенсифицируется при насыщении их сероводородом и углекислым газом, являющимися продуктами жизнедеятельности сульфатвосстанавливающих бактерий (СВБ).
Среди различных методов борьбы с коррозией нефтепромыслового оборудования и трубопроводов ведущее место в настоящее время и на ближайшую перспективу принадлежит ингибиторной защите, как не требующей значительных капитальных вложений и серьезной перестройки технологии добычи, сбора и подготовки нефти.
Органические ингибиторы коррозии (ИК) обеспечивают высокую степень защиты оборудования нефтедобычи и нефтесбора от коррозии при малых концентрациях в коррозионной среде. ИК обладают быстродействием и их применение экономически эффективно. Поэтому ни одно месторождение, содержащее агрессивные компоненты, не эксплуатируется без применения ингибиторной защиты от коррозии. Достоинством этого метода является его простота и экономичность, возможность использования, как на новых скважинах, так и на находящихся уже в эксплуатации, что позволяет в процессе освоения месторождений легко заменять существующий ингибитор на более эффективный, не нарушая при этом технологию добычи на промыслах.
Несмотря на имеющуюся широкую номенклатуру замедлителей коррозии и бактерицидов, идет постоянный поиск новых, более эффективных веществ, обеспеченных отечественной сырьевой базой, способных выступать как в роли ингибиторов универсального действия, но и как бактерицидов, так как СВБ в водных средах быстро адаптируются к реагентам.
Исследования прошлых лет показали эффективность использования водных растворов четвертичных аммонийных солей как ИК и бактерицидов.
Целью настоящей работы является синтез новых четвертичных аммонийных солей и исследование их бактерицидных и ингибирующих свойств, подбор оптимальной товарной формы реагентов, разработка ресурсосберегающей, экологически чистой технологии их получения, с использованием в качестве сырья целевых и побочных продуктов предприятий г.Стерлитамака.
Для достижения поставленной цели решены следующие задачи:
- разработка методов синтеза четвертичных аммонийных солей на основе этаноламинов и N,N’-тетраметил-диаминометана;
- проведение испытаний полученных соединений в качестве бактерицидов и ингибиторов коррозии металлов;
- подбор оптимальных условий получения четвертичных аммонийных солей;
- разработка простой безотходной технологии получения синтезированных соединений.
Научная новизна:
Алкенилированием N,N’-тетраметил-диаминометана с эпихлоргидрином, гидрохлоридом пиперилена и смесью гидрохлоридов изопрена синтезированы новые хлористые соли, полностью подавляющие рост сульфатвосстанавливающих бактерий при концентрации 100-150 мг/л и ингибирующие сероводородную коррозию металлов на 82-96%.
На основе этаноламинов с эпихлоргидрином, гидрохлоридом пиперилена и смесью гидрохлоридов изопрена получены новые четвертичные аммонийные соли, подавляющие рост СВБ при концентрации 150-200 мг/л и ингибирующие сероводородную коррозию металлов на 68-72%.
Изучена бактерицидная и ингибирующая активность синтезированных соединений и влияние их строения.
Установлено, что кватернизация N,N’-тетраметил-диаминометана по одному атому азота усиливает ингибирующие и ослабляет бактерицидные свойства его аммонийной соли, а кватернизация по двум атомам азота – наоборот усиливает бактерицидные и ослабляет ингибирующие свойства. Для солей на основе этаноламинов эта зависимость прослеживается от числа (НО-С2Н4)-групп, т.е. с увеличением числа (НО-С2Н4)-групп бактерицидная активность солей возрастает, а защитная эффективность – уменьшается.
Практическая значимость работы:
– полученные реагенты расширяют и углубляют известные сведения о химии четвертичных аммонийных солей и представляют интерес, как в теоретическом, так и в прикладном аспекте.
– определены четвертичные аммонийные соли (ЧАС), применение которых дает наибольший защитный и бактерицидный эффект;
– разработана опытно-промышленная установка получения данных реагентов.
Публикации. По материалам диссертации опубликованы 3 статьи в журналах «Нефтехимия», «Башкирский химический журнал», «Коррозия: материалы, защита», 8 тезисов, опубликованных на Международной научно-практической конференции «Нефтегазопереработка и нефтехимия-2007», 2007 г., XXI Международной научно-технической конференции «Химические реактивы, реагенты и процессы малотоннажной химии», 2008 г., V международной научно-технической конференции «Инновации и перспективы сервиса», 2008 г. и во внутривузовских конференциях.
Структура и объем работы. Диссертация включает введение, пять глав, обобщающие выводы и список литературы из 142 наименований работ отечественных и зарубежных авторов. Работа изложена на 112 страницах машинописного текста, содержит 14 рисунков и 21 таблица.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении показана актуальность проблемы защиты нефтегазодобывающего оборудования от коррозионного разрушения, вызванного СВБ. Обоснованы цель и задачи исследования.
В первой главе представлен обзор различных классов химических соединений, обладающих бактерицидными и ингибирующими коррозию металлов свойствами. Показано, что основная роль отводится азотсодержащим соединениям.
Вторая глава посвящена выбору и обоснованию объекта исследования, приведены характеристики и физико-химические свойства исходных соединений, представлены методики получения четвертичных аммонийных солей в кристаллическом виде и в виде водных растворов, а также методики исследования синтезированных солей в качестве бактерицидов и ингибиторов коррозии металлов.
В третьей главе приведены результаты обсуждения экспериментов по синтезам бактерицидов и ингибиторов коррозии, приведены характеристики и физико-химические свойства синтезированных соединений, доказано строение синтезированных соединений.
Синтез четвертичных аммонийных солей на основе
N,N’-тетраметилдиаминометана
Взаимодействием N,N’-тетраметилдиаминометана (ТМДМ) с гидрохлоридом пиперилена, смесью гидрохлоридов изопрена и эпихлоргидрином были синтезированы моноалкенил-N,N’-тетраметил-диаминометанхлориды и диалкенил-N,N’-тетраметил-диаминометанхлориды.
Схематично получение хлористых солей можно представить в следующем виде:
а) синтез моноалкениламмонийных солей
б) синтез диалкениламмонийных солей
где R – ; ; смесь гидрохлоридов изопрена:
,, (далее обозначим –С5Н9).
Синтезы ЧАС проводили при атмосферном давлении, в токе инертного газа азота, при постоянном перемешивании, мольное соотношение АХ : ТМДМ от 1,0 : 2,3, температура от 200 до 900С, продолжительность реакции менялась от 1 до 9 ч. Реакции вели в растворе обессоленной воды и без растворителя.
С целью определения влияния условий проведения синтеза хлористых солей моно- и диалкенилN,N’-тетраметилдиаминометанов выполнены экспериментальные исследования с изменением температуры, продолжительности реакции и мольного соотношения реагирующих веществ.
Влияние температуры и времени реакции на выход ЧАС при проведении синтеза в среде обессоленной воды и без растворителя на примере получения хлористых солей N-моно(1-метил-2-бутенил) -N,N’-тетраметил-диаминометанхлорида и N,N’-ди(1-метил-2-бутенил) -N,N’-тетраметил-диаминометандихлорида представлено на рисунках 1 и 2.
Из рисунка 1 видно, что увеличение температуры способствует увеличению выхода продуктов реакции. Максимальный выход продуктов реакции, как в водной среде, так и без растворителя, достигается уже при 60 0С.
Из рисунка 2 видно, что реакция для монозамещения в водной среде заканчивается за 3 ч., а без применения растворителя продолжительность реакции увеличивается до 5 ч., содержание основного вещества при этом составило 94,8-98,3%.
Рис. 1. Влияние температуры на выход хлористого N-(1-метил-2-бутенил)-N,N’-тетраметил-диаминометана и N,N’-ди(1-метил-2-бутенил) -N,N’-тетраметил-диаминометандихлорида:
1 – IX (водн. раствор, 3 ч.);
2 – IX (без растворителя, 5 ч.);
3 – X (водн. раствор, 5 ч.);
4 – X (без растворителя, 7 ч.).
Рис. 2. Влияние продолжительности реакции на выход хлористого N-(1-метил-2-бутенил)-N,N’-тетраметил-диаминометана и N,N’-ди(1-метил-2-бутенил) -N,N’-тетраметил-диаминометандихло-рида (600С):
1 - IX (мольн. соотнош. 1,0 : 1,1, водный раствор);
2 - IX (мольн. соотнош. 1,0 : 1,1, без растворителя);
3 – X (мольн. соотнош. 1,0 : 2,2, водный раствор);
4 – X (мольн. соотнош. 1,0 : 2,2, без растворителя).
Рис. 3. Влияние мольного соотношения реагирующих веществ на выход хлористого N-(1-метил-2-бутенил)-N,N’-тетраметил-диаминометана (60 оС):
1 – водный раствор (3 ч.);
2 – без растворителя (5 ч.).
Рис. 4. Влияние мольного соотношения реагирующих веществ на выход N,N’-ди(1-метил-2-бутенил) -N,N’-тетраметил-диаминометандихлорида (60 оС):
1 – водный раствор (5 ч.);
2 – без растворителя (7 ч.).
Для дизамещения реакция в водной среде заканчивается за 5 ч., а без растворителя – за 7 ч., содержание основного вещества составило 94,3-98,1 %.
Влияние мольного соотношения реагирующих веществ на выход хлористых N,N’-моно(1-метил-2-бутенил)-N,N’-тетраметил-диаминометан-хлорида и N,N’-ди(1-метил-2-бутенил)-N,N’-тетраметил-диаминометанди-хлорида представлено на рисунках 3 и 4.
Так, из рисунков 3 и 4 видно, что оптимальное мольное соотношение ГХП : ТМДМ достигается при избытке амина и составляет 1,0 : 1,1 – для хлористых солей N,N’-моно(1-метил-2-бутенил) -N,N’-тетраметил-диаминометанхлорид и 1,0 : 2,2 – для N,N’-ди(1-метил-2-бутенил) -N,N’-тетраметил-диаминометандихлорида.
Таким образом, оптимальными условиями получения ЧАС на основе ГХП и ТМДМ в водной среде для моноалкенил-N,N’-тетраметил-диаминометанов являются: температура – 60 0С, время проведения реакции – 3 ч., мольное соотношение – 1,0 : 1,1; а для диалкенил-N,N’-тетраметил-диаминометанов: температура – 60 0С, время проведения реакции – 5 ч., мольное соотношение – 1,0 : 2,2. При проведении реакции без растворителя для моноалкенил-N,N’-тетраметил-диаминометанов: температура – 60 0С, время проведения реакции – 5 ч., мольное соотношение – 1,0 : 1,1; а для диалкенил-N,N’-тетраметил-диаминометанов: температура – 60 0С, время проведения реакции – 7 ч, мольное соотношение – 1,0 : 2,2.
В найденных условиях были получены остальные хлористые соли на основе N,N’-тетраметил-диаминометана, эпихлоргидрина и смеси гидрохлоридов изопрена.
Выход хлористых солей моно- и диалкенил-N,N’-тетраметил-диаминометана в найденных оптимальных условиях представлен в таблице 1. Анализируя данные таблицы 1, следует отметить, что использование в синтезах ЧАС в качестве растворителя обессоленной воды значительно увеличивает скорость реакции. Этот факт объясняется влиянием природы рас-
Таблица 1
Выход реагентов в оптимальных условиях на основе N,N-тетраметил-диаминометана
| Шифр | Наименование соединения | Формула | Условия проведения синтезов | ||||
| Среда | Время, ч | Температура, 0С | Мольное соотношение АХ : ТМДМ | Выход, масс. % | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| IX | Хлористый N-(1-метил-2- бутенил)-N,N’-тетраметил-диаминометан | jpg"> | Водн. | 3 | 60 | 1,0 : 1,1 | 98,9 |
| Без водн. | 5 | 94,8 | |||||
| X | N,N’-ди (1-метил-2-бутенил) -N,N’-тетраметил-диаминометандихлорид | 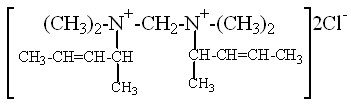 | Водн. | 5 | 60 | 1,0 : 2,2 | 98,1 |
| Без водн. | 7 | 94,3 | |||||
| XI | Хлористый N,N’-(2-пентенил) -N,N’-тетраметил-диаминометан |  | Водн. | 3 | 60 | 1,0 : 1,1 | 98,3 |
| Без водн. | 6 | 92,9 | |||||
| XII | N,N’-ди (2-пентенил) -N,N’-тетраметил-диаминометандихлорид |  | Водн. | 5 | 60 | 1,0 : 2,2 | 98,1 |
| Без водн. | 7 | 92,5 | |||||
| VII | Хлористый N-(2,3-эпоксипропил)-N,N’-тетраметил-диаминометан |  | Водн. | 5 | 80 | 1,0 : 1,1 | 96,5 |
| Без водн. | 7 | 92,4 | |||||
| VIII | N,N’-ди (2,3-эпоксипропил) -N,N’-тетраметил-диаминометандихлорид |  | Водн. | 6 | 80 | 1,0 : 2,2 | 96,2 |
| Без водн. | 8 | 92,3 | |||||
– С5Н9 - смесь гидрохлоридов изопрена,,
творителя, которая выражается в его способности сольватировать ионы, образующиеся при диссоциации исходных реагентов. Вода и исходные реагенты образуют более устойчивые гидролизованные ионы. При этом, хлорид-ион галогенпроизводного замещается на гидрокси-группу, обладающую более высокой нуклеофильной способностью. В результате этого скорость реакции в водной среде увеличивается.
Синтез четвертичных аммонийных солей на основе этаноламинов
Для получения ЧАС на основе моно-, ди- и триэтаноламинов (ЭА) в качестве алкенилирующего агента использовали эпихлоргидрин, гидрохлорид пиперилена и смесь гидрохлоридов изопрена.
Синтез хлористых солей можно представить в виде реакций:
где R – ; ; смесь гидрохлоридов изопрена:
,, (далее обозначим –С5Н9).
Синтез ЧАС проводили при атмосферном давлении, в токе инертного газа азота, при постоянном перемешивании, в растворе обессоленной воды и без растворителя. Мольное соотношение реагирующих веществ менялось АХ : ЭА от 1,0 : 1,0 до 1,0 : 1,3, температура от 30 до 90 0С, продолжительность реакции 1-10 ч.
Влияние температуры, времени реакции и мольного соотношения реагирующих веществ на выход хлористых N-алкениламмонийных солей в водной среде и без растворителя представлены на рисунках 5-7 на примере получения N-(1-метил-2-бутенил)- моноэтаноламмонийхлорида.
Рис. 5. Влияние температуры на выход N-(1-метил-2-бутенил)- моноэтаноламмонийхлорида (мольное соотношение 1,0 : 1,1):
1 – в водном растворе (6 ч.);
2 – без растворителя (8 ч.).
Рис. 6. Влияние продолжительности реакции на выход N-(1-метил-2-бутенил)- моноэтаноламмонийхлорида (60 0С, мольн. соотнош. 1,0 : 1,1):
1 – в водном растворе;
2 – без растворителя.
Рис.7. Влияние мольного соотношения хлористого N-(1-метил-2-бутенил)- моноэтаноламмонийхлорида (60 0С):
1 – в водном растворе (6 ч);
2 – без растворителя (8 ч).
Из рисунка 5 видно, что выход продуктов реакций в водной среде и без растворителя достигается при 60 0С.
С увеличением времени реакции происходит увеличение выхода солей. Так, из рисунка 6 видно, что реакция в водной среде заканчивается за 6 ч, содержание основного вещества при этом составило 96,9 %, а при проведении реакции без растворителя образовывалась вязкая масса коричневого цвета, при этом наибольший выход продуктов реакции достигается за 8 ч., содержание основного вещества составило 89,2 %.
Влияние мольного соотношения реагирующих веществ на выход солей представлено на рисунке 7, из которого видно, что оптимальный выход ЧАС достигается при мольном соотношении ГХП : МЭА=1,0 : 1,1.
Таким образом, условиями получения ЧАС на основе ГХП и МЭА являются: в водном растворе: температура – 60 0С, время проведения реакции – 6 ч., мольное соотношение реагирующих веществ 1,0 : 1,1. При проведении реакции без применения растворителя: температура – 60 0С, время проведения реакции – 8 ч., мольное соотношение реагирующих веществ 1,0 : 1,1.
В найденных оптимальных условиях были синтезированы и остальные четвертичные аммонийные соли на основе этаноламинов (данные приведены в таблице 2.).
Строение синтезированных соединений и их характеристика
Реагенты были выделены в кристаллическом виде из водных растворов. Все синтезированные четвертичные аммонийные соли представляют собой кристаллические вещества от желтого до коричневого цвета: соли на основе N,N-тетраметил-диаминометана – кристаллы желтого цвета, а на основе этаноламинов – желто-коричневого цвета. Все соли хорошо растворяются в воде, не растворяются в органических растворителях и нефти.
Строение выделенных соединений доказывалось по данным элементного состава, ИК- и ЯМР-спектров.
ИК-спектры снимали на спектрофотометре UR-29.
Таблица 2
Выход реагентов в оптимальных условиях на основе этаноламинов
| № | Наименование соединения | Формула | Условия проведения синтезов | ||||
| Среда | Время, ч | Температура, 0С | Мольное соотношение АХ : ЭА | Выход, масс. % | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| XVI | N-(1-метил-2-бутенил)- моноэтаноламмонийхлорид | Водн. | 6 | 60 | 1,0 : 1,1 | 96,9 | |
| Без водн. | 8 | 89,2 | |||||
| XVII | N-(1-метил-2-бутенил)- диэтаноламмонийхлорид | Водн. | 7 | 60 | 1,0 : 1,1 | 94,9 | |
| Без водн. | 9 | 88,1 | |||||
| XVIII | N-(1-метил-2-бутенил)- триэтаноламмонийхлорид | Водн. | 8 | 60 | 1,0 : 1,1 | 92,8 | |
| Без водн. | 10 | 89,7 | |||||
| XIX | N-(2-пентенил)- моноэтаноламмонийхлорид | Водн. | 6 | 60 | 1,0 : 1,1 | 98,8 | |
| Без водн. | 8 | 96,9 | |||||
Окончание таблицы 2
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| XX | N-(2-пентенил)- диэтаноламмонийхлорид | Водн. | 7 | 60 | 1,0 : 1,1 | 96,7 | |
| Без водн. | 9 | 92,6 | |||||
| XXI | N-(2-пентенил)- триэтаноламмонийхлорид | Водн. | 8 | 60 | 1,0 : 1,1 | 94,9 | |
| Без водн. | 10 | 90,9 | |||||
| XIII | N-(2,3-эпоксипропил)-моноэтаноламмонийхлорид | Водн. | 10 | 80 | 1,0 : 1,1 | 88,2 | |
| Без водн. | 11 | 83,7 | |||||
| XIV | N-(2,3-эпоксипропил)-диэтаноламмонийхлорид | Водн. | 11 | 80 | 1,0 : 1, | 86,4 | |
| Без водн. | 13 | 82,1 | |||||
| XV | N-(2,3-эпоксипропил)-триэтаноламмонийхлорид | Водн. | 12 | 80 | 1,0 : 1,1 | 82,2 | |
| Без водн. | 15 | 79,8 |
– С5Н9 – смесь гидрохлоридов изопрена,,.
В полученных спектрах всех синтезированных соединений наличие широкой интенсивной полосы поглощения в области 3000-2850 см-1 указывает на наличие солеобразования. Во всех синтезированных соединениях присутствуют полосы поглощения в области 1360-1240 см-1, характерные для деформационных колебаний метиленовых групп, соединенных в солях с электроноакцепторным азотом при переходе от амина к соли.
Спектры ЯМР 1Н и 13С (в режиме СОМ и JMOD) записаны на спектрометре Bruker АМ-300 (рабочая частота прибора 300 МГц (1Н) и 75.47 МГц (13С)). В качестве внутренних стандартов и растворителей использовали СDCl3, C6D12. На рисунке 8 представлен ЯМР-спектр N-(2,3-эпоксипропил)-триэтаноламмонийхлорида на 13С.

Рис. 8. ЯМР-спектр N-(2,3-эпоксипропил)-триэтанол-аммонийхлорида на 13С.
Спектр ЯМР 1Н,, м.д., J/Гц: 2,87м [2Н, Н(9), СН2], 2,96м [1Н, Н(8), СН], 3,52т [2Н, Н(7), СН2], 3,98т [6Н, Н(2,3,5), СН2], 4,10т [6Н, Н(1,4,6), СН2], 4,63 уш.с [3Н, Н(10,11,12), ОН]. Спектр ЯМР 13С,, м.д.: 58,78 [С(9), СН2], 59,93 [С(8), СН], 63,49 [С(1,4,6), СН2], 65,61 [С(7), СН2], 66,07 [С(2,3,5), СН2].
В четвертой главе приведены результаты испытаний синтезированных соединений в виде водных растворов в качестве бактерицидов и ингибиторов коррозии металлов.
Исследование синтезированных четвертичных аммонийных солей
в качестве бактерицидов
Все синтезированные четвертичные аммонийные соли в виде водных растворов испытаны в качестве бактерицидов для подавления роста сульфатвосстанавливающих бактерий. Определение степени подавления роста сульфатвосстанавливающих бактерий проводилось по методике РД 39-3-973-83 «Методика контроля микробиологической зараженности нефтепромысловых вод и оценка защитного и бактерицидного действия реагентов». – Уфа: ВНИИСПТ.- 1984.
Результаты испытаний приведены в таблице 3.
Таблица 3
Бактерицидная активность в подавлении роста СВБ
| Шифр | Формула | Степень подавления СВБ, % при концентрации реагента, мг/л | |||||
| 50 | 100 | 150 | 200 | 250 | 300 | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Промышленный бактерицид «Катасол 28-5» | 50 | 60 | 98 | 100 | 100 | 100 | |
| XI |  | 60 | 80 | 100 | 100 | 100 | 100 |
| X |  | 80 | 100 | 100 | 100 | 100 | 100 |
| XI |  | 80 | 90 | 100 | 100 | 100 | 100 |
| XII |  | 90 | 100 | 100 | 100 | 100 | 100 |
| VII |  | 40 | 60 | 80 | 100 | 100 | 100 |
| VIII |  | 50 | 80 | 100 | 100 | 100 | 100 |
| XVI | 30 | 45 | 65 | 75 | 100 | 100 | |
Окончание таблицы 3
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| XVII | 40 | 50 | 80 | 100 | 100 | 100 | |||
| XVIII | 75 | 90 | 100 | 100 | 100 | 100 | |||
| XIX | 40 | 60 | 85 | 100 | 100 | 100 | |||
| XX | 65 | 90 | 100 | 100 | 100 | 100 | |||
| XXI | 80 | 95 | 100 | 100 | 100 | 100 | |||
| XIII | 30 | 40 | 60 | 70 | 80 | 100 | |||
| XIV | 50 | 60 | 70 | 80 | 100 | 100 | |||
| XV | 60 | 75 | 85 | 100 | 100 | 100 | |||
– С5Н9 - смесь гидрохлоридов изопрена,,.
Данные таблицы 3 показывают, что наибольшей бактерицидной активностью обладают соли X, XI, XII, XXI, подавляющие рост СВБ при 100-150 мг/л; а соли VII, VIII, IX, XV, XVII, XVIII, XIX, XX подавляют СВБ при 150-200 мг/л.
На основании проведенных исследований можно сделать следующий вывод, что среди хлористых солей на основе N,N’-тетраметил-диаминометана бактерицидная активность в отношении СВБ увеличивается в следующем порядке: моно- < ди-. То есть, с увеличением числа введенных алкенилзаместителей степень подавления роста СВБ увеличивается.
Бактерицидная активность четвертичных аммонийных солей при подавлении СВБ на основе этаноламинов увеличивается в следующем порядке: моно- < ди-<триэтаноламин.
Исследования синтезированных четвертичных аммонийных солей
в ингибировании сероводородной коррозии металлов
Для изучения защитной эффективности ЧАС коррозионные испытания были проведены в стерильной питательной среде Постгейта при 37 0С, их продолжительность в питательной среде – 168 часов (цикл развития СВБ). Как в стерильных, так и в средах с СВБ, коррозионное поражение углеродистой стали Ст3 носит равномерный характер, локальных эффектов не наблюдается.
Результаты проведенных исследований представлены в таблице 4.
Таблица 4
Влияние концентрации ЧАС на степень защиты от
сероводородной коррозии металлов
| Шифр | Формула соединения | Защитный эффект, Z, % | |||
| Концентрация ЧАС, мг/л | |||||
| 50 | 100 | 200 | 400 | ||
| 1 | 2 | 3 | 4 | 5 | 6 |
| Промышленный ингибитор ИНХП-12.01 | 45 | 98 | 99 | 99 | |
| IX |  | 40 | 92 | 93 | 93,7 |
| X |  | 42 | 82 | 82,4 | 85 |
| XI |  | 50 | 96 | 97 | 97,5 |
| XII |  | 32 | 86 | 86,4 | 87 |
| VII |  | 22,5 | 41 | 41,5 | 41 |
Окончание таблицы 4
| 1 | 2 | 3 | 4 | 5 | 6 | |
| VIII |  | 27 | 60 | 62 | 64 | |
| XVI | 32,7 | 66 | 66,4 | 67 | ||
| XVII | 27 | 52 | 53 | 53,9 | ||
| XVIII | 29 | 47 | 48 | 49 | ||
| XIX | 37 | 72 | 72,4 | 72,6 | ||
| XX | 35 | 68 | 69 | 69,8 | ||
| XXI | 25 | 52 | 53 | 54 | ||
| XIII | 20,5 | 41 | 41,5 | 44 | ||
| XIV | 17 | 30 | 31 | 32 | ||
| XV | 11,5 | 20 | 21,2 | 22 | ||
– С5Н9 - смесь гидрохлоридов изопрена,,.
Из сопоставления данных, приведенных в таблице 4, следует, что исследованные ЧАС замедляют скорость коррозии. Наиболее эффективно работают соли на основе гидрохлоридов пиперилена и смеси гидрохлоридов изопрена с N,N’-тетраметил-диаминометаном, т.е. соединения IX, X, XI, XII. При чем защитный эффект среди хлористых солей на основе N,N’-тетраметил-диаминометана увеличивается в следующем порядке: моно- > ди-. То есть, с увеличением числа введенных алкенилзаместителей степень защиты уменьшается.
А для ЧАС на основе этаноламинов защитная эффективность в ингибировании сероводородной коррозии металлов увеличивается в следующем порядке: моно- > ди-> триэтаноламин.
В пятой главе на основе проведенных исследований разработана технология, позволяющая наряду с основным продуктом, нарабатывать бактерициды и ингибиторы сероводородной коррозии металлов. Приведена технологическая схема узла их синтеза, а также материальный баланс получения бактерицидов и ингибиторов коррозии на основе N,N’-тетраметил-диаминометана и гидрохлорида пиперилена.
ВЫВОДЫ
- Взаимодействием N, N’-тетраметил-диаминометана с эпихлоргидрином, гидрохлоридом пиперилена и смесью гидрохлоридов изопрена получены новые хлористые соли моноалкенил- N,N’-тетраметил-диаминометана и диалкенил- N,N’-тетраметил-диаминометана, полностью подавляющие рост сульфатвосстанавливающих бактерий при концентрации 100-150 мг/л. Установлено, что степень подавления роста сульфатвосстанавливающих бактерий увеличивается при увеличении числа введенных в молекулу ЧАС алкенил-групп.
- Взаимодействием этаноламинов с эпихлоргидрином, гидрохлоридом пиперилена и смесью гидрохлоридов изопрена получены новые хлористые соли, полностью подавляющие рост сульфатвосстанавливающих бактерий при концентрации 150-200 мг/л. Установлено, что степень подавления роста сульфатвосстанавливающих бактерий увеличивается в следующем порядке: моно- < ди-<триэтаноламин.
- Синтезированные ЧАС испытаны в качестве ингибиторов против сероводородной коррозии металлов. Установлено, что ЧАС на основе N,N’-тетраметил-диаминометана и гидрохлоридов пиперилена и смеси гидрохлоридов изопрена показали защитный эффект на 82-96%, при чем с увеличением числа введенных алкенилзаместителей степень защиты уменьшается. А для ЧАС на основе ЭА степень защиты составила 68-72%, зашитная эффективность увеличивается в следующем порядке: моно- > ди-> триэтаноламин
- Подобраны оптимальные условия получения четвертичных аммонийных солей с количественным выходом как в виде водных растворов, так и без применения растворителя.
- Разработана универсальная, ресурсосберегающая, экологически чистая технология, позволяющая получать бактерициды и ингибиторы сероводородной коррозии металлов, с использованием в качестве сырья целевых и побочных продуктов предприятий.
- Проведенные исследования показали эффективность синтезированных четвертичных аммонийных солей в качестве ингибиторов широкого спектра действия, уровень защитного действия которых достаточен для использования в нефтедобывающей промышленности. Проявляемое ими антибактериальное действие по отношению к СВБ, наиболее опасных в условиях добычи, транспортировки и переработки нефти, позволяют рекомендовать их в качестве ингибиторов коррозии стали в данной отрасли.
Основное содержание диссертации изложено в следующих публикациях:
- Никонорова Н.И., Левашова В.И. Синтез и исследование свойств четвертичных аммонийных солей на основе N,N’-тетраметилдиаминометана и 4-хлор-2-пентена // Нефтехимия. – Москва. – 2009. Т.49, №3. С.268-271.
- Никонорова Н.И., Левашова В.И. Синтез и исследование свойств четвертичных аммонийных солей на основе этаноламинов и эпихлоргидрина // Башкирский химический журнал. – Уфа. – 2008, №3. С. 26-28.
- Никонорова Н.И., Левашова В.И. Синтез и исследование свойств четвертичных аммонийных солей на основе бисамина и гидрохлоридов изопрена // Коррозия: материалы, защита. – Москва. - 2008, №8. С. 37-39.
- Никонорова Н.И., Левашова В.И., Антипов В.А. Синтез N-алкениламмонийных солей на основе моно-, ди- и триэтиламинов // Международная научно-практическая конференция «Нефтегазопереработка и нефтехимия - 2007». Тезисы докладов. – Уфа. – 2007. – С.189.
- Никонорова Н.И., Левашова В.И., Антипов В.А. Получение N-алкениламмонийных солей на основе N, N’-тетраметилдиаминометана и гидрохлорида пиперилена // Международная научно-практическая конференция «Нефтегазопереработка и нефтехимия - 2007». Тезисы докладов. – Уфа. – 2007. – С.195.
- Никонорова Н.И., Левашова В.И., Антипов В.А., Дехтярь Т.Ф. Синтез N-алкениламмонийных солей на основе этаноламина и гидрохлорида пиперилена//Международная научно-практическая конференция «Нефтегазопереработка и нефтехимия - 2007». Тезисы докладов. – Уфа. – 2007. – С.190.
- Никонорова Н.И., Левашова В.И. Синтез четвертичных аммонийных солей // Всероссийская конференция молодых ученых, аспирантов, студентов. Тезисы докладов. - Стерлитамак, 2008. – С. 29
- Никонорова Н.И., Левашова В.И. Разработка новых бактерицидных реагентов // XXI Международная научно-техническая конференция «Химические реактивы, реагенты и процессы малотоннажной химии (РЕАКТИВ-2008)» - Уфа. – 2008. С. 53-54.
- Никонорова Н.И., Левашова В.И. Синтез час на основе эпихлоргидрина // V международная научно-техническая конференция «Инновации и перспективы сервиса». Тезисы докладов. - Уфа, 2008. – С. 5.

