Синтез, строение и реакции тиенилсодержащих кросс-сопряженных диеноновых производных циклогексана и соединений на их основе
На правах рукописи
ФОМИНА ЮЛИЯ АНДРЕЕВНА
СИНТЕЗ, СТРОЕНИЕ И РЕАКЦИИ ТИЕНИЛСОДЕРЖАЩИХ
КРОСС-СОПРЯЖЕННЫХ ДИЕНОНОВЫХ ПРОИЗВОДНЫХ ЦИКЛОГЕКСАНА И СОЕДИНЕНИЙ НА ИХ ОСНОВЕ
02.00.03 – органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Саратов - 2008
Работа выполнена в ГОУ ВПО “Саратовский государственный университет имени Н.Г. Чернышевского”
на кафедре органической и биоорганической химии
Научный руководитель: доктор химических наук, профессор
Кривенько Адель Павловна
Официальные оппоненты: доктор химических наук, профессор
Пурыгин Петр Петрович
(Самарский государственный университет);
доктор химических наук, профессор
Решетов Павел Владимирович
(Саратовский государственный медицинский университет).
Ведущая организация: Кубанский государственный технологичес-кий университет (г. Краснодар)
Защита состоится 18 декабря 2008 года в 1400 часов на заседании диссертационного совета Д 212.243.07 при Саратовском государственном университете имени Н.Г. Чернышевского по адресу:
410012, г. Саратов, ул. Астраханская, 83, корп. I, химический факультет СГУ.
С диссертацией можно ознакомиться в Научной библиотеке
Саратовского государственного университета имени Н.Г. Чернышевского
Автореферат разослан 14 ноября 2008г.
Ученый секретарь диссертационного совета Сорокин В.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Синтез, исследование строения и свойств кросс-сопряженных диеноновых производных циклических кетонов (далее диенонов) является одним из перспективных направлений современной органической химии. Эти соединения широко используются при построении различных конденсированных гетероциклических систем, в создании новых практически полезных веществ, в том числе и биологически активных.
Внимание исследователей к соединениям указанного типа не ослабевает до сих пор. В этой области успешно работают химики Московского государственного университета, Санкт-Петербургского государственного университета, Харьковского национального университета, представители зарубежья. По химии кросс-сопряженных диеноновых производных циклических кетонов недавно появилась обзорная статья, обобщающая достижения последних лет.
Большая часть работ посвящена симметрично построенным системам, что объясняется их доступностью и однозначностью химического поведения. Аналоги несимметричного строения достаточно хорошо изучены на примере соединений, содержащих периферические фурильный и арильные заместители (Саратовский государственный университет). Решены вопросы их синтеза, стереохимии, регионаправленности реакций с нуклеофильными реагентами. Реакции с электрофилами не изучались. Тиенилзамещенные диеноны указанного типа до наших исследований систематически не рассматривались. Введение в молекулу диенона близких по ароматичности колец (бензольного и тиофенового) могло оказать существенное влияние на направление нуклеофильных и электрофильных атак, стереохимию продуктов, привести к построению новых гетероциклов, биоактивных веществ. Известно, что тиофеновое кольцо является фрагментом полусинтетических антибиотиков, противокашлевых препаратов, средств для лечения печени, компонентом природных соединений и других практически значимых веществ.
В связи с указанным изучение теоретических, синтетических и прикладных аспектов химии тиенилсодержащих кросс-сопряженных диеноновых производных циклогексана, их реакций с нуклеофильными и электрофильными реагентами является актуальным.
Работа является частью плановых научных исследований, проводимых на кафедре органической и биоорганической химии Саратовского государственного университета имени Н.Г.Чернышевского по теме «Физико-химическое исследование молекулярных, супрамолекулярных систем и создание новых материалов с заданными свойствами» (№ госрегистрации 0120.0 6035509), работ, выполненных при финансовой поддержке Федерального агентства по науке и инновациям (грант № 02.513.11.3028).
Цель и задачи работы. Синтез несимметричных кросс-сопряженных диеноновых производных циклогексана, содержащих тиенильный заместитель, изучение регионаправленности их реакций с нуклеофильными и электрофильными реагентами, установление строения полученных соединений и изучение их биологической активности.
Научная новизна. Синтезированы ранее неизвестные кросс-сопряженные диеноновые производные циклогексана, содержащие, наряду с тиенильным, фурильный либо арильный заместители, а также фурилзамещенные три- и тетраеноны, На основании спектральных данных и РСтА установлена их Е,Е-конфигурация.
Диеноны, содержащие тиофеновый цикл в отличие от их фурилсодержащих аналогов реагируют с гидразином по двум возможным направлениям с образованием региоизомерных NH-гексагидроиндазолов, соотношение которых определяется наличием и природой замещающих групп в периферических заместителях. Для диенона, сочетающего два гетероциклических заместителя (фурильный и тиенильный), установлена принципиальная возможность азациклизации с участием фурилметиленового фрагмента.
Реакции с фенилгидразином независимо от природы гетероциклического заместителя протекают региоспецифично с образованием одного типа региоизомерных гексагидроиндазолов – тиенилзамещенных NPh-гексагидроиндазов.
При взаимодействии диенонов с гидразинами получены новые гетероциклические ансамбли, включающие линейносвязанные и конденсированные гетероциклы, установлено их строение (транс-, цис-конфигурация) и изучены реакции с участием NH атома (ацилирование) и экзоциклической двойной связи (окислительное присоединение N-аминофталимида). При ацилировании NH-гексагидроиндазолов получены транс-N-малеинилпроизводные, существующие в виде внутренних солей. Окислительное присоединение N-аминофталимида к NPh-гексагидро-индазолам в зависимости от строения илиденового заместителя протекает с сохранением гетерокольца (для тиенилметилензамещенных), либо с раскрытием (для фурилметилензамещенных).
При бромировании тиенилметиленарилметиленциклогексанонов в зависимости от соотношения реагентов получены продукты просоединения брома по одной, либо по двум экзоциклическим двойным связям, причем дибромирование протекает избирательно по арилметиленовому фрагменту, что является первым примером электрофильных реакций в ряду несимметричных диенонов.
Предложены и обсуждены вероятные схемы реакций.
Практическая значимость заключается в разработке способов получения ранее неизвестных тиенилсодержащих диеноновых производных циклогексана несимметричного строения и полизамещенных гидроиндазолов на их основе, содержащих фармакофорные фрагменты и группы. Установлено, что диеноны и тетраенон с нитрогруппой в гетерокольце обладают антистафилококковой активностью, превышающей активность препаратов сравнения.
На защиту выносятся результаты исследований по:
- синтезу кросс-сопряженных тиенилсодержащих диеноновых производных циклогексана несимметричного строения.
- синтезу фурилсодержащих три- и тетраенонов ряда циклогексана.
- изучению реакций диенонов с нуклеофильными (гидразингидрат, фенилгидразин) и электрофильным (бром) реагентами, выявлению их региоспецифичности и региоселективности.
- синтезу замещенных гекса(тетра)гидроиндазолов, содержащих тиофеновый цикл, изучению их реакций (ацилирование, окислительное присоединение N-аминофталимида).
- изучению стереостроения полученных соединений.
- изучению биологической активности синтезированных веществ.
Апробация работы. Основные результаты работы представлялись на IV, V, VI Всероссийских конференциях молодых ученых “Современные проблемы теоретической и экспериментальной химии” (Саратов, 2003, 2005, 2007), VII всероссийской школе-конференции по органической химии (Екатеринбург, 2004), Международной конференции по органической химии “Органическая химия от Бутлерова и Бейльштейна до современности”, (Санкт-Петербург, 2006), VI Международной научной конференции “Фундаментальные и прикладные проблемы современной химии в исследованиях молодых ученых” (Астрахань, 2006), International conference chemistry of nitrogen containing heterocycles “CNCH-2006” (Kharkiv, 2006), IX научной школе-конференции по органической химии, ИОХ РАН (Москва, 2006), XVII Российской молодежной научной конференции “Проблемы теоретической и экспериментальной химии” (Екатеринбург, 2007), XVIII Менделеевском съезде по общей и прикладной химии (Москва, 2007), Российской научно-практической конференции “Достижения и перспективы в области создания новых лекарственных средств” (Пермь, 2007), XI Международной научно-технической конференции “Перспективы развития химии и практического применения алициклических соединений” (Волгоград, 2008), XI Всероссийской конференции “Карбонильные соединения в синтезе гетероциклов” (Саратов, 2008).
Публикации. По теме диссертации опубликована 21 работа: из них 4 статьи в центральной печати, в том числе 3 статьи в журналах, рекомендованных ВАК, 10 статей в сборниках научных трудов, 7 тезисов докладов Международных и Российских конференций.
Объем и структура работы. Диссертация изложена на 152 страницах машинописного текста, включая введение, четыре главы, выводы, список использованных источников из 154 наименований, 23 таблицы, 11 рисунков. Приложение содержит 43 стр.
Благодарность. Автор выражает глубокую благодарность научному руководителю, заслуженному работнику высшей школы РФ, доктору химических наук, профессору Кривенько Адель Павловне, к.х.н., доценту Голикову А.Г. за помощь в интерпретации спектральных данных, д.м.н., проф. Шубу Г.М., к.м.н., асс. Шаповал О.Г. (кафедра микробиологии с вирусологией и иммунологией СГМУ) за выполнение исследований антимикробной активности, проф. Солодовникову С.Ф. (Институт неорг. химии им. А.В. Николаева СО РАН, г. Новосибирск) за сотрудничество при выполнении рентгеноструктурных исследований.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Синтез и строение ди- и полиенонов
Осуществлен синтез тиенилсодержащих диеноновых производных циклогексана, не содержащих замещающих групп в перифирических циклах (1; здесь и далее нумерация соединений соответствует нумерации в диссертационной работе), отличающихся природой замещающих групп в бензольном (OMe, NO2) (2, 3), и в тиофеновом (NO2) (5, 6) циклах; диенона (4) с двумя различными гетероциклическими фрагментами (тиенильный и фурильный), диенона симметричного строения с 5-нитротиенильными заместителями (7), и фурилсодержащих три- и тетраеноновых производных циклогексана 8-13 с протяженной системой сопряженных двойных связей. Диеноны 1, 2, ранее описанные в литературе, получены для выявления закономерностей в реакционной способности и спектральных отнесений в ряду однотипнопостроенных соединений при различной вариантности заместителей.
 R = H (1), 4-OMe (2), 3-NO2 (3) R = H (1), 4-OMe (2), 3-NO2 (3) |  |
 R = H (5), 4-OMe (6) R = H (5), 4-OMe (6) | 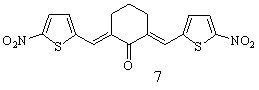 |
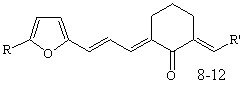 R=H: R’=Ph (8), 4-OMeC6H4 (9), Fu (10); R= NO2: R’=Ph (11), 4-OMeC6H4 (12) R=H: R’=Ph (8), 4-OMeC6H4 (9), Fu (10); R= NO2: R’=Ph (11), 4-OMeC6H4 (12) |  |
Кетоны 1-4, 8-10 получены кротоновой конденсацией (гет)арилметиленциклогексанонов с 2-тиофенкарбальдегидом (3-нитро-бензальдегидом) или фурилакролеином в условиях основного катализа.


R = Ph (8), 4-OMeC6H4 (9), Fu (10)
Синтез кетонов с 5-нитротиенильным (соед. 5-7) и 5-нитрофурильным (соед. 11-13) заместителями осуществлен в условиях кислотного катализа (ледяная уксусная кислота с добавлением конц. H2SO4). В качестве карбонильной компоненты использовались диацетат 5-нитро-2-тиофенкарбальдегида и 5-нитро-2-фурилакролеин.
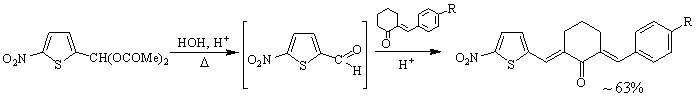
5, 6
R = H (5), OMe (6)

R = H (11), 4-OMe (12)
Симметрично построенные кетоны 7, 13 получены с целью использования в качестве модельных для интерпретации спектров ЯМР1Н соединений несимметричного строения, содержащих 5-нитротиофеновый (соед. 5, 6) и 5-нитрофурановый (соед. 11, 12) циклы, и изучения их биоактивности.


В ИК-спектрах диенонов 1-7 и полиенонов 8-13 полоса валентных колебаний карбонильной группы смещена в область низких частот вследствие сопряжения и проявляется в области 1662-1645 см-1. Большая интенсивность валентных колебаний этиленовой связи (1600-1543 см-1) по сравнению с поглощением связи С=О является аналитическим признаком их S-цис-расположения. Наличие полос внеплоскостных деформационных колебаний связи С=СН (968-984 см-1) свидетельствует о Е,Е-конфигурации кетонов, при которой тиенильный(фурильный) и арильный заместители находятся с карбонильной группой по разные стороны этиленовой связи.
Следует отметить близкие значения винильных протонов в спектрах ЯМР1Н. Однако анализ спектральных данных широкого круга полученных нами диенонов позволил выделить химические сдвиги тиенилметиленового (=СНTh) и арилметиленового (=СНAr) протонов, находящихся в области 7,82-8,02 м.д. и 7,77-7,81 м.д. соответственно. Положение химических сдвигов винильных протонов (7,77-8,02 м.д.) свидетельствует о Е,Е-конфигурации кетонов.
Такой вывод подтвержден рентгеноструктурным анализом одного из представителей ряда – 2-(2-тиенилметилен)-6-(2-фурилметилен)циклогекса-нона (4), выделенного в виде хорошо образованных кристаллов (рис. 1.).

