Кросс-сопряженные диеноновые производные циклогекса(пента)нона и соединения на их основе в реакциях с с- и n -нуклеофильными реагентами
На правах рукописи
Морозова Анастасия александровна
КРОСс-сОПРЯЖЕННЫЕ ДИЕНОНОВЫЕ ПРОИЗВОДНЫЕ ЦИКЛОГЕКСА(ПЕНТА)НОНА и соединения на их основе
в реакциях с С- и n-нуклеофильными реагентами
02.00.03 – органическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Саратов - 2008
Работа выполнена в Саратовском государственном университете
имени Н.Г. Чернышевского на кафедре органической и биоорганической химии
Научный руководитель : заслуженный работник Высшей школы РФ,
доктор химических наук, профессор
Кривенько Адель Павловна
Официальные оппоненты: доктор химических наук, профессор
Решетов Павел Владимирович
(Саратовский государственный медицинский университет);
доктор химических наук, профессор
Древко Борис Иванович
(Саратовский военный институт радиационной, химической и биологической защиты).
Ведущая организация: Дальневосточный государственный университет
Защита состоится 21 февраля 2008 года в 1400 часов на заседании диссертационного совета Д 212.243.07 при Саратовском государственном университете имени Н.Г. Чернышевского по адресу: 410012, г. Саратов, ул. Астраханская, 83, корп. I, химический факультет СГУ.
С диссертацией можно ознакомиться в Научной библиотеке
Саратовского государственного университета имени Н.Г. Чернышевского
Автореферат разослан 10 января 2008г.
Ученый секретарь диссертационного совета ![]() Сорокин В.В.
Сорокин В.В.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Неослабевающий интерес к химии кросс-сопряженных производных циклических кетонов (диенонов) обусловлен, прежде всего, их доступностью, высокой реакционной способностью, что играет исключительную роль в органическом синтезе, а так же возможностью их практического применения в различных областях (медицина, оптика, ракетная техника и др.). Из многочисленных реакций диенонов наиболее изучены реакции с азотсодержащими нуклеофильными реагентами. Значительно меньше, и только на примере субстратов симметричного строения, представлены в литературе реакции с донорами Михаэля, имеющими высокую СН-кислотность. Практически не изученными до наших исследований оставались реакции несимметричных диенонов, содержащих дополнительные и неравноценные активные центры, что требует решения вопросов региоселективности и региоспецифичности реакций и создает перспективу выявления новых аспектов химии этого класса соединений, синтеза на их основе конденсированных карбо- и гетероциклических соединений.
В русле решения указанных проблем выполнена настоящая работа, направленная на изучение реакций кросс-сопряженных диеноновых производных циклопентанона и циклогексанона, разработку на их основе путей синтеза полифункциональнозамещенных карбо- и гетероциклических систем, в том числе и содержащих фармакофорные фрагменты и группы.
Работа является частью плановых научных исследований, проводимых на кафедре органической и биоорганической химии Саратовского государственного университета имени Н.Г.Чернышевского по теме «Теоретическое и экспериментальное исследование новых материалов и систем с заданными физико-химическими и биологическими свойствами» (рег. № 3.4.03), работ, выполненных при финансовой поддержке Федерального агентства по науке и инновациям (грант № 02.513.11.3028).
Цель работы.
Изучение реакций с C-нуклеофильными реагентами диарил(гетарил)метиленциклопентанонов и -гексанонов симметричного и несимметричного строения, выявление их избирательной реакционной способности, синтез новых карбо-, гетероциклических соединений на их основе, установление строения полученных соединений.
Научная новизна.
Впервые изучены реакции циклогекса(пента)диенонов, cодержащих ароматические и фурильный заместители в различных комбинациях, с С-нуклеофильными реагентами (ацетилацетоном, ацетоуксусным эфиром).
Направление реакций определяется природой заместителей, размером алицикла, симметричностью строения субстрата и типом нуклеофильного реагента.
На основе симметричных диенонов, содержащих фенилметиленовый фрагмент, синтезированы новые карбоциклические соединения - гидроксизамещенные пергидронафталин(индан)оны, -карбоксилаты, имеющие транс-сочленение циклов, аксиальную ориентацию гидроксильной группы и экваториальное расположение других заместителей.
Диеноны, содержащие акцепторный м-нитрофенильный заместитель, реагируют с ацетоуксусным эфиром с образованием продуктов О-гетероциклизации - смеси изомерных гексагидроциклопента[b]пиран(хромен)карбоксилатов, отличающихся положением кратной связи и гидроксильной группы.
В несимметричных диенонах нуклеофильные атаки протекают по фенилметиленовому фрагменту (для фенилметилен-фурилметиленцикланонов) - региоселективно (для производных циклогексанона) и региоспецифично (для производных циклопентанона), либо с участием 3-нитрофенилметиленового заместителя. При этом получены гидроксипергидронафталин(индан)оны, -карбоксилаты и смеси изомерных гидроксипергидронафталин(индан)- и гексагидроциклопента[b]пиран(хромен)карбоксилатов. Как и в случае симметричных аналогов наличие акцепторной нитрофенильной группировки обеспечивает протекание О-гетероциклизации, а донорный фурильный и фенильный заместители - карбоциклизации.
Под действием кислот гидроксипергидронафталин(индан)оны,
-карбоксилаты претерпевают дегидратацию и полную енолизацию с участием эндоциклической оксогруппы. В зависимости от размера аннелированного цикла образуются енолы - бициклодекадиенилэтаноны, -карбоксилаты (для производных циклогексанона) или смесь изомеров – бициклононадиенилэтанонов, -карбоксилатов (для производных циклопентанона), отличающихся положением кратной связи. На основании РСтА установлена полная конфигурация енолов – циклогексадиеновое кольцо существует в конформации «ванна», что сводит к минимуму скошенное взаимодействие объемных заместителей и объясняет енолизацию.
Реакции ацетилнафталин(индан)онов, -карбоксилатов и продуктов их дегидратации-енолизации с гидразином протекают с участием 1,3-диоксофрагмента как азациклизация с образованием новых конденсированных гетероциклов –замещенных циклогекса(пента)индазолов.
Под действием гидроксиламина этоксикарбонилзамещенные системы претерпевают нуклеофильное замещение алициклической карбонильной группы с образованием оксимов, в случае ацетилсодержащих аналогов протекает гетероциклизация, приводящая к циклогекса(пента)изоксазолам.
Предложены и обсуждены вероятные схемы реакций.
Практическая значимость работы заключается в синтезе ранее неизвестных гидроксипергидронафталин(индан)онов, -карбоксилатов, гидронафталинил(инденил)этанонов, -карбоксилатов, гексагидроциклопента[b]пиран(хромен)карбоксилатов, циклопента(гекса) индазолов, -изоксазолов с фармакофорными фрагментами и группами. По результатам компьютерного скрининга с использованием программы PASS, среди синтезированных веществ выделены соединения, обладающие с большой вероятностью различными видами биоактивности.
На защиту выносятся результаты исследований по:
- изучению взаимодействия кросс-сопряженных диенонов С5,С6 алициклического ряда с С-нуклеофильными реагентами (ацетилацетоном, ацетоуксусным эфиром);
- выявлению стерео- и регионаправленности реакций;
- построению новых карбоциклических систем на основе дифенилметилен- и фенилметиленфурилметиленциклопентанонов и
-гексанонов;
- построению новых О-гетероциклических систем на основе ди-м-нитрофенилметилен- и м-нитрофенилметиленфенил(фурил)метилен циклопента(гекса)нонов;
- изучению превращений синтезированных гидрокси пергидронафталин(индан)онов, -карбоксилатов под действием кислот и азотсодержащих нуклеофильных реагентов (гидразина, гидроксиламина);
- изучению (стерео)строения полученных новых соединений.
Апробация работы. Основные результаты работы представлялись на V, VI Всероссийских конференциях молодых ученых “Современные проблемы теоретической и экспериментальной химии” (Саратов, 2005, 2007), I Международном форуме (6 Международной конференции молодых ученых и студентов) “Актуальные проблемы современной науки” (Самара, 2005), X Международной конференции студентов и аспирантов по фундаментальным наукам “Ломоносов - 2005”(Москва, 2005), VI Международной конференции молодых ученых “Современные тенденции в органическом синтезе и проблемы химического образования”, (Санкт-Петербург, 2005) VI Международной научной конференции «Фундаментальные и прикладные проблемы современной химии в исследованиях молодых ученых» (Астрахань, 2006), IX научной школе-конференции по органической химии, ИОХ РАН (Москва, 2006), XVIII Менделеевском съезде по общей и прикладной химии (Москва, 2007).
Публикации. По теме диссертации опубликовано 14 работ: из них 11 статей, в том числе 2 статьи в реферируемых журналах, 9 статей в сборниках научных трудов, 3 тезисов докладов.
Объем и структура работы. Диссертация изложена на 160 страницах машинописного текста, включая введение, три главы, выводы, список использованных источников из 164 наименований, 27 таблиц, 4 рисунка. Приложение содержит 64 стр.
Благодарность. Автор выражает глубокую благодарность научному руководителю, заслуженному работнику высшей школы РФ, доктору химических наук, профессору Кривенько Адель Павловне.
Кандидату химических наук, доценту кафедры органической и биоорганической химии СГУ Голикову А.Г. за научные консультации, помощь в интерпретации спектральных данных.
Проф. Солодовникову С.Ф. (Институт неорг. химии им. А.В. Николаева СО РАН, г. Новосибирск) за сотрудничество и выполнение рентгеноструктурных исследований.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Реакции диенонов с С-нуклеофильными
реагентами (ацетилацетоном, ацетоуксусным эфиром)
В качестве объектов исследования нами были выбраны известные диеноновые производные циклопентанона и циклогексанона 1-12, содержащие фурилметиленовый и арилметиленовые заместители, в том числе с донорными (п-N(СН3)2, п-ОМе) и акцепторной (м-NO2) группировками.
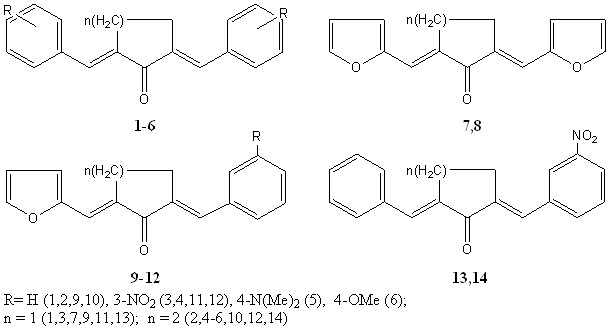
В качестве С-нуклеофильного реагента использовались ацетилацетон и ацетоуксусный эфир. Выбор С-нуклеофилов определялся их доступностью и высокой С-Н кислотностью.
1.1 Реакции симметричных диенонов
Нами впервые изучено взаимодействие с ацетилацетоном и ацетоуксусным эфиром симметричных диенонов 1-4. Реакции осуществлялись в растворе диметилформамида в условиях основного катализа (пиперидин), при соотношении субстрат:реагент=1:2 и выдерживании реакционной смеси в течение 7 суток.
При реакции дифенилметилензамещенных диенонов 1,2 были выделены продукты карбоциклизации - 6-ацетил-3-фенилметилен-3а-гидрокси-7-фенил-гексагидро-1Н-индан-5-он (15), 3-ацетил-8-фенилметилен-8а-гидрокси-4-фенил-октагидронафталин-2-он (16) и этил-1-фенилметилен-7а-гидрокси-4-фенил-6-оксо-октагидро-1Н-индан-5-карбоксилат (17), этил-5-фенилметилен-4а-гидрокси-3-оксо-1-фенил-декагидронафталин-2-карбоксилат (18) с выходами 65-70 %, как результат конденсации Михаэля и последующей внутримолекулярной альдолизации.
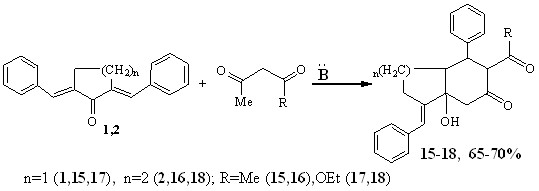
Соединения 15-18, по данным ЯМР 1Н, 13С-спектров существуют в кетонной форме. Енольная форма присутствует в следовых количествах, о чем свидетельствуют данные ТСХ и малоинтенсивные сигналы енольного протона в ЯМР 1Н – спектрах.
С целью изучения влияния заместителей на направление реакции нами было исследовано взаимодействие диенонов, содержащих электроноакцепторный (3-NO2С6Н4-) и электронодонорные (4-N(Me)2С6Н4-, 4-OMeС6Н4-, Fu-) заместители в ароматическом цикле.
Конденсация бис(3-нитрофенилметилен)циклоалканонов 3,4 в аналогичных условиях (диметилформамид, пиперидин) привела к иному результату - образованию смеси изомерных продуктов О-гетероциклизации - гексагидроциклопента[b]пиран(хромен)карбоксилатов (19a,20a), (19b,20b), а не ожидаемых карбоциклов.
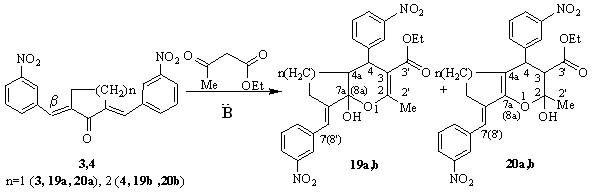
В спектрах ЯМР 13С присутствует удвоенное количество сигналов sp3 гибридных атомов углерода -8(9), что подтверждает наличие изомерной смеси. Наряду с сигналами изомеров 19a,b (С-7а(8а) 97.10 м.д., С-3’ 170.40 м.д., С-2’ 20.09 м.д., С-4 43.83 м.д.), присутствуют сигналы, соответствующие изомерам 20a,b (С-2 – 94.55 м.д., С-3’- 171.20 м.д., С-2’ -22.30 м.д., С-4 – 47.85 м.д.), причем последние более интенсивны, что свидетельствует о преимущественном образовании соединений 20a,b, с кратной связью, сопряженной с илиденовым заместителем.
Реакции халконов 5-8, содержащих электронодонорные группы (4-N(Me)2С6Н4-, 4-OMeС6Н4-, Fu-) с ацетоуксусным эфиром не протекают, вероятно, из-за уменьшения частичного положительного заряда на реакционном центре (-центре).
Направление взаимодействия симметричных диенонов с ацетоуксусным эфиром (ацетилацетоном) определяется характером арилметиленовых фрагментов и может протекать через 1,5-дикетоновый интермедиат (аддукт конденсации Михаэля):
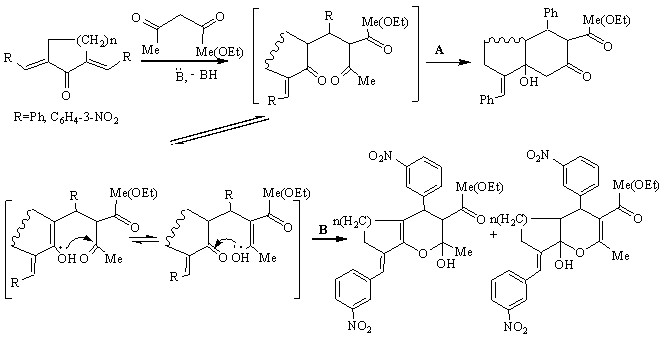
В случае фенилметиленовых заместителей имеет место внутримолекулярная альдолизация; продуктами реакции являются гидроксизамещенные пергидронафталин(индан)оны, -карбоксилаты (направление А). Введение электроноакцепторной нитро-группы в фенильное кольцо способствует енолизации, что приводит к реализации пути В и образованию продуктов гетероциклизации - гексагидроциклопента[b]пиран(хромен)карбоксилатов.
1.2 Реакции несимметричных диенонов
В несимметричных диенонах, в отличие от симметричных аналогов, для атаки С-нуклеофила появляются две «мишени» и возможность протекания реакций в альтернативных направлениях.
Реакции халконов 9-14 с ацетоуксусным эфиром и ацетилацетоном осуществлялись в тех же условиях, что и для симметричных аналогов 1-8 (диметилформамид, пиперидин, соотношение реагентов=1:2, выдерживание реакционной смеси в течение 7 суток).
Реакции диенонов 9,10 протекали региоселективно по фенилметиленовому фрагменту (по -центру) для соед. 10 и региоспецифично для циклопентанового аналога (9). В результате с высокими выходами (70-75%) были получены продукты карбоциклизации - пергидронафталин(индан)оны, -карбоксилаты 21-23. Минорные аддукты нуклеофильной атаки фурилметиленового ’-углеродного атома (соед. 21А, 22А) зарегистрированы при помощи ЯМР13С- спектров.
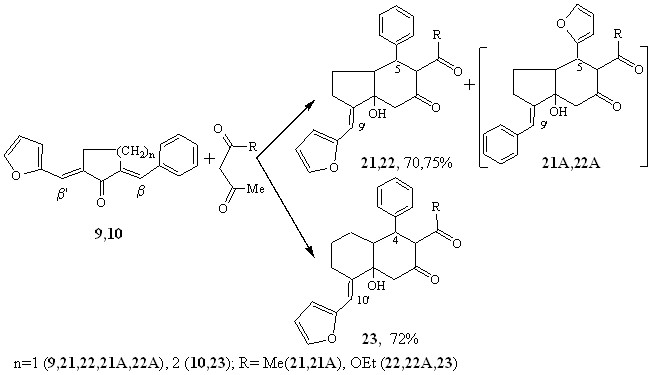
В спектрах ЯМР 13С сигналы атомов С-5 практически совпадают с аналогичными сигналами соединений 15, 16, 18 (49.91-50.95 м.д., ~0.2 - 0.5 м.д.), в отличие от резонансных сигналов атомов С-9’ (для соед. 21,22) и С-10’(для соед. 23) (120.64 - 121.31 м.д.), отличающихся на ~ 12-13 м.д. (108.05 – 109.44 м.д. для соединений 15-18). В спектрах циклопентаноновых систем кроме того регистрируются так же ключевые сигналы атомов С-5(59.55, 60.21м.д.), С-9’(119.71-119.75м.д) изомеров 21А, 22А.
На основании данных ЯМР 13С-спектроскопии соединениям 21-23, 21А,22А приписано транс-сочленение циклов, аксиальное расположение гидроксильной группы и экваториальная ориентация остальных заместителей.
Реакции с ацетоуксусным эфиром диенонов 11-14, содержащих акцепторный нитрофенильный заместитель протекают региоселективно с участием последнего (по -центру).
Продуктами являлись смеси изомеров карбо- и гетероциклического строения: циклопента[b]пиран(хромен)- (25a-d) и инданон(нафталинон) карбоксилатов (24a-d) с преобладанием последних.
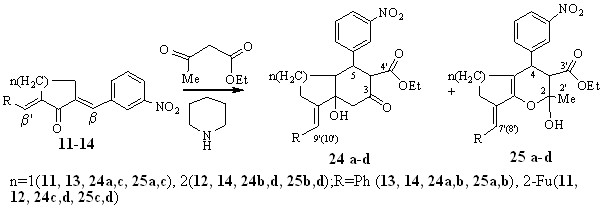
Таким образом, взаимодействие несимметричных халконов с ацетоуксусным эфиром в зависимости от строения ароматических заместителей протекает как карбо-, либо гетероциклизация.
2. Реакции гидроксизамещенных пергидронафталин(индан)онов,
-карбоксилатов
2.1 Превращения под действием кислот
С целью изучения свойств впервые синтезированных нами веществ исследована реакция дегидратации гидроксизамещенных пергидронафталин(индан)онов 15,16,21 и -карбоксилатов 17,18,22,23.
Наличие в данных соединениях атомов водорода в -положениях относительно гидроксильной группы предполагает возможность протекания реакции в двух альтернативных направлениях или их одновременной реализации.
Установлено, что во всех случаях при дегидратации протекает полная енолизация с участием оксогруппы алицикла. При этом в зависимости от размера аннелированного цикла образуются смеси изомеров 26a-d, 27a-d (для производных циклопентанона), отличающиеся положением двойных связей в цикле, либо индивидуальные соединения 28a-c (для производных циклогексанона).
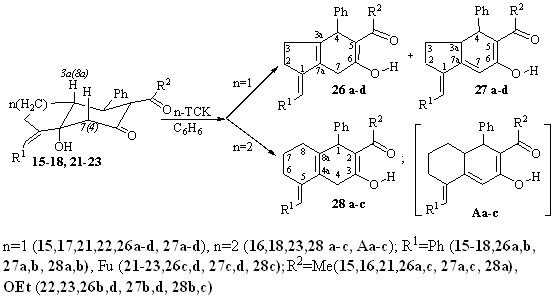
В спектрах ЯМР 1Н гидронафталинилэтанонов, -карбоксилатов 28 а-c наиболее характеристичными являются сигналы магнитнонеэквивалентных метиленовых протонов Н4 (3.23–3.40 м.д., 1На, д. и 3.51–3.54 м.д., 1Не, д.), взаимодействующих с КССВ 20.5–22.2 Гц, присутствуют также сигналы винильных протонов илиденового заместителя (6.31–6.52 м.д., 1Н, с.), енольной гидроксильной группы (12.25–16.01 м.д.,1Н, с.), протонов бензильного типа Н1 (4.11–4.37 м.д., 1Н, с.).
В спектрах изомерных смесей, наряду с сигналами протонов изомеров 26 а-d Н7 (1На 2.76–3.21 м.д., д. и 1Не 2.83–3.37 м.д., д. J 19.2–22.2 Гц.), Н4 (4.09–4.15 м.д., 1Н, с.), енольных протонов (11.06- 16.51м.д., 1Н, с.), присутствуют сигналы, соответствующие изомерам 27 а-d: синглет протона Н7 (6.48–6.90 м.д., 1Н), дублет протонов Н4 (3.98–4.18 м.д., 1Н, J 8.5–8.8 Гц), синглет протона ОН-группы (11.52-16.72 м.д., 1Н).
Для объяснения направления дегидратации и причины енолизации нами проведен расчет теплот образования предполагаемых интермедиатов (В, С), соединений 26 а-d, 27 а-d, 28 а-c, А а-c (МОРАС, РМ3).
Для бициклодеканонов термодинамически наиболее выгодным оказалось образование интермедиатов В (n=2, Нf (В-С) = 2.3–3.75 ккал/моль), для бициклононанов образование интермедиатов В и С равновероятно (n=1, Нf (В-С) = 1.0–1.1 ккал/моль).
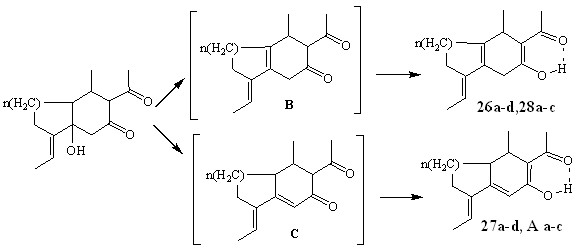
Енолизация приводит к выигрышу в энергии на 2.7–6 ккал/моль, вероятно за счет образования ВВС.
Для гидронафталинилэтанона 28а и -карбоксилата 28c были проведены рентгеноструктурные исследования (рис. 2.1.1, 2.1.2, нумерация автономная).
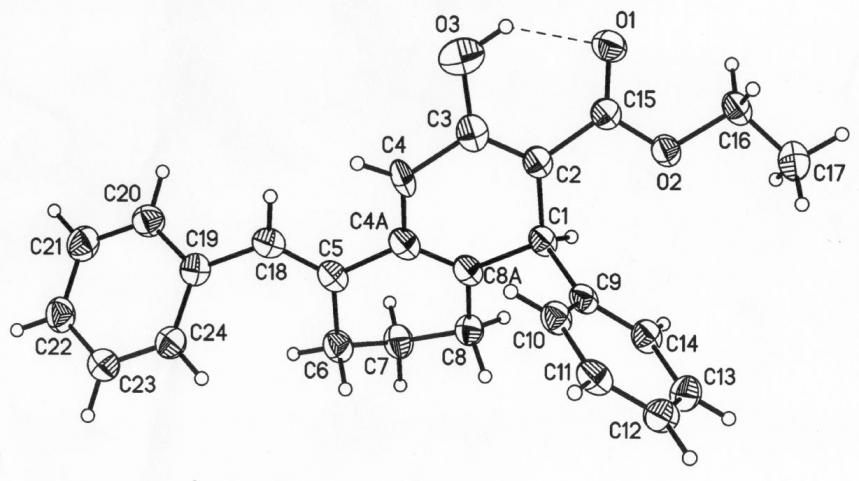
Рис.2.1.1 Общий вид молекулы 1-(5-фенилметилен-3-гидрокси-1-фенил-1,4,5,6,7,8-гексагидронафталин-2-ил)этанона (28b) (по данным РСтА).

