Синтез, строение и свойства пери- оксизамещенных карбонильных производных аценафтена и аценафтилена
На правах рукописи
Безуглов Артур Николаевич
СИНТЕЗ, СТРОЕНИЕ И СВОЙСТВА пери-ОКСИЗАМЕЩЕННЫХ КАРБОНИЛЬНЫХ ПРОИЗВОДНЫХ АЦЕНАФТЕНА И АЦЕНАФТИЛЕНА
02.00.03 – органическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Ростов-на-Дону – 2010
Работа выполнена в НИИ Физической и органической химии Южного федерального университета.
Научный руководитель: доктор химических наук, профессор
Межерицкий Валерий Владимирович
Официальные оппоненты: доктор химических наук, профессор
Озерянский Валерий Анатольевич
кандидат химических наук,
старший научный сотрудник ЮНЦ РАН
Бичеров Александр Викторович
Ведущая организация: Кубанский государственный технологический университет.
Защита состоится “11” июня 2010 года в 14.00 часов на заседании диссертационного совета Д 212.208.14 в НИИ физической и органической химии ЮФУ по адресу: 344090 г. Ростов-на-Дону, пр. Стачки, 194/2, конференц-зал.
С диссертацией можно ознакомиться в научной библиотеке Южного федерального университета (344006, г. Ростов-на-Дону, ул. Пушкинская, 148)
Автореферат разослан “____” мая 2010 года.
Ученый секретарь

диссертационного совета,
доктор химических наук, профессор Морковник А.С.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Как известно, орто-замещенные карбонильные производные бензольного ряда играют важную роль в синтезе орто-аннелированных гетероциклов. Ароматические пери-замещенные альдегиды, кетоны и карбоновые кислоты также являются универсальными предшественниками пери-аннелированных гетероциклических систем. Вместе с тем, они могут выступать в качестве уникальных моделей для изучения так называемых «пери-эффектов» (см. ниже).
Сказанное, в основном относится к производным нафталина, тогда как пери-замещенные карбонильные производные аценафтена и аценафтилена практически не исследовались. Появление биметиленового «мостика» в пери-положениях противоположных гидроксикарбонильной группировке существенным образом меняет геометрию этой группировки и нафталинового фрагмента, что приводит к изменению конформаций пери-расположенных заместителей и их химического поведения в реакциях гетероциклизации.
Помимо этого, пери-гидроксикарбонильные производные аценафтена интересны как потенциальные предшественники пери-гидроксикарбонильных производных аценафтилена, качественное отличие которых состоит в появлении сопряжения пери-заместителей через -систему нафталинового ядра. Последние важны как исходные вещества для синтеза теоретически возможных пери-аннелированных гетероциклов с замкнутым ароматическим контуром.
Таким образом, актуальность работы в теоретическом плане состоит в получении новых знаний о синтезе, строении и свойствах пери-оксикарбонильных производных аценафтена и аценафтилена, а в практическом – в получении принципиально новых соединений с потенциально полезными свойствами на их основе.
Цель исследования. Цель данного исследования состояла в разработке новых методов синтеза пери-гидроксизамещенных альдегидов и кетонов аценафтенового и аценафтиленового ряда, а также их производных и изучении строения и химических превращений полученных соединений.
Научная новизна.
- Найдены синтетические подходы к получению первых представителей пери-гидрокси- и пери-метоксизамещенных альдегидов и кетонов аценафтенового и аценафтиленового ряда.
- С помощью спектральных (ИК, УФ, ЯМР 1Н), рентгенодифракционных исследований, а также расчетных методов проведен конформационный анализ пери-гидрокси- и пери-метоксизамещенных альдегидов, их азометинов и кетонов аценафтенового и аценафтиленового ряда; изучен характер и специфика внутримолекулярных взаимодействий между пери-расположенными заместителями в сопоставлении с аналогично замещенными производными нафталина.
- Осуществлены реакции конденсации и гетероциклизации синтезированных соединений; получены новые пери-аннелированные гетероциклические системы на ядре аценафтена и аценафтилена.
Практическая значимость. Большинство изученных реакций имеет препаративную значимость и позволяет синтезировать ранее неизвестные пери-замещенные карбонильные соединения и пери-аннелированные гетероциклические системы на основе аценафтена и аценафтилена, являющиеся интересными объектами для физико-химических исследований и поиска свойств, полезных для практического применения.
Апробация работы и публикации. Основные результаты работы представлены на IV Международной конференции по новым технологиям и приложениям современных физико-химических методов, Ростов-на-Дону, 2007 г., X Молодежной конференции по органической химии, Уфа, 2007 г., IX Международном семинаре по магнитному резонансу (спектроскопия, томография и экология), Ростов-на-Дону, 2008 г., V Международной конференции по новым технологиям и приложениям современных физико-химических методов, Ростов-на-Дону, 2009 г.
По материалам диссертации опубликовано 5 статей и 6 тезисов докладов.
Объем и структура работы. Диссертационная работа состоит из введения, 3-х глав, выводов, списка цитируемой литературы и приложения. В первой главе представлены сведения об общих методах синтеза и реакциях гетероциклизации пери-оксизамещенных карбонильных производных нафталина. Вторая глава содержит результаты собственных исследований автора. Третья глава– экспериментальная часть.
Работа изложена на 117 страницах машинописного текста, содержит 9 таблиц, 65 схем и 13 рисунков. Библиография насчитывает 132 наименования.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
- Синтез пери-гидроксикарбонильных производных аценафтена
Для удобства изложения и комментирования табличных материалов и рисунков на схеме 1 приведены ключевые соединения.
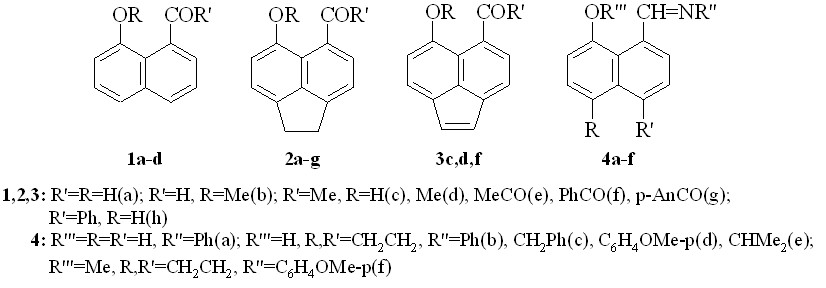
Схема 1
К началу наших исследований были описаны, полученные ранее в нашей лаборатории, лишь два пери-гидроксиаценафтеновых кетона 2с,h (схема 1), тогда как альдегид 2а не был известен.
Традиционный метод синтеза указанных соединений показан на схеме 2. Главным недостатком этого метода является необходимость повторения всей перечисленной последовательности превращений для каждого из целевых аценафтенонов. Кроме того, этим путем не удается получить пери-гидроксиаценафтальдегид 2а.
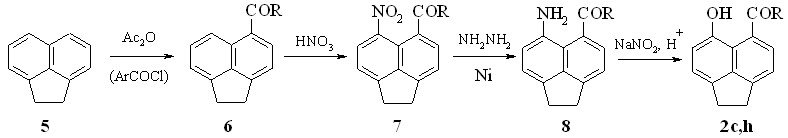
Схема 2
В настоящей работе нами предложен универсальный путь (схема 3), который состоит в кислотнокатализируемом ацилировании (формилировании) сложных эфиров 5-гидроксиаценафтена 10. Использование сложных эфиров необходимо для избежания орто-ацилирования по отношению к гидроксигруппе. При этом продукты реакции получаются в виде смеси изомеров О-ацилированных кетонов и альдегидов 11, которые могут быть разделены после расщепления сложноэфирной группы. Этим путем были выделены целевые пери-гидроксиальдегид 2а и кетоны 2с,h.
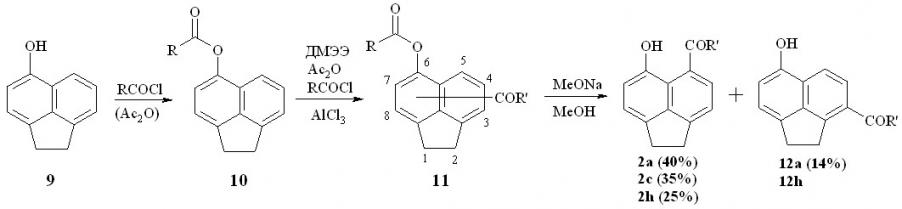 Схема 3
Схема 3
В случае формилирования и бензоилирования, помимо пери-гидроксиальдегида 2а и кетона 2h удалось выделить другие изомеры, которым на основании спектральных данных считаем возможным приписать структуру 3-замещенного 6-гидроксиаценафтена 12a,h. Изомеры 2a,h и 12a,h отличаются наличием у первых и отсутствием у вторых внутримолекулярной водородной связи, что отражается на положении сигнала протона гидроксигруппы в спектрах ЯМР 1Н. У соединений 2a,h это слабопольный сигнал в области 10-11.5 м.д., а у 3-изомеров 12а,h – в районе 5-5.5 м.д. Из продуктов ацетилирования в индивидуальном состоянии удалось выделить лишь пери-гидроксиацетил-аценафтен 2с.
- Синтез 5-ацетил-6-гидроксиаценафтилена
Синтез 5-ацетил-6-гидроксиаценафтилена 3с – первого представителя неизвестного класса пери-гидроксиацилаценафтиленов осуществлялся путем дегидрирования хлоранилом 5-ацетил-6-бензоилоксиаценафтена 2f (схем 4). В результате превращения образуется смесь исходного 2f и дегидрированного 3f соединений, которые могут быть разделены колоночной хроматографией после расщепления сложноэфирной группы.
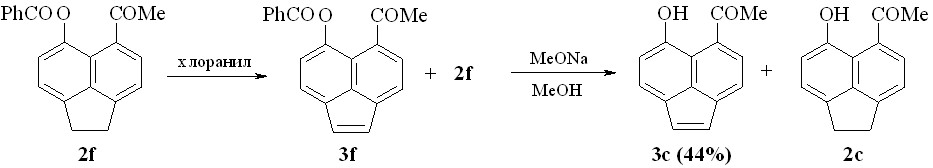
Схема 4
В спектре ЯМР 1Н аценафтенового производного 2с биметиленовому звену соответствует четырехпротонный центросимметричный мультиплет с центром при 3.4 м.д., который исчезает, а вместо него появляются два однопротонных дублета (6.82 и 7.20 м.д.) с малой КССВ (5.13 Гц) при переходе к аценафтиленовому пери-гидроксикетону 3с.
- Типы внутримолекулярных взаимодействий в пери-гидрокси- и
пери-метоксикарбонильных соединениях
Как было сказано выше, пери-гидрокси- и пери-метоксизамещенные карбонильные соединения могут выступать в качестве моделей для изучения «пери-эффектов» (водородные связи, электрофил-нуклеофильные взаимодействия, существующие между пери-расположенными заместителями). Знание особенностей конформационного строения пери-замещенной карбонильной группировки и сущности «пери-эффектов» важно при изучении реакционной способности и прогнозировании свойств и химических превращений этих соединений.
На схеме 5 и далее впервые собраны и проанализированы нами в рамках единой концепции возможные типы внутримолекулярных пери-взаимодействий рассматриваемого здесь класса пери-гидроксизамещенных карбонильных соединений.
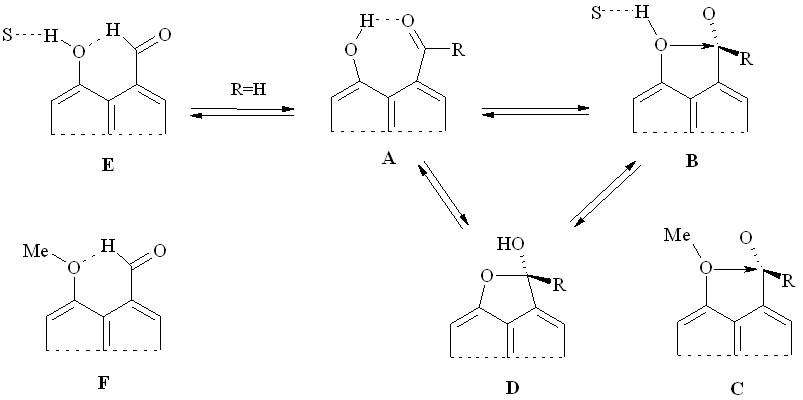
Схема 5
Модель А – это классическая внутримолекулярная водородная связь (ВВС). При разрыве этой связи под действием полярных растворителей S возникает внутримолекулярное аттрактивное электрофил-нуклеофильное взаимодействие пери-расположенных заместителей (модель В). Этот эффект в качестве единственно возможного реализуется также в пери-метоксизакрепленной модели С и может рассматриваться как начальная фаза присоединения О-нуклеофила к карбонильной группе. Оба типа взаимодействий, как А, так и B могут быть движущей силой реакции, приводящей к замыканию пятизвенного гетероцикла D, моделируя собой кислотный или основный катализ при взаимодействии карбонильной группы с нуклеофилами. Если в качестве карбонильной функции выступает альдегидная группа, возможен еще один из «пери-эффектов» Е или F. Этот тип взаимодействия можно рассматривать как разновидность слабой ВВС.
В целях изучения влияния этиленового и винильного мостика на характер и прочность взаимодействий между пери-расположенными заместителями нами были проведены спектральные (ИК, УФ, ЯМР 1Н), рентгенодифракционные и квантово-химические исследования синтезированных нами пери-гидрокси-, пери-метоксизамещенных кетонов, альдегидов и их азометинов аценафтенового и аценафтиленового ряда 2a-d, 3с,d, 4b-f в сопоставлении с описанными ранее соответствующими производными нафталинового ряда 1a-d, 4a (схема 1).
- Внутримолекулярная водородная связь
- Данные ИК спектроскопии
О наличии и прочности внутримолекулярной водородной связи в пери-гидроксизамещенных альдегидах и кетонах можно судить по характеру изменений полосы валентных колебаний карбонильной группы (С=О) в ИК спектрах их растворов в различных растворителях (табл. 1). Полученные результаты не следует отождествлять с данными другой экспериментальной оценки силы водородной связи, основанной на корреляциях между положением, шириной и интенсивностью полосы колебаний гидроксигруппы, однако с помощью используемого в настоящей работе метода можно достаточно достоверно судить об относительной склонности к разрыву ВВС в ряду однотипных соединений а значит, косвенно, и о прочности ВВС. Описываемая ниже методология применяемых в данной работе спектральных исследований предложена в работах: Packer R.J., Smith D.C.C. J. Chem. Soc. C. 1967, 2194 и Berry D., Smith D.C.C. J. Chem. Soc. Perkin Trans. I. 1972, 699. В рамках этой методологии во избежание ассоциации молекул субстрата за счет образования межмолекулярных водородных связей все измерения ИК спектров проводились при низкой, но одинаковой концентрации изучаемых объектов (0.5%).
Как следует из табл. 1, в ИК спектре раствора пери-гидроксинафтальдегида 1а в таком малоосновном растворителе как хлороформ, проявляется лишь одна полоса при 1660 см-1, тогда как в растворе более полярного и основного тетрагидрофурана, в результате установления динамического равновесия между ВВС- и МВС-конформерами (схема 5, A и Е), присутствуют две карбонильные полосы при 1660 и 1680 см-1.
Таблица 1. Положение полос C=O и OH в ИК спектрах растворов
пери-замещенных альдегидов и кетонов а.
| № соединения | R1 | R2 | Растворитель, фаза | 1-C=O,б см-1 | 8-OH, см-1 |
| 1а | ОН | CHO | CHCl3 | 1660 (а) | 2770 |
| ТГФ | 1660 (а) 1680 (b) a:b=~2:1 | 3150 | |||
| 1b | ОМе | CHO | CHCl3 | 1680 (b) | |
| 2а | ОН | CHO | Вазелиновое масло | 1660 (a) | |
| CHCl3 | 1660 (a) | 2500 | |||
| ТГФ | 1660 (a) | 2980 | |||
| 2b | ОМе | CHO | Вазелиновое масло | 1670 | |
| 1с | ОН | COMe | CCl4 | 1660 (a) 1694 (b) a:b = 6:1 | 3100 |
| CHCl3 | 1660 (a) 1698 (b) a:b = 3:1 | 3200 | |||
| ТГФ | нет (a) 1708 (b) | 3300 | |||
| 1d | ОМе | COMe | CHCl3 | 1696 | |
| 2с | ОН | COMe | Вазелиновое масло | 1635 (a) нет (b) | 2713 |
| CCl4 | 1640 (a) нет (b) | ||||
| ТГФ | 1640 (a) 1700 (b) a:b = 7:1 | ||||
| 2d | ОМе | COMe | Вазелиновое масло | 1700 | |
| CCl4 | 1693 | ||||
| ТГФ | 1700 | ||||
| 3с | ОН | COMe | Вазелиновое масло | 1635 (a) нет (b) | 2630 |
| CCl4 | 1640 (a) нет (b) | ||||
| ТГФ | 1640 (a) 1700 (b) a:b = 7:1 | ||||
| 3d | ОМе | COMe | Вазелиновое масло | 1695 | |
| CCl4 | 1700 | ||||
| ТГФ | 1700 |
Примечание:
а Измерения проводились для 0.5%-ных растворов при толщине слоя 1мм.
б a – низкочастотная полоса, b –высокочастотная полоса, a : b – отношение высоты пиков.
Низкочастотная полоса а (1660 см-1) принадлежит альдегидной группе, участвующей в образовании ВВС (форма А), а высокочастотная (b) – форме Е, участвующей в образовании МВС субстрата с растворителем (схема 5). Значение высокочастотной полосы совпадает с таковым для пери-метоксинафтальдегида 1b (табл. 1), что может быть связано с существованием последнего и МВС-формы пери-гидроксинафтальдегида в конформациях E и F. Относительное содержание конформеров А:Е (для пери-гидроксиальдегидов) и А:B (для пери-гидроксикетонов) в растворах определяется соотношением интенсивностей низкочастотной (а) и высокочастотной (b) полос колебаний. Внутри ряда однотипных соединений при их одинаковой концентрации и в одинаковых условиях соотношение a:b позволяет на качественном уровне оценить прочность ВВС: чем больше доля ВВС-конформера А в полярном растворителе тем устойчивее к разрыву ВВС.
По этому показателю ВВС в пери-гидроксинафтальдегиде 1а (a:b = 2:1, в ТГФ) значительно прочнее, чем в пери-гидроксинафтилметилкетоне 1с (a:b = 0:1, в ТГФ). Показательно и то, что ВВС в кетоне 1с претерпевает раскрытие даже в таких инертных (не основных) растворителях, как четыреххлористый углерод (a:b = 6:1) и хлороформ (a:b = 3:1).
Биметиленовый или винильный мостик способствует упрочению ВВС. Так, у аценафтенового пери-гидроксиальдегида 2а как в конденсированной фазе (вазелиновое масло), так и в растворах (CHCl3, ТГФ) присутствует только низкочастотная полоса при 1660 см-1. У аценафтенового 2с и аценафтиленового 3с пери-гидроксиметилкетонов в конденсированной фазе (вазелиновое масло) и в растворе четыреххлористого углерода также присутствует только низкочастотная полоса при 1635-1640 см-1, а в растворе тетрагидрофурана разрыв семичленного Н-цикла происходит лишь у ~10-12% молекул (a : b = 7 : 1), что сопровождается появлением слабоинтенсивной высокочастотной полосы при 1700 см-1.
Частота валентных колебаний пери-гидроксигруппы тоже чувствительна к прочности ВВС-конформера и содержанию его в равновесной смеси конформеров А и B или A и E. Чем прочнее семичленный Н-цикл и чем выше содержание конформера А (схема 5) в растворе при прочих равных условиях, тем ниже значение волнового числа ОН (табл. 1).
- Данные УФ спектроскопии
В УФ спектрах положение длинноволновой полосы тоже зависит от основности растворителя и относительного содержания ВВС-конформера (табл. 2).
При переходе от инертного четыреххлористого углерода к высокоосновному тетрагидрофурану как у пери-гидроксинафтальдегида 1а, так и у пери-гидроксинафтилметилкетона 1с происходит гипсохромный сдвиг от 394 до 350 нм и от 372 до 324 нм соответственно. Несмотря на то, что максимумы длинноволновой полосы поглощения этих соединений лежат ниже 400 нм, их растворы в четыреххлористом углероде окрашены в интенсивный оранжевый цвет, поскольку поглощение продолжается и выше этой отметки. Причем окраска пери-гидроксикетона 1с обусловлена наличием ВВС-конформера А, тогда как МВС-конформер B бесцветен. Раствор альдегида 1а в тетрагидрофуране остается окрашенным из-за того, что разрыв ВВС претерпевает ~ 30% молекул, тогда как в случае пери-гидроксикетона 1с происходит полная замена ВВС-конформера А МВС-конформером B.
Таблица 2. Положение длинноволновой полосы поглощения в УФ спектрах
пери- замещенных нафтальдегидов и нафтилкетонов.
| № соединения | R1 | R2 | Растворитель | макс., нм (lg ) | Цвет |
| 1а | OH | CHO | CCl4 | 394 (3.52) | оранжевый |
| ТГФ | 350 (3.45) | оранжевый | |||
| 1b | OMe | CHO | EtOH | 330 (3.63) | бесцветный |
| 2а | OH | CHO | CCl4 | 414 (3.71) | красный |
| ТГФ | 406 (3.71) | красный | |||
| 2b | OMe | CHO | CCl4 | 350 (3.70) | кремовый |
| ТГФ | 360 (3.81) | кремовый | |||
| 1с | OH | COMe | CCl4 | 372 (3.37) | желтый |
| ТГФ | 324 (3.58) | бесцветный | |||
| 1d | OMe | COMe | CHCl3 | 330 (3.70) | бесцветный |
| 2с | OH | COMe | CCl4 | 405 (3.45) 500 (1.95) | красный |
| ТГФ | 399 (3.56) 500 (2.21) | красный | |||
| 2d | OMe | COMe | MeCN | 333 (3.82) | бесцветный |
| 3с | OH | COMe | CCl4 | 378 (3.40) 503 (2.90) | красный |
| ТГФ | 374 (3.49) 417 (3.23) 500 (2.70) | красный | |||
| MeCN | 374 (3.70) 483 (2.78) | красный | |||
| 3d | OMe | COMe | MeCN | 356 (3.72) 400 (3.08) 500 (2.08) | желтый |
Как можно видеть в табл. 2, положение длинноволновой полосы в УФ спектрах аценафтенового пери-гидроксиальдегида 2а и пери-гидроксикетона 2с, (макс. 414 и 405 нм в четыреххлористом углероде и 406 и 399 нм в тетрагидрофуране, соответственно) практически одинаково, что находится в согласии с относительным содержанием (по данным ИК спектроскопии, табл.1) ВВС-конформера А в этих растворах: 100 и 100% для альдегида 2а и 100 и ~ 88-90% для кетона 2с соответственно.
Растворы соединений 2а,с в четыреххлористом углероде и в тетрагидрофуране имеют интенсивный красный цвет, поскольку поглощение света на 500 нм отличается от нулевого (lg 2). Батохромный сдвиг максимума длинноволновой полосы аценафтенового пери-гидроксиальдегида 2а и пери-гидроксикетона 2с по сравнению с аналогичными производными нафталина 1а, с составляет в четыреххлористом углероде ~ 20 и 30 нм, а в тетрагидрофуране ~ 60 и 70 нм соответственно, что подтверждает вывод, сделанный на основании анализа данных ИК спектроскопии, о более прочной ВВС при наличии биметиленового звена в пери-положениях, противоположных пери-гидроксикарбонильной группировке.
Картина УФ спектров аценафтиленового пери-гидроксикетона 3с имеет существенные отличия от нафталинового и аценафтенового пери-гидроксикетонов. Максимум самой длинноволновой полосы сдвигается к ~500 нм. Правда, интенсивность этой полосы (lg 2.90 в CCl4 и 2.70 в ТГФ) значительно меньше, чем у наиболее длинноволновой полосы (в области 400 нм) аценафтенового пери-гидроксикетона 2с (табл. 2). В растворе в тетрагидрофуране в виде инфлексии появлятся полоса при ~420 нм. Поглощение завершается в районе ~600 нм. Наблюдаемые изменения, безусловно, связаны с наличием винильной цепочки, позволяющей вступать пери-заместителям в сопряжение через -систему нафталинового ядра (схема 6).

Схема 6
Как уже отмечалось, в соответствии с данными ИК спектроскопии (табл. 1), ВВС в молекуле 3с прочнее, чем у пери-гидроксинафтилметилкетона 1с, и примерно такая же, как у аценафтенового пери-гидроксикетона 2с.
- Данные ЯМР 1Н спектроскопии
Нами были рассмотрены значения химических сдвигов протонов в спектрах ЯМР 1Н групп OH, CH=O, CH=N, участвующих в образовании водородной связи.
Обычные водородные связи приводят, как правило, к увеличению химсдвига протона в следствие дезэкранирования. Хотя степень экранирования в спектре ЯМР 1H не отражает строго величину энергии водородной связи, тем не менее, в ряду однотипно построенных соединений значение химического сдвига протона, участвующего в образовании ВВС позволяет на качественном уровне судить об относительной прочности этой связи.
В спектрах ЯМР 1Н (табл. 3) пери-гидроксинафтальдегида 1а химический сдвиг протона пери-гидроксигруппы (11.60 м.д.) практически совпадает с таковым (11.50 м.д.) у его аценафтенового аналога 2а. Однако, по-видимому, не следует трактовать эти данные как признак одинаковой прочности ВВС. Как показано выше, более прочной (по сравнению с альдегидом 1а) ВВС отличается аценафтеновый альдегид 2а, что также подтверждается рассчитанными нами величинами энергии ее разрыва, составляющими 9 и 13 ккал/моль соответственно. В спектре пери-гидроксинафтальдегида 1а в ТГФ наблюдаются слабопольное смещение сигнала протона формильной группы (от 9.76 в CDCl3 до 10.39 м.д. в ТГФ) и сильнопольное – протона группы O-H (от 11.60 в CDCl3 до 10.72 м.д. в ТГФ), что связано с переходом ~30% молекул (по данным ИК-спектроскопии, табл. 1) из ВВС-формы А в МВС-форму Е.
Таблица 3. Химические сдвиги протонов в спектрах ЯМР 1Н пери-окси-
замещенных альдегидов и азометинов (в CDCl3)
| № соединения | R1 | R2 | Другие заместители | 1-CHO, м.д. | 1-CHNR, м.д. | 8-OH, м.д. |
| 1а | ОН | CHO | 9.76 | 11.60 | ||
| 10.39 (ТГФ) | 10.72 | |||||
| 1b | OMe | CHO | 11.03 | |||
| 2а | ОН | CHO | 4-CH2CH2-5 | 9.80 | 11.50 | |
| 2b | ОМе | CHO | 4-CH2CH2-5 | 11.20 | ||
| 4а | ОН | СНNPh | 8.54 | 14.00 | ||
| 4b | ОН | СНNPh | 4-CH2CH2-5 | 8.60 | 14.60 | |
| 4с | ОН | СНNCH2Ph | 4-CH2CH2-5 | 8.30 | 14.70 | |
| 4d | ОН | СНNC6H4OMe-п | 4-CH2CH2-5 | 8.56 | 14.83 | |
| 4f | ОМе | СНNC6H4OMe-п | 4-CH2CH2-5 | 9.75 | ||
| 4е | ОН | СНNCHMe2 | 4-CH2CH2-5 | 8.25 | 15.10 |
Судя по разнице величин слабопольного смещения (OH,азометины – OH,альдегиды = 2.5-3.5 м.д., табл. 3), при переходе от пери-гидроксиальдегидов 1а, 2а к пери-гидроксиазометинам 4а-е происходит существенное упрочение ВВС. Кроме того в ряду аценафтеновых азометинов 4b-e прослеживается упрочение ВВС с ростом основности иминного атома азота, что сопровождается слабопольным смещением сигнала протона гидроксигруппы.
Таким образом, из представленного выше анализа данных спектроскопии ЯМР 1Н, можно заключить, что прочность ВВС в ряду обсуждаемых пери-гидроксисоединений зависит как от основности атома-акцептора Х, так и от наличия или отсутствия биметиленового звена, что находится в соответствии с данными ИК и УФ спектроскопии.
Таблица 4. Химические сдвиги протонов в спектрах ЯМР 1Н пери-замещенных
метилнафтилкетонов
| № соединения | R1 | R2 | Другие заместители | Растворитель | 1-MeCO, м.д. | 8-OH, м.д. |
| 1с | OH | MeCO | CCl4 | 2.40 | 11.50 | |
| 1d | OMe | MeCO | CDCl3 | 2.15 | ||
| 2с | OH | MeCO | 4-CH2CH2 -5 | CDCl3 | 2.80 | 11.60 |
| 2d | OMe | MeCO | 4-CH2CH2 -5 | CDCl3 | 2.55 | |
| 3с | OH | MeCO | 4-CH=CH -5 | CDCl3 | 2.90 | 12.90 |
| ДМСО-d6 | 2.60 | 11.50 | ||||
| 3d | OMe | MeCO | 4-CH=CH -5 | CDCl3 | 2.65 |
В ряду пери-гидроксикетонов при переходе от пери-гидроксинафтил-метилкетона 1с к аценафтеновому 2с и далее к аценафтиленовому производному 3с слабопольный сдвиг сигнала протона гидроксигруппы также указывает на возрастание прочности ВВС (табл. 4).
Вывод о возрастании прочности ВВС в ряду 1с2с3с, вытекающий из анализа спектров ЯМР 1Н, в принципе совпадает с таковым, сделанным на основании анализа их ИК спектров в растворах.
- Данные рентгено-дифракционных исследований
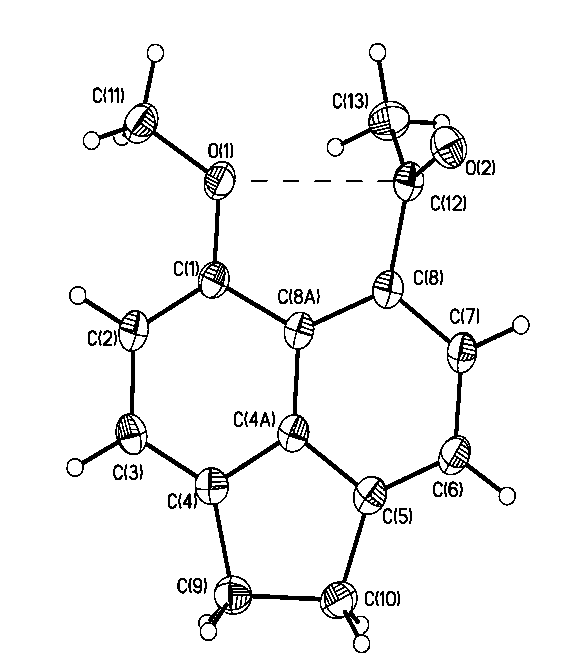
Согласно данным РСА в молекулах аценафтенового пери-гидроксиальдегида 2а, пери-гидроксикетона 2с и пери-гидроксиазометина 4с атом водорода гидроксигруппы вовлечен в образование внутримолекулярной водородной связи с замыканием плоского семичленного Н-связанного цикла. Молекулы характеризуются приближенной Cs симметрией с незначительным отклонением семичленного Н-цикла и аценафтенового ядра, которые почти копланарны. Торсионные углы O2C11C8C8A 2а, O2C13C10C12 2с и N1C13C10C12 4с составляют – 3.0, 4.2 и 3.9 град, соответственно. Угол при атоме водорода близок к развернутому (172.8 2a 165.0 град 2с, 170.67 град. 4с), что является характерной особенностью семичленных Н-связанных циклов по сравнению с шестичленными (аналогичный угол в шестичленном Н-цикле молекулы 2-гидрокси-1-нафтальдегида, составляет 148.90 град).
Одним из показателей прочности ВВС считается расстояние между двумя электроотрицательными атомами, участвующими в образовании этой связи. Расстояния O1O2 у альдегида 2а, кетона 2с и O1N1 у азометина 4с по данным РСА составляют 2.587, 2.511 и 2.566, соответственно. Из этого следует, что наиболее прочная ВВС реализуется у кетона 2c, затем идет азометин 4с и далее альдегид 2a. Такая последовательность несколько не совпадает с данными, полученными при анализе спектров ИК, УФ и ЯМР 1Н, из которых следует, что наиболее прочной ВВС в растворах при прочих равных условиях обладают пери-гидроксизамещенные азометины, затем следуют альдегиды и кетоны. Наблюдаемое несоответствие, по-видимому, обусловлено стерическими факторами, а именно отталкиванием метильной группы и атома водорода в орто-положении в кристаллах.
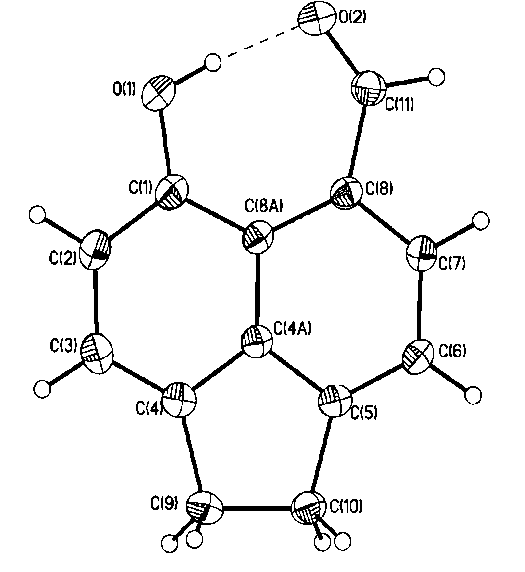
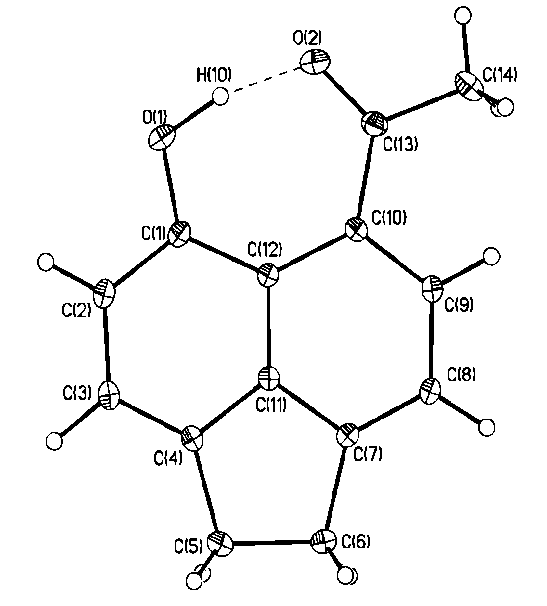

2а 2с 4с
Рис. 1. Общий вид соединений 2а,с и 4с в представлении атомов тепловыми
эллипсоидами колебаний (p=50%)
Таблица 5 Избранные валентные углы (град) и несвязевые расстояния ()
по данным РСА и квантовохимического расчета (в фигурных скобках)
| Углы, град | 2а | 2с | 4с | Расстояния | 2а | 2с | 4с |
| C1C8АC8 | 130.1(1) {129.9} | O1O2 | 2.587(2) {2.592} | 2.511(1) {2.531} | |||
| C1C12C10 | 131.29(5) {130.8} | 130.01 | O1N1 | 2.566 | |||
| C4C4АC5 | 111.2(1) {111.1} | O1C11 | 3.142(2) {3.152} | ||||
| C4C11C7 | 110.34(4) {110.4} | 111.11 | O1C13 | 3.181(1) {3.188} | 3.168 | ||
| O2C11C8C8А | 3 | C1C8 | 2.610(2) {2.616} | ||||
| O2C13C10C12 | 4.2 | C1C10 | 2.639(1) {2.642} | 2.614 | |||
| N1C13C10C12 | 3.9 | C4C5 | 2.333 {2.331} | ||||
| C4C7 | 2.320(1) {2.324} | 2.334 |
Значения валентных углов в нафталиновом ядре и примыкающих к нему углов в пятичленном карбоцикле и семичленном Н-цикле существенно отклоняются от значений в 120 град., что приводит к изменениям несвязевых расстояний между пери-расположенными атомами углерода C1–C8 и C4–C5 в соединении 2а, C1–C10 и C4–C7 в соединениях 2с и 4с. Эта «принудительная» деформация валентных углов, возникающая благодаря «стягивающему» эффекту биметиленового звена, обеспечивает благоприятные условия для стабилизации семичленного Н-цикла при образовании ВВС.
Поскольку на настоящий момент не описано ни одной структуры пери-гидроксизамещенных карбонильных производных нафталина с ВВС-циклом, не имеющей такого мостика, как в молекулах 2а, 2с, 4с можно предположить, что семичленные Н-связанные циклы в кристаллическом состоянии для них не характерны.
При помощи квантовохимических расчетов методами теории функционала плотности B3LYP/6-31G** и B3LYP/6-311++G** были исследованы системы 1, 2, 3 (схема 1). Энергию водородных связей рассчитывали по барьеру разрыва.
Как показали расчеты, во всех пери-гидроксизамещенных альдегидах (1а-3а) и кетонах (1с-3с) реализуется прочная связь O-H…O с почти линейным углом при атоме водорода и энергией ~9-13 ккал/моль для молекул 1 и до 13-18 ккал/моль для систем 2, 3. Молекулы имеют Cs симметрию, кислородные центры сближены до ~2.5. В конформерах Е (схема 5, без учета влияния растворителя – S) пери-гидроксиальдегидов (1а-3а) формируются достаточно устойчивые системы с водородной связью O…H-C. При этом барьер обратного перехода составляет 5-7 ккал/моль (нижняя граница водородной связи) и растет от молекулы 1а к 2а и далее к 3а. На основании анализа спектральных данных (табл. 1-3), расчетов и выводов о влиянии геометрии (РСА) молекулы на склонность ВВС к разрыву в различных растворителях исследованные соединения могут быть расположены по мере уменьшения прочности ВВС в следующий ряд: 2а > 2с 3с > 1а > 1с.
- Внутримолекулярное аттрактивное электрофил-нуклеофильное взаимодействие
Сопоставление данных для структур 1d и 2d, приведенных на рис. 2, показывает почти совпадающие величины валентных углов Q1, Q2, Q4, Q5, что говорит об одинаковом направлении наклона связей в одну и ту же сторону, так называемый «эффект наклона» (leaning effect). Наблюдаемый эффект трактуется как моделирование начальной фазы присоединения нуклеофила к карбонильной группе (Schweizer W.B., Procter G., Kaftory M., Dunitz J.D. Helv. Chim. Acta. 1978, 61, 2783). Считается, что оптимальная величина угла Q7 приближения нуклеофила к двойной связи С=О составляет 95-105 град. В молекуле пери-метоксинафтилметилкетона 1d этот угол (Q7, 107.60 град) близок к оптимальному, тогда как у аценафтенового производного 2d он заметно больше (117.53 град), также, у сравниваемых соединений отличаются валентные углы (Q3 и Q6), что указывает на существенное внутриплоскостное искажение углеродного скелета нафталинового ядра и является причиной увеличения расстояния d1 (разница составляет 0.172 ). Приведенные данные указывают на более слабый аттрактивный характер электрофил-нуклеофильного взаимодействия у аценафтенового представителя 2d по сравнению с нафталиновым 1d. Об этом также свидетельствуют углы 1 разворота плоскости карбонильной группы относительно плоскости нафталинового ядра. Этот угол в молекуле соединения 1d составляет 75.0 град, а у соединения 2d – 60.8 град.
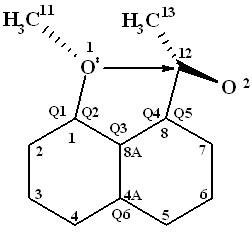
1d 2d
Рис. 2. Схематическое изображение соединения 1d и общий вид соединения 2d в
представлении атомов тепловыми эллипсоидами колебаний (p=50%)
Таблица 6. Некоторые структурные параметры, по данным РСА и квантово-
химического расчета (в фигурных скобках) пери-метоксикетонов 1d и 2d.
| Углы, град | 1d | 2d | Расстояние | 1d | 2d |
| Q1 | 124.49{123.8} | 124.51{124.1} | d1(O1…C12) | 2.607{2.644} | 2.778{2.822} |
| Q2 | 115.98{115.1} | 115.21{115.5} | d2(C1…C8) | 2.500{2.523} | 2.566{2.575} |
| Q3 | 121.78{123.4} | 127.57{128.0} | d3(C4…C5) | 2.495{2.472} | 2.333{2.334} |
| Q4 | 125.58{125.0} | 124.76{125.3} | d4(O1-C1) | 1.341 | 1.368{1.360} |
| Q5 | 115.38{115.3} | 116.56{115.7} | d5(C12-O2) | 1.228 | 1.215{1.217} |
| Q6 | 121.59{120.9} | 111.99{112.0} | d6(C12-C8) | 1.487 | 1.500{1.512} |
| Q7(O1C12O2) | 107.60{113.9} | 117.53{120.7} | |||
| 1(O2C12C8C7) | 75.0 {62.2} | 60.8 {55.5} | |||
| 2(C11O1C1C2) | ~2-3 | 17.7 {3.7} |
По данным расчета, несвязевые расстояния O…C=О составляют 2.644 для системы 1d и 2.822, 2.852 для систем 2d, 3d, что меньше длины ван-дер-ваальсового контакта кислород–углерод (~3 ). Рассчитанная энергия взаимодействия O…C=O не превышает 1.5 ккал/моль для систем 2d, 3d и составляет 3 ккал/моль для молекулы 1d. Таким образом, сила рассматриваемого внутримолекулярного аттрактивного кислород-углеродного взаимодействия уменьшается при переходе от структуры 1d к 2d и далее к 3d.
- Химические свойства пери-оксизамещенных альдегидов и кетонов
аценафтенового и аценафтиленового ряда
- Реакции конденсации пери-гидроксиаценафтальдегида с ацетофенонами, первичными аминами и малононитрилом
Пери-гидроксиаценафтальдегид 2а в условиях кислотного катализа (этилортоформиат – 70%-ная хлорная кислота) реагирует с метиларилкетонами с образованием перхлоратов 13, гидролиз которых приводит к халконам 14, которые, по данным спектров ЯМР 1Н, находятся в транс-конфигурации (JНa,Hb > 15 Гц). Судя по величине слабопольного сигнала протона Ha при двойной связи (~ 9.3 м.д.), можно предположить наличие ВВС, т.н. «слабого типа» (C-Ha…O) в этих соединениях (схема 7).
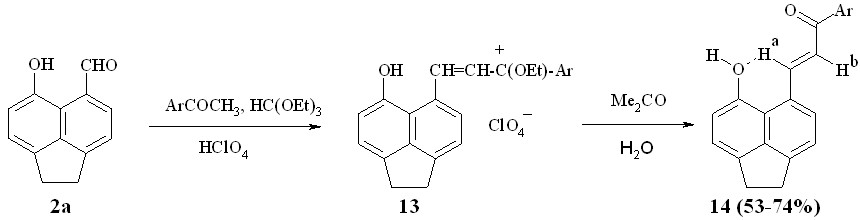
Схема 7
Пери-гидрокси- и пери-метоксиальдегиды 2а,b при взаимодействии с первичными аминами с хорошими выходами дают пери-гидроксиазометины 4b-f, при взаимодействии которых с малонодинитрилом образуются соответствующие аценафтилиденмалононитрилы 15 и 16. Эти же соединения могут быть получены и при непосредственном взаимодействии альдегидов 2а,b с малонодинитрилом в присутствии пиперидина. Метиновый протон в спектрах ЯМР 1Н соединений 15 и 16 проявляется при 9.22 и 9.35 м.д. соответственно, что с учетом окраски их растворов (макс. 430 и 420 нм), позволяет сделать предположение о копланарном (или близком к нему) расположении нафталинового ядра и фрагмента HC=C(CN)2 и о наличии ВВС «слабого типа». Интересно, что пери-метоксинафтилиден-малононитрил, у которого, по данным РСА, фрагмент HC=C(CN)2 развернут на 45о, имеет бледножелтую окраску (макс., 226 нм) и меньшее слабопольное смещение сигнала метинового протона в спектре ЯМР 1Н(9.05 м.д.).
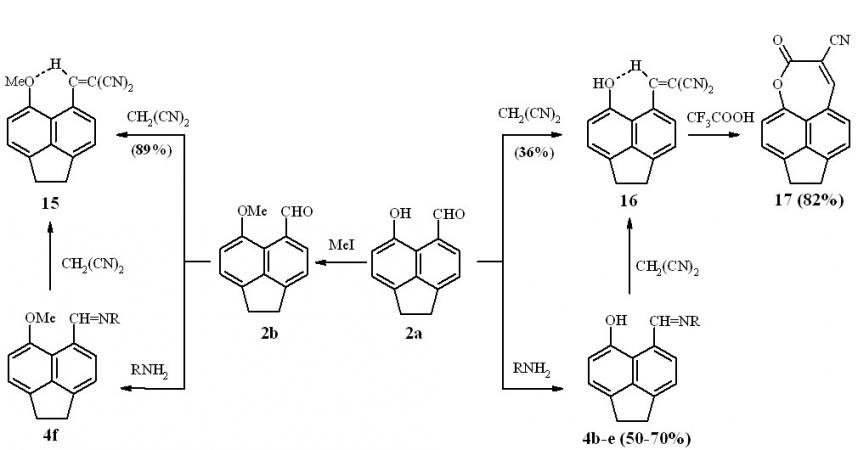
Схема 8
При кипячении пери-гидроксиаценафтилиденмалононитрила 16 в трифторуксусной кислоте образуется 3-цианоаценафтоксепинон 17. При этом, сигнал метинового протона в его спектре ЯМР 1Н претерпевает существенное сильнопольное смещение (7.60 м.д.) по сравнению с таковым у его пери-гидроксизамещенного предшественника 16 (9.35 м.д.), что является дополнительным подтверждением наличия у последнего аттрактивного взаимодействия типа C-H…O.
- Свойства пери-гидроксиацетилаценафтена
6.2.1. Реакции конденсации метильной группы с ароматическими альдегидами
При взаимодействии пери-гидроксиаценафтенилметилкетона 2с с ароматическими альдегидами в условиях кислотного (этилортоформиат – 70%-ная хлорная кислота) или щелочного катализа, в зависимости от природы заместителя в бензольном кольце альдегида образуются халконы или смеси с продуктами их гетероциклизации.
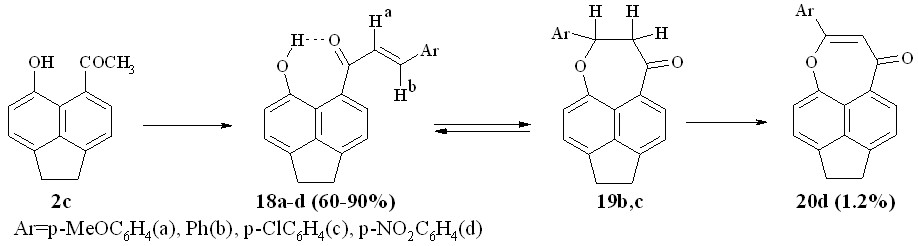
Схема 9
Так, индивидуальный халкон 18а образуется только при взаимодействии кетона 2с с анисовым альдегидом. При взаимодействии с бензальдегидом или п-хлорбензальдегидом в растворе образуются смеси халконов 18b,c и аценафтоксепинонов 19b,с в соотношении ~ 80:20 % (по спектрам ЯМР 1Н).
По данным спектров ЯМР 1Н, халконы 18а-с находится в транс-конфигурации (JНa,Hb > 15 Гц). Значение химсдвига протона гидроксигруппы халконов 18а-с в районе 10.5 м.д. в спектрах ЯМР 1Н свидетельствует о наличии у них ВВС.
Взаимодействие с п-нитробензальдегидом в щелочной среде приводит к аморфному трудно растворимому осадку, из которого удалось извлечь следовое количество аценафтоксепинона 20d – продукта дегидрирования соответствующего дигидропредшественника. В роли дегидрирующего агента, вероятно, выступает электрон-дефицитная молекула п-нитробензальдегида.
6.2.2. Реакции, приводящие к замыканию шестичленных гетероциклов
Ранее в работах сотрудников нашей лаборатории было показано, что пери-бромацетилацилоксинафталины являются перспективными исходными веществами для синтеза различных пери-аннелированных гетероциклов. Подобные свойства ожидались и от пери-бромацетилацилоксиаценафтенов.
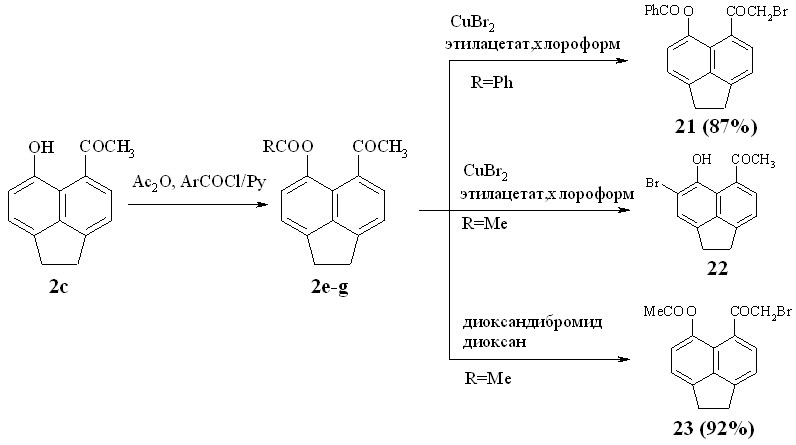
Схема 10
Ацилоксипроизводные 5-ацетил-6-гидроксиаценафтена 2e-g были получены путем О-ацилирования последнего уксусным ангидридом или хлорангидридами ароматических кислот в пиридине.
Бромирование двубромистой медью пери-бензоилоксикетона 2f приводит к ожидаемому бромкетону 21, тогда как в случае пери-ацетоксикетона 2е происходит расщепление сложноэфирной группы и бромирование в орто-положение по отношению к гидроксигруппе, что приводит к продукту 22. Пери-ацетоксибромкетон 23 был получен бромированием пери-ацетоксикетона 2е диоксандибромидом в диоксане.
Взаимодействие с пиперидином пери-ацилоксибромкетонов 21 и 23 в диоксане приводит к ожидаемому пиранону 24 (схема 11).
При обработке раствора пери-бензоилоксибромкетона 21 в этиловом спирте 5%-ным раствором гидроксида калия с выходом 70-80% было получено соединение 26, которое, вероятно, может существовать в двух таутомерных формах 26а,b.

Схема 11
Спектр ЯМР 1Н достаточно сложен, однако можно видеть два сигнала от протонов двух различных гидроксильных групп при 12.2 и 15.4 м.д., что подтверждает наличие в растворе двух таутомерных форм. О наличии формы 26b также свидетельствует способность этого соединения образовывать борфторидный 27 и металлические 28 комплексы-хелаты.
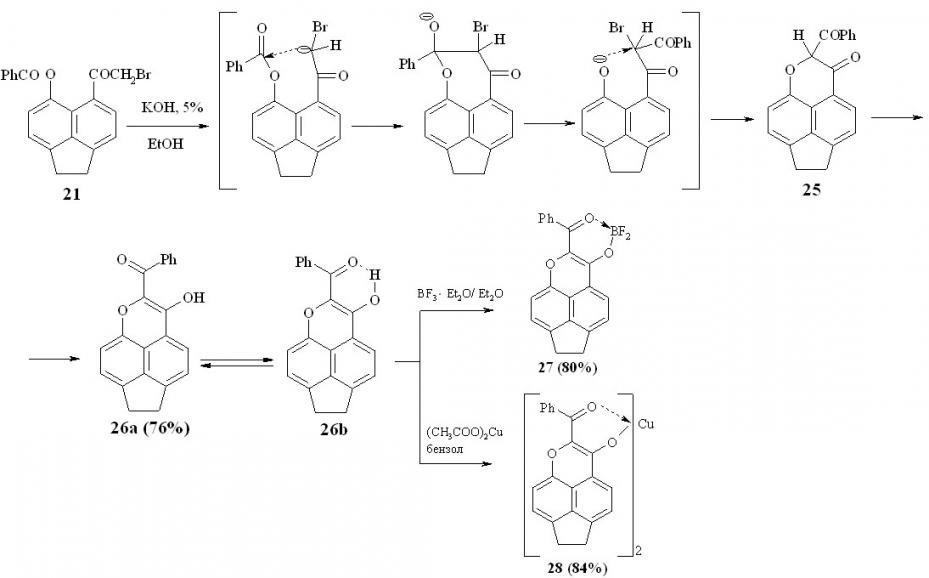
Схема 12
Взаимодействие пери-бензоилоксибромкетона 21 с анисовым альдегидом в метаноле в присутствии метилата натрия приводит к образованию пиранона 31 с выходом 48%. Этот же продукт был получен исходя из пери-гидроксихалкона 18а (схема 13) путем его О-ацилирования хлорангидридами ароматических кислот в пиридине с последущим бромированием и взаимодействием дибромпроизводного 30 с пиперидином. В качестве бромирующих агентов могут быть использованы бром, раствор брома в четыреххлористом углероде, диоксандибромид. Интересно отметить, что в результате бромирования образуется смесь двух соединений (возможно диастереомеров), которые обладают различной хроматографической подвижностью и могут быть выделены препаративно. При обработке смеси диастереомеров 30 пиперидином образуется пиранон 31.
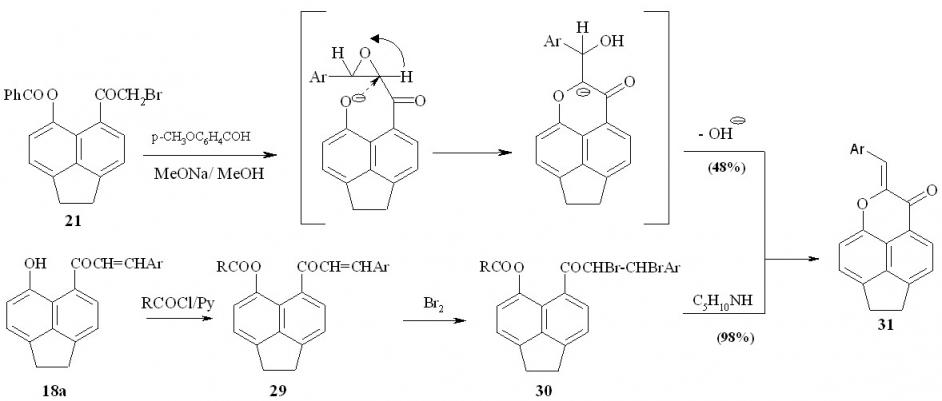
Схема 13
Взаимодействие пери-гидроксиацетилаценафтилена 3с с метилгидразином в этаноле приводит к образованию пери-аннелированной гетероароматической системы – диазафеналена 33. Это соединение также было получено ранее в нашей лаборатории встречным синтезом при взаимодействиии кетона 2с с метилгидразином с последующим дегидрированием хлоранилом (схема 14). В спектре ЯМР 1Н диазафеналена 33 по сравнению с аценафтеновым аналогом 32 наблюдается значительное слабопольное смещение всех ароматических протонов, что указывает на существенное усиление ароматичности системы 33 по сравнению с системой 32.

Схема 14
6.2.3. Получение оксепинонов
Идея превращения неароматических молекул в ароматические путем введения одной кратной связи весьма привлекательна, так как позволяет наглядно проследить за происходящими при этом изменениями их физических и химических свойств. Подходящими объектами такого плана являются пери-аннелированные гетероциклические производные аценафтена и аценафтилена.
В данной работе эта идея реализована в виде превращения 2-арилзамещенных 7,8-дигидро-4Н-аценафт[5,6-bc]оксепин-4-онов 35f,g в соответствующие 2-арилзамещенные 4Н-аценафт[5,6-bc]оксепин-4-оны 36f,g.
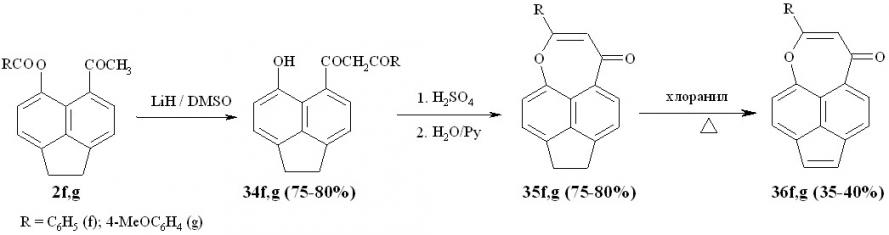
Схема 15
В результате перегруппировки пери-ацилоксиацетилаценафтенов 2f,g под действием гидрида лития в ДМСО образуются соответствующие пери-гидроксидикетоны 34f,g, которые под действием концентрированной серной кислоты циклизуются с образованием пери-аннелированных гетероциклических производных 35f,g. Путем дегидрирования хлоранилом последних образуются соответствующие производные аценафтилена 36f,g.
В спектрах ЯМР 1Н соединений 36f,g область ароматических протонов смещена на 0.3-0.4 м.д. в слабое поле по сравнению с аценафтеновыми производными 35f,g, что может рассматриваться как незначительное увеличение ароматичности первых. Протоны при двойной связи, появляющиеся в результате дегидрирования биметиленового звена, также приобретают ароматический характер и проявляются виде дублетов в спектрах ЯМР 1Н соединений 36f,g в интервале 7.2-7.4 м.д.
Квантовохимическое изучение систем 35 и 36 проводилось в рамках теории функционала плотности методом B3LYP/6-31G** при помощи программы Gaussian 03. Для модельных соединений 35, 36 (R=H) также были проведены дополнительные расчеты методом B3LYP/6-311+G**. Результаты расчетов показали, что структурные характеристики систем 35 и 36 близки, все неводородные атомы формируют плоскость симметрии, при этом ароматические заместители R выведены из плоскости сопряжения системы (угол поворота ~30 град.) и участия в формировании единой -системы не принимают. Несмотря на близость структурных характеристик, распределение электронной плотности в системах 35 и 36 несколько отличается. Так, в системе 36 электронная плотность более делокализована, что выражается в меньшем значении ее дипольного момента (3.516 Д) чем для 35 (4.475 Д). Этот факт может служить косвенным подтверждением большего ароматического характера систем 36 по сравнению с 35.
При обработке нафтоксепинона 36g хлорной кислотой в среде этилортоформиата был выделен кристаллический перхлорат 37g темно-красного цвета, который в органических растворителях отщепляет хлорную кислоту и превращается в исходный нафтоксепинон 36g.
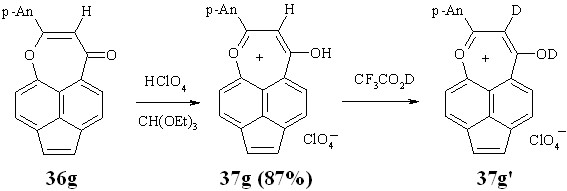
Схема 16
В ИК спектре перхлората 37g, по сравнению со спектром оксепинона 36g, исчезает полоса колебаний карбонильной группы и появляется размытая полоса гидроксигруппы с макс 3080 см-1, а также интенсивная характеристическая полоса перхлорат-аниона (макс 1122 см-1). В спектре ЯМР 1Н соединения 37g в дейтеротрифторуксусной кислоте исчезает сигнал протона Н3, что, по-видимому, обусловлено заменой его на дейтерий (37g’), а сигналы протонов аценафтиленового фрагмента претерпевают дальнейшее слабопольное смещение по сравнению с аценафтеновым и аценафтиленовым оксепинонами 35f и 36f. Эти спектральные характеристики свидетельствуют об образовании нового гетероароматического катиона 37g с 14-электронным контуром.
ВЫВОДЫ
- Разработаны пути построения пери-гидроксикарбонильной группировки на ядре аценафтена и аценафтилена.
- С помощью метода РСА установлено конформационное строение пери-гидрокси- и пери-метоксизамещенных альдегидов и кетонов аценафтенового и аценафтиленового ряда, геометрия которых подтверждена квантово-химическим расчетом. Показано, что пери-гидроксикарбонильные соединения образуют плоский семичленный ВВС-цикл копланарный с ароматическим фрагментом молекулы, тогда как карбонильная группа пери-метоксизамещенных кетонов в значительной степени выведена из плоскости нафталинового ядра. Геометрия пери-метоксиаценафтальдегида свидетельствует о наличии слабой ВВС между протоном формильной группы и кислородным атомом метоксигруппы, при этом пери-заместители практически копланарны с плоскостью аценафтенового ядра.
- С помощью спектральных методов (ИК, УФ, ЯМР 1Н) определена склонность семичленного Н-цикла к разрыву в зависимости от основности органических растворителей и установлена относительная прочность ВВС в ряду исследуемых объектов, подкрепленная данными квантовохимического расчета.
- На основании проведенных исследований впервые представлена и проанализирована общая картина конформаций и внутримолекулярных взаимодействий между пери-расположенными гидрокси-, метокси- и карбонильными группами на ядрах нафталина, аценафтена и аценафтилена.
- Изучены химические превращения синтезированных пери-гидроксикарбонильных соединений. Получены новые пери-гидроксизамещенные азометины, халконы и пери-аннелированные гетероциклические системы аценафтенового и аценафтиленового ряда.
Основное содержание диссертации опубликовано в следующих работах:
- Л. Г. Миняева, Р. В. Тюрин, В. В. Межерицкий, А. Н. Безуглов. Синтез 5-ацетил-6-гидроксиаценафтилена // Журнал органической химии, 2007, 43, вып.8, с.1258-1260.
- Р.В.Тюрин, А.А.Милов, А.Н.Антонов, Л.Г.Миняева, В.В.Межерицкий, А.Н.Безуглов. Синтез и строение 2-арил-4Н-аценафт[5,6-bc]оксепин-4-онов // Журнал органической химии, 2007, 43, вып.10, с.1474-1478.
- Л.Г.Миняева, В.В.Межерицкий, А.Н.Безуглов. Новый подход к синтезу пери-гидроксизамещенных карбонильных производных аценафтена // Журнал органической химии, 2008, 44, вып.3, с.361-364.
- В. В. Межерицкий, Л. Г. Миняева, А. Н. Безуглов, К.А.Лысенко, Ю.В.Ревинский, А.А.Милов. Строение пери-гидрокси- и пери-метоксизамещенных альдегидов и кетонов по данным спектроскопических исследований и квантово-химических расчетов // Журнал органической химии, 2010, 46, вып. 1, с.98-112.
- А.Н.Безуглов, Л.Г.Миняева, К.А.Лысенко, В.В.Межерицкий. Пери-гидроксиаце-нафтоильные соединения // Журнал органической химии, 2010, 46 вып.3, с. 344-351.
- Л. Г. Миняева, Р. В. Тюрин, В. В. Межерицкий, А. Н. Безуглов. Новый подход к синтезу пери-гидроксизамещенных карбонильных производных аценафтена // Тезисы IV Международной конференции по новым технологиям и приложениям современных физико-химических методов, Ростов-на-Дону, 18-22 сентября 2007 г. с.109.
- Р.В.Тюрин, А.А.Милов, Л.Г.Миняева, А.Н.Антонов, В.В.Межерицкий, А.Н.Безуглов. Синтез и строение 2-арил-4Н-аценафт-[5,6-bc]-оксепин-4-онов // Тезисы IV Международной конференции по новым технологиям и приложениям современных физико-химических методов, Ростов-на-Дону, 18-22 сентября 2007 г. с.149.
- Л.Г.Миняева, А.Н.Антонов, В.В.Межерицкий, А.Н.Безуглов. Некоторые свойства 6-гидрокси-5-формилаценафтена // Тезисы X Молодежной конференции по органической химии, г.Уфа, 26-30 ноября 2007 г., с. 92.
- Л.Г.Миняева, А.Н.Антонов, В.В.Межерицкий, А.Н.Безуглов. 1,3-Диметилацеперида-зилен – новая пери-аннелированная гетероароматическая система // Тезисы X Молодежной конференции по органической химии, г.Уфа, 26-30 ноября 2007 г., с. 93.
- А.Н.Безуглов, Л.Г.Миняева, В.В.Межерицкий. Пери-гидроксиаценафтоильные соединения // Тезисы IX Международного семинара по магнитному резонансу (спектроскопия, томография и экология), Ростов-на-Дону, 15-20 сентября 2008 г. с.33.
- А.Н.Безуглов, Л.Г.Миняева, К.А.Лысенко, В.В.Межерицкий. Пери-гидрокси-аценафтоильные соединения // Тезисы V Международной конференции по новым технологиям и приложениям современных физико-химических методов, Ростов-на-Дону, 18-22 сентября 2009 г. с.32.
Все статьи в ЖОрХ в англоязычном варианте переизданы издательством «Springer».

