Синтез и кислотные свойства трет- бутил - и трифторметилфенилпроизводных тетраазапорфиринов
На правах рукописи
Кузмина Екатерина Леонидовна
Синтез и кислотные свойства трет-бутил - и
трифторметилфенилпроизводных тетраазапорфиринов
02.00.03 – Органическая химия
02.00.04 – Физическая химия
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Иваново 2013
Работа выполнена на кафедре органической химии федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Ивановский государственный химико-технологический университет»
| Научные руководители: | |
| доктор химических наук, доцент | Петров Олег Александрович |
| доктор химических наук, профессор | Майзлиш Владимир Ефимович |
| Официальные оппоненты: | |
| доктор химических наук, профессор | Плахтинский Владимир Владимирович ФГБОУ ВПО «Ярославский государственный технический университет», профессор кафедры органической химии |
| доктор химических наук, профессор | Березин Михаил Борисович ФГБУН «Институт химии растворов имени Г.А. Крестова РАН», г. Иваново, главный научный сотрудник лаборатории физической химии растворов макроциклических соединений |
| Ведущая организация: | ФГБУН «Институт физиологически активных веществ Российской академии наук», г. Черноголовка, Московская область |
Защита диссертации состоится 2 декабря 2013 г. в 1000 часов на заседании диссертационного
совета Д 212.063.01 в ФГБОУ ВПО «Ивановский государственный химико-технологический университет» по адресу: 153000, г. Иваново, пр. Ф. Энгельса, д. 7.
Тел. (4932) 32-54-33. Факс (4932) 32-54-33, е-mail [email protected]
С диссертацией можно ознакомиться в библиотеке
Ивановского государственного химико-технологического университета по адресу:
153000, г. Иваново, пр. Ф. Энгельса, д. 10.
Автореферат разослан « 31 » октября 2013г.
Ученый секретарь диссертационного
совета Д 212.063.01 Данилова Елена Адольфовна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Установление влияния структуры соединений на их свойства рассматривается как одна из наиболее важных проблем органической химии. В большинстве случаев закономерности «структура-свойство» носят чисто качественный характер, и в получении веществ с заданными свойствами неизбежен эмпирический подход, предполагающий синтез и исследование ряда родственных соединений. Вследствие многообразных возможностей модификации молекулярной структуры наиболее подходящими объектами для такого изучения являются тетрапиррольные макрогетероциклические соединения - тетраазапорфирины. В связи с уникальными свойствами, которые тесно связаны с особенностями строения их молекул, они привлекают все более пристальное внимание исследователей. Одним из направлений химической модификации тетраазапорфиринов является – замещение и, – аннелирование. Такое изменение строения молекулы позволяет варьировать физико-химическими свойствами соединений, которые необходимы при использовании в качестве высокоэффективных и селективных катализаторов, химических сенсоров, жидкокристаллических веществ, фотосенсибилизаторов для фотодинамической терапии, пигментов и красителей и др.
Успешное практическое применение тетраазапорфиринов требует не только разработки методов синтеза новых соединений, но и изучение реакционной способности в различных реакциях.
В настоящее время лишь незначительное количество тетраазапорфиринов исследовалось с целью изучения влияния природы замещения в макрогетероцикле на процессы кислотно-основного взаимодействия в протоноакцепторных средах, а всестороннее изучение кислотных свойств и устойчивости в основных средах таких макрогетероциклических соединений весьма важно для их практического использования. Кроме того, сведения о кислотности вносят определенный вклад в дальнейшее развитие теории реакционной способности сложных органических молекул.
В связи с этим постановка исследования, направленного на синтез новых производных тетраазапорфиринов и изучение влияния структуры на их кислотные свойства, актуальна и научно обоснована.
Целью настоящей работы является синтез и исследование тетра(4-трет-бутил-5-нитро)фталоцианина в процессах кислотно – основного взаимодействия, а также изучение влияния периферийного окружения молекулы тетраазапорфирина на кислотные свойства окта(м - трифторметилфенил)тетраазапорфина, гекса(м – трифторметилфенил)бензотетраазапорфина и тетра(4-трет-бутил)фталоцианина.
Для достижения поставленной цели в работе поставлены и решены следующие задачи:
1. Синтез нового дизамещенного фталонитрила, содержащего в 4 и 5 положении трет-бутильную и нитрогруппы, и получение на его основе тетра(4-трет-бутил-5-нитро)фталоцианина.
2. Изучение реакционной способности тетра(4-трет-бутил)фталоцианина, тетра(4-трет-бутил-5-нитро)фталоцианина и трифторметилфенилзамещенных тетраазапорфиринов в кислотно-основном взаимодействии с азотсодержащими основаниями.
Работа выполнена в рамках госбюджетных тем ИГХТУ «Молекулярное конструирование порфиринов и фталоцианинов нового поколения. Фундаментальное исследование (1.7.10)», «Молекулярное конструирование порфиринов и фталоцианинов нового поколения в качестве перспективных материалов с максимальным функциональным соответствием их использования в различных областях науки и техники (1.7.11)» и «Химическая модификация фталоцианинов и порфиринов для создания новых перспективных материалов различного назначения (3.2730.12)» по заказ-наряду Минобразования и науки РФ, а также при финансовой поддержке Российского фонда Фундаментальных исследований (грант №10-03-00305а).
Научная новизна. Осуществлен синтез ранее неизвестного 4- трет-бутил-5-нитрофталонитрила и фталоцианина на его основе. Впервые изучена реакционная способность тетра(4-трет-бутил)фталоцианина, тетра(4 -трет-бутил-5-нитро)фтало-
цианина, окта (м - трифторметилфенил)тетраазапорфина и гекса(м–трифторметилфе-
нил)бензотетраазапорфина в процессах кислотно-основного взаимодействия в протоноакцепторных средах. Обнаружено, что в присутствии азотсодержащих оснований они проявляют свойства двухосновных NH-кислот и образуют комплексы с переносом протонов, обладающие различной устойчивостью во времени. Установлено, что реакция кислотно–основного взаимодействия замещенных фталоцианинов и тетраазапорфиринов с основаниями относятся к числу необычно медленных процессов, а её кинетические параметры значительно зависят от величины рКа и стерических возможностей протоноакцепторных молекул. Впервые найдена зависимость между кислотными свойствами изученных макроциклов и их реакционной способностью при взаимодействии с основаниями.
Практическая значимость. Модификацией полученного 4-трет-бутил-5-нитрофталонитрила реакциями нуклеофильного замещения, восстановления нитрогруппы и дальнейшего N-алкилирования и ацилирования, диазотирования можно получить ряд новых дизамещенных фталонитрилов, а на их основе соответствующих фталоцианинов, обладающих важными прикладными свойствами. Полученные в работе экспериментальные данные вносят определенный вклад в развитие теории реакционной способности сложных органических молекул, и могут быть использованы при изучении каталитической активности замещенных фталоцианинов и тетраазапорфиринов, при выборе оптимальных условий синтеза их металлокомплексов.
Положения, выносимые на защиту.
- Синтез 4-трет-бутил-5-нитрофталонитрила и тетра(4-трет-бутил-5-нитро)-фталоцианина на его основе.
- Результаты исследования влияния структуры тетра(4-трет-бутил)фталоцианина, тетра(4-трет-бутил-5-нитро)фталоцианина, окта (м - трифторметилфенил)тетрааза-порфина и гекса(м - трифторметилфенил)бензотетраазапорфина на их реакционную способность в кислотно-основном взаимодействии с циклическими и ациклическими азотсодержащими основаниями.
Личный вклад автора состоит в непосредственном участии на всех этапах работы – в постановке цели и задач работы, планировании и выполнении экспериментальных исследований, обработке экспериментальных данных, обсуждении полученных результатов.
Апробация работы. Результаты исследований докладывались и обсуждались на XXV Международной Чугаевской конференции по координационной химии (г. Суздаль, 2011 г.); Международной молодежной научной школе «Химия порфиринов и родственных соединений» (г. Иваново, 2012 г.); Всероссийской конференции «Современные проблемы химической науки и образования (г. Чебоксары, 2012 г.); научной конференции фестиваля студентов, аспирантов и молодых ученых «Молодая наука в классическом университете. Актуальные проблемы современного естествознания» (г. Иваново, ИвГУ, 2012 г.); XIV Международной конференции «Наукоемкие технологии - 2012» (г. Тула, 2012 г.); 66-й Всероссийской конференции студентов, магистров и аспирантов высших учебных заведений с международным участием (г. Ярославль, ЯГТУ, 2013 г.).
Публикации. По материалам диссертационной работы опубликовано 5 статей в журналах, входящих в перечень ВАК и 7 тезисов докладов на международных, всероссийских и региональных научных конференциях.
Объем и структура диссертации. Диссертация состоит из введения, обзора литературы, экспериментальной части, обсуждения результатов, выводов и списка цитируемой литературы (170 наименований). Материалы работы изложены на 115 страницах машинописного текста и содержат 17 таблиц и 37 рисунков и 9 схем.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснованы актуальность диссертационной работы, выбор объектов исследования, сформулированы цель и задачи работы.
- Литературный обзор
Литературный обзор состоит из четырех разделов, в которых отражены основные подходы к синтезу тетраазапорфиринов и фталоцианинов, рассмотрены особенности их электронного и геометрического строения во взаимосвязи с кислотными свойствами. Рассмотрена специфика электронных спектров поглощения молекулярных и анионных форм тетраазапорфириновых макроциклов.
- Экспериментальная часть
Приведены синтезы тетра(4 – трет - бутил)фталоцианина, окта(м – трифторме-
тилфенил)тетраазапорфина и гекса(м–трифторметилфенил)бензотетраазапорфина, осуществленные по известным методикам, а также ранее неизвестных 4-трет-бутил-5-нитрофталонитрила и тетра(4-трет-бутил-5-нитро)фталоцианина. Представлены методики исследования, а также характеристики приборов, используемых для изучения состава, строения и физико-химических свойств (элементный анализ, ИК, ЯМР 1Н, 13С и электронная спектроскопия, хромато-масс-спектрометрия и др.).
- Обсуждение результатов
3.1. Синтез 4-трет-бутил-5-нитрофталонитрила
Известно, что при нитровании 4-трет-бутил-о-ксилола, путем последовательных операций образуется 3-нитро-5-трет-бутилфталонитрил, а из 4-бромфталимида получают 4-бром-5-нитрофталонитрил. Поэтому в качестве объекта нитрования был использован 4-трет-бутилфталимид, заранее полученный по известной методике из о-ксилола. Предварительно квантово-химическими расчетами (АМ1), выполненными к.х.н. доц. А.В. Борисовым, проведено теоретическое определение преимущественного места вступления нитрогруппы в молекулу 4-трет-бутилфталимида.
Реакцию нитрования 4-трет-бутилфталимида можно представить следующим образом (схема 1):
Схема 1
Для оценки места вступления нитрогруппы была выбрана величина активационного барьера реакции E, рассчитанная как разность суммы теплот образования исходных соединений R1 и R2 и теплоты образования переходного состояния Ts: E= H0fR1+H0fR2-H0fTs.
Таблица 1
| R1H0f ккал/моль | R2H0f ккал/моль | Ts H0f ккал/моль | PH0f ккал/моль | E ккал/моль |
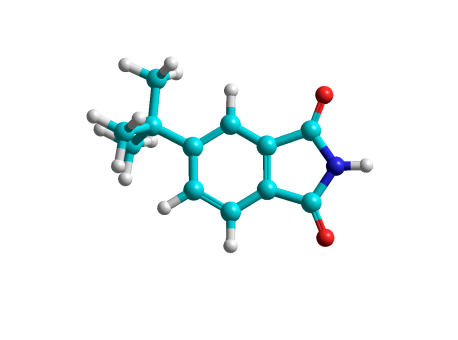 |  |  |  | 5.102 |
| 181.102 | -27.081 | |||
 |  | 6.508 | ||
| 182.508 | -32.844 | |||
 |  | 2.256 | ||
| -45.109 | 221.109 | 178.296 | -26.178 |
Результаты расчетов показали, что наиболее вероятным местом вступления нитрогруппы в этом случае является положение 5 (E=2.256 ккал/моль (табл. 1), что и было в дальнейшем экспериментально подтверждено.
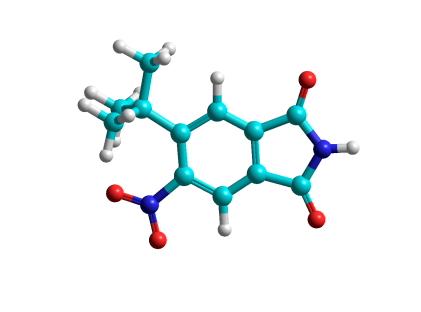
4-трет-Бутил-5-нитрофталонитрил (4) получен путем осуществления ряда последовательных реакций: нитрованием 4-трет-бутилфталимида, с последующими амидированием и дегидратацией (схема 2).

Схема 2
Состав и строение полученного соединения подтверждены с помощью данных элементного анализа, хромато-масс-спектрометрии, жидкостной хроматографии, ИК и ЯМР 1Н, 13С спектроскопии.
В масс-спектре 4-трет-бутил-5-нитрофталонитрила (ионизация электронным ударом) присутствуют сигналы молекулярного иона с m/z 230 (25 %) [M+Н]+, а также продуктов его фрагментации с m/z 214 (100 %) [M–CH3]+, 184 (40 %), [M–NO2]+, 169 (35 %) [M–2CN–CH3]+, 141 (30 %) [M–2CN–3CH3–NO2]+ и др. (рис. 1).
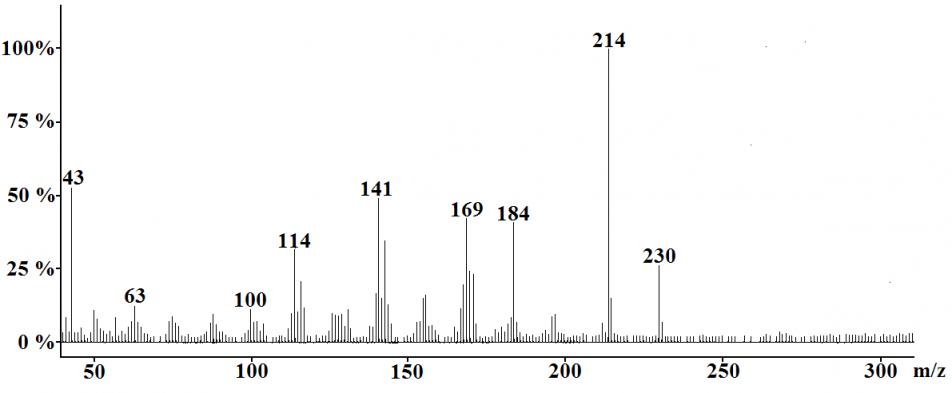 |  |
| Рис. 1. Масс-спектр 4-трет-бутил-5-нитрофталонитрила | Рис. 2. Хроматограмма 4-трет-бутил-5-нитрофталонитрила |
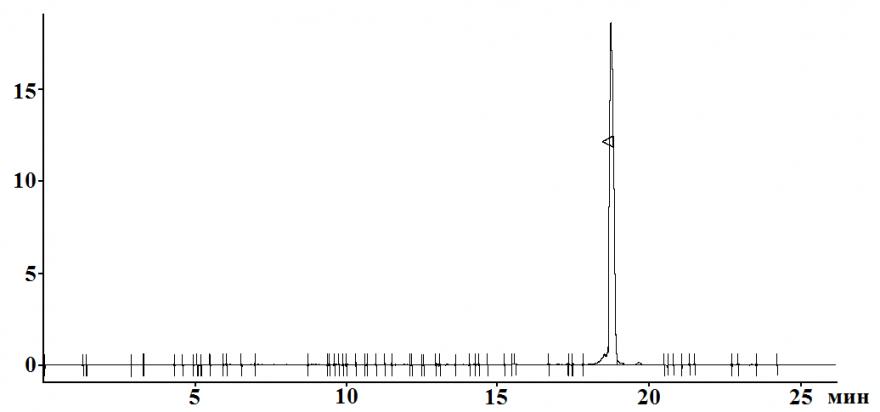
Анализируя данные хромато-масс-спектрометрии (рис. 1, 2) и жидкостной хроматографии (рис. 3), можно с уверенностью сказать, что выделенный фталонитрил представляет собой индивидуальное соединение.
 | |
| Рис. 3. Жидкостная хроматограмма 4-трет-бутил-5-нитрофталонитрила | Рис. 4. ИК спектр 4-трет-бутил-5-нитрофталонитрила |
В ИК спектре отмечены полосы поглощения при 2239 см-1, соответствующие наличию нитрильной, в области 1539 и 1366 см-1 – нитрогруппы, а в интервале 2800-3000 см-1 - трет-бутильной группы. Кроме того, в интервале 1600-2000 см-1 характер спектральной кривой свидетельствует о наличии 1,2,4,5-замещенного бензола (рис. 4).
Данные ЯМР спектров также подтверждают строение полученного фталонитрила. орто-Положение нитрогруппы (относительно трет-бутильного фрагмента) подтверждается отсутствием дальних констант спин-спинового взаимодействия (КССВ) (для п-расположенных протонов значения JHH менее 1 Гц), которые ранее наблюдались для 3-нитро-5-о-ксилола и соответствующих фталевой кислоты, фталимида и фталонитрила, в которых NO2-группа находится в м-положении. Кроме того, с целью подтверждения полученных результатов были проведены квантово-химические расчеты ЯМР спектров с использованием пакета программ Gaussian 98, выполненные д.х.н. В.В. Александрийским. Для оптимизации геометрии использовался метод B3LYP/6-311G(D,P), являющийся разновидностью DFT с гибридным функционалом. Константы экранирования ЯМР на ядрах углерода рассчитывались методом GIAO, с тем же функционалом и базисным набором, что и при оптимизации геометрии (B3LYP/6-311G(D,P)). Расчетные и экспериментальные величины химических сдвигов представлены в таблице 2.
Отметим, что наблюдается хорошая корреляция расчетных и экспериментальных величин химических сдвигов 13С (рис. 5).
Таблица 2.
Экспериментальные и расчетные химические сдвиги 13С и 1Н
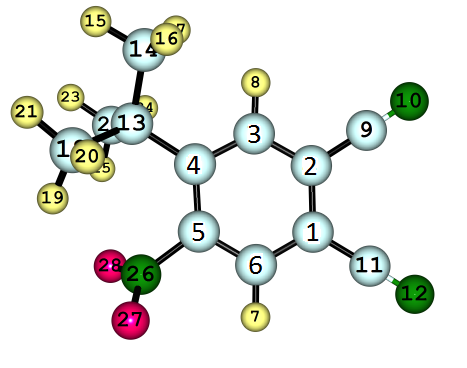 | Расчет | Эксперимент |
| С1 | 119,68 | 114,85 |
| С2 | 122,96 | 117,94 |
| С3 | 139,81 | 135,12 |
| С4 | 154,66 | 148,00 |
| С5 | 159,96 | 152,64 |
| С6 | 135,11 | 128,67 |
| С9 | 116,45 | 114,19 |
| С11 | 115,60 | 113,40 |
| С13 | 42,50 | 36,92 |
| С(СH3) | 29,35 | 30,92 |
| H8 | 7,97 | 8,06 |
| H7 | 7,74 | 7,77 |
| Рис. 5. Корреляция экспериментальных и расчетных химических сдвигов | 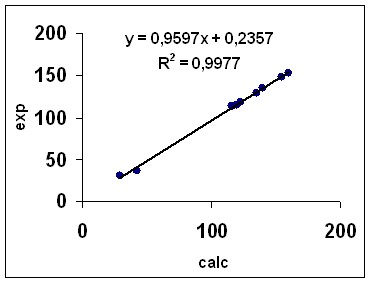 | |
3.2. Синтез тетра(4-трет-бутил-5-нитро)фталоцианина
Синтез тетра(4-трет-бутил-5-нитро)фталоцианина (H2Рс(t-Bu)4(NO2)4) осуществлен «нитрильным» методом путем взаимодействия 4-трет-бутил-5-нитрофтало-нитрила с ацетатом магния при 180-185 С. Плав обрабатывали раствором концентрированной соляной кислотой (при этом происходила деметаллизация комплекса) (схема 3), затем дистиллированной водой до нейтральной среды, сушили. Целевой продукт экстрагировали хлороформом и подвергали жидкостной хроматографии на колонке окисью алюминия.
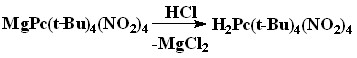
Схема 3
Идентификацию полученного фталоцианина проводили с привлечением данных элементного анализа, колебательной и электронной спектроскопии. Электронный спектр поглощения (ЭСП) комплекса с магнием в хлороформе трансформировался из однополосного (max = 681 нм) в типичный двухполосный спектр (max = 664, 700 нм) безметального фталоцианина (рис. 6).
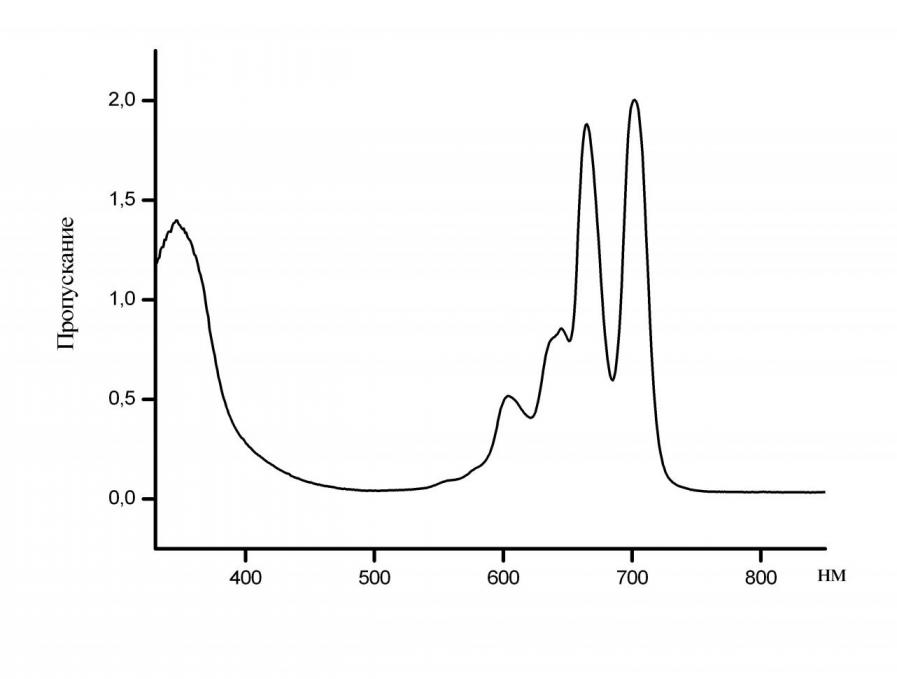 |
| Рис. 6. ЭСП тетра(4-трет-бутил-5-нитро)фталоцианина в хлороформе |
В ИК спектре H2Рс(t-Bu)4(NO2)4 кроме полос поглощения, ранее отмеченных у исходного фталонитрила, наблюдаются интенсивная полоса в области 1007 см-1, характерная для безметальных фталоцианинов, а в области 3290-3310 см-1 полоса, отвечающая валентным колебаниям NH-связей внутрициклических атомов азота макрокольца.
- Особенности кислотно - основного взаимодействия замещенных
фталоцианина с азотсодержащими основаниями в бензоле и
диметилсульфоксиде
Проведено спектральное исследование состояния H2Рс(t-Bu)4(NO2)4 и тетра(4-трет-бутил)фталоцианина (H2Рс(t-Bu)4) в системе азотсодержащее основание - бензол (ДМСО).
 |  |
| H2Рс(t-Bu)4(NO2)4 | H2Рс(t-Bu)4 |
Установлено, что электронный спектр поглощения (ЭСП) H2Рс(t-Bu)4(NO2)4 в бензоле с добавками пиридина (Ру), 2 – метилпиридина (МеРу) и триэтиламина (Еt3N) содержит в видимой области две хорошо разрешенные Qx и Qy - полосы с I = 700 нм и II =670 нм соответственно. Однако при введении в бензол добавок морфолина (Mor) и диэтиламина (Еt2NH) в ЭСП H2Рс(t-Bu)4(NO2)4 с течением времени регистрируется одновременное уменьшение интенсивности полос поглощения при I и II и рост интенсивности полосы поглощения при = 681 нм (рис. 7). Картина спектральных изменений в ходе реакции не зависит от природы основания. Исчезновение расщепления между двумя компонентами Q – полосы в ЭСП (рис. 7), свидетельствующее о повышении симметрии – хромофора молекулы от D2h до D4h, указывает на то, что H2Рс (t-Bu)4(NO2)4 в присутствии морфолина и диэтиламина проявляет свойства двухосновной NH-кислоты и образует комплексы с переносом протонов – H2Рс(t-Bu)4(NO2)4·2Mor и H2Рс(t-Bu)4(NO2)4·2Еt2NH. Предполагается, что в этих комплексах протоны NH - групп H2Рс(t-Bu)4(NO2)4, связанные с молекулами основания, располагаются над и под плоскостью макроцикла, что является необходимым условием соблюдения симметрии распределения зарядов. В системе бензол-пиперидин (Рip) (н-бутиламин (BuNH2)) комплексы с D4h – симметрией образуются сразу же при сливании свежеприготовленных растворов. Все полученные комплексы подвергаются самопроизвольному распаду с течением времени с образованием бесцветных продуктов.
Исследование состояния тетра(4-трет-бутил)фталоцианина в протоноакцепторных средах позволило установить, что в бензоле депротонирование H2Рс(t-Bu)4 не наблюдается даже в присутствии достаточно сильных оснований (н-бутиламин, диэтиламин, трет–бутиламин (t-BuNH2)). Напротив, кислотно-основное взаимодействие (КОВ) в среде ДМСО проходит в сравнительно мягких условиях. В системе ДМСО - Еt2NH (t-BuNH2) расщепление Q – полосы исчезает с течением времени, что
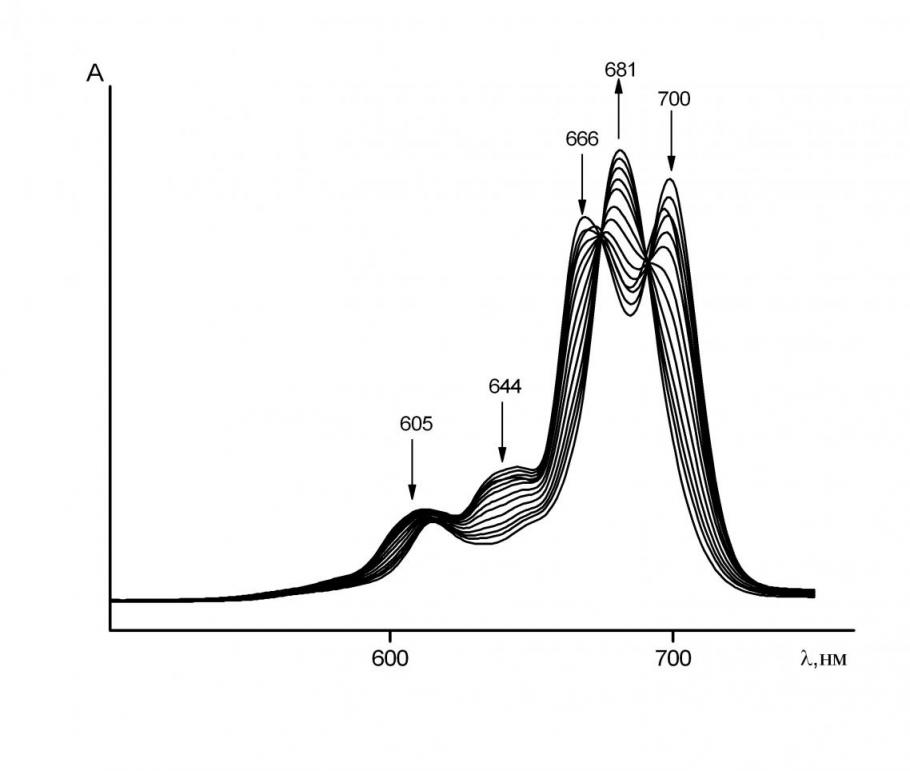 | 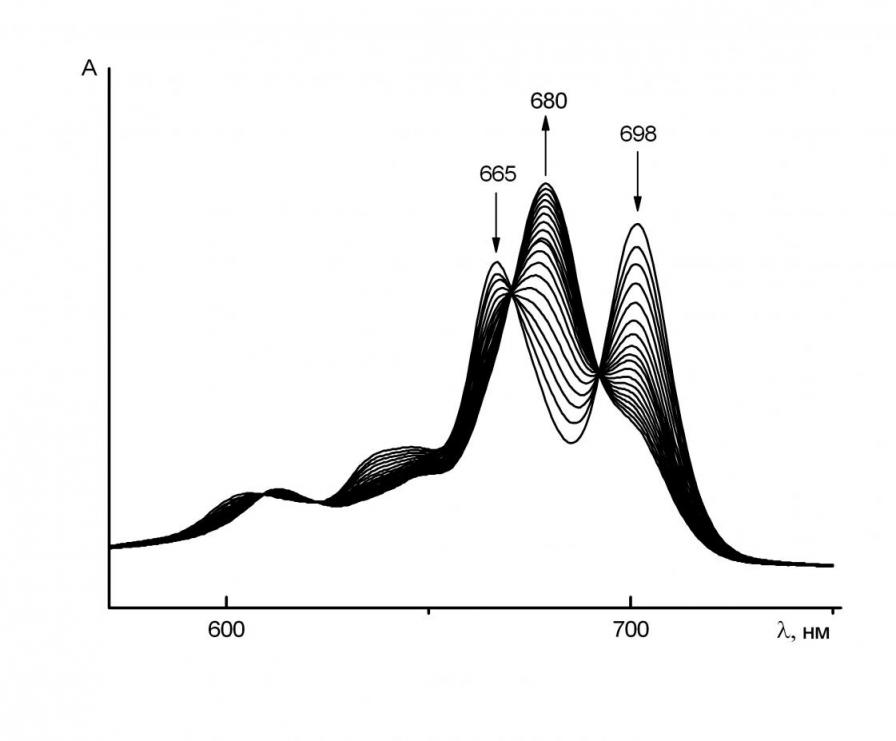 |
| Рис. 7. Изменение ЭСП H2Рс (t-Bu)4(NO2)4 в присутствии морфолина в течение 80 мин при СMor=9.98 моль/л и Т=358 К | Рис. 8. Изменение ЭСП H2Рс(t-Bu)4 в присутствии диэтиламина в течение 80 мин при СЕt2NH=2.41 моль/л и Т=318 К |
свидетельствует о повышении симметрии молекулы от D2h до D4h (рис.8). Образующиеся при этом комплексы H2Рс(t-Bu)4 ·2 Еt2NH и H2Рс(t-Bu)4 . 2 (t-BuNH2) обладают достаточно высокой кинетической устойчивостью, как и комплекс H2Рс(t-Bu)4·2BuNH2, который в системе ДМСО-BuNH2 образуется предельно быстро.
3.4. Реакционная способность тетра(4-трет-бутил)фталоцианина и тетра(4-трет-бутил-5-нитро)фталоцианина в кислотно-основном взаимодействии с азотсодержащими основаниями
Кислотно – основное взаимодействие замещенных фталоцианина с основаниями (В) в бензоле и диметилсульфоксиде протекает в соответствии с уравнениями:
H2Рс (t-Bu)4(NO2)4 + 2В H2Рс (t-Bu)4(NO2)4 2В (1)
H2Рс (t-Bu)4 + 2В H2Рс (t-Bu)42В (2)
Во всех случаях реакции (1,2) имеют порядок равный единице по NH-кислоте. Порядок реакции (n) по основанию изменяется от 1 до 2 (рис. 9, 10), а кинетические уравнения имеют вид:
-d СH2Рс (t-Bu) 4(NO2)4 / d = k СH2Рс (t-Bu) 4(NO2)4 СMor (3)
-d СH2Рс (t-Bu) 4(NO2)4 / d = k СH2Рс (t-Bu) 4(NO2)4 С2Еt2NH (4)
-d СH2Рс (t-Bu) 4 / d = k СH2Рс (t-Bu) 4(NO2)4 С2В (5)
где В - Еt2NH, t-BuNH2.
Полученные данные с учетом спектральных изменений (рис. 7, 8) позволяют полагать, что перенос протонов NH - групп от H2Рс(t-Bu)4(NO2)4 к морфолину осуществляется двухстадийно в соответствии со следующей схемой:
![]()
H2Рс (t-Bu)4(NO2)4 + Mor H2Рс (t-Bu)4(NO2)4 Mor (6)
![]()
H2Рс (t-Bu)4(NO2)4 Mor + Mor H2Рс (t-Bu)4(NO2)4 2Mor (7)
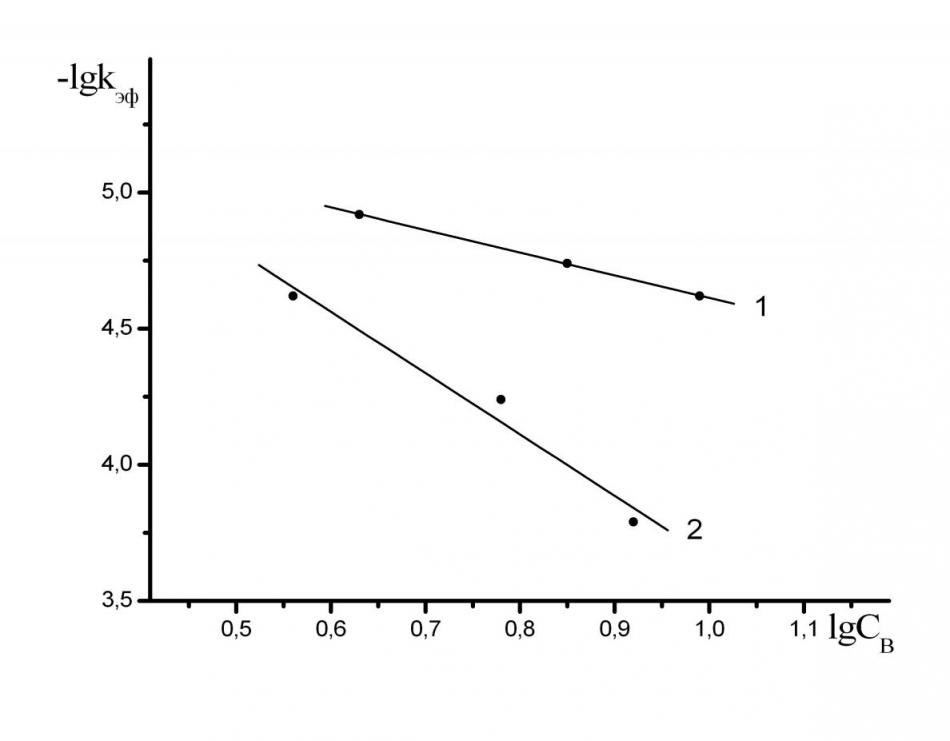 | 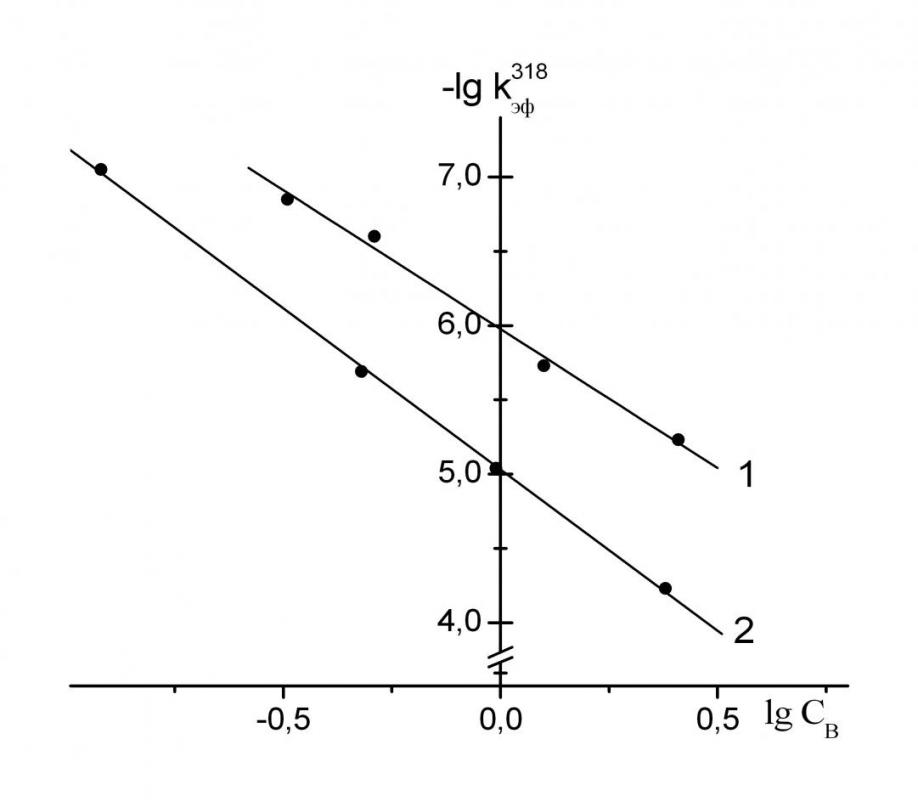 |
| Рис. 9. Зависимости lgkэф от lgСB для реакции H2Рс(t-Bu)4(NO2)4 с морфолином (1) и диэтиламином (2) в бензоле при Т=358 (1) и 318 К (2) | Рис. 10. Зависимости lgkэф от lgСB для реакции H2Рс(t-Bu)4 с трет – бутилами - ном (1) и диэтиламином (2) в ДМСО при 318 К |
При взаимодействии H2Рс(t-Bu)4(NO2)4 и H2Рс(t-Bu)4 с диэтиламином и H2Рс(t-Bu)4 с трет – бутиламином также не исключается возможность протекания процесса в две стадии (6,7) с k1 k2.
Из данных табл. 3, 4 видно, что кислотно – основное взаимодействие, происходящее согласно (1,2), характеризуется низкими значениями констант скоростей вследствие стерического экранирования атомами и – электронами макроциклической системы внутрициклических протонов NH – групп.
Таблица 3.
Кинетические параметры реакции кислотно-основного взаимодействия
H2Рс(t-Bu)4(NO2)4 с азотсодержащими основаниями в бензоле,
(СH2Рс (t-Bu)4(NO2)4 = 0.75 x 10-5 моль/л)
| Основание (В) | СВ, моль/л | Т, К | kэф x 105, с-1 | k x 106, лп/(мольп·с) | Еа., кДж/моль | A, c-1 |
| Морфолин | 9.98 | 298 338 348 358 | 0.77 1.12±0.05 1.70±0.07 2.4±0.1 | 0.97 1.50±0.04 2.15±0.06 3.05±0.09 | 35±4 | 1.33 |
| Диэтиламин | 8.45 | 298 308 318 | 6.40±0.25 9.70±0.40 16.00±0.60 | 0.70±0.02 1.10±0.03 1.80±0.05 | 36±4 | 1.43 |
Примечание. Параметры k298 для морфолина рассчитаны по уравнению Аррениуса,
п – порядок реакции по основанию.
Обнаружено, что среди всех изученных оснований максимальной реакционной способностью при взаимодействии с H2Рс(t-Bu)4(NO2)4 обладают пиперидин (рКа=11.23) и н-бутиламин (рКа=10.60). Реакция КОВ проходит со скоростями, не позволяющими измерить их обычными кинетическими методами. Уменьшение рКа на ~ 6 порядков в ряду Pip Mor МеРу Py ингибирует процесс кислотно-основного взаимодействия. При этом пиридин (рКа=5.23) и 2-метилпиридин (рКа=5.97) не вступают во взаимодействие с H2Рс(t-Bu)4(NO2)4.
Таблица 4.
Кинетические параметры реакции кислотно-основного взаимодействия H2Рс(t-Bu)4 с азотсодержащими основаниями в диметилсульфоксиде,
(СH2Рс(t-Bu)4 =0.23 x 10-5 моль/л)
| Основание (В) | СВ, моль/л | Т, К | kэф x 105, с-1 | k x 106, л2/(моль2·с) | Еа., кДж/моль | A, c-1 |
| Диэтиламин | 2.41 | 298 308 318 | 12.40±0.49 26.50±0.65 59.55±0.90 | 2.04±0.06 4.36±0.13 9.80±0.29 | 62±6 | 1.51·105 |
| трет – Бутиламин | 2.58 | 298 308 318 | 0.100±0.004 0.250±0.001 0.60±0.02 | 0.170±0.005 0.40±0.01 0.96±0.03 | 68±7 | 1.41·105 |
Увеличение числа алкильных заместителей или разветвление углеродной цепи в В также препятствует переносу протонов от NH-кислоты к основанию. Замена BuNH2 на Еt2NH (рКа=10.93) приводит к существенному уменьшению скорости КОВ (табл. 3), а взаимодействие H2Рс(t-Bu)4(NO2)4 с Еt3NH (рКа = 10.87) не наблюдается. В случае H2Рс(t-Bu)4 скорость взаимодействия с Еt2NH и t-BuNH2, судя по величинам k298, различается в ~10 раз (табл.4).
3.5. Спектральная картина кислотно-основного взаимодействия с участием
фенилзамещенных тетраазапорфирина
В предварительных опытах было установлено, что в системе бензол – Py(МеРу, Еt2NH, Еt3NH) ЭСП окта(м-трифторметилфенил)тетраазапорфина (H2Tap(C6H4CF3)8) имеет расщепленную Q – полосу с I =659 нм и II =593 нм. При этом повышение температуры не оказывает влияние на характер ЭСП.
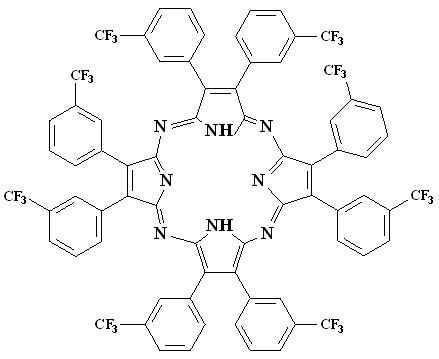 | 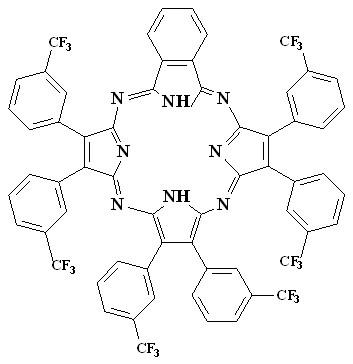 |
| H2Tap(C6H4CF3)8 | H2Тар(C6H4CF3)6(С4Н4) |
При введении в бензол добавок морфолина, бензиламина (BzNH2), пиперидина, н-бутиламина и трет – бутиламина расщепление Q - полосы исчезает с течением времени (рис. 11), что свидетельствует о двухосновном NH – кислотном характере H2Tap(C6H4CF3)8. В случае гекса(м-трифторметилфенил)бензотетраазапорфина (H2Тар(C6H4CF3)6(С4Н4)) подобные спектральные изменения наблюдаются только в присутствии н-бутиламина и пиперидина (рис. 12).
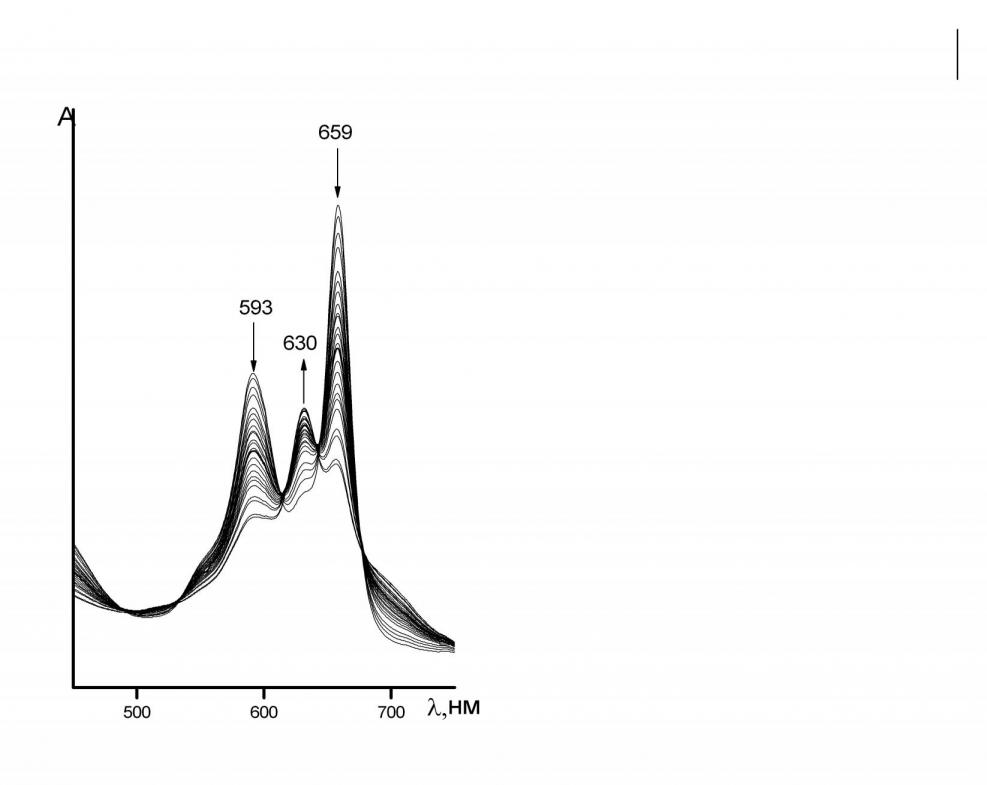 | 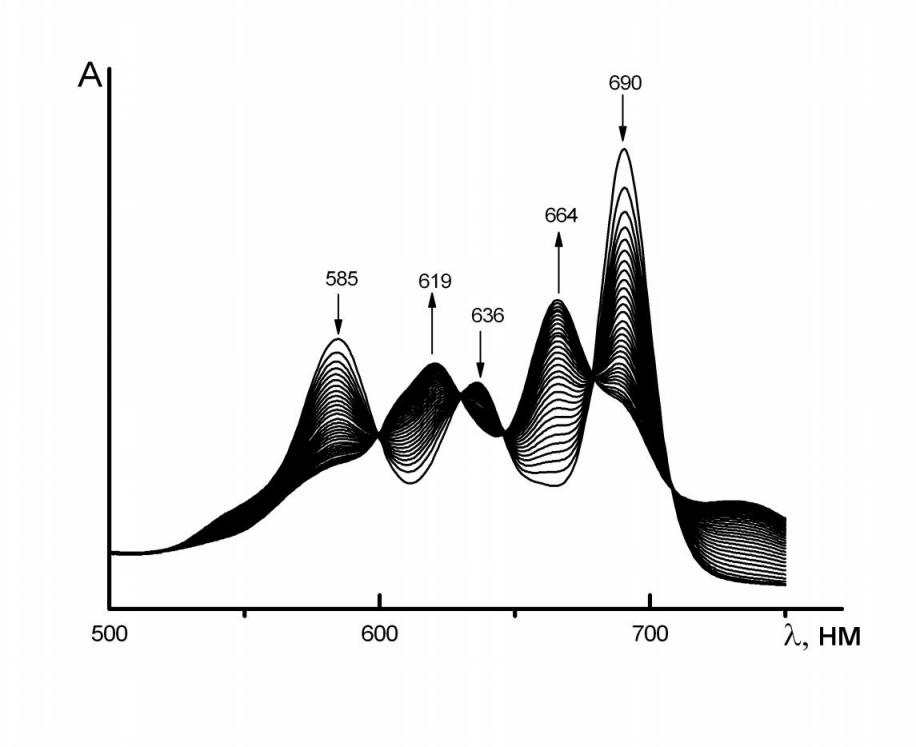 |
| Рис. 11. Изменение ЭСП H2Tap(C6H4CF3)8 в присутствии н-бутиламина в течение 60 мин при СBuNH2 = 5.06 моль/л и Т=348 К | Рис. 12. Изменение ЭСП H2Тар(C6H4CF3)6(С4Н4) в присутствии н- бутиламина в течение 90 мин при СBuNH2 = 2.53 моль/л и Т = 338 К |
Обнаружено, что образующиеся в результате депротонирования макроцикла комплексы с переносом протонов H2Tap(C6H4CF3)82Mor, H2Tap(C6H4CF3)8 2BzNH2, H2Tap(C6H4CF3)8 2Pip, H2Tap(C6H4CF3)8 2BuNH2, H2Tap(C6H4CF3)8 2(t-BuNH2), H2Тар(C6H4CF3)6(С4Н4)2BuNH2 и H2Тар(C6H4CF3)6(С4Н4)2Pip являются кинетически неустойчивыми и подвергаются распаду с деструкцией – хромофора молекулы.
3.6. Реакционная способность фенилзамещенных тетраазапорфина в
кислотно - основном взаимодействии с азотсодержащими основаниями в бензоле
Реакции кислотно-основного взаимодействия с участием фенилзамещенных тетраазапорфина:
H2Tap(C6H4CF3)8 + 2В H2Tap(C6H4CF3)8 2В (8)
H2Тар(C6H4CF3)6(С4Н4) + 2В H2Тар(C6H4CF3)6(С4Н4) 2В (9)
подчиняются кинетическим уравнениям:
-d СH2Tap(C6H4CF3) 8 / d = k СH2Tap(C6H4CF3) 8 СB, (10)
где В – Mor, BzNH2, Pip, BuNH2 и t-BuNH2.
-d СH2Тар(C6H4CF3) 6(С4Н4) / d = k СH2Тар(C6H4CF3) 6(С4Н4) СВ, (11)
где В - BuNH2, Pip.
Как и в случае взаимодействия H2Рс(t-Bu)4(NO2)4 с морфолином в бензоле межмолекулярный перенос протонов NH – групп от H2Tap(C6H4CF3)8 и H2Тар(C6H4CF3)6(С4Н4) к В происходит в две стадии и относятся к числу медленных процессов (табл. 5, 6).
Таблица 5.
Кинетические параметры реакции кислотно-основного взаимодействия Н2Тар(С6Н4СF3)8 с азотсодержащими основаниями в бензоле,
(СH2Tap(C6H4CF3) 8 =0.43 x 10-5 моль/л)
| Основание (В) | СВ, моль/л | Т, К | kэф x 105, с-1 | k x 106, л/(моль·с) | Еа., кДж/моль | A, c-1 |
| ВuNH2 | 7.60 | 298 328 338 348 | 3.5 9.2±0.4 13.0±0.5 18.0±0.7 | 4.2 11.0±0.3 15.5±0.5 21.5±0.6 | 31±3 | 1.14 |
| t-ВuNH2 | 9.05 | 298 328 338 348 | 0.42 0.55±0.02 0.73±0.03 1.35±0.05 | 0.37 0.50±0.01 0.65±0.02 1.20±0.03 | 44±4 | 2.57·102 |
| Mor | 10.90 | 298 328 338 348 | 0.12 0.90±0.03 1.60±0.06 2.90±0.10 | 0.11 0.82±0.02 1.47±0.04 2.70±0.08 | 55±6 | 4.81·102 |
| BzNH2 | 8.00 | 298 328 338 348 | 0.12 1.04±0.03 2.04±0.06 3.65±0.10 | 0.18 1.60±0.05 3.15±0.10 5.60±0.17 | 59±6 | 3.96·103 |
| Pip | 8.95 | 298 328 338 348 | 5.00 17.1±0.7 25.04±1.00 35.07±1.40 | 6.23 21.20±0.60 31.17±0.90 42.40±1.20 | 34±3 | 5.68 |
Примечание. Параметры k298 рассчитаны по уравнению Аррениуса.
Как и следовало ожидать, наиболее реакционноспособными при взаимодействии с H2Tap(C6H4CF3)8 являются BuNH2 (рКа=10.60) и Pip (рКа=11.23). Замена BuNH2 на t-BuNH2 (рКа=10.45) приводит к снижению скорости КОВ в ~10 раз (табл. 5). В отличие от первичных аминов перенос протонов NH – групп от H2Tap(C6H4CF3)8 к Еt2NH (рКа=10.93) и Еt3N (рКа=10.87) не наблюдается. Не менее сильное влияние на кинетику КОВ оказывает протонодонорная способность В. В ряду Pip BzNH2 Mor уменьшение рКа на ~2.5 порядка приводит к снижению скорости переноса протонов NH – групп в ~60 раз на фоне роста Еа процесса (табл. 5). Пиридин (рКа=5.23) и 2 – метилпиридин (рКа=5.97) вследствие низкой протоноацепторной способности не вступают во взаимодействие с H2Tap(C6H4CF3)8 в бензоле.
В отличие от H2Tap(C6H4CF3)8 перенос протонов NH – групп от H2Тар(C6H4CF3)6(С4Н4) к BzNH2, Mor и t-BuNH2 не наблюдается. В случае с BuNH2 и Pip скорость КОВ, судя по величинам k298, различается в ~7 и 14 раз соответственно на фоне увеличения Еа процесса (табл. 5, 6).
Следовательно,, – бензоаннелирование в тетраазапорфириновом макроцикле приводит к уменьшению кислотных свойств молекулы, что затрудняет перенос протонов NH – групп от H2Тар(C6H4CF3)6(С4Н4) к В.
Таблица 6.
Кинетические параметры реакции кислотно-основного взаимодействия H2Тар(C6H4CF3)6(С4Н4) с азотсодержащими основаниями в бензоле,
(СH2Тар(C6H4CF3) 6(С4Н4) = 0.82 x 10-5 моль/л)
| Основание (В) | СВ, моль/л | Т, К | kэф x 105, с-1 | k x 106, л/(моль·с) | Еа., кДж/моль | A, c-1 |
| ВuNH2 | 5.06 | 298 328 338 348 | 0.30 3.0±0.1 5.6±0.2 11.0±0.4 | 0.60 5.9±0.2 11.0±0.3 21.8±0.6 | 61±6 | 2.95·104 |
| Рip | 5.11 | 298 328 338 348 | 0.30 3.70±0.15 7.4±0.3 15.1±0.6 | 0.45 5.20±0.15 10.45±0.30 29.50±1.00 | 67±7 | 2.51·105 |
Примечание. Параметры k298 рассчитаны по уравнению Аррениуса
Анализ кинетических данных (табл. 3,5) показывает, что Н2Тар(С6Н4СF3)8 в реакции с основаниями является менее реакционноспособным, чем H2Рс(t-Bu)4(NO2)4. Кроме того, он не активен при взаимодействии с Еt2NH в бензоле, а с BuNH2 и Pip реакция идет во времени. На основании полученных данных можно сделать вывод, что ряду H2Рс(t-Bu)4 H2Tap(C6H4CF3)6(С4Н4) H2Tap(C6H4CF3)8 H2Рс(t-Bu)4(NO2)4 кислотность внутрициклических NH – связей увеличивается, и как следствие, облегчается межмолекулярный перенос протонов NH – групп от макроциклической молекулы к В.
Основные результаты и выводы
1. Осуществлен синтез ранее неизвестных 4-трет-бутил-5-нитрофталонитрила и тетра(4-трет-бутил-5-нитро)фталоцианина на его основе.
2. Проведено систематическое исследование реакций кислотно-основного взаимодействия трет-бутилзамещенных фталоцианина и трифторметилфенилзамещенных тетраазапорфина с азотсодержащими основаниями в бензоле и диметилсульфоксиде.
3. Показано, что в присутствии азотсодержащих протоноакцепторных молекул H2Рс(t-Bu)4, H2Рс(t-Bu)4(NO2)4, H2Tap(C6H4CF3)8 и H2Tap(C6H4CF3)6(С4Н4) проявляют свойства двухосновных NH – кислот и образуют различные по кинетической устойчивости комплексы с переносом протонов. Наибольшей устойчивостью обладают комплексы, образованные с участием H2Рс(t-Bu)4.
4. Установлено, что реакции кислотно-основного взаимодействия с участием исследованных фталоцианинов и тетраазапорфиринов относятся к числу кинетически контролируемых процессов и характеризуются необычно низкими значениями констант скоростей.
5. Обнаружено, что с увеличение рКа оснований удаление внутрициклических протонов NH –групп облегчается. Напротив, увеличение числа алкильных заместителей в амине, а также разветвление углеводородной цепи в азотсодержащем основании существенно затрудняет этот процесс.
6. Показано, что реакционная способность изученных фталоцианинов и тетраазапорфинов при взаимодействии с основаниями возрастает в ряду H2Рс(t-Bu)4 H2Tap(C6H4CF3)6(С4Н4) H2Tap(C6H4CF3)8 H2Рс(t-Bu)4(NO2)4, вследствие увеличения кислотных свойств молекулы.
Основное содержание работы изложено в публикациях:
1. Петров, О.А. Кинетические особенности межмолекулярного переноса протонов NH - групп окта(м – трифторметилфенил)тетраазапорфина в системе азотсодержащее основание-бензол / О.А. Петров, О.Г. Хелевина, Е.Л. Кузмина // Журн. физ. химии, 2010. -Т. 84. – Вып. 9. - С. 1654 -1659.
2. Петров, О.А. Кинетика переноса протонов от октафенилзамещенных тетраазапорфиринов к органическим основаниям в бензоле / О.А. Петров, Е.Л. Кузмина, О.Г. Хелевина, В.Е. Майзлиш // Журн. физ. химии, 2011.-Т 85. – Вып. 9. - С. 1696 - 1701.
3. Кузмина, Е.Л. Кинетика кислотно-основного взаимодействия тетра(4-трет-бутил)фталоцианина с азотсодержащими основаниями в диметилсульфоксиде / Е.Л. Кузмина, О.А. Петров // Журн. общ. химии, 2012. - Т.82. – Вып. 5. - С. 850- 855.
4. Петров, О.А.Кинетика переноса протонов от гекса(м-трифторметилфенил)бензо -
тетраазапорфирина к азотсодержащим основаниям в бензоле / О.А. Петров, Е.Л. Кузмина // Журн. физ. химии, 2012. - Т.86. – Вып. 12. - С.1958 - 1963.
5. Майзлиш, В.Е. 4–Трет–бутил-5–нитрофталонитрил / В.Е. Майзлиш, И.Г. Абрамов, А.В. Шалина, А.В. Родионов, А.В. Борисов, Е.Л. Кузмина, В.В. Александрийский, О.А. Петров, Г.П. Шапошников // Изв. вузов. Химия и хим. технология, 2013. - Т 56. – Вып. 2. – С. 11-17.
6. Кузмина, Е.Л. Кинетика образования комплексов с переносом протонов тетра(4-трет-бутил)фталоцианина в системе азотсодержащее основание – диметилсульфоксиде / Е.Л. Кузмина, О.А. Петров, В.Е. Майзлиш // Тез. докладов XXV Международной Чугаевской конференции по координационной химии и «Физико-химические методы в химии координационных соединений». Суздаль, 2011. - С. 269.
7. Кузмина, Е.Л. Реакционная способность фенилзамещенных тетраазапорфиринов в кислотно – основном взаимодействии с азотсодержащими основаниями / Е.Л. Кузмина, О.А. Петров, М.С. Наумова // Тез. докладов международной молодежной научной школа «Химия порфиринов и родственных соединений». Иваново, 2012. - С. 69-70.
8. Кузмина Е.Л. Реакционная способность замещенных фталоцианина в кислотно-основном взаимодействии с азотсодержащими основаниями / Е.Л. Кузмина, Г.В. Осипова, А.В. Родионов, О. А. Петров, В. Е. Майзлиш // Тез. докладов международной молодежной научной школы «Химия порфиринов и родственных соединений». Иваново, 2012. - С. 70-71
9. Журавлева, Ю.М. 4–Трет-бутил-5–нитрофталонитрил и металлофталоцианины на его основе / Ю.М. Журавлева, Е.Л. Кузмина, В.Е. Майзлиш // Тез. докладов всероссийской конференции «Современные проблемы химической науки и образования». Чебоксары, 2012. - Т.1. - С. 71
10. Шалина, А.В. Замещенные металлофталоцианины, сочетающие нитро- и трет-бутильные группы / А.В. Шалина, Ю.М. Журавлева, Е.Л. Кузмина // Тез. докладов молодой науки в классическом университете для студентов, аспирантов и молодых ученых: Актуальные проблемы современного естествознания. Иваново, ИвГУ, 2012. - С. 67- 68.
11. Кузмина, Е.Л. Состояние тетра(4-нитро-5-трет-бутил)фталоцианина в системе азотсодержащее основание-бензол / Е.Л. Кузмина, О.А. Петров, В.Е. Майзлиш, Г.П. Шапошников, В.С. Шарунов, И.Г. Абрамов // Тез. докладов XIV международной научно-технической конференции «Наукоемкие технологии - 2012». Тула, 2012. - С. 70.
12. Родионов, А.В. Синтез и кислотные свойства тетра-(4-трет-бутил-5-нитро)фтало-
цианина / А.В. Родионов, Е.Л. Кузмина, В. Е. Майзлиш, О.А. Петров // Тез. докладов 66-я всероссийской научной- технической конференции студентов, магистров и аспирантов высших учебных заведений с международным участием. Ярославль, ЯГТУ, 2013. - С. 66.

