Синтез и химическая модификация амино- и гидрокси-хлоринов
На правах рукописи
МАЛЬШАКОВА Марина Вячеславовна
СИНТЕЗ И ХИМИЧЕСКАЯ МОДИФИКАЦИЯ АМИНО- И ГИДРОКСИ-ХЛОРИНОВ
02.00.03 "Органическая химия"
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Иваново – 2006-07
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования “Сыктывкарский государственный университет”
Научный руководитель: кандидат химических наук, старший научный сотрудник
Белых Дмитрий Владимирович
Официальные оппоненты:
Ведущая организация:
Защита состоится 200 г. в часов на заседании диссертационного совета Д 212.063.01 при Государственном образовательном учреждении высшего профессионального образования ”Ивановский государственный химико-технологический университет” по адресу: 153000, г. Иваново, пр. Ф. Энгельса, д. 7.
С диссертацией можно ознакомиться в библиотеке при Государственном образовательном учреждении высшего профессионального образования ”Ивановский государственный химико-технологический университет” по адресу: 153000, г. Иваново, пр. Ф. Энгельса, д. 10.
Автореферат разослан " " 2006 г.
Ученый секретарь
диссертационного совета Хелевина О.Г.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Природные и синтетические порфирины и их аналоги находят применение в самых разных областях науки и техники. Из-за высокой стоимости и относительно низкой стабильности природные порфирины, в частности, хлорофиллы и их производные используются главным образом для синтеза биологически активных веществ и медицинских препаратов. Основные направления применения производных хлорофилла в медицине – онкология и гематология. В настоящее время ряд производных хлорофилла (а) активно исследуются в качестве фотосенсибилизаторов (ФС) для фотодинамической терапии (ФДТ) онкологических заболеваний. Некоторые из этих веществ (хлорин е6) уже используются в клинической практике как действующие вещества медицинских препаратов. Хлорины, содержащие карборановые фрагменты, считаются перспективными препаратами для борнейтронзахватной терапии (Б-НЗТ) онкологических заболеваний, причем сочетание в одной молекуле хлоринового и карборанового фрагментов позволяет применять Б-НЗТ совместно с ФДТ (так называемые «двойные» или «бинарные» стратегии терапии). Высокая тропность производных хлорофилла к злокачественным новообразованиям позволяет рассматривать их как основу противоопухолевых препаратов с любым механизмом действия (ингибирование МЛУ, цитостатическое действие и т.п.). Присоединение к молекуле природного хлорина соответствующего фармакофора может дать соединение направленного действия, избирательно поражающее злокачественное новообразование. Кроме того, сочетание в одной молекуле двух и более фармакофоров может привести к усилению уже известных активностей вещества и возникновению новых. Спектральные характеристики природных хлоринов и их низкая темновая токсичность позволяют считать эти соединения так же потенциальными ФС для фотодинамической стерилизации донорской крови.
Кроме того, природные хлорины зачастую являются практически безальтернативными исходными соединениями для синтеза несимметричных хлоринов и порфиринов: синтез таких соединений, исходя из пиррола и его производных, зачастую более сложен, чем получение таких соединений из хлорофилла и его ближайших производных.
Таким образом, изучение химических превращений природных хлоринов и разработка методов введения в их молекулы фармакофорных групп и фрагментов биологически активных соединений представляет интерес, как с точки зрения фундаментальной науки, так и с практической точки зрения.
Цель и задачи исследования. Целью настоящей работы является разработка методов введения на периферию хлоринового макроцикла фрагментов биологически активных молекул, фармакофорных групп и других заместителей.
Для достижения поставленной цели необходимо было решить следующие задачи:
-синтез амидных производных хлорина е6, содержащих амино- и гидрокси-группы;
-изучение взаимодействия метилфеофорбида (а) с этилендиамином с целью синтеза ди- и три-аминохлоринов;
-синтез хлоринов, содержащих фармакофорные группы, фрагменты биологически активных молекул и другие заместители с использованием реакций гидроксильных и амино-групп полученных производных хлорина е6.
Научная новизна работы. С высокими выходами синтезированы амидные производные хлорина е6, содержащие в молекуле одну, две и три амино-группы, а так же хлорины, содержащие амино-группы, присоединенные к хлориновому циклу мостиками различной длины. На примере синтеза ряда полифункциональных хлоринов показана возможность использования реакций алкилирования и ацетилирования периферических гидроксильных и амино-групп амидных производных хлорина е6 для введения дополнительных заместителей на периферию хлоринового цикла. Варьирование длины спейсера, присоединяющего амино-группу, позволяет регулировать расстояние, на котором располагается вводимый на периферию хлоринового цикла фрагмент. В результате впервые синтезированы хлорины, содержащие на периферии хлоринового цикла один или два фрагмента дитерпеноида изостевиола. Получены новые производные хлорина е6, содержащие в молекуле карборановый фрагмент. Осуществлено введение на периферию хлоринового макроцикла присоединенной гибкими длинными спейсерами винильной группы. Предложенный в настоящей работе подход к введению дополнительных заместителей на периферию хлоринового цикла может быть распространен на синтез других полифункциональных хлоринов.
Практическая значимость. Синтезированные соединения являются потенциальными ФС для терапии онкологических и вирусных заболеваний (хлорины, содержащие на периферии хлоринового цикла один или два фрагмента дитерпеноида изостевиола); препаратами для совместного применения ФДТ и Б-НЗТ злокачественных новообразований (производные хлорина е6, содержащие карборановый фрагмент); мономерами для синтеза полимерных ФС для фотодинамической стерилизации крови (хлорины, содержащие на периферии макроцикла винильную группу, присоединенную мостиками различной длины).
Апробация работы и публикации. Основные материалы работы докладывлись и обсуждались на 3 Всероссийских конференциях: Санкт-Петербург, (2005); Казань (2005); Сыктывкар, (2006). По материалам диссертации опубликовано 2 статьи и тезисы 5 докладов на Всероссийских конференциях. Получено положительное решение на патент.
Объем и структура диссертации. Диссертационная работа изложена на стр., содержит таблицы, рисунков и состоит из введения, 3-х глав, выводов и списка литературы из наименований.
Основное содержание работы
1. Литературный обзор
В литературном обзоре рассмотрены методы введения амино- и гидрокси-групп на периферию хлоринового цикла и использование реакций введенных амино- и гидрокси-групп для дальнейшей химической модификации природных хлоринов. Анализ имеющихся литературных данных позволяет заключить, что одним из самых простых способов введения гидроксильной и амино-группы на периферию хлоринового цикла является реакция раскрытия экзоцикла метилфеофорбида (а) и его аналогов под действием амино-спиртов и диаминов соответственно. В то же время, дальнейшая химическая модификация с использованием реакций гидроксильных и амино-групп получаемых таким образом 13-амидов хлорина е6 в литературе не описана. Синтез хлоринов с двумя и тремя гидроксильными группами может быть осуществлен амидированием сложноэфирных групп хлорина е6 13-N-(2-гидроксиэтил)-амида 15,17-диметилового эфира при действии чистого этаноламина, причем реакция протекает в мягких условиях с высоким выходом ди- и три-аминохлоринов и не требует предварительной активации исходного соединения. Несмотря на то, что этот подход, по-видимому, ограничен и может быть использован только в случае простых аминов, жидких при обычных условиях, простота исполнения реакции, регио-селективность и высокие выходы являются его важными преимуществами. На основе анализа литературных данных определены цель и задачи исследования.
2. Результаты и их обсуждение
2.1. Синтез амино- и гидроксихлоринов
Исходя из метилфеофорбида (а) (1) синтезирован ряд амино- и гидрокси-хлоринов.

| X; n | Условия реакции | Выход, % | |
| 2 | O; 2 | Этаноламин, CHCl3, комнатная температура, 2 ч. | 80 |
| 3 | N; 2 | Этилендиамин, CHCl3, комнатная температура, 3 ч. | 75 |
| 4 | N; 6 | Гексаметилендиамин, ТГФ, комнатная температура, 3 ч. | 77 |
Рис. 1. Синтез гидрокси- и аминохлоринов
Взаимодействие с этаноламином для получения соответствующего амида проводилось согласно литературной методике, спектральные характеристики совпадают с описанными в литературе. Аминохлорины с амино-группами, присоединенными спейсерами различной длины получены при действии на метилфеофорбид (а) этилендиамина и гексаметилендиамина, изменения, происходящие в спектральных характеристиках (ИК и ЯМР) аналогичны описанным в литературе.
Изучено взаимодействие (1) с этилендиамином. Показано, что при действии чистого этилендиамина на амид (3) происходит амидирование его сложноэфирных групп, причем сначала в реакцию вступает сложноэфирная группа заместителя в положении 17:
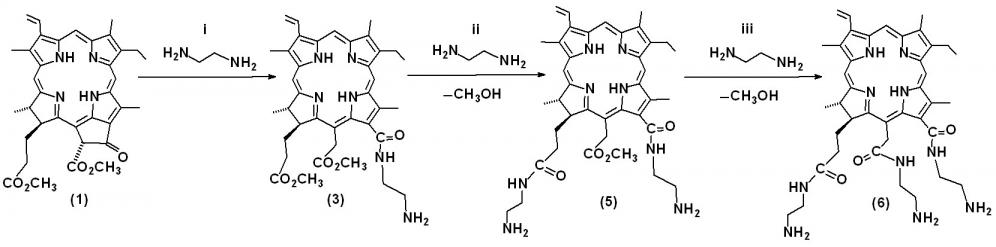
i: этилендиамин, CHCl3, 200С, 3 ч; ii: этилендиамин, 200С, 20 ч, без выделения исходного моноамида; iii: этилендиамин, 200С, 40 ч.
Рис. 2. Синтез ди- и триаминохлоринов
Получение ди- и три-аминохлоринов (5) и (6) может быть осуществлено с высокими выходами и без выделения промежуточных соединений. Показано, что в реакции амидирования этилендиамином большей реакционной способностью обладает сложноэфирная группа в положении 17, что совпадает с литературными данными по реакциям амидирования этаноламином и кислотно-катализируемого гидролиза сложноэфирных групп аналогичных амидных производных хлорина е6. Более высокую реакционную способность сложноэфирной группы в положении 17 можно объяснить ее меньшей стерической затрудненностью.
Ввиду не очень хорошей растворимости синтезированного триаминохлорина (6) в органических растворителях, подтверждение его строения при помощи ПМР-спектроскопии оказалось затруднительным. Поэтому был получен его триацетат (7), структура которого была установлена при помощи ИК- и ПМР-спектроскопии.
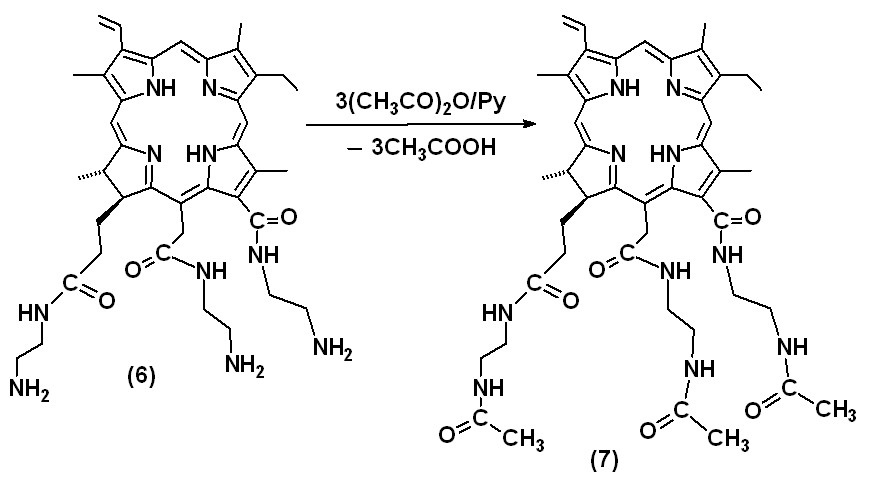
Рис. 3. Синтез триацетата триаминохлорина (7).
2.2. Химическая модификация амино- и гидрокси-производных хлорина е6 с использованием реакций амино- и гидрокси-групп
2.2.1. Алкилирование амино- и гидрокси-групп производных хлорина е6
Алкилирование амино-хлоринов бензилхлоридом приводит к соответствующим N-бензильным производным:

| n | Условия реакции | Выход, % | |
| 8 | 2 | Кипячение в метаноле, 3 ч | 59 |
| 9 | 6 | Кипячение в метаноле, 1.5 ч | 24 |
Рис. 4. Синтез N-бензильных производных хлорина е6

