Закономерности электрохимической интеркаляции лития в железоуглеродные сплавы и аналитические приложения
На правах рукописи
КУЧЕРЕНКО Светлана Викторовна
ЗАКОНОМЕРНОСТИ ЭЛЕКТРОХИМИЧЕСКОЙ ИНТЕРКАЛЯЦИИ ЛИТИЯ В ЖЕЛЕЗОУГЛЕРОДНЫЕ СПЛАВЫ
И АНАЛИТИЧЕСКИЕ ПРИЛОЖЕНИЯ
Специальность 02.00.05 – Электрохимия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Саратов – 2009
Работа выполнена в ГОУ ВПО «Южно-Российский государственный технический университет (Новочеркасский политехнический институт)»
Научный руководитель – кандидат химических наук, доцент
Липкин Михаил Семенович
Официальные оппоненты – доктор химических наук, профессор
Попова Светлана Степановна
кандидат химических наук
Маленкова Анжелика Станиславовна
Ведущая организация – ОАО «Литий-элемент» (г. Саратов)
Защита состоится «28» мая 2009 г. в 13 часов на заседании диссертационного совета Д 212.242.09 при ГОУ ВПО «Саратовский государственный технический университет» по адресу: 413100, г. Энгельс, пл. Свободы, 17, Энгельсский технологический институт (филиал) ГОУ ВПО «Саратовский государственный технический университет», ауд. 237.
С диссертацией можно ознакомиться в научно-технической библиотеке ГОУ ВПО «Саратовский государственный технический университет» по адресу: 410054, Саратов, ул. Политехническая, 77.
Автореферат разослан « 28 » апреля 2009 года.
Ученый секретарь
диссертационного совета В.В. Ефанова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Создание и развитие средств и методов анализа содержания углерода в конструкционных сплавах является важной и актуальной задачей современного производства, поскольку именно от этого параметра зависит большой комплекс их механических и физико-химических свойств. Большие перспективы в решении этой задачи имеют электрохимические методы экспресс-контроля, сочетающие аппаратную простоту, оперативность, а главное – чувствительность как к составу, так и структуре исследуемых железоуглеродных сплавов. Эти широкие возможности открывает процесс электрохимической интеркаляции лития в структуру железоуглеродных фаз.
Изучение закономерностей интеркаляции новых структур представляется очень важным для развития теории и приложения электродных процессов в апротонных органических электролитах – литиевых и литий-ионных ХИТ, сплавов, аккумулирующих водород, и многих других.
Анализ литературных данных свидетельствует об актуальности разработки новой методики экспресс-определения содержания углерода. Сложность этой задачи для существующих методов анализа связана: с малым ковалентным радиусом углерода, со сложным характером его микро- и макрораспределения по объему и в кристаллической решетке железоуглеродного сплава, а также требованием экспрессности и неразрушающего пробоотбора.
В настоящей работе рассматриваются возможности применения электрохимической интеркаляции лития в структуру железоуглеродных фрагментов стали из апротонных органических электролитов для разработки неразрушающего электрохимического экспресс-определения содержания и идентификации фазового состояния углерода.
Цель работы заключалась в выборе электролитной системы и параметров подаваемых и измеряемых сигналов, обеспечивающих возможность применения процесса электрохимической интеркаляции лития в железоуглеродные сплавы в количественном и фазовом анализе углерода в конструкционных сталях.
Задачи исследования:
– изучение стехиометрических соотношений процесса интеркаляции;
– разработка методики и изучение закономерностей процесса интеркаляции лития в железоуглеродные фазы;
– выбор растворителя и соли электролитной системы, обеспечивающих получение аналитического сигнала;
– апробация методики неразрушающего определения углерода.
Научная новизна работы.
Впервые показана возможность электрохимической интеркаляции лития в железоуглеродные фазы углеродистых сталей и чугунов. Показано, что в зависимости от условий интеркаляции могут образовываться «солеподобные» и «металлоподобные» интеркалаты. Установлено, что механизм процесса интеркаляции включает, кроме известных стадий транспорта в электролите и твердой фазе, стадию переноса решеточных искажений. Показано, что выявленные закономерности интеркаляции лития могут служить основой методики вольтамперометрического и гальваноимпульсного определения массовой доли и фазовых состояний углерода в конструкционных сталях.
Практическая значимость. Результаты работы могут быть рекомендованы к внедрению в лабораториях технологического контроля машиностроительных, металлургических предприятий, организаций-поставщиков металлопродукции, научных и образовательных учреждениях, связанных с анализом сталей в виде методик и устройств электрохимического экспресс-анализа конструкционных сталей.
На защиту выносятся следующие положения:
- новый фактический материал о возможности интеркаляции литием углеродсодержащих фаз железоуглеродных сплавов из апротонных органических электролитов;
- зависимость равновесный потенциал – состав интеркалата определяется деформацией кристаллической решетки и взаимодействием интеркалированных частиц;
- кинетика интеркаляции железоуглеродных фаз включает стадии транспорта в электролите, электрохимическую стадию и твердофазный перенос, периодически сменяющие друг друга в ходе процесса;
- новые данные о количественном определении углерода на основе калибровочных зависимостей, полученных по поляризационным кривым электрохимической интеркаляции, а также по форме катодной импульсной хронопотенциограммы.
Апробация работы. Результаты диссертационной работы были представлены на Всероссийской конференции «Электрохимия и экология» (Новочеркасск, ЮРГТУ (НПИ), 2008), на I-й Международной научной конференции «Современные методы в теоретической и экспериментальной электрохимии» (Плес, 2008), на 56-й и 57-й научно-технических конференциях (Новочеркасск, ЮРГТУ (НПИ), 2007, 2008), на внутривузовских конференциях и научных семинарах ЮРГТУ (НПИ) 2006, 2007, 2008 г.
Публикации. По материалам диссертации опубликованы 12 работ, из них 2 статьи – в центральных журналах, рекомендованных ВАК, 3 статьи в ведущих научных рецензируемых журналах и 7 публикаций в сборниках материалов конференций.
Структура и объем работы. Диссертационная работа состоит из введения, пяти глав, основных выводов. Список использованных литературных источников включает 148 наименований. Диссертация изложена на 155 страницах машинописного текста, содержит 75 рисунков, 19 таблиц и приложения.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснована актуальность темы диссертации, сформулированы цель и задачи, которые решались в процессе выполнения работы.
В первой главе изложены основные литературные данные о структурных и кристаллографических состояниях углерода в сталях и чугунах. Особое внимание уделено термодинамической активности углерода в железоуглеродных сплавах, макро- и микрораспределению углерода в сталях и чугунах. Рассмотрены существующие методы и методики определения углерода в сталях, анализ которых показал, что углерод определяют в основном количественно, не указывая присутствующих в образце углеродсодержащих фаз. Большое внимание уделено структурным особенностям процесса интеркаляции, термодинамике, кинетике и механизму электрохимической интеркаляции. Рассмотрено влияние эффекта соинтеркаляции анионов литиевой соли и молекул растворителя, а также сольватации катиона лития в неводных электролитах.
Вторая глава «Методика экспериментальных исследований» содержит описание используемых образцов железоуглеродных сплавов и методик исследования.
В работе использовали эталонные образцы углеродистых сталей и чугунов Института стандартных образцов Центрального научно-исследовательского института черной металлургии им. И.П. Бардина, утвержденных Госстандартом и внесённых в Государственный реестр средств измерений, прошедших государственные испытания (табл. 1). Структура и фазовый состав образцов были исследованы с помощью металлографического и рентгенофазового анализов.
В качестве электролитов использовали: безводный LiBF4 в ацетонитриле, LiBF4 в диметилформамиде, LiBF4 в пропиленкарбонате в смеси с диметоксиэтаном (1:3), LiCl в ацетонитриле, LiCl в ацетоне, LiClO4 в ацетонитриле концентрациями 1 моль/л. Соли, используемые в электролитах, были квалификации х.ч., используемые растворители – марки ч.д.а.
Для удаления воды из электролита использовали молекулярные сита типа CaX (синтетический цеолит). Свежепрокаленные молекулярные сита массой из расчета 50 г/л засыпали в герметичную ячейку с электролитом и выдерживали в течение трех суток. Операцию повторяли 3 раза. Чистоту электролита контролировали поляризационными измерениями на индифферентном электроде, сравнивая кривые фона с кривыми основного процесса. Для всех образцов соотношение токов кривой основного процесса к токам фона составляло от одного порядка и более.
Для оценки общей картины интеркаляции применяли вольтамперометрический метод с линейной разверткой потенциала, изучение состава интеркалатов осуществляли потенциостатической кулонометрией. Измерения проводили на установке, включающей потенциостат П-50-1, программатор ПР-8, самописец XY RECORDER A3, а также стандартную трехэлектродную ячейку с объемом рабочего раствора 50 мл. Рабочим электродом служили стандартные образцы сталей и чугунов. В качестве электрода сравнения использовали хлорсеребряный электрод, реализованный в соответствующем неводном электролите, вспомогательным электродом служил стеклоуглерод. Конструкционные элементы ячейки были изготовлены из стекла и фторопласта, являющихся инертными к используемым электролитам. Перед проведением каждого опыта образцы шлифовали на наждачной бумаге, затем на фильтровальной бумаге.
Таблица 1
Основные характеристики используемого набора стандартных образцов
| Марка железоуглеродного сплава | ГСО | Содержание углерода, % | Количество структурных составляющих, % | Количество фаз, % |
| Сталь У11 | 4150–93П | 0,119 | Феррит – 87,871, Перлит – 12,129 | Феррит – 98,304, цементит – 1,696 |
| Сталь У12 | 4362–92П | 0,219 | Феррит – 74,968, Перлит – 25,032 | Феррит – 96,804, цементит – 3,196 |
| Сталь У15 | 4464–91П | 0,205 | Феррит – 76,774, Перлит – 23,226 | Феррит – 97,014, цементит – 2,986 |
| Сталь УНЛ2 | 1377–93П | 0,188 | Феррит – 78,968, Перлит – 21,032 | Феррит – 97,269, цементит – 2,731 |
| Чугун Ч5г | 1148–91П | 1,82 | Перлит – 98,972 Графит – 1,028 | Феррит – 87,180, цементит–11,793 графит – 1,028 |
| Чугун Ч7в | 1378–88П | 2,90 | Перлит – 97,883 Графит – 2,117 | Феррит – 86,221, цементит–11,663 графит – 2,117 |
| Чугун Ч10а | 4460–91П | 3,21 | Перлит – 97,571 Графит – 2,429 | Феррит – 85,946, цементит–11,625 графит – 2,429 |
Термодинамические и кинетические закономерности изучали методом ступенчатой потенциостатической хроноамперометрии, количественное и фазовое определение углерода осуществляли катодной импульсной хронопотенциометрией с использованием датчика прижимной конструкции.
В третьей главе «Вольтамперометрические и потенциостатические исследования интеркаляции лития в металлуглеродные образцы» определены диапазоны потенциалов изучаемого процесса, а также стехиометрические соотношения интеркаляции.
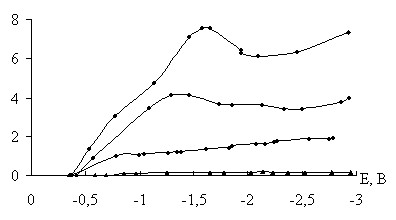
Поляризационные кривые интеркаляции для всех рассматриваемых электролитов характеризовались участками задержки и спадов тока при потенциалах в диапазонах – 1,4 – 1,9 В и – 2,5 до – 3 В (рис. 1). Первому диапазону можно поставить в соответствие процессы интеркаляции лития в малоуглеродные структурные фрагменты ферритного типа FexCy:
FexCy + zLi+(s) + z LizFexCy,
где Li+(S) – сольватированный катион лития в используемом неводном электролите.
Вторую область потенциалов можно соотнести с интеркаляцией цементитных фрагментов, в области потенциалов – 3 В вероятна интеркаляция фрагментов свободного углерода.
Для изучения продуктов катодного внедрения (интеркалатов) процесс проводили потенциостатически при потенциалах характерных участков катодных поляризационных зависимостей. По результатам измерения рН воды, в которой выдерживали интеркалированный образец (табл. 2) видно, что при потенциалах интеркаляции малоуглеродных фрагментов наблюдалась кислая среда. Это можно объяснить образованием «солеподобных» интеркалатов, для которых состояние лития близко к ионному, а взаимодействие с водой сводится к коррозии железа по схеме
2LizFexCy + H2O + 1/2O2 2LizFexO-Cy + 2H+.
При этом деинтеркаляция под действием воды являлась существенно заторможенным процессом. Таким образом, интеркаляция лития в металлуглеродные фазы является, по-видимому, необратимой.
При более отрицательных потенциалах образуются, вероятно, «металлоподобные» интеркалаты, взаимодействующие с водой по схеме
2LizFexCy + 2zH2O 2FexCy + 2zLiOH + H2. ![]()
В результате этого взаимодействия среда раствора становилась щелочной, в данном случае можно говорить об электрохимической обратимости интеркаляции. Электрохимическая обратимость продуктов интеркаляции была максимальной для высокоуглеродных фрагментов, что следует из взаимного расположения катодного перегиба и соответствующего ему анодного максимума на ЦВА (рис. 2).
Обратимая интеркаляционная емкость, (табл. 2), в значительной мере зависит от величины потенциала интеркаляции и природы электролитной системы: она существенно возрастает для всех электролитных систем при потенциалах в окрестности – 3 В, что соответствует высокоуглеродным фрагментам. Наблюдаемые на поляризационных зависимостях максимальные плотности тока также обнаруживают сильную зависимость от природы электролитной системы. Это можно связать с эффектом соинтеркаляции, в результате которой в структуру основы попадает не только катион лития, но и часть его сольватной оболочки.
Таблица 2
Стехиометрические характеристики процесса интеркаляции
| Электролитная система | Потенциал катодного внедрения Е, В | Количество эквивалентов Li/моль C до горизонтального участка, xs | рН | Стехиометрия обратимой интеркаляционной емкости, |
| LiBF4 в АН | – 1,7 | 0,815 | 5,1 | – |
| LiBF4 в АН | – 3 | 6,072 | 10,8 | 0,029 |
| LiBF4 в ПК+ДМЭ | – 2,1 | 2,908 | 7,8 | 0,000029 |
| LiBF4 в ПК+ДМЭ | – 3 | 0,718 | 10 | 0,0047 |
| LiBF4 в ДМФ | – 3 | 15,023 | 8,2 | 0,000074 |
| LiCl в АН | – 2,3 | 0,018 | 8,8 | 0,00029 |
| LiCl в АН | – 3,2 | 0,034 | 11 | 0,047 |
| LiCl в ацетоне | – 3,35 | 0,339 | 10,2 | 0,0074 |
| LiClO4 а АН | – 1,7 | 0,048 | 6,31 | – |
| LiClO4 в АН | – 3 | 0,053 | 7,45 | 0,000013 |

Четвертая глава «Исследование термодинамических и кинетических закономерностей электрохимической интеркаляции лития в металлуглеродные фазы» посвящена исследованию термодинамики и кинетики интеркаляции лития в углеродсодержащие фазы, а также влиянию природы электролитной системы на процесс интеркаляции.
В отличие от интеркаляции чистого углерода изучение интеркаляции лития в металлуглеродные фрагменты осложняется сильным влиянием компромиссного потенциала участков железа на устанавливающиеся бестоковые потенциалы. В связи с этим для исследования термодинамических и кинетических закономерностей интеркаляции был разработан вариант метода ступенчатой потенциостатической хроноамперометрии. Подаваемым сигналом являлся ступенчато меняющийся потенциал шагом 0,04 В, длительность 60 с. Измеряемым сигналом являлась зависимость плотности тока от времени. Кусочное интегрирование этой зависимости в пределах текущей ступени включения позволило получить дифференциальные зависимости dQ/dE от Е (рис. 3, 4).
На дифференциальных зависимостях первый участок соответствует начальным стадиям интеркаляции в малоуглеродные структурные фрагменты (ферритные фазы), существенно отличающимся по закономерностям от последующих, в связи с чем окончание этих стадий выражается точкой разрыва. Медленный рост на втором участке можно соотнести с последующими стадиями интеркаляции малоуглеродных фрагментов. Последний участок связан с интеркаляцией высокоуглеродных фрагментов (цементитные и графитовые фазы), поэтому он зачастую отсутствует на зависимостях образцов с малым содержанием углерода.
Из общей теории зависимости равновесный потенциал – состав интеркалата, а также на основании полученных экспериментальных данных и численных экспериментов была получена зависимость
Е(x) = A + B(x) + Cln(x/(xmax – x)),
где В(х) определяется кусочно-непрерывной функцией:
![]()
![]() x x1
x x1
B(x) = (x), x1 < x x2
![]() x2 < x < xmax,
x2 < x < xmax,
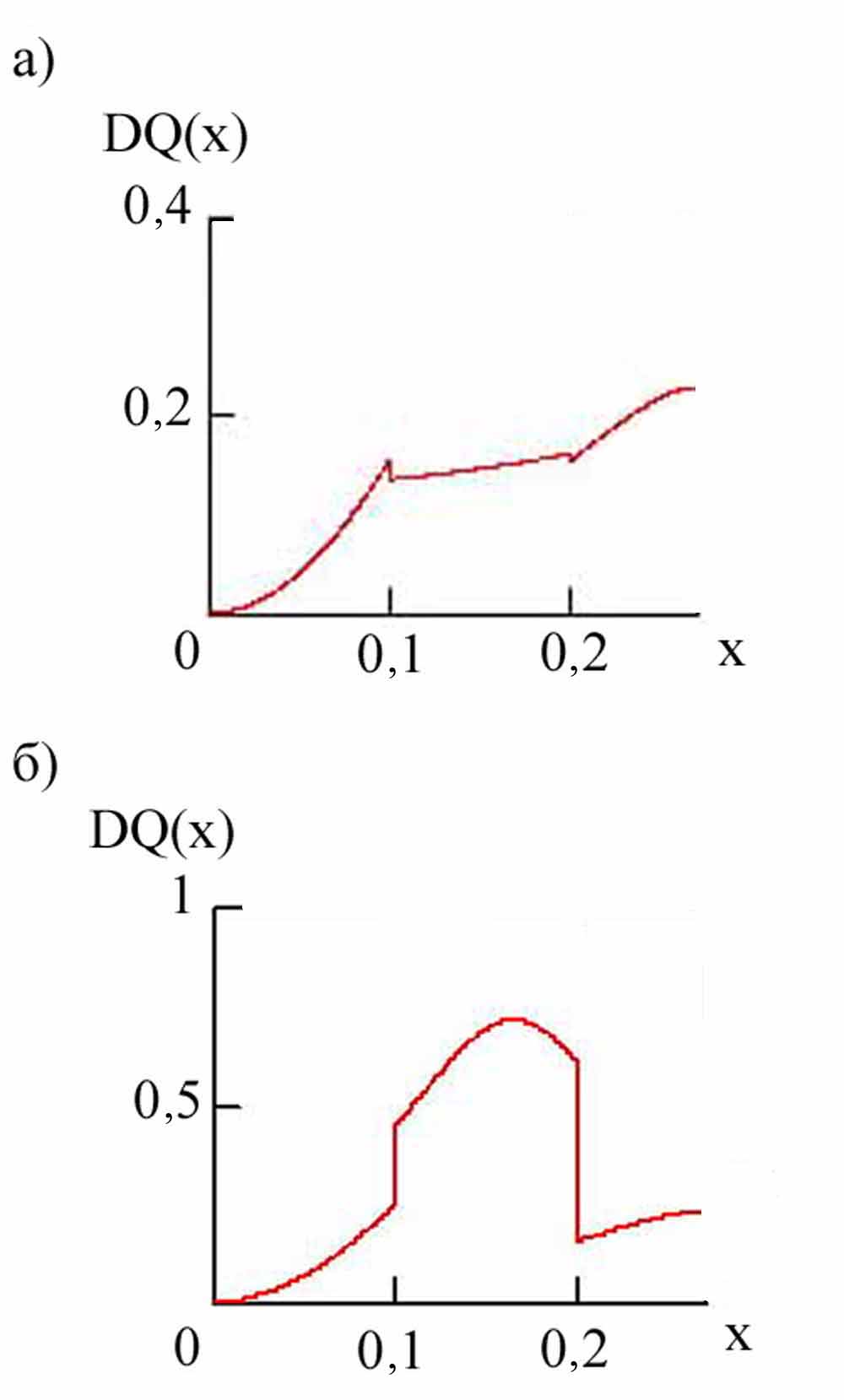
где x1, x2, xmax – стехиометрические границы соответственно первого, второго участков и максимальная стехиометрия. В расчетах использовали (x) полиномиального вида. Соответственно зависимость Е(х) будет иметь ступенчатую форму.
Расчеты с использованием функции Е(х) вида (рис. 5а) согласуются с формой экспериментальной зависимости (с точностью до постоянного множителя) для электролитов LiCl в АН и LiBF4 в АН для образцов с содержанием углерода до 0,219 %. Это соответствие означает, что зависимость равновесного потенциала интертеркаляции на первом участке определяется деформацией структуры железоуглеродных фрагментов. Следующий участок определяется взаимодействием интеркалированных частиц, преимущественно притяжением сложного характера (отрицательный коэффициент при старшей степени (x)). Последний участок также определяется деформационными ограничениями.
Зависимости, подобные полученным в электролите на основе ПК (рис. 5 б), получены для функции (x) сложной формы, что соотносится со сменой отталкивания притяжением между интеркалированными частицами. Экспериментальные зависимости имеют еще более сложную форму. Для этого электролита наблюдается изменение формы дифференциальной зависимости с изменением содержания углерода.
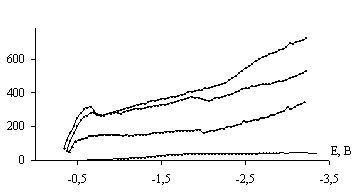
Для исследования кинетики интеркаляции лития в углеродсодержащие сплавы оценивали коэффициент диффузии лития D. Полученные значения D для каждого образца изменяются сложнопериодическим образом в диапазоне от 10-4 до 10-10 см2/с. Эффективные диффузионные константы интеркаляции можно разделить на три группы (рис. 6). Как видно из экспериментальных данных, лимитирующие стадии чередуются.
Смену лимитирующих стадий можно объяснить следующим образом: накопление внедренных частиц в поверхностных слоях материала вызывает увеличение электрохимического перенапряжения и снятие ограничений доставки ионов в электролите, в результате чего процесс начинает контролироваться твердофазными стадиями. В этих стадиях деформация решетки предшествует переносу внедренных частиц, чем можно объяснить получаемую сложнопериодическую зависимость коэффициента диффузии.
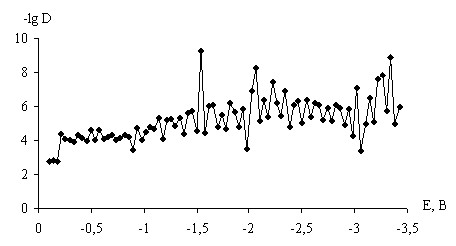
Рис. 6. Зависимость эффективных диффузионных констант от потенциала
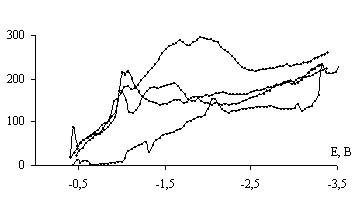
Электрохимическую стадию изучали, обрабатывая начальный участок поляризационных кривых в тафелевских координатах. Величина электрохимического перенапряжения коррелирует с дипольным моментом молекулы растворителя и радиусом аниона электролитной соли (на рис. 7 – зависимости константы уравнения Тафеля b). Это можно связать с эффектами соинтеркаляции молекулы растворителя и аниона электролитной соли, что влияет также на транспортные характеристики интеркалированных частиц.
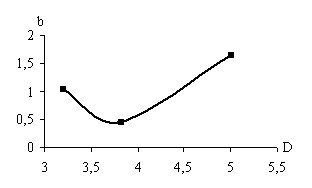
Рис. 7. Влияние природы электролита на электрохимическое перенапряжение
Соинтеркаляция компонентов электролитной соли и органического растворителя может оказывать расклинивающее и блокирующее действие на структуру основы. В первом случае понижается подвижность интеркалированного комплекса, во втором – снижается интеркаляционная емкость.
В табл. 3 приведены основные результаты изучения термодинамики и кинетики интеркаляции. Приведенную общую кинетическую картину можно интерпретировать на основе следующей качественной модели процесса. Имеются два вида каналов интеркаляции – ферритного и цементитного типа. Интеркаляция в ферритный канал (Ф) является необратимой, происходит при более положительных потенциалах и сопровождается, вероятно, «генерацией» точечных структурных дефектов (1). Внедрение в цементитный канал (Ц) является обратимым, происходит при более отрицательных потенциалах и сопровождается «поглощением» точечных дефектов (2), являющихся ловушками интеркалированных частиц. Между каналами Ф и Ц имеются переходные области (П) и дефекты (Д).
Таблица 3
Основные результаты изучения стехиометрии, термодинамики,
кинетики интеркаляции железоуглеродных фаз в различных электролитах
| Электролитная система | Общая характеристика стехиометрии интеркаляции | Термодинамика интеркаляции | Кинетическая характеристика катодного внедрения |
| LiBF4 в АН | Li0,029C при Е = – 3В | Начальные стадии интеркаляции – деформация кристаллической структуры. Далее – притяжение интеркалированных частиц | В основном - диффузия в электролите. Электрохимическое перенапряжение - среднее |
| LiBF4 в ПК+ДМЭ | Li0,0047C при Е = – 3В | Начальные стадии интеркаляции – деформация кристаллической структуры. Далее – сложное взаимодействие интеркалированных частиц | Преобладание твердофазной диффузии. Электрохимическое перенапряжение - высокое |
| LiCl в АН | Li0,047C при Е = – 3,2 В | Начальные стадии интеркаляции – деформация кристаллической структуры. Далее – притяжение интеркалированных частиц | Преобладание стадии переноса решеточных искажений. Электрохимическое перенапряжение - высокое |
На основании выявленных закономерностей катодного внедрения лития в железоуглеродные фазы можно предложить следующую их математическую реализацию. Хронопотенциограмму катодного внедрения определяют концентрации: лития в ферритной фазе СLi(Ф), лития в цементитной фазе СLi(Ц), дефектов (вакансий) в подрешетке железа СД.
Взаимодействия компонентов при внедрении сводятся к:
1) генерированию дефектов при внедрении лития в ферритную фазу;
2) взаимодействию дефектов с литием в цементитной фазе.
В конечно-разностной форме система уравнений, описывающая динамику концентраций компонентов и потенциала, имеет вид
![]()
![]()
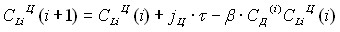
![]()
![]()
![]() , если
, если ![]() <
<![]() <
<![]()
![]()
0, если ![]() <
<![]()
![]()
![]() , если
, если ![]() <
<![]()
![]()
0, если ![]() >
>![]()
![]()
![]() , если
, если ![]() <
<![]() <
<![]()
![]()
![]() , если
, если ![]() <
<![]() ,
,
где ![]() ,
, ![]() – потоки в ферритную и цементитную фазы соответственно,
– потоки в ферритную и цементитную фазы соответственно,
![]() – шаг по временной переменной,
– шаг по временной переменной,
![]() – концентрация ионов Li+ в электролите,
– концентрация ионов Li+ в электролите,
![]() ,
, ![]() – количество ферритных и цементитных вакансий соответственно,
– количество ферритных и цементитных вакансий соответственно,
![]() ,
, ![]() – равновесные потенциалы интеркаляции феррита и цементита,
– равновесные потенциалы интеркаляции феррита и цементита,
![]() ,
, ![]() – коэффициенты переноса интеркаляции феррита и цементита.
– коэффициенты переноса интеркаляции феррита и цементита.
Основным результатом реализации предлагаемой модели является зависимость потенциала от времени ![]() (рис. 8, 9).
(рис. 8, 9).
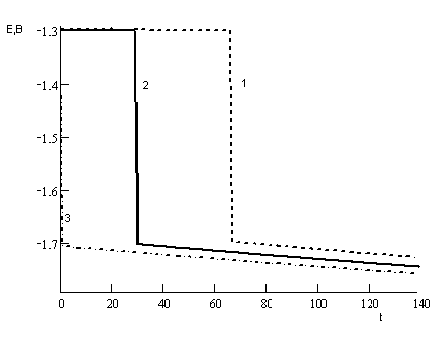
Рис. 8. Расчетные хронопотенциограм-
мы процесса интеркаляции при разных значени-
ях констант скорости внедрения в ферритные
каналы: 1 – kф = 0,3; kЦ = 0,09
2 – kф = 0,27; kЦ = 0,09
3 – kф = 0,1; kЦ = 0,09
Значения остальных параметров модели: = 0,003; j = 0,05; = 0,5; Nф = 0,3; NЦ = 0,5
Смещение потенциала в процессе внедрения обусловлено уменьшением вакантных позиций для внедрения в соответствующей подсистеме. Величина скачка потенциала в точке окончания интеркаляции феррита определяется различием констант скоростей катодного внедрения феррита и цементита. Длина участка интеркаляции пропорциональна количеству вакансий для внедрения, что обосновывает возможность определения общей массовой доли углерода, а также его структурных составляющих по длинам участков хронопотенциограмм, разделенных скачком потенциала (феррит-цементит) или точкой перегиба (цементит). Точки разделения участков интеркаляции могут исчезать при близости констант скорости внедрения в ферритную и цементитную фазы, а также вследствие образования точечных дефектов в подсистеме железа при интеркаляции феррита.
Пятая глава «Применение электрохимической интеркаляции лития в определении углерода в конструкционных сталях и чугунах» посвящена методам вольтамперометрического и импульсного гальваностатического определения углерода и его фазовых состояний в сплавах железо-углерод.
Из общей кинетической картины процесса интеркаляции можно предположить, что для электролита LiCl в АН могут быть характерны отсутствие участка интеркаляции ферритной фазы и слабая выраженность точки перегиба хронопотенциограммы на участке интеркаляции цементита. Для электролита LiBF4 в ПК+ДМЭ участок интеркаляции феррита также может отсутствовать вследствие высокого электрохимического перенапряжения. Условия интеркаляции из LiBF4 в АН ближе к оптимальным из всех рассмотренных случаев.
Для количественной оценки содержания углерода в образце были построены калибровочные зависимости плотность тока – содержание углерода (рис. 10) при выделенном потенциале, полученные по поляризационным кривым электрохимической интеркаляции. Угловой коэффициент, характеризующий общую чувствительность метода, позволил выделить электролитные системы: LiClO4 в АН и LiBF4 в АН, которые могут быть рекомендованы в измерениях вольтамперометрическим методом.
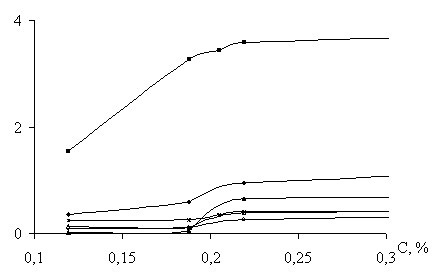
Метод импульсной хронопотенциометрии позволяет анализировать массовую долю углерода по положению точек перегиба. Но ввиду многокомпонентности системы и сложности процессов был разработан следующий способ обработки хронопотенциометрических зависимостей (рис. 11): весь диапазон потенциалов хронопотенциограммы делили на равные участки, затем подсчитывалось количество значений в каждом. Это количество значений пропорционально длине горизонтального участка, выражающего интеркаляцию в соответствующий фрагмент. Полученная гистограмма распределения значений по диапазонам позволяет: определять величину и положение горизонтального участка, а также количество значений в диапазоне, которое может использоваться как аргумент калибровочной функции. Проведенными исследованиями было показано, что целесообразно использовать многомерную калибровочную функцию содержание углерода – количество значений в каждом из диапазонов гистограммы.
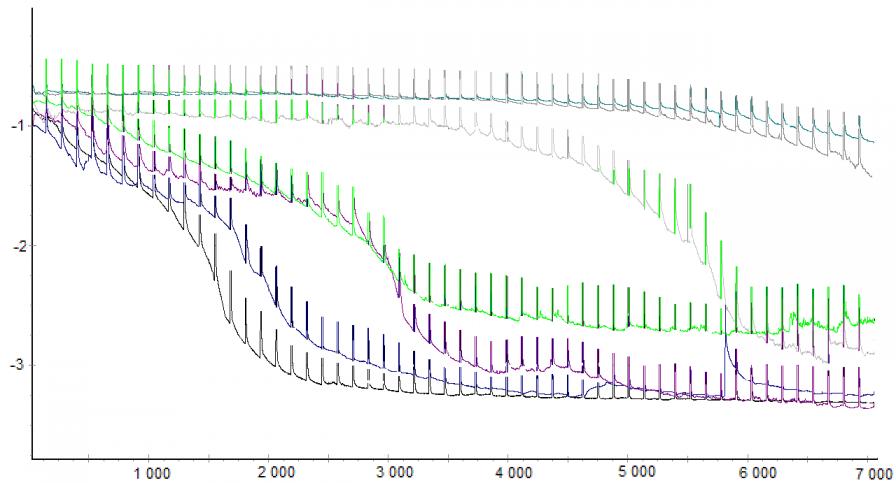
На основании выявленных абсолютных погрешностей измерений можно рекомендовать использование электролита LiClO4 в АН для определения содержания углерода в низкоуглеродистых сталях (до 0,3 %), а систему LiBF4 в АН – для сталей с содержанием углерода от 0,3 до 1,7 %.
Основные фазовые разновидности углерода – феррит и цементит – могут быть качественно и количественно идентифицированы по вольтамперометрическим и хронопотенциометрическим зависимостям процесса катодного внедрения лития из апротонного органического электролита. Импульсные хронопотенциограммы преобразовывали в гистограммы распределения значений по диапазонам потенциалов (рис. 12).
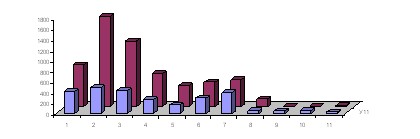
Максимумы гистограмм соответствуют окончанию интеркаляции разновидностей углеродсодержащих фаз. Их величина коррелирует с массовой долей феррита и цементита в сплаве.
Основные результаты и выводы
- Впервые показана возможность интеркаляции литием углеродсодержащих фаз железоуглеродных сплавов из апротонных органических электролитов. Имеются два вида каналов интеркаляции – ферритного и цементитного типа. Ферритные фазы интеркалируются необратимо с образованием «солеподобных» интеркалатов, для которых состояние лития близко к ионному. Цементитные и графитовые фазы интеркалируются обратимо с образованием «металлоподобных» интеркалатов. Обратимая интеркаляционная емкость зависит от природы применяемой электролитной системы и величины потенциала интеркаляции.
- Факторами, определяющими термодинамику катодного внедрения лития в железоуглеродные фазы, являются деформация кристаллической решетки и взаимодействие интеркалированных частиц. Форма дифференциальной зависимости равновесный потенциал – состав интеркалата определяется природой фрагмента интеркалируемой железоуглеродной фазы.
- Кинетика интеркаляции железоуглеродных фаз включает стадии транспорта в электролите, электрохимическую стадию и твердофазный перенос, сопряженный с переносом точечных дефектов к каналам ионной проводимости. Эти стадии могут периодически сменять друг друга.
- Установлено, что кинетические особенности интеркаляции лития в железоуглеродные фазы определяются природой электролита, от которого зависит величина электрохимического перенапряжения, а также возможность соинтеркаляции молекул растворителя и аниона электролитной соли, влияющей на транспортные характеристики интеркалированных частиц. Электрохимическое перенапряжение катодного внедрения возрастает в ряду 1 М электролитов: LiBF4 в ДМФ, LiClO4 в АН, LiBF4 в АН, LiCl в ацетоне, LiBF4 в ПК+ДМЭ, LiCl в АН.
- Величина скачка потенциала в точке окончания интеркаляции феррита литием определяется различием констант скоростей катодного внедрения феррита и цементита. Длина участка потенциала интеркаляции пропорциональна количеству вакансий для внедрения, что обосновывает возможность определения общей массовой доли углерода, а также его структурных составляющих по длинам участков хронопотенциограмм.
- Установлено, что количественное определение углерода в сталях возможно на основе калибровочных зависимостей содержание углерода – плотность тока, полученных по поляризационным кривым электрохимической интеркаляции, а также содержание углерода – длина участка интеркаляции катодной импульсной хронопотенциограммы. Феррит и цементит могут быть качественно и количественно идентифицированы по вольтамперометрическим и хронопотенциометрическим зависимостям процесса катодного внедрения лития из апротонного органического электролита.
- Определено, что условиям наиболее полной и равномерной интеркаляции в наибольшей степени соответствует система 1 М LiBF4 в АН. Преимуществами идентификации углеродсодержащих фаз обладает метод импульсной хронопотенциометрии как более экспрессный и дающий калибровочные зависимости в более широком диапазоне потенциалов.
Основные положения и результаты диссертации опубликованы в следующих работах
I. Публикации в центральных изданиях, включенных в перечень периодических изданий ВАК РФ:
1. Жильцова (Кучеренко) С.В. Органические растворители как среда процесса экспресс-анализа углеродсодержащих фаз конструкционных сталей / М.С. Липкин, Т.В. Липкина, С.В. Жильцова, С.А. Пожидаева, В.Г. Шишка // Изв. вузов. Сев.-Кав. регион. Техн. науки. – 2006. – Прил. к № 2. – С. 95-98.
2. Кучеренко С.В. Анализ железоуглеродных сплавов. Варианты методик / М.С. Липкин, С.В. Кучеренко, Т.В. Липкина, С.А. Пожидаева, В.Г. Шишка // Изв. вузов. Сев.-Кав. регион. Естественные науки. – 2008. – Спец. вып.: Проблемы электрохимии и экологии. – С. 77-81.
II. Публикации в других изданиях
3. Кучеренко С.В. Неразрушающее электрохимическое определение углерода в конструкционных сталях / М.С. Липкин, С.В. Кучеренко, Т.В. Липкина, С.А. Пожидаева, В.Г. Шишка // Контроль. Диагностика. – 2008. – № 5. – С. 56-59.
4. Кучеренко С.В. Интеркаляция лития из апротонных электролитов в углеродсодержащие фазы системы железо-углерод / М.С. Липкин, С.В. Кучеренко, Н.В. Кучеренко, Т.В. Липкина, С.А. Пожидаева, В.Г. Шишка // Вестник СГТУ. – 2008. – № 3 (34), Вып. 1. – С. 48-56.
5. Кучеренко С.В. Новый метод определения содержания углерода в конструкционных сталях / М.С. Липкин, С.В. Кучеренко, Т.В. Липкина, Н.В. Кучеренко // Вестник Всерос. науч.-исслед. и проект.-конструктор. ин-та электровозостроения. – Новочеркасск, 2007. – Вып. 1 (53): 100-летию Юж.-Рос. гос. техн. ун-та (НПИ) посвящается. – С. 138-144.
6. Кучеренко С.В. Применение импульсного гальваностатического метода в определении содержания углерода в сталях / М.С. Липкин, С.В. Кучеренко, С.А. Пожидаева // Электрохимия и экология: материалы Всерос. конф., г. Новочеркасск, 17-20 сент. 2008 г. / под ред. Е.Ш. Кагана, Н.В. Смирновой; Юж.-Рос. гос. техн. ун-т (НПИ). – Новочеркасск: ЮРГТУ (НПИ), 2008. – С. 25.
7. Кучеренко С.В. Изучение интеркаляции лития в углеродсодержащие фазы конструкционных сталей / С.В. Кучеренко, М.С. Липкин, Т.В. Липкина // Студенческая весна-2007: сб. науч. тр. аспирантов и студентов ЮРГТУ (НПИ). – Новочеркасск: ЮРГТУ (НПИ), 2007. – С. 207-208.
8. Жильцова (Кучеренко) С.В. Возможности электрохимического анализа неметаллических компонент металлокомпозиционных материалов / О.Л. Галченко, С.В. Жильцова, М.С. Липкин, М.В. Шведов // Студенческая научная весна-2006: сб. науч. тр. аспирантов и студентов ЮРГТУ (НПИ) / Юж.-Рос. гос. техн. ун-т (НПИ) – Новочеркасск: ЮРГТУ, 2006. – С. 157.
9. Кучеренко С.В. Анализ дифференциальных зависимостей ЭДС-состав процесса электрохимической интеркаляции лития в углеродсодержащие фазы образца стали У15 / Т.В. Липкина, С.В. Кучеренко, В.Г. Шишка, А.К. Степанян // Ученые ЮРГТУ (НПИ) к юбилею университета: материалы 56-й науч.-техн. конф. проф.-препод. состава, научных работников, аспирантов и студентов / Юж.-Рос. гос. техн. ун-т (НПИ). – Новочеркасск: «Оникс+», 2007. – С. 160-161.
10. Кучеренко С.В. Применение метода потенциостатической хронокулонометрии к изучению термодинамики интеркаляции лития в железоуглеродные сплавы / С.В. Кучеренко, М.С. Липкин // Современные методы в теоретической и экспериментальной электрохимии: тез. докл. I-й Междунар. науч. конф., Плес, Ивановская обл., 23-27 июня 2008 г. – Плес, 2008. – С. 50.
11. Кучеренко С.В. Изучение кинетики интеркаляции лития в сплавы железо-углерод методом хроноамперометрии со ступенчатым изменением потенциала / С.В. Кучеренко, М.С. Липкин // Современные методы в теоретической и экспериментальной электрохимии: тез. докл. I-й Междунар. науч. конф., Плес, Ивановская обл., 23-27 июня 2008 г. – Плес, 2008. – С. 66.
12. Кучеренко С.В. Изучение термодинамических закономерностей интеркаляции лития в углеродные фазы сталей методом ступенчатой потенциостатической хронокулонометрии / С.В. Кучеренко, М.С. Липкин // Сборник статей и сообщений по материалам 57-й науч.-техн. конф. профессорско-преподават. состава, научных работников, аспирантов и студентов / Юж.-Рос. гос. техн. ун-т (НПИ). – Новочеркасск: ЮРГТУ (НПИ), 2008. – С. 94-95.

