Применение ru 2 (oac) 4 cl в каталитических превращени ях диазосоединений
На правах рукописи
МАЙДАНОВА АННА ВЛАДИМИРОВНА
ПРИМЕНЕНИЕ Ru2(OAc)4Cl В КАТАЛИТИЧЕСКИХ ПРЕВРАЩЕНИЯХ ДИАЗОСОЕДИНЕНИЙ
02.00.03 – Органическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Уфа – 2012
Работа выполнена в Федеральном государственном бюджетном учреждении науки Институте органической химии Уфимского научного центра Российской академии наук.
Научный руководитель: кандидат химических наук,
доцент
Султанова Римма Марсельевна
Официальные оппоненты: доктор химических наук,
профессор
Кунакова Райхана Валиулловна
кандидат химических наук,
доцент
Вафина Гузэль Фагимовна
Ведущая организация ФГБОУ ВПО «Уфимский государственный
нефтяной технический университет»
Защита диссертации состоится «16» марта 2012 года в 14оо часов на заседании диссертационного совета Д 002.004.01 в Федеральном государственном бюджетном учреждении науки Институте органической химии Уфимского научного центра Российской академии наук по адресу: 450054, Башкортостан, г. Уфа, проспект Октября, 71, зал заседаний. Факс (347) 2356066, e-mail: [email protected].
С диссертацией можно ознакомиться в научной библиотеке Уфимского научного центра РАН.
Автореферат разослан «15» февраля 2012 г.

Ученый секретарь
диссертационного совета
доктор химических наук,
профессор Ф. А. Валеев
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Алифатические диазосоединения находят широкое применение в органическом синтезе как предшественники карбенов и карбеноидов в реакциях, катализируемых соединениями переходных металлов (родия, меди или палладия). Во многих методах синтеза практически важных веществ, обладающих физиологической активностью (например, аттрактантов и простагландинов), каталитические реакции с участием диазосоединений являются ключевой стадией схемы. Причем природа переходного металла и лигандного окружения являются факторами, определяющими не только выход целевого продукта, но и стерео- и региоселективность процесса. Например, катализируемое Rh2(OAc)4 внутримолекулярное N–H внедрение с участием -ацилдиазоацетатов, содержащих азетидиновый фрагмент, используется для получения бициклических -лактамных антибиотиков. Однако применение катализаторов на основе Rh, Cu, Pd не всегда целесообразно, так как в их присутствии могут протекать внутри- и межмолекулярные реакции диазокарбонильных соединений с активными C–H, O–H, С=С, C=O связями. В последнее время в качестве эффективных катализаторов дедиазотирования диазосоединений используются соединения рутения, например, порфириновые комплексы Ru(II).
В связи с этим поиск и изучение свойств новых эффективных и селективных катализаторов карбеноидного разложения диазосоединений на основе рутения, позволяющих проводить реакции циклопропанирования олефинов и функционализации соединений, в том числе не содержащих кратные связи, в мягких условиях, является актуальной задачей.
Работа выполнена в соответствии с планом научно-исследовательских работ Федерального государственного бюджетного учреждения науки Института органической химии Уфимского научного центра РАН по теме: «Развитие новых методов синтеза гетероциклических систем» (номер государственной регистрации 0120.0 801444), при финансовой поддержке Программы Президиума РАН «Разработка методов получения химических веществ и создание новых материалов». Направление: «Развитие методологии органического синтеза и создание соединений с ценными прикладными свойствами».
Цель работы. Исследование и установление основных закономерностей взаимодействия непредельных соединений, спиртов и аминов с диазосоединениями в присутствии Ru2(OAc)4Cl и разработка подходов к синтезу функционально замещенных циклопропанов, эфиров, производных глицина.
В рамках диссертационной работы определены следующие наиболее важные задачи:
– поиск эффективных регио- и стереоселективных катализаторов карбеноидного разложения диазосоединений на основе соединений Ru, позволяющих проводить реакцию по связям С=С, С=О, С–О, С–Х, Н–Х с получением функциональнозамещенных циклопропанов, производных аминоуксусной кислоты и гетероциклических соединений.
– изучить влияние природы катализатора, растворителя, исходных субстратов и условий проведения реакции на взаимодействие диазосоединений с непредельными соединениями, спиртами и аминами.
– установить взаимосвязь «структура-реакционная способность» для исходных субстратов, которая позволила бы подойти к направленному синтезу замещенных эфиров глицина с использованием катализируемой Ru-содержащим катализатором реакции метилдиазоацетата с аминами различного строения.
Научная новизна и практическая ценность работы. Предложен эффективный и региоселективный катализатор Ru2(OAc)4Cl для получения простых эфиров, эфиров циклопропанкарбоновой и аминоуксусной кислот, -кетоаминов путем взаимодействия диазосоединений (диазометана, диазоацетона, диазоацетофенона, адамантаноилдиазометана, метилдиазоацетата) со стиролом, 1,3-диенами, тиолами, спиртами и аминами.
Показано, что внедрение метоксикарбонилкарбена по связи N–H алифатических и ароматических аминов протекает региоселективно, что позволяет получать новые производные аминокислот. Важной стадией внедрения метоксикарбонилкарбена по связи N–H при использовании катализатора Ru2(OAc)4Cl является генерирование карбеноидной частицы.
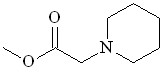
Относительная реакционная способность первичных, вторичных и ароматических аминов в реакции с метилдиазоацетатом в присутствии Ru2(OAc)4Cl изучена методом конкурирующих реакций. Установлено, что наибольшую активность проявляют анилин, морфолин, пирролидин, пиперидин.
На основе реакции замещенных анилинов с метилдиазоацетатом синтезированы N-фенилзамещенные глицинаты – структурные блоки для получения блокаторов кальциевых каналов Т-типа.
Взаимодействием N-этил-2-аминоэтанола с метилдиазоацетатом получен с выходом 85% N-этилморфолин-2-он – перспективный синтон для синтеза,-диалкиламинокислот.
Апробация работы. Результаты работы представлены на II и III Международных научно-технических конференциях «Китайско–Российское научно-техническое сотрудничество. Наука–Образование–Инновации» (Урумчи, КНР, 2009 г., Харбин, КНР, 2010 г.), Всероссийской конференции по органической химии (RCOC) (Москва, 2009 г.), Всероссийской конференции с элементами научной школы для молодежи «Наука, инновации, молодежь» (Обнинск, 2009 г.), Научно-практической конференции студентов и аспирантов химического факультета, посвященной 100-летию основания Башкирского государственного университета (Уфа, 2009 г.), VII Всероссийской конференции с международным участием «Химия и медицина» (Уфа, 2010 г.).
Публикации. По материалам диссертационной работы опубликованы 2 статьи в журналах, рекомендованных ВАК, и тезисы 6 докладов в сборниках научных конференций.
Структура и объем диссертации. Диссертационная работа состоит из введения, литературного обзора (глава 1), обсуждения полученных результатов (глава 2), экспериментальной части (глава 3), выводов, списка литературы и приложения. Работа содержит 8 таблиц и 5 рисунков. Диссертация изложена на 133 страницах, список цитируемой литературы включает 192 наименования.
Автор выражает глубокую благодарность д.х.н., проф. В. А. Докичеву за помощь, оказанную при выполнении работы.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
- Взаимодействие метилдиазоацетата с олефинами, спиртами и аминами в присутствии Ru2(OAc)4Cl
Каталитическое взаимодействие алкилдиазоацетатов с непредельными соединениями, аминами, спиртами и тиолами широко применяется в органическом синтезе как удобный метод получения производных циклопропанкарбоновой кислоты, эфиров, производных аминокислот и полифункциональных гетероциклических соединений, многие из которых являются практически важными соединениями (циластатин, пиретроиды, -лактамные антибиотики и т.д.). Соединения Rh(II), Cu(I), Pd(II) наиболее часто используются в этих процессах[1], однако следует учитывать способность указанных соединений вызывать полимеризацию исходных олефинов и продуктов реакции. В связи с этим, разработка новых катализаторов карбеноидного разложения диазосоединений на основе переходных металлов не теряет своей актуальности.
В данной работе изучены каталитические свойства Ru2(OAc)4Cl в реакциях метилдиазоацетата (МДА) с соединениями, содержащими связи С=С, СС, С=О, С–Н, С–О, О–Н, S–Н, N–Н.
Реакции проводили при 75оС без растворителя при мольном соотношении субстрат : МДА : Ru2(OAc)4Cl = 500 : 50 : 1 в течение 6 ч. Установлено, что взаимодействие стирола 1 с N2CHCO2Me 2а в присутствии Ru2(OAc)4Cl приводит к образованию метилового эфира 2-фенилциклопропанкарбоновой кислоты 3а в виде смеси транс- и цис-изомеров в соотношении 2:1 (схема 1). Соотношение и выход образующихся продуктов определяли на основании интегральных интенсивностей сигналов протонов при атоме С-1 циклопропанового кольца в спектре ЯМР 1Н (СDCl3) при H 1.91 м.д. для цис-изомера 3a, 2.08 м.д. для транс-изомера 3a (внутренний стандарт нитрометан). Продукта внедрения метоксикарбонилкарбена по связи С–Н ароматического кольца в реакционной массе обнаружено не было.
Схема 1
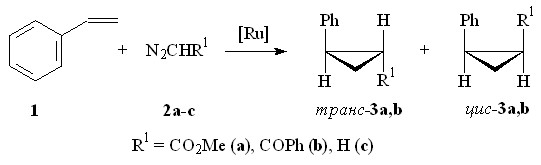
В то же время, циклопропанирование стирола диазоацетофеноном 2b в выбранных условиях протекает с образованием 1-бензоил-2-фенилциклопропана 3b преимущественно в виде транс-изомера (соотношение транс : цис = 10 : 1) с общим выходом 40%. С диазометаном 2c в присутствии Ru2(OAc)4Cl (Et2O, 0оС) стирол 1 не реагирует.
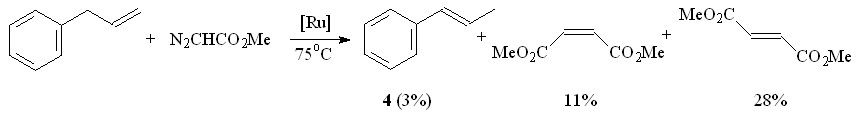
С целью изучения влияния заместителя при С=С-связи на циклопропанирование с помощью N2CHCO2Me в присутствии Ru2(OAc)4Cl нами вовлечены в реакцию различные олефины, в том числе функционально замещенные. В результате проведенных исследований установили, что эффективность Ru2(OAc)4Cl зависит как от природы С=С-связи олефина, так и диазосоединения. Так, аллилбензол в выбранных нами условиях не вступает в реакцию с МДА. Из реакционной массы был выделен только продукт изомеризации исходного олефина – транс--метилстирол 4 с выходом 3% (схема 2).
Схема 2
Терминальные и циклические алкены (гекс-1-ен, циклогексен, норборнен) не реагируют с N2CHCO2Me в присутствии Ru2(OAc)4Cl, наблюдается образование лишь продуктов рекомбинации МДА – диметиловых эфиров фумаровой и малеиновой кислот.
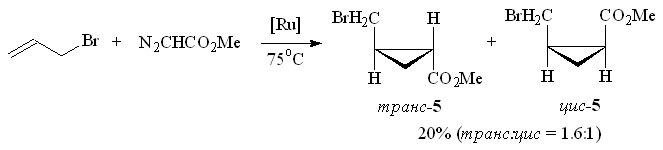
Наличие в молекуле олефина атома галогена, гидрокси- или аминогруппы определяет направление реакции с метилдиазоацетатом в присутствии Ru2(OAc)4Cl. Взаимодействие аллилбромида с N2CHCO2Me дает смесь метиловых эфиров транс- и цис-изомеров 2-бромметилциклопропанкарбоновой кислоты 5 с выходом 20% (схема 3). Образования метилового эфира 2-бромпент-4-еновой кислоты – продукта формального внедрения метоксикарбонилкарбена в связь С–Br, что имеет место при использовании в качестве катализатора Rh2(OAc)4, в реакционной массе обнаружено не было.
Схема 3
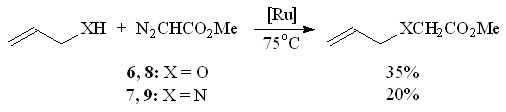
Следует отметить, что катализируемое Ru2(OAc)4Cl взаимодействие аллилового спирта 6 и аллиламина 7 с N2CHCO2Me в выбранных условиях протекает путем региоселективного внедрения метоксикарбонилкарбена по связям О–Н и N–H с образованием соответственно метилового эфира аллилоксиуксусной кислоты 8 и метилового эфира N-аллилглицина 9 с выходами 35 и 20% (схема 4), тогда как в присутствии Rh- и Cu-содержащих катализаторов в аналогичных реакциях образуется смесь продуктов внедрения по связи Х–Н и циклопропанирования С=С-связи[2].
Схема 4
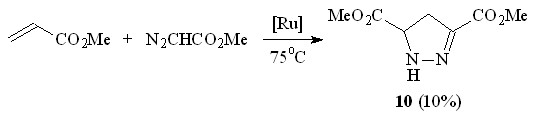
Для электронодефицитных алкенов, например, метилакрилата, основным направлением реакции с метилдиазоацетатом в условиях катализа Ru2(OAc)4Cl являются полимеризация исходного алкена, а также 1,3-диполярное циклоприсоединение: диметиловый эфир 4,5-дигидро-1H-пиразол-3,5-дикарбоновой кислоты 10 образуется c выходом 10% (схема 5).
Схема 5
В случае несимметричного 1,3-диена – изопрена, циклопропанирование МДА протекает региоселективно по наиболее замещенной С=С-связи и приводит к образованию смеси транс- и цис-изомеров метилового эфира 2-винил-2-метилциклопропан-1-карбоновой кислоты 11 с общим выходом 23% (схема 6).
Схема 6
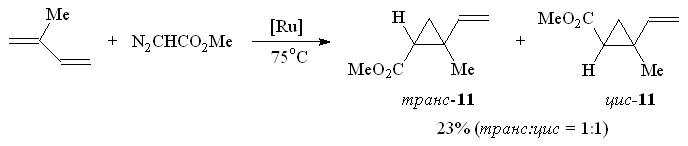
Для доказательства строения и отнесения сигналов в спектрах ЯМР 1Н и 13С циклопропанов 11 были записаны двумерные спектры ЯМР с гомоядерной и гетероядерной 1Н-13С корреляциями. Отнесение сигналов транс- и цис-изомеров 11 проведено на основании анализа величин химических сдвигов, КССВ, а также данных NOESY спектров протонов циклопропанового кольца. Так, в спектре ЯМР 1Н смеси транс- и цис-изомеров соединения 11 протоны при С-1 атоме циклопропанового кольца проявляются в виде двух дублетов дублетов при H 1.74 м.д. (J1,cis-3 6.0 Гц, J1,trans-3 8.1 Гц) для цис-11 и 1.79 м.д. (J1,cis-3 6.0 Гц, J1,trans-3 7.9 Гц) для транс-11. Наличие в NOESY спектре кросс-пиков между сигналами протонов H-3cis (H 1.05 м.д.) и H-1 (H 1.74 м.д.), а также Н-1 (H 1.74 м.д.) и протона при С=С-связи (H 5.45 м.д.) свидетельствует о взаимодействии между ними, подтверждая таким образом транс-конфигурацию заместителей циклопропанового фрагмента. Для метилового эфира цис-2-винил-2-метилциклопропан-1-карбоновой кислоты 11 наличие NOE-эффекта между протонами H-1 циклопропанового кольца (H 1.79 м.д.) и протонами СН3-группы (H 1.28 м.д.) подтверждает их пространственную сближенность и, как следствие, цис-расположение заместителей в циклопропановом кольце.
В случае 2,3-диметилбутадиена-1,3 образуется метиловый эфир 2-изопропенил-2-метилциклопропан-1-карбоновой кислоты 12 с выходом 60% с преимущественным содержанием транс-изомера (схема 7). Продуктов дициклопропанирования по обеим двойным связям 2,3-диметилбутадиена-1,3 в реакционной массе обнаружено не было.
Схема 7

Из числа изученных олефинов, в том числе функционально замещенных, в реакцию с N2CHCO2Me в выбранных условиях не вступали непредельные карбонильные соединения: винилметилкетон и коричный альдегид, а также соединения, содержащие тройную связь – окт-4-ин, фенилацетилен, ацетонитрил. Следует отметить, что во всех случаях наблюдалось разложение метилдиазоацетата, диметилфумарат и диметилмалеинат были выделены с выходами 25-80%.
Эффективность рутениевого катализатора в циклопропанировании непредельных соединений метилдиазоацетатом, вероятно, обусловлена способностью образующегося карбеноида координироваться с олефином. В случае стирола и 1,3-диенов, где двойная связь С=С сопряжена с ароматическим кольцом или другой двойной связью, образование -олефинового комплекса оказывается более предпочтительным, что и определяет высокую активность катализатора в данной реакции.
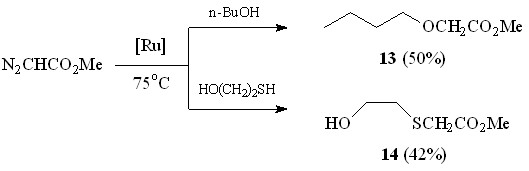
Наряду с непредельными спиртами и аминами взаимодействие N2CHCO2Me в присутствии Ru2(OAc)4Cl наблюдалось с бутан-1-олом и 2-меркаптоэтанолом (схема 8). Так, бутан-1-ол реагирует с МДА с образованием продукта внедрения метоксикарбонилкарбена по связи O–H – метилового эфира бутоксиуксусной кислоты 13 с выходом 50%. Повышенная нуклеофильность атома серы обусловливает селективное протекание реакции N2CHCO2Me с 2-меркаптоэтанолом по связи S–H, давая метил 2-(гидроксиэтил)тиоацетат 14 с выходом 42%.
Схема 8
Таким образом, показано, что Ru2(OAc)4Cl является эффективным катализатором циклопропанирования стирола и 1,3-диенов метилдиазоацетатом, а также внедрения метоксикарбонилкарбена по связи гетероатом–водород (О–Н, N–Н, S–H).
- Каталитическое взаимодействие алифатических аминов с диазосоединениями в присутствии Ru2(OAc)4Cl
Каталитическое внедрение в связь N–H алкоксикарбонилкарбенов, генерируемых из диазоэфиров, является одним из удобных методов синтеза физиологически активных N-замещенных эфиров глицина и гетероциклических соединений[3].
Наряду с диазометодом для получения производных аминокислот широко применяется карбоксиметиленирование аминов галогенуксусными кислотами в щелочной среде. Однако использование этого метода не всегда бывает эффективным. Существенными недостатками данного способа являются необходимость поддержания постоянного значения рН 10–11 для алифатических и 8–10 для ароматических аминов, возможность протекания побочных реакций гидролиза галогенуксусной кислоты, что приводит к уменьшению выхода целевого продукта, низкая селективность в случае использования первичных аминов и образование смеси трудноразделяемых производных, а также значительная продолжительность реакции[4].
Указанных недостатков лишен предлагаемый нами способ каталитического карбоксиметиленирования аминов диазокарбонильными соединениями в присутствии Ru2(OAc)4Cl.
С целью изучения влияния условий реакции (температура, природа растворителя, соотношение компонентов реакции) на выход целевого N-замещенного эфира глицина и разработки оптимальных условий проведения реакции внедрения метоксикарбонилкарбена, генерируемого из метилдиазоацетата, по связи N–H на первом этапе нами исследовано взаимодействие диэтиламина 15 с МДА в присутствии различных катализаторов.
Установлено, что в ряду испытанных нами катализаторов на основе переходных и редкоземельных металлов (RuCl3, Ru2(OAc)4Cl, Pd(OAc)2, Cu(OTf)2, Сu(OAc)2, Dy(OAc)3, CeCl3, Ce(OAc)3, Nd(OTf)3) наиболее высокую каталитическую активность при проведении реакции в дихлорэтане при 55оС в течение 6 ч проявляет Ru2(OAc)4Cl. При его использовании выход метил N,N-диэтилглицината 16 составил 65%, в остальных случаях выход эфира 16 не превышал 38% (схема 9). В отсутствие катализатора метилдиазоацетат с диэтиламином не реагирует.
Схема 9

Применение других растворителей (пентана, диэтилового эфира, хлористого метилена), а также изменение температуры приводили к снижению выхода эфира 16 (табл. 1). Например, при проведении реакции в присутствии Ru2(OAc)4Cl в среде хлористого метилена и температуре 25С выход метил N,N-диэтилглицината 16 не превышал 10%.
Таблица 1
Влияние температуры и растворителя на выход метил N,N–диэтилглицината 16
| Растворитель | Температура, С | Выход, % |
| ClCH2CH2Cl ClCH2CH2Cl C6H6 CH2Cl2 CH2Cl2 C5H12 Et2O без растворителя | 55 25 55 40 25 25 25 55 | 65 20 65 16 10 <5 7 <5 |
Оптимальным соотношением амин : N2CHCO2Me : катализатор оказалось соотношение 50:50:1. При этом выход эфира 16 составил 65%, в то время как при других соотношениях реагентов и катализатора выход продукта значительно снижался (табл. 2).
Таблица 2
Влияние соотношения компонентов реакции на выход метил N,N–диэтилглицината 16
| Мольное соотношение Et2NH : N2CHCO2Me : Ru2(OAc)4Cl | Выход, % |
| 4000 : 4000 : 1 200 : 200 : 1 100 : 100 : 1 50: 50 : 1 20 : 20 : 1 | <5 10 30 65 12 |
На примере взаимодействия дибутиламина 17 и N2CHCO2Me показано, что повышение температуры реакции благоприятно влияет на выход образующихся глицинатов. Так, метил N,N-дибутилглицинат 18 образуется с выходом 42% при проведении процесса при 55оС, а при увеличении температуры на 20оС выход эфира 18 возрастает до 55%.
Сравнение каталитической активности ряда хлорсодержащих комплексов рутения Ru2(OAc)4Cl, Ru(PPh3)3Cl2 и Ru(PPh3)3(H)Cl в реакции дибутиламина 17 с метилдиазоацетатом показало, что из исследованных катализаторов Ru2(OAc)4Cl проявляет эффективность, сравнимую с известным катализатором Ru(PPh3)3Cl2 (схема 10).
Схема 10
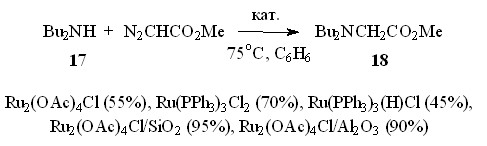
Известно, что при нанесении на пористые носители активность катализатора возрастает за счет увеличения его удельной поверхности. Так, при нанесении Ru2(OAc)4Cl на силикагель или окись алюминия выход метилового эфира N,N-дибутилглицина 18 повышается до 95%.
С целью изучения влияния строения амина на реакционную способность связи N–H в присутствии Ru2(OAc)4Cl нами исследовано взаимодействие метилдиазоацетата с первичными и вторичными аминами, в качестве которых использованы диэтил- 15, дибутил- 17, N-аллил-N-пентил- 19, бутил- 24 амины, морфолин 20, пирролидин 21, пиперидин 22, N-этил-2-аминоэтанол 23, анилин 25, (+)--метилбензиламин 26, (–)-цитизин 27 и 5-амино-экзо-3-азатрицикло[5.2.1.02,6]декан-4-он 28. Реакцию проводили при 75С путем прибавления раствора N2CHCO2Me в бензоле в течение 30 мин к амину, содержащему катализатор, при мольном соотношении амин : N2CHCO2Me : Ru2(OAc)4Cl = 50:50:1 (схема 11).
Схема 11
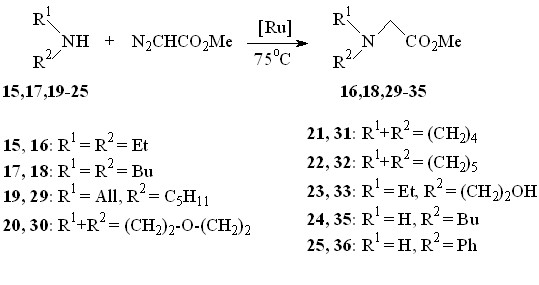
Показано, что внедрение метоксикарбонилкарбена протекает региоселективно по связи N–H, вне зависимости от структуры амина с выходами 20-85%, не затрагивая другие функциональные группы (OH, C=O, C=C) (табл. 3). Следует отметить, что гетероциклические амины – имидазол, 3-амино- и 4-аминопиридины – не реагируют с N2CHCO2Me в выбранных нами условиях.
Таблица 3
Выход N–замещенных метилглицинатов 16,18,29-40, относительные константы скорости (krel), потенциалы ионизации (Iр) и основность (pKa) аминов
| Амин | Продукт | Выход (%) | krel (амин/17) | Iр, эВ | pKa | ||
| H2O | MeCN | DMSO | |||||
| Et2NH 15 | 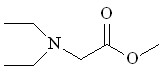 16 16 | 65 | - | 8.01 | 10.93 | 18.75 | 10.50 |
| Bu2NH 17 | 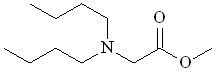 18 18 | 55 | 1 | 7.69 | 11.25 | - | - |
| | 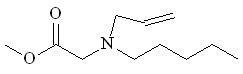 29 29 | 70 | 0.744 | - | (9.99) | - | - |
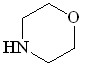 20 20 | 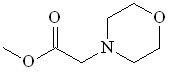 30 30 | 85 | 1.140 | 8.20 | 8.70 | 16.61 | 8.50 |
| |  31 31 | 67 | 1.845 | 8.00 | 11.27 | 19.58 | 10.80 |
| |  32 32 | 77 | 2.040 | 8.20 | 11.12 | 18.92 | 10.50 |
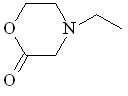 34 34 | 85 | 0.745 | - | 9.96 | - | - | |
| BuNH2 24 | 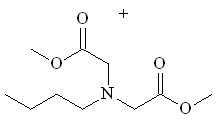 36 36 | 17 33 | 0.505 | 8.71 | 10.60 | - | - |
| Продолжение табл. 3 | |||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| | 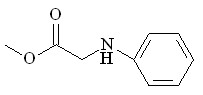 37 37 | 71 | 1.183 | 7.72 | 4.58 | 10.56 | 3.6 |
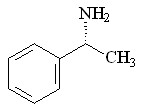 26 26 | 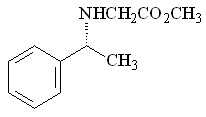 38 38 | 95 | - | - | - | - | - |
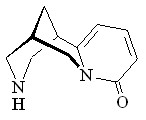 27 27 |  39 39 | 20 | - | - | - | - | - |
 28 28 | 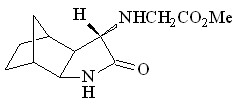 40 40 | 90 | - | - | - | - | - |
Катализируемое Ru2(OAc)4Cl взаимодействие N-этил-2-аминоэтанола 23 с N2CHCO2Me в бензоле при 75оС протекает региоселективно по связи N–H и сопровождается внутримолекулярной циклизацией образующегося метилового эфира N-этил-N-(2-гидроксиэтил)глицина 33 в N-этилморфолинон-2 34 с выходом 85% (схема 12).
Схема 12
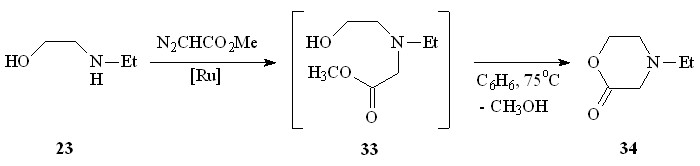
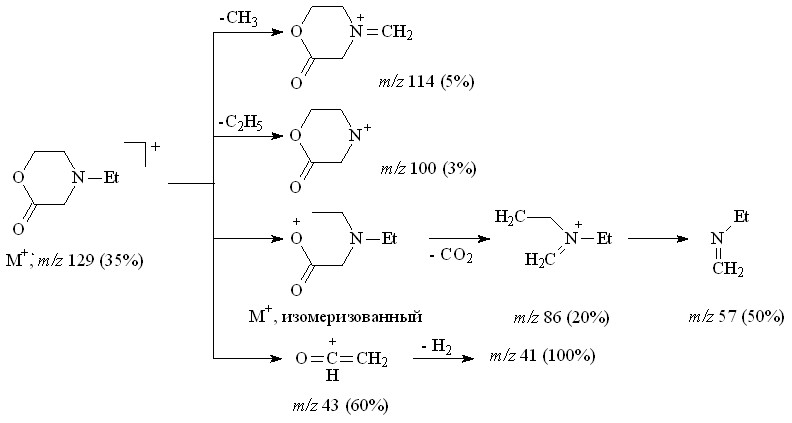
N-Этилморфолин-2-он 34 был выделен в индивидуальном виде колоночной хроматографией. В ИК-спектре морфолинона 34 наблюдается характеристическая для циклических лактонов полоса валентных колебаний группы С=О при 1735 см-1. В спектре ЯМР 1Н не обнаружено химических сдвигов метиленовых протонов при Н 3.24 м.д. и сигнала протонов сложноэфирной группы при Н 3.69 м.д. Масс-спектр (ЭУ) содержит пик молекулярного иона 129.0833, что подтверждает брутто-формулу C6H11NO2, а также ряд пиков осколочных ионов, соответствующих отщеплению метильного (m/z=114.0609), этильного (m/z=100.0667) и ОСН=СН2 (m/z=86.0353) радикала, и катион-радикала C4H9N+ (m/z=71.0446). Фрагментарный ион с массовым числом 85.0628 соответствует отщеплению нейтральной молекулы CO2, что однозначно подтверждает структуру N-этилморфолин-2-она 34. Диагностические осколочные ионы распада лактона 34 представлены на схеме 13.
Схема 13
Взаимодействие N2CHCO2Me с N-аллил-N-пентиламином 19 в присутствии Ru2(OAc)4Cl приводит к образованию метилового эфира N-аллил-N-пентилглицина 29 с выходом 70%, при этом продуктов циклопропанирования и внутримолекулярной перегруппировки аммониевого илида в реакционной массе обнаружено не было.
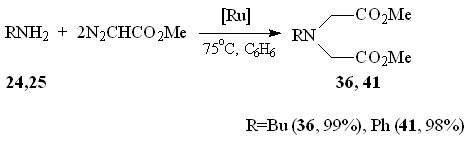
Бутиламин 24 с эквимольным количеством N2CHCO2Me дает продукты как моно- 35, так и дивнедрения 36 метоксикарбонилкарбена по связи N–H с выходами 17 и 33% соответственно. В отличие от бутиламина взаимодействие анилина 25 с N2CHCO2Me протекает селективно с образованием метилового эфира N-фенилглицина 37 с выходом 71%. Каталитическое взаимодействие первичных аминов 24 и 25 с двукратным мольным избытком метилдиазоацетата приводит к образованию метилового эфира N-бутил-N-[(метоксикарбонил)метил]глицина 36 и метилового эфира N-[(метоксикарбонил)метил]-N-фенилглицина 41 с количественными выходами (схема 14).
Схема 14
Как и анилин 25, (+)--метилбензиламин 26 взаимодействует с эквимольным количеством МДА селективно, образуя продукт моновнедрения по связи N–H – метиловый эфир N-(1-фенилэтил)глицина 38 с выходом 95%.
Образование устойчивого комплекса Ru2(OAc)4Cl с алкалоидом (–)-цитизином 27, вероятно, является причиной низкого выхода (20%) метилового эфира N-цитизинилуксусной кислоты 39. Связи С=С пиридонового кольца и карбонильная группа цитизина 26 не реагируют с метилдиазоацетатом в присутствии Ru2(OAc)4Cl в выбранных нами условиях.
Реакция полициклического амина 5-амино-экзо-3-азатрицикло[5.2.1.02,6]декан-4-она 28, содержащего преимущественно экзо-изомер (10 : 1), с эквимольным количеством МДА в присутствии Ru2(OAc)4Cl протекает региоселективно по аминогруппе, при этом в реакцию (согласно спектрам ЯМР 1Н реакционной смеси) вступают оба изомера. Причем при хроматографическом разделении реакционной смеси на SiO2 (элюент хлороформ : метанол = 20 : 1) был выделен метиловый эфир N-(экзо-3-азатрицикло[5.2.1.02,6]декан-4-он-5-ил)глицина 40 в виде транс-изомера с выходом 90%. Следует отметить, что при использовании в качестве катализаторов Rh2(OAc)4 и Cu(OTf)2 лактам 28 в реакцию с N2CHCO2Me не вступает.
Структура синтезированного метилового эфира транс-N-(экзо-3-азатрицикло[5.2.1.02,6]декан-4-он-5-ил)глицина 40 доказана с помощью спектроскопии ЯМР 1Н, 13С. В спектре NOESY соединения 40 наблюдается кросс-пик между протоном Н-5 (H 3.02 м.д.) и сигналом протона Нsyn-10 при H 1.37 м.д., что свидетельствует об их пространственном взаимодействии. В спектре ЯМР 1Н величина КССВ вицинальных протонов Н-5 и Н-6 составляет 3J5,6 = 3.5 Гц, что указывает на транс-положение протона при С-5.
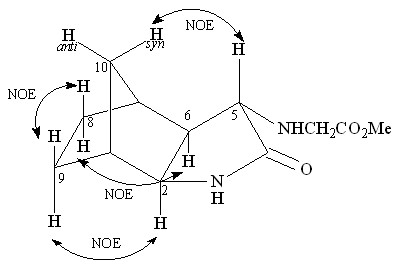
Рис. 1. NOESY взаимодействия между протонами соединения 40
В литературе практически отсутствуют количественные сведения, касающиеся относительной реакционной способности аминов в реакции каталитического внедрения метоксикарбонилкарбена по связи N–H. В связи с этим для установления закономерностей, связывающих строение аминов со скоростью взаимодействия их с метилдиазоацетатом, методом конкурирующих реакций исследовано взаимодействие дибутиламина 17 и аминов 15 или 19-25 с N2CHCO2Me в присутствии Ru2(OAc)4Cl (табл. 3). Относительную реакционную способность определяли при 75°С путем прибавления раствора N2CHCO2Me в бензоле к смеси дибутиламина 17 и амина 15 или 19-25 при мольном соотношении 17 : 15 или 19-25 : N2CHCO2Me : Ru2(OAc)4Cl = 50 : 50 : 50 : 1. Наиболее высокую активность проявили анилин 25 и циклические амины – морфолин 20, пирролидин 21, пиперидин 22. К сожалению, величины полученной относительной реакционной способности исследованных аминов не поддаются прямой корреляции с данными по основности и потенциалами ионизации. Только для дибутиламина 17, пирролидина 21 и пиперидина 22 обнаружена линейная зависимость относительных констант скорости (krel) от потенциала ионизации (Iр).
Необходимо отметить, что в отличие от соединений меди и родия в присутствии Ru2(OAc)4Cl образования димеров метоксикарбонилкарбена – диметилмалеината и диметилфумарата – в реакционных массах не наблюдается.
Каталитическая активность комплексов Ru в реакциях аминов с диазосоединениями весьма чувствительна к природе последних. Например, использование Ru(PPh3)3Cl2 при взаимодействии аминов с диазокетонами оказалось неэффективным[5]. С целью выяснения влияния природы диазосоединений на протекание реакции N–Н внедрения в присутствии Ru2(OAc)4Cl изучено взаимодействие морфолина 20 с диазоацетофеноном 2b, диазометаном 2c, диазоацетоном 42, адамантаноилдиазометаном 43 (схема 15).
Схема 15

Установлено, что реакция внедрения по связи N–H диазосоединений 2а-c, 42, 43, катализируемая Ru2(OAc)4Cl, протекает легко, с образованием соответствующих производных морфолина 30, 44-47 с выходами 60-96%.
На основании полученных нами результатов и литературных данных взаимодействие аминов с диазокарбонильными соединениями в присутствии комплексов рутения можно представить схемой 16.
Схема 16
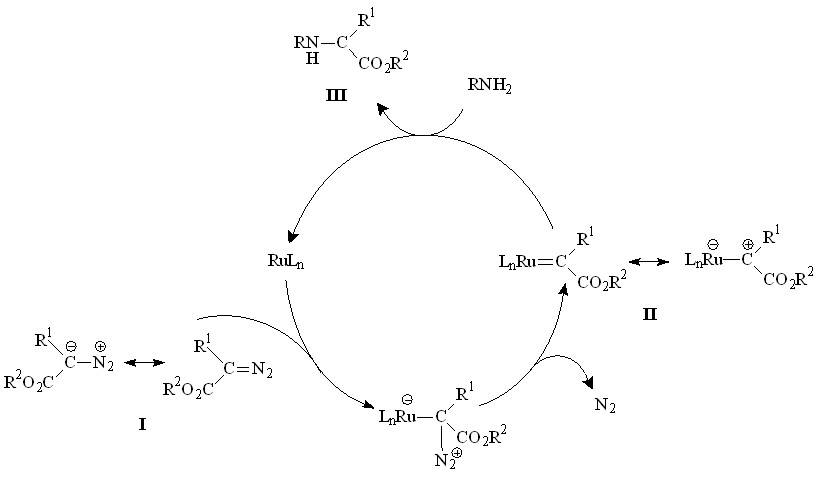
На первой стадии происходит взаимодействие диазосоединения I с центральным атомом Ru с образованием карбеноида II. Атака карбеноида гетероатома исходного амина и последующий 1,2-гидридный сдвиг приводят к образованию продукта внедрения карбена по связи N–H III.
Таким образом, найдено, что Ru2(OAc)4Cl является эффективным и региоселективным катализатором получения N-производных метилового эфира глицина путем взаимодействия первичных или вторичных аминов с метилдиазоацетатом.
3. Каталитическое взаимодействие аминоспиртов с метилдиазоацетатом
Как было показано (раздел 2), реакция 2-амино-N-этилэтанола 23 с метилдиазоацетатом, катализируемая Ru2(OAc)4Cl, протекает региоселективно по связи N–H с образованием N-этилморфолинона-2 34 с выходом 85% в результате внутримолекулярной циклизации метил N-(2-гидроксиэтил)-N-этилглицината 33. Эта реакция может стать удобным методом получения 1,4-дигетероциклогексанов, обладающих высокой физиологической активностью. Например, морфолиновый фрагмент – один из часто встречающихся элементов структуры фармакологических препаратов.
С целью разработки метода получения морфолинонов и изучения селективности реакции аминоспиртов с метилдиазоацетатом исследовано его взаимодействие с 2-амино-N-этилэтанолом 23, моноэтаноламином 48, диэтаноламином 49 и 2-амино-N-трет-бутилоксикарбонилэтанолом 50 в присутствии Ru2(OАс)4Cl, Rh2(OAc)4 и Cu(OTf)2 (схема 17).
Схема 17

При использовании в качестве катализатора Cu(OTf)2 или Rh2(OAc)4 взаимодействие N-этил-2-аминоэтанола 23 с N2CHCO2Me протекает с низкой селективностью и выходами с образованием замещенного моноэтаноламина 51 (3%) и морфолинонов 52 (13%) и 34 (2%).
Моноэтаноламин 48 и диэтаноламин 49 в присутствии Ru2(OАс)4Cl или Rh2(OAc)4 в реакцию с N2CHCO2Me не вступают. Диэтаноламин 49 реагирует с N2CHCO2Me под действием Cu(OTf)2 селективно по связи О–Н, приводя к образованию производного диэтаноламина 53 и продукта его внутримолекулярной циклизации N-(2-гидроксиэтил)морфолинона-1 54 с общим выходом 20% в соотношении 4 : 1 соответственно.
Взаимодействие 2-амино-N-трет-бутилоксикарбонилэтанола 50 с метилдиазоацетатом в присутствии Ru2(OАс)4Cl, Rh2(OAc)4 или Cu(OTf)2 протекает селективно по О–Н связи с образованием метил (2-амино-N-трет-бутилоксикарбонил)этоксиацетата 55 с выходами 34, 44 и 34% соответственно. В спектре ЯМР 1Н сигнал протонов метиленовой группы соединения 55 резонирует в виде синглета при H 4.11 м.д., а в спектре ЯМР 13С наблюдается пик при С 68.19 м.д., что соответствует продукту внедрения метоксикарбонилкарбена по связи О–Н. Продукта внутримолекулярной циклизации – соответствующего морфолинона-3 – в реакционных массах обнаружено не было, что можно объяснить стерическим препятствием объемной трет-бутилоксикарбонильной группы.
Таким образом, применение в качестве катализатора Ru2(OАс)4Cl для получения морфолинонов оправдано только при использовании N-алкил-2-аминоэтанолов.
4. Взаимодействие метилдиазоацетата с ароматическими аминами, катализируемое Ru2(OAc)4Cl
Интерес к синтезу N-фенилзамещенных глицинатов обусловлен применением их в качестве структурных блоков при получении производных 1,4-диазепана, которые являются блокаторами кальциевых каналов Т-типа[6].
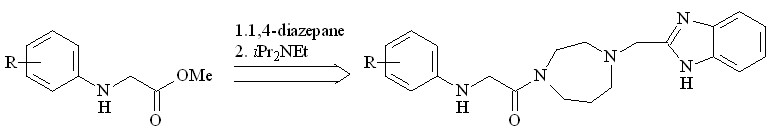
С целью разработки методов получения N-фенилзамещенных глицинатов и установления влияния природы заместителя в ароматическом кольце на протекание внедрения метоксикарбонилкарбена по связи N–H исследовано взаимодействие замещенных анилинов с метилдиазоацетатом в присутствии Ru2(OAc)4Cl (схема 18).
Схема 18
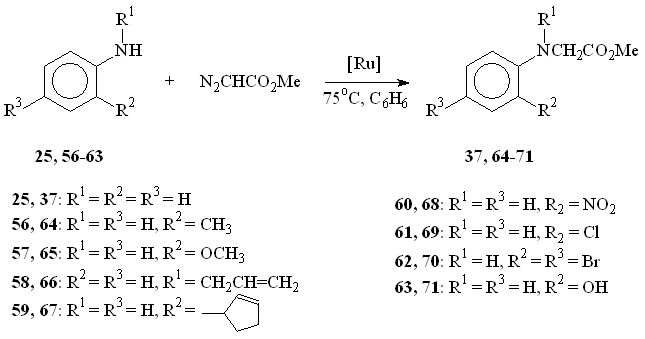
Таблица 4
Выход N–фенилзамещенных глицинатов 37, 64-71, относительные константы скорости (krel) и основность (pKa) ароматических аминов
| Амин | Продукт | Выход, % | pKa | krel(амин/25) |
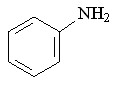 25 25 | 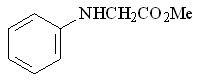 37 37 | 71 | 4.69 | 1 |
 56 56 |  64 64 | 87 | 4.54 | 1.0480 |
 57 57 |  65 65 | 71 | 4.62 | 0.5708 |
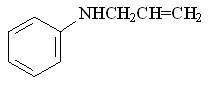 58 58 | 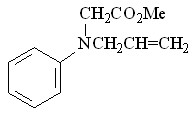 66 66 | 43 | 4.17 | 0.1760 |
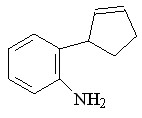 59 59 | 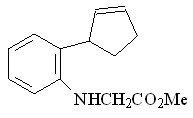 67 67 | 91 | - | 0.5341 |
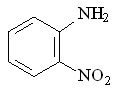 60 60 | 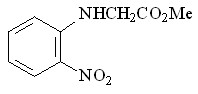 68 68 | 18 | -0.22 | 0.1775 |
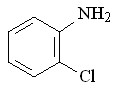 61 61 | 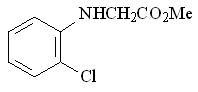 69 69 | 80 | 2.74 | 0.7870 |
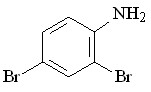 62 62 | 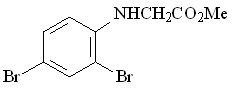 70 70 | 33 | 1.87 | 0.2973 |
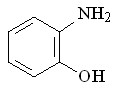 63 63 | 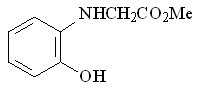 71 71 | 35 | 9.97 | 0.2055 |
Условия реакций: 2% мол. Ru2(OAc)4Cl, С6Н6, 75оС
В качестве исходных ароматических аминов были использованы: 2-метил- 56, 2-метокси- 57, N-аллил- 58, 2-(циклопент-2-енил)- 59, 2-нитро- 60, 2-хлор- 61, 2,4-дибром- 62, 2-гидрокси- 63 анилины. Реакцию проводили в течение 6 ч при 75С путем прибавления раствора N2CHCO2Me в бензоле в течение 30 мин к бензольному раствору амина и Ru2(OAc)4Cl при мольном соотношении амин : N2CHCO2Me : катализатор = 50:50:1. Как и в случае алифатических аминов, внедрение метоксикарбонилкарбена протекает региоселективно по связи N–H с образованием продуктов моновнедрения метоксикарбонилкарбена вне зависимости от структуры амина с выходами 18-91% (табл. 4).
При взаимодействии метилдиазоацетата с N-аллил- 58 и 2-(циклопент-2-енил)- 59 анилинами в присутствии Ru2(OAc)4Cl образуются метиловые эфиры N-аллил-N-фенилглицина 66 и N-(2-циклопент-2-енил)фенилглицина 67 с выходами 43 и 91% соответственно. Продуктов циклопропанирования и внутримолекулярной перегруппировки в реакционной массе обнаружено не было.
Реакции N2CHCO2Me с замещенными анилинами, имеющими в орто-положении электронодонорный метильный 56, метоксильный 57, циклопентенильный 59 заместитель или атом хлора 61, протекают с выходами 71 – 91%. В то же время, взаимодействие метилдиазоацетата с производными анилина, имеющими в орто-положении нитро-, гидрокси-группу или атомы брома, приводит к образованию соответствующих метилглицинатов 68, 71, 70 с выходами 18 – 35%. Полученные результаты подтверждают специфический эффект орто-заместителей ароматических соединений.
Для определения относительной реакционной способности ароматических аминов методом конкурирующих реакций исследовано взаимодействие анилина 25 и аминов 56-63 с N2CHCO2Me в присутствии Ru2(OAc)4Cl (табл. 4). Относительную реакционную способность определяли при 75°С путем прибавления раствора метилдиазоацетата в бензоле к смеси, содержащей анилин 25 и исследуемый амин 56-63 при мольном соотношении 25 : 56-63: N2CHCO2Me : Ru2(OAc)4Cl = 50 : 50 : 50 : 1. Из числа изученных аминов только о-толуидин 56 проявляет активность, сравнимую с анилином. Для других о-замещенных анилинов 57, 59-63 значение относительной константы скорости (krel) значительно меньше 1. Как и в случае алифатических аминов, значения полученной относительной реакционной способности исследованных аминов не поддаются прямой корреляции с данными по основности, что, вероятно, обусловлено стерическим, индукционным и мезомерным эффектами заместителей, находящихся в орто-положении ароматических соединений.
Как и в случае алифатических аминов, в присутствии Ru2(OAc)4Cl образования димеров метоксикарбонилкарбена – диметилмалеината и диметилфумарата не наблюдалось.
Таким образом, установлено, что эффективным катализатором получения моноэфиров N-фенилглицинатов диазометодом является Ru2(OAc)4Cl.
Выводы
- Предложен новый эффективный и региоселективный катализатор Ru2(OAc)4Cl получения производных метиловых эфиров циклопропанкарбоновой и аминоуксусной кислот, эфиров и тиоэфиров в реакциях метилдиазоацетата со стиролом, 1,3-диенами, тиолами, спиртами и аминами.
- Показано, что реакция первичных или вторичных аминов с метилдиазоацетатом в присутствии Ru2(OAc)4Cl протекает региоселективно по аминогруппе, не затрагивая при этом другие функциональные группы.
- Методом конкурирующих реакций установлена относительная реакционная способность ряда алифатических и ароматических аминов в реакции с метилдиазоацетатом, катализируемой Ru2(OAc)4Cl. Обнаружено, что наиболее высокую активность проявили анилин, морфолин, пирролидин, пиперидин.
- На основе реакции замещенных анилинов с метилдиазоацетатом получены N-фенилзамещенные глицинаты – структурные блоки для получения блокаторов кальциевых каналов Т-типа.
- Найдено, что Ru2(OAc)4Cl является эффективным катализатором получения метиламинов, -кето-аминов (1-морфолин-4-ил-ацетона, 1-морфолин-4-ил-ацетофенона, адамантил(1-морфолин-4-ил-метил)кетона) путем взаимодействия диазометана и диазокетонов с аминами.
- Обнаружено, что взаимодействие N-этил-2-аминоэтанола с метилдиазоацетатом сопровождается внутримолекулярной циклизацией образующегося метилового эфира в N-этилморфолин-2-он с выходом 85%.
Основное содержание работы изложено в следующих публикациях:
- Майданова А.В., Бакеева А.Д., Султанова Р.М., Биглова Р.З., Докичев В.А. Катализируемое Ru2(OAc)4Cl взаимодействие метилдиазоацетата с аминами. // Журн. орган. химии. – 2010. – Вып. 10. – Т. 46. – С.1458-1462.
- Майданова А.В., Бакеева А.Д., Султанова Р.М., Биглова Р.З., Докичев В.А. Катализируемое Ru2(OAc)4Cl взаимодействие метилдиазоацетата с замещенными анилинами. // Вестник БашГУ. – 2010. – Т. 15. – № 1. – С. 21-24.
- Майданова А.В., Сафуанова Р.М., Султанова Р.М. Синтез N–замещенных метилглицинатов на основе катализируемого Ru2(OAc)4Cl взаимодействия метилдиазоацетата с аминами. // Тезисы докладов II Международной научно-технической конференции «Китайско–Российское научно-техническое сотрудничество. Наука–Образование–Инновации». – Урумчи. – 2009. – С. 68.
- Майданова А.В., Султанова Р.М. Взаимодействие аминов с метилдиазоацетатом в присутствии Ru2(OAc)4Cl. // Тезисы докладов Всероссийской конференции по органической химии (RCOC). – Москва. – 2009. – с. 273.
- Майданова А.В., Султанова Р.М. Каталитическое взаимодействие аминоспиртов с метилдиазоацетатом. // Тезисы докладов Всероссийской конференции с элементами научной школы для молодежи «Наука, инновации, молодежь». – Обнинск. – 2009. – с. 134.
- Майданова А.В., Бакеева А.Д., Султанова Р.М., Биглова Р.З. Взаимодействие метилдиазоацетата с аминами, катализируемое Ru2(OAc)4Cl. // Тезисы докладов Научно-практической конференции студентов и аспирантов химического факультета, посвященной 100-летию основания Башкирского государственного университета. – Уфа. – 2009. – с. 7.
- Майданова А.В., Бакеева А.Д., Султанова Р.М., Биглова Р.З. Синтез метил N-фенилглицинатов с использованием метилдиазоацетата. // Тезисы докладов VII Всероссийской конференции с международным участием «Химия и медицина». – Уфа. – 2010. – С. 237.
- Майданова А.В., Султанова Р.М. Каталитическое взаимодействие аминоспиртов с метилдиазоацетатом. // Тезисы докладов III Международной научно-технической конференции «Китайско–Российское научно-техническое сотрудничество. Наука–Образование–Инновации». - Харбин. – 2010. – С.110.
[1] Doyle M.P., McKervey M.A., Ye T. Modern Catalytic Methods for Organic Synthesis with Diazo Compounds: From Cyclopropanes to Ylides. 1998, 652.
[2] Noels A.F. et al. Tetrahedron, 1982, 38, 2733.
[3] Игл И. и др. Пат. 006636 (2002). США.
[4] Яшунский В.Г. Усп.химии, 1976, 9, 1537.
[5] Del Zotto A. et al. J. Chem. Soc., Perkin Trans. 1, 1999, 17, 3079.
[6] Gu S.J. et al. Bioorg. Med. Chem. Letters, 2010, 20, 2705.

