Закономерности электрохимического наноструктурирования при катодном внедрении стронция и кальция в матричные электроды на основе сплавов системы bi-pb-cu
На правах рукописи
Шустова Наталья Григорьевна
ЗАКОНОМЕРНОСТИ ЭЛЕКТРОХИМИЧЕСКОГО НАНОСТРУКТУРИРОВАНИЯ ПРИ КАТОДНОМ ВНЕДРЕНИИ СТРОНЦИЯ И КАЛЬЦИЯ В МАТРИЧНЫЕ ЭЛЕКТРОДЫ НА ОСНОВЕ СПЛАВОВ СИСТЕМЫ Bi-Pb-Cu
Специальность 02.00.05. – Электрохимия
А в т о р е ф е р а т
диссертации на соискание ученой степени
кандидата химических наук
Саратов 2009
Работа выполнена в ГОУ ВПО «Саратовский государственный технический университет»
Научный руководитель доктор химических наук, профессор Попова Светлана Степановна
Официальные оппоненты доктор химических наук, профессор Казаринов Иван Алексеевич
кандидат химических наук
Апаликова Любовь Евгеньевна
Ведущая организация НИТИ «Тесар» (г.Саратов)
Защита состоится «18» декабря 2009 в 15 часов на заседании диссертационного совета Д 212.242.09 при Саратовском государственном техническом университете по адресу: 413100, г.Энгельс, пл. Свободы, 17, Энгельсский технологический институт (филиал) Саратовского государственного технического университета.
С диссертацией можно ознакомиться в научно-технической библиотеке Саратовского государственного университета по адресу: 410054, г.Саратов, ул. Политехническая, 77, Саратовский государственный технический университет.
Автореферат разослан 18 ноября 2009
Ученый секретарь
диссертационного совета В.В. Ефанова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. В настоящее время в качестве наиболее перспективных объектов для промышленного применения среди известных высокотемпературных сверхпроводников рассматриваются соединения внедрения на основе висмута и свинца системы Ca(Sr)-Bi-Pb(Tl)-Cu-О. Однако кинетика и механизм процессов, протекающих при формировании такого типа сплавов, изучены недостаточно. Необходимы дальнейшие поиски наиболее технологичных, экологически чистых и экономичных процессов их синтеза. Наиболее эффективны в этом отношении электрохимические процессы. При этом следует учитывать, что на начальном этапе реакции электровыделения металлов в сплав протекают через образование ад-ионов и их превращение в ад-атомы и диффузию ад-атомов по вакансиям в глубь электрода, то есть на наноразмерном уровне. Объединяясь в ансамбли, ад-атомы образуют наноструктуры, свойства которых будут зависеть не только от особенностей кристаллической решетки металла электрода, но и от концентрации дефектов на его поверхности и в объеме, от возможности перехода в разновалентное состояние внедряющихся атомов вследствие обмена электронами с атомами металла электрода. Таким образом, помимо решения практически важных задач повышения критической температуры перехода в сверхпроводящее состояние, стабилизации их структуры и свойств, такие исследования, несомненно, внесут дополнительный вклад в развитие представлений о механизме периодических колебательных окислительно-восстановительных процессов, обусловленных способностью компонентов металлической матрицы проявлять переменную валентность, в том числе и в сложных оксидных системах на их основе, о фазовых превращениях, о кинетике и механизмах твердофазных реакций.
Дальнейшее развитие химии соединений внедрения (замещения) во многом должно определяться знанием механизма формирования наноструктур. В этом отношении использование метода электрохимического внедрения для получения матричных электродов на основе сплавов Bi-Cu, Pb-Cu, Bi-Pb, Bi-Pb-Cu и их последующего электрохимического модифицирования щелочноземельными металлами представляет научный и практический интерес в силу малой изученности взаимосвязи между их составом, структурой и свойствами.
Цель работы. Установление кинетических закономерностей и механизма твердофазных реакций в матричных электродах системы медь-висмут-кальций (стронций), свинец-висмут-кальций (стронций), медь-свинец-висмут-кальций (стронций).
Задачи исследования:
- изучить влияние потенциала, концентрации и температуры раствора на кинетику электрохимического внедрения висмута из водных растворов его солей в медь, на состав формирующегося слоя сплава и его свойства;
- установить кинетические закономерности катодного внедрения свинца в медь;
- исследовать электрохимическое поведение пленочных Bi-Cu, Pb-Cu электродов в апротонных органических растворах солей щелочноземельных металлов с помощью метода катодного внедрения;
- установить взаимосвязь между фазовыми превращениями и диффузионно-кинетическими характеристиками сплавообразования в пленочных матричных электродах системы Cu-Bi-Pb при катодном внедрении щелочноземельных металлов из апротонных растворов их солей до и после обработки в магнитном поле;
- исследовать влияние обработки пленочных Bi-Cu электродов в магнитном поле. Научная новизна. Проведено систематическое исследование электрохимического поведения меди в водных растворах солей висмута и свинца с помощью метода катодного внедрения. Определено влияние потенциала, температуры и концентрации раствора на диффузионно-кинетические характеристики процесса сплавообразования. Показано, что при обработке по методу катодного внедрения происходит распределение атомов внедряющегося компонента на всю глубину электрода. Установлено, что при катодной обработке в водных растворах солей висмута и свинца в составе образующихся слоев сплавов присутствуют оксиды внедряющихся металлов. Это открывает перспективы для разработки совмещенного способа катодного внедрения металлов с протекающим параллельно процессом образования частиц оксидов этих металлов. Получены новые данные о кинетических закономерностях катодного внедрения щелочноземельных металлов (кальций, стронций) из апротонных органических растворов их солей в пленочные электроды на основе меди, электрохимически модифицированной висмутом и свинцом. Установлено влияние обработки исходных растворов и изготовленных Cu-Bi-Pb – электродов в магнитном поле на кинетику фазообразования.
Практическая значимость. Показано, что метод катодного внедрения как эффективный метод электрохимического наноструктурирования позволяет получать структуры сплавов с заданным распределением внедряющихся элементов по глубине токонесущей матрицы электрода, определяющим их диффузионно-кинетические характеристики. Способность к циклированию по щелочноземельному металлу позволяет предложить разработанные электроды для использования в химических источниках тока, а их чувствительность к воздействию магнитного поля подтверждает возможность использования полученных данных в качестве основы для разработки электрохимического метода синтеза оксидных высокотемпературных сверхпроводников системы Bi(Pb)SrCaCuO.
Обоснованность и достоверность полученных результатов. В работе использован комплекс современных, независимых, взаимодополняющих электрохимических и физико-химических методов исследования: потенциостатический метод, метод кривых спада потенциала (при размыкании цепи), циклическая вольтамперометрия, оптическая микроскопия поверхности, рентгенофазовый анализ, лазерное микрозондирование. Исследовано влияние обработки растворов и электродов в магнитном поле на кинетику процессов в формируемых фазах. При оценке воспроизводимости экспериментальных результатов использовалась методика среднестатической оценки доверительного интервала по 3-6 параллельным измерениям, который характеризовался критерием Кохрена.
Апробация результатов работы. Основные положения работы апробированы на международных и всероссийских конференциях: «Проблемы трибоэлектрохимии» (Новочеркасск, 2006); «Физико-химические процессы в конденсированном состоянии и на межфазных границах» Фагран-2006 (Воронеж, 2006); Фагран-2008 (Воронеж, 2008); «Защитные и специальные покрытия, обработка поверхности в машиностроении и приборостроении» (Пенза, 2007); «Инновационные технологии в промышленности Уральского региона» в рамках Международной промышленной выставки «Industry Expo» (Екатеринбург, 2008); «Актуальные проблемы электрохимической технологии» (Саратов, СГТУ, 2008); «Покрытия и обработка поверхности» (Москва, 2009); «Синтез инноваций: направления и перспективы» (Саратов, 2009); «Совершенствование технологии гальванических покрытий» (Киров, 2009); «Нелинейные процессы и проблемы самоорганизации в современном материаловедении (индустрия наносистем и материалы)», Всероссийская конференция – школа (Воронеж, 2009г); Внутривузовская научно-практическая конференция молодых ученых (Энгельс, 2007).
Публикации. По теме диссертации опубликовано 16 печатных работ, включая 4 статей в журналах, рекомендованных ВАК РФ («Журнал прикладной химии», «Известия вузов. Химия и химическая технология», «Вестник СГТУ»).
Структура и объем работы. Диссертация состоит из введения, четырех глав, выводов, списка использованной литературы из 158 наименований и приложения. Работа изложена на страницах и содержит 52 рисунка и 30 таблиц.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении дано обоснование актуальности темы, рассмотрены цель и задачи исследования, отражены научная новизна и практическая значимость результатов работы.
Глава 1. Литературный обзор
В первой главе дан анализ современных представлений о механизме возникновения сверхпроводимости в металлах и оксидах, рассмотрены методы синтеза и электрохимия многокомпонентных Ca(Sr)-Bi-Pb-Cu и оксидных ВТСП нестехиометрических систем Bi(Pb)SrCaCuО. Уделено особое внимание взаимосвязи между составом и их свойствами, структурой изучаемых соединений.
Показано, что электрохимические методы синтеза пленочных материалов подобного типа позволяют конструировать на поверхности наноструктуры атомного размера.
Глава 2. Экспериментальная часть
Объектами исследования служили медь, свинец, электрохимические сплавы, Bi- Cu, Bi-Pb, Bi-Pb-Cu, изготовленные путем катодного внедрения висмута и свинца в медь, а также пленочные Ca(Sr)-Bi-Pb-Cu на медной основе.
Внедрение висмута и свинца в медь вели из водных растворов солей Bi(NO3)3, Pb(NO3)2, Pb(CH3COO)2. Для модифицирования сплавов Bi-Cu, Bi-Pb, Bi-Pb-Cu щелочноземельными металлами (Ca, Sr) использовали растворы соответствующих солей в диметилформамиде. Диапазон рабочих концентраций: 0,12…0,9 моль/л. Водные растворы готовили на бидистиллированной воде из реактивов марки х.ч. Диметилформамид осушали путем вакуумной перегонки по общепринятой методике.
Электрохимическая ячейка представляла собой сосуд с разделенными анодным и катодным пространствами, снабженный термостатирующей рубашкой. В качестве противоэлектрода служили стержни из спектрального графита или листового титана. Видимая рабочая поверхность исследуемых электродов составляла 1,5 см2. Поверхность Cu электродов очищалась от загрязнений и полировалась влажным стеклянным порошком (до зеркального блеска). Затем электрод промывался бидистиллированной водой и сушился фильтровальной бумагой. С поверхности Pb электрода после очистки от загрязнений срезали верхний слой с помощью скальпеля и шлифовали фетровой тканью до зеркального блеска.
Для измерения потенциала в водных растворах использовали стандартный хлорсеребряный электрод сравнения (Е = 0,223 В при 20° С). Неводный хлорсеребряный электрод готовился на основе раствора CaCl2 в ДМФ. Все электрохимические измерения проведены на потенциостате П-5848 в комплекте с самопишущим прибором КСП-4 или осциллографом для регистрации тока и потенциала. Для работы с растворами солей висмута и свинца была выбрана область потенциалов от -0,3 до -0,6 В, катодное внедрение кальция и стронция вели в области потенциалов -2,0 -3,0 В.
Циклирование в потенциодинамическом режиме вели при скоростях от 8 до 80 мВ/с. Рабочий диапазон температур составлял 20 50 С.
Глава 3. Экспериментальные результаты и их обсуждение
3.1. Кинетические закономерности электровыделения висмута на медном электроде: влияние потенциала, концентрации и температуры
Представленные на рис. 1 i,t- кривые для меди в растворе нитрата висмута показывают, что чем отрицательнее потенциал, тем выше плотность тока. Зависимость lg iBi – E в стационарных условиях имеет вид прямой. На начальном этапе поляризации (t=20…40 с) на i,t- кривых появляются две ступени – два предельных тока, которые можно связать с образованием двух фаз Bi-Cu, различающихся по составу. Анализ i,t- кривых в координатах i-t (рис.2) и i-1/t (рис.3) позволил оценить плотность тока в момент включения i(0) и рассчитать константу внедрения kb и произведение СBiDBi (табл.1). Бестоковые хронопотенциограммы (рис.4) подтвердили образование нескольких различающихся по составу фаз. Причем в диапазоне потенциалов от -0,45 до -0,6 В кривые приобретают характерный ступенеобразный ход, что может указывать на формирование новых фаз различного состава в структуре поверхностного слоя меди. Согласно результатам рентгенофазового анализа (рис. 6) в поверхностном слое меди образуются фазы: Bi, -Bi2O3 и -Bi2O3.
Предварительное оксидирование меди оказывает сильное активирующее действие на катодный процесс: плотность тока на начальных участках i-t – кривых возрастает в несколько раз. Ступенеобразный вид i,t – кривых сохраняется и согласуется с представлением об участии кислорода в процессе фазообразования при взаимодействии разряжающихся ионов висмута с медной основой и образовании оксида висмута (III).
Сравнительный анализ бестоковых хронопотенциограмм BiCu-электродов после катодной обработки меди в растворах Bi(NO3)3 различной концентрации показал, что наиболее стабильная во времени фаза формируется в растворе 0,01М.
Как для меди, так и для оксидированной меди зависимости i-1/t не идут в начало координат. Это может быть связано с протеканием параллельного процесса адсорбции молекул воды и интеркалированием продуктов их разряда в глубь электрода. Зависимость диффузионно-кинетических характеристик медного элетрода в водных растворах Bi(NO3)3 различной концентрации от потенциала (табл. 1, 2) носит периодический колебательный характер. Значения СBiDBi периодически меняются с ростом отрицательного потенциала, причем для оксидированного электрода они значительно выше, чем для медного.
Анализ влияния температуры на кинетику электрохимического внедрения висмута в медный электрод на стадии образования твердого раствора Bi(Cu) показал, что и в этом случае величины i(0), kb, СBiDBi носит периодический, колебательный характер, вследствие изменения состава образующейся на электроде фазы и соответственно, изменения коэффициента диффузии внедряющихся атомов висмута через эту фазу.
Максимальное значение СBiDBi 0,049*10-7 моль*см-2*с-1/2 получено для температур 30 и 50° С.
Таблица 1
Влияние концентрации Bi(NO3)3 на диффузионно-кинетические характеристики процесса образования твердого раствора висмута в меди при Екп=-0,45В
| С, моль/л | 0,003 | 0,0035 | 0,004 | 0,0053 | 0,007 | 0,01 | 0,014 |
| С0D *10 7 моль*см2*с1/2 | 1,635 | 0,347 | 2,429 | 0,509 | 2,25 | 1,27 | 3,02 |
| kb, мА*см-2*с-1/2 | 2,67 | 0,57 | 3,97 | 0,83 | 3,68 | 2,08 | 4,9 |
Таблица 2
Влияние потенциала на диффузионно-кинетические характеристики процесса образования твердого раствора висмута в меди при катодной обработке медного электрода в 0,01М растворе Bi(NO3)3
| - Екп, В | 0,30 | 0,35 | 0,40 | 0,45 | 0,50 | 0,55 | 0,60 |
| С0D*107, моль*см2*с1/2 | 0,23 | 0,28 | 0,073 | 0,062 | 0,16 | 0,25 | 0,26 |
| kb, мА*см-2*с-1/2 | 0,38 | 0,45 | 0,12 | 0,1 | 0,26 | 0,41 | 0,42 |
| i(0), мА/см2 | 0,57 | 0,35 | 0,61 | 0,85 | 0,8 | 1,2 | 2,1 |
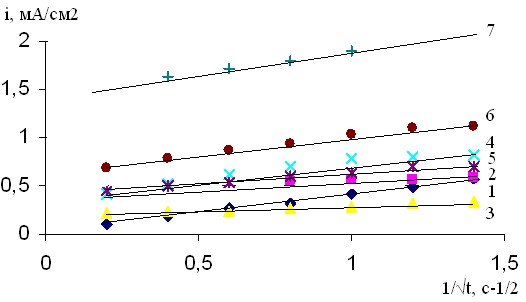
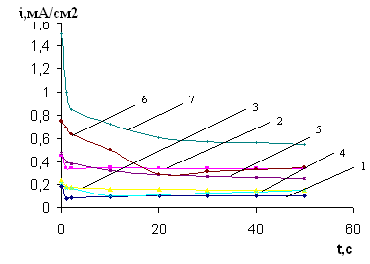
Рис. 1. Кривые i-t Cu –электрода в 0,004М растворе Bi(NO3)3 при -Ек, В: 1- 0,3; 2- 0,35; 3- 0,4; 4- 0,45; 5- 0,5; 6- 0,55; 7- 0,6
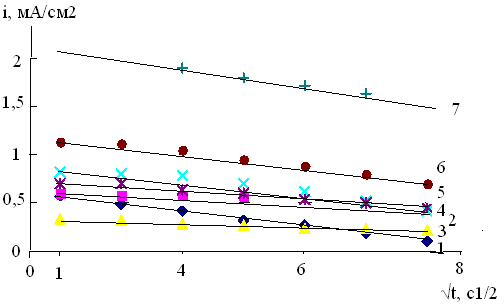
Рис.3. Зависимость i-t для процесса катодной обработки меди в 0,004М растворе Bi(NO3)3 при потенциалах,
-Ек, В: 1- 0,3; 2- 0,35; 3- 0,4; 4- 0,45; 5- 0,5; 6- 0,55; 7- 0,6

Рис.2. Зависимость i-1/t для меди в 0,004М растворе Bi(NO3)3 при -Ек, В: 1- 0,3; 2- 0,35; 3- 0,4; 4- 0,45; 5- 0,5; 6- 0,55; 7 -0,6

Рис.4.Влияние потенциала предобработки меди в 0,004М Bi(NO3)3 на ход бестоковых хронопотенциограмм Bi(Cu) электродов, -Ек, В: 1- 0,3; 2- 0,35; 3- 0,4; 4- 0,45; 5- 0,5; 6- 0,55; 7- 0,6
Рис. 5. Микрофотография поверхности BiCu-электрода после катодной обработки меди при потенциале -0,45В в течение 45 мин в 0,01 М растворе нитрата висмута. Увеличение 200
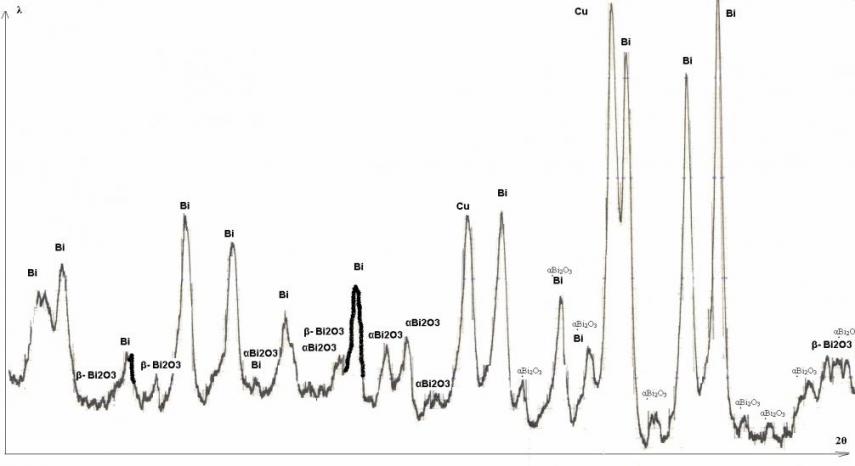
Рис. 6. Рентгенограмма BiCu-электрода после обработки меди в 0,01М растворе соли висмута при -0,45В
3.2. Электрохимическое модифицирование свинцового электрода висмутом: влияние концентрации и потенциала
Согласно ходу i,t – кривых (рис.7) найденные путем анализа их в координатах i-t и i-1/t величину плотности тока в момент замыкания цепи i(0), константы внедрения kb и произведения СBiDBi (табл.3), как и бестоковые хронопотенциограммы BiPb-электродов (рис.8) показывают, что и в случае обработки свинца в растворе Bi(NO3)3 образуются две различающиеся по составу фазы. Это согласуется с результатами лазерного микрозондирования (табл.4) и рентгенофазового анализа (рис.9). Скорость формирования твердого раствора BiPb на поверхности свинца возрастает с увеличением концентрации раствора Bi(NO3)3 (рис.7). При этом четко прослеживается переход от одной концентрационной области к другой (0,017-0,020 моль/л), когда на электроде меняется состав образующейся фазы.
Согласно рентгенофазовому анализу на поверхности свинца при обработке в водном растворе Bi(NO3)3, помимо твердого раствора Bi в Pb присутствуют с тетрагональная и орторомбическая фазы оксидов свинца, Pb2O3, Pb3O4, оксиды висмута Bi2O3 и фаза состава Bi12PbO20 (рис. 9).
Таблица 3
Диффузионно-кинетические характеристики процесса внедрения висмута в свинец
из 0,007М раствора Bi(NO3)3 при 20С
| Потенциал, В | С0D*107, моль*см2*с1/2 | kb, мА*см-2*с-1/2 | i(0), мА/см2 | -Еб/т исх, В | -Еплощ, В |
| -0,35 | 0,45 | 0,007 | 18 | -0,4 | -0,47 |
| -0,4 | 0,64 | 0,011 | 7,5 | -0,43 | -0,47 |
| -0,45 | 0,53 | 0,009 | 5 | -0,45 | -0,49 |
| -0,5 | 0,66 | 0,011 | 20 | -0,47 | -0,48 |
| -0,55 | 1,98 | 0,032 | 30 | -0,46 | -0,5 |
| -0,6 | 1,01 | 0,017 | 31 | -0,46 | -0,36 |
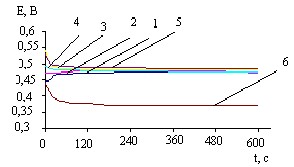
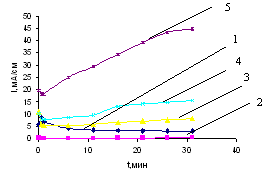
Рис.7. Кривые i-t для Pb электрода при Ек= - 0,4В и 20С в растворах Bi(NO3)3, моль/л: 1- 0,007; 2- 0,01; 3- 0,014; 4- 0,017; 5- 0,02
Рис.8. Бестоковые хронопотенциограм-мы Bi(Pb)- электрода, полученного путем катодной предобработки Pb в 0,007 М растворе Bi(NO3)3 при -Ек, В: 1-0,35; 2-0,4; 3-0,45; 4-0,5; 5-0,55; 6-0,6
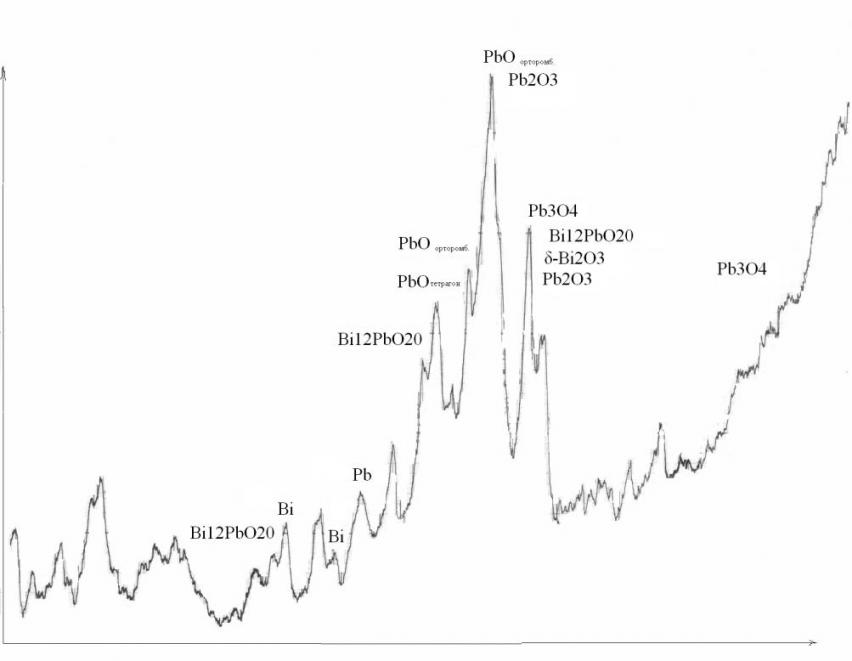
Рис. 9. Рентгенограммы Pb –электрода после обработки при Ек= -0,4В в 0,014М растворе Bi(NO3)3
3.3. Диффузионно-кинетические характеристики процесса электровыделения висмута на PbCu электроде
Согласно представленным в табл.5 данным, увеличение концентрации Bi(NO3)3, как и смещение потенциала в отрицательную сторону способствуют значительному увеличению как i(0), так и kb и СBiDBi. Это позволяет говорить о том, что использование модифицированных свинцом медных электродов PbCu способствует разработке поверхности электрода и возрастанию диффузионно-кинетических характеристик процесса катодного внедрения висмута.
Таблица 5
Влияние потенциала и концентрации Bi(NO3)3 на диффузионно-кинетические характеристики процесса внедрения висмута в свинцовомедный электрод
Бестоковый потенциал BiPbCu-электродов смещается в отрицательную сторону при увеличении катодной поляризации. При этом содержание висмута в PbCu-электроде возрастает почти вдвое, по сравнению с Pb-электродом согласно результатам лазерного микроанализа (табл.4) имеет место более интенсивное продвижение висмута в глубь электрода.
Таблица 4
Результаты лазерного микрозондирования Pb и PbCu электродов на глубине 570 мкм на содержание Bi после обработки в 0,007М растворе Bi(NO3)3 в течение 45 мин
По данным рентгенофазового анализа (рис. 10) после обработки в растворе Bi(NO3)3 присутствуют на PbCu - электроде: оксид свинца (II) с тетрагональной и орторомбической решеткой, оксид свинца (III) и свинцовый сурик (Pb3O4), фаза оксида висмута (III), Cu6PbO8, CuBi2O4.
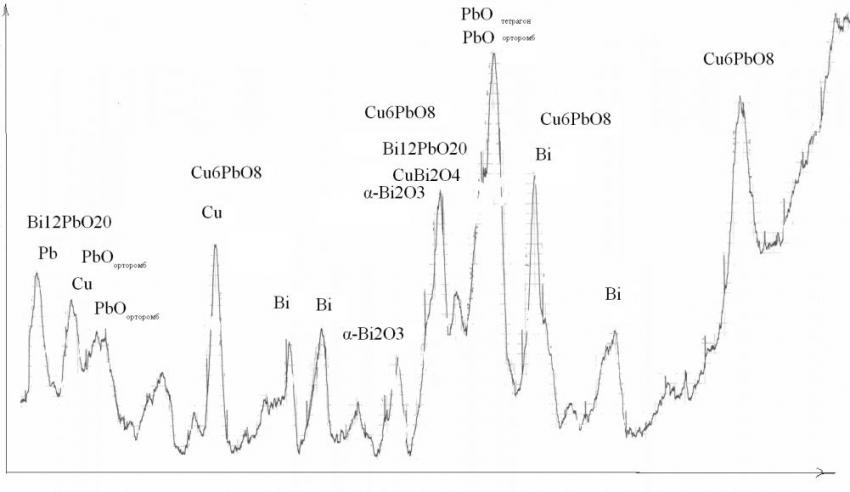
Рис. 10. Рентгенограммы PbCu - электрода после внедрения висмута при потенциале -0,4В в 0,014М растворе Bi(NO3)3
3.4. Электрохимическое формирование матричной структуры Ca(Ва)x BiCu пленочных электродов в апротонных органических растворах
3.4.1. Закономерности электровыделения кальция и бария в медный электрод
При катодной поляризации медного электрода в растворе CaCl2 в ДМФ в области потенциалов от -2,2 до -3,0 В с течением времени плотность тока на электроде стремится к нулю вследствие продвижения возникающего фронта диффузии атомов кальция в глубь медного электрода (рис.14). Смещение бестокового потенциала медного электрода в отрицательную сторону после катодной поляризации (рис. 15) подтверждает внедрение кальция в медь согласно реакции
хСа2+ +2хе - + хСu СахСu. (1)
Значения потенциала исходного медного электрода в растворах CaCl2 в ДМФ приведены в табл.6. Бестоковые хронопотенциограммы СахСu электрода имеют две задержки (рис. 15): в области потенциалов от -2,2 до -3,0 В и в области –(1,2±0,2) В. По сравнению с бестоковым потенциалом исходного медного электрода –(0,45±0,07) В потенциал СахСu электрода в 4-5 раз выше, что говорит о значительном содержании кальция в сплаве СахСu и хорошо согласуется с результатами лазерного микрозондирования (табл. 7-9).
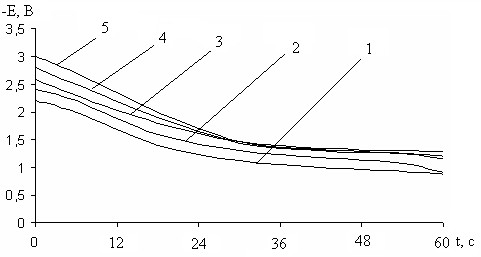
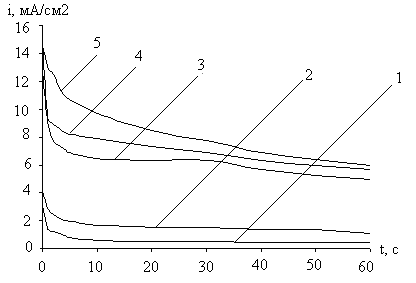
Рис. 11. Кривые i-t катодного внедрения кальция в медь из 0,63М раствора CaCl2 в ДМФ при –Ек, В: 1- 2,2; 2- 2,4; 3- 2,6; 4- 2,8; 5- 3,0
Рис. 12. Влияние потенциала внедрения кальция на ход бестоковых Eб/т, t – кривых CaхCu электродов в 0,63М CaCl2 в ДМФ –Ек, В: 1- 2,2; 2- 2,4; 3- 2,6; 4- 2,8; 5- 3,0
Таблица 6
Значения бестокового потенциала Cu медного электрода в растворе CaCl2 в ДМФ
| СCaCl2 в ДМФ, М | 0,027 | 0,09 | 0,36 | 0,63 |
| Еб/т, В | -0,38 | -0,47 | -0,52 | -0,41 |
Таблица 7
Содержание кальция в CaxCu электроде после катодной обработки в 0,63М CaCl2 в ДМФ при Ек= -2,6В в течение 45 мин
| Глубина проникновения | 145 мкм | 185 мкм | 210 мкм | 230 мкм |
| Образец №1 | 11,1 | 9,4 | 8,3 | 7,8 |
| Образец №2 | 11,3 | 10,2 | 8,3 | 8,2 |
Таблица 8
Диффузионно-кинетические характеристики процесса катодной обработки Cu электрода при различных потенциалах в 0,63 М CaCl2 в ДМФ
| Ек, В | -2,2 | -2,4 | -2,6 | -2,8 | -3,0 |
| kB, мА*см-2*с-1/2 | 0,2 | 0,4 | 27,4 | 28,4 | 31,6 |
| CCaDCa*107, моль* см-2*с-1/2 | 0,12 | 0,25 | 16,8 | 17,4 | 19,3 |
| i(0), мА/см2 | 2 | 3 | 8,5 | 10,2 | 13,5 |
| ГСа(Cu), моль*см -3 | 2,21 | 4,44 | 12,6 | 18,05 | 33,31 |
| DCa(Cu) *1015, см2*с-1 | 0,05 | 0,06 | 1,3 | 0,96 | 0,58 |
Таблица 9
Диффузионно-кинетические характеристики процесса катодной обработки Cu электрода в растворах CaCl2 в ДМФ различной концентрации при потенциале -3,0 В
| Концентрация раствора CaCl2 в ДМФ, моль/л | 0,027 | 0,09 | 0,36 |
| kB, мА*см-2*с-1/2 | 8 | 5,6 | 12,9 |
| CCaDCa*108, моль* см-2*с-1/2 | 7,35 | 5,14 | 11,8 |
| i(0), мА/см2 | 2,6 | 3,2 | 5 |
| ГСа(Cu), моль*см -3 | 5,18 | 7,54 | 21,6 |
| DCa(Cu) *1012, см2*с-1 | 7,29 | 0,3249 | 0,108 |
В растворах нитрата бария в ДМФ величина плотности тока более чувствительна к длительности процесса, чем к величине потенциала обработки. Бестоковый потенциал BaxCu электрода –0,5 В. Потенциал погружения меди в растворе Ba(NO3)2 не превышал (0,03±0,005) В. Результаты расчета величины СВаDВа (табл. 11) для процесса внедрения бария в медь показали, что эта величина на два порядка выше, чем для Bi(Сu) и Tl(Сu) сплавов. Это подтвердили и результаты лазерного микроанализа (табл. 10).
Сопоставление данных табл.7 и 10 показывает, что внедрение бария в медь происходит значительно легче и на тех же глубинах барий накапливается в больших количествах. Соответственно почти на порядок различаются величины ССаDСа и СВаDВа (сравнение табл. 8 и 11).
Таблица 10
Процентное содержание бария в меди в зависимости от потенциала обработки
| Потенциал, В | -2,0 | -2,4 | -2,8 | ||
| Глубина зондирования | |||||
| 145 мкм | ~ 45,2 | ~ 50,1 | ~ 53,7 | ||
| 185 мкм | ~ 13,8 | ~ 16,5 | ~ 18,4 | ||
| 210 мкм | ~ 11,3 | ~ 15,3 | ~ 15,6 | ||
| 230 мкм | ~ 8,6 | ~ 8,3 | ~ 13,7 | ||
Рентгенофазовый анализ образцов, полученных при -2,8 В в растворах всех концентраций, идентифицировал полученный продукт как твердый раствор бария в меди.
Таблица 11
Влияние потенциала на диффузионные параметры процесса образования твердого раствора бария в медном электроде в 0,1 М растворе Ba(NO3)2 в ДМФ
| - Екп, В | 2,0 | 2,2 | 2,4 | 2,6 | 2,8 |
| СВаDВа*107, моль см2*с-1/2 | 5,56 | 6,55 | 6,98 | 11,1 | 12,7 |
3.4.2. Особенности внедрения висмута в Cu – электрод из раствора Bi(NO3)3 после обработки раствора в магнитном поле
После обработки растворов Bi(NO3)3 в магнитном поле плотность тока на Cu электроде возрастает в несколько раз. При этом возрастает и время достижения состояния насыщения поверхности электрода восстанавливающимися атомами висмута (область минимума на i,t - кривых), когда в твердом растворе Bi(Cu) начинается процесс образования интерметаллического соединения BixCu. На всех этапах процесса зависимость плотности тока от потенциала имеет периодический характер. Необычным оказался и ход бестоковых хронопотенциограмм. После размыкания цепи потенциал сохранял высокое значение и смещался в отрицательную сторону. Эффект усиливался по мере снижения концентрации раствора. Согласно представлениям о связи ориентационного эффекта молекул воды в адсорбированном слое с работой выхода электрона, после обработки раствора в магнитном поле происходит смещение поверхностного потенциала воды Н2О в отрицательную сторону вследствие внедрения висмута в металл электрода. Известно, что максимальное значение Н2О(Ме) при потенциале нулевого заряда составляет 0,4 В (скачок потенциала, связанный с ориентацией адсорбированных диполей воды = - Н2О(Ме) при = 0).
Табл.12
Диффузионно-кинетические характеристики процесса внедрения висмута в медь из раствора Bi(NO3)3 после обработки раствора в магнитном поле
| CBi(NO3)3, моль/л | 0,007 | 0,01 | ||||||
| - Ек, В | 0,35 | 0,4 | 0,45 | 0,5 | 0,35 | 0,4 | 0,45 | 0,5 |
| СBiDBi, *107, моль*см2*с1/2 | 0,94 | 0,78 | 0,6113 | 0,6464 | 1,62 | 1,22 | 1,53 | 1,47 |
| kb, мА*см-2 * с-1/2 | 1,54 | 1,28 | 1 | 1,06 | 2,65 | 2 | 2,5 | 2,4 |
| i(0), мА/см2 | 2,6 | 3 | 2,3 | 1,85 | 4 | 5 | 4,15 | 5,6 |
3.4.3. Закономерности внедрения кальция в медновисмутовый электрод
В растворах низкой концентрации (0,027 моль/л) в области более электроположительных значений потенциалов на кривых наблюдаются задержки тока (рис.14). Наиболее богатая кальцием фаза формируется при потенциале -2,6 В (рис.13). Наиболее стабильными, согласно анализу бестоковых хронопотенциограмм, являются фазы, сформированные при Е КП = -2,6 В (Ест.= -2,0 В) Е КП = -2,4 В (Ест.= -1,9 В). С увеличением концентрации раствора до 0,045 моль/л в течение первой минуты процесса во всем диапазоне потенциалов поляризации на поверхности идёт формирование твёрдого раствора (рис.15), первые зародыши интерметаллида начинают формироваться на пятой минуте процесса. Величина плотности тока в начальный момент поляризации возрастает по мере смещения потенциала в сторону более электроотрицательных значений. С повышением концентрации раствора скорость образования ИМС во всём диапазоне исследуемых потенциалов снижается. Возможной причиной может быть возрастание доли ион-ионных взаимодействий и изменение поверхностного потенциала растворителя и ориентации его молекул на поверхности электрода вследствие в структуре раствора. Бестоковые хронопотенциограммы (рис. 16) СахCuBi электродов с увеличением концентрации, как и при смещении потенциала в катодную сторону (рис.14 и 16) смещаются в электроотрицательную область, что указывает на увеличение количества внедренного кальция в СахCuBi электроде согласно электродной реакции
хСа2+ +2хе - + х CuBi СахCuBi (2)
Таблица 13
Значение стационарного потенциала Еисх исходного BiCu электрода и потенциала задержки на бестоковых хронопотенциограммах CaBiCu электрода в растворах CaCl2 в ДМФ различной концентрации после катодной обработки при различных потенциалах
| Концентрация CaCl2, моль/л | Потенциал, В | |||||||||||
| -2,0 | -2,2 | -2,4 | -2,6 | -2,8 | -3,0 | |||||||
| - ЕисхBiO | - ЕплощCaBiCu | - ЕисхBiO | - ЕплощCaBiCu | - ЕисхBiO | - ЕплощCaBiCu | - ЕисхBiO | - ЕплощCaBiCu | - ЕисхBiO | - ЕплощCaBiCu | - ЕисхBiO | - ЕплощCaBiCu | |
| 0,027 | 0,35 | 1,0 | 0,31 | 1,3 | 0,31 | 1,85 | 0,31 | 2,0 | 0,3 | 1,1 | 0,35 | 1,45 |
| 0,045 | 0,37 | 0,79 | 0,38 | 0,8 | 0,37 | 0,77 | 0,38 | 0,82 | 0,38 | 0,97 | 0,38 | 0,84 |
| 0,09 | 0,35 | 1,45 | 0,32 | 1,55 | 0,38 | 1,92 | 0,38 | 2,1 | 0,35 | 2,2 | 0,32 | 2,45 |
| 0,36 | 0,19 | 0,74 | 0,24 | 1,28 | 0,38 | 0,58 | 0,42 | 0,52 | 0,43 | 0,48 | 0,41 | 0,6 |
Таблица 14
Диффузионно-кинетические характеристики процесса внедрения Са в BiCu – электроды
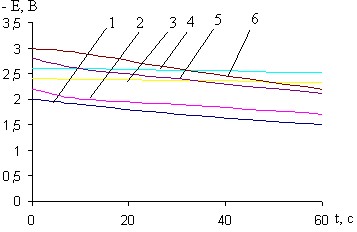
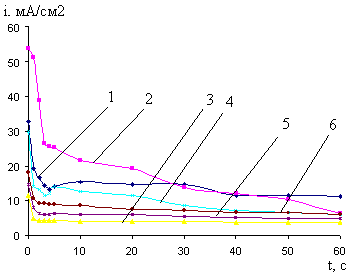
Рис.13. Кривые i-t катодного внедрения кальция из 0,027 М раствора CaCl2в BiCu при - Ек, В: 1- 2,0; 2- 2,2; 3- 2,4; 4- 2,6; 5- 2,8; 6- 3,0
Рис.14. Влияние потенциала предобработки BiCu электрода в 0,027М растворе CaCl2 в ДМФ на ход бестоковых хронопотенциограмм CaBiCu- электрода при - Ек, В: 1- 2,0; 2- 2,2; 3- 2,4; 4- 2,6; 5- 2,8; 6- 3,0
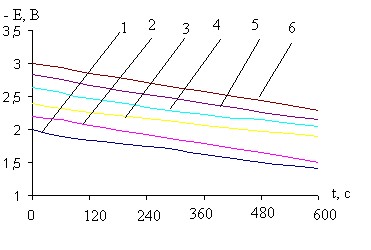
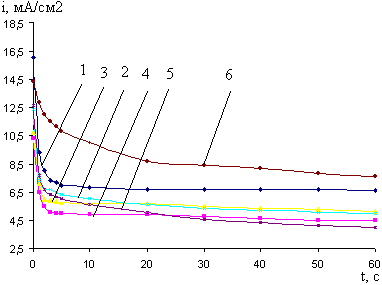
Рис. 15. Кривые i-t катодного внедрения кальция из 0,045 М раствора CaCl2в BiCu при - Ек, В: 1- 2,0; 2- 2,2; 3- 2,4; 4- 2,6; 5- 2,8; 6- 3,0
Рис. 16. Влияние потенциала предобработки BiCu электрода в 0,09М растворе CaCl2 в ДМФ на ход бестоковых хронопотенциограмм CaBiCu- электрода - Ек, В: 1- 2,0; 2- 2,2; 3- 2,4; 4- 2,6; 5- 2,8; 6- 3,0
Таблица 15
Влияние температуры на диффузионно-кинетические характеристики процесса внедрения кальция в BiCu – электрод из 0,027 раствора CaCl2 в ДМФ при потенциале -2,6В
| Температура, С | 25 | 30 | 35 | 40 | 45 | 50 |
| kb, мА*см-2c1/2 | 5,9 | 8,1 | 2,9 | 1,5 | 2,9 | 1,2 |
| СсаDca*107, моль*см-2 | 3,61 | 4,95 | 1,8 | 0,92 | 1,8 | 0,73 |
| i(0), мА*см-2 | 30 | 27,5 | 18,5 | 22,5 | 20 | 24,5 |
3.4.4. Закономерности внедрения щелочноземельных металлов на медном электроде, модифицированном висмутом и таллием
На начальном этапе поляризации образование фазы твердого раствора медь - висмут протекает в условиях конкурирующего влияния адсорбционного взаимодействия анионов раствора с поверхностью электрода. Глубина минимума тока и его продолжительность во времени зависят от потенциала поляризации. При концентрации 1 моль/л изменение потенциала от -0,3 до -0,6 В сопровождается увеличением тока в момент времени t 30с от 0,08 до 1,35 мА/см2.
Таблица 16
Процентное содержание висмута и таллия в медном электроде после катодной обработки в 0,1М растворах соответствующих солей в течение 45 минут
| Потенциал, В | Содержание висмута, % | Содержание таллия, % | ||||
| -0,35 | -0,4 | -0,45 | -0,35 | -0,4 | -0,45 | |
| 145 мкм | 57,3 | 44,2 | 51,2 | 2,4 | 1,7 | 1,3 |
| 185 мкм | 11,8 | 11,5 | 17,5 | 0,9 | 0,7 | 0,7 |
| 210 мкм | 7,5 | 7,2 | 12,3 | 0,6 | 0,6 | 0,5 |
После установления стационарного состояния (Т= 30 мин и более) диапазон токов сужается, но по-прежнему сохраняется сильное влияние потенциала: ток в рассматриваемом интервале потенциалов возрастает от 0,10 до 0,55 мА/см2. Состояние насыщения в образующемся твёрдом растворе достигается очень медленно. При более длительной поляризации можно наблюдать появление ещё одного максимума, что связано с образованием двух различных по составу фаз, которым на i-E кривых отвечают два максимума: Е1= -0,35 В; Е2= -0,53 В. Наиболее стабильная фаза, как показали измерения бестокового потенциала, образуется при потенциале -0,45В. Согласно данным рентгенофазового анализа позволили идентифицировать состав, полученный на поверхности меди в результате ее катодной обработки в растворах соли таллия образуются фазы![]() -Tl, Tl2O3, Cu2O. С увеличением времени обработки происходит уменьшение содержания чистого таллия в глубине электрода. Образование сложного оксидного слоя на поверхности меди уменьшает долю чистого таллия на поверхности и препятствует го диффузии в глубь электрода. Диффузионные характеристики полученных пленочных Bi(Сu) и Tl(Сu) электродов приведены в табл. 17.
-Tl, Tl2O3, Cu2O. С увеличением времени обработки происходит уменьшение содержания чистого таллия в глубине электрода. Образование сложного оксидного слоя на поверхности меди уменьшает долю чистого таллия на поверхности и препятствует го диффузии в глубь электрода. Диффузионные характеристики полученных пленочных Bi(Сu) и Tl(Сu) электродов приведены в табл. 17.
Сравнительный анализ бестоковых хронопотенциограмм для таллий-медных электродов показал, что и в этом случае на меди формируется твердый раствор, потенциал которого лежит отрицательнее исходного потенциала рабочего электрода.
Таблица 17
Влияние потенциала на диффузионные характеристики (С0D) процессов внедрения висмута и таллия в медь из 0.1 М водных растворов нитратов
| - Екп, В | 0,1 | 0,2 | 0,3 | 0,4 | 0,45 | 0,5 | 0,55 | 0,6 |
| СBiDBi*107, моль см2*с-1/2 | - | - | 0.23 | 0,07 | 0.06 | 0.16 | 0,25 | 0,25 |
| СTlDTl*106, моль см2*с-1/2 | 0,31 | 0.5 | 0,72 | 1.4 | - | 1,8 | - | - |
3.5. Особенности внедрения кальция в BiCu – электроды, подвергнутые магнитной обработке
Влияние предобработки BiCu – электродов в магнитном поле на их поведение при потенциалах внедрения кальция из раствора CaCl2 в ДМФ показало, что процесс уже с самого начала (с момента замыкания цепи) протекает в области более низких плотностей тока, мало зависит от потенциала (рис. 17) и от присутствия в сплаве кислорода.
Зависимости i-1/t (рис. 19) и i-t (рис. 20), независимо от потенциала идут параллельно друг другу. Это указывает, что процесс диффузии атомов кальция в глубь BiCu – электродов происходит с одинаковой скоростью, а найденные экстраполяцией на ось плотностей тока величины i(0) и i(t) близки по величине, но возрастают по мере смещения потенциала в катодную сторону. Этот факт можно объяснить определяющим влиянием дефектов поверхности, концентрация которых задана режимом обработки в магнитном поле.

Ингибирующий эффект магнитного поля может быть связан с особенностями структуры сплава BiCu: наличием в ней разновалентных атомов висмута и меди, легко вступающих в реакции электронного обмена.
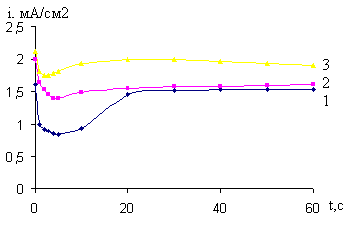
Рис. 17. Кривые i-t катодного внедрения кальция из 0,027 М раствора CaCl2 в BiCu электрод после его обработки в магнитном поле (напряжение 300В, 1233мТл, время воздействия 2с) и при –Ек, В: 1- 2,4; 2- 2,6; 3- 2,8
Рис. 18. Бестоковые хронопотенциограммы CaBiCu-электрода после катодного внедрения кальция из 0,027 М раствора CaCl2 в BiCu электрод после его обработки в магнитном поле (напряжение 300В, 1233мТл, время воздействия 2с) и при –Ек, В: 1- 2,4; 2- 2,6; 3- 2,8
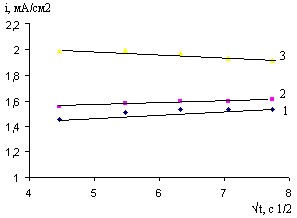
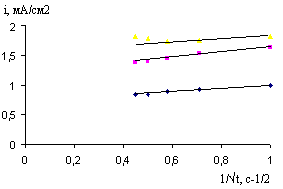
Рис. 19. Зависимость i-1/t в 0,027 М растворе CaCl2 для BiCu электродов после их обработки в магнитном поле (напряжение 300В, 1233мТл, время воздействия 2с), и при –Ек, В: 1- 2,4; 2- 2,6; 3- 2,8
Рис. 20. Зависимость i-t в 0,027 М растворе CaCl2 для BiCu электрода после его обработки в магнитном поле (напряжение 300В, 1233мТл, время воздействия 2с), и при –Ек, В: 1- 2,4; 2- 2,6; 3- 2,8
3.6. Циклируемость матричных CaxBiCu-электродов по кальцию
В работе установлено, что при циклировании в потенциоджинамическом режиме по мере увеличения скорости развертки потенциала ЦПДК свежеизготовленных CaxBiyCu электродов (1 цикл) в 0,027 М растворе CaCl2 в ДМФ смещаются в область катодных токов. При этом потенциал перехода электрода из катодной области в анодную лежит в пределах -(1,9±0,05), В в BiCu – электрод, если катодное внедрение велось при Ек -2,6В (рис. 31). На пятом цикле (рис. 32) при увеличении скорости развертки потенциал перехода смещается в отрицательную сторону почти до -2,4 В. Однако при Vp = 8 мВ/с ЦПДК практически полностью лежит в области катодных токов. При этом ЦПДК фиксируют колебания тока, но лежат в тех же пределах плотностей тока, что и на первом цикле. Таким образом, можно говорить о достаточно хорошей обратимости CaxBiCu электродов и рекомендовать их для источников тока с Са – анодом. При более длительном циклировании (до 100 циклов и более) диапазон рабочих токов практически не изменяется. Смещение потенциала реверса в катодной области до -2,8 В приводит к увеличению скорости накопления кальция в CaxBiCu – электроде. Но при этом наблюдать усиление «электрохимических шумов» связанных с твердофазными превращениями, обусловленными переходами Bi(II)Bi(III), Cu(II)Cu(I), присутствием кислорода в сплаве, вследствие электровыделения висмута в медь из водных растворов. Это согласуется с результатами ренгенофазового анализа и лазерного микрозондирования. Возможные реакции можно представить следующими схемами:
CaxBiyCu -2e Cax-1BiyCu+Ca2+ (5)
CaxCu – 2yeCax-yCu+ yCa2+ (6)
CaxBi – 2ye Cax-yBi+yCa2+ (7)
xCa2++xe +BiyCuCaxBiy-xCu (8)
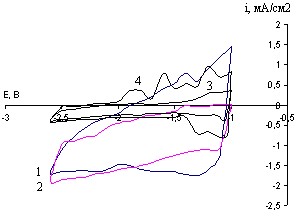
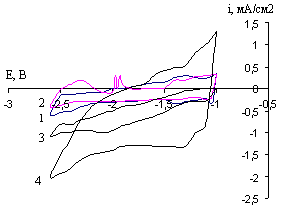
Рис. 24. ЦПДК CaxBiCu - электрода в растворе CaCl2 в ДМФ 0,027М при потенциале -2,6В в течение 45 минут при 20С и скоростях развертки, мВ/с: 1- 40; 2- 20; 3- 80; 4- 8 (1 цикл)
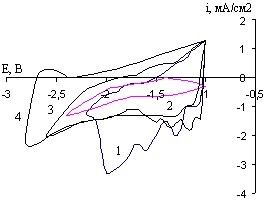
Рис.25. ЦПДК CaxBiCu-электрода в растворе CaCl2 в ДМФ 0,027М при потенциале -2,6В в течение 45 минут при 20С и скоростях развертки, мВ/с: 1- 80; 2- 8; 3- 20; 4- 40 (5 цикл)
Рис. 26. Циклические потенциодинамические кривые CaxBiCu – электрода в растворе CaCl2 в ДМФ 0,027М при Vp=80мВ/с в течение 45 минут при 20С и различных потенциалах, -Ек В: 1- 2,2; 2- 2,4; 3- 2,6; 4- 2,8 (1 цикл)
Глава 4. Технологические рекомендации
Согласно полученным данным, можно рекомендовать следующие условия:
- Обработка медного электрода при потенциале -0,45 В, в течение 45 минут в водном растворе Bi(NO3)3 (0,01 моль/л), обработанном предварительно в магнитном поле напряженностью 5 кА/м в течение 20 минут.
- Катодное внедрение кальция из раствора CaCl2 в ДМФ при потенциале -2,6 В в течение 45-60 минут.
- Циклирование в диапазоне от -2,6 до -1,0 В обеспечивает хорошую обратимость CaxBiyCu электродов и позволяет рекомендовать их для внедрения.
- Данные по магнитной обработке водных растворов Bi(NO3)3 и изготовленных BiхCu – электродов, подтвердившие наличие электронных переходов в структуре CaxBiyCu – электродов, позволяют рекомендовать метод катодного внедрения как метод структурирования на наноразмерном уровне многокомпонентных сплавов системы Ca(Sr)-Bi-Cu, Ca(Sr)-Bi-Pb-Cu.
Выводы
1. Изучено влияние потенциала, концентрации соли висмута и температуры на кинетику электрохимического внедрения висмута в медь, на состав формирующегося слоя сплава и его свойства. Установлено, что наиболее стабильное значение бестокового потенциала и равномерная однородная поверхность электрода образуется при потенциале -0,45В, концентрации 0,01М и температуре 25С.
2. Проведенные исследования показали принципиальную возможность электрохимического модифицирования поверхности электрода кальцием из апротонного органического раствора соответствующей соли по методу катодного внедрения. Установлено, что в ходе поляризации на исследуемом CuBi электроде, обработанном в слабоконцентрированных растворах соли кальция в области более электроположительных потенциалов формируется ИМС, с повышением концентрации раствора образование ИМС на поверхности во всём диапазоне исследуемых потенциалов, затруднено вследствие возрастания доли ион-ионных взаимодействий и возможной перестройки структуры раствора. Предположительно идет формирование пересыщенного твердого раствора.
3. В результате модифицирования медного электрода в нитратных растворах солей висмута, таллия и бария медь образует с висмутом и барием интерметаллическое соединение, а с таллием твердый раствор. Полученные результаты согласуются с данными из литературных источников, и подтверждены результатами лазерного и рентгенофазового анализов.
4. Определено, что ингибирующий эффект магнитного поля может быть связан с особенностями структуры сплава BiCu: наличием в ней разновалентных атомов висмута и меди, легко вступающих в реакции электронного обмена.
5. Установлено, что CaxBiCu электроды обладают достаточно хорошей обратимостью и рекомендуются для источников тока с Са – анодом.
Основное содержание диссертации изложено в следующих работах:
1. Медведева Н.Г. Влияние подложки на процесс катодного восстановления висмута. / Н.Г. Медведева, О.Н. Щербинина, Е.Л. Сурменко // Известия ВУЗов. Химия и химическая технология. 2007. Т. 50. Вып. 8. С.75-78.
2. Медведева Н.Г. Электрохимическое модифицирование матричных структур на основе меди кальцием. / О.Н. Щербинина, Е.Л. Сурменко, Н.Г. Медведева, С.С. Попова // Журнал прикладной химии. 2009. Т.82. Вып.4, С. 599-602.
3. Медведева Н.Г. Электрохимическое модифицирование матричных структур на основе свинца кальцием. / О.Н. Щербинина, Н.Г. Медведева, С.С. Попова // Известия ВУЗов. Химия и химическая технология. 2009. Т.52, Вып.4, С.57-61.
4. Медведева Н.Г. Процесс внедрения кальция в медновисмутовый тонкопленочный электрод. / О.Н. Щербинина, Н.Г. Медведева, С.С. Попова. // Известия ВУЗов. Химия и химическая технология. 2009. Вып.7, С.99-102.
Статьи в реферируемых сборниках и трудах конференций:
5. Медведева Н.Г. Катодная обработка свинцового электрода в растворе соли висмута. / О.Н. Щербинина, Н.Г. Медведева, // Вестник Саратовского государственного технического университета 2007. № 2 (24), Вып.1. С.65-68
6. Медведева Н.Г. Электровыделение висмута на меди из водных растворов нитрата висмута. / Н.Г. Медведева, О.Н. Щербинина, И.С. Панга, С.С. Попова // Проблемы трибоэлектрохимии: Материалы Междунар. науч.-техн. конф. 16-19 мая 2006г. г. Новочеркасск: ЮРГТУ, 2006. С.250-254
7. Медведева Н.Г. Модифицирование свинцового электрода в растворе соли висмута / Н.Г. Медведева, О.Н. Щербинина // Физико-химические процессы в конденсированном состоянии и на межфазных границах. Фагран-2006: III Всерос. конф. г. Воронеж, 8-14 октября 2006г. Воронеж, 2006. С. 164-166
8. Медведева Н.Г. Электрохимическое модифицирование матричных структур на основе свинца и меди кальцием и висмутом. / Н.Г. Медведева, О.Н.Щербинина, Е.Л. Сурменко // Внутривузовская научно-практическая конференция молодых ученых. г. Энгельс, 14-18 мая 2007 г. С. 243-245
9. Медведева Н.Г. Разработка новых материалов на основе оксидированной меди, модифицированной висмутом, лантаном и литием Разработка новых материалов на основе оксидированной меди, модифицированной висмутом, лантаном и литием / Н.Г. Медведева, О.Г. Лысенко, А.В. Певчев, С.С. Попова // Защитные и специальные покрытия, обработка поверхности в машиностроении и приборостроении: IV Всерос. науч.-практич. конф. 2-3 октября 2007г., Пенза, ПГУ, 2007. С.58-60
10. Медведева Н.Г. Электрохимическое модифицирование матричных структур на основе свинца кальцием / Н.Г. Медведева, О.Н. Щербинина, С.С. Попова // Физико-химические процессы в конденсированном состоянии и на межфазных границах. Фагран-2008: IV Всерос. конф., Воронеж, 6-9 октября 2008 г. С.178-181
11. Медведева Н.Г. Катодная обработка медного электрода, модифицированного висмутом и таллием в апротонных органических растворах солей щелочноземельных металлов / Н.Г. Медведева, О.Н. Щербинина, С.С. Попова // «Инновационные технологии в промышленности Уральского региона» науч.-практ. конф. в рамках Международной промышленной выставки «Industry Expo», Екатеринбург, 5-7 ноября 2008 г. С. 98-100
12. Медведева Н.Г. Образование фаз внедрения при катодной поляризации медной фольги в растворах солей цинка, кадмия и свинца и их влияние на адгезионные свойства медной фольги / Н.Г.Медведева, А.К. Певчев, С.С.Попова // Актуальные проблемы электрохимической технологии. Сборник статей молодых ученых. Саратов, СГТУ, 2008 г. С.51-56
13. Медведева Н.Г. Влияние температуры на электрохимическое поведение меди в растворах солей висмута / Н.Г.Медведева, О.Н. Щербинина, С.С. Попова // Научно-практическая конференция. «Покрытия и обработка поверхности», Москва, 18-20 марта 2009 г. С.165-168
14. Медведева Н.Г. Модифицирование медно-висмутового тонкопленочного электрода в апротонном растворе соли кальция / Н.Г.Медведева, О.Н. Щербинина // Синтез инноваций: направления и перспективы: Материалы научно-практической конференции. Саратов: СГТУ. 2009г. С.76-78
15. Шустова Н.Г. (Медведева) Электрохимическое поведение меди, модифицированной висмутом, в диметилформамидном растворе CaCl2 / Н.Г. Шустова, О.Н. Щербинина // Совершенствование технологии гальванических покрытий: XIV Всерос. совещание. Киров, ВятГУ, 5-8 октября 2009 г.
16. Шустова Н.Г. (Медведева) Электрохимическое поведение меди в нитратных растворах / Н.Г.Шустова О.Н. Щербинина, С.С. Попова // Нелинейные процессы и проблемы самоорганизации в современном материаловедении (индустрия наносистем и материалы): 7 Всерос.конфер.-школа. Воронеж. 28 сентября - 2 октября 2009 г.
Подписано в печать 13.11.09 Формат 6084 1/16
Бум.офсет. Усл.печ.л. 1,0 Уч.-изд.л. 1,0
Тираж 100 экз. Заказ Бесплатно
Саратовский государственный технический университет
410054, Саратов, политехническая ул., 77
Отпечатано в РИЦ СГТУ. 410054, Саратов, Политехническая ул., 77

