Кинетика и механизм ингибирующего действия производных фенозана, салициловой кислоты и их синергических смесей с - токоферолом и фосфолипидами
На правах рукописи
ПЕРЕВОЗКИНА МАРГАРИТА ГЕННАДЬЕВНА
КИНЕТИКА И МЕХАНИЗМ ИНГИБИРУЮЩЕГО ДЕЙСТВИЯ ПРОИЗВОДНЫХ ФЕНОЗАНА, САЛИЦИЛОВОЙ КИСЛОТЫ
И ИХ СИНЕРГИЧЕСКИХ СМЕСЕЙ С -ТОКОФЕРОЛОМ И ФОСФОЛИПИДАМИ
Специальность 02.00.04 – Физическая химия
Автореферат
Диссертации на соискание ученой степени
кандидата химических наук
Тюмень, 2003
Работа выполнена в Тюменской государственной медицинской академии
на кафедре общей и биоорганической химии
Научный руководитель:
доктор химических наук, профессор Сторожок Н.М.
Официальные оппоненты:
доктор химических наук, профессор Захаров М.С.
кандидат химических наук, доцент Качалова Г.С.
Ведущая организация: Тюменский государственный университет, г. Тюмень
Защита состоится «27»_июня 2003 г. в 14.00 часов в зале им. А.Н. Косухина на заседании диссертационного совета Д 212.273.06 в Тюменском государственном нефтегазовом университете.
По адресу: 625000, г. Тюмень, ул. Володарского, 38. ТюмГНГУ.
С диссертацией можно ознакомиться в библиотеке ТюмГНГУ.
Автореферат разослан « » мая 2003 г.
Ученый секретарь
диссертационного совета,
доктор химических наук,
профессор И.Г. Жихарева
ВВЕДЕНИЕ
Актуальность. В настоящее время антиоксиданты (АО) широко применяются для стабилизации окисления топлива, смазочных масел, пластмасс, резинотехнических изделий. Особые требования предъявляются к ингибиторам окисления, применяемым в медицине, пищевой промышленности. Перечень официально разрешенных, нетоксичных АО невелик, наибольшее применение нашли исследованные ранее природные АО: -токоферол (-ТФ) /Tappel, 1970, Храпова, 1971, Аристархова и др., 1972, Kartha, 1977, Ingold, 1982, Бурлакова и др., 1992/, -каротин /Касаикина и др., 1975, Barton, Ingold, 1984, Krinski, 1989, Terao, 1989, Palozza, 1992, Сторожок, 1995/, флавоноиды /Pras, Wichers, Bruins et al., 1988, Kostyuk et al, 2000, Potapovich et al, 2001 /.
В последние годы во всем мире ведется целенаправленный поиск эффективных ингибиторов окисления среди объектов морского промысла /Богуславская, Максимов, 1988/, лекарственных растений /Герчиков, Гарифуллина, 1998/, сапропелей /Филиппов, 1975/ и др. Исследования подобного рода позволили открыть новые классы АО, отыскать альтернативные природные источники известных ингибиторов окисления. В качестве АО исследуют природные пигменты: астаксантин, зеаксантин /Lim, 1992, Капитонов, Пименов, 1996/, действующее вещество золотого корня - тирозол С (аурол) /Pras, Wichers, Bruins et al., 1988, Сторожок, Гуреева и др., 2002/. Большинство АО, обнаруженных в результате изучения природных объектов, в последующем синтезируются и становятся доступными для большинства населения. Так, внедрение схемы синтеза убихинона (коэнзима Q10) по итогам международного конкурса, обеспечило возможность широкого применения его как АО и лекарственного препарата /Каган, 1983, 1997/.
Параллельно со скринингом биоАО, синтезтруются ингибиторы нового поколения на основе модификации химической структуры известных соединений. В результате направленного синтеза получены новые АО «гибридной» природы, сочетающие в своей структуре несколько фрагментов, взаимонезависимо или синергически действующих на разные стадии сложного процесса окисления.
В последние годы в ИБХФ им. Н.М. Эмануэля РАН синтезирован ряд стерически затрудненных АО (ИХФАНов), представляющих собой сложноэфирные производные фенозана (метилокса) (3,5 дитрет.бутил-4-гидроксифенилпропановой кислоты) и этаноламина (коламина), замещенного в свою очередь алкильными заместителями с разной длиной цепи, включающей от 8 до 16 атомов углерода. Для некоторых ИХФАНов на модели спонтанного окисления липидов гомогенатов головного мозга мышей оценена антиоксидантная активность /Никифоров, Белостоцкая, Вольева и др., 2003/.
В НИОХ им. Н.Н. Ворожцова СО РАН синтезирована группа замещенных амидов салициловой кислоты, имеющих в о.- и п.-положении экранирующие трет.бутильные заместители. Ранее сравнительного тестирования ингибирующих свойств указанных соединений с целью выявления среди них активных АО не проводилось.
Третьим направлением создания высокоэффективных АО является поиск синергических смесей. Синергисты обеспечивают значительное усиление действия ингибитора, что позволяет применять его в меньшем количестве. В качестве синергистов природного происхождения исследуются фосфолипиды (ФЛ) / Ishikawa et al 1975, 1984, Сторожок, 1986, 1996/, аминокислоты /Hudson, 1981/, аскорбиновая кислота /Niki et al, 1983, Etsuo, 1984/. Изучение кинетики и механизма взаимодействия АО и синергистов разной природы представляет несомненный теоретический и практический интерес, поскольку позволяет создавать новые способы предотвращения окисления органических материалов. Важным представляется поиск синергических композиций с природными соединениями (-ТФ, ФЛ), совместно локализованными в биологических мембранах. Эффекты неаддитивности, потенциально возможные в действии новых синтетических АО и компонентов клеточных мембран, необходимо учитывать при стабилизации окисления биологически активных липидов, при использовании АО в качестве лекарственных средств.
Настоящая работа находится на стыке указанных направлений. В исследовании представлены результаты сравнительного исследования ингибирующего действия двух классов новых отечественных АО, разработанных в Институте биохимической физики им. Н.М. Эммануэля РАН (г. Москва) (ИХФАНЫ) и в Институте органической химии им. Н.Н. Ворожцова СО РАН (г. Новосибирск) (амиды салициловой кислоты). Показано, что ИХФАНЫ не обладают местным и общетоксическим действием, не оказывают влияния на эмбриогенез и развитие потомства, проявляют антиацетилхолинэстеразную активность /Молочкина Е.М. 1998./, регулируют рост клеток растений /Бурлакова Е.Б. 1998./. Производные салициловой кислоты (аспирин, фенетол, осалмид) применяются в медицине /Машковский, 2002/. Новые соединения, созданные на основе амидов салициловой кислоты, также имеют перспективны практического использования в качестве фармпрепаратов и АО.
Настоящая работа посвящена сравнительному исследованию антиоксидантной и антирадикальной активности новых перспективных АО, изучению возможности усиления их активности в синергических композициях.
Целью работы являлось сравнительное изучение закономерностей окисления модельных систем в присутствии ряда новых синтетических фенолов - производных фенозана и салициловой кислоты, исследование роли различных фрагментов молекулы в обеспечении ингибирующего действия антиоксидантов, поиск путей усиления их эффективности в композиции с синергистами ингибиторов окисления.
Задачи исследования.
- Исследовать кинетику инициированного окисления метилолеата в присутствии индивидуальных АО различного химического строения: калиевой соли (3/,5/-дитрет.бутил-4/-гидроксифенил) пропановой кислоты (фенозана К) (I), метилового эфира фенозана К (II), N,N-диметиламиноэтилового эфира -(3/,5/-дитрет.бутил-4/-гидроксифенил) пропановой кислоты сукцината (ИХФАН-9) (III), N,N,N-триметиламиноэтилового эфира -(3/,5/-дитрет.бутил-4/-гидроксифенил) пропановой кислоты иодида (ИХФАН-10) (IV), N,N-диметил-N-октиламиноэтилового эфира -(3/,5/-дитрет.бутил-4/-гидроксифенил) пропановой кислоты бромида (ИХФАН-10-С-8) (V), N,N-диметил-N-дециламиноэтилового эфира -(3/,5/-дитрет.бутил-4/-гидроксифенил) пропановой кислоты бромида (ИХФАН-10-С-10) (VI), N,N-диметил-N-додециламиноэтилового эфира -(3/,5/-дитрет.бутил-4/-гидроксифенил) пропановой кислоты бромида (ИХФАН-10-С-12) (VII), N,N-диметил-N-гексадециламиноэтилового эфира -(3/,5/-дитрет.бутил-4/-гидроксифенил) пропановой кислоты бромида (ИХФАН-10-С-16) (VIII), амида 1-(N-4-гидроксифенил) салициловой кислоты (осалмида) (IX), амида 1-(N-4-гидроксифенил-3,3,5-тритрет. бутил)-5-этил салициловой кислоты (X), амида 1-(N-4-гидроксифенилпропил-3,5-дитритрет.бутил)-5-этил салициловой кислоты (XI), амида 1-(N-4-гидроксифенилпропил-3,3,5-тритрет.бутил)-5-этил салициловой кислоты (XII), п-аминофенола (XVI), п-ацетаминофенола (парацетамола) (XVII). 2,6-дифенил-4-метоксифенола (XVIII), дибунола (2,6-дитрет.бутил-4-метилфенола) (IXX), -токоферола (XX).
- Для всех исследуемых соединений I - XX изучить особенности брутто-ингибирующего действия в зависимости от концентрации.
- Исследовать антирадикальную активность всех означенных выше ингибиторов окисления I - XX, оценить значение констант k7 элементарной реакции между антиоксидантом и пероксильными радикалами.
- Изучить кинетику накопления пероксидов при окислении модельных ненасыщенных липидов в присутствии поименованных выше АО: III, IV, V, VI. VII, VIII, IX, X, XI, XII, XVII.
- Установить характер совместного ингибирующего действия -токоферола с поименованными выше пространственно затрудненными фенолами: IV, VIII, IX, XII, XVII.
- Исследовать особенности сочетанного ингибирующего действия фосфолипидов с поименованными выше синтетическими и природными фенолами: IV, VIII, IX, XII, XVII.
Материал и методы исследования. В работе использованы манометрический метод поглощения кислорода, метод термохемилюминесценции, иодометрический метод определения количества гидропероксидов, метод Ребиндера и метод рефрактометрии определения критической концентрации мицеллообразования.
Исследуемые амидные производные салициловой кислоты были синтезированы в институте органической химии (НИОХ) им. Н.Н. Ворожцова СО РАН, сложноэфирные производные фенозана К, дибунол - в институте биохимической физики им. Н.М. Эмануэля РАН. В качестве реперного АО использовали -токоферол (2,5,7,8-тетраметил-2-(4,8,12-триметилтридецил)-6-гидроксихроман), линолевую кислоту (ЛК), фосфолипиды (ФЛ) фирмы (Serva) США, метилолеат (МО) синтезирован в НИОХ СО РАН, очищен перегонкой под вакуумом при остаточном давлении 5 мм рт. ст. В качестве инертного к окислению растворителя применяли хлорбензол, очищенный методом простой перегонки.
Научная новизна. Впервые оценена антирадикальная активность и изучены особенности ингибирующего действия ряда поименованных выше сложных эфиров фенозана К и этаноламина III, IV, V, VI, VII, VIII, отличающихся между собой длиной цепи заместителя у кватернизированного атома азота. Впервые исследованы закономерности окисления модельного субстрата (метилолеата) в присутствии ряда поименованных выше амидных производных салициловой кислоты IX, X, XI, XII, XVI, различающихся степенью экранированности фенольных –ОН групп и удаленностью между собой амидного и ароматического фрагментов молекулы, а также парацетамола XVII. Определены константы элементарной реакции взаимодействия указанных выше АО с пероксильными радикалами (k7), установлена взаимосвязь строения и их антирадикальной активности. Для всех упомянутых выше соединений изучены особенности зависимости доза-эффект. Кинетически описана кинетика накопления гидропероксидов в присутствии амидных производных салициловой кислоты: III, IV, V, VI, VII, VIII, IX, X, XI, XII), и ароматического амина - п-ацетаминофенола (парацетамола) (XVII). Впервые установлен эффект синергизма -токоферола с пространственно затрудненными АО –производными фенозана К: IV, VIII, XII, изучены закономерности изменения эффективности указанных смесей от концентрации каждого компонента. Кинетически описан эффект антагонизма, впервые обнаруженный в системе, ингибируемой смесями -токоферола с поименованными выше пространственно незатрудненными АО: IX, XVII.. Выявлен и изучен эффект синергизма при сочетанном ингибирующем действии поименованных выше фенольных соединений: IV, VIII), (IX, XII, XVII с фосфолипидами (яичным фосфатидилхолином).
Практическая значимость работы заключается в отборе наиболее эффективных антиоксидантов среди ряда поименованных выше соединений, являющихся сложными эфирами фенозана К (I) с метанолом (II) или этаноламином (III, IV, V, VI, VII, VIII, IX), различающихся между собой длиной заместителя у кватернизированного атома азота. Проведен скрининг с целью поиска активных ингибиторов окисления среди амидных производных салициловой кислоты (Х, XI, XII и п-ацетаминофенола (парацетамола) (XVII). Установлена взаимосвязь между строением и ингибирующей активностью изученных классов антиоксидантов разной природы. Разработаны рекомендации для направленного синтеза высокоэффективных ингибиторов окисления на основе пара-аминофенола. Установлены оптимальные составы синергических композиций -токоферола с новыми АО – производными фенозана К: IV, VIII, XII, позволяющие увеличить эффективность ингибирования окисления в 2-5 раз. Установлены концентрационные диапазоны, обеспечивающие максимальную эффективность синергических смесей новых антиоксидантов: IV, VIII, IX, XII, XVII с фосфолипидами. Полученные данные могут быть использованы при разработке новых способов стабилизации окисления пищевых липидов, основ фармпрепаратов, косметических средств.
Апробация работы. Основные результаты работы представлены и обсуждены на Х Российском Национальном конгрессе “Человек и лекарство“ (г. Москва, 1995, 1997, 2003 гг.), XI Международной конференции по химии органических и элементоорганических пероксидов (г. Москва, 2003 г.), Межвузовской научной конференции молодых ученых и студентов “Актуальные проблемы теоретической, экспериментальной и клинической медицины“ (г.Тюмень,2001, 2002 гг.), Международном симпозиуме “Медицина и охрана здоровья” (Тюмень, 2001, 2002 гг.), 75-ой Всероссийской студенческой научной конференции (Казань 2001 г.), VI Международной конференции “Биоантиоксидант“ (г. Москва, 2002 г.).
Публикации. Основной фактический материал и выводы диссертации опубликованы в 12 работах (6 статей и 6 тезисов докладов).
Положения работы, выносимые на защиту:
1. Антирадикальная активность (k7) и особенности ингибирующего действия в неполярной и вводно-эмульсионной среде производных фенозана К (I), его метилового эфира (II), поименованных выше сложных эфиров с этаноламином: III, IV, V, VI, VII, VIII, различающихся между собой длиной заместителя у аммониевого азота,
2. Антирадикальная и антиокислительная активность новых антиоксидантов, представляющих собой названные выше амидные производные салициловой кислоты: IX, X, XI, XII, п-ацетаминофенола (XVII).
3. Кинетика разрушения гидропероксидов в присутствии поименованных выше замещенных амино- (III, IV, V, VI, VII, VIII) и амидосодержащих ингибиторов окисления (IX, X, XI, XII) и п-ацетаминофенола (XVII).
4. Особенности сочетанного ингибирующего действия -токоферола с новыми пространственно незатрудненными и экранированными антиоксидантами: IV, VIII, XII. Кинетика и механизм эффектов синергизма смесей указанных соединений и -токоферола, взаимосвязь между концентрацией каждого из компонентов и эффективностью бинарных смесей.
5. Кинетика эффектов синергизма в совместном ингибирующем действии фосфолипидов и новых антиоксидантов различного строения: производных фенозана К (IV, XII), амида) салициловой кислоты (осалмида) (IX), п-ацетаминофенола (XVII).
Объем и структура диссертации. Диссертация изложена на 170 страницах текста, содержит 11 таблиц, 24 рисунка. Работа состоит из введения, обзора литературы и материалов и методов исследования, результатов собственных исследований, обсуждения результатов, списка литературы.
СОДЕРЖАНИЕ РАБОТЫ
Глава 1. Исследование особенностей ингибирующего действия антиоксидантов производных фенозана
Одним из перспективных направлений создания новых высокоэффективных антиоксидантов (АО) является синтез «гибридных молекул», сочетающих в своей структуре несколько характеристических групп, взаимонезависимо или синергически воздействующих на процесс окисления субстратов в липидной или водной фазе. В главе представлены результаты исследования новых АО, представляющих собой стерически затрудненные АО - сложные эфиры фенозана К (метилокса) и этаноламина, замещенного в свою очередь одним или несколькими алкильными радикалами с разной длиной цепи (R3), включающей от одного до 16 углеродных атомов (см. формулы, схема 1). Ингибиторы известны под названием ИХФАНЫ.
Методом хемилюминесценции (ХЛ) была оценена константа взаимодействия АО с пероксильными радикалами:
k7
RO2° + InH ROOH + In° (7),
где InH – ингибитор окисления, In° - феноксильный радикал ингибитора.
Показано, что значения k7 дибунола, фенозана К, его метилового эфира сравнимы между собой (табл.1). Антирадикальная активность (АРА) ИХФАНа-9 и ИХФАНа-10 по сравнению с ними ниже в 1,5- 2,5 раза (табл.1). Уменьшение k7 ИХФАНОВ по сравнению с дибунолом объясняется влиянием электроноакцепторных заместителей /Рогинский В.А. 1988./. Активность природного АО – -ТФ в реакции с ведущими окисление радикалами RO2• выше, чем у исследуемых АО практически в 360 раз. Фактор ингибирования f для дибунола и -ТФ равнялся 2,0; а для ИХФАНов был близок к 2,5, что обусловлено наличием в их структуре двух реакционных центров.
Исследование действия АО в модельной системе инициированного окисления метилолеата (МО) при 60С показало высокую эффективность действия ИХФАНОВ как ингибиторов окисления. Видно, что в их присутствии появляются периоды индукции, пропорциональные количеству АО (рис.1). Следует заметить, что при их введении в систему окисления происходило значительное снижение начальной и максимальной скорости поглощения кислорода (рис. 2). Эти данные указывали, что аминосодержащие АО, возможно, активны в качестве разрушителей гидропероксидов (ROOH). Для подтверждения этой гипотезы исследовали кинетику накопления ROOH при окислении МО (рис. 3). Введение ингибиторов в систему окисления приводило к снижению концентрации ROOH по сравнению с контролем. Наибольшую активность в качестве разрушителей ROOH проявили ИХФАН-9, ИХФАН-10 и ИХФАН-10-С-16. Распад гидропероксидов сопровождается, по всей вероятности, образованием молекулярных продуктов, поскольку вторичного инициирования окисления не происходило.
ФОРМУЛЫ ПРОИЗВОДНЫХ ФЕНОЗАНА
I II ФЕНОЗАН К МЕТИЛОВЫЙ ЭФИР ФЕНОЗАНА
калиевая соль -(3,5-дитрет.бутил-4- метиловый эфир -(3,5-дитрет.бутил-4-
гидроксифенил) гидроксифенил) пропановой кислоты
пропановой кислоты
III IV
ИХФАН-9 ИХФАН-10
N,N-диметиламиноэтиловый эфир N,N,N-триметиламиноэтиловый эфир
-(3,5-дитрет.бутил-4-гидроксифенил) -(3,5-дитрет.бутил-4-гидроксифенил)
пропановой кислоты сукцинат пропановой кислоты иодид
V VI
ИХФАН-10-С-8 ИХФАН-10-С-10
N,N-диметил-N-октиламиноэтиловый эфир N,N-диметил-N-дециламиноэтиловый эфир
-(3,5-дитрет.бутил-4-гидроксифенил) -(3,5-дитрет.бутил-4-гидроксифенил) пропановой кислоты бромид пропановой кислоты бромид
VII VIII
ИХФАН-10-С-12 ИХФАН-10-С-16
N,N-диметил-N-додециламиноэтиловый N,N-диметил-N-гексадециламиноэтиловый
эфир -(3,5-дитрет.бутил-4-гидроксифенил) эфир -(3,5-дитрет.бутил-4-гидрокси-пропановой кислоты бромид фенил) пропановой кислоты бромид
ФОРМУЛЫ АО, ПРОИЗВОДНЫХ САЛИЦИЛОВОЙ КИСЛОТЫ
IX X
Амид 1-(N-4-гидрокси-фенил)- Амид 1-(N-4-гидроксифенил-
салициловой кислоты 3,3,5-тритрет. бутил)-5-этил
(Осалмид) салициловой кислоты
XI XII
Амид 1-(N-4-гидроксифенилпропил- Амид 1-(N-4-гидроксифенилпропил-
3,5-дитритрет.бутил)-5-этил 3,3,5-тритрет.бутил)-5-этил
салициловой кислоты салициловой кислоты
ФОРМУЛЫ РЕПЕРНЫХ И МОДЕЛЬНЫХ ФЕНОЛОВ
XIII XIV XV
Гидроксибензол Аминобензол Салициловая кислота
орто-гидроксибензойная кислота
XVI XVII
Пара-минофенол пара-ацетаминофенол (Парацетамол)
XVIII IXX XX
2,6-дифенил-4- 2,6-дитрет. бутил-4-метилфенол -Токоферол
метоксифенол (ДФФ) (Дибунол) 2,5,7,8-тетраметил-2-(4,8,12-
триметилтридецил)-6-
гидроксихроман
Схема 1. Структурные формулы АО
Таким образом, исследуемые АО способны эффективно обрывать цепи окисления при взаимодействии с пероксильными радикалами, а также предотвращать возможность вторичного инициирования процесса за счет разрушения гидропероксидов молекулярным путем.
Было установлено, что при сравнимых концентрациях исследуемые вещества проявляют высокую антиоксидантную активность (АОА), в 13-43 раза увеличивают периоды торможения окисления модельного субстрата (табл. 1).
В последние годы для некоторых природных ингибиторов (-ТФ, -каротина, аурола и др. ) была показана возможность уменьшения действия АО в области высоких доз как при окислении в модельных системах /Храпова, 1988, Сторожок, 1996, Гуреева, 2001/, так и ингибировании in vivo /Ланкин, Тихазе, 2000/. В связи с этим представляло интерес изучить эффективность действия новых АО в широком диапазоне концентраций. Таблица 1
Кинетические характеристики действия антиоксидантов
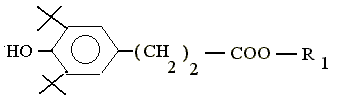  | |||||||
| № п/п | Название АО | R3 *** | К7 10-4, М-1 с-1 | инд, мин* (САО= const = 110-3, М) | АОА** (АО)- (МО) (МО) | АОА** (АО) (-ТФ) | АОА** (АО) (ДИБ) |
| I | Фенозан К | - | 2,20 | 920 | 35,4 | 1,54 | 0,97 |
| II | Метиловый эфир фенозана | - | 2,30 | 1050 | 40,4 | 1,75 | 1,10 |
| III | ИБХФАН-9 | - | 0,80 | 1025 | 39,4 | 1,70 | 1,08 |
| IV | ИБХФАН-10 | -CH3 | 0,60 | 1125 | 43,3 | 1,88 | 1,90 |
| V | ИБХФАН-10-С-8 | -C8H17 | 1,10 | 350 | 13,5 | 0,58 | 0,40 |
| VI | ИБХФАН-10-С-10 | -C10H21 | 1,00 | 500 | 19,2 | 0,83 | 0,55 |
| VII | ИБХФАН-10-С-12 | -C12H25 | 1,00 | 425 | 16,3 | 0,71 | 0,45 |
| VIII | ИБХФАН-10-С-16 | -C16H33 | 0,95 | 1080 | 41,5 | 1,80 | 1,16 |
| XIX | Дибунол | - | 1,40 | 950 | 36,5 | 1,58 | - |
| XX | -Токоферол | - | 360,00 | 600 | 23,1 | - | 0,63 |
p 0,05 * условия окисления приведены в подписях к рис. 1
**АОА по отношению к МО, - ТФ, дибунолу
*** R3 - количество углеродных атомов в алкильном радикале молекулы ИХФАНОВ
На рис. 4 а,б приведена зависимость изменения величины периодов индукции от концентрации АО разного строения в сравнении с -ТФ и дибунолом. Видно, что по характеру концентрационных кривых, ингибиторы разделяются на две группы. Величина периодов индукции для ингибиторов, не имеющих длинноцепочечных заместителей (фенозан К, его метиловый эфир, дибунол, ИХФАН-9 и ИХФАН-10), возрастает прямо пропорционально их количеству в системе окисления (рис. 4 а). Для -ТФ воспроизводится экстремальная зависимость, описанная ранее в литературе (рис. 4а).
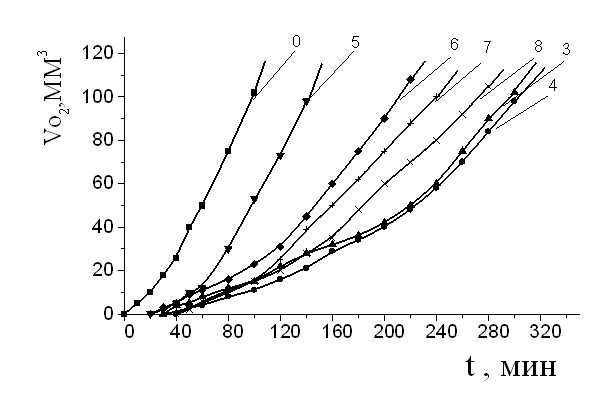 Рис.1.Кинетические кривые поглощения кислорода при инициированном окислении метилолеата (МО) в присутствии равных концентраций АО: 0 - МО (контроль); 5 - ИХФАН-10-С-8; 6 - ИХФАН-10-С-10; 7 - ИХФАН-10-С-12; 8 - ИХФАН-10-С-16; 3 - ИХФАН-9; 4 - ИХФАН-10. МО : хлорбензол 1 : 1. САО = 210-4 М. Wi = 4.210-8 (Мc)-1, T= 600С.
Рис.1.Кинетические кривые поглощения кислорода при инициированном окислении метилолеата (МО) в присутствии равных концентраций АО: 0 - МО (контроль); 5 - ИХФАН-10-С-8; 6 - ИХФАН-10-С-10; 7 - ИХФАН-10-С-12; 8 - ИХФАН-10-С-16; 3 - ИХФАН-9; 4 - ИХФАН-10. МО : хлорбензол 1 : 1. САО = 210-4 М. Wi = 4.210-8 (Мc)-1, T= 600С.
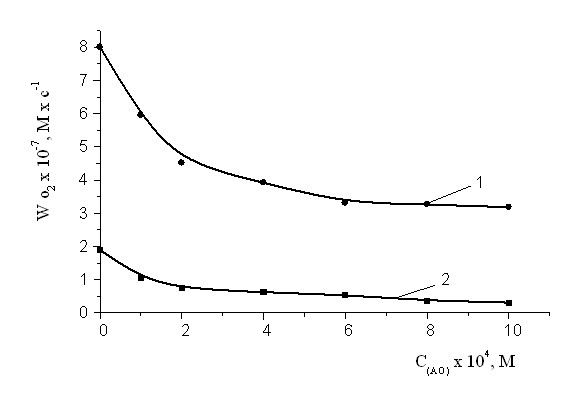 Рис.2. Зависимость максимальной (1) и начальной (2) скорости окисления МО от концентрации ИХФАНА-10.
Рис.2. Зависимость максимальной (1) и начальной (2) скорости окисления МО от концентрации ИХФАНА-10.
МО : хлорбензол 1 : 1. Wi =4.210-8(Мc)-1, T= 600С
Рис.3 Кинетические кривые накопления гидропероксидов при аутоокисленииМО в присутствии равных концентраций АО. Стрелкой обозначен момент введения АО в реакционную смесь.
0 – МО (контроль). Обозначение АО соответствует табл.1. T = 600C

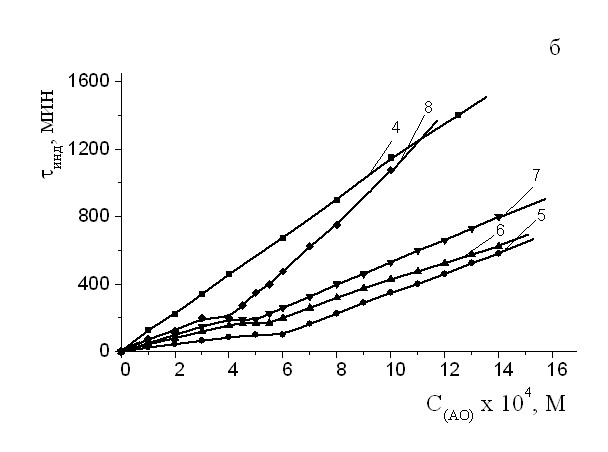 Рис.4 а) Зависимость изменения величины периодов индукции от концентрации АО. Обозначение ИХФАНов соответствуют табл.1; 9 – дибунол; 10 - -ТФ.
Рис.4 а) Зависимость изменения величины периодов индукции от концентрации АО. Обозначение ИХФАНов соответствуют табл.1; 9 – дибунол; 10 - -ТФ.
б). Зависимость изменения величины периодов индукции от концентрации АО. Обозначение АО соответствуют табл.1. МО: хлорбензол 1:1. САО = 210-4 М, Wi = 4.210-8 (Мc)-1,
T= 600С.
Следует отметить, что во всем исследуемом диапазоне концентраций ИХФАНЫ превосходят дибунол и -токоферол (на 30%). Наибольшие периоды торможения во всем изученном диапазоне концентраций проявляются для ИХФАНа-10. Для группы ИХФАНОВ, содержащих в своей структуре остаток этаноламина, замещенного в свою очередь N-алкильными заместителями с разной длиной углеводородной цепи (схема 1), указанная концентрационная кривая имеет изломы (рис. 4 б). На кривых выделяется 3 участка. Видно, что на 1 участке зависимость для всех АО носит линейный характер, с ростом концентрации на кривых появляется второй достаточно узкий отрезок, в пределах которого не происходит изменения величины периодов индукции. При превышении некоторой «пороговой» концентрации вновь наблюдается увеличение брутто-эффективности торможения, прямо пропорциональное концентрации АО.
Очевидно, что указанные различия в действии разных концентраций АО связаны с их строением. Была проанализирована взаимосвязь между «пороговой» концентрацией АО и длиной цепи его алкильного заместителя (длиной радикала R3). Установлено, что «пороговая» концентрация, соответствующая «излому» концентрационных кривых, уменьшается пропорционально росту длины цепи заместителя R3 (рис. 5 а). Указанная корреляция указывает, что в растворах при определенных концентрациях АО возможно формирование мицелл. Косвенно об образовании мицелл с участием ингибитора, включающего в молекуле неполярный и полярный фрагменты (табл. 1), могли судить на основании следующих данных.
- При «пороговых» концентрациях АО изменяются оптические свойства растворов, увеличивается показатель преломления.
- Критическая концентрация мицеллообразования, оцененная методом Ребиндера, практически соответствовала «пороговым» концентрациям.
- Наблюдалась корреляция между концентрацией мицеллообразования и длиной цепи заместителя R3 у атома азота.
- Наклон концентрационных кривых на 3 участке, оцениваемый отношением прироста периодов индукции к приращению концентрации АО (инд/[InH]), прямо пропорционален R3 (рис. 5 б).
Совокупность приведенных выше данных можно объяснить, по всей вероятности, формированием в системе окисления микрогетерогенной системы.
В связи с вышеизложенным считали необходимым изучить особенности кинетики окисления липидов в водно-эмульсионной среде в присутствии додецилсульфата и соотношении вода:масло 1:3 /Паничева, Юффа, 1990/ (рис. 6 а,б). Присутствие ПАВ обеспечивало образование микрореакторов, в которых ОН-группы ингибиторов были ориентированы к ядру мицелл. В указанных условиях исследовали характер изменения инд.от концентрации исследуемых АО. Было показано, что всех ингибиторов, независимо от их строения указанные кривые однотипны: в диапазоне (2,0–4,5)x10-4 М зависимости выходят на плато, дальнейшее увеличение количества АО не приводит к росту инд. Показано, что максимальные значения инд. уменьшаются по мере роста числа углеродных атомов в цепи заместителя R3.
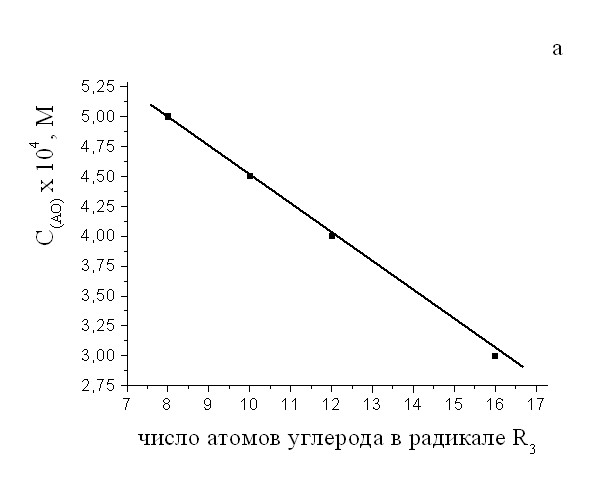

Рис.5 а) Взаимосвязь пороговой концентрации мицеллообразования и длины цепи радикала R3;
б) Взаимосвязь инд/[InH] и длины цепи заместителя R3: 1- на 3 участке концентрационной зависимости, 2 - на 1 участке концентрационной зависимости. Условия окисления приведены в подписях к рис.1.

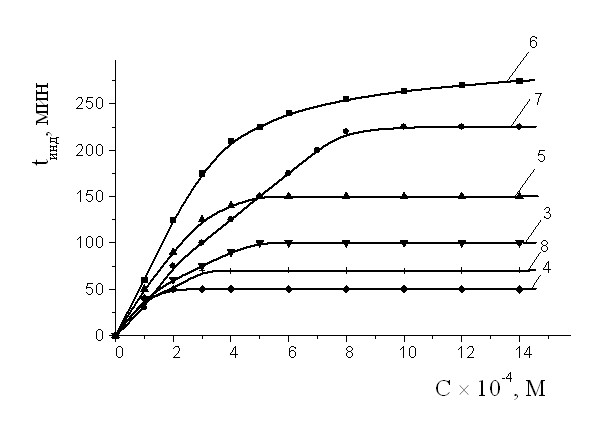 Рис.6. а) Зависимость изменения величины периодов индукции от концентрации АО при инициированном окислении МО в водно-эмульсионной среде.1 – метиловый эфир фенозана; 2 – дибунол; 3 – фенозан К; 4 – -ТФ. Условия окисления приведены в подписях к рис.1.
Рис.6. а) Зависимость изменения величины периодов индукции от концентрации АО при инициированном окислении МО в водно-эмульсионной среде.1 – метиловый эфир фенозана; 2 – дибунол; 3 – фенозан К; 4 – -ТФ. Условия окисления приведены в подписях к рис.1.
б) Зависимость изменения величины периодов индукции от концентрации АО при инициированном окислении МО в водно-эмульсионной среде. Обозначения АО на рис. соответствуют табл.1. Условия окисления приведены в подписях к рис.1
Обращает внимание, что рис. 6 б, по существу, воспроизводит 1 участок кривых рис. 4 б. Указанное соответствие обусловлено, вероятно, образованием однотипных микрогетерогенных систем. В среде окисления формируются микрореакторы, ядро которых составляют активные фенольные ОН-группы, а внешнюю обкладку – ионогенные аммониевые группы, связанные с алкильным заместителем R3. Додецилсульфат в этих условиях обеспечивает стабилизацию (солюбилизацию) системы за счет взаимодействия гидрофобных фрагментов молекул ингибитора и ПАВ. Таким образом, эффективность ингибирования липидов определяется не только антирадикальной активностью исследуемых АО (k7), возможностью разрушения ROOH, но и образованием с их участием микрогетерогенных систем.
Можно полагать, что благодаря особенностям своей структуры (наличию липофильного длинноцепочечного фрагмента, сравнимого с остатками природных высших жирных кислот, и положительно заряженного атома азота) молекулы ИХФАНОВ смогут удерживаться в бислое клеточных мембран и обеспечивать ингибирование неферментативных процессов окисления.
Глава 2. Взаимосвязь химической структуры и ингибирующего действия производных салициловой кислоты
В медицинской практике широко используются такие препараты, как салициловая кислота, парацетамол, осалмид. Свойства указанных соединений как АО до настоящего времени практически не изучались.
На основе салициловой кислоты в НИОХ им. Н.Н. Ворожцова СО РАН синтезирован ряд фенолов различной степени экранирования, являющихся амидными производными салициловой кислоты. Считали, что новые соединения потенциально способны выполнять роль АО. Нами проведено сравнительное изучение их действия с целью выявления высокоэффективных ингибиторов окисления. Считали важным выявить взаимосвязь между строением и их антиоксидантным действием.
Изучение антирадикальной активности амидных производных салициловой кислоты хемилюминесцентным методом показало, что наибольшую активность в реакции с пероксильными радикалами (RO2•) проявляет осалмид (табл.2.), аномально высокая К7 которого обусловлена наличием -р-сопряжения между амино-группой и фенолом. Анализ значений К7 исследуемых структур показывает, что удаление друг от друга амидного и ароматического фрагментов, а также введение двух о.трет. бутильных заместителей, экранирующих -ОН – группу фенола, приводит к существенному снижению К7 (табл.2.). Сравнение значений К7 изучаемых и реперных АО показывает, что антирадикальная активность осалмида и парацетамила превосходит таковую дибунола, но существенно уступает активности -ТФ. Соединения XI и XII в реакции с радикалами RO2• менее активны, чем дибунол в 2,7-2,4 раза.
При изучении брутто-ингибирующей активности, тестируемой манометрическим методом по поглощению кислорода, было выявлено, что наиболее эффективен пара-аминофенол (табл. 2). Этот феномен, по всей вероятности, обусловлен межмолекулярными взаимодействиями между амино- и гидрокси-группами, что приводит к восстановлению активной формы АО. Анализ показывает, что вне зависимости от величины К7 введение двух о.трет.бутильных заместителей приводит к увеличению брутто-ингибирующего действия. Этот факт объясняется, по всей вероятности, различиями в активности феноксильных радикалов АО разного строения.
Известно, что пространственно незатрудненные феноксилы проявляют высокую активность в побочной реакции с субстратом окисления (RH + In• R• + InH), приводящей к снижению действия АО /Бурлакова, Храпова, 1975, Бурлакова, Крашаков, Храпова, 1992, Сторожок, Гуреева, 2003/.
Для изучения роли гидрокси-, амино-и карбоксильной групп изучали в одних и тех же условиях окисления ингибирующее действие фенола, анилина, салициловой кислоты, моделирующих фрагменты структурыгибридных молекул, какими являются изучаемые нами АО. Результаты показали, что модельные соединения проявляют крайне низкую антирадикальную и брутто- ингибирующую активность (табл. 2, рис. 7 а)
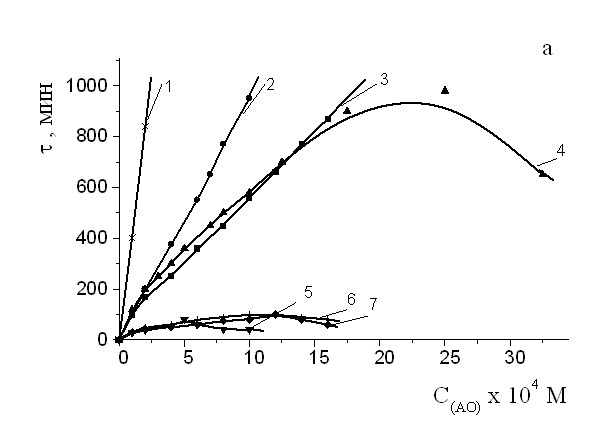
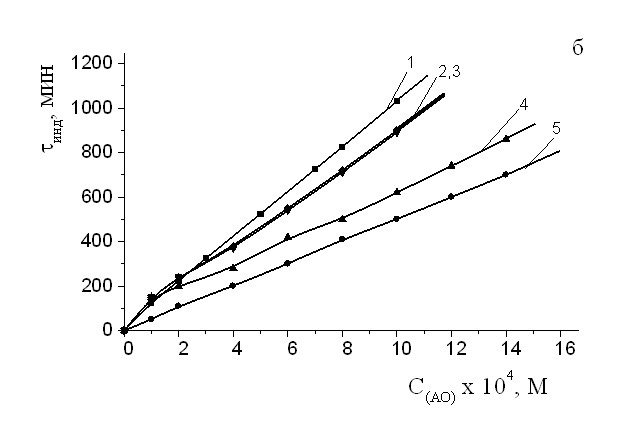 Рис. 7 а) Зависимость периодов индукции от концентрации АО: 1 - п-аминофенол; 2 – дибунол; 3 - 2,6-дифенил-4-метоксифенол; 4 - -ТФ; 5 – фенол; 6-салициловая кислота; 7- анилин. Условия окисления приведены в подписях к рис.1.
Рис. 7 а) Зависимость периодов индукции от концентрации АО: 1 - п-аминофенол; 2 – дибунол; 3 - 2,6-дифенил-4-метоксифенол; 4 - -ТФ; 5 – фенол; 6-салициловая кислота; 7- анилин. Условия окисления приведены в подписях к рис.1.
б) Зависимость периодов индукции от концентрации АО: 1 – парацетамол; 2 –амид салициловой кислоты (XII); 3 – амид салициловой кислоты (XI); 4 - амид салициловой кислоты (X); 5- осалмид. Условия окисления приведены в подписях к рис.1.
 Рис.8 Кинетика разрушения гидропероксидов при аутоокислении ЛК в присутствии равных концентраций АО: 1-контроль; 2 - амид салициловой кислоты (X); 3 - амид салициловой кислоты (XI); амид салициловой кислоты (XII); 4 – осалмид; 5 – парацетамол. Стрелкой показан вброс АО.
Рис.8 Кинетика разрушения гидропероксидов при аутоокислении ЛК в присутствии равных концентраций АО: 1-контроль; 2 - амид салициловой кислоты (X); 3 - амид салициловой кислоты (XI); амид салициловой кислоты (XII); 4 – осалмид; 5 – парацетамол. Стрелкой показан вброс АО.
С (АО)=соnst=210-4M. T=60° C
В салициловой кислоте фенольная ОН-группа не активна по причине образования внутримолекулярной водородной связи, не позволяющей фенольному гидроксилу участвовать в реакции с радикалами RO2•, ведущими процесс окисления.
Таблица 2
Кинетические параметры фенольных АО различного химического строения
| № п/п | Название АО | К710-4, М-1с-1 | инд, мин* (САО=const= 110-3, М) | АОА** (АО)- (МО) (МО) | АОА** (АО) (-ТФ) | АОА** (АО) (ДИБ) |
| XIII | Гидроксибензол | 0,24 | 40 | 0,54 | 0,07 | 0,04 |
| XIV | Аминобензол | 0,20 | 100 | 2,85 | 0,17 | 0,11 |
| XV | Салициловая кислота | 0,23 | 80 | 2,08 | 0,13 | 0,08 |
| XVI | Пара-минофенол | 10,00 | 4800 | 183,62 | 8,00 | 5,05 |
| XVII | Пара-ацетамино-фенол [парацетамол] | 4,00 | 1030 | 38,62 | 1,72 | 1,10 |
| IX | Амид 1-(N-4-гидроксифенил) салициловой кислоты (осалмид) | 6,86 | 500 | 18,23 | 0,83 | 0,55 |
| X | Амид 1-(N-4-гидроксифенил-3,3,5-тритрет. бутил)-5-этил салициловой кислоты | 1,69 | 620 | 22,85 | 1,03 | 0,65 |
| XI | Амид 1-(N-4-гидроксифенил-пропил-3,5-дитритрет.бутил)-5-этил салициловой кислоты | 0,52 | 890 | 33,23 | 1,48 | 0,95 |
| XII | Амид 1-(N-4-гидроксифенил-пропил-3,3,5-тритрет.бутил)-5-этил салициловой кислоты | 0,85 | 900 | 0,97 | 1,50 | 0,95 |
| XVIII | 2,6-дифенил-4-метоксифенол (ДФФ) | 5,14 | 560 | 20,54 | 1,07 | 0,59 |
| XX | -токоферол | 360,00 | 600 | 22,08 | - | 0,63 |
| XIX | 2,6-дитрет.бутил-4-метилфенол (дибунол) | 1,40 | 950 | 35,54 | 1,58 | - |
p 0,05 * условия окисления приведены в подписях к рис. 1
**АОА по отношению к МО, - ТФ, дибунолу
Таким образом, важным фактором, определяющим эффективность АО, является не только наличие активных групп, но и их сочетание и определенное расположение в молекуле.
При сравнении соединения IX и X, XI, XII видно, что ОН-группа в производных салициловой кислоты, не зависимо от степени ее экранирования, не вносит существенного вклада в эффективность ингибирования (периоды индукции сравнимы).
Из анализа полученных данных можно рекомендовать синтезировать соединения, у которых экранированная ОН-группа будет находиться в пара-положении к амидной группировке, что исключит образование водородной связи. Можно полагать, что направленный синтез указанных структур позволит создать новую группу потенциально эффективных АО.
При исследовании ингибирующего действия производных салициловой кислоты было установлено, что эти соединения способствуют снижению начальной и максимальной скоростей окисления. Это позволяло предположить возможность разрушения гидропероксидов с участием этих соединений, что и было подтверждено экспериментально при их введении в частично окисленный субстрат (рис. 8). Из рис. 8 видно, что все производные салициловой кислоты, не зависимо от особенностей их строения, а также парацетамол эффективно разрушали гидропероксиды и тормозили их накопление в дальнейшем.
Таким образом, механизм действия амидных производных салициловой кислоты в процессе окисления связан как с уничтожением пероксильных радикалов, так и эффективным разрушением гидропероксидов. Вероятно, что способность разрушать пероксиды обусловлена присутствием в структуре АО амидной группы.
Таким образом, в результате проведенного кинетического скрининга среди АО группы ИХФАНОВ и производных салициловой кислоты было отобрано ряд наиболее эффективных структур, несомненно, имеющих перспективны практического применения в различных областях промышленности, пищевой технологии, медицине, косметологии.
Глава 3
Кинетика сочетанного ингибирующего действия природных соединений (-токоферола, фосфолипидов) с синтетическими фенолами
Представлялось важным отыскать способы дополнительного усиления действия АО за счет подбора компонентов, способных образовать с изучаемыми ингибиторами синергические пары. Синергические композиции, широко используются в целях стабилизации окисления основ технических масел, полимеров, топлива, фармпрепаратов, пищевых, косметических средств /Азатян, 1997, Карпухина, Эмануэль, 1984, Денисов. 1997/. В качестве синергистов могут выступать ингибиторы окисления, взаимно усиливающие действие друг друга, или вещества, самостоятельно не проявляющие ингибирующей активности, но увеличивающие эффективность АО. В литературе описаны эффекты синергизма в совместном действии смесей -ТФ с фосфолипидами (ФЛ) /Ishikawa et al 1975, 1984, Сторожок, 1986, 1996/, аскорбиновой /Niki et al, 1983, Etsuo, 1984/ и другими органическими кислотами /Эмануэль, 1966/, алифатическими аминами /Achmad, 1983/, дибунолом /Пименова, 1985/.
В связи с этим исследовали совместное действие ряда ИХФАНОВ, производных салициловой кислоты в сочетании с основным природным АО – -ТФ и ФЛ. Было показано, что сочетанное действие композиции АО и -ТФ существенно выше простой суммы аддитивных эффектов компонентов. Эти данные свидетельствовали о проявлении эффектов синергизма в совместном действии исследуемых АО и -ТФ. Эффективность действия смеси () определяли как разность между значением периодов индукции () в опытах со смесями ингибиторов () и i, полученной сложением в экспериментах, где АО использовались порознь. Величину эффекта синергизма оценивали в процентах, исходя из формулы (/i), %.
Более подробно изучили характер изменения эффективности смесей от концентрации АО. Указанные закономерности представлены для группы ИФХАНОВ на рис. 9, а для производных салициловой кислоты – на рис. 10.
Можно видеть, что характер полученных экстремальных зависимостей однотипен. Можно выделить диапазоны с наиболее высокой эффективностью смесей. Из приведенных кривых видно, что дополнительное введение -ТФ приводит к (25 50) % увеличению эффективности действия ИХФАНОВ разного строения (рис. 9,10). Показано, что синергический эффект зависит от концентрации -ТФ. Так, при концентрации -ТФ 2.510-4 М эффективность смеси возрастает на 50%, а при ее увеличении до 510-4 М – на 60%.
Из приведенных данных видно, что применение синергических композиций позволяет при той же эффективности снизить концентрацию АО в 2-3 раза. Результаты работы показывают, что имеется возможность дополнительного усиления действия АО за счет создания синергических смесей. Эффекты синергизма АО могут бить использованы для стабилизации процессов окисления органических материалов самой разной природы, включая масла, топлива, пластмассы, медицинские препараты.
Применение синергических композиций позволяет также существенно снижать концентрацию синтетических АО, что особенно важно для медицины и пищевой промышленности, поскольку синтетические фенолы в относительно высоких дозах проявляют токсичность.
Механизм эффекта синергизма смесей пространственно затрудненного (экранированного) фенола и -ТФ состоит в следующем. При ингибировании окислении в системе образуются феноксилы двух видов, которые обмениваются атомами водорода с исходными фенолами. По всей вероятности, в паре ТФ - АО, последний является донором атомов Н. В результате обменной реакции происходит восстановление активной фенольной формы -ТФ, который в этих условиях может многократно обрывать цепи окисления. Кроме того, присутствие АО, способного разрушать гидропероксиды без образования свободных радикалов, исключает дополнительный путь расходование -ТФ при взаимодействии с радикалами, образующимися при их гомолитическом распаде
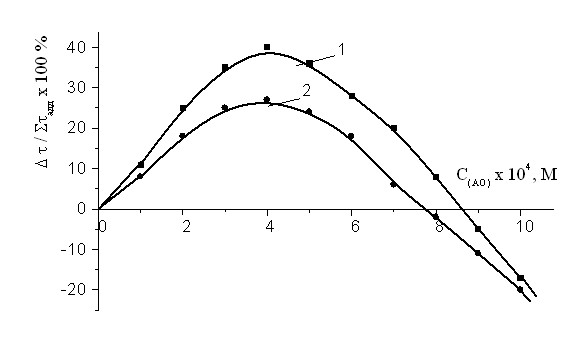 Рис 9. Зависимость эффекта синергизма в композиции -ТФ+АО от концентрации ИХФАН-10-С-16 (1) и ИХФАН-10 (2). С -ТФ = const = 2,510-4М, Wi = 4.210-8 (Мc)-1,Т=60°С.
Рис 9. Зависимость эффекта синергизма в композиции -ТФ+АО от концентрации ИХФАН-10-С-16 (1) и ИХФАН-10 (2). С -ТФ = const = 2,510-4М, Wi = 4.210-8 (Мc)-1,Т=60°С.
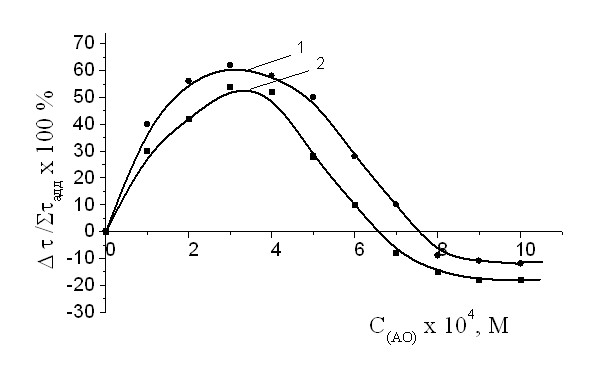 Рис 10. Зависимость эффекта синергизма в композиции -ТФ+АО от концентрации амида салициловой кислоты (XII) при постоянных концентрациях -ТФ, 510-4М (1) и 2,5 10-4М (2). Wi = 4.210-8 (Мc)-1, Т = 60°С.
Рис 10. Зависимость эффекта синергизма в композиции -ТФ+АО от концентрации амида салициловой кислоты (XII) при постоянных концентрациях -ТФ, 510-4М (1) и 2,5 10-4М (2). Wi = 4.210-8 (Мc)-1, Т = 60°С.
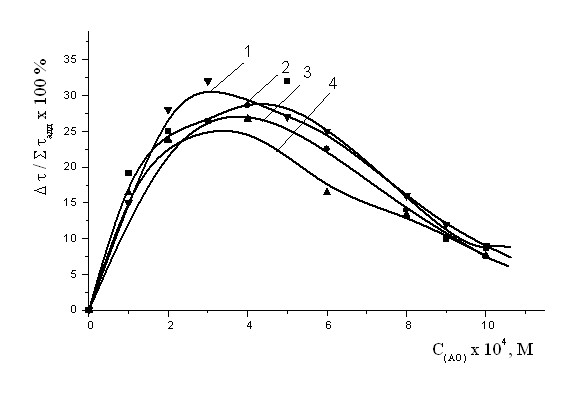 Рис. 11. Зависимость эффекта синергизма в композиции АО+ФЛ от концентрации АО: парацетамола (1); амид салициловой кислоты (XII) (2); -ТФ (3); ихфана-10 (4). Wi= 4,210-8М-1c-1.С ФЛ = const = 510-3M, Т = 60°С.
Рис. 11. Зависимость эффекта синергизма в композиции АО+ФЛ от концентрации АО: парацетамола (1); амид салициловой кислоты (XII) (2); -ТФ (3); ихфана-10 (4). Wi= 4,210-8М-1c-1.С ФЛ = const = 510-3M, Т = 60°С.
(вырожденном разветвлении процесса). Кинетическим результатом указанных процессов является усиление действия -ТФ при добавлении пространственно затрудненного фенола.
Для ряда АО (амида салициловой кислоты (XII), ИХФАНА-10, парацетамола, осалмида, дибунола и -ТФ) была изучена эффективность совместного действия с яичным фосфатидилхолином (ФХ). Действие смеси сравнивалось с АО эффектом индивидуальных составляющих. Результаты приведены на рис. 11. Показано, что для смесей указанных АО с ФЛ выполнялись соотношения, свидетельствующие о синергизме: >(АО+ФЛ), W-1 О2<(W-1 О2+W-1 О2 ФЛ). Зависимость доза-эффект представляет собой кривую с экстремумом, по характеру сравнимую с кривыми эффективности смесей изучаемых АО с -ТФ (рис. 9,10). Следовательно, при введении яичного ФХ можно получить дополнительный выигрыш в периодах индукции по сравнению с аддитивным действием составляющих смеси (до 30 %) (рис.11).
Механизм реализации эффекта синергизма обусловлен восстановлением активной фенольной формы -ТФ за счет ненасыщенных остатков высших жирных кислот, присутствующих с структуре ФЛ /Сторожок, 1996/. При этом образуются относительно малоактивные по сравнению с RO2i радикалы, не участвующие в дополнительном инициировании процесса.
Результаты настоящей работы показывают перспективность применения композиций новых, исследуемых нами АО и ФЛ для стабилизации процессов окисления. Полученные данные могут послужить в качестве методологической основы разработки новых композиций АО или ингибиторов и ФЛ, обеспечивающих длительное сохранение нативного состояния биологически активных липидов, пищевых продуктов, лекарственных средств, косметики. Новые АО и их синергические смеси могут успешно применяться для стабилизации окисления пластмасс, смазочных масел и топлив.
Таким образом, в результате настоящей работы произведен отбор высокоэффективных АО среди синтетических фенольных соединений различного строения. Изучен механизм их ингибирующего действия. Показаны пути дополнительного усиления эффективности АО в композиции с -ТФ или ФЛ.
ВЫВОДЫ
- Установлена антиоксидантная и антирадикальная активность фенольных соединений: калиевой соли (3/,5/-дитрет.бутил-4/-гидроксифенил) пропановой кислоты (фенозана К) (I), метилового эфира фенозана К (II), N,N-диметиламиноэтилового эфира -(3/,5/-дитрет.бутил-4/-гидрокси-фенил) пропановой кислоты сукцината (ИХФАН-9) (III), N,N,N-триметиламиноэтилового эфира -(3/,5/-дитрет.бутил-4/-гидроксифенил) пропановой кислоты иодида (ИХФАН-10) (IV), N,N-диметил-N-октиламиноэтилового эфира -(3/,5/-дитрет.бутил-4/-гидроксифенил) пропановой кислоты бромида (ИХФАН-10-С-8) (V), N,N-диметил-N-дециламиноэтилового эфира -(3/,5/-дитрет.бутил-4/-гидроксифенил) пропановой кислоты бромида (ИХФАН-10-С-10) (VI), N,N-диметил-N-додециламиноэтилового эфира -(3/,5/-дитрет.бутил-4/-гидроксифенил) пропановой кислоты бромида (ИХФАН-10-С-12) (VII), N,N-диметил-N-гексадециламиноэтилового эфира -(3/,5/-дитрет.бутил-4/-гидроксифенил) пропановой кислоты бромида (ИХФАН-10-С-16) (VIII), амида 1-(N-4-гидроксифенил) салициловой кислоты (осалмида) (IX), амида 1-(N-4-гидроксифенил-3,3,5-тритрет. бутил)-5-этил салициловой кислоты (X), амида 1-(N-4-гидроксифенилпропил-3,5-дитритрет.бутил)-5-этил салициловой кислоты (XI), амида 1-(N-4-гидроксифенилпропил-3,3,5-тритрет.бутил)-5-этил салициловой кислоты (XII), п-аминофенола (XVI), п-ацетаминофенола (парацетамола) (XVII). Значение константы k7 в упомянутом выше ряду производных фенозана К составляет (2,20; 2,30; 0,80; 0,60; 1,10; 1,00; 1,00; 0,94)104 М-1с-1, в ряду амидов салициловой кислоты (6,86; 1,70; 0,50; 0,85)104 М-1с-1 соответственно. Для п.-аминофенола (XVI) и парацетамола (XVII) величина k7 равна (10,0; 4,00)104 М-1с-1 соответственно. При равных концентрациях (1,010-3М) антиоксидантная активность по отношению к дибунолу в том же ряду составляет 0,97; 1,10; 1,10; 1,20; 0,40; 0,55; 0,45; 1,16; 0,55; 0,65; 0,95; 0,95; 5,05; 1,10 соответственно. Показано, что у производных салициловой кислоты введение трет.бутильных заместителей, а также разделение амидной группы и бензольного кольца приводит к снижению антирадикальной активности и увеличению брутто-ингибирующего действия ингибиторов.
- Установлена способность антиоксидантов разрушать гидропероксиды с образованием нерадикальных продуктов. Активность производных фенозана К как разрушителей гидропероксидов метилолеата падает в ряду: IV>III>VIII>VII>VI>V. Действие парацетамола (XVII) и амидов салициловой кислоты в реакции с гидропероксидами линолевой кислоты изменяется в ряду XVII>IX>XII>XI>X. Показано, что неэкранированные аминофенолы наиболее активны в реакции с гидропероксидами. Для производных салициловой кислоты удаление амидной группы от бензольного кольца увеличивает активность ингибиторов как разрушителей гидропероксидов.
- Установлено, что при окислении метилолеата в среде неполярного растворителя (хлорбензола) все ИХФАНЫ с длинноцепочечными заместителями у кватернизированного атома азота (R3=C8H17 – С16Н33) в области концентраций (3,0- 6,0)10-4 М образуют микрогетерогенные системы, в которой ОН - группа фенола ориентируется к ядру мицеллы, что приводит к снижению брутто-эффективности ингибитора по сравнению с фенозаном и его метиловым эфиром. Концентрация мицеллообразования для ингибиторов V, VI, VII, VIII cоставляет (6,0; 5,0; 4,0; 3,0)10-4 М соответственно. Свыше указанных концентраций с участием антиоксидантов формируются бислойные структуры, в которых часть фенольных ОН-групп располагается в поверхностном слое и участвует в реакции с пероксильными радикалами. Эффективность ингибиторов в этой области коррелирует с длиной цепи заместителя R3.
- Показано, что при окислении метилолеата в вводно-эмульсионной среде присутствии додецилсульфата все антиоксиданты достигают максимума своей эффективности при концентрациях 4,010-4 М, дальнейшее ее повышение не приводит к увеличению действия ингибиторов.
- Установлен эффект синергизма в сочетанном ингибирующем действии -токоферола с пространственно затрудненными фенолами: ИХФАНОМ-10 (IV), ИХФАНОМ-10-С-16 (VIII), производными салициловой кислоты X, XII. Показано, что наибольший ингибирующий эффект проявляется при соотношении -токоферола и указанных антиоксидантов в диапазоне 1:1 -1:2 и может достигать для разных ингибиторов в упомянутом выше ряду 29%, 40%, 55% и 60% соответственно. Превышение указанного соотношения за счет увеличения концентрации второго компонента приводит к снижению величины эффекта синергизма, а при соотношении выше 1:7 в совместном действии проявляется эффект антагонизма. C эффективностью антиоксидантов как разрушителей гидропероксидов.
- Показано, что в совместном действии -токоферола с неэкранированными антиоксидантами: осалмидом (IX) и п-ацетаминофенолом (XVII) проявляется эффект антагонизма. Эффект антагонизма при сочетании -токоферола с указанными ингибиторами может достигать 70-80 %.
- Показано, что производные фенозана К (ИХФАН-10) (IV), амид салициловой кислоты (Х), парацетамол (XVII), -токоферол образуют синергические смеси с яичным фосфатидилхолином. Максимальный эффект синергизма отмечается для парацетамола (XVII) – 32%, наименьший –для ИХФАНА-10 (IV)– 21%. Вне зависимости от природы ингибитора наиболее эффективны и сравнимы по своему действию композиции с соотношением между антиоксидантом и фосфолипидами равным 1:2 – 1:1.
Исследования поддержаны грантом РФФИ 02-04-49452 и грантом "Содействия интеграции высшего образования и фундаментальной науки" ("Интеграция") И 0566/1653.
СПИСОК ПУБЛИКАЦИЙ ПО ТЕМЕ ДИССЕРТАЦИИ
- Перевозкина М.Г., Бекетов Б.Н. Антиоксидантные свойства парафармацевтического препарата «Диаскэл» // В сб.: Актуальные проблемы теоретической, экспериментальной и клинической медицины. – Тюмень. – 2001. – с. 53-55.
- Перевозкина М.Г. Ингибирующая активность новых гибридных антиоксидантов // В сб.: Медицина и охрана здоровья. Тюмень. - 2001. – с.74.
- Мотов В.М., Гуреева Н.В., Перевозкина М.Г., Исследование антиоксидантной активности новых серусодержащих фенолов // В сб.: Актуальные проблемы теоретической, экспериментальной и клинической медицины. – Тюмень. – 2002. – с. 91-93.
- Гуреева Н.В., Русина И.Ф., Крысин А.П., Сторожок Н.М., Перевозкина М.Г. Антирадикальная активность фенолов различного химического строения // В сб.: Биоантиоксидант. – М. – 2002. – с. 137-139.
- Перевозкина М.Г., Бекетов Б.Н. Антиоксидантные свойства элеутерококка и аскорбиновой кислоты // // В сб.: Биоантиоксидант. – М. – 2002. – с. 453-455.
- Перевозкина М.Г., Мотов В.М., Гуреева Н.В., Сторожок Н.М. Эффекты сочетанного действия антиоксидантов мексидола и СО-4 // В сб.: Человек и лекарство. – М. - 2003. – с.666.
- Перевозкина М.Г., Гуреева Н.В., Сторожок Н.М. Антиоксидантная активность новых серусодержащих фенолов // В сб.: Современные методы исследования в медицине и фармации. Казань. – 2002. – 29-30.
- Перевозкина М.Г., Мотов В.М., Гуреева Н.В., Сторожок Н.М. Эффекты сочетанного действия антиоксидантов мексидола и СО-4 // В сб.: Медицина и охрана здоровья. Тюмень. - 2002. – с.155.
- Перевозкина М.Г., Рябов А.В., Сторожок Н.М., Русина И.Ф. Особенности ингибирующего действия производных салициловой кислоты // В сб.: XI международная конференция по химии органических и элементоорганических пероксидов. – М. – 2003. – с.64-65.
- Сторожок Н.М, Перевозкина М.Г., Никифоров Г.А.., Русина Е.Б., Бурлакова Е.Б. Взаимосвязь строения и ингибирующего действия производных фенозана // В сб.: XI международная конференция по химии органических и элементоорганических пероксидов. – М. – 2003. – с. 66-67.
- Сторожок Н.М, Перевозкина М.Г., Никифоров Г.А., Русина И.Ф. Особенности ингибирующего действия антиоксидантов группы ИХФАНОВ // В сб.: Биоантиоксидант. Научный вестник мед. акад.- Тюмень. - 2003.- с 52-59.
- Рябов А.В., Мотов В.М., Перевозкина М.Г., Гуреева Н.В., Крысин А.П., Сторожок Н.М. Сравнительная характеристика известных ингибиторов окисления и новых антиоксидантов – производных салициловой кислоты // В сб.: Биоантиоксидант. Научный вестник мед. акад.- Тюмень. - 2003.- с 77-80.

