Окисление воды морскими водорослями и функциональными химическими моделями на основе кластеров m n iv и c o iii
На правах рукописи
Куркина Галина Александровна
Окисление воды морскими водорослями и функциональными химическими моделями на основе кластеров MnIV и CoIII
02.00.04 – физическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Черноголовка – 2008
Работа выполнена в Институте проблем химической физики РАН
Научный руководитель:
доктор химических наук
Джабиев Таймураз Савельевич
Официальные оппоненты:
доктор биологических наук
Мамедов Махир Джафар оглы
ведущий научный сотрудник отдела биоэнергетики
НИИ физико-химической биологии им А.Н. Белозерского
МГУ им. М.В. Ломоносова
г. Москва
кандидат физико-математических наук
Симбирцева Галина Владимировна
Филиал института энергетических проблем химической физики РАН
г. Черноголовка
Ведущая организация:
Центр Фотохимии РАН
г. Москва
Защита состоится «___»_____________2008 г. в ___ ч на заседании Диссертационного Совета Д 002.082.02 при Институте проблем химической физики РАН по адресу: 142432, Московская обл., г. Черноголовка, пр-т академика Н.Н. Семенова, 1, корпус общего назначения Института проблем химической физики РАН.
С диссертацией можно ознакомиться в библиотеке ИПХФ РАН.
Автореферат разослан «___»____________2008 г.
Ученый секретарь
диссертационного совета Д 002.082.02,
доктор химических наук Т.С.Джабиев
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Жизнь на Земле полностью зависит от солнечной энергии. Это основной и практически неиссякаемый источник энергии на поверхности Земли. Около 50% радиации, которая достигает поверхности Земли (видимая область солнечного излучения), может быть использована фотосинтезирующими организмами для синтеза органических веществ из неорганических материалов CO2 и H2O. Этот процесс можно представить следующей схемой:
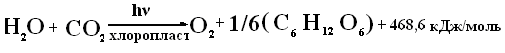
Большим вкладом в решение энергетических проблем будущего может оказаться создание эффективных преобразователей солнечной энергии в потенциальную энергию экологически чистого топлива. Для создания таких преобразователей, для осуществления “искусственного фотосинтеза“, необходимо знать в деталях механизм действия природного фотосинтеза.
Целью настоящей диссертационной работы было изучение функциональных химических моделей марганцевого кофактора оксидазы фотосистемы II природного фотосинтеза, окисляющей воду до кислорода в фотосистеме II природного фотосинтеза, на основе кластеров переходных металлов кобальта(III) и марганца (IV), а также поиск природных фотосинтезирующих организмов, способных окислять воду до озона.
Основным вкладом данной диссертационной работы в науку являются изучение многоэлектронных процессов, в результате которых в координационных сферах полиядерных кластеров CoIIIn, где n меняется от 4 до 24 и более, окисляются несколько молекул воды и образуются в этом коллективном процессе до шести молекул кислорода. Кроме того, изучены некоторые аспекты окисления воды кластерами Mn (IV) в сернокислых растворах.
Другим основным вкладом является открытие реакции шестиэлектронного окисления воды до озона в хлоропластах бурых (Cystoseira barbata) и красных (Callithamnion corymbosum) морских водорослях в процессе фотосинтеза. Реакция шестиэлектронного окисления воды до озона бурыми морскими водорослями ранее не была известна.
Актуальность темы.
Изучение механизма действия природного фотосинтеза является актуальной темой не только из-за важности этого процесса для поддержания жизни на Земле, но и для подготовки к осуществлению “искусственного фотосинтеза” вне клетки. В этой связи весьма актуально исследование функциональных химических моделей марганцевого кофактора оксидазы фотосистемы II фотосинтеза на основе кластеров MnIV и CoIII. На решение этой актуальной темы и направлена настоящая диссертационная работа.
Цель работы.
Целью диссертационной работы было уточнение механизма окисления воды до кислорода и выяснение возможности окисления воды до озона в функциональной химической модели марганцевого кофактора оксидазы фотосистемы II природного фотосинтеза – в сернокислых растворах MnIV, а также природных фотосинтезирующих организмах. Кроме того, необходимо было изучить кинетику и механизм окисления воды кластерами кобальта(III) перспективного катализатора окислительной части фотокаталитического преобразователя солнечной энергии в химическую энергию.
Задачи исследования. Для достижения указанной цели были поставлены следующие задачи:
- Изучение кинетики термо- и фотостимулированного окисления воды в функциональной химической модели Mn – co (сернокислые растворы сульфата марганца (IV).
- Количественное исследование кинетики образования озона в изученных системах.
- Поиск биологических объектов, способных окислять воду до озона.
- Изучение кинетики и механизма окисления воды соединениями CoIII до кислорода.
Научная новизна. Изучено неизвестное ранее явление – шестиэлектронное окисление воды до озона хлоропластами красных (Callithamnion corymbosum) и бурых (Сystoseira barbata) морских водорослей. Изучены кинетика и механизм окисления воды кластерами CoIII и MnIV в кислых средах.
Практическая ценность. Установлены новые механизмы многоэлектронного окисления воды до кислорода, которые могут служить теоретической базой для подбора эффективных катализаторов окисления воды в фотокаталитических преобразователях световой энергии, представляющих практическую ценность для проблемы утилизации солнечной энергии. Другой практической ценностью можно считать выделение O3 бурыми (Сystoseira barbata) и красными (Callithamnion corymbosum) морскими водорослями. Многие водоросли используются для биоочистки сточных вод. Теперь становится ясным, что это связано, скорее всего, с фотогенерированием ими озона.
Апробация работы. Результаты диссертационной работы обсуждались на следующих Всероссийских и международных конференциях и симпозиумах:
XVII Симпозиум «Современная химическая физика» (Туапсе, 2005), XXIV Всероссийская школа – симпозиум молодых ученых по химической кинетике (Московская область, пансионат “Березки”, 2006), XVШ Симпозиум «Современная химическая физика» (Туапсе, 2006), XXV Всероссийская школа – симпозиум молодых ученых по химической кинетике (Московская область, пансионат «Юность», 2007), Международная междисциплинарная научная конференция «Синергетика в естественных науках», г. Тверь, 2007, Voevodsky Conference “Physics and chemistry of elementary chemical processes” Chernogolovka, Moscow Region, Russia, 2007, Всероссийский Симпозиум "Нанофотоника", г. Черноголовка, 2007, VII Международнуя молодежнуя конференция ИБХФ РАН-ВУЗы "Биохимическая физика" Москва, 2007 г.
Публикации. Результаты диссертации представлены в 3 статьях и 9 тезисах докладов.
Положения, выносимые на защиту:
- Многоэлектронное окисление воды в химической функциональной модели марганцевого кофактора (4Mn-co) оксидазы фотосистемы II природного фотосинтеза.
- Шестиэлектронное окисление воды до озона красными и бурыми морскими водорослями.
- Кинетика и механизм окисления воды соединениями СоIII в хлорнокислых растворах.
Структура и объем диссертации. Диссертация состоит из введения, обзора литературы (глава 1), экспериментальной части (глава 2), обсуждения результатов исследования (главы 3-4), выводов и списка литературы. Работа изложена на 113 страницах машинописного текста, иллюстрирована 40 рисунками. Библиография включает 153 наименования.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснована актуальность исследования, сформулированы цели работы, ее научная новизна и практическая значимость.
Глава 1. Обзор литературы.
В литературном обзоре рассмотрены процессы окисления воды в природном фотосинтезе и в химических функциональных модельных системах на основе ионов переходных металлов.
Глава 2. Экспериментальная часть.
В работе использовали дистиллированную воду, хлорную кислоту марки х.ч. фирмы Aldrich и высокоочищенный трифторид кобальта CoF3 фирмы Aldrich.
Для работы применяли серную кислоту марки «о.с.ч.», перманганат калия (KMnO4 «ч.д.а.»). Для приготовления растворов реагентов использовали дистиллированную воду. Растворы Mn(IV) получали восстановлением Mn(VII) в 12 М и 9,5 М H2SO4 в течение 10 часов при комнатной температуре по следующим самопроизвольным реакциям:
4 Mn(VII) + 6 H2O 4 Mn(IV) + 3O2 + 12H+
2 Mn(VII) + 3 H2O 2 Mn(IV) + O3 + 6H+.
Регистрацию спектров проводили на приборе “Specord М 40”. Для экспериментов использовались кварцевые термостатируемые кюветы с различной толщиной оптического слоя. Температура внутри кюветы поддерживалась с точностью до ±0,20С. Набор кювет с длиной оптического пути от 0,073 до 3,0 см позволил варьировать концентрации реагентов в широких пределах. Для количественного определения озона использовали нейтральный раствор йодида калия.
Кинетику газообразования изучали волюмометрическим методом.
Для описания коллективных внутрикластерных процессов использовали фазовые траектории различных процессов.
Глава 3. Окисление воды сульфатом Mn(IV) в растворах серной
кислоты. Многоэлектронное окисление воды красными и бурыми морскими водорослями.
§ 1. Многоэлектронное термостимулированное окисление воды кластерами Mn(IV).
Из литературы известно, что при низких концентрациях MnIV (меньше 3 ммоль/л) и высоких температурах (85 – 1000С) окисление воды в сернокислых средах происходит в координационной сфере биядерного комплекса:
MnIV22H2O 2MnII + O2 + 4H+.
В этом случае каждый ион MnIV выступает в качестве двухэлектронного окислителя (переход MnIV MnII), а сам биядерный комплекс является четырехэлектронным окислителем. Образующиеся в реакции соединения MnII быстро окисляются марганцем (IV) до MnIII, поскольку наличие двух изосбестических точек при 510 и 650 нм указывает на отсутствие в реакционной смеси заметных количеств иных соединений марганца, кроме MnIV и MnIII. Ясно, что биядерный комплекс MnIV2, являющийся четырехэлектронным окислителем, не способен генерировать озон – продукт шестиэлектронного окисления воды. Чтобы получить озон, необходимо использовать более высокие концентрации MnIV, когда становится возможным образование более крупных кластеров марганца, чем биядерный комплекс MnIV2.
 |
| Рис. 1. Изменение спектра поглощения реакционной смеси при термостимулированном восстановлении Mn(IV) Mn(III) в 12 М серной кислоте. Температура процесса 930С, [Mn(IV)] = 0,01 моль/л. Время реакции: 1 – 3 мин; 2 – 7 мин; 3 – 17 мин; 4 – 24 мин; 5 – 56 мин. |
При окислении воды кластерами марганца (IV) по мере увеличения числа активируемых молекул субстрата в координационной сфере кластера наблюдаемая энергия активации обычно снижается. Однако энергия активации, определяемая из скорости брутто-процесса, не может быть приписана определенному элементарному процессу, так как в этих системах процесс идет, как правило, по двум (или более) маршрутам. Для получения более надежных значений Еа следует провести процесс в условиях, когда скорость реакции преимущественно обусловлена кластерами определенного состава с исключением вклада от параллельного маршрута.
 а а | 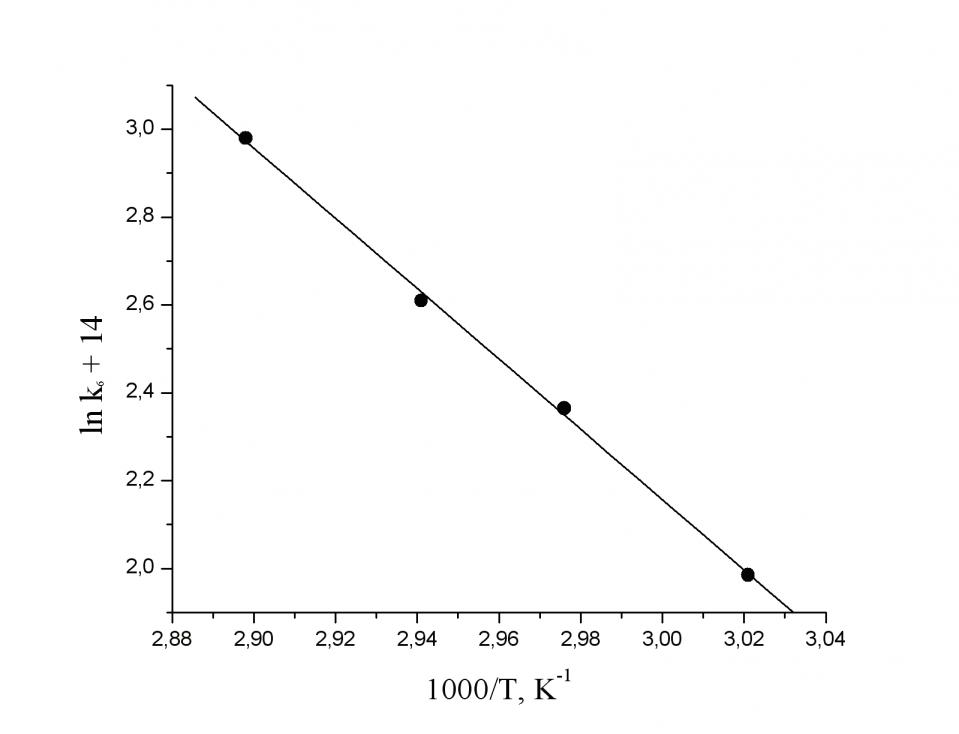 б б |
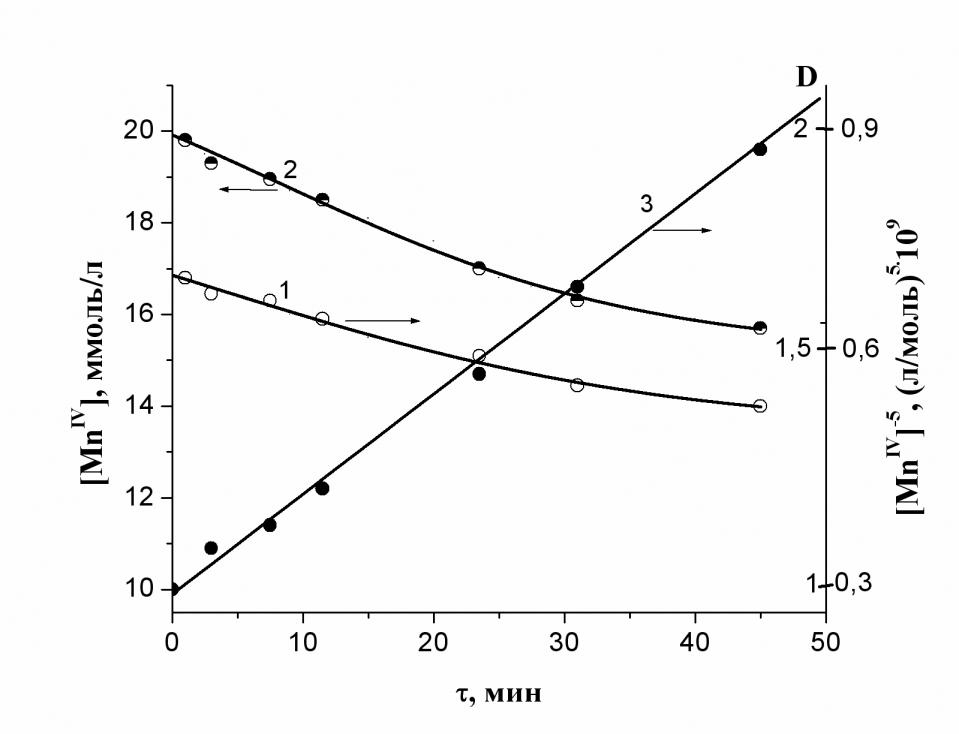
| Рис. 2а. Кинетика расходования Mn (IV) (2) в процессе окисления воды при температуре 63 оС. Кривая 1 представляет собой изменение оптической плотности D реакционной смеси на длине волны = 417 нм. | б. Температурная зависимость константы скорости реакции восстановления кластера MnIV12 в координатах Аррениуса. |
На рис. 2а показана кинетическая кривая восстановления соединений Mn (IV) (кривая 2) и ее линейная анаморфоза (кривая 3) в координатах {[C]-5, }. Хорошая «линеаризация» кинетической кривой показывает, что в условиях опыта основной вклад в процесс вносят гексамерные кластеры Ох6, содержащие по двенадцать ионов Mn (IV), поскольку кинетически независимым окислителем в этих системах является «мономер» Ох, представляющий собой биядерный комплекс MnIV2.
В относительно узком температурном интервале (от 60 до 720С) определили энергию активации процесса синергетического окисления 12 молекул воды до 4 молекул озона в координационной сфере кластера MnIV12 по константам скорости реакции (рис. 2б). Полученная при этом энергия активации Е6 = 68 кДж/моль оказалось ниже, чем при окислении воды до кислорода в координационной сфере биядерного комплекса MnIV2 Еа = 102,5 кДж/моль. Правда, предэкспоненциальный множитель (k0 = 5·107 c-1) оказывается при этом значительно меньше обычного значения ~ 1013 с-1.
Осуществление этого же процесса при более высоких температурах (от 78 до 900С) показывает, что в этом случае основной вклад в реакцию вносят кластеры Ох3 (т.е. MnIV6) с небольшим вкладом второго маршрута, описываемого экспоненциальной кинетической кривой и обусловленного, вероятнее всего, восстановлением кластеров Ох6, присутствующих в незначительном количестве в реакционной смеси при повышенных температурах (78-900 С). Выделив вклад в скорость процесса, обусловленный кластерами MnIV6, мы определили константы скорости реакции этих кластеров при различных температурах. По этим данным получена энергия активации окисления 6 молекул воды до двух молекул озона в координационной сфере гексаядерных кластеров марганца (IV). Оказалось, что в этом случае энергия активации Е3 = 98,2 кДж/моль мало отличается от Еа = 102,5 кДж/моль для реакции окисления воды до кислорода биядерными комплексами MnIV2. При этом предэкспоненциальный множитель k0 оказывается близким к нормальному для мономолекулярных реакций распада кластеров на продукты (~ 1013 с-1).
Таким образом, энергия активации многосубстратного внутрикластерного концертного процесса может значительно уменьшиться при увеличении числа активируемых субстратов. Следует отметить, что степень агрегации реакционноспособных кластеров сильно зависит не только от концентрации реагента и температуры процесса, но и от кислотности среды. Так, при переходе от растворов в 9,5 М серной кислоте к 12 молярной серной кислоте при этих же температурах и концентрациях реагентов вместо кластеров Ох6 и Ох3 основными реакционноспособными кластерами оказываются соответственно Ох4 и Ох2, т.е. комплексы MnIV8 и MnIV4. Но эти кластеры окисляют воду до кислорода, а не до озона.
§ 2. Фотостимулированное окисление воды комплексами Mn(IV) в 9,5 М H2SO4.
Сернокислые растворы Mn(IV) способны окислять воду как при нагревании, так и при освещении их светом при комнатной температуре.
На рис. 3а показано фотостимулированное восстановление MnIV MnIII при малых концентрациях соединений марганца (IV). Линейная анаморфоза кинетической кривой спрямляется в координатах {[MnIV]-3, }, это говорит о том, что реакция окисления воды имитирует реакцию четвертого порядка. Состав реакционноспособного кластера Охn легко определить из фазовой траектории, построенной по кинетической кривой рис. 3а. Полученная фазовая траектория показана на рис. 3б. Первая производная безразмерной скорости процесса w/w0 по степени превращения (1- х) в самом начале реакции равна четырем, что прямо указывает на состав реакционноспособного кластера Ох4, содержащего 8 ионов MnIV, поскольку кинетически независимым окислителем в этих системах является «мономер» Ох, представляющий собой биядерный комплекс MnIV2.
 а а | 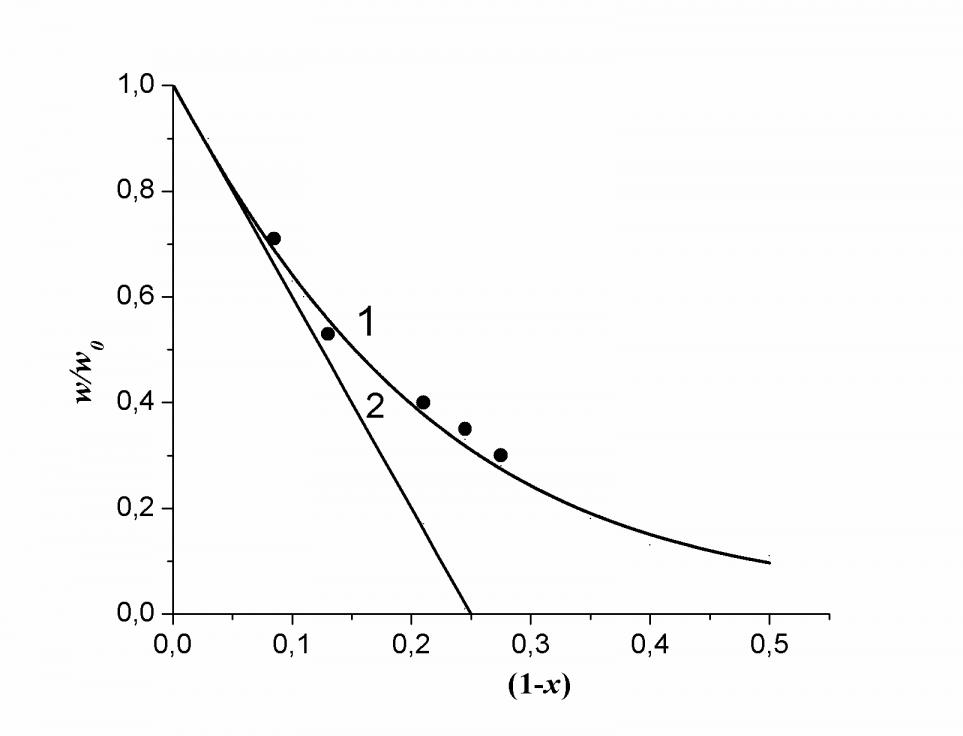 б б |
| Рис. 3а Фотостимулированное восстановление MnIV при комнатной температуре (1) и анаморфоза кинетической кривой 1 в координатах {[MnIV]-3, } (2). | б. Фазовая траектория фотостимулированного процесса восстановления MnIV водой, построенная по кинетической кривой 1рис. 3а. |
Известно, что в координационных сферах кластеров Охn при n > 2 продуктами окисления воды могут оказаться молекулы озона. Интересно было изучить возможность фотостимулированного образования озона в результате шестиэлектронного окисления воды в координационной сфере марганцевого кластера. Оказалось, что фотостимулированное окисление воды до озона в координационных сферах марганцевых кластеров Охn с n > 2 действительно наблюдается (рис. 4). Кроме того, была изучена кинетика образования озона при шестиэлектронном окислении воды кластерами Oxn при освещении реакционной смеси квантами света различной длины волны спектра излучения лампы ДРШ - 1000 с использованием стеклянных светофильтров (стекло оптическое цветное ГОСТ 9411-75).
Фотостимулированное окисление воды до озона представляет большой интерес, поскольку такая реакция наблюдается при облучении видимым светом красных и бурых морских водорослей, попавших в экстремальные условия.
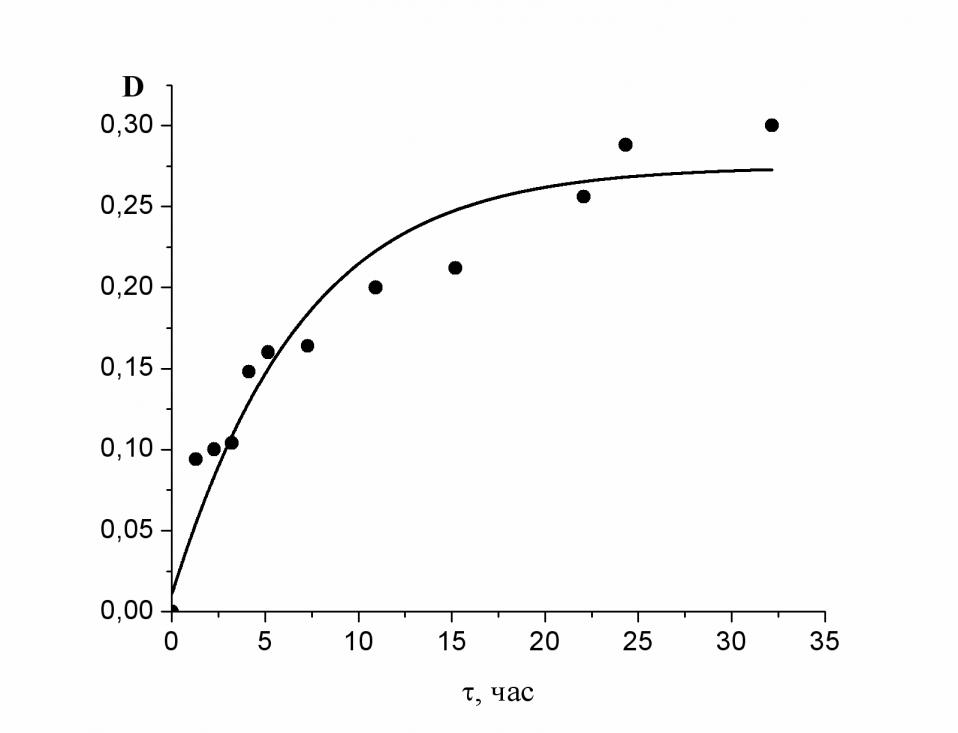 |
| Рис. 4. Кинетика фотоиндуцированного образования озона при комнатной температуре. Использовали свет лампы ДРШ - 1000 со светофильтром ПС 15. |
§ 3. Многоэлектронное фотосинтетическое окисление воды
красными и бурыми морскими водорослями.
Ранее в нашей группе, было показано, что красные морские водоросли (Phyllophora nervosa и Polysiphonia elongate) способны выделять озон под действием видимого света. Перед нами стояла задача поиска других фотосинтезирующих организмов, которые могут окислять воду до озона.
а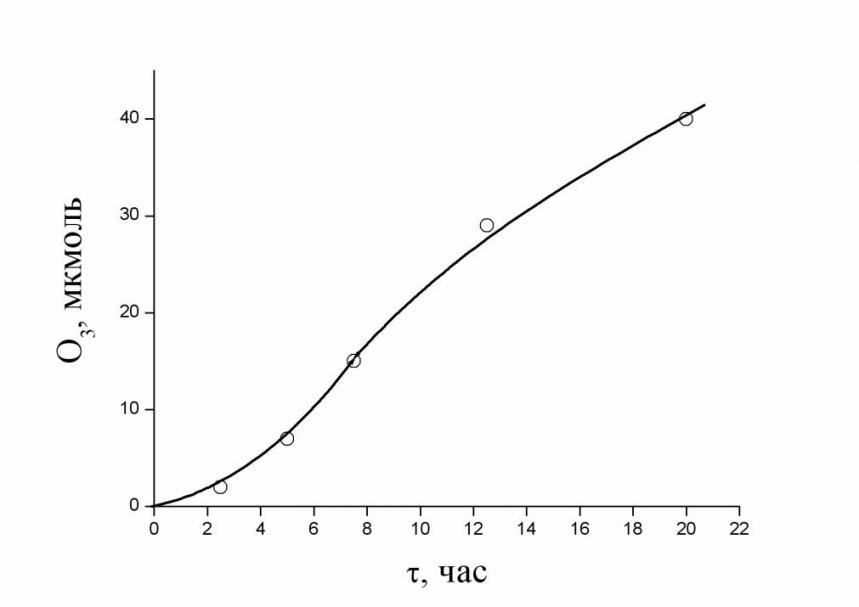 | 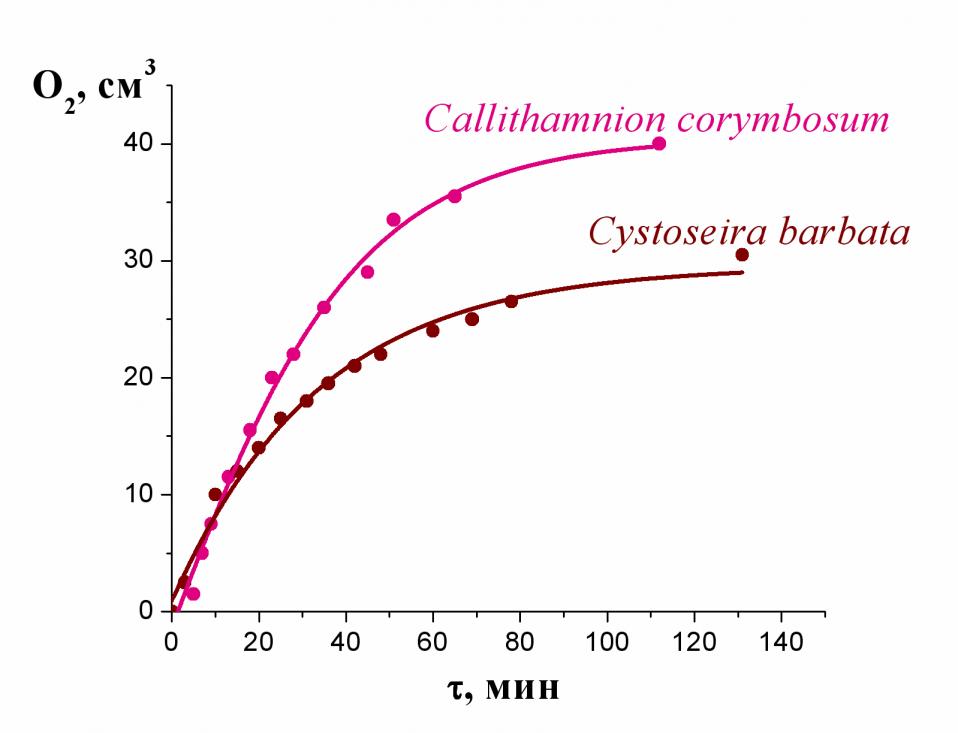 б б |
| Рис.5а. Кинетика выделения озона при фотосинтезе в хлоропластах красных морских водорослей Callithamnion corymbosum. | б. Образование кислорода при освещении видимым светом красных и бурых морских водорослей. |
Для этого в стеклянную трубку длиной 36 и диаметром 2.5 см загружали увлажненные морской водой красные (Callithamnion corymbosum) или бурые (Cystoseira barbata) водоросли, которые были собраны на северо-восточном побережье Черного моря (в районе г. Туапсе). Трубчатый реактор продувался чистым сухим аргоном со скоростью 0.2 л/мин, газовый поток на выходе проходил через водный раствор йодида калия для количественного определения озона. При облучении красных морских водорослей двумя лампами накаливания по 150 ватт каждая раствор йодида калия в кювете желтел в результате окисления йодида озоном. Количество образующегося йода (в форме I3) определяли спектрофотометрическим методом на приборе Specord M 40 по калибровочной кривой. Типичная кинетическая кривая образования озона при облучении видимым светом красных водорослей Callithamnion corymbosum приведена на рис. 5а. В случае Cystoseira barbata получается аналогичная кинетическая кривая образования озона, хотя индукционный период в этом случае слишком велик (более 20 часов). По мере старения водорослей их фотосинтетическая активность снижается.
На начальных стадиях фотостимулированной реакции образования озона красными морскими водорослями наблюдается относительно небольшой индукционный период (рис. 5а), связанный с приведением водорослей в экстремальные условия (дефицит воды из-за продувки реактора потоком сухого аргона). Заметное снижение скорости генерирования озона со временем (рис. 5а) связано, по-видимому, с дальнейшим обезвоживанием хлоропластов водорослей.
Такое же снижение скорости в ходе реакции наблюдается при фотосинтетическом образовании кислорода (рис. 5б). В этом случае дезактивация процесса обусловлена выдуванием СО2, который необходим для фотогенерирования О2 (судя по литературным данным, СО2 играет роль структурирующего фактора в Mn-co). В отличие от озона, молекулы кислорода образуются в присутствии достаточно больших количеств воды, и начального индукционного периода не наблюдается (рис. 5б). Следует отметить, что в обоих случаях, т.е. как в красных, так и в бурых морских водорослях скорость образования озона приблизительно в 105 раз меньше, чем скорость образования кислорода при фотосинтезе этих же водорослей.
Образование небольших количеств озона в природе объясняется в литературе процессами окисления биомассы. Объяснение это следует признать ошибочным, поскольку по нашим данным озон генерируется лишь при облучении водорослей светом. В темновых условиях озон не образуется. Мы полагаем, что в природных объектах озон формируется так же, как в модельной химической системе, т.е. при шестиэлектронном окислении воды в координационной сфере кластера MnIV6, содержащего шесть ионов марганца. Марганцевый кофактор в окисляющем воду активном центре ФС II хлоропластов, в координационной сфере которого формируется молекула кислорода, в настоящее время представляется состоящим из четырех ионов Mn и одного иона Ca2+ (марганцевый кофактор 4Mn-co). Мы считаем, что при облучении видимым светом морских водорослей озон образуется в координационной сфере другого марганцевого кофактора – 6Mn-co, который содержит 6 ионов MnIV. Малая скорость генерирования озона водорослями по сравнению со скоростью выделения кислорода связана, по нашему мнению, с ничтожным содержанием 6Mn-co в обезвоженных хлоропластах водорослей по сравнению с 4Mn-co в нормальных условиях. В зеленых листьях высших растений при обезвоживании образуется, вероятно, ещё меньше гексаядерных кофакторов 6Mn-co, поскольку нет никаких сведений о возможном образовании хотя бы следов озона при фотосинтезе с их участием. Мы испытали зеленые листья 12 видов высших растений Подмосковья, и ни в одном случае не обнаружили образования озона при фотосинтезе.
Анализ продуктов окисления воды красными морскими водорослями на присутствие в газовой фазе H2O2 дал отрицательный результат. Следовательно, если даже в хлоропластах при облучении и образуется H2O2, как считают некоторые исследователи, он полностью разлагается на H2O и O2.
Таким образом, в красных и бурых морских водорослях, как и в функциональной химической модели на основе кластеров MnIV, существуют, по-видимому, два типа марганцевых кофакторов (хорошо известный тетраядерный 4Mn-co (рис.6а, и гексаядерный 6Mn-co (рис.6б)), что позволяет окислять воду в ФС II хлоропластов морских водорослей как четырехэлектронно до молекулы кислорода, так и шестиэлектронно до молекулы озона.
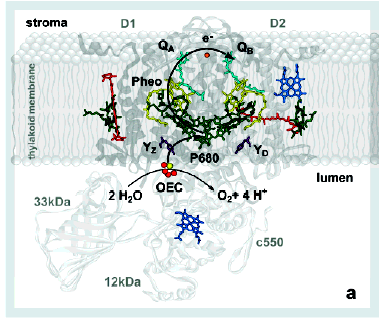 | 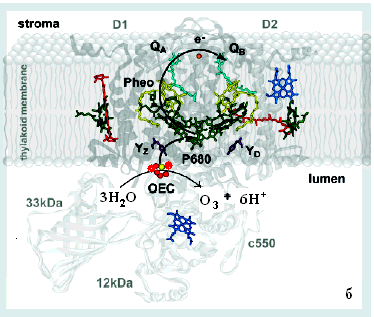 |
| Рис. 6. Локализация активного центра 6Mn-co, предложенного нами (б). | с 4Mn-co в тилакоидной мембране (а) и с |
Глава 4. Концертное окисление воды кластерами кобальта (III).
Реакция окисления воды соединениями CoIII в кислых растворах изучается уже более 100 лет, однако полной ясности о механизме этого процесса до сих пор нет. Почти все исследователи в XX веке предполагали в ходе реакции образование ОН – радикалов: Co3+ + H2O = Co2+ + H+ + OH, что просто невероятно. Как видно из значения стандартных редокс-потенциалов пар Co3+/Co2+ (Eo = 1,82 B) и ОН/Н2О (Eo = 2,85 B) образование ОН радикала термодинамически запрещено. Только в двух работах предполагали трехэлектронное окисление воды до НО2 – радикала, однако и эти представления включают в себя как внутренние противоречия, так и несогласованность с другими данными. Одним из важных достижений в изучении реакции окисления воды соединениями СоШ является выражение скорости расходования окислителя в виде бинома, включающего линейную и параболическую зависимости скорости от концентрации окислителя: -d[CoIII] / dt = k1[CoIII] + k2[CoIII]2. Мы установили, что в этом биноме в зависимости от условий проведения опытов второй член бинома в выражении скорости может иметь показатель степени больше двойки, вплоть до n = 6.
Изучение кинетики окисления воды в хлорнокислых растворах соединений CoIII привело нас к выводу, что этот процесс осуществляется в координационных сферах полиядерных кластеров CoIII4n, где n = 1 6, с участием одновременно нескольких молекул воды в коллективном процессе.
Английские и израильские исследователи ранее безуспешно пытались описать изучаемую реакцию одним стехиометрическим уравнением. Однако, опыт показывает, что практически во всех случаях вода окисляется по двум параллельным маршрутам. На рис. 7а представлена кинетика реакции восстановления CoF3 в 1,7 молярном водном растворе HClO4, измеренная спектрофотометрически при температуре 12 оС (кривая 1). Кинетическая кривая 1 представляет собой сумму двух кинетических кривых: кривой 2, описывающей один из каналов восстановления CoIII в составе полиядерного кластера Охn, и разности кривых 1 и 2, которая описывает кинетику экспоненциального расходования окислителя Ох, и вкладом которой в суммарный процесс после четвертой минуты можно пренебречь. Для наглядности кинетическая кривая первого (экспоненциального) канала изображена отдельно кривой 3. Кривая 2 получена следующим образом. При t > 5 мин кинетическая кривая расходования окислителя Ох хорошо описывается законом кинетики реакции IV порядка по [Ox] (см. линейную анаморфозу 4). Экстраполяция этой кинетической кривой к началу реакции дает нам полную кривую 2 расходования окислителя по этому закону (по IV порядку). Разницу между кривой 2 и наблюдаемой в опыте кривой 1 (кривая 3) мы приписываем параллельному маршруту расходования окислителя (экспонента 3). Что касается второго маршрута, то это концертное окисление 8 молекул Н2О до четырех молекул кислорода в координационной сфере кластера Ох4, т.е. СоIII16 (см. ниже).
Экспоненциальная кинетика (кривая 3) восстановления Co(III) по первому каналу связана, по-видимому, с четырехэлектронным процессом окисления двух молекул воды до молекулы О2 в координационной сфере другого кластера Oxn, где n > 4 (по нашим данным, Ox представляет собой кластер CoIII4, а не биядерный комплекс (Co-O-Co)4+, как предполагалось нашими предшественниками ранее): (Н2О)2CoIII4n = (CoIII4n)-4 + О2 + 4Н+. В пользу такого объяснения говорит образование в элементарном акте внутрикластерного процесса по первому маршруту всего одной молекулы кислорода (число образующихся молекул О2 определили с помощью фазовой траектории, которая была построена по кинетической кривой накопления О2 по этому каналу).
Реакция окисления воды по второму каналу (кинетическая кривая 2) имитирует закон реакции четвертого порядка, и спрямляется в координатах {[CoIII]-3, }, (линейная анаморфоза 4 на рис.7а). Состав реакционноспособного кластера Охn второго канала легко определить из фазовой траектории, построенной по кинетической кривой 2 на рис.7а.
 а а | 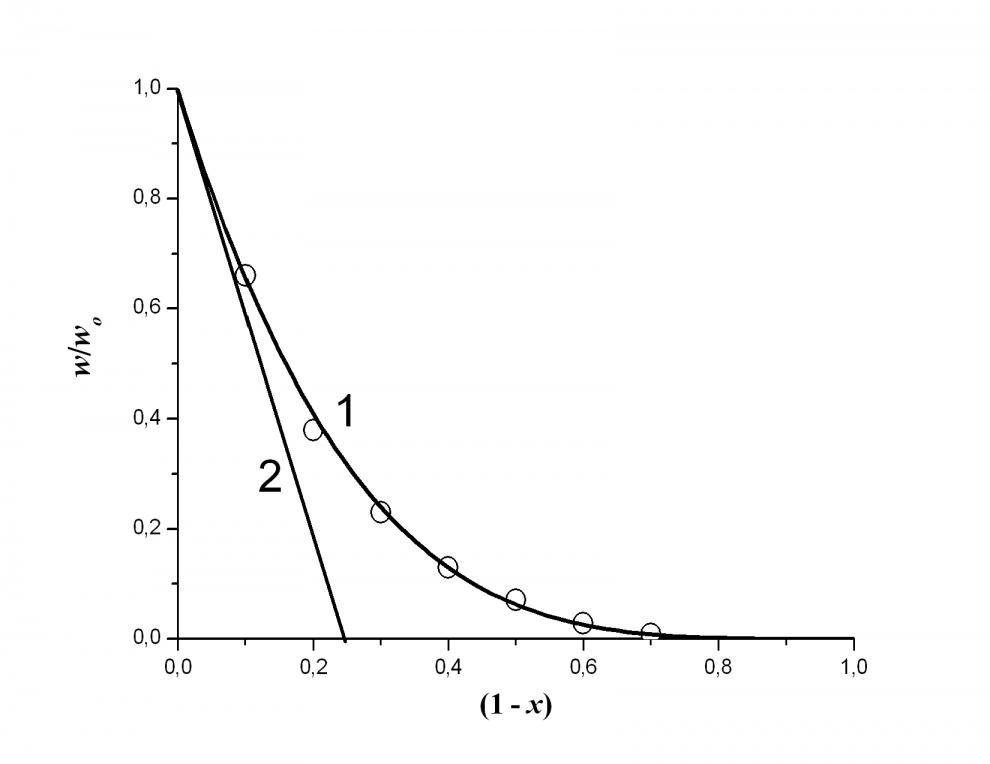 б б |
| Рис. 7а Кинетика восстановления соединений CoIII по двум параллельным реакциям (1), одна из которых (кривая 1 минус кривая 2) является реакцией первого порядка по концентрации окислителя Ох (кривая 3). Условия: [CoIII] = 0.004 моль/л, [HClO4] = 1.7 моль/л, Т =12 оС | б. Фазовая траектория процесса восстановления соединений CoIII водой, построенная по кинетической кривой 2 рисунка 7а. |
Полученная фазовая траектория показана на рис. 7б. Первая производная безразмерной скорости процесса w/wo по степени превращения (1 – х) в самом начале реакции (прямая 2) равна четырем, что прямо указывает на состав реакционноспособного кластера Ох4, собранного из 4 кинетически независимых окислителей Oх (т.е. из четырех тетраядерных кластеров CoIII4). На рис. 7б по оси абсцисс отложена степень превращения окислителя (1 – х), где х = [CoIII] / ([CoIII] + [CoII]) – мольная доля CoIII в растворе, содержащем только CoIII и CoII. Таким образом, этот процесс (второй маршрут реакции) описывается уравнением: (Н2О)8СоIII16 = 4СоII4 + 4O2 +16H+. В этой реакции кластером CoIII16 одновременно активируются 8 молекул Н2О, (синергетический процесс).
В зависимости от условий проведения опытов можно наблюдать различные комбинации двух каналов формирования кислорода: (Ох, Ох2) О2 + 2О2, (Ох, Ох3) О2 + 3О2, (Ох, Ох4) О2 + 4О2, (Ох2, Ох4) 2О2 + 4О2. Здесь в скобках указаны типы кластеров, которые окисляют воду по I и II маршрутам. Справа приведены количества кислорода, образующиеся в суммарном процессе по этим двум маршрутам.
Как правило, процесс окисления воды осуществляется по двум каналам, хотя в некоторых случаях один из каналов может значительно превосходить другой по активности. Такой пример приведен на рис. 8а. Здесь показана кинетика накопления кислорода при окислении воды в 5,5 мл 0,145 молярного CoF3 в растворе 4,26 молярной HClO4 при температуре 43 оС. Максимально возможный выход O2 в этом опыте при полном восстановлении CoIII в CoII составляет 5 мл. Из фазовой траектории (кривая 1 на рис. 8б), построенной по кинетической кривой образования О2 (рис. 8а), следует, что в этих условиях реакционноспособный кластер представляет собой Ох3 (первая производная фазовой траектории в начале процесса равна 3, прямая 2 на рис. 8б), и первым маршрутом реакции можно полностью пренебречь. В целом процесс описывается полностью вторым маршрутом: (Н2О)6СоIII12 = 3СоII4 + 3О2 + 12Н+.
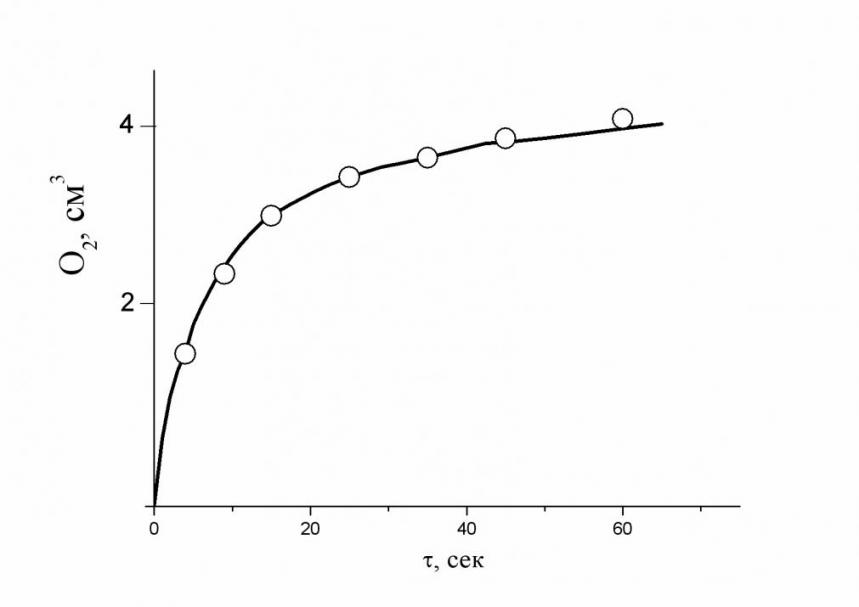 а а | 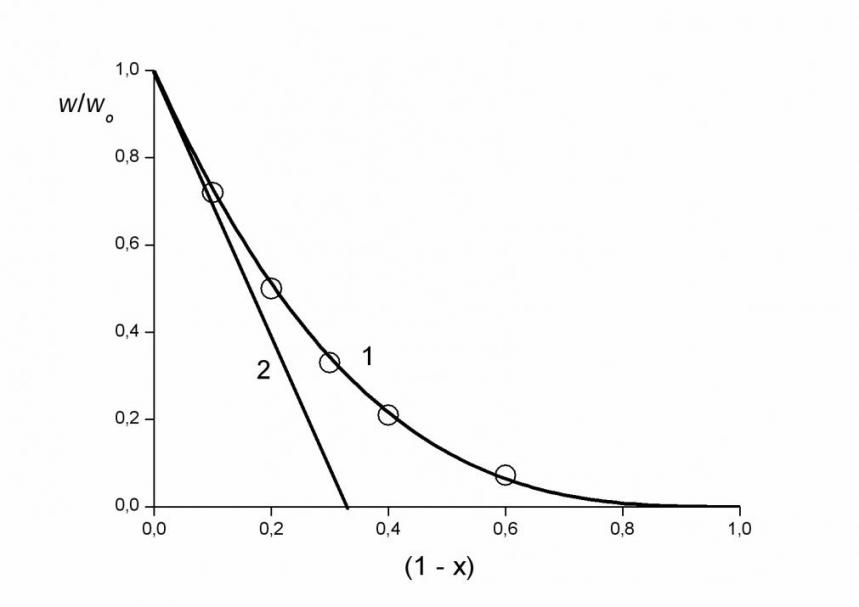 б б |
| Рис. 8а. Кинетика образования кислорода при окислении воды кластерами CoIII. Условия: [CoIII] = 0.145 моль/л, [HClO4] = 4.26 моль/л, температура 43 оС. | б. Фазовая траектория процесса образования кислорода (1), построенная по кинетической кривой рис.8а и её производная в начальный момент (2). |
В литературе имеются противоречивые сведения об ингибирующем влиянии добавок CoII в реакционную смесь. В одних работах утверждается, что CoII не влияет на скорость восстановления CoIII, тогда как в других указывают, что CoII ингибирует процесс окисления воды. Мы установили, что часть процесса, которая описывается законом реакции первого порядка (первый маршрут реакции), не зависит от присутствия продукта реакции CoII, тогда как окисление воды кластерами CoIII по второму маршруту, сильно тормозится соединениями CoII. Если в процессе превалирует первый маршрут, то влияние примесей CoII практически не сказывается; если же вклад первого маршрута незначителен (как в случае, приведенном на рис. 8а), то тормозящее влияние соединений Co(II) на скорость окисления воды велико, что согласуется с данными экспериментов.
Несмотря на термодинамическую возможность шестиэлектронного окисления воды до озона в координационной сфере кластеров Co(III)n с n = 6 и более, нам не удалось наблюдать образования озона ни при каких условиях проведения реакции. Отсутствие озона в продуктах окисления воды кластерами кобальта (Ш) несколько неожиданно, поскольку кластеры MnIV6 окисляют воду до озона. Возможно, это различие в поведении кластеров марганца и кобальта и предопределило выбор природных фотосинтезирующих организмов для кофактора оксидазы в фотосистеме II фотосинтеза именно марганцевого кофактора Mn-co.
ВЫВОДЫ
- Показано, что в координационных сферах марганцевых кластеров Mn2n при n > 2 при фотостимулированном окислении воды может образовываться не только кислород, но и озон.
- Открыто и изучено неизвестное ранее явление – шестиэлектронное окисление воды до озона хлоропластами красных морских водорослей (Callithamnion corymbosum) и бурых морских водорослей (Сystoseira barbata).
- Окисление воды до кислорода соединениями Co(III) в слабокислых растворах хлорной кислоты осуществляется в координационных сферах полиядерных кластеров CoIII4n, где n 1.
- Энергия активации внутрикластерного концертного процесса значительно уменьшается при увеличении числа активируемых молекул субстрата.
- Сделан вывод о перспективности использования кластеров переходных металлов в качестве катализаторов окисления воды в фотокаталитических преобразователях световой энергии в химическую.
СПИСОК ПУБЛИКАЦИЙ ПО ТЕМЕ ДИССЕРТАЦИИ
Статьи:
- Т.С. Джабиев, Г.А. Куркина, А.Е. Шилов. Концертное окисление воды кластерами кобальта (III).// Международный научный журнал «Альтернативная энергетика и экология», № 4 (48), 2007, с. 77-81.
- Т.С. Джабиев, Г.А. Куркина, академик А.Е. Шилов. Многоэлектронное окисление воды кластерами марганца (IV) в сернокислых растворах. // Международный научный журнал «Альтернативная энергетика и экология», № 6, 2007, с. 94-97.
- Таймураз С. Джабиев, Галина А. Куркина. Фотоиндуцированное окисление воды до озона морскими водорослями и функциональной химической моделью марганцевого кофактора фотосистемы II природного фотосинтеза. // Сборник трудов «Физика и химия процессов, ориентированных на создание новых наукоемких технологий, материалов и оборудования». № 6, 2007, с. 94-97.
Тезисы докладов:
1. Куркина Г.А., Джабиев Т.С. Тезисы доклада «Кинетика окисления воды соединениями кобальта (III) в хлорнокислых растворах» на XVII Симпозиуме «Современная химическая физика», Туапсе 2005, с. 135-136.
2. Куркина Г.А., Джабиев Т.С. Тезисы доклада «Окисление воды кластерами кобальта (III) в растворах хлорной кислоты» на XXIV Всероссийской школе-симпозиуме молодых ученых по химической кинетике, Пансионат «Березки» МО, 2006, с. 43.
3. Куркина Г.А., Джабиев Т.С. Тезисы доклада «Многоэлектронное окисление воды кластерами кобальта (III) » на XVIII Международный симпозиуме «Современная химическая физика», Туапсе 2006, с.216- 217.
4. Куркина Г.А., Джабиев Т.С. Тезисы доклада « Кинетика и механизм окисления воды кластерами кобальта (III)» на XXV Всероссийской школе-симпозиуме молодых ученых по химической кинетике, Пансионат «Юность» МО, 2007 с. 34.
5. Куркина Г.А., Джабиев Т.С. Тезисы доклада «Синергетическое окисление воды кластерами кобальта (III)» на Международной междисциплинарной научной конференции «Синергетика в естественных науках», г. Тверь, 2007, с. 256-258.
6. Dzhabiev T.S., Kurkina G.A., Shilov A.E. «Many-electron water oxidation in the coordination sphere of cobaltic clusters», Voevodsky Conference “PHYSICS AND CHEMISTRY OF ELEMENTARY CHEMICAL PROCESSES” Chernogolovka, Moscow Region, Russia, 2007, p. 174-175.
7. Dzhabiev T.S., Kurkina G.A., Shilov A.E. «Six-electron water oxidation in photosynthesis and its chemical functional model», Voevodsky Conference “PHYSICS AND CHEMISTRY OF ELEMENTARY CHEMICAL PROCESSES” Chernogolovka, Moscow Region, Russia, 2007, p. 216-217.
8. Куркина Г.А., Джабиев Т.С. Тезисы доклада «Фотогенерация озона морскими водорослями и функциональной химической моделью марганцевого кофактора фотосистемы II природного фотосинтеза» на Всероссийском симпозиуме «Нанофотоника 2007» МО, Черноголовка, 2007, с.103.
9. Куркина Г.А. Тезисы доклада «Многоэлектронное окисление воды в хлоропластах растений и водорослей» на VII Международной молодежной конференции ИБХФ РАН-ВУЗы "Биохимическая физика", Москва, 2007, с. 45.

