Механизм первичной стадии реакции озона с олефинами
На правах рукописи
Майоров Алексей Владимирович
Механизм первичной стадии реакции озона с олефинами
02.00.04 – физическая химия
АВТОРЕФЕРАТ
диссертация на соискание учёной степени
кандидата химических наук
Москва-2007
Работа выполнена в Институте биохимической физики им.
Н. М. Эмануэля РАН
Научный руководитель:
доктор химических наук
Крисюк Борис Эдуардович
Официальные оппоненты:
доктор химических наук
Игнатов Станислав Константинович
кандидат химических наук
старший научный сотрудник
Зюбина Татьяна Сергеевна
Ведущая организация:
Институт химической физики им. Н. Н. Семенова РАН г. Москва
Защита диссертации состоится ________________________ на заседании диссертационного совета Д 002.082.02 при Институте проблем химической физики РАН, 142432, Московская обл., Ногинский р-он, г. Черноголовка, пр-т Академика Семенова, д.1.
С диссертацией можно ознакомиться в библиотеке Института проблем химической физики РАН
Автореферат диссертации разослан _______________ 2007 г.
Учёный секретарь
диссертационного совета Д 002.082.02,
доктор химических наук Т. С. Джабиев
- Общая характеристика работы
- Актуальность работы
Взаимодействие озона с двойной связью – это одна из наиболее специфических реакций непредельных соединений. Она часто используется при количественном и качественном анализе, при синтезе и в химической технологии, а также в медицине, биологии, технике. Озон так же часто является причиной старения полимерных материалов. Эта реакция является одной из наиболее часто исследуемых, что отражено в сотнях работ и десятках обзоров и монографий за последние 40 лет. Механизм этой реакции интенсивно изучали как теоретически, так и экспериментально последние лет 50-60. Сейчас дискуссия идет главным образом о том, протекает ли эта реакция путем согласованного присоединения, или же она идет в две стадии через промежуточное бирадикальное состояние.
Диссертационная работа выполнена в соответствии с планом научно-исследовательских работ института биохимической физики РАН, при финансовой поддержке Отделения химии и наук о материалах РАН, проект «Теоретическое и экспериментальное изучение природы химической связи и механизмов важнейших химических реакций и процессов».
- Цель работы
Теоретическое исследование механизма присоединения озона к олефинам, а также сравнение расчётных данных с экспериментальными.
- Научная новизна
Методами квантовой химии проведено систематическое исследование геометрического и электронного строения озона, комплексов озона с этиленом и тетрафторэтиленом (ТФЭ), переходных состояний реакции озона с этиленом, ТФЭ, гексафторпропиленом (ГФП), ацетиленом. Изучено два механизма присоединения озона к олефинам. В отличие от результатов, полученных другими авторами, показано, что существует два механизма присоединения и в зависимости от природы заместителей и температуры преобладает один из них, либо реакция идет по двум каналам одновременно.
- Благодарность
Автор выражает огромную благодарность Попову А.А. за помощь, полезные советы и поддержку на всех стадиях работы.
- Апробация работы
Результаты исследований, вошедшие в диссертационную работу, были представлены в виде 4 стендовых докладов на 14, 17, 18 симпозиумах “Современная химическая физика” в г.Туапсе в 2002, 2005, 2006 годах. В виде устных докладов части работы представлялись на 2 (2002 г.) 3 (2003 г.), 4 (2004 г.), 5 (2005 г.) ежегодных молодёжных конференциях "Биохимическая физика" ИБХФ - ВУЗЫ, устного доклада на молодёжной школе "Современные проблемы биохимической физики" ИБХФ РАН (2002 г.), на Плехановских чтениях в виде двух стендовых (2002 г.) и (2004 г.) и трёх устных докладов в 2005 г., в 2006 г., 2007 г. Так же данная работа была представлена на XXV всероссийской школе-симпозиуме молодых учёных по химической кинетики, организованной Химическим факультетом МГУ в марте 2007, где за неё был присуждён диплом 2-ой степени.
- Публикации
По теме диссертационной работы опубликовано 11 печатных работ, в том числе 3 статьи, и 8 тезисов докладов.
- Структура и объём диссертации
Диссертация состоит из введения, литературного обзора, методической части, анализа результатов, обсуждения полученных данных и выводов. Материал работы изложен на 106 страницах машинописного текста, содержит 30 рисунков и 35 таблиц. Список литературы включает 64 наименования.
- Список принятых сокращений
ППЭ – поверхность потенциальной энергии
DFT – метод функционала плотности
ТФЭ – тетрафторэтилен
ГФП – гексафторпропилен
B3LYP – метод на базе теории функционала плотности с обменно-корреляционным функционалом Becke3LYP
ПС – переходное состояние
ПС1 – ПС в согласованном механизме (Криге)
ПС2 – ПС в несогласованном механизме (Демур)
ПО – первичный озонид
ЭОК – этилен-озоновый комплекс
UHF – неограниченный метод Хартри-Фока
RHF – ограниченный метод Хартри-Фока
MP(2,4) – поправки (порядок) в рамках теории Моллера-Плессета для учёта электронной корреляции.
CAS – многоконфигурационные расчёты
- Основное содержание работы
- Введение
Исследование первичного акта присоединения озона к олефинам на примере этилена, ТФЭ, ГФП, а так же ацетилена является актуальным с фундаментальной точки зрения. Недостаток экспериментальных данных и их неоднозначность, а так же слишком большая разница между разными экспериментами (в тысячи раз) наряду со сложностью электронного строения озона и переходных состояний делает данные объекты привлекательными для теоретического исследования.
Озон классифицируется как 1,3-диполь без кратных связей, стабилизация которых происходит за счёт образования внутреннего октета. Электронное строение озона может быть представлено как цвиттер-ионное (O+–O–O-,O=O+–O- и т.д.), либо как бирадикальное (O*–O–O*). Трёхцентровая 4 электронная система –система характеризуется относительно высоколежащей ВЗМО и низколежащей НЗМО, и частицы с подобными группами могут проявлять как электрофильные, так и нуклеофильные свойства.
Химия озона подробно изучена как теоретическими, так и экспериментальными методами. Однако реакции, где озон проявляет себя как бирадикал, проработаны в меньшей степени. Это делает актуальным квантово-химическое исследование первичной стадии реакции озона с олефинами.
- Выбор расчётной модели
Реакции озона с олефинами посвящено небольшое количество теоретических работ. Одной из причин является сложность электронного строения озона. Волновая функция озона обладает частично многоконфигурационным характером, что значительно ограничивает круг корректно описывающих исследуемую систему методов.
Целью работы являлось сравнение двух механизмов взаимодействия озона с двойной связью: путём согласованного 1,3-циклоприсоединения и несогласованного присоединения. Поэтому при выборе методов расчёта мы искали такой метод, который позволил бы сравнить оба механизма на одном уровне расчета.
Расчёты производились с помощью программы Гауссиан-03 (Gaussian Inc.)
С использованием литературных данных были выбраны три основных метода расчёта: метод UHF - для получения близкой геометрии, UMP2, UB3LYP - для получения точных численных значений энергий активации и констант скорости реакций.
В результате только метод UB3LYP оказался пригодным для решения поставленной задачи. Выводы, к которым мы пришли относительно выбора адекватного метода, согласуются с литературными данными.
Сказанное выше в сумме с тем, что UB3LYP обладает малой ресурсоёмкостью, предопределило его использование при поиске и сравнении ПС для обоих механизмов реакции озона с олефинами.
Таким образов DFT-методы являются надёжным и приемлемым инструментом для расчёта геометрических, электронных свойств ПС в присоединении озона к олефинам.
- Эмпирическая схема присоединения озона к олефинам
Энергетическую кривую первой стадии реакции озона с олефинами по механизму Криге можно представить в следующем виде:
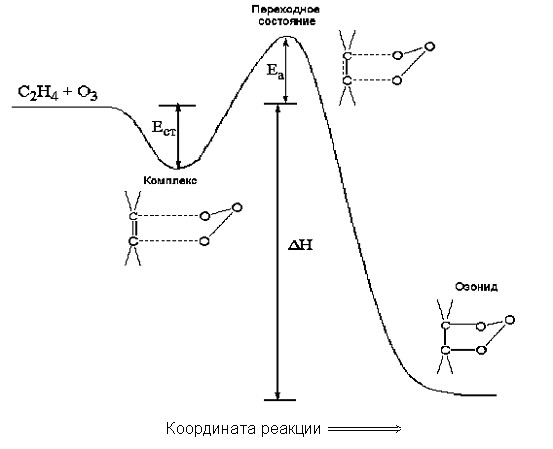

Сперва реагенты образуют устойчивый ЭОК, энергия стабилизации Eст которого отсчитывается от энергии исходных реагентов, далее образуется переходное состояние.
Схему путей присоединения озона к олефинам на примере этилена можно представить следующим образом:
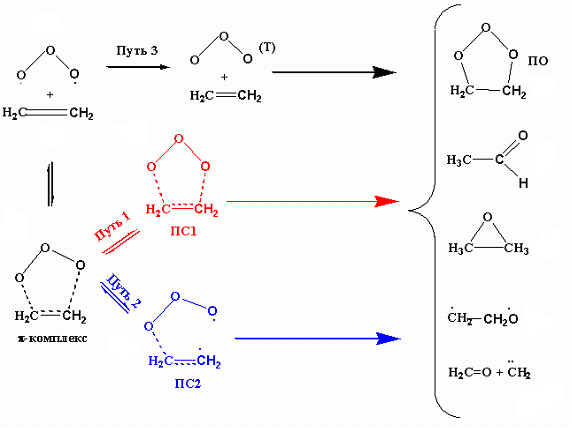
Из ЭОК реакция может идти по пути 1, это согласованное 1,3-циклоприсоединение, протекающее через образование симметричного ПС1. Это общепризнанный путь реакции.
Путь 2 - это несогласованное присоединение одним из крайних кислородов озона к одному из углеродов двойной связи, через образование несимметричного ПС2. При этом озон проявляет бирадикальные свойства и это необходимо учитывать при расчётах.
В пользу присоединения по пути 2 можно привести следующие доводы:
- Озон с С-Н-связями ведёт себя как радикал;
- Озон обладает высоким сродством к электрону, что облегчает образование полярного ПС2;
- ПС2 более вероятная конфигурация при столкновении, чем ПС1;
- Это объясняет появление эпоксидов и карбонилов на первой стадии реакции.
Кроме вышеописанных путей реакции существует путь 3, где реакция протекает в триплетном состоянии. Озон легко переходит в триплетное состояние, для этого достаточно освещения даже в ИК-диапозоне. Реакция присоединения триплетного озона к двойной связи происходит практически безбарьерно с отщеплением триплетного молекулярного кислорода и образованием эпоксида.
- Геометрия этилен озонового комплекса (ЭОК)
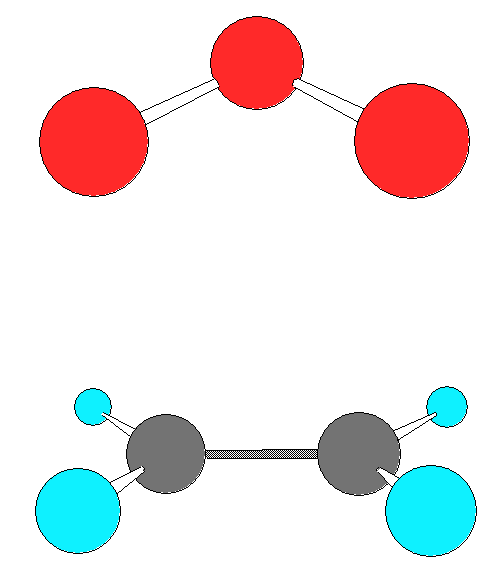
Нами было обнаружено два типа ЭОК – симметричный конверт и скрученный конверт.
Геометрия обоих ЭОК показана ниже:
 |  |
Какой из ЭОК образуется, зависит от распределения зарядов в олефине (см. рис ниже). Если в качестве заместителей при углеродах двойной связи доноры электронов, как на рисунке (а), то в симметричном положении озон находится в устойчивом равновесии. В противном случае, как на рисунке (б), когда заместители стягивают на себя отрицательный заряд, и озон оказывается в положении неустойчивого равновесия. Поэтому для этилена и ацетилена основной ЭОК – симметричный конверт, а для ТФЭ и ГФП – скрученный конверт.
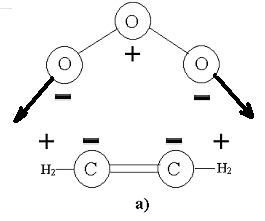 | 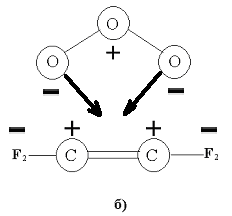 |
а) - распределение зарядов реакции присоединения озона к этилену и электростатическая сила, изображённая чёрными стрелками, б) - распределение зарядов реакции присоединения озона к ТФЭ, и электростатическая сила, изображённая чёрными стрелками.
Геометрические и термодинамические параметры ЭОК – симметричный конверт (Табл. 1):
Таблица 1. Параметры оптимизированного симметричного комплекса озона с этиленом при расчётах B3LYP и UB3LYP, расстояния в , Eст в кДж/моль, значения квадрата спина до и после аннигиляции (S2 и S2A соответственно)
| Метод | Базис | R1=R2 | ROO | RCC | S2 | S2A | Eст |
| UB3LYP | 6-31G** | 2.846 | 1.286 | 1.337 | 0.3 | 0.003 | -8.7 |
| 6-31+G** | 3.03 | 1.284 | 1.338 | -4.26 | |||
| 6-311G** | 2.874 | 1.279 | 1.333 | -8.28 | |||
| 6-311+G** | 3.041 | 1.278 | 1.333 | -4.54 | |||
| MP2 | 6-31G** | 2.471 | 1.325 | 1.349 | 0 | -25.12 | |
| 6-31+G** | 2.447 | 1.33 | 1.355 | -24.43 | |||
| 6-311G** | 2.584 | 1.297 | 1.346 | -21.59 | |||
| 6-311+G** | 2.568 | 1.3 | 1.35 | -19.95 | |||
| UHF | 6-31G** | 3.575 | 1.294 | 1.317 | 0.96 | 0.14 | -2.55 |
| 6-31+G** | 3.95 | 1.293 | 1.321 | 0.96 | 0.14 | -2.04 | |
| 6-311G** | 3.617 | 1.194 | 1.317 | 0 | 0 | -4.33 | |
| 6-311+G** | 3.839 | 1.283 | 1.319 | 0.95 | 0.12 | -2.65 | |
Геометрические и термодинамические параметры ЭОК – смещённый конверт представлены в Табл. 2 ниже:
Таблица 2. Параметры асимметричного комплекса озона с ТФЭ при расчётах, расстояния в , Eст в кДж/моль, S2A=0.1 для тех состояний, у которых ненулевой S2
| Метод | базис | R1 | R2 | RC=C | S2 | Eст |
| UB3LYP | 6-31G** | 3.26 | 3.28 | 1.325 | 0 | -9.06 |
| 6-31+G** | 3.84 | 3.52 | 1.326 | -2.49 | ||
| 6-311G** | 3.03 | 3.17 | 1.324 | -7.70 | ||
| 6-311+G** | 3.88 | 3.48 | 1.322 | -2.97 | ||
| MP2 | 6-311+G** | 3.09 | 3.35 | 1.328 | 0 | -12.93 |
| UHF | 6-31G** | 3.42 | 3.5 | 1.3 | 0 | -4.60 |
| 6-31+G** | 3.9 | 3.62 | 1.301 | 0.9 | -2.92 | |
| 6-311G** | 3.5 | 3.63 | 1.298 | 0.9 | -3.62 | |
| 6-311+G** | 3.92 | 3.64 | 1.299 | 0.9 | -3.35 |
- Переходные состояния
Для того чтобы найти ПС2, была построена поверхность потенциальной энергии (ППЭ) в зависимости от обеих координат (R1,R2) между крайними кислородами озона и углеродами двойной связи:
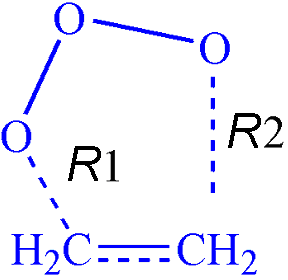
С помощью метода RHF была получена следующая ППЭ, изображённая на рисунке слева, где видна только одна седловая точка - ПС1 с координатами (1.9, 1.9 ). Однако, при переходе от замкнутых оболочек к открытым картина изменилась. На правом рисунке хорошо видно, что вместо седловой точки в центре появился горб, а седловая точка сместилась вбок, что соответствует ПС2 с координатами (1.9, 3 ):
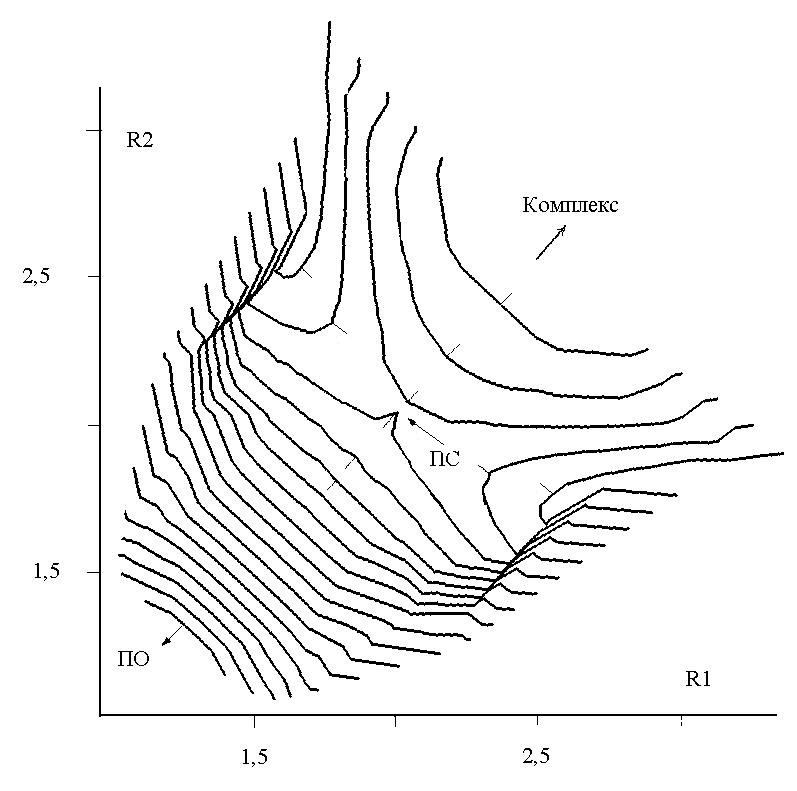 |  |
| ППЭ реакции “этилен + озон”, расчет RHF/6-31G**. Изолинии проведены через 17 кДж/моль, риски на изолиниях указывают направление снижения энергии, значения R1 и R2 в | ППЭ по данным расчета UHF/6-311G**, расстояния в |
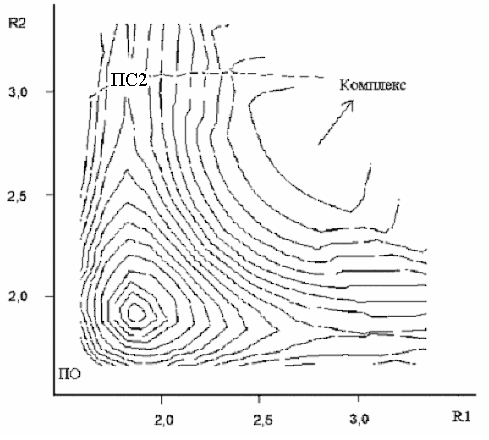
Таким образом, методы RHF и MP2 дают для ПС симметричную структуру, а UHF и UMP2 – несимметричную. ПС1 и ПС2 появляются на разных уровнях расчёта, что не позволяет их корректно сравнивать. И только метод UB3LYP находит оба типа ПС на одном уровне расчёта. Для структуры ППЭ расчет UB3LYP дал следующую картину:
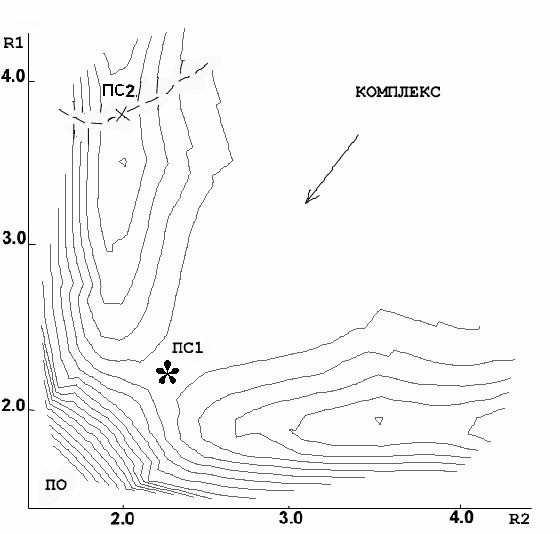

На рисунке изображены изолинии ППЭ в зависимости от (R1, R2), в центре и по бокам видны точки перевала, соответствующие обоим типам переходных состояний. Расстояние между изолиниями составляет 5 кДж/моль.
ПС1 выглядит так, как показано на рисунке ниже:
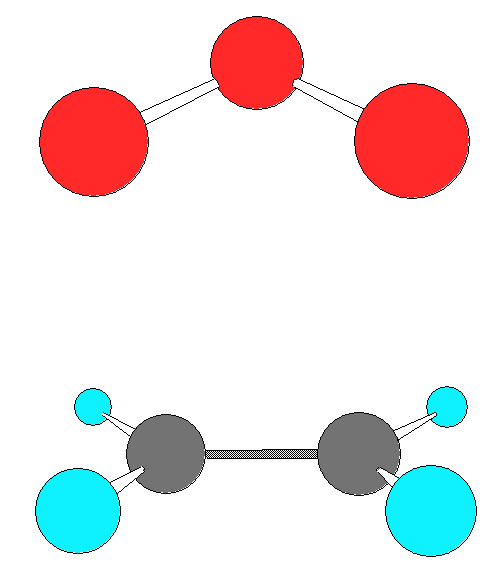
Далее изображены два варианта ПС2:
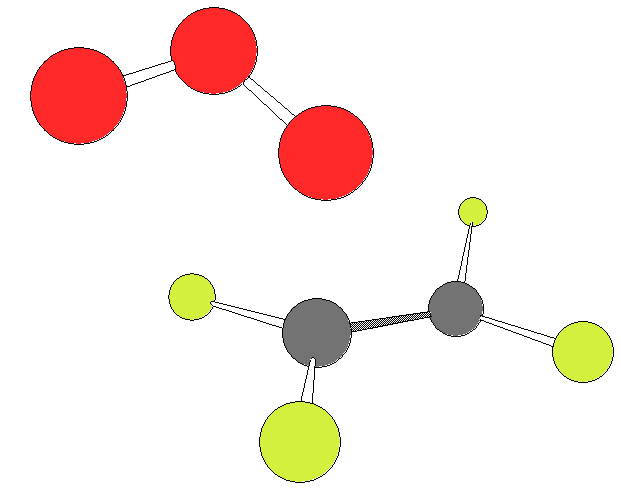 | 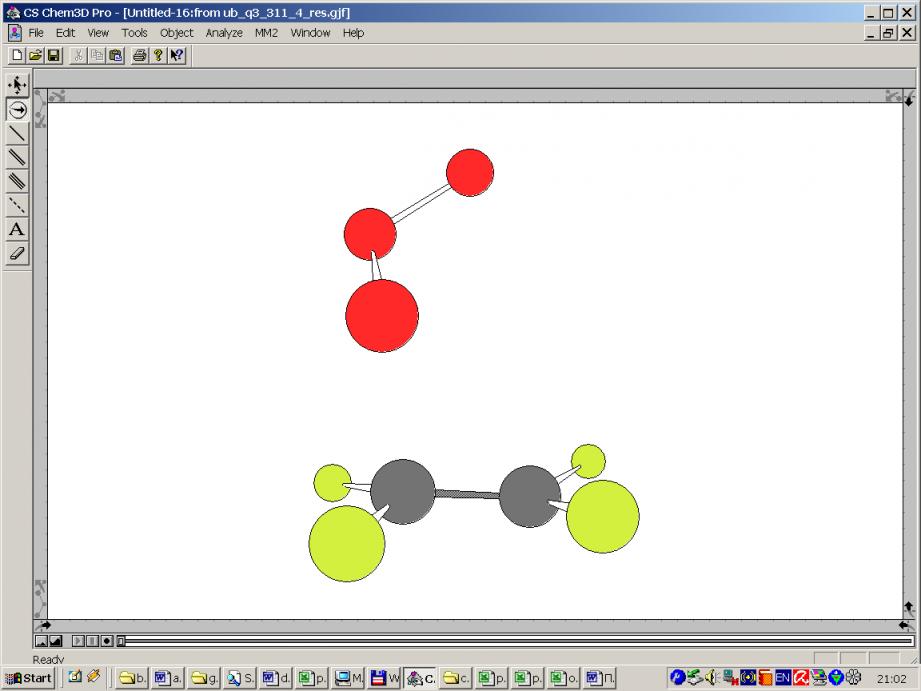 |
В Табл.3 приведены геометрические параметры ПС1 и ПС2 реакции озона с этиленом:
Таблица 3. Значение геометрических параметров (), S2, S2A переходных состояний, рассчитанных для реакции озона с этиленом методом B3LYP
| Базис | Rco1 | Rco2 | RCC | S2 | S2A |
| ПС1 | |||||
| 6-31G** | 2.348 | 2.348 | 1.359 | 0 | |
| 6-31+G** | 2.339 | 2.339 | 1.364 | ||
| 6-311G** | 2.274 | 2.274 | 1.363 | ||
| 6-311+G** | 2.276 | 2.276 | 1.366 | ||
| aug-cc-pvdz | 2.315 | 2.315 | 1.366 | ||
| ПС2 | |||||
| 6-31G** | 1.947 | 3.911 | 1.376 | 0.718 | 0.9 |
| 6-31+G** | 1.944 | 3.945 | 1.381 | 0.726 | |
| 6-311G** | 1.926 | 3.902 | 1.377 | 0.740 | |
| 6-311+G** | 1.926 | 3.902 | 1.377 | 0.740 | |
| aug-cc-pvdz | 1.941 | 3.926 | 1.381 | 0.711 | |
Для ТФЭ ПС имеют аналогичный вид, в Табл. 4 ниже представлена их геометрия:
Таблице 4. Значение геометрических параметров (), S2, S2A переходных состояний, рассчитанных для реакции озона с ТФЭ методом UB3LYP
| Базис | Rco1 | Rco2 | RCC | S2 | S2A |
| ПС1 | |||||
| 6-31G** | 2.296 | 2.296 | 1.366 | 0 | |
| 6-31+G** | 2.270 | 2.270 | 1.370 | ||
| 6-311G** | 2.252 | 2.252 | 1.368 | ||
| 6-311+G** | 2.243 | 2.243 | 1.371 | ||
| aug-cc-pvdz | 2.25 | 2.25 | 1.371 | ||
| ПС2 | |||||
| 6-31G** | 2.066 | 4.277 | 1.371 | 0.679 | 0.08 |
| 6-31+G** | 2.038 | 4.343 | 1.378 | 0.692 | 0.08 |
| 6-31+G** | 2.028 | 3.695 | 1.374 | 0.667 | 0.09 |
| 6-311G** | 2.020 | 3.555 | 1.368 | 0.680 | 0.07 |
| 6-311+G** | 2.001 | 4.069 | 1.377 | 0.733 | 0.1 |
| 6-311+G** | 2.011 | 4.302 | 1.377 | 0.721 | 0.1 |
| aug-cc-pvdz | 2.01 | 3.65 | 1.37 | 0.66 | 0.07 |
| aug-cc-pvdz | 2.01 | 4.05 | 1.37 | 0.71 | 0.09 |
В случае остальных реагентов были найдены также два типа ПС, которые мало отличаются от имеющихся. Ниже показаны оба типа ПС для реакции озона с ГФП, (а) – ПС1, (б) – ПС2 с атакой на крайний углерод, (с) – ПС2 с атакой на средний углерод:
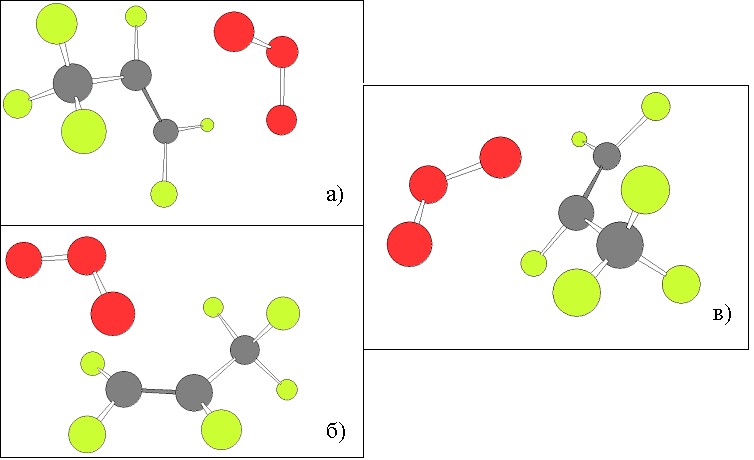

Геометрия ПС для ГФП показана в Табл. 5:
Таблица 5. Геометрия ПС реакции озона с ГФП в , метод UB3LYP
| Базис | Rкрайний | Rцентральный | RCC | S2 | S2A |
| Симметричное ПС | |||||
| 6-31+G** | 2.2 | 2.27 | 1.38 | 0 | |
| 6-311G** | 2.18 | 2.25 | 1.378 | ||
| 6-311+G** | 2.175 | 2.24 | 1.381 | ||
| Несимметричное ПС | |||||
| 6-31+G** | 3.56 | 1.92 | 1.38 | 0.74 | 0,08 |
| 6-31+G** | 4.38 | 1.93 | 1.39 | 0.77 | |
| 6-31+G** | 1.98 | 4.3 | 1.39 | 0.72 | |
| 6-311G** | 4.34 | 1.92 | 1.38 | 0.79 | |
| 6-311G** | 1.97 | 4.24 | 1.38 | 0.74 | |
| 6-311+G** | 1.96 | 4.29 | 1.39 | 0.74 | |
| 6-311+G** | 4.37 | 1.91 | 1.39 | 0.79 | |
Для ацетилена, ПС имеет похожий тип, (а) - ПС2, (б) - ПС1:
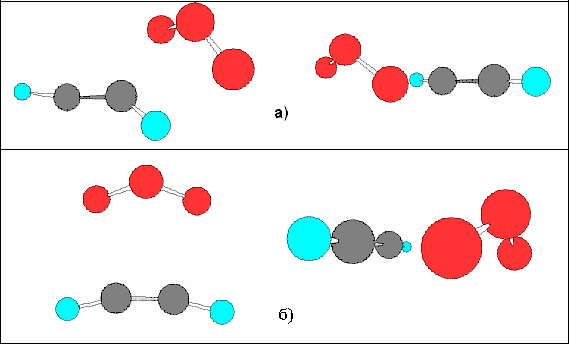
В Табл. 6 показаны геометрические параметры обоих типов ПС для ацетилена:
Таблица 6. Геометрия ПС реакции озона с ацетиленом в , метод UB3LYP
| Базис | Rco1 | Rco2 | RCC | S2 | S2A |
| Симметричное ПС | |||||
| 6-31g | 2.02 | 2.02 | 1.227 | 0 | |
| 6-311g | 2.15 | 2.15 | 1.225 | ||
| 6-311+g | 2.155 | 2.155 | 1.225 | ||
| aug-cc-pvdz | 2.195 | 2.195 | 1.231 | ||
| Несимметричное ПС | |||||
| 6-31g | 4.08 | 1.91 | 1.234 | 0.68 | 0.08 |
| 6-311g | 4.06 | 1.87 | 1.23 | 0.71 | |
| 6-311+g | 4.08 | 1.87 | 1.23 | 0.72 | |
| aug-cc-pvdz | 4.09 | 1.9 | 1.24 | 0.67 | |
Расчеты част от колебаний показали, что как ПС1, так и ПС2 имеют одну мнимую частоту и являются истинными переходными состояниями. Кроме того из таблиц видно, что ПС1 является чисто синглетным состоянием (S2 = 0), а ПС2 имеет более высокий квадрат спина (S2 = 0.6–0.8), который обнуляется после процедуры аннигиляции (S2А), что означает, что ПС2 так же синглетное ПС.
Чтобы убедится в этом, мы провели многоконфигурационные расчеты CAS для ПС2, которые показали, что это состояние синглетное и бирадикальное. Аномальные значения S2 являются результатом применения однодетерминатного приближения к двуцентровой системе.
В Табл. 7 приведены Eа для обоих типов ПС для разных реагентов, рассчитанные методом UB3LYP, в скобках энергия ПС2, с развёрнутым кислородом:
Таблица 7. Энергия активации для обоих типов присоединения озона к двойной связи, значени
| Базис | Eа, кДж/моль | ||
| ПС1 | ПС2 | ||
| Озон+этилен | |||
| 6-31G | -4.81 | 15.75 | |
| 6-31+G** | 0.57 | 20.49 | |
| 6-311G** | -2.51 | 19.74 | |
| 6-311+G** | 2.61 | 23.49 | |
| Aug-cc-pvdz | 1.74 | 23.15 | |
| озон+ТФЭ | |||
| 6-31G** | 5.9 | 4.99 | |
| 6-31+G** | 19.59 | 14.19 | |
| 6-311G** | 14.12 | 9.07 | |
| 6-311+G** | 21.95 | 20.32 | |
| Aug-cc-pvdz | 18.98 | 15.99 | |
| озон+ГФП | |||
| средний углерод | крайний углерод | ||
| 6-31+G** | 30.5 | 36.37 | 35.28 |
| 6-311G** | 23.03 | 34.2 | 29.6 |
| 6-311+G** | 32.7 | 43.69 | 37.31 |
| озон+ацетилен | |||
| 6-31g | 7.86 | 25.5 | |
| 6-31+G** | 15.9 | 32.9 | |
| 6-311g | 15.42 | 34.92 | |
| 6-311+g | 13 | 39.27 | |
| aug-cc-pvdz | 16.67 | 34.75 | |
Видно, что когда в качестве заместителей возле двойной связи выступают доноры электронов, в данном случае это атомы Н, то ПС1 энергетически выгоднее ПС2.
Если заместители – акцепторы электронов (в ТФЭ – F), то наоборот ПС2 энергетически выгоднее ПС1. В случае же ГФП, в качестве одного из заместителей возле двойной связи выступает углерод, то есть по сравнению с ТФЭ стягивание электронной плотности меньше, поэтому разница между энергиями ПС1 и ПС2 исчезает.
В реакции озона с ГФП атака озона на крайний атом углерода двойной связи примерно на 5 кДж/моль выгоднее, чем средний.
Нами было установлено, что в случае ПС2 имеет место безбарьерное вращение самого дальнего от этилена кислорода. Расчёты дают разницу в энергии для таких состояний около 5 кДж/моль для ТФЭ и ГФП. Для этилена такая разница ниже.
Однако для того, чтобы сравнить оба пути присоединения озона к олефинам, недостаточно учесть только разницу в Eа, потому что кроме этого оба типа ПС отличаются друг от друга энтропией, что необходимо учесть.
- Сравнение констант скоростей для обоих каналов реакции
Были вычислены соответствующие константы скорости первой стадии присоединения озона к этилену, ТФЭ, ГФП, ацетилену по обоим механизмам. Для этого с помощью программы MOLTRAN (S. K. Ignatov) и с использованием результатов настоящих квантовых расчетов были вычислены значения энтальпии (H) и энтропии (S) активации для обоих путей реакции.
По этим данным с использованием стандартной теории переходного состояния были рассчитаны соответствующие значения констант скорости:
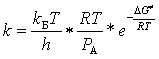 ,
,
где kБ – постоянная Больцмана, РА – стандартное давление, h – постоянная Планка, а G - энергия Гиббса образования ПС:
![]() .
.
Результаты такой оценки значения константы скорости для исследованных веществ приведены ниже в Табл. 8:
Таблица 8. Костанты скорости для обоих типов присоединения озона к двойной связи
| Базис | k, л/моль*сек | ||
| ПС1 | ПС2 | ||
| Озон+этилен (298 К) | |||
| 6-31G | 4.3 105 | 2.09 103 | |
| 6-31+G** | 4.82 104 | 4.02 102 | |
| 6-311G** | 1.00 105 | 4.33 102 | |
| 6-311+G** | 5.88 104 | 4.74 102 | |
| Aug-cc-pvdz | 1.27 105 | 5.89 102 | |
| эксперим. | 4.72 104 | ||
| озон+ТФЭ (170 К) | |||
| 6-31G** | 2.24 10-7 | 3.83 10-3 | |
| 6-31+G** | 2.59 10-12 | 2.28 10-6 | |
| 6-311G** | 1.90 10-10 | 1.33 10-4 | |
| 6-311+G** | 3.37 10-13 | 1.12 10-7 | |
| Aug-cc-pvdz | 1.84 10-11 | 5.64 10-7 | |
| эксперим. | 3.28 10-7 | ||
| озон+ГФП (150 К) | |||
| средний углерод | крайний углерод | ||
| 6-31+G** | 1.45 10-14 | 7.27 10-13 | 8.93 10-12 |
| 6-311G** | 2.71 10-12 | 2.5 10-12 | 9.84 10-10 |
| 6-311+G** | 3.47 10-15 | 4.15 10-14 | 3.78 10-12 |
| эксперим | 7.4 10-8 | ||
| озон+ацетилен (298 К) | |||
| 6-31G** | 4.71 104 | 1.70 103 | |
| 6-31+ G** | 2.13 103 | 1.43 102 | |
| 6-311 G** | 1.01 103 | 3.04 101 | |
| 6-311+ G** | 6.11 103 | 1.29E 101 | |
| aug-cc-pvdz | 1.50 103 | 4.71E 101 | |
| эксперимент | 47 | ||
При анализе константы скорости реакции необходимо иметь в виду то, что расчётное значение ПС2 занижено примерно в 3–10 раз из-за недоучёта свободного вращения озонового фрагмента.
Для системы озон–этилен k1/k2>102, то есть доля реакции по механизму Демура составляет менее 1%, причем k1 с точностью до порядка близка к экспериментальному значению.
Для системы озон–ТФЭ картина противоположная k1/k2 >10-4, то есть доля реакции по механизму Демура составляет более 99.99%, и k2 с точностью до порядка совпадает с экспериментальным значением. Из чего видно, что несмотря на ненулевое значения S2 полученное ПС2 согласуется с экспериментом.
В случае системы озон–ГФП k2/k1 >102, то есть доля реакции по механизму Демура по-прежнему более 99.9%, однако разрыв между обеими константами сократился.
К экспериментальному значению ближе k2, чем k1.
У ГФП исчезает симметрия обоих углеродов двойной связи, поэтому k2 атаки на крайний углерод и на средний углерод отличаются друг от друга в 100 раз. То есть более 99% реакции протекает с атакой на крайний углерод.
Наконец, для системы озон–ацетилен k1/k250, то есть в данном случает речь идёт о конкуренции обоих механизмов. При этом усложнение базиса, начиная с 6-31+G**, мало меняет константу скорости реакции по обоим механизмам.
Вычисленная k1 на два порядка больше экспериментального значения при 298 К.
- Заключение
Итак, первая стадия присоединения озона к этилену, ТФЭ, ГФП и ацетилену исследована на протяжении всей координаты реакции разными квантово-химическими методами. Установлено, что сначала образуется устойчивый комплекс, далее присоединение происходит через образование ПС обоих типов, то есть присоединение идет по механизмам Криге и Демура, причём оба эти механизма реализуются параллельно и конкурируют друг с другом. Были вычислены константы скорости присоединения, по обоим механизмам и оценен их вклад для вышеперечисленных олефинов. Был сделан вывод, что соотношение каналов присоединения зависит от заместителей и строения олефинов. Для этилена и ацетилена 99.99% реакции протекает по механизму Криге, а для ТФЭ и ГФП 99.99% реакции протекает по механизму Демура.
- Выводы
- Методами квантовой химии установлено, что существует два механизма присоединения озона к олефинам: согласованное 1,3-циклоприсоединение через ПС1 и несогласованное присоединение, которое протекает через промежуточное бирадикальное переходное состояние ПС2.
- Оба механизма: согласованное и несогласованное присоединение О3 к С=С–связи конкурируют друг с другом. Отношение констант скорости по каждому каналу k1/k2 зависит от природы заместителей, температуры, и др. условий.
- В случае, когда все заместители в этилене суть доноры электронов, величина k1/k2>102, в случае, когда все заместители – акцепторы электронов (ТФЭ) k1/k2<10-4, в промежуточном случае, когда три заместителя атомы фторы, а один алкильный заместитель (ГФП) k1/k2<10-2.
- С помощью квантово-химического расчета показано, что реакция протекает через формирование промежуточного комплекса с дальнейшим образованием ПС1 или ПС2. Найдено два типа комплекса: симметричный конверт и скрученный конверт. Показано, что для реакции озона с этиленом основным комплексом является симметричный конверт, а для реакции озона с ТФЭ – скрученный конверт.
- Тип комплекса зависит от заместителей при углеродах двойной связи: если заместителями являются доноры электронов, то симметричные –комплексы выгодней (этилена и ацетилен), в противном случае выгоднее асимметричные комплексы (ТФЭ).
- Реакция присоединения озона к ТФЭ и к ГФП протекает в основном (как минимум на 99%) по несогласованному механизму, через образование несимметричного бирадикального переходного состояния, тогда как реакция присоединения озона к этилену при 298К протекает в основном по согласованному механизму, через образование симметричного переходного состояния.
- Основное содержание работы изложено в следующих публикациях
симметричного переходного состояния;
- Крисюк Б. Э., Майоров А. В., Попов А. А. Квантово-химическое исследование механизма реакции озона с этиленом. // Химическая физика. 2003. Т. 22. № 9. С. 3–9.
- Крисюк Б. Э., Майоров А. В., Попов А. А. Реакция озона с этиленом: согласованное или несогласованное присоединение. // Химическая физика. 2007. T. 26. № 6. С. 16–22.
- Майоров А. В., Крисюк Б. Э., Попов А. А. Взаимодействие озона с тетрафторэтиленом. // Химическая физика. 2007. T. 26. № 7. С. 22–26.
- Крисюк Б. Э., Майоров А. В., Попов А. А. Реакция озона с этиленом: согласованное или несогласованное присоединение. //Тезисы докладов XVII симпозиума “Современная химическая физика”. Туапсе. 2005 г. С. 47–48.
- Майоров А. В., Крисюк Б. Э., Спиридонов Д. С., Попов А. А. Ab initio расчёт озона реакции озона с этиленом. //Тезисы докладов второй ежегодной молодёжной конференции ИБХФ–ВУЗы “Биохимическая физика”. Москва. 2002. С. 34–35.
- Крисюк Б. Э., Майоров А. В., Попов А. А. Сравнение симметричного и несимметричного хода реакции этилена с озоном методом квантово-химического расчета. // Труды IV ежегодной молодежной конференции ИБХФ РАН–ВУЗы “Биохимическая физика”. Москва. 2004. С. 22.
- Майоров А. В., Крисюк Б. Э., Попов А. А. Согласованное и несогласованное присоединение озона к тетрафторэтилену. Расчет G98/03.// Труды V международной молодежной конференции ИБХФ РАН–ВУЗы “Биохимическая физика”. Москва. 2005. С. 265–266.
- Майоров А. В. Согласованное и несогласованное присоединение озона к олефинам на примере этилена и тетрафторэтилена.//Тезисы докладов XXV всероссийской школы-симпозиума молодых учёных по химической кинетики. Химический факультет МГУ. 2007. С. 39.
- Майоров А. В. Конкуренция механизмов Демура и Криге в реакции присоединения озона к олефинам.// Труды VI международной молодежной конференции ИБХФ РАН–ВУЗы “Биохимическая физика”. Москва. 2006. С. 23.
- Крисюк Б. Э., Майоров А. В., Попов А. А. Структура потенциальной поверхности реакции озона с этиленом. // Тезисы 14 Симпозиума "Современная химическая физика", Туапсе, 2002, С. 39.
- Крисюк Б. Э., Майоров А. В., Попов А. А. Механизм реакции озона с тетрафторэтиленом. //Тезисы докладов XVII симпозиума “Современная химическая физика”. Туапсе. 2005 г. С. 137–138.

