Аминолиз 2,2 ’,7,7 ’ -тетрагидроксидинафтилметана и исследование свойств полученных соединений
На правах рукописи
ШЕЛЕНКОВА Людмила Витальевна
АМИНОЛИЗ 2,2’,7,7’-ТЕТРАГИДРОКСИДИНАФТИЛМЕТАНА И ИССЛЕДОВАНИЕ СВОЙСТВ ПОЛУЧЕННЫХ СОЕДИНЕНИЙ
Специальность 02.00.03 – органическая химия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата химических наук
Москва-2011
Работа выполнена на кафедре органической химии химического факультета
Московского педагогического государственного университета
Научный руководитель:
доктор химических наук, профессор
МАСЛЕННИКОВА Вера Ивановна
Официальные оппоненты:
доктор химических наук, доцент
БЕЛОГЛАЗКИНА Елена Кимовна
кандидат химических наук,
старший научный сотрудник
КОМЛЕВ Игорь Витальевич
Ведущая организация – Российский университет дружбы народов
Защита состоится 4 апреля 2011 г. в 15 часов 30 минут на заседании Диссертационного Совета Д 212.154.25 в Московском педагогическом государственном университете по адресу: 119021, Москва, Несвижский пер., 3.
С диссертацией можно ознакомиться в библиотеке МПГУ по адресу: 119991, Москва, ул. Малая Пироговская, 1, стр. 1.
Автореферат разослан «…..» ………………………..2011 г.
Ученый секретарь диссертационного совета ПУГАШОВА Н.М.
ОБЩЕЕ СОДЕРЖАНИЕ РАБОТЫ
Актуальность работы. Ароматические амины – широко известный класс органических соединений, химия которых изучается уже в течение нескольких столетий. Пристальное внимание химиков к этим веществам обусловлено разносторонними возможностями их применения. Ароматические амины и их производные используются для производства красителей, взрывчатых веществ, пластификаторов, синтетических волокон, в медицине, парфюмерии, сельском хозяйстве и т. д. Кроме того, благодаря высоким реакционным и комплексообразующим способностям, они являются перспективными структурными блоками для дизайна макрогетероциклических полифункциональных соединений, играющих важную роль в создании наноразмерных супрамолекулярных систем, биомиметиков, лекарственных препаратов нового поколения, сенсоров, лигандов для металлокомплексных катализаторов.
Один из наиболее простых и удобных методов синтеза ароматических аминов – аминирование их гидроксилсодержащих аналогов. Для прямого превращения фенолов и нафтолов в соответствующие аминопроизводные существует большое количество методик, различных по реагентам, предпочтительным субстратам и техническому исполнению. Однако практическое значение замещение гидроксила на аминогруппу имеет только для простейших производных нафталина и резорцина. Аминирование более сложных гидроксиароматических соединений практически не исследовано. Для получения их аминированных аналогов используется сборка из соответствующих аминоароматических билдинг-блоков.
Цель работы. Изучение взаимодействия с первичными аминами и аммиаком олигогидроксидинафталиновых систем на примере аминирования 2,2',7,7'-тетрагидроксидинафтилметана; синтез и исследование свойств олигоаминированных нафталинов.
Научная новизна. В результате проделанной работы впервые исследовано замещение гидроксильных групп в молекуле 2,2',7,7'-тетрагидроксидинафтилметана на аминогруппы. Установлено, что во всех рассмотренных случаях оно сопряжено с разрывом С-С связей и элиминированием метиленового звена. Аминирование ароматических соединений, сопровождающееся разрывом С-С связей ранее не было известно и в данной работе описано впервые. Показано, что регионаправленность процесса, а также состав и структура аминированных продуктов определяются природой используемого амина. Найден подход к синтезу 2,2',7,7'-тетра(аминоорганил)-динафтилметанов. С использованием в качестве промежуточного соединения 2,2',7,7'-тетратрифлатодинафтилметана впервые получены ди- и тетрааминированные производные динафтилметана. Впервые рассмотрено фосфорилирование и комплексообразование 2,2',7,7'-тетра(фениламино)-1,1'-бинафтила и получены его фосфорсодержащие и координационные производные.
Практическая ценность. Изучены подходы к аминированию 2,2',7,7'-тетрагидроксидинафтилметана. Разработаны методы синтеза олигоаминированных нафталиновых систем различного типа. Прямым аминированием тетрагидроксидинафтилметана первичными аминами и аммиаком получены диаминонафталины и тетраамино-1,1'-бинафтилы, соотношение которых зависит от природы аминирующего реагента. Каталитическим аминированием тетратрифлатодинафтилметана синтезированы ди- и тетрааминированные динафтилметаны. Модификацией 2,2',7,7'-тетра(фениламино)-1,1'-бинафтила получены фосфорилированные производные и комплексы с солями переходных металлов (AgNO3, FeBr2, CuCl), которые могут представлять интерес для каталитических исследований.
Апробация работы. Результаты работы были представлены и обсуждались на IV Международном симпозиуме “Молекулярный дизайн и синтез супрамолекулярных архитектур” (Казань, 2006), XVIII Менделеевском съезде по общей и прикладной химии (Москва, 2007), XV Международной конференции по химии соединений фосфора, посвящённой 100-летию со дня рождения М.И. Кабачника (Санкт-Петербург, 2008), V Международной конференции по органической химии для молодых учёных (Санкт-Петербург, 2009), Всероссийской конференции «Итоги и перспективы химии элементоорганических соединений», посвященной 110-летию со дня рождения академика А.Н.Несмеянова (Москва, 2009), Всероссийской конференции по органической химии. (Москва, 2009), Международном симпозиуме «Advanced Science in Organic Chemistry» (Украина, 2010).
Работа выполнена при финансовой поддержке РФФИ (гранты № 06-03-32354a, 09-03-00201a) и гранта Президента Российской Федерации для поддержки ведущих научных школ России (НШ - 5515.2006.3).
Публикации. По материалам диссертации имеется одиннадцать публикаций, три статьи в журналах, рекомендованых ВАК и восемь тезисов докладов.
Объем и структура работы. Диссертация изложена на 119 страницах машинописного текста. Содержит 4 таблицы, 2 схемы и 15 рисунков. Список цитируемой литературы включает 142 наименований. Работа состоит из введения, литературного обзора, посвященного синтезу и модификации аминированных динафталиновых систем, обсуждения результатов собственных исследований, экспериментальной части, выводов и списка литературы.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Публикации, посвященные прямому аминированию олигогидрокси-динафталиновых систем в литературе практически отсутствуют. Нами была найдена единственная работа, немецкий патент 1893 года, в котором описывается взаимодействие 2,2',7,7'-тетрагидроксидинафтилметана 1 и 2,2'-дигидрокси-динафтилметана 2 с анилином в присутствии его солянокислой соли. Авторы патента предполагали, что полученные соединения представляют собой тетра- и диаминированные производные динафтилметана 3, 4 соответственно.
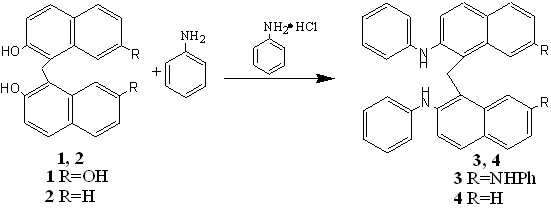
Данные, приведённые в патенте, и послужили отправной точкой для нашей работы.
1. Аминолиз 2,2',7,7'-тетрагидроксидинафтилметана
Согласно методике, указанной в патенте, мы нагревали смесь динафтилметана 1, анилина и гидрохлорида анилина 6 ч. при 200С. Исследование выделенных продуктов с использованием современных физико-химических методов анализа показало, что полученные нами результаты отличаются от данных, приведенных авторами патента, и свидетельствуют о необычном протекании процесса, не укладывающемся в рамки ранее изученных реакций аминирования нафтолов.
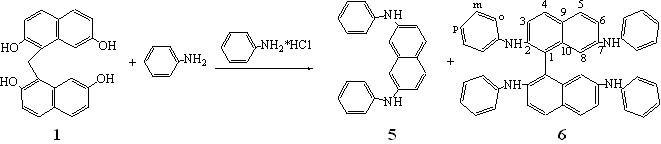
Во-первых, взаимодействие завершалось образованием двух продуктов, выходы которых после разделения на колонке составляли 38 (6) и 3 (5) %.
Во-вторых, в спектрах ЯМР 1Н, 13С обоих полученных соединений отсутствовали сигналы протонов и атома углерода метиленового звена (рис. 1). В спектрах ЯМР 1Н фиксировались сигналы протонов фенильных и нафтильных колец, а также сигнал в области, характерной для NН протонов, в спектрах ЯМР 13С - только сигналы атомов углерода ароматических ядер.

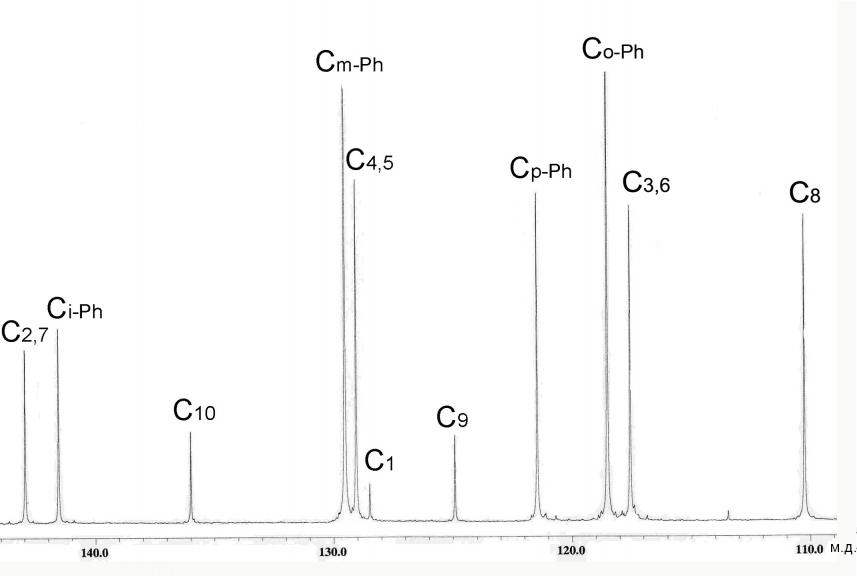
Рисунок 1. Спектры ЯМР 1Н (а) и 13С (б) соединения 6
В третьих, по данным масс-спектрометрии масса основного продукта соответствовала 2,2',7,7'-тетра(фениламино)бинафтилу 6, масса минорного продукта - 2,7-бис(фениламино)нафталину 5.
С целью интенсификации процесса мы осуществили приведенную выше реакцию в микроволновом реакторе СЕМ Discover, что позволило снизить температуру взаимодействия до 145°С, сократить его время до 2 ч. и повысить выходы аминированных продуктов 5, 6 до 5 и 58%, соответственно. В то же время маршрут реакции остался неизменным. В обоих рассмотренных случаях замещение гидроксильных групп в динафтилметане 1 было сопряжено с расщеплением мостиковых С-С связей и элиминированием метиленового звена.
Полученные нами результаты и имеющиеся литературные данные позволяли предположить, что взаимодействие динафтилметана 1 с анилином протекает по схеме 1. Процесс начинается аналогично реакции Бухерера с согласованного протонирования в нафталиновых ядрах углеродных атомов с повышенной электронной плотностью и образования стабилизированных сопряжением систем a и b, которые далее вступают в реакцию с амином. В результате последующих преобразований молекула теряет ароматичность, восстановление которой может происходить двумя путями (I, II).
 Схема 1. Схема аминолиза 1 первичными аминами и аммиаком
Схема 1. Схема аминолиза 1 первичными аминами и аммиаком
По одному из них (I) за счет перераспределения электронной плотности в интермедиате f осуществляется разрыв С-С связей, отщепляются вода и формальдегид и образуются две молекулы аминонафтола g, последующее аминирование которых приводит к диаминонафталину h.
Второй путь (II) включает в себя перегруппировку в интермедиате f, приводящую к образованию новой С-С связи между аминированными по положениям 2,2' -нафталиновыми блоками. Такое протекание процесса возможно при наличии в интермедиате f дополнительной пары гидроксильных групп в положениях 7,7', которые подают электронную плотность атомам углерода в положениях 8,8', сближенным в пространстве с углеродными атомами в положениях 1,1'. За счет трансаннулярного взаимодействия между атомами углерода в положениях 1,8' или 1',8 происходит завязывание новой С-С связи и элиминирование метиленового звена, что приводит к 1,8'-бинафтилу l. Реакция завершается аминолизом двух оставшихся гидроксильных групп и образованием 1,1'-бинафтила m.
Разветвление реакционного трека и приведенный на схеме 1 путь образования бинафтила m подтверждаются двумя дополнительными экспериментами. Во-первых, мы провели аминирование 2,7-дигидроксинафталина 7 анилином в тех же условиях, что и динафтилметана 1 и показали, что в результате реакции образуется только один продукт, 2,7-бис(фениламино)нафталин 5. Следовательно, в использованных нами условиях аминолиза соединения 1 образование новой С-С связи не может происходить за счет сшивки двух молекул диаминонафталина 5.
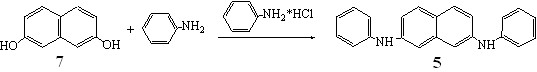
Во-вторых, мы осуществили взаимодействие с анилином 2,2'-дигидроксидинафтилметана 2, имеющего только одну пару гидроксильных групп. Так же, как и при аминировании тетрагидроксидинафтилметана 1, реакция протекала с расщеплением мостиковых С-С связей, но сшивки нафталиновых колец в этом случае не происходило, процесс завершался образованием 2-фениламинонафталина 8. Данный факт подтверждает влияние заместителей в положении 7,7' молекулы динафтилметана 1 на перераспределение электронной плотности в интермедиате f (схема 1), и, следовательно, на регионаправленность процесса в целом.

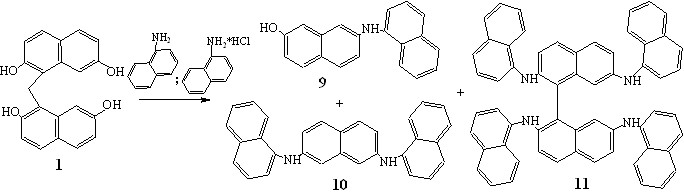
Для изучения влияния на регионаправленность процесса природы аминирующего реагента во взаимодействие с динафтилметаном 1 были введены первичные амины с различными заместителями у атома N (-нафтиламин, втор-бутиламин, циклогексиламин, гексиламин) и аммиак. Реакции проводили в микроволновом реакторе CEM Discover при 140-150С в присутствии солей аминов. Образовавшиеся аминонафталины выделяли с использованием колоночной хроматографии.
При взаимодействии динафтилметана 1 с -нафтиламином. основными продуктами реакции были моно- и диаминированные нафталины 9, 10, выходы которых составили 23 и 21%, соответственно. Тетрааминированный бинафтил 11 был выделен с выходом 8%. Можно предположить, что низкий выход соединения 11 обусловлен большим объемом аминонафтильных заместителей в положениях 2,2', затрудняющим трансаннулярное взаимодействие между атомами углерода в положениях 1,8' в интермедиате f (схема 1), а, следовательно, и создание С-С связи между нафталиновыми ядрами ароматического остова.
Сделанному нами предположению соответствуют результаты, полученные при аминолизе динафтилметана 1 аминами с объемными алифатическими заместителями у атома N. Во всех случаях реакции развивались исключительно по пути I (схема 1) с разрывом мостиковых С-С связей между двумя нафталиновыми ядрами в молекуле 1 и образованием моно- и диаминированных нафталинов (g, h, соответственно). Степень замещения гидроксильных групп на аминогруппы и соотношение образующихся продуктов зависели от выбора реагента и длительности взаимодействия. Повышение температуры процесса не приводило к изменению его регионаправленности.

Так, при использовании втор-бутиламина основными продуктами являлись 2,7-бис(втор-бутиламино)нафталин 12 и 7-втор-бутиламинонафт-2-ол 13, выходы которых составили 24 и 8%, соответственно. При аминировании 1 циклогексиламином выход 2,7-бис(циклогексиламино)нафталина 14 возрастал пропорционально увеличению длительности нагревания с 11 % (11 ч) до 21 % (30 ч), а выход 7-циклогексиламинонафт-2-ола 15 уменьшался с 23 % (11 ч) практически до 0 % (30 ч). Наиболее селективно и быстро протекало взаимодействие динафтилметана 1 с гексиламином. 2,7-Бис(гексиламино)нафталин 16, выделенный с выходом 35%, был единственным продуктом реакции.
Состав и структура соединений 12-16 были установлены с использованием масс-спектрометрии и ЯМР спектроскопии и дополнительно подтверждены встречным синтезом бис(гексиламино)нафталина 16 прямым аминированием 2,7-дигидрокси-нафталина 7 гексиламином.
О симметричной структуре диаминонафталинов 12, 14, 16 свидетельствовало наличие трех дублетов протонов нафталинового ядра с равными интегральными интенсивностями в спектрах ЯМР 1Н, а так же присутствие трех синглетов третичных атомов углерода, двух синглетов нефункционализированных четвертичных атомов углерода и одного слабопольного сигнала углеродных атомов (С2,7), связанных с аминогруппой, в спектрах ЯМР 13С.
Наличие 6 сигналов нафтильных протонов в спектрах ЯМР 1H, а также 6 сигналов третичных углеродных атомов и 2 сигналов функционализированных четвертичных углеродных атомов с химическими сдвигами, соответствующими атомам углерода, связанным с амино- и гидроксо-группами, в спектрах ЯМР 13С, подтверждало образование несимметричных моноаминированных нафталинов 13, 15.
Взаимодействие динафтилметана 1 c аммиаком протекало аналогично аминированию 1 анилином (схема 1). Однако высокая реакционная способность введенных в нафталиновые ядра аминогрупп и наличие в реакционной смеси формальдегида, выделившегося в результате элиминирования метиленового звена, приводили к изменению маршрута реакции и образованию третьего продукта, диазепинового производного 19, выход которого составил 48%. 2,7-Диаминонафталин 17 и 2,2',7,7'-тетраамино-1,1'-бинафтил 18 были выделены с выходами 14 и 36%, соответственно.
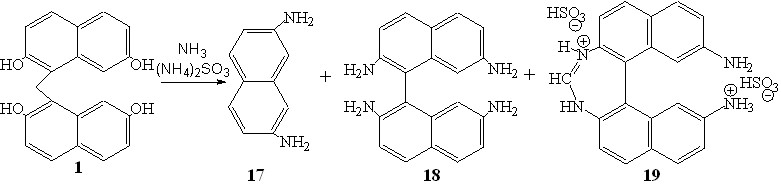
Данные MALDI, ИКС, ЯМР 1Н, 13С соединений 17, 18 полностью соответствовали их составу и структуре.
В спектре ЯМР 1Н (рис. 2) дисульфита 7,7'-диамино-1,1'-бинафтил-1,3-диазепина 19 наблюдалось четыре дублетных сигнала протонов Н3-6 и синглетный сигнал протонов Н8 нафталиновых колец c cоотношением интегральных интенсивностей IН3:IН4:IН5:IН6:IН8 = 1:1:1:1:1, что доказывало симметричность образующейся жёсткой циклической структуры.
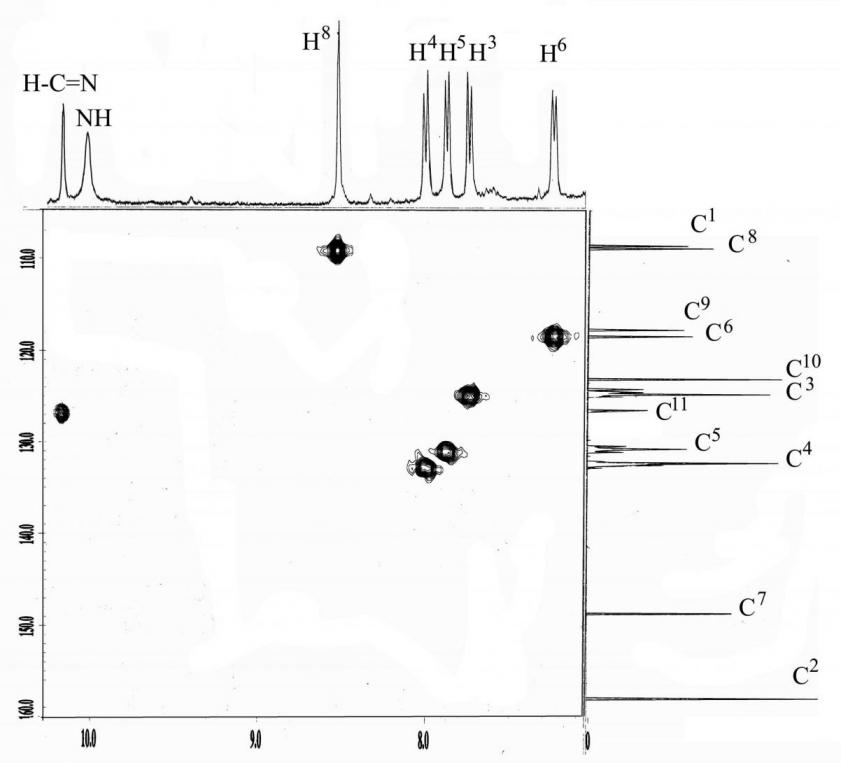
Рисунок 2. Спектр двумерной Н-С корреляции соединения 19
Кроме того, в слабом поле спектра фиксировали синглет, соответствующий протону при углероде иминного фрагмента и уширенный сигнал NH протонов. В спектре ЯМР 13С 19 (рис. 2) присутствовало 5 синглетных сигналов третичных углеродных атомов и 3 сигнала нефункционализированных четвертичных углеродных атомов нафталиновых колец, сигнал третичного атома углерода иминного фрагмента, а также слабопольные сигналы четвертичных атомов углерода, связанных с амино (148.7 м.д.) и имино (158 м.д.) группами. Данные элементного анализа и MALDI для соединения 19 полностью соответствовали предложенной диазепиновой структуре.
2. Синтез олигоаминированных динафтилметанов
В связи с тем, что прямое аминирование 2,2',7,7'-тетрагидроксидинафтилметана 1 аммиаком и первичными аминами сопровождалось деструкцией остова исходной молекулы, мы решили изменить стратегию синтеза его аминосодержащих производных и использовать для этой цели каталитическое аминирование тозильных и трифлатных производных динафтилметана.
Взаимодействие тетрагидроксидинафтилметана 1 с п-толуолсульфохлоридом и ангидридом трифторметансульфоновой кислоты проводили в пиридине при 20-25оС в течение 48 ч. Реакции протекали по классической схеме за счет электрофильного замещения атомов водорода в гидроксильных группах 1 и завершались образованием 2,2',7,7'-тетратозил- (20) и -тетра(трифторметансульфонил)- (21) динафтилметанов, выделенных с выходами 69 и 67%, соответственно.
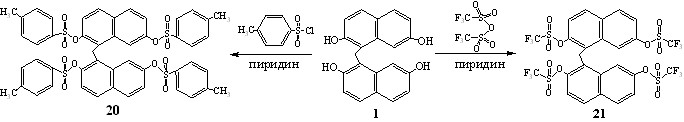
Состав и структура соединений 20, 21 полностью подтверждались данными элементного анализа, MALDI и спектроскопии ЯМР 1Н, 19F, 13С. Так, например, в спектре ЯМР 1Н тетратрифлатодинафтилметана 21 отсутствовали сигналы OH-протонов и фиксировались 5 дублетов нафталиновых протонов и синглет метиленовых протонов мостика. В спектре ЯМР 19F 21 наблюдали два синглетных сигнала с близкими химическими сдвигами: -72.9, -73.2 м.д., в спектре ЯМР 13С - два слабопольных синглета с 146.4 и 148.3 м.д. атомов углерода, связанных с трифлатными группами, что обусловлено неэквивалентностью трифторметансульфонильных фрагментов, расположенных в положениях 2 и 7.
Тетрафункционализированные динафтилметаны 20, 21 были введены в реакции с аминами. Попытки замещения тозильных групп на аминогруппы в тетратозилате 20 с использованием различных методик не привели к положительным результатам. Получить аминопроизводные динафтилметана удалось только при каталитическом аминировании тетратрифлата 21.
Взаимодействие 21 с анилином и гексиламином осуществляли при 110C в присутствии катализатора (Pd(OAc)2, BINAP) и Cs2CO3 в течение 5 ч.
Реакция 21 с анилином протекала селективно и завершалась образованием 2,2'-дитрифлато-7,7'-ди(фениламино)-динафтилметана 22, выделенного с выходом 70%.
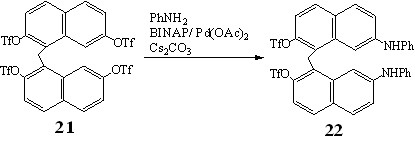
Наличие сигналов атомов Н и С метиленового звена в спектрах ЯМР 1Н и 13С соединения 22 указывало на сохранение структуры исходного динафтилметана, а соотношение интегральных интенсивностей сигналов протонов нафталиновых и бензольных ядер в спектре ЯМР 1Н и данные MALDI свидетельствовали о замещении на фениламиногруппы только двух трифлатных фрагментов.
Присутствие в спектре ЯМР 19F динафтилметана 22 одного синглетного сигнала с химическим сдвигом -73.2 м.д., а в спектре ЯМР 13С – по одному сигналу атомов углерода, связанных с амино ( 143.1 м.д.) и трифлатной ( 146.3 м.д.) группами, позволяло предположить, что замещение происходило у одинаковых атомов углерода либо в положениях 2,2', либо в положениях 7,7'.
Для выяснения этого вопроса был проведен специальный эксперимент. В использованных для синтеза соединения 22 условиях мы осуществили трифлатирование 2,2'-дигидроксидинафтилметана 2.
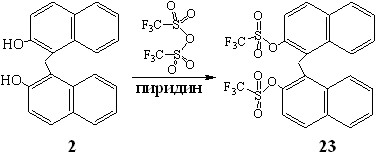
Химический сдвиг -73.2 м.д. синглетного сигнала, зафиксированного в спектре ЯМР 19F 2,2'-дитрифлатодинафтилметана 23 был идентичен таковому в спектре диамина 22, а химический сдвиг атомов углерода в положениях 2,2', связанных с трифлатными группами, в спектре ЯМР 13С 23 (145.6 м.д.) аналогичен слабопольному сигналу (146.3 м.д.), имеющемуся в спектре 22. Приведенные данные свидетельствовали о том, что аминирование тетратрифлата 21 происходило по более открытым положениям 7,7'. Дополнительным доказательством сделанного вывода служило отсутствие взаимодействия дитрифлата 23 с анилином в условиях аминирования тетратрифлата 21.
Селективность реакции тетратрифлатодинафтилметана 21 с гексиламином была гораздо ниже, чем в предыдущем случае. С использованием колоночной хроматографии из реакционной смеси с выходами 12 и 13% были выделены два основных продукта: 2,7'-бис(гексиламино)-2',7-бис(трифторметансульфонил)-динафтилметан 24 и 2,2',7,7'- тетракис(гексиламино)динафтилметан 25.
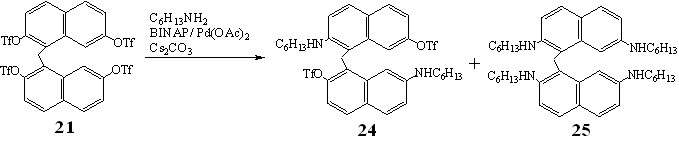
Следует отметить, что аминированные динафтилметаны 24, 25 были выделены в виде комплексов с молекулой ангидрида трифторметансульфоновой кислоты, о чем свидетельствуют данные масс-спектрометрии и спектроскопии ЯМР 19F.
В спектре ЯМР 19F диамина 24 фиксировали три синглетных сигнала, два из которых ( -72.8 и -73.3 м.д.) принадлежали атомам фтора трифлатных групп в положениях 7 и 2, третий, с -73.0 м.д., ангидриду трифторметансульфоновой кислоты. Наличие двух сигналов трифлатных фрагментов в спектре ЯМР 19F и удвоение сигналов ароматических протонов в спектре ЯМР 1Н указывали на различное расположение трифлатных и аминогрупп в молекуле 24.
Наличие в спектре ЯМР 19F соединения 25 одного синглетного сигнала ( -73.0 м.д.), соответствующего ангидриду трифторметансульфоновой кислоты, а в спектре ЯМР 1Н пяти сигналов ароматических протонов с равными интегральными интенсивностями доказывало образование тетраминированного динафтилметана 25.
3. Фосфорилирование динафталиновых систем
В связи с тем, что производные бинафталинов, особенно фосфорсодержащие, нашли широкое применение в металлокомплексном катализе нами было рассмотрено фосфорилирование тетра(фениламино)бинафтила 6 и тетрагидроксидинафтилметана 1 реагентами трехвалентного фосфора.
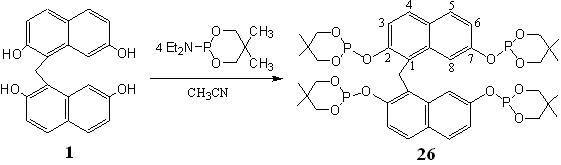
Тетрагидроксидинафтилметан 1 легко реагировал с 2-диэтиламидо-5,5-диметил-1,3,2-диоксафосфинаном при комнатной температуре. Тетрафосфорилированный динафтилметан 26 кристаллизовался непосредственно из реакционной смеси и был выделен с выходом 60%.
В отличие от соединения 1 тетра(фениламино)бинафтил 6 не взаимодействовал с неопентиленамидом даже при длительном нагревании (30 дней, 90-100оС) реакционных смесей. Поэтому в качестве фосфорилирующего реагента был использован обладающий более высокой реакционной способностью 5,5-диметил-2-хлоро-1,3,2-диоксафосфинан.
Взаимодействие 6 с неопентиленхлорфосфитом протекало при 20С и также, как в предыдущем случае, приводило к тетрафосфорилированному продукту 27. Однако выделить его в чистом виде не удалось, поэтому соединение 27 без выделения из реакционной смеси подвергли сульфуризации. Тионамидофосфат 28 самопроизвольно выпадал в осадок из реакционной смеси, выход его составил 54%.
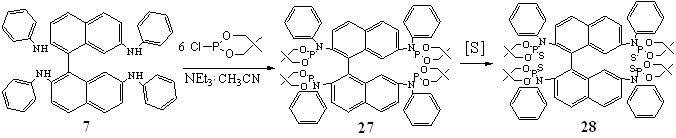
Данные элементного анализа, масс-спекрометрии и спектроскопи ЯМР соединений 26, 28 полностью соответствовали приведенным формулам.
С целью получения макрофосфоциклических призводных во взаимодействие с динафталинами 1, 6 были введены диамид и дихлорангидрид изопропилфосфита. Реакции осуществляли при 20-25С и соотношении динафталин: фосфит 1: 2. Циклофосфорилирование динафтилметана 1 тетраэтилдиамидоизопропилфосфитом завершалось образованием соединения 29, содержащего один двадцатичетырёхчленный и два восьмичленных гетероцикла. Выход макроцикла 29 составил 55 %.
В спектре ЯМР 31P соединения 29 вследствие наложения сигналов ядер атомов фосфора 24-членного цикла наблюдалось три синглета с 125.8, 129.0 и 129.8 м.д. и соотношением интегральных интенсивностей 2:1:1 соответственно. В спектре ЯМР 1Н фиксировали сигналы протонов изопропильных фрагментов и удвоение сигналов ароматических протонов и метиленовых протонов мостика, которое говорило о различном расположении в пространстве нафтильных колец относительно друг друга.
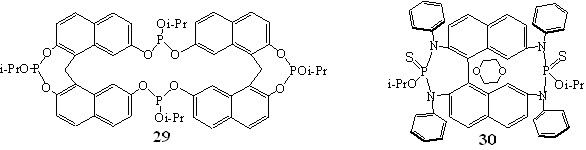
Взаимодействие тетракис(фениламино)бинафтила 6 с изопропилдихлорфосфитом приводило к образованию смеси продуктов, выделить которые в трехвалентном состоянии не удалось. После добавления к реакционной смеси серы в спектре ЯМР 31Р фиксировали два синглетных сигнала с химическими сдвигами 63.2 и 61.9 м.д. Продукты реакции выделяли с использованием колоночной хроматографии. Одно из полученных веществ идентифицировать не удалось. Второе вещество 30, выход которого составил 5%, по данным физико-химических исследований содержало в своём составе 2 гетероцикла: семичленный и одиннадцатичленный.
По данным масс-спектрометрии и спектроскопии ЯМР 1Н (рис. 3) соединение 30 образует комплекс с молекулой диоксана. Соотношение интегральных интенсивностей сигналов алкильных и ароматических протонов в спектре ЯМР 1Н 30 соответствовало макроциклическому производному, в котором на один бинафталиновый остаток приходится две изопропокси-группы и одна молекула диоксана.
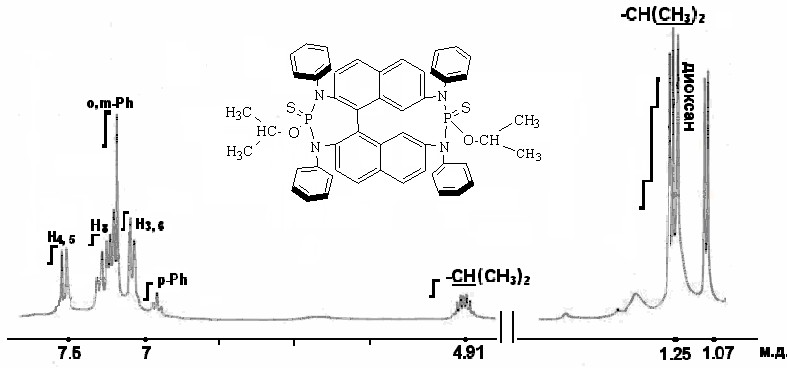
Рисунок 3. Спектр ЯМР 1Н соединения 30
Большой сдвиг сигнала метиленовых протонов диоксана в сильнопольную область, обусловлен тем, что он находится в области экранирования ароматических колец макроцикла.
4. Комплексообразование 2,2’,7,7’-тетра(фениламино)-1,1’-бинафтила с солями переходных металлов
В качестве комплексообразователей для получения координационных соединений на основе тетра(фениламино)бинафтила 6 были использованы соли переходных металлов CuCl, AgNO3 и FeBr2. Реакции проводили при комнатной температуре, варьируя растворители и соотношение реагентов.
Взаимодействие тетраамина 6 с CuCl осуществляли при соотношении лиганд: металл 1: 2. По данным элементного анализа в образовавшемся комплексе 31 на одну молекулу лиганда приходилось два металлофрагмента. Учитывая данные ЯМР 1Н и склонность хлорида меди к образованию полимерных координационных соединений, можно предположить, что 31 имеет олигомерную или полимерную структуру, где атомы меди координированы азотом двух бинафталиновых лигандов.

Взаимодействие бинафтила 6 с AgNO3 проводили при соотношениях 6: AgNO3 1: 2, 1: 3, 1: 4. Смешение реагентов осуществляли тремя способами. 1) При первоначальном соотношении 6: AgNO3 1: 2 добавляли порционно к реакционной смеси нитрат серебра, полностью комплексообразование завершалось только при соотношении 6: AgNO3 1: 4. 2) К раствору 6 в хлористом метилене в течение 5 ч прикапывали раствор AgNO3 в метаноле, реакция заканчивалась, когда соотношение лиганд: металл достигало 1: 4. 3) Раствор 6 и AgNO3, взятых в соотношении 1: 4 выдерживали 2 ч. Во всех случаях наблюдалось образование одного и того же продукта комплексообразования. По данным MALDI и элементного анализа комплекс 32 содержал в молекуле 3 металлофрагмента. В спектре ЯМР 1Н 32 фиксировали удвоение количества сигналов протонов фенильных групп по сравнению со спектром свободного лиганда 6, что обусловлено магнитной и химической неэквивалентностью фенильных фрагментов в положениях 2,2' и 7,7'.
Исходя из имеющихся данных, можно предположить, что атомы Ag в 32 имеют различную координацию: один из них координирован двумя атомами N сближенных в пространстве фениламиногрупп в положениях 2,2', каждый из двух других координирован атомом N разобщенных в пространстве фениламиногрупп, находящихся в положениях 7,7'.
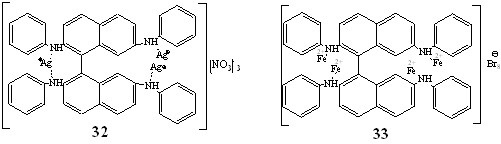
Комплексообразование 6 с FeBr2 осуществляли варьируя соотношения лиганд: металл от 1:2 до 1:5, наиболее эффективно процесс протекал при соотношении 6: FeBr2 1: 5. Данные масс-спектрометрии и элементного анализа комплекса 33 соответствовали наличию в его молекулах 4 металлофрагментов. В спектре ЯМР 1Н 33 фиксировали сигналы всех протонов лиганда 6 с несколько измененными химическими сдвигами. В спектре ЯМР 13С наблюдали увеличение количества сигналов атомов углерода фенильных колец по сравнению со спектром свободного лиганда 6, что обусловлено неэквивалентностью фенильных фрагментов в молекуле четырехядерного комплекса 33.
ВЫВОДЫ
- Исследовано взаимодействие 2,2',7,7'-тетрагидроксидинафтилметана с первичными аминами различной природы и аммиаком. Продемонстрирована уникальность данного процесса: во всех рассмотренных случаях замещение гидроксильных групп в тетрагидроксидинафтилметане сопряжено с расщеплением С-С связей и элиминированием метиленового звена. Дальнейшая регионаправленность реакции определяется влиянием природы введенных в нафталиновые кольца аминогрупп на конформационное состояние ароматического остова.
- Установлено, что при реакции тетрагидроксидинафтилметана с анилином основным продуктом является 2,2',7,7'-тетракис(фениламино)-1,1’-бинафтил, образующийся за счет создания новой С-С связи вследствие трансаннулярного взаимодействия между атомами углерода С1 одного и С8' второго нафталинового кольца динафтилметана.
- Показано, что наличие объемых заместителей в аминогруппах, введенных в нафталиновые ядра динафтилметана, затрудняет трансаннулярное взаимодействие и препятствует образованию новой С-С связи.
- Доказано, что при использовании в качестве реагентов первичных аминов с объемным алифатическим заместителем у атома азота реакция завершается образованием 7-органиламинонафт-2-олов и 2,7-бис(органиламино)нафталинов.
- Установлено, что наличие в положениях 2,2’ нафталиновых колец динафтилметана сближенных в пространстве первичных аминогрупп, вводимых при использовании в качестве аминирующего агента аммиака, приводит к образованию диазепинового производного динафтилметана.
- Разработан двустадийный путь синтеза аминированных динафтилметанов, базирующийся на трифлатировании 2,2',7,7'-тетрагидроксидинафтилметана и последующем каталитическом замещении трифлатных фрагментов на аминогруппы.
- Взаимодействием 2,2',7,7'-тетра(фениламино)-1,1'-бинафтила с хлорангидридами кислот трехвалентного фосфора синтезированы его тетрафосфорилированное и гетероциклическое производные, координацией c солями переходных металлов (CuCl, AgNO3, FeBr2) - комплексы, состав и структура которых зависели от природы используемого комплексообразователя.
Основное содержание диссертации отражено в следующих публикациях:
- Э.Е. Нифантьев, В.И. Масленникова, Т.Ю. Сотова, Л.К. Васянина, Л.В. Шеленкова / Новое семейство макрофосфоциклических соединений // Доклады Российской Академии Наук. 2007. Т. 414. Вып. 3. С. 343-345 (0.18 п.л., авторский вклад 30 %)
- В. И. Масленникова, Т. Ю. Сотова, Л. К. Васянина, Л. В. Шеленкова, Э. Е. Нифантьев / Тетрафункционализированные производные 2,2',7,7'-тетрагидроксидинафтилметана // Журнал общей химии. 2008. Т. 78. Вып. 11. С. 1870 – 1877 (0.5 п.л., авторский вклад 30 %)
- E.E. Nifantyev, V.I. Maslennikova, L.V. Shelenkova, I.I. Levina, D.M. Polekhin / Synthesis and phosphorylation of 2,2',7,7'-tetra(phenylamino)-1,1'-binaphthalene // Mendeleev Communication. 2009. Vol. 19. Р. 101-102 (0.12 п.л., авторский вклад не распределен)
- Maslennikova V.I., Sotova T.Yu., Shelenkova L.V., Adamson O.S., Dementyev A.I., Nifantyev E.E. / Supramolecular correction of the regiodirection of 2,2',7,7'-tetrahydroxydinaphthylmetane phosphorylation.// IV-th international symposium “Molecular design and synthesis of supramolecular architectures”. Book of abstracts. Kazan. Russia. 2006. Р.62 (0.06 п.л., авторский вклад не распределен)
- Т.Ю. Сотова, Л.В. Шеленкова, В.И. Масленникова. Э.Е. Нифантьев / Макрогетероциклические соединения на основе 2,2',7,7'-тетрагидроксидинафтилметана // XVIII Менделеевский съезд по общей и прикладной химии. 2007. Москва. Сборник тезисов докладов. М.: Граница. С. 443 (0.06 п.л., авторский вклад не распределен)
- Л.В. Шеленкова, Т.Ю. Сотова, В.И. Масленникова, Э.Е. Нифантьев / Функционализированные производные 2,2',7,7'-тетрагидроксидинафтилметана // XVIII Менделеевский съезд по общей и прикладной химии. 2007. Москва. Сборник тезисов докладов. М.: Граница. С.515 (0.06 п.л., авторский вклад не распределен)
- L.V. Shelenkova, V.I. Maslennikova, A.V. Burikhina, D.M. Polekhin, E.E. Nifantiev / Synthesis and phosphorylation of 1,1'-binaphthalene-2,2',7,7'-tetraphenylamine // XV-th international conference on chemistry of phosphorus compounds. Saint-Petersburg. Russia. Book of abstracts. С-Пб.: Издательство «Теза». 2008. P. 220 (0.06 п.л., авторский вклад не распределен)
- Burikhina A.V., Shelenkova L.V., Maslennikova V.I., Nifantiev E.E. / The amination of polyhydroxyaromatic compaunds // Fifth International Conference on Organic Chemistry for Young Scientists. Saint-Petersburg. Russia. Book of abstracts. С-Пб.: Издательство «Лема». 2009. P. 108 (0.06 п.л., авторский вклад не распределен)
- Масленникова В.И., Шеленкова Л.В., Полехин Д.М., Нифантьев Э.Е. / Фосфоциклические производные динафталиновых систем // Всероссийская конференция «Итоги и перспективы химии элемент-органических соединений», посвященная 110-летию со дня рождения академика А.Н.Несмеянова. Москва. Сборник тезисов докладов. М.: ИНЭОС РАН. 2009. С. 46 (0.06 п.л., авторский вклад не распределен)
- Шеленкова Л.В., Масленникова В.И., Полехин Д.М., Нифантьев Э.Е. / Прямое аминирование 2,2',7,7'-тетрагидроксидинафтилметана // Всероссийская конференция по органической химии. Москва. Сборник тезисов докладов. М.: ИОХ РАН. 2009. С. 456 (0.06 п.л., авторский вклад не распределен)
- Шеленкова Л.В., Масленникова В.И., Нифантьев Э.Е. / Регионаправленность взаимодействия 2,2',7,7'-тетрагидроксидинафтил метана с первичными аминами и аммиаком // International Symposium on Advanced Science in Organic Chemistry. Miskhor, Crimea. Book of abstracts. 2010. P. 243 (0.06 п.л., авторский вклад не распределен)

