Газочувствительность полупроводниковых оксидов металлов как результат химических превращений и химических реакций на каталитически активных поверхностях
РОССИЙСКИЙ НАУЧНЫЙ ЦЕНТР “КУРЧАТОВСКИЙ ИНСТИТУТ”
На правах рукописи
УДК 544. 723
МАЛЫШЕВ ВАЛЕРИЙ ВАЛЕНТИНОВИЧ
ГАЗОЧУВСТВИТЕЛЬНОСТЬ ПОЛУПРОВОДНИКОВЫХ ОКСИДОВ МЕТАЛЛОВ КАК РЕЗУЛЬТАТ ХИМИЧЕСКИХ ПРЕВРАЩЕНИЙ И ХИМИЧЕСКИХ РЕАКЦИЙ НА КАТАЛИТИЧЕСКИ АКТИВНЫХ ПОВЕРХНОСТЯХ
Специальность 01.04.17.
Химическая физика, в том числе физика горения и взрыва
Автореферат диссертации на соискание ученой степени
доктора физико-математических наук
Москва - 2008 г.
Работа выполнена в Институте молекулярной физики Российского научного центра “Курчатовский институт”
Научный консультант по вопросам химии доктор химических наук В. К. Ежов
Официальные оппоненты:
Гордон Евгений Борисович - доктор физико-математических наук, Институт проблем химической физики РАН
Набиев Шавкат Шарифович - доктор физико-математических наук, Российский научный центр «Курчатовский институт»
Трахтенберг Леонид Израйлевич - доктор физико-математических наук, Институт химической физики им. Н. Н. Семенова РАН
Ведущая организация Научно-исследовательский физико-химический институт им. Л. Я. Карпова, ФГУП (НИФХИ)
Защита состоится __________________________ на заседании диссертационного совета Д 520.009.05 в РНЦ “Курчатовский институт” в____ час. ____ мин. по адресу: 123182, Москва, площадь Академика Курчатова, д. 1.
С диссертацией можно ознакомиться в библиотеке Российского научного центра “Курчатовский институт”
Автореферат разослан ________________________________________________________
Ученый секретарь диссертационного совета
доктор химических наук В. Ф. Серик
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы. Актуальность выбранной темы диссертации определяется необходимостью решения целого ряда проблем по химическим превращениям и химическим реакциям газов на каталитически активных поверхностях полупроводниковых оксидов металлов (ПОМ), нашедших в настоящее время широкое применение в качестве первичных преобразователей концентрации газов в окружающем воздухе. К ним относятся:
- Хемосорбция молекул кислорода и воды на поверхности ПОМ, формирование «кислородно-гидроксильного» слоя (далее КГС), определение его состава и температурных границ. КГС создает каталитически активную поверхность и играет, наряду с естественными дефектами ПОМ «биографического» происхождения, роль активных центров, на которых, по существу, и происходят реакции диссоциации и химические реакции взаимодействия продуктов диссоциации с реакционноспособными ион-радикалами кислорода и отрицательно заряженными гидроксильными группами, входящими в состав КГС. От свойств КГС зависят сопротивление и проводимость ПОМ, характер их зависимости от температуры и, в конечном счете, газочувствительность к анализируемым газам. В свою очередь газочувствительность и проводимость ПОМ, как непосредственно измеряемые на опыте физические величины, являются достаточно объективными инструментальными средствами для исследования указанных процессов на каталитически активных поверхностях.
Процесс хемосорбции кислорода и молекул воды, с нашей точки зрения, изучен недостаточно, и данные разных авторов нередко противоречивы. В литературе отсутствуют экспериментальные данные по температурным границам существования хемосорбированных ионов кислорода и гидроксильных групп, а также связи КГС с электрофизическими параметрами ПОМ. Указанные вопросы наряду с реакционными способностями КГС, определяющими свойства и специфику ПОМ, являются, по существу, одними из ключевых вопросов в проблеме катализа и каталитических реакций на поверхности ПОМ. Изучение данного вопроса имеет не только научный интерес, но и большое практическое значение с точки зрения газочувствительности ПОМ.
- Влияние паров воды в воздухе или его влажности на показания (сопротивление, проводимость) ПОМ. Этому вопросу посвящено достаточно большое число публикаций, однако, данные разрознены, их трудно систематизировать. Результаты исследований газочувствительности к самим парам воды в литературе отсутствуют, хотя они могли бы ответить на многие поставленные выше вопросы.
- Проблема газочувствительности различных типов ПОМ к выбранным нами газам. Как показал литературный обзор публикаций, этому вопросу уделено достаточно большое внимание, однако, данные разных авторов нередко противоречивы и, что главное, не подлежат систематизации. Для построения эмпирических уравнений для концентрационных зависимостей в основном использовались данные для чувствительности, которая, как показали наши исследования, не может быть мерой концентрации газов. Для использования ПОМ в практических целях требуются результаты, основанные на систематических исследованиях структур, изготовленных из материалов, произведенных на предприятиях России, а эмпирические уравнения для концентрационных зависимостей должны быть построены по данным для сопротивления ПОМ, которое является единственной мерой концентрации газов.
- Каталитическая активность ПОМ, которая по определению является главной характеристикой для любого катализатора. Она включает в себя такие параметры, как быстродействие, тип реакций взаимодействия ПОМ с анализируемыми газами, селективность ПОМ к конкретным газам. Указанные вопросы в литературе освещены слабо, имеющиеся отдельные данные по быстродействию противоречивы и нередко не соответствуют действительности. В литературе также отсутствуют сведения о принадлежности реакций газов к определенному типу каталитических реакций. Вопросы селективности сводятся в основном к проблемам перекрестной чувствительности и никак не связываются с типом каталитических реакций газов на поверхности ПОМ.
- Систематизация химических реакций, протекающих в процессе контактов газов с поверхностью ПОМ. Реакций, объясняющих механизмы взаимодействия ПОМ с газовыми примесями, в литературе приведено достаточное количество, но отсутствует системный подход при их рассмотрении. Нередко отсутствуют сведения о балансе электронов, участвующих в реакциях ионов кислорода и, особенно, гидроксильных групп, входящих в состав КГС. Отсутствуют также сведения о реакциях регенерации ПОМ в сухом и влажном воздухе после удаления газов.
- Актуальность работы предопределяется выбором газов и типов ПОМ для проведения исследований. В работе использовались наиболее востребованные на сегодня газы с точки зрения пожарной безопасности (СН4 и Н2), экологии окружающего воздуха (СН4, СО, NH3, NO), безопасности и здоровья персонала при работе с взрывоопасными (CH4, H2) и токсичными (CO, NH3, NO) газами. В исследованиях использовался наиболее распространенный, химически стойкий, стабильный и изученный тип ПОМ – двуокись олова (SnO2), в порошок которого с целью повышения чувствительности и снижения рабочих температур добавлялись различные каталитические добавки.
- Подавляющее большинство экспериментальных исследований по газочувствительным и динамическим характеристикам ПОМ в смесях воздуха с различными газами выполнено зарубежными специалистами. В РФ таких систематических и широкомасштабных исследований практически не проводилось.
Цель и задачи исследований. На основании перечисленных выше проблем вырисовывается ряд ключевых задач по проблемам хемосорбции молекул кислорода и воды на поверхности ПОМ, каталитической активности ПОМ, механизма взаимодействия газов с ПОМ, а также проблемам сенсорной диагностики, которые требуют своего решения. Для этого необходимо выполнить работы по следующим направлениям:
- Исследовать проводимость ПОМ в сухом воздухе в максимально возможном интервале температур, что позволит получить информацию о закономерностях и температурных границах формирования хемосорбированных ионов кислорода на поверхности ПОМ («кислородной» части КГС).
- Исследовать газочувствительность к парам воды нескольких типов ПОМ в максимальном интервале влажности от 0 до 100% RH и температур ПОМ. Такие исследования позволят составить представление о закономерностях и температурных границах формирования «гидроксильной» части КГС (ионов ОН).
- На основании результатов исследований проводимости ПОМ в сухом и влажном воздухе определить состав кислородно-гидроксильного слоя (КГС), что позволит интерпретировать закономерности чувствительности ПОМ к газам и ее зависимости от влажности газовой среды.
- Провести исследования температурной зависимости чувствительности нескольких типов ПОМ к различным газам в сухом воздухе в широком диапазоне температур при одинаковой концентрации анализируемых газов. Такие исследования, проведенные в идентичных условиях, позволят получить представления о влиянии каталитических добавок в слой SnO2 на чувствительность ПОМ, а также определить оптимальные температурные режимы при эксплуатации сенсоров.
- Исследовать концентрационную зависимость для нескольких типов ПОМ и поименованным выше газам в широком, практически важном, диапазоне концентраций и максимальном диапазоне изменения влажности воздушно-газовой среды от 0 до 100 % RH. Такие исследования позволят установить степень влияния влажности на показания ПОМ, определить лучшую структуру ПОМ для регистрации каждого газа в метрологически корректной влажной воздушно-газовой среде (стандартная атмосфера с влажностью от 0 до 100% RH и только одна конкретная газовая примесь), определить эмпирические зависимости сопротивления ПОМ от концентрации газа, описывающие опытные данные с наименьшей погрешностью в возможно большем интервале концентраций газов и влажности газовой среды. Такие исследования позволят также оценить дрейф сопротивления в чистом воздухе и воспроизводимость показаний в пределах одного цикла измерений, а также порог чувствительности для каждого газа и структуры ПОМ в сухом и влажном воздухе.
- Исследовать динамические характеристики различных структур ПОМ в сухих газовых средах. Такие исследования позволят оценить скорость реакций газов с ПОМ. На основании измеренных и вычисленных параметров для ПОМ и их тенденциях можно оценить каталитическую активность исследуемых ПОМ, установить тип их реакций с анализируемыми газами.
- Интерпретировать механизмы взаимодействия газов с поверхностью ПОМ наиболее вероятными химическими реакциями газов с КГС с соблюдением баланса электронов, хемосорбированных ионов кислорода и гидроксильных групп в каждой реакции, а также представить химические реакции регенерации ПОМ после удаления газов.
- Исследовать структуры ПОМ на длительную стабильность и воспроизводимость показаний. Такие исследования позволят сделать заключение о распределении на поверхности газочувствительного слоя ПОМ хемосорбированных ионов кислорода, групп ОН и вакансий кислорода, а также непосредственно измерить важнейший эксплуатационный параметр газовых сенсоров – воспроизводимость показаний.
Научная новизна. В процессе реализации поставленных задач и целей исследований были выполнены следующие работы:
1. Впервые выполнены исследования проводимости шести типов ПОМ на основе
чистой SnO2 и SnO2 с пятью каталитическими добавками: 3% La2O3, 3% Pd, 1% Sb2O5
+ 3% La2O3, 1% Pt + 3% Pd и 3% Pd с каталитическим слоем из Al2O3 в азоте марки ОСЧ и сухом воздухе в диапазоне от комнатной температуры до 6500С, позволившие установить ранее неизвестные закономерности для собственного полупроводника и получить новые данные по хемосорбции молекул кислорода.
2. Впервые проведены исследования чувствительности к парам воды в воздухе для семи типов ПОМ на основе чистой SnO2 и SnO2 с шестью каталитическими добавками: 3% La2O3, 3% Pd, 1% Sb2O5 + 3% La2O3, 1% Pt + 3% Pd, 3% Pd с каталитическим слоем из Al2O3 и 1% CuO. Выполнены исследования концентра-ционной зависимости для пяти типов ПОМ на основе чистой SnO2 и SnO2 с четырьмя каталитическими добавками: 3% La2O3, 3% Pd, 1% Sb2O5 + 3% La2O3, 3% Pd с каталитическим слоем из Al2O3 в диапазоне концентрации паров Н2О от 0.28 до 2.9 % об. (10 – 100 % RH) при изменении температуры ПОМ от 200 до 6000С.
3. Впервые проведены систематические исследования чувствительности (отклика) к СО, СН4, Н2, NН3, С6Н14, С2Н5ОН семи типов ПОМ на основе чистой SnO2 и SnO2 с шестью каталитическими добавками: 3% La2O3, 3% Pd, 1% Sb2O5 + 3% La2O3, 3% Pd с каталитическим слоем из Al2O3, 1% CuO в сухом воздухе при концентрации газов 200 ppm в диапазоне температур 100 – 6000С.
4. Впервые проведены исследования чувствительности (отклика) к NО шести типов ПОМ на основе чистых SnO2, ZnO и WO3, а также структур SnO2 с тремя каталитическими добавками: 3% La2O3, 1% Sb2O5 + 3% La2O3 и 1% Pt + 3% Pd в сухом воздухе при концентрации 100 ppm NО в диапазоне температур 100 – 6000С.
5. Впервые проведены систематические исследования концентрационной зависимости четырёх типов ПОМ на основе SnO2 и SnO2 с тремя каталитическими добавками: 3% La2O3, 1% Sb2O5 + 3% La2O3 и 1% Pt + 3% Pd в смесях воздуха с СО. Исследования проводились при оптимальном режиме нагрева в диапазоне концентраций 0.5 – 98 ppm СО и семи значениях влажности газовой среды 0, 10, 20, 40, 60, 80 и 100% RH.
6. Впервые проведены систематические исследования концентрационной зависимости четырёх типов ПОМ на основе чистой SnO2 и SnO2 с тремя каталитическими добавками: 3% Pd, 1% Pt + 3% Pd, 3% Pd c каталитическим слоем из Al2O3 в смесях воздуха с СН4. Исследования проводились при оптимальном режиме нагрева в диапазоне концентраций 1 - 20600 ppm СН4 и семи значениях влажности газовой среды 0, 10, 20, 40, 60, 80 и 100% RH.
7. Впервые проведены систематические исследования концентрационной зависимости
шести типов ПОМ на основе чистой SnO2 и SnO2 с пятью каталитическими добавками: 3% Pd, 3% La2O3, 1% Pt + 3% Pd, 1% Sb2O5 + 3% La2O3 и 3% Pd c каталитическим слоем из Al2O3 в смесях воздуха с Н2. Исследования проводились в режиме нагрева до температур 450 и 5000С в диапазоне концентраций 1 - 19700 ppm Н2 при семи значениях влажности газовой среды 0, 10, 20, 40, 60, 80 и 100% RH.
8. Впервые проведены систематические исследования концентрационной зависимости
четырех типов ПОМ на основе чистой SnO2 и SnO2 с тремя каталитическими добавками: 3% Pd, 3% La2O3 и 1% Pt + 3% Pd в смесях воздуха с NН3. Исследования проводились в диапазоне концентраций 0.5 - 100 ppm NН3 при шести значениях влажности газовой среды 0, 10, 20, 40, 60, и 80 % RH.
9. Впервые проведены систематические исследования концентрационной зависимости шести типов ПОМ на основе чистых SnO2, ZnO и WO3, а также структур SnO2 с тремя каталитическими добавками: 3% La2O3, 1% Sb2O5 + 3% La2O3 и 1% Pt + 3% Pd в смесях воздуха с NО. Исследования проводились при нескольких температурах нагрева в диапазоне концентраций 0.5 - 100 ppm NО при семи значениях влажности газовой среды 0, 10, 20, 40, 60, 80 и 100 % RH.
10. По результатам выполненных систематических концентрационных исследований (пп. 5 – 9) во влажном воздухе получены новые данные по зависимости сопротивления и чувствительности образцов ПОМ от влажности газовой среды. Определены оптимальные структуры ПОМ для регистрации СО, СН4, H2, NН3 и NO. Для всех исследованных газов и ПОМ получены эмпирические концентрационные зависимости, описывающие опытные данные практически во всей области концентраций в диапазоне влажности 0 (10) – 100 % RH с погрешностью до 10 - 15%.
11. Впервые получены данные для порогов чувствительности Сmin к исследованным газам во влажном воздухе и уточнены данные для сухого воздуха, значения которых, как оказалось, во много раз (иногда на порядки) ниже литературных данных.
12. Проведены исследования динамических характеристик поименованных выше типов
ПОМ для следующих газов: Н2О, CO, CH4, H2, NH3, С6Н14, С2Н5ОН и H2S в диапазоне температур от 300 до 6000С. Измерения проводились в сухих газовых смесях воздуха с двумя значениями концентрации газов, отличающимися по величине от 10 (Н2О, H2S) до 10000 (Н2, С2Н5ОН) раз. Данные по быстродействию в таком объеме и качестве получены впервые.
13. Проведены 129 – суточные испытания шести типов ПОМ с газочувствительными слоями из чистой SnO2 и SnO2 с пятью каталитическими добавками: 3% Pd, 3% La2O3, 1% Sb2O5 + 3% La2O3, 1% Pt + 3% Pd и 3% Pd c каталитическим слоем из Al2O3 на длительную стабильность и воспроизводимость показаний в газовых смесях воздуха с 16 ppm СО и 15000 ppm СН4 при различных температурах нагрева и влажности воздуха 55 % RH. Данные по воспроизводимости показаний ПОМ при длительных испытаниях ПОМ получены впервые.
14. Предложены новые схемы химических реакций взаимодействия исследованных газов с поверхностью ПОМ, протекающих по следующему сценарию: диссоциация молекул химические реакции продуктов диссоциации с хемосорбированными ионами О2- и ОН, входящими в состав КГС. При этом соблюден баланс электронов и участвующих в реакциях хемосорбированных ионов. Впервые представлены реакции регенерации ПОМ в сухом и влажном воздухе после удаления газов.
15. На основе анализа экспериментальных данных по проводимости и чувствительности
(отклика) ПОМ установлены новые критерии для определения типа реакций с ПОМ для донорных и акцепторного газа (NO) в условиях существования на их поверхности «кислородно-гидроксильного» слоя.
Достоверность результатов. Полученные в работе научные результаты отличаются своей достоверностью, поскольку исследования выполнены на прокалиброванном оборудовании с применением специально разработанной прецизионной компьютерной методики и образцовых средств измерения давления газов с классом точности 0.15 и 1.5. В качестве исходных газовых смесей использовались метрологические аттестованные поверочные газовые смеси (ПГС) и поверочный нулевой газ (ПНГ) – воздух, изготовленные на предприятии ОАО «Линде-газ» и снабженные паспортом на каждый газовый баллон. Приготовление газовых смесей с микроконцентрациями газов производилось на лабораторной газосмесительной установке по разработанной автором манометрической методике смешения газовых компонентов в баллонах из нержавеющей стали под давлением. Калибровка электроизмерительной аппаратуры производилась с помощью высокоточных сопротивлений типа С2-29 класса 0.5 и 0.25. Для изготовления исследуемых образцов ПОМ использовались химические соединения марки ЧДА. Представительность полученных результатов обеспечивалась одновременным тестированием нескольких образцов каждого типа ПОМ.
Практическая значимость результатов работы. Проведенные исследования и испытания с опытными образцами ПОМ позволили получить и систематизировать новые данные по газочувствительным и метрологическим характеристикам, нередко отличающиеся в лучшую сторону от принятых в научной среде результатов. Опытные образцы газовых сенсоров практически подготовлены для использования в качестве первичных преобразователей концентрации газов в приборах газового контроля.
Основные положения, выносимые на защиту:
1. Универсальный экспериментально измерительный комплекс с методикой проведения исследований и калибровки образцов газочувствительных датчиков разных типов в газовых смесях воздуха, азота, аргона с различными (в том числе токсичными) газами, состоящий из следующего оборудования:
- Двух газо-смесительных установок (ГСУ) для приготовления лабораторных газовых смесей в баллонах под давлением;
- Универсальной газо-динамической установки (ГДУ) с 4-мя модификациями для исследования газочувствительности к растворимым и нерастворимым в воде газам, исследования динамических параметров датчиков и модификации для исследования динамических параметров и чувствительности датчиков к парам воды;
- Комплекта электроизмерительного и компьютерного оборудования, обеспечивающего нагрев и термостабилизацию образцов ПОМ, а также проведение исследований на ГДУ, измерение показаний образцов и их запись на магнитных носителях в автоматическом режиме по программе, разработанной для PC IBM.
2. Метод измерения проводимости в качестве инструментального средства для изучения хемосорбционных явлений на каталитически активных поверхностях ПОМ.
3. Результаты впервые выполненных исследований проводимости чистой SnO2 и ПОМ на ее основе в среде инертного газа (азота) и в сухом воздухе в области температур от комнатной до 6500С, позволившие установить неизвестные ранее закономерности для полупроводников. На основании полученных экспериментальных данных впервые удалось оценить состав «кислородной» части КГС, оценить температурные границы существования хемосорбированных ионов кислорода О и О2- и их концентрацию на всех стадиях их формирования.
4. Результаты впервые выполненных исследований проводимости SnO2 и ПОМ на ее основе в сухом и влажном воздухе в области температур 200 – 6000С, позволившие экспериментально установить закономерности формирования «гидроксильной» части КГС и оценить концентрацию гидроксильных групп ОН на поверхности ПОМ.
5. Экспериментальные данные по составу кислородно-гидроксильного слоя на поверхности ПОМ и интерпретация его роли в формировании чувствительности ПОМ к газам. Показано, что концентрация хемосорбированных ионов кислорода О и О2- и гидроксильных групп ОН определяется концентрацией свободных носителей (электронов) в зоне проводимости ПОМ.
6. Результаты впервые выполненных исследований чувствительности нескольких типов ПОМ на основе SnO2 к парам воды и концентрационных исследований во влажном воздухе в диапазоне концентраций паров воды от 0 до 2.9 % об (100 % RH). Установлено, что наименьшее влияние влажности на показания образцов ПОМ наблюдается при температурах нагрева выше 450 – 5000С.
7. Результаты впервые выполненных систематических исследований чувствительности (отклика) нескольких типов ПОМ на основе чистой SnO2 и SnO2 с шестью каталитическими добавками: 3% La2O3, 3% Pd, 1% Sb2O5 + 3% La2O3, 1% Pt + 3% Pd, 1% CuO и 3% Pd с каталитическим слоем из Al2O3 в сухом воздухе к 8 газам: Н2О, СО, СН4, Н2, NH3, NO, C6H14 и C2H5OH.
8. Результаты впервые выполненных систематических исследований концентрационных зависимостей нескольких типов ПОМ в газовых смесях воздуха с СО, СН4, Н2, NH3 и NO в широком диапазоне концентраций газов при семи значениях влажности 0, 10, 20, 40, 60, 80 и 100 % RH. Для всех исследованных газов определены наилучшие структуры ПОМ, для которых получены эмпирические концентрационные зависимости, описывающие опытные данные практически во всей области исследований с погрешностью до 10 - 15%.
9. Новые данные для порогов чувствительности ПОМ к исследованным газам во влажном, а также в сухом воздухе, значения которых оказались во много раз (иногда
на порядки) ниже литературных данных.
10. Результаты проведенных исследований по быстродействию нескольких типов ПОМ в сухих газовых смесях воздуха с 8 газами. Показано, что постоянная времени при нарастании концентрации газов 0.9 и при ее спаде 0.9 снижается с ростом температуры и достигает уровня 1 сек уже 450 – 5000С. Данные по быстродействию в предложенном объеме и качестве получены впервые.
11. Результаты проведенных 129 – суточных испытаний шести типов ПОМ на длительную стабильность и воспроизводимость показаний в газовых смесях воздуха с 16 ppm СО и 15000 ppm СН4 при различных температурах нагрева и влажности воздуха 55 % RH. Показано, что единственной мерой концентрации газовых примесей в воздухе может быть только сопротивление (проводимость) ПОМ, которое гораздо меньше подвержено временным и «биографическим» факторам. Установлено, что наилучшей для регистрации СО и СН4 по стабильности и воспроизводимости показаний является структура SnO2 + 3% La2O3, нагретая до 5000С. Для этого ПОМ воспроизводимость показаний, по крайней мере, с шестого дня испытаний находится в пределах 4.5 % для СО и 3 % для СН4. Такие данные для ПОМ получены впервые.
12. Наиболее вероятные, по мнению автора, химические реакции взаимодействия
исследованных газов с поверхностью ПОМ, протекающие по следующему сценарию: диссоциация молекул химические реакции продуктов диссоциации с хемосорбированными ионами О2- и ОН, входящими в состав КГС. Для каждой реакции газов с КГС представлен баланс электронов, хемосорбированных ионов и дополнительных вакансий кислорода. Убедительно продемонстрирован акцепторный характер реакции NO с ПОМ. Впервые представлены реакции регенерации ПОМ в сухом и влажном воздухе после удаления газов.
13. Новые критерии по определению типа реакций для донорных и акцепторного газа (NO) с ПОМ в условиях существования на их поверхности «кислородно-гидроксильного» слоя, определенные на основе анализа экспериментальных данных по проводимости и чувствительности ПОМ. Установлено, что реакции СO, CH4, H2, NH3, H2O с поверхностью исследованных ПОМ должны быть отнесены к донорному или р-типу реакции независимо от типа полупроводника, а реакция NО с поверхностью ПОМ к акцепторному или n – типу реакции, особенно, при концентрациях выше 1-10 ppm NО и влажности выше 10% RH.
14. Заключения и выводы, сделанные на основе температурных зависимостей чувствительности исследованных ПОМ к различным газам, по их селективности в сухом воздухе при концентрации газов 200 ppm (для NO при концентрации 100 ppm) и по возможностям практического применения ПОМ. Показано, что акцепторный n-тип реакций NO со всеми ПОМ, а СО со структурами SnO2 + 3 % Pd с каталитическим слоем из Al2O3 и SnO2 + 1% CuO в интервале температур 150 – 3500С может рассматриваться как критерий селективности ПОМ к указанным газам.
Вклад автора. Автор разработал концептуальную основу решения поставленных задач, экспериментальное оборудование (ГСУ и ГДУ и ее модификаций), методику проведения исследований, а также алгоритм измерения газочувствительных характеристик ПОМ. Автором разработана методика проведения исследований хемосорбции молекул кислорода и воды на поверхности ПОМ и определения состава КГС. Автор лично выполнил все исследования по газочувствительности, быстродейст-вию и воспроизводимости ПОМ в газовых смесях воздуха с исследованными газами. Автором разработана методика обработки опытных данных, дана интерпретация полученных результатов и методика построения химических реакций газов с КГС на поверхности ПОМ, а также реакций регенерации ПОМ после удаления газов.
Объем и структура диссертации. Диссертация состоит из Введения, Заключения, Библиографии, 2 Глав с обзором литературы по материалам диссертации, 10 оригинальных Глав и трех Приложений. Материал диссертации представлен на 349 листах, включающих 132 рисунка и 38 таблиц.
Апробация результатов исследований. Результаты исследований представлялись на следующих Всесоюзных, Всероссийских и Международных конференциях и семинарах:
1. Конференция «Датчики на основе технологии микроэлектроники», МДНТП им. Ф. Э. Дзержинского, Москва, 1989, СССР; 2. III научно-технический семинар по электронным датчикам, Сентябрь 1989, ЦНИИ ”Электроника”, Москва, СССР; 3. Всесоюзная конференция ”Химические сенсоры - 89”, 20 - 24 сентября 1989, Ленинград, СССР; 4. International Conference “Eurosensors IV”, 1-3 October 1990, Karlsruhe, FRG; 5. Вторая всесоюзная конференция по анализу неорганических газов, 1-5 октября 1990, Ленинград, СССР; 6. IV-конференция «Электронные датчики «Сенсор-91»», 10-12 июля 1991, Ленинград, СССР; 7. Конференция по атомно-водородной энергетике, ИАЭ им. И. В. Курчатова, Москва, 1991; 8. International Congress “Metrology –91”, 17-19 September 1991, Lyon, France; 9. International Conference “Eurosensors V”, 30 Sept. – 2 Oct. 1991, Rome, Italy; 10. International Conference “Eurosensors VI”, 5-7 Octоber 1992, S-Sebastian, Spain; 11. Conference “MST Physical Sensors, LIGA – Processes”, June 22-23 1993, St. Peterburg, RF; 12. ”Microsystems technology - Russia”, ”Сенсор-Техно-93”, July, С-Петербург, 1993; 13. International Conference “Eurosensors VII”, 26-29 September 1993, Budapest, Hungary; 14. Conference on Gas Sensors, 5-8 October 1993, Vilnius, Lithuania; 15. The 6-th International Metrological. Congress, 19-21 October 1993, Lille, France; 16. The 5-th International meeting on chemical sensors, 11-14 July 1994, Roma, Italy; 17. International Conference “Eurosensors VIII”, 25-28 September 1994, Toulouse, France; 18. International Conference “Eurosensors IX and Transducer”, 2-5 October 1995, Stockholm, Sweden; 19. VI International meeting on chemical sensors, 22-25 July, Gaithersburg. USA, 1996; 20. American Chemical Society Meeting, 25-30 August 1996, Orlando, USA; 21. The 10-th European Conference on Solid-State Transducers ”Eurosensors-X”, 8-11 September 1996, Leuven, Belgium; 22. The 11-th European Conference on Solid State Transducers “Eurosensors-XI”, 21-24 September 1997, Warsaw, Poland; 23. AGS Symposium Series 690, Polymers in Sensors, July 1998, Detroit, USA; 24. The 4-th East Asian Conference on Chemical Sensors, 23-26 November 1999, Hsinchu, Taiwan; 25. Всероссийская конференция с международным участием «Сенсор 2000», Сенсоры и микросистемы, 21 – 23 июня 2000, Санкт – Петербург, РФ; 26. Ученый Совет Института Молекулярной Физики РНЦ “Курчатовский институт” (представление результатов исследований на Курчатовский Конкурс работ РНЦ), Ноябрь 2000, Москва; 27. Ученый Совет Института
Молекулярной Физики РНЦ “Курчатовский институт” (апробация докторской диссертации), Декабрь 2007, Москва.
Публикации. Общее число научных трудов автора – 128, из них по тематике диссертации 85, включая 37 статей, 28 тезисов конференций и 20 научных отчета. В журналах из перечня ВАК РФ опубликовано 7 работ.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во Введении сформулированы общие представления о предмете исследований, обоснована актуальность темы, сформулированы цели и задачи исследований, научная новизна, практическая ценность и достоверность полученных результатов. Приведены наиболее характерные примеры каталитических свойств полупроводниковых оксидов металлов (ПОМ), даны строгие критерии определения понятия катализатор. Даны сведения об апробации работы, основных положениях, выносимых на защиту, основных публикациях и личном вкладе автора, описаны структура и объем диссертации.
В Главе 1 даны общие представления об особенностях полупроводниковых оксидов металлов, о процессах, происходящих при адсорбции газов на их поверхности, кратко изложены основы теории хемосорбции газов на поверхности полупроводников и каталитической активности ПОМ.
В Главе 2 представлен обзор литературных данных по газочувствительным харвктеристикам различных ПОМ к пяти анализируемым газам (CO, CH4, H2, NH3 и NO). Обзор включает в себя 140 публикаций за период с 1995 по 2007 г.
Глава 3. Экспериментальная аппаратура для исследования газочувствительных и динамических характеристик образцов ПОМ. Методика проведения исследований и обработки опытных данных.
Исследования газочувствительных и динамических характеристик образцов ПОМ проводились на лабораторном газо-измерительном комплексе Института Молекулярной Физики РНЦ «Курчатовский Институт». Он состоял из двух газо-смесительных установок (ГСУ), баллонов с газовыми смесями и чистым воздухом, газо-динамической установки (ГДУ) и блока регистрации и измерения сигнала сенсоров. ГСУ предназначена для получения газовых смесей в баллонах под давлением.
3.1. Газо-динамическая установка.
Газо-динамическая установка (ГДУ) позволяла создавать калибровочные газовые смеси практически с любыми газовыми компонентами, включая взрывоопасные и токсичные газы, в широком диапазоне концентраций и влажности газовой среды. ГДУ имела несколько модификаций, каждая из которых предназначалась для проведения конкретных исследований в конкретных газовых средах. Принципиальная схема газо-динамической установки (ГДУ), которая применялась для исследования газочувствительности ПОМ к нерастворимым в воде газам (СО, СН4, Н2, NO и др.) изображена на рис. 3.1. Помимо указанной на рис. 3.1 основной модификации, в работе использовались еще три специальные модификации ГДУ, которые применялись при исследовании газочувствительности ПОМ к растворимым в воде газам (NH3, H2S, C2H5OH и др.), при исследовании динамических характеристик ПОМ и исследовании динамических характеристик и чувствительности ПОМ к парам воды. Все отмеченные модификации имели одинаковую систему разбавления исходных газовых смесей, и отличались либо методикой увлажнения калибровочных газовых смесей, либо конструкцией измерительных камер, в которые устанавливались исследуемые образцы ПОМ.
Основой установки являлись электронные регуляторы расхода газа (РРГ), установленные на четырёх идентичных газовых линиях. На всех линиях установлены также идентичные cтабилизаторы давления газа - (СДГ), манометры (М) и электромагнитные запорные клапаны (ЭК). На линии 1(Q1) установлен РРГ с пределом измерения 0.28 см3/сек, а на остальных газовых линиях (Q2, Q3 и Q4) – РРГ с пределом измерения 2.3 см3/сек. Назначение всех указанных элементов - обеспечение установки и стабилизации расходов газов в газовых линиях ГДУ на заданном уровне.

В процессе проведения исследований по линиям 1 и 2 подавалась газовая смесь воздуха с анализируемыми газами (возможно использование двух газов), а по линиям 3 и 4 всегда подавался метрологически аттестованный воздух марки (ПНГ). В качестве исходных газовых смесей использовались заводские поверочные газовые смеси (ПГС) воздуха с анализируемыми газами или газовые смеси воздуха с микроконцентрациями газов, приготовленные нами на лабораторной газосмесительной установке (ГСУ) в баллонах под давлением.
Калибровочная газовая смесь, формирование которой происходило в линии смешения газовых потоков q1, q2 и q3, и чистый воздух (q4) далее подводились к электромагнитному
Рис. 3.1. Принципиальная схема ГДУ для исследований с нерастворимыми в воде газами.
переключателю газовых потоков (ЭПГП) и поступали в заданной последовательности в измерительную камеру с образцами ПОМ.
Концентрация анализируемых газов в калибровочной газовой смеси определялась степенью разбавления исходных газовых смесей чистым воздухом и вычислялась по следующей формуле:
C = С0·(q1 + q2)/(q1 + q2 + q3) = C0·(q1 + q2)/Q, (3.1)
где q1, q2, q3, q4 - расходы газовых потоков в линиях 1, 2, 3 и 4, а Q = q1 + q2 + q3 - результирующий газовый поток, который всегда поддерживался на уровне 2.3 см3/сек., а С0 концентрация анализируемого газа в исходной газовой смеси. Такой же по величине расход воздуха q4 проходил по нулевой линии 4. Линия 2 реально применялась для получения калибровочных газовых смесей с коэффициентом разбавления К = Со/С в диапазоне 1 – 10, а линия 1 – с коэффициентом разбавления в диапазоне от 9 до 200.
Суммарная инструментальная погрешность концентрации анализируемого газа в калибровочной газовой смеси определялась по следующей формуле
C/C = C0/C0 + qj/qj + (qj + q3 )/(qj + q3), (3.2)
где C0/C0 - погрешность концентрации газа в исходной газовой смеси, qj/qj –погрешность расхода газа, проходящего через РРГ на линиях 1 или 2, (qj + q3 )/ qj + q3 – погрешность результирующего газового потока. В результате проведённой калибровки регуляторов РРГ с помощью специального прецизионного газового стенда удалось практически вдвое снизить погрешность концентрации газов в калибровочной газовой смеси по сравнению с паспортными данными на РРГ. Теперь погрешность концентрации газов С в калибровочной газовой смеси с учётом погрешности концентрации газа С0 в исходной газовой смеси (С0/С0 3%) и приготовленной нами на ГСУ (С0/С0 = 6 - 7%) в указанных выше диапазонах коэффициента разбавления с использованием линии 2 не превышала 3 % и 7%, соответственно, а с использованием линии 1 не выходила из пределов от 3 - 7 % и 16%, соответственно.
Увлажнение калибровочной газовой смеси воздуха с анализируемым газом достигалось посредством пропускания части газового потока через ручной регулятор газовых потоков (РРГП) и оригинальный увлажнитель нашей конструкции. РРГП с тонкой регулировкой сечения своего газового канала позволял оперативно (за 5-7 мин) изменять влажность результирующего газового потока в измерительной камере с образцами ПОМ во всём возможном диапазоне значений от 0 до 100% RH. Влажность результирующего газового потока измерялась гигрометром «Волна – 5М», датчик которого был установлен в камере смешения. Погрешность величины влажности определялась точностью поддержания её значения в процессе измерений и обычно составляла в стационарном режиме ± 0.3 % RH.
3.2. Методика проведения исследований газочувствительности ПОМ и обработки экспериментальных данных.
Методика измерений сопротивления, вычисления газочувствительности сенсоров и обработки опытных данных иллюстрируется рис. 3.2. Особенность применённой методики исследований и измерений параметров ПОМ заключалась в возможности создания в измерительной камере с образцами ПОМ одиночных или последовательности прямоугольных импульсов концентрации анализируемого газа С(t), амплитуда которых равна концентрации газа в калибровочной газовой смеси. Под воздействием этих импульсов формировались ответные сигналы образцов ПОМ в виде импульсов проводимости (t) или сопротивления Rg(t), которые регистрировались на экране монитора. Это позволяло получить чистый дифференциальный эффект от воздействия концентрации анализируемого газа на образцы и одновременно вычислить их чувствительность (отклик) S = R0/Rg, где R0 и Rg – сопротивление ПОМ на стабильном участке в чистом воздухе и в конце импульсов в газовой смеси, соответственно. Импульсы концентрации газа формировались с помощью быстродействующего электромагнитного переключателя газовых потоков (ЭПГП), в зависимости от положения золотника которого в измерительную камеру с образцами поступали чистый воздух или калибровочная газовая смесь. Это имитировало создание импульсов концентрации газа Cg(t). Исследования проводились в условиях термостабилизации образцов ПОМ, характеризующейся постоянcтвом сопротивления нагревателя RhТ и подводимой к нему электрической мощности Wh. Нагрев образцов ПОМ и измерение их проводимости обеспечивалось двумя специальными 8-канальными электронными приборами. В процессе измерений на газочувствительный слой ПОМ (R0 или Rg) подавалось постоянное напряжение 10 В. Технологический процесс формирования калибровочной газовой смеси заданного состава, подачи газовых смесей, переключения
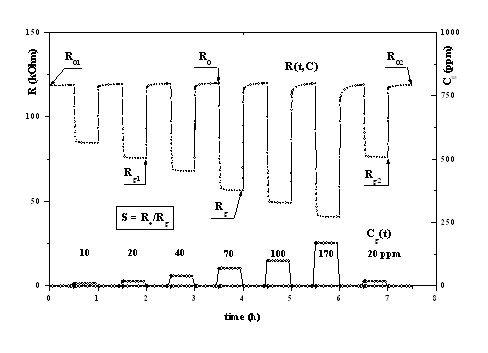
Рис. 3.2. Иллюстрация методики измерения сопротивления R0 и Rg образцов ПОМ под воздействием импульсов концентрации анализируемого газа.
газовых потоков и измерения проводимости или сопротивления ПОМ и концентрации анализируемого газа был полностью автоматизирован и осуществлялся по программе, разработанной для PC IBM.
Исследования температурной зависимости чувствительности ПОМ к анализируемым газам проводились при изменении температуры нагрева ПОМ в диапазоне от 100 до 6000С с интервалом 500С. Длительности импульса концентрации газов и времени продувки камеры чистым воздухом были приняты равными 30 мин, а длительность самого процесса измерений составляла более 12 час. Исследования проводились в сухих газовых средах (0% RH) при одинаковой концентрации газов в воздухе равной 200 ppm. Результатом этих исследований были диаграммы импульсов сопротивления ПОМ R(t,T) и постоянной концентрации газа C(t).
Исследования концентрационной зависимости ПОМ проводились, как правило, для одной или двух температур нагрева с использованием одной или двух - трёх исходных газовых смесей при максимально возможном коэффициенте разбавления. Результатом этих исследований были диаграммы импульсов сопротивления ПОМ R(t,С) и переменных концентраций газа С(t). Каждое измерение R(t,C) проводилось при неизменной влажности газовой среды (чистого воздуха и калибровочной газовой смеси), которая последовательно устанавливалась равной 0, 10, 20, 40, 60, 80 и 100% RH.
Диаграммы R(t,T) и R(t,С,RH) служили основным материалом для определения чувствительности ПОМ S = R0/Rg (см. рис. 3.2) и построения графиков S(T), Rg(C,RH) и S(C,RH), отражающих их газочувствительные и концентрационные характеристики.
Диаграммы R(t,C,RH) позволяли оценить дрейф сопротивления ПОМ в чистом воздухе R0, который определялся по формуле d = {[(R02–R01)/R01]/t}·100% час-1, где R01 и R02 – сопротивления сенсора в чистом воздухе на стабильных участках в начале и конце диаграммы для каждого поддиапазона концентраций анализируемых газов, соответственно, t – отрезок времени между двумя указанными измерениями в часах (см. рис. 3.2).
По диаграммам R(t,C), когда проводилось два и более измерения сопротивления при одинаковой концентрации анализируемого газа, как показано на рис. 3.2 при С = 20 ppm, можно было оценить «первичную» воспроизводимость или повторяемость показаний. За параметр «воспроизводимость» “r” мы приняли относительное изменение величины сопротивления, т.е r = [(Rg2 - Rg1)/Rg1]·100%, где Rg1 и Rg2 первое и второе измеренное сопротивление ПОМ при одинаковой концентрации анализируемого газа, соответственно.
По графикам S(T) определялась оптимальная температура нагрева ПОМ, при которой в дальнейшем исследовались концентрационные зависимости. Графики зависимостей Rg(C,RH) и S(C,RH) давали наглядное представление о реакции ПОМ на анализируемые газы и влиянии влажности газовой среды на сопротивление и чувствительность ПОМ. На рис. 3.3 и 3.4 в качестве иллюстрации методики проведения исследований и обработки экспериментальных данных показаны реальные графики Rg(C,RH) и S(C,RH), полученные для ПОМ на основе чистой SnO2, нагретой до 5000 С, в газовых смесях воздуха с водородом.
Близость данных по сопротивлению и чувствительности ПОМ в диапазоне влажности газовой среды от 0 до 100% RH даёт основание произвести усреднение этих данных по влажности для каждого значения концентрации. Такое усреднение было выполнено, и его результаты вместе со среднеквадратичными отклонениями среднеквадратичных параметров sdXma = ± [(Xi - Xma)2/(m -1)] представлены графически на рис 3.5 и 3.6. Здесь Xi – сопротивление Ri или чувствительность Si-1
Рис. 3.3. Сопротивление ПОМ на основе чистой SnO2 в зависимости от концентрации Н2 в воздухе и влажности газовой среды.
Рис. 3.4. Чувствительность (отклик) ПОМ на основе чистой SnO2 в зависимости от концентрации Н2 в воздухе и влажности газовой среды.
ПОМ в газовой среде при одном из значений влажности, Xma - среднеарифметическое значение сопротивления Rma или чувствительности Sma в конкретном диапазоне влажности (в данном случае 0-100% RH), m – число измерений или значений влажности для каждой из концентраций анализируемого газа. Из графика на рис. 3.5 видно, что данные по среднеарифметическим значениям сопротивления, по крайней мере, в интервале концентраций 10 - 19700 ppm газа (Н2), должны достаточно хорошо аппроксимироваться линейной зависимостью вида
lgRma = A + k·lg C, (3.3)
где А и k постоянные числа. Вычисленная линейная аппроксимация изображена на рис. 3.5 пунктирной линией. На графике показаны также численные значения коэффициентов A и k. В данном случае линейная аппроксимация проводилась в координатах [lgRma – lgC]. Для остальных анализируемых газов и сенсорных структур наилучших результатов по линейной аппроксимации данных по сопротивлению удавалось достигнуть в других координатах [Rma – lgC], [Rma – C], [lgRma – C] и т. д.
Данные по среднеарифметическим значениям чувствительности, как это видно из графика на рис. 3.6, также должны достаточно хорошо аппроксимироваться в интервале концентраций C = 1 – 19700 ppm линейной зависимостью вида
lg (Sma-1) = B + n·lg C, (3.4)
Рис. 3.5. Среднеарифметические значения сопротивления ПОМ на основе чистой SnO2 в диапазоне влажности 0 – 100% RH в зависимости от концентрации Н2 в воздухе.
Рис. 3.6. Среднеарифметические значения чувствительности (отклика) ПОМ на основе чистой SnO2 в диапазоне влажности 0 – 100% RH в зависимости от концентрации Н2 в воздухе.
полученной логарифмированием известной зависимости чувствительности от концентрации анализируемого газа. Здесь n – показатель степени. Вычисленная линейная аппроксимация показана на графике пунктирной линией. На графике показаны также численные значения коэффициентов B и n. Для большинства анализируемых газов и образцов ПОМ линейная аппроксимация проводилась в координатах [lg(Sma-1) – lgC], как в данном случае. Графики зависимости чувствительности от концентрации на рис. 3.4 и 3.6 позволяют оценить порог чувствительности ПОМ к анализируемым газам для заданной минимальной чувствительности, которую мы принимали обычно равной Smin = 1.1. Порог чувствительности Cmin оценивался либо экстраполяцией или интерполяцией зависимостей S(C, RH) и Sma(C), либо расчётным путем по уравнению (3.4).
На рис. 3.7 представлены графики зависимости среднеквадратичных величин отклонения среднеарифметических значений сопротивления sdRma/Rma в относительном выражении от концентрации Н2. Из приведённого графика видно, что наименьшее отклонение sdRma/Rma имеют структуры на основе чистой SnO2 и структура SnO2 + 3% La2O3, работающие при 500 и 4500С, соответственно. Его величина не превышает 6 – 10 %. Параметр sdRma/Rma может служить достаточно объективным критерием воспроизводимости или повторяемости показаний образцов ПОМ.
Рис. 3.7. Среднеквадратичные отклонения
среднеарифметических значений
сопротивления исследованных ПОМ в
диапазоне влажности 0 – 100% RH в
зависимости от концентрации Н2 в воздухе.
Рис. 3.8. Иллюстрация методики исследования быстродействия ПОМ и определения постоянной времени 0.9 при нарастании и спаде концентрации газа.
3.3. Методика проведения исследований динамических параметров образцов ПОМ и обработки экспериментальных данных.
Методика измерений и обработки опытных данных иллюстрируется рис. 3.8, на котором изображены импульс концентрации анализируемого газа С(t) и
соответствующие импульсы проводимости образцов ПОМ (t). График показывает также на три возможные типа конфигурации импульсов проводимости – слабо нарастающий 1(t), быстро нарастающий с выходом на амплитудное значение сигнала 2(t) и стремительно нарастающий с последующим спадом показаний, как принято говорить, с «носом», 3(t). Постоянная времени 0.9 вычислялась в секундах по количеству точек с начала импульса проводимости образца ПОМ после подачи газовой смеси до значения сигнала, равного 90% максимальной величины импульса проводимости. Параметр 0.9 вычислялся аналогичным образом с конца импульса проводимости образца ПОМ после подачи чистого воздуха до значения, равного 10 % показаний в чистом воздухе. Временной интервал t между точками в программе “t-prg” ограничивал измерения параметров 0.9 и 0.9 величиной 1 сек.
3.4. Критерии выбора оптимальной структуры ПОМ для регистрации газов в воздухе.
Нами были приняты пять, наиболее объективных, с нашей точки зрения, критерия отбора структуры ПОМ для регистрации конкретного газа в воздухе.
1. Минимальная зависимость сопротивления Rg от влажности газовой среды. Поэтому первым объективным критерием является величина среднеквадратичного отклонения cреднеарифметических значения сопротивления структуры sdRma/Rma, вычисленная для широкого интервала влажности 0-100% RH или 10-100% RH, и зависимость этой величины от концентрации анализируемого газа. Такие данные в качестве иллюстрации представлены на рис. 3.7, а методика их вычисления описана выше.
2. Существование простой (желательно, линейной) по типу эмпирической зависимости между среднеарифметическим сопротивлением структуры Rma, определённом в наиболее широком диапазоне влажности газовой среды, и концентрацией газа (по типу уравнения (3.3)), справедливой для наиболее широкого диапазона концентраций и с наименьшей погрешностью аппроксимации.
3. Абсолютная величина сопротивления образцов ПОМ не должна превышать в чистом воздухе R0 1–3 мОм, а в газовой смеси Rg 50 – 100 кОм.
4. Высокое быстродействие, определяющее способность структур реагировать на мгновенный выброс газа, а также форма ответного импульса проводимости (t) или сопротивления Rg(t), близкая к типу 2(t) (см. рис. 3.8).
5. Стабильность и воспроизводимость показаний (сопротивления Rg) образцов ПОМ в газовой смеси воздуха с анализируемым газом при постоянной концентрации газа и влажности газовой среды в процессе проведения длительных испытаний.
Глава 4. Проводимость ПОМ в сухом и влажном воздухе. Состав «кислородно-гидроксильного» слоя.
Из обзора литературы следует, что ПОМ являются катализаторами хемосорбционных и диссоциативных процессов для окружающей воздушной среды. Представлены доказательства диссоциации молекул кислорода и воды на поверхности ПОМ и существования на ней хемосорбированных отрицательно заряженных ионов кислорода в формах О2, О и О2- и гидроксильных групп ОН, иначе говоря, существование так называемого «кислородно-гидроксильного» слоя. Это приводит к возникновению акцепторного уровня в запрещенной зоне полупроводника, смещению уровня Ферми в направлении зоны проводимости и, как следствие, отрицательному заряжению поверхности ПОМ. Проводимость ПОМ при адсорбции кислорода из-за поглощения его ионами свободных электронов из зоны проводимости полупроводника уменьшается. Одновременно показано, насколько велико противоречие в литературных данных по температурным границам существования форм хемосорбированных ионов кислорода.
Экспериментальных исследований по хемосорбции молекул кислорода проведено много, но, как было отмечено, полученные данные весьма противоречивы. Результаты исследований газочувствительности к самим парам воды в литературе отсутствуют. Уточнение экспериментальных данных по границам существования хемосорбированных ионов кислорода и гидроксильных групп ОН позволило бы получить важную информацию по составу и свойствам «кислородно-гидроксильного» слоя, играющего основную роль при хемосорбционных и каталитических процессах на поверхности ПОМ.
Объективная картина о температурных границах формирования хемосорбированных ионов кислорода и гидроксильных групп может быть получена только с учетом данных о проводимости собственного полупроводника. Наиболее обстоятельные исследования проводимости чистой SnO2 в атмосфере азота выполнены только Фонстадом и Редикером еще в 1971г. Из работы следует, что при комнатной температуре проводимость SnO2 может изменяться от 0.25 до 40 (Омсм)-1 в зависимости от плотности свободных зарядов (электронов) от 1016 до 2.51018 см-3, соответственно. Показано, что проводимость SnO2 и подвижность электронов для плотности электронов 81016 см-3 уменьшается с температурой вплоть до температур 4000С. Для плотности электронов 0.81016 см-3 те же исследования проведены только до комнатных температур. При температурах выше 4000С данные для проводимости, а также для плотности электронов и их подвижности в литературе отсутствуют. В реальных условиях ПОМ, в том числе и SnO2, не могут рассматриваться как чистые или собственные полупроводники, поскольку они постоянно находятся в контакте с окружающей воздушной средой, оказывающей существенное влияние на электронные состояния поверхности и, следовательно, на проводимость.
В данной Главе представлены результаты исследований проводимости шести структур ПОМ: чистой SnO2 и SnO2 с каталитическими добавками 3% Pd, 3% La2O3, 1% Sb2O5 + 3% La2O3, 1% Pt + 3% Pd и 3% Pd с каталитическим слоем из Al2O3, в чистом азоте и сухом воздухе в диапазоне температур от комнатной до 6500С. Проведены также экспериментальные исследования чувствительности тех же структур ПОМ (кроме структуры SnO2 + 1% Pt + 3% Pd) к парам воды в воздухе в диапазоне концентраций Н2О от 0 до 2.88 об %. (0 – 100 % RH) и температур 200 – 6000С.
4.1. Проводимость ПОМ в азоте и сухом воздухе. Кислородная составляющая КГС.
При нахождении образцов ПОМ в инертной атмосфере, например, в среде чистого азота, или вакууме на их поверхности существуют только вакансии кислорода VO, сосредоточенные на обрывах периодичности кристаллической решетки SnO2 на поверхностных ионах Sn4+. Проводимость ПОМ в этом состоянии определяется только концентрацией собственных электронов в зоне проводимости полупроводника, которая зависит от температуры. При нахождении ПОМ в атмосфере сухого воздуха происходит формирование «кислородной» составляющей КГС. За полный процесс формирования ионов О и О2- каждая молекула кислорода оккупирует два иона Sn4+, а зона проводимости ПОМ обедняется на два и четыре электрона, соответственно. В результате проводимость ПОМ в сухом воздухе должна понизиться по сравнению с проводимостью чистого ПОМ, а ее величина будет определяться концентрацией свободных электронов в обедненной зоне проводимости полупроводника, температурой и формой хемосорбированного иона кислорода
4.1.1. Методика проведения исследований.
Исследование проводимости образцов ПОМ в азоте и сухом воздухе проводилось на модификации ГДУ для нерастворимых в воде газов, изображенной на рис. 3.1. Удаление с поверхности ионов кислорода, молекул воды и гидроксильных групп в первом случае и молекул воды и гидроксильных групп во втором достигалось в процессе специальной длительной температурной тренировки образцов ПОМ в постоянном потоке азота марки ОСЧ или сухого воздуха с расходом 1 см3/сек. За критерий очистки поверхности была выбрана стабилизация проводимости при комнатной температуре на характерном для каждого типа ПОМ уровне.
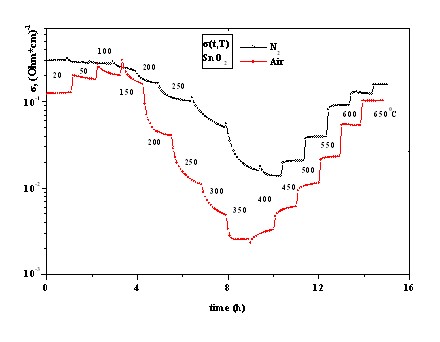
Рис. 4.1. Диаграммы проводимости чистой SnO2 в азоте и сухом воздухе при изменении температуры нагрева.
Измерения проводимости в среде азота и сухого воздуха проводились при последовательном нагреве образцов ПОМ от комнатной температуры до температур 650°С с интервалом 50°С. Время нахождения образцов при каждой температуре составляла от 50 до 70 мин. Результатом исследований в азоте марки ОСЧ и сухом воздухе были диаграммы удельной проводимости (t,Т), изображенные для чистой SnO2 на рис. 4.1. Для остальных структур ПОМ были получены аналогичные
зависимости. Удельная проводимость в (Омсм)-1 рассчитывалась по измеренным величинам сопротивления образцов ПОМ с учетом геометрических размеров газочувствительного слоя ЧИПа, которые были равны 0.10.040.003 см.
На рис. 4.2 и 4.3 показаны зависимости проводимости исследованных ПОМ от температуры в среде азота и сухого воздуха в координатах [lg – T]. Оба рисунка наглядно иллюстрируют экстремальный характер зависимости (Т) и определяющую роль в проводимости ПОМ в сухом воздухе свободных электронов собственного полупроводника. Минимум проводимости, как видно из графиков, наблюдается в сухом воздухе в области температур 300 – 4000С для чистой SnO2 и 280 – 3500С – для остальных ПОМ. Графики иллюстрируют также роль каталитических добавок в порошок SnO2. Все добавки относятся к классу акцепторных, понижающих количество свободных электронов в зоне проводимости ПОМ. При этом отчетливо прослеживается закономерность: чем ниже валентность акцептора, тем ниже проводимость ПОМ.
Кроме того, наблюдается определенная закономерность смещения температуры минимума проводимости в область меньших значений с понижением валентности металла. Следует также обратить внимание на начальные ветви кривых lg (T) на рис. 4.2 для легированных ПОМ в области температур до 100 - 150°С, которые характеризуют примесную проводимость полупроводников. Вместе с тем, отсутствие подобной ветви у чистой SnO2 свидетельствует о ее достаточно высокой чистоте.
4.1.2. Интерпретация результатов исследований. Концентрация хемосорбированных ионов кислорода в КГС.
Рассмотрим полученные закономерности проводимости ПОМ аналитически, исходя из известной формулы для проводимости электронного полупроводника
= ееne, (4.1)
где проводимость ПОМ в (Омсм)-1, е – подвижность электронов в см2В-1с-1, е –
заряд электрона равный 1.610-19 Ас и ne – число или концентрация электронов в зоне
проводимости ПОМ. Если обозначить за nеN2 количество электронов собственного полупроводника в атмосфере азота и за nеAir – количество электронов в сухом воздухе, то убыль количества электронов в сухом воздухе за счет образования хемосорбированных ионов кислорода nО и изменение проводимости ПОМ О в сухом воздухе по отношению к собственному полупроводнику составит
nО = nеN2 - nеAir и О = N2- Air (4.2)
На рис. 4.4 изображены зависимости проводимости чистой SnO2 в азоте и сухом воздухе, а также вычисленное по формуле (4.2) изменение проводимости, вызванное хемосорбцией молекул кислорода. Там же показан отрезок зависимости проводимости для чистой SnO2 в азоте, заимствованный из упомянутой выше работы Фонстада [139], при концентрации электронов 0.81016 см-3 при комнатной температуре. Из графика
Рис. 4.2. Проводимость исследованных ПОМ в азоте в зависимости от температуры.
Рис. 4.3. Проводимость исследованных ПОМ в сухом воздухе в зависимости от температуры
N2(Т) видно, что наблюдается хорошее совпадение наших данных с данными этой работы. График О(Т) на рис. 4.4 позволяет сделать несколько заключений. Во-первых, отчетливо видно, что хемосорбированные ионы кислорода в области температур 250 - 5500С захватывают практически все свободные электроны из зоны проводимости собственного полупроводника. Далее, наблюдаемые два максимума на указанной зависимости при 200 и 550-6000С должны принадлежать двум разным формам хемосорбированного кислорода: О и О2-, соответственно. При температуре 4000С в минимуме кривой О(Т) проводимость определяется обоими формами хемосорбированного кислорода при тенденции снижения концентрации ионов О и возрастания концентрации ионов О2-. Начальный спадающий отрезок кривой, вероятнее всего, связан с молекулярной формой хемосорбированного кислорода О2. Наконец, несмотря на отток электронов из зоны проводимости ПОМ на ионы кислорода О2- и, казалось бы, ожидаемое при этом общее понижение проводимости ПОМ при температурах выше 400 – 4500С, проводимость его, тем не менее, возрастает. Это еще
раз свидетельствует об определяющей роли в проводимости ПОМ в сухом воздухе собственных электронов полупроводника.
Данные по изменению проводимости в сухом воздухе (рис. 4.3) позволяют, используя уравнение (4.1), оценить количество электронов nО, захваченных хемосорбированными ионами кислорода, и количество этих ионов NO на поверхности:
nО = О/1.6е10-19 cм-3 и NO = nО/ см-3, (4.3)
где – заряд иона кислорода. Для оценки величин подвижности электронов при их плотности 0.81016 см-3 в области исследованных нами температур (выше комнатной)
Рис. 4.4. Проводимость чистой SnO2 в азоте и сухом воздухе в зависимости от температуры.
Рис. 4.5. Концентрация хемосорбированных ионов кислорода О и О2- в КГС и вызванное ими изменение концентрации электронов в зоне проводимости SnO2.
мы вынуждены были прибегнуть к графической экстраполяции зависимости е(Т) из упомянутой выше работы. При этом использовались закономерности зависимости е(Т) до температур 400°С, полученные для SnO2 с плотностью электронов 81016 см-3. Результаты вычислений убыли свободных электронов nО из зоны проводимости и концентрации ионов кислорода NO на поверхности SnO2 представлены на рис. 4.5 в зависимости от температуры. Графики на рисунке наглядно подтверждают все предположения и утверждения, высказанные выше.
4.2. Проводимость ПОМ во влажном воздухе. Гидроксильная составляющая КГС.
4.2.1. Методика проведения исследований чувствительности ПОМ к парам воды.
Для исследования газочувствительности ПОМ к парам воды была использована специальная модификация ГДУ, состоящая из двух линий, по которым подавался метрологически аттестованный воздух. По одной из линий поток воздуха перед поступлением в измерительную камеру с образцами ПОМ проходил через увлажнитель, после выхода из которого воздушный поток обогащался парами воды с парциальным давлением в пределах от 0 мм.Hg до давления насыщенных паров при комнатной температуре. Парциальное давление паров воды в потоке и, следовательно, концентрация Н2О в воздухе рассчитывались по значениям влажности с учётом величин атмосферного давления и комнатной температуры. Импульсы концентрации паров воды формировались с помощью ЭПГП, в зависимости от положения золотника которого в измерительную камеру с образцами ПОМ поступали сухой или влажный воздух.
Исследования концентрационной зависимости проводимости исследованных структур ПОМ проводились в диапазоне температур от 200 до 6000С с интервалом 500С при концентрациях паров Н2О, соответствующих влажности воздуха 10, 40, 70 и 98-100% RH. Длительности импульса концентрации Н2О были равны 1 часу, а времени продувки камеры сухим воздухом - 45 мин. Весь цикл измерений был проведён при комнатной температуре 22 ± 20С и атмосферном давлении 750 ± 5 мм. Hg. С учетом переменных условий окружающей среды для каждого указанного выше значения влажности были получены следующие усредненные значения концентрации паров Н2О: С1 = 0.275 ± 0.008, С2 = 1.1 ± 0.043, С3 = 2.09 ± 0.027 и С4 = 2.88 ± 0.037 об %. Для исключения возможной нестабильности сопротивления, которая наблюдается при включениях нагрева образцов ПОМ, все измерения концентрационной зависимости проводились без выключения питания в течение всего периода исследований.
Результатом исследований концентрационных зависимостей структур ПОМ во влажном воздухе были диаграммы (С,t) (аналогичные диаграмме на рис. 3.2). Диаграммы (C,t) были получены для каждого исследованного типа ПОМ, однако, в дальнейшем результаты измерений будут представлены только для чистой SnO2. Зависимости проводимости ПОМ на основе чистой SnО2 от температуры нагрева и концентрации паров Н2О (влажности) изображены на рис. 4.6. Там же показана зависимость (T) для чистой SnO2 в среде азота. График наглядно демонстрирует экстремальный характер зависимости (T) в сухом (см. также рис. 4.3) и влажном воздухе и тенденцию повышения проводимости с ростом влажности воздуха. Из графиков видно,
Рис. 4.6. Проводимость чистой SnO2 в сухом и влажном воздухе в зависимости от температуры.
Рис. 4.7. Чувствительность (отклик) исследованных ПОМ к парам воды в воздухе при её концентрации 2.9 % об в зависимости от температуры.
что положение минимума зависимости (T) не зависит от концентрации Н2О, и для указанной структуры оно наблюдается при температуре 3500С. Проводимость ПОМ особенно резко изменяется в интервале концентраций от 0 до С1 или от 0 до 10% RH. Далее с ростом концентрации Н2О тенденция увеличения проводимости замедляется, а при С С2 проводимость практически стабилизируется. Такая же закономерность отмечается и у остальных структур ПОМ. Минимумы зависимостей (T) во влажном воздухе для ПОМ на основе структур с каталитическими добавками 3% Pd, 3 % La2O3, 1% Sb2O5 + 3% La2O3 и 3% Pd с каталитическим слоем из Al2O3 достигаются в интервале температур 300 – 370, 250 – 400, 300 – 400 и 300- 3500С, соответственно.
На рис. 4.7 представлены температурные зависимости чувствительности (отклика) S(T) структур ПОМ к парам воды при их концентрации 2.9 % об. Как видно из графиков, чувствительность всех структур ПОМ к парам воды имеет отчетливо выраженные максимумы, а наименьшей чувствительностью при температурах выше 4500С к парам воды обладают структуры SnO2 + 1% Pt + 3% Pd, SnO2 + 1% Sb2O5 + 3% La2O3, SnO2 + 3% La2O3. При 6000С чувствительность для всех структур практически одинакова и находится на сравнительно высоком уровне 1.7 – 1.9
4.2.2. Интерпретация результатов исследований. Концентрация хемосорбированных гидроксильных групп в КГС.
Термическая диссоциация молекул воды на каталитически активной поверхности ПОМ по данным химической литературы может проходить с образованием молекул водорода, которые диссоциируют на два атома, и кислорода:
Н2О Н2 + 1/2·О2 и Н2 2·Н (4.4)
Как было установлено в разделе 4.1, кислородная составляющая КГС состоит их двух форм хемосорбированного кислорода: О в области температур от комнатной до 350 - 4000С превалирует ион О, а в диапазоне температур (350-400) – 6500С – ион О2-. По нашим соображениям формирование иона О может закончится при 400 – 5000С, а ион О2- начинает формироваться при температурах 250 - 3000С. Атомы водорода взаимодействуют с обоими формами хемосорбированного кислорода О и О2- с образованием гидроксильных групп:
2·Н + 2·О 2·ОН ne = 0 Т = Тком – (400-500)0С (4.5)
2·Н + 2·О2- 2·ОН + 2·е ne = + 2·е Т > 250 – 3000C (4.6)
Как следует из уравнений (4.5) и (4.6), в обоих случаях вместо двух ионов кислорода возникают две гидроксильные группы. Реакция (4.6) сопровождается повышением проводимости ПОМ, в то время как в результате реакции (4.5) проводимость ПОМ не должна изменяться.
Несмотря на то, что в реакции атомов водорода (4.5) дополнительные электроны в зону проводимости ПОМ не поступают, проводимость его в области температур от 200 до 350 - 4000С, тем не менее, возрастает (рис. 4.6), а чувствительность к парам воды имеет наибольшие значения (рис. 4.7). Это может означать, что в указанной области температур действует иной механизм увеличения проводимости, чем простое высвобождение электронов в результате химических реакций. Известно, что молекулы воды обладают сильной полярностью, которая способствует усилению их адсорбции на поверхности, особенно при невысоких температурах, а затем и их хемосорбции на ионах кислорода. Сильная полярность молекул воды может способствовать понижению высоты энергетического межзеренного барьера Шоттке Vs, что подтверждается литературными данными. Высота барьера пропорциональна поверхностному заряду, и даже небольшое его изменение может привести к заметному изменению проводимости ПОМ. Резюмируя, можно сказать, что в области температур ниже 350 - 4000С, где превалирует в КГС ион кислорода О, увеличение проводимости ПОМ при адсорбции молекул воды происходит благодаря их сильной полярности и снижения при этом высоты энергетического межзеренного барьера. При температурах выше 250 – 3000С, когда начинается формирование иона О2-, свой вклад в увеличение проводимости ПОМ постепенно начинают вносить дополнительные электроны за счет реакции (4.6), который должен возрастать с ростом температуры. В обеих областях температуры концентрация гидроксильных групп будет определяться концентрацией электронов в зоне проводимости ПОМ, а значит его проводимостью.
Для определения концентрации групп ОН произведем вычисления, аналогичные тем, которые были сделаны для ионов кислорода в разделе 4.1.2. Если обозначить за nе0 количество электронов в сухом воздухе и nе – количество электронов во влажном воздухе с влажностью, то приращение количества электронов за счет образования гидроксильных групп при увлажнении воздуха nОН и изменение проводимости ПОМ ОН во влажном воздухе будут равны
nОН = nе - nе0 и ОН = - 0 (4.7)
Рис. 4.8. Изменение проводимости исследованных ПОМ, вызванное 100% влажностью в зависимости от температуры.
Рис. 4.9. Концентрация гидроксильных групп в КГС исследованных ПОМ при влажности 100% RH в зависимости от температуры.
Вычисленные значения изменения проводимости для всех исследованных ПОМ при увлажнении воздуха до 100 % RH показаны на рис. 4.8 в зависимости от температуры. Из рисунка видно, что зависимости ОН(Т) в целом повторяют закономерности проводимости в сухом и влажном воздухе, однако, имеют менее резкие минимумы и меньшую крутизну ветвей. Из рис. 4.6 видно, что формы зависимости (T,RH) в сухом и влажном воздухе практически эквидистантны. Это может свидетельствовать о том, что адсорбция Н2О с образованием гидроксильных групп происходит со слабо изменяющейся интенсивностью на фоне переменной концентрации хемосорбированных ионов кислорода О и О2- (рис. 4.5). Отсюда следует важный вывод о том, что процесс диссоциации молекул воды с образованием ионов ОН должен происходить в широком интервале температур, по крайней мере, до 600 - 6500С. Вероятно, по этой причине ПОМ сохраняют при таких температурах высокую чувствительность к парам Н2О. Данные по изменению проводимости во влажном воздухе позволяют, используя уравнение (4.1), оценить количество гидроксильных групп в КГС, по крайней мере, в области существования в КГС ионов кислорода О2-. Как можно видеть из уравнения (4.6), образование каждой группы ОН должно сопровождаться высвобождением в зону проводимости ПОМ одного электрона, т. е. ne = NOH. Используя это равенство и формулы (4.1) и (4.7), получаем следующее выражение для NOH
NOH = ОН/1.6е10-19 cм-3 (4.8)
Результаты вычислений концентрации NOH при влажности воздуха 100% RH представлены на рис. 4.9 в зависимости от температуры. Графики на рисунке наглядно подтверждают все предположения и утверждения, высказанные выше.
4.2.3. Зависимость количества гидроксильных групп в КГС от влажности воздуха.
В предыдущем разделе было получено выражение (4.8) для количества электронов в зоне проводимости ПОМ, находящегося в окружающем влажном воздухе при неизменной влажности, в данном случае 100% RH. В состоянии динамического равновесия с влажным воздухом при произвольной влажности концентрация хемосорбированных ионов кислорода и гидроксильных групп должна быть пропорциональна концентрации кислорода и воды в воздухе. Опуская расчеты, представим окончательное выражение для концентрации гидроксильных групп в зависимости от изменения проводимости в относительном выражении от влажности:
NOН(,T) = А(Т,) + В(Т)(/100), (4.9)
где А(Т,) и В(Т) – функции температуры, влажности, а 100 – максимальное изменение проводимости при 100 % RH.
Графики на рис. 4.10 демонстрируют резкое изменение проводимости, а, следовательно, согласно уравнению (4.9) и резкое возрастание количества хемосорбированных гидроксильных групп в диапазоне влажности 0 - 10 % RH. Количество NOН при 10 % RH достигает 40 - 70 % от максимального значения при 100% RH практически во всем исследованном диапазоне температур. Указанные закономерности можно интерпретировать, на наш взгляд, только сильной полярностью молекул воды, которая способствует усилению их адсорбции на поверхности и
снижению при этом высоты энергетического межзеренного барьера.
4.3. Состав кислородно-гидроксильного слоя.
Наиболее полное представление о составе и закономерностях КГС можно получить только при отображении обеих составляющих КГС на одном графике в зависимости от температуры и влажности воздуха. Такие обобщенные зависимости концентрации ионов кислорода О и О2- и гидроксильных групп ОН от температуры изображены на рис. 4.11 для чистой SnO2 при трех значениях влажности – 0, 10 и 100% RH.
Основываясь на интерпретации процессов хемосорбции молекул кислорода и воды и рис. 4.11, можно сделать несколько важных выводов, по крайней мере, для области температур выше 350 - 4000С, с которых набирает рост зависимость NO2-(T) и в которой состоятельна реакция (4.6). В этой области температур в соответствии с реакцией (4.6) общее количество активных центров (ионов Sn4+), занятых ионами О2- и группами ОН, будет неизменным и будет перераспределяться между указанными ионами с изменением влажности. Легко проверить также, что суммарное изменение проводимости ПОМ в реальном влажном воздухе, вызванное хемосорбцией ионов кислорода О2- и гидроксильных групп ОН, неизменно и равно изменению
проводимости ПОМ, вызванное хемосорбцией ионов кислорода О2- в сухом воздухе. Это
Рис. 4.10. Изменение проводимости ПОМ на основе чистой SnO2 в зависимости от температуры и влажности воздуха.
Рис. 4.11. Концентрация хемосорбиро-ванных ионов кислорода О и О2- и групп ОН в КГС в зависимости от температуры и влажности воздуха.
означает, что при увеличении влажности воздуха и температуры ПОМ в КГС все более будут превалировать гидроксильные группы и реакции продуктов диссоциации газов с ними. Этим можно объяснить снижение чувствительности ПОМ к газам во влажном воздухе, поскольку количество электронов, выделяющихся в реакциях газов с гидроксилами всегда меньше, чем в реакциях с ионами О2-. Только в случае взаимодействия ПОМ с водородом (см. Главу 8) количество электронов, высвобождающихся в зону проводимости ПОМ в результате реакций с обоими ионами одинаково и равно двум. Поэтому сопротивление SnO2, как было показано при иллюстрации методики обработки опытных данных в разделе 3.2 Главы 3, практически не зависит от влажности воздуха в диапазоне от 0 до 100% RH. Для других газов влияние влажности на показания ПОМ вследствие специфики их реакций с ПОМ будет более заметным. Но об этом более подробно написано в Главах 5 и 8.
Глава 5. Газочувствительные характеристики и влияние влажности на показания исследованных ПОМ.
В Главах 5, 6, 7, 8 и 9 диссертации изложены результаты проведенных исследований по газочувствительности структур ПОМ к CO, H2, CH4, NH3 и NO. В автореферате все полученные данные будут представлены в одной данной Главе, а каждому газу будет посвящен отдельный раздел.
Методика проведения исследований и обработки опытных данных детально описана и проиллюстрирована в Главе 3. Поэтому здесь мы ограничимся кратким изложением процедуры исследований и иллюстрацией зависимостей чувствительности от температуры для исследованных ПОМ и среднеарифметических значений сопротивления для наилучших структур, выбранных нами для каждого газа в соответствии с критериями, изложенными в разделе 3.4 Главы 3. Будут также приведены полученные нами данные для порога чувствительности исследованных ПОМ вместе с данными из литературных источников.
5.1. Окись углерода.
На рис. 5.1 представлены температурные зависимости чувствительности семи исследованных нами структур ПОМ к СО при экспозиции 200 ppm в сухих газовых средах. Все кривые имеют чётко выраженный максимум в интервале температур 400 – 5000С. Из графиков видно, что введение каталитических добавок 3% La2O3 и 1% Sb2O5 + 3% La2O3 в SnO2 не приводит к изменению характера зависимости S(T) по сравнению с чистой SnO2. Наибольшей чувствительностью к СО обладают структура SnO2 + 3% La2O3, а наименьшей – чистая SnO2. Поведение структур SnO2 + 3% Pd и SnO2 + 1% Pt + 3% Pd заметно отличается от других структур ПОМ. Здесь максимум чувствительности наблюдается при 3000С. Структура SnO2 + 3% Pd + Al2O3 (кат. слой), как видно из графика, практически не чувствует СО, а структура SnO2 + 1% CuO начинает чувствовать СО только при температурах выше 400-4500С, достигая величины 3.3 при температуре 6000С. По графикам зависимостей S(T) определялись оптимальные температуры нагрева, при которых выполнялись последующие исследования. Исследования концентрационной зависимости структур ПОМ проводились в диапазоне концентраций 0.5 – 98 ppm СО. В процессе исследований использовалась одна исходная газовая смесь с концентрацией СО 98 ± 3 ppm (3 %) при семи значениях влажности газовой смеси 0, 10, 20, 40, 60, 80 и 100% RH. Всего было получено 84 диаграммы R(t,C,RH).
Для всех исследованных ПОМ и каждого значения концентрации СО было
проведено усреднение данных по сопротивлению в диапазоне влажности 10-100% RH по методике изложенной в разделе 3.2 Главы 3. Полученные данные были аппроксимированы уравнением Rma = A + k·lg C.
Аналогичные действия были проведены для данных по чувствительности ПОМ к СО для диапазона влажности 10-100% RH. Полученные результаты были аппроксимированы уравнением lg(Sma-1) = B + n·lgC.
Методика определения порога чувствительности описана в Главе 3, а его средние значения в диапазоне влажности 10-100 % RH и в сухой газовой среде
представлены в таблице 5.1. Результаты для порога чувствительности во влажном воздухе получены впервые, и их значения примерно в 3 раза выше, чем в сухом воздухе.
Рис. 5.1. Чувствительность (отклик) исследованных структур ПОМ от температуры нагрева в сухой газовой среде при концентрации 200 ppm CO.
Рис. 5.2. Среднеарифметические значения сопротивления структуры SnO2 +1% Sb2O5 + 3% La2O3 в диапазоне влажности 10 - 100% RH в зависимости от концентрации СО в воздухе.
Установлено, что по совокупности «первичных» признаков (см. Главу 3), наилучшей для регистрации СО является структура SnO2 + 1% Sb2O5 + 3% La2O3,
работающая при температуре 4500С и потребляющая 210 mW (рис. 5.2). Там же
показано аналитическое выражение эмпирического уравнения и диапазон концентраций СО, в котором производилась аппроксимация данных для Rma. Воспроизводимость показаний этой структуры во всём исследованном диапазоне концентраций 0.5 - 98 ppm находится в пределах 6 - 10 %.
Таблица 5.1. Порог чувствительности ПОМ к СО в диапазоне влажности 10-100 %RH и в сухой газовой среде при чувствительности S = 1.1.
| ПОМ | T, 0С | Сmin, ppm | |
| 0% RH | 10-100%RH | ||
| SnO2 | 450 | 0.3 | 1.1 ± 0.05 |
| 490 | 5 * | ||
| SnO2 + 3%La2O3 | 450 | 0.5 | 1.6 ± 0.060 |
| SnO2 + 1% Sb2O5 +3% La2O3 | 450 | 0.3 | 0.80 ± 0.03 |
| SnO2 +1% Pt +3% Pd | 300 | 1.0 | 0.43 ± 0.02 |
| ZnO | 490 | 5 * | |
| SnO2 – CeO – PdOx (94:5:1) | 120-180 | 40 * | |
| SiO2 - Co3O4, SiO2 - NiO | 50-300 | 10 * | |
| SnO2 : Ca : Nb2O5 (90:5:5) | - | 30 * | |
*литературные данные
5.2. Метан.
На рис. 5.3 представлены температурные зависимости чувствительности семи исследованных нами структур ПОМ к СН4 при экспозиции 200 ppm в сухих газовых средах. Все кривые имеют чётко выраженный максимум в интервале температур 400 – 5000С. Наибольшей чувствительностью к СН4 обладают структуры SnO2 + 1% Pt + 3% Pd и SnO2 + 3% Pd c каталитическим слоем из Al2O3, а наименьшей – структура SnO2 + 1% CuO. Последняя структура, как видно из рис. 5.3, начинает чувствовать метан только с 5000С, достигая величины 1.5 при температуре 6000С. Из графиков видно, что введение каталитических добавок 3% La2O3 и 1% Sb2O5 + 3% La2O3 в SnO2 не приводит к изменению характера зависимости S(T) по сравнению с чистой SnO2. Введение же добавок, содержащих Pd, приводит к снижению положения максимума зависимости S(T) более чем на 1000С. По графикам зависимостей S(T) определялись оптимальные температуры, при которых выполнялись последующие исследования. Исследования концентрационной зависимости ПОМ проводились в диапазоне концентраций 1 - 20600 ppm СН4 при семи значениях влажности газовой смеси 0, 10, 20, 40, 60, 80 и 100% RH. В качестве исходных газовых смесей использовались промышленная ПГС с концентрацией 20600 ppm (2.06 % об) СН4 и газовая смесь, приготовленная на лабораторной газосмесительной установке разбавлением ПГС, с концентрацией 175.4 ppm СН4. Всего было получена 71 диаграмма R(t,C,RH). Для всех исследованных ПОМ и каждого значения концентрации СН4 было проведено усреднение данных по сопротивлению в диапазоне влажности 10-100% RH по методике изложенной в разделе 3.2 Главы 3. Полученные данные были аппроксимированы уравнением lgRma = A + k·lgC.
Аналогичные действия ПОМ к СН4 для диапазона были проведены для данных по чувствительности в диапазоне влажности 10-100% RH. Полученные результаты были аппроксимированы уравнением lg(Sma-1) = B + n·lgC.
Средние значения порога чувствительности в диапазоне влажности 10-100% RH и
в сухой газовой среде представлены в таблице 5.2. Результаты для порога чувствительности во влажном воздухе получены впервые.
Рис. 5.3. Чувствительность (отклик) исследованных структур ПОМ от температуры нагрева в сухой газовой среде при концентрации 200 ppm CH4.
Рис. 5.4. Среднеарифметические значения сопротивления структуры SnO2 +1% Pt + 3% Pd в диапазоне влажности 10-100% RH в зависимости от концентрации СH4 в воздухе.
Таблица 5.2. Порог чувствительности ПОМ к СН4 в диапазоне влажности 10-100 %RH и в сухой газовой среде при чувствительности S = 1.1.
| ПОМ | T, 0С | Сmin, ppm | |
| 0% RH | 10-100%RH | ||
| SnO2 | 500 | 1.5 | 17 ± 6 |
| 450 | 500 * | ||
| SnO2 + 3% Pd | 450 | 0.8 | 27 ± 11 |
| SnO2 +1% Pt +3% Pd | 400 | 0.7 | 10 ± 3 |
| SnO2 + 3% Pd + Al2O3 (c.l.) | 450 | 0.6 | 7 ± 2 |
| 80 wt.% Fe2O3 + 20 wt.% SnO2 | 490 | 500 * | |
*литературные данные
Установлено, что по совокупности «первичных» признаков (см. Главу 3),
наилучшей для регистрации СH4 является структура SnO2 + 1% Pt + 3% Pd, работающая
при температуре 4000С и потребляющая 180 mW (рис. 5.4). На рис. 5.4 показано
аналитическое выражение эмпирического уравнения и диапазон концентраций СН4, в котором производилась аппроксимация данных для Rma. Воспроизводимость показаний этой структуры во всём исследованном диапазоне концентраций 1-20600 ppm находится в пределах 6 - 10 %.
5.3. Водород.
На рис. 5.5 представлены температурные зависимости чувствительности семи исследованных нами структур ПОМ к Н2 при экспозиции 200 ppm в сухих газовых средах. Из графиков видно, что все кривые имеют чётко выраженный максимум в интервале температур 300 – 5000С. Введение каталитических добавок 3% La2O3 и 1% Sb2O5 + 3% La2O3 и 1% CuO в SnO2 приводит к повышению температуры максимума зависимости S(T) по сравнению с чистой SnO2 на 50, 100 и 1600С, соответственно. Введение же добавок, содержащих Pd, приводит к снижению положения максимума зависимости S(T) примерно на 500С. Наибольшей чувствительностью к Н2 обладают структуры SnO2 + 3% Pd + Al2O3 (каталитический слой) (S 70) и SnO2 + 3% Pd (S 30). Остальные структуры ПОМ имеют примерно одинаковую чувствительность к Н2 на уровне 20 - 25. По графикам зависимостей S(T) определялись оптимальные температуры, при которых выполнялись последующие исследования. Исследования концентрационной зависимости ПОМ проводились при температурах нагрева 450 и 5000С в диапазоне концентраций 1 - 19700 ppm Н2 при семи значениях влажности газовой смеси 0, 10, 20, 40, 60, 80 и 100% RH. В качестве исходных газовых смесей использовались промышленная ПГС с концентрацией 19700 ppm (1.97 % об) Н2 и газовая смесь, приготовленная на лабораторной газосмесительной установке разбавлением ПГС, с концентрацией 175 ppm Н2. Всего было получено 105 диаграмм R(t,C,RH). Для всех исследованных ПОМ и каждого значения концентрации Н2 было проведено усреднение данных по сопротивлению в диапазоне влажности 0 (10)-100% RH по методике изложенной в разделе 3.2 Главы 3. Полученные данные были аппроксимированы уравнением lgRma = A + k·lgС.
Аналогичные действия были проведены для данных по чувствительности ПОМ к Н2 для диапазона влажности 0-100% RH. Полученные результаты были аппроксимированы уравнением lg(Sma-1) = B + n·lgC.
Средние значения порога чувствительности в диапазоне влажности 10-100% RH и в сухой газовой среде представлены в таблице 5.3. Результаты для порога чувствительности во влажном воздухе получены впервые.
Установлено, что по совокупности
«первичных» признаков (см. Главу 3), наилучшей для регистрации H2 являются две структуры: на основе чистой SnO2 и структуры SnO2 + 3% La2O3, работающие
Рис. 5.5. Чувствительность (отклик) исследованных структур ПОМ от температуры нагрева в сухой газовой среде при концентрации 200 ppm H2.
при температуре 5000С (потребляемая мощность 230 mW) и 4500С ( 200 mW), соответственно. Зависимости сопротивления Rma и чувствительности Sma от концентрации
Таблица 5.3. Порог чувствительности ПОМ к Н2 в диапазоне влажности 10-100 %RH и в сухой газовой среде при чувствительности S = 1.1.
| ПОМ | T, 0С | Сmin, ppm | |
| 0% RH | 0(10)-100%RH | ||
| SnO2 | 450 | - | 0.16 ± 0.01 |
| 500 | - | 0.06 ± 0.008 | |
| 300 | 100* | ||
| SnO2 + 3% Pd | 400 | 3 | 10 ± 5 |
| 450 | 4 | 14 ± 6 | |
| SnO2 + 3% La2O3 | 450 | - | 0.08 ± 0.006 |
| 500 | - | 0.22 ± 0.02 | |
| SnO2 +1% Pt +3% Pd | 450 | 1.5 | 4 ± 2 |
| 500 | 2 | 6 ± 2 | |
| SnO2 + 1% Sb2O5 + 3% La2O3 | 450 | 0.2 | 0.6 ± 0.3 |
| 500 | 0.5 | 0.8 ± 0.2 | |
| SnO2 + 3% Pd + Al2O3 (c.l.) | 450 | 1 | 2 ± 0.5 |
| 500 | 5 | 10 ± 5 | |
| 80 wt.% Fe2O3 + 20 wt.% SnO2 | 490 | 50 * | |
| NiO + CoO3 | 50-300 | 10 * | |
| FeNbO4 | 223 | 100 * | |
| Ga2O3 | 700 | 50 * | |
| Cu-Pc | 95 | 1 * | |
*литературные данные
для чистой SnO2 показаны на рис. 3.5 и 3.6 в Главе 3. Там же показаны аналитические выражения эмпирических уравнений и диапазон концентраций Н2, в которых производилась аппроксимация данных для Rma и Sma. Воспроизводимость показаний указанных структур во всём исследованном диапазоне концентраций 1-19700 ppm находится в пределах 4 - 10 %.
5.4. Аммиак.
На рис. 5.7 представлены температурные зависимости чувствительности семи исследованных нами структур ПОМ к NН3 при экспозиции 200 ppm в сухих газовых средах. Все кривые имеют чётко выраженный максимум в интервале температур 400 – 5000С. Наибольшей чувствительностью к NН3 обладают чистая SnO2 и структура SnO2 + 3% Pd c каталитическим слоем из Al2O3, а наименьшей – структуры SnO2 + 1% Sb2O5 + 3% La2O3 и SnO2 + 1% CuO. Из графиков видно, что введение каталитической добавки La приводит к повышению положения максимума чувствительности примерно на 1000С, а введение добавки Pd в SnO2 – к снижению положения максимума зависимости S(T) по сравнению с чистой SnO2. По графикам зависимостей S(T) определялись оптимальные температуры, при которых выполнялись последующие исследования.
Исследования концентрационной зависимости ПОМ проводились при температурах нагрева ПОМ 400 и 5000С в диапазоне концентраций 0.5 - 100 ppm NН3 при шести значениях влажности газовой смеси 0, 10, 20, 40, 60, и 80% RH. В качестве исходных газовых смесей использовались лабораторные газовые смеси,
Рис. 5.7. Чувствительность (отклик) исследованных структур ПОМ от температуры нагрева в сухой газовой среде при концентрации 200 ppm NН3.
Рис. 5.8. Среднеарифметические значения сопротивления структуры SnO2 + 3% La2O3 в диапазоне влажности 10 - 80% RH в зависимости от концентрации NН3 в воздухе.
приготовленные на газо-смесительной установке с концентрациями 89.4 ppm NН3 и 1900 ppm NН3. Всего было получено 72 диаграммы R(t,C,RH).
Для всех исследованных структур ПОМ и каждого значения концентрации NН3 было проведено усреднение данных по сопротивлению в диапазоне влажности 10-80 % RH по методике изложенной в разделе 3.2 Главы 3. Полученные данные были аппроксимированы уравнением lgRma = A + k·lgС.
Средние значения порога чувствительности в диапазоне влажности 10 - 80% RH и в сухой газовой среде представлены в таблице 5.4. Результаты для порога чувствительности к NН3 в сухом и влажном воздухе получены впервые.
Таблица 5.4. Порог чувствительности ПОМ к NН3 в диапазоне влажности 10-80 %RH и в сухой газовой среде при чувствительности S = 1.1.
| ПОМ | T, 0С | Сmin, ppm | |
| 0 % RH | 10-80% RH | ||
| SnO2 | 500 | 1.5 | 1 |
| SnO2 + 3% Pd | 400 | 1.5 | 1 |
| SnO2 + 3% La2O3 | 500 | 4 | 0.8 |
| SnO2 +1% Pt +3% Pd | 400 | 1.5 | 0.3 |
Установлено, что по совокупности «первичных» признаков (см. Главу 3) наилучшей для регистрации NН3 является структура SnO2 + 3% La2O3, работающая при температуре 5000С и потребляющая 230 mW. На рис. 5.8 показано аналитическое выражение эмпирического уравнения и диапазон концентраций NН3, в котором производилась аппроксимация данных для Rma. Воспроизводимость показаний этой структуры во всём исследованном диапазоне концентраций 0.5 - 100 ppm находится в пределах 8 - 14 %.
5.5. Окись азота.
На рис. 5.9 представлены температурные зависимости чувствительности семи исследованных нами структур ПОМ к NO при экспозиции 100 ppm в сухих газовых средах. Из графиков видно, что у всех кривых наблюдается резкий спадающий характер зависимостей S*(T) с повышением температуры. Только у структуры на основе чистой ZnO наблюдается максимум кривой S(T) в районе 3000С. Наибольших значений чувствительность к NO достигается при 1000С, а ее значение равно для структур на основе чистых SnO2, ZnO, WО3 и структур SnO2 + 1% Sb2O5 + 3% La2O3, SnO2 + 3% La2O3 и SnO2 + 1% Pt + 3% Pd равно 173, 76, 730, 82, 1240 и 134, соответственно. При температурах выше 4500С все структуры ПОМ практически перестают чувствовать NO. Введение каталитических добавок Sb и Pt c Pd в SnO2 приводит к понижению
чувствительности, а введение добавки La приводит к повышению чувствительности по сравнению с чистой SnO2. Наибольшей чувствительностью к NO в интервале температур 350-5000С обладают структуры ПОМ на основе чистых ZnO и WО3. Структуры SnO2 + 3% La2O3 и SnO2 + 1% Pt + 3% Pd при тех же температурах почти не чувствуют NO. По графикам зависимостей S(T) определялись оптимальные температуры, при которых выполнялись последующие исследования.
Исследования концентрационной зависимости ПОМ проводились при 2 – 3 значениях температуры нагрева в интервале от 300 до 4500С в диапазоне концентраций 0.5 - 100 ppm NO при семи значениях влажности газовой смеси 0, 10, 20, 40, 60, 80 и 100% RH. В качестве исходных газовых смесей использовались промышленная ПГС азота с концентрацией 740 ppm NO и газовая смесь азота с NO, приготовленная на лабораторной газосмесительной установке разбавлением ПГС, с концентрацией 100 ppm NO. Всего было получено 105 диаграмм R(t,C,RH). Для всех исследованных ПОМ и каждого значения концентрации NO было проведено усреднение данных по сопротивлению в диапазоне влажности 0-100% или 10 – 100% RH по методике, изложенной в разделе 3.2 Главы 3. Полученные данные были аппроксимированы линейной зависимостью в координатах [R - C], [lgR – C], [R – lgC] и [lgR – lgC].
Аналогичные действия были проведены для данных по чувствительности ПОМ к NO для диапазона влажности 0-100 и 10-100% RH. Полученные результаты были аппроксимированы уравнением lg(Sma* - 1) = В + n·lgC в той области концентраций и влажности, где реакция NO с ПОМ имеет акцепторный характер, т.е. чувствительность Sma* = Rgas/R0 > 1.
Средние значения порога чувствительности в диапазоне влажности 0(10)-100% RH и в сухой газовой среде представлены в таблице 5.5. Результаты для порога чувствительности в сухом и влажном воздухе получены впервые.
Установлено, что по совокупности «первичных» признаков (см. раздел 3.4 Главы 3), наилучшими для регистрации NO является ПОМ на основе чистой WO3, работающая при температуре 3500С (потребляемая мощность 180 mW). На рис. 5.10 показано аналитическое выражение эмпирического уравнения и диапазон концентраций
Рис. 5.9. Чувствительность (отклик) S* исследованных структур ПОМ от температуры нагрева в сухой газовой среде при концентрации 100 ppm NO.
Рис. 5.10. Среднеарифметические значения сопротивления чистой WO3 в диапазоне влажности 0-100% RH в зависимости от концентрации NO в воздухе.
Таблица 5.5. Порог чувствительности ПОМ к NO в диапазоне влажности 0 (10)-100 % RH и в сухой газовой среде при чувствительности S = 1.1.
| ПОМ | T, 0С | Сmin, ppm | |
| 0% RH | 0(10)-100%RH | ||
| SnO2 | 350 | 20 | 3 ± 0.05 |
| 400 | 20 | 8 ±1 | |
| - | 10 ppb NO2 * | ||
| - | 20 ppb NO2 * | ||
| ZnO | 400 | 8 | 10 ± 0.5 |
| 450 | 8 | 9 ± 0.3 | |
| WO3 | 350 | - | 1.6 ± 0.05 |
| 400 | - | 5 ± 0.2 | |
| 450 | - | 12 ± 2 | |
| - | 50 ppb NO2 * | ||
| SnO2 + 1% Sb2O5 + 3% La2O3 | 350 | 0.8 | 3.3 ± 0.2 |
| 400 | 0.1 | 4 ± 0.3 | |
| SnO2 + 3% La2O3 | 300 | 0.2 | 0.3 ± 0.01 |
| 350 | 0.5 | 2.2 ± 0.06 | |
| SnO2 +1% Pt +3% Pd | 300 | 80 | 10 ± 5 |
*литературные данные
NО, в котором производилась аппроксимация данных для Rma. Воспроизводимость показаний этой структуры во всём исследованном диапазоне концентраций 0.5 - 60 ppm находится в пределах 5 - 15 %.
Глава 6 . Динамические характеристики и каталитическая активность ПОМ.
В соответствии с описанной в Главе 3 методикой были проведены исследования динамических параметров ПОМ для восьми газов: CO, CH4, H2, NH3, H2O, С6Н14, С2Н5ОH и H2S. Измерения выполнены в газовых смесях с двумя во много раз отличающимися друг от друга значениями концентрации – 5 ppm и 98 ppm для СО, 20 и 10000 ppm для СН4, 100 ppb и 1000 ppm для Н2, 10 и 100 ppm для NH3, 0.3 и 3.0 % об для паров Н2О, 10 ppm и 2000 ppm для С6Н14, 100 ppb и 1000 ppm для С2Н5ОН и, наконец, 3 и 30 ppm для Н2S. ПОМ на основе чистой SnO2 и с добавками 3% La2O3 и 3% Pd исследовались со всеми газами. Для отдельных газов использовались также и другие составы газочувствительных слоёв. С целью получения наиболее объективной информации во всех исследованиях применялись одни и те же образцы ПОМ, которые перед измерениями на каждом газе подвергались длительной продувке в чистом воздухе. При изложении материала, который обстоятельно представлен в Главе 10 диссертации, мы ограничимся иллюстрацией результатов исследований только для одного газа - CO, тем более, что зависимости динамических параметров от температуры для всех газов однотипны.
Рис. 6.1. Быстродействие исследованных структур ПОМ при нарастании концентрации СО в воздухе в зависимости от температуры.
Рис. 6.2. Быстродействие исследованных структур ПОМ при спаде концентрации СО в воздухе в зависимости от температуры.
В качестве исходных газовых смесей в исследованиях с окисью углерода, метаном, водородом в области высоких концентраций использовались поверочные газовые смеси (ПГС), а в области низких концентраций и микроконцентраций смеси воздуха с Н2, СН4, NH3, C6H14, C2H5OH и H2S, которые готовились на лабораторной ГСУ.
По результатам исследований показано, что динамические параметры 0.9 и 0.9 ПОМ имеют резко спадающий характер с ростом температуры с достижением уровня 1 сек уже при температурах 450 – 5000С и не зависят от концентрации газов (см. рис. 6.1 и 6.2). Такая стабилизация параметров 0.9 и 0.9 объясняется тем, что наша аппаратура не позволяла измерять значения параметров 0.9 меньше 1 сек. Реальные значения параметров 0.9 при высоких температурах безусловно должны быть ниже 1 сек, поскольку скорость реакций с температурой только возрастает и, следовательно, времена реакции должны снижаться. Полученные нами численные значения параметров 0.9 и 0.9 во много раз, а иногда на порядки, ниже данных, приводящихся в литературных источниках. Исследования по быстродействию для паров воды в воздухе выполнены впервые.
Измеренные величины постоянной времени при нарастании концентрации 0.9 характеризуют скорость химических реакций газов на поверхности ПОМ и их каталитические свойства, а 0.9 - степень регенерируемости катализатора.
Каталитическая активность характеризуется скоростью химических реакций, которая определяется числом молекул конкретного вещества, реагирующих в единицу времени в единице объема. Используя полученные данные для 0.9 и концентрации молекул газа легко определить, что скорость реакции, например, СН4, с поверхностью ПОМ при указанных условиях будет не меньше 5.41017 см-3сек-1 1.910-2 мольсек-1 с тенденцией повышения с ростом температуры.
Глава 7. Стабильность и воспроизводимость показаний ПОМ.
7.1. Экспериментальные данные.
В данной Главе (в диссертации Глава 11) представлен экспериментальный материал, полученный в процессе 129 – суточных испытаний шести структур ПОМ с газочувствительными слоями из чистой SnO2 и SnO2 с пятью каталитическими добавками: 3% Pd, 3% La2O3, 1% Sb2O5 + 3% La2O3, 1% Pt + 3% Pd и 3% Pd c каталитическим слоем из Al2O3 на длительную стабильность и воспроизводимость показаний в газовых смесях воздуха с 16 ppm СО и 15000 ppm СН4. Испытания проводились в режиме непрерывной продувки измерительной камеры чистым воздухом и газовыми смесями с расходом 1 см3/сек при двух температурах нагрева каждой структуры при постоянной влажности газовой среды 55% RH. В качестве исходных газовых смесей использовались промышленные ПГС с концентрациями 98 ppm СО и 20600 ppm (2.06 % об) СН4. Длительности импульса концентраций СО и СН4 и времени продувки камеры чистым воздухом были приняты равными 1 часу. Результатом этих исследований были диаграммы импульсов сопротивления образцов ПОМ R(t,С). На рис. 7.1 представлены диаграммы R(t,C) для структуры SnO2 + 3% La2O3, продемонстрировавшей наилучшую воспроизводимость показаний в газовых смесях воздуха с СО и СН4. Методика непосредственных измерений проиллюстрирована для той же структуры на рис. 7.2 в увеличенном масштабе на 10 и 91 дни испытаний.
Из диаграммы на рис. 7.1 видно, что в момент подачи питания на нагреватель наблюдается резкий рост сопротивления в чистом воздухе R0 от его значения при комнатной температуре R0Тк (при этом на газочувствительный слой подано 10 В.) до величины R0 max. Достигнув наибольшего значения, сопротивление структур ПОМ далее начинает снижаться или дрейфовать со спонтанными выбросами и спадами, но в целом, как мы ожидаем, по асимптотическому закону. Установлено, что сопротивление для большинства структур ПОМ в газовых смесях Rg снижается симбатно с сопротивлением в чистом воздухе. Показано, что усредненный за период с 10 по 91 день испытаний (рис. 7.2) дрейф сопротивления R0 для исследованных структур находится в пределах – (0.2 – 0.7) % ·d-1, дрейф сопротивления в газовых смесях – в пределах (0.2 – 0.6) %·d-1 для СО и (0.1 – 0.5) %·d-1 для СН4, а дрейф чувствительности в среднем находится в пределах – (0.01 – 0.13) %·d-1 (для СО) и (0.2 – 0.5) %·d-1 (для СН4).
Непредсказуемость сопротивления в чистом воздухе R0 и, следовательно, чувствительности S, а также практическая невозможность измерить или даже проверить его величину во время эксплуатации приборов газового контроля позволяют сделать однозначный вывод, что чувствительность (отклик) является некорректным параметром для построения эмпирических концентрационных зависимостей сенсоров, изготовленных на основе ПОМ. Сопротивление же структур ПОМ в газовых смесях Rg, которое в отличие от чувствительности является непосредственно измеряемой величиной, меньше подвержено временным и «биографическим» факторам и может быть проконтролировано в процессе работы прибора. Тем самым очевидно, что сопротивление структур ПОМ является единственной мерой концентрации газовых примесей в воздухе. Поэтому для построения эмпирических концентрационных зависимостей ПОМ должны быть использованы опытные данные для сопротивления Rg(С) в координатах [R – C], [lgR – C], [lgR – lgC] и т.д., что и было сделано нами в Главе 5.
Определена воспроизводимость исследованных структур ПОМ, равная среднеквадратичному отклонению среднеарифметических величин сопротивления r = sd(Rma)/Rma. Для этого проведено усреднение значений Rg структур ПОМ для каждого газа в каждом цикле измерений в интервалах времени с нарастающим числом дней, начиная с последнего измерения в 99 день испытаний.
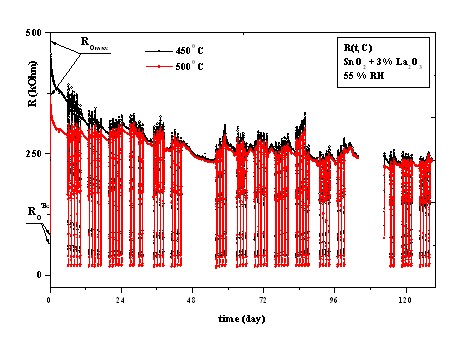
Рис. 7.1. Диаграммы сопротивления R(t,C) структуры SnO2 + 3% La2O3 при температурах нагрева 450 и 5000С в процессе испытания образцов.
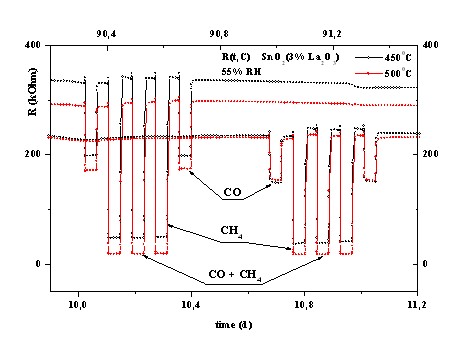
Рис. 7.2. Диаграммы сопротивления R(t,C) структуры SnO2 + 3% La2O3 под воздействием импульсов концентрации СО и СН4 на 10 (слева) и 91(справа) день испытаний
Показано, что воспроизводимость так же, как и само значение сопротивления Rma возрастает с удлинением интервала усреднения по мере приближения к началу испытаний. Определены временные интервалы, в которых воспроизводимость не превышает 5 %. Установлено, что по всем показателям для регистрации СО и СН4 наилучшей является структура SnO2 + 3% La2O3, нагретая до 5000С. Воспроизводимость показаний этой структуры при измерения концентрации обоих газов на уровне 16 ppm CO и 15000 ppm СН4 в воздухе, по крайней мере, с шестого дня испытаний не превышает 4.5 % для СО и 3 % для СН4, соответственно.
7.2. Интерпретация дрейфа сопротивления ПОМ.
Каждой температуре Т соответствует свое динамическое равновесие между поверхностью ПОМ и окружающим влажным воздухом, характеризуемое определенным количеством хемосорбированных ионов кислорода NOТ, количеством гидроксильных групп OH в КГС NOHТ и количеством вакансий кислорода NVoТ на поверхностных ионах Sn4+, суммарное количество которых определяется структурой кристаллитов газочувствительного слоя ПОМ:
NVoТ(Т,) + NOТ(Т,) + NOHТ(Т,) = NSn4+ (7.1)
Учитывая особенности барьерного механизма проводимости и сильную полярность молекул воды, можно предположить, что при комнатной температуре Тк во влажном воздухе поверхность ПОМ будет состоять в основном из гидроксильных групп и молекулярной воды, занимающих активные центры на ионах Sn4+
NН2ОТк() + NOHТк() = NSn4+, (7.2)
где NН2ОТк() – концентрация молекулярной воды. Как следствие, сопротивление ПОМ
при этом будет наименьшим. Это явление и наблюдается в действительности на диаграммах на рис. 7.1 при t = 0 (R0Tк), когда питание нагревателей еще не включено.
При включении питания нагрев ПОМ до температур 400 – 5000С происходит мгновенно. Также мгновенно за времена 10-12 – 10-6 сек происходит адсорбция молекул атмосферного кислорода, часть из которых участвует в процессе рекомбинации гидроксильных групп с образованием хемосорбированного иона кислорода О2-, и десорбция образованных молекул воды.
ОН + ОН + 1/2О2 + 2е Н2О + 2О2- ne = - 2е (7.3)
Поскольку концентрация гидроксильных групп при комнатной температуре определенно выше их концентрации при температуре Тh (см. тенденции на рис. 4.9), то и концентрация образованных в реакции (7.3) ионов О2- будет выше равновесного значения. Реакция (7.3) приводит к быстрому обеднению зоны проводимости ПОМ и, как следствие, к резкому росту сопротивления R0 до значения R0max, которое оказывается значительно больше равновесного значения при температуре Тh. Это явление отчетливо наблюдается на упомянутых диаграммах R(t,C) на рис 7.1.
По мере нахождения структур ПОМ в нагретом состоянии состав КГС будет стремиться к своему равновесному состоянию, которое определяется температурой нагрева Тh и должно характеризоваться (при постоянной влажности воздуха) меньшим количеством ионов О2- и гидроксильных групп ОН на поверхностных ионах олова Sn4+ и, соответственно, большим количеством свободных вакансий кислорода на тех же ионах олова согласно уравнению (7.1). Процесс удаления хемосорбированных ионов О2- и ОН происходит, вероятнее всего, по сценарию рекомбинации одноименных ионов в молекулы газов с их последующей десорбцией:
2О2- О2 + 2VO + 4е ne = + 4е (7.4)
2ОН Н2О + 1/2О2 + 2е ne = + 2е (7.5)
Результатом указанных реакций является высвобождение электронов в зону проводимости ПОМ и, как следствие, понижение сопротивления ПОМ, что и наблюдается в действительности. Снижение сопротивления будет продолжаться до тех пор, пока не установится динамическое равновесие, соответствующее температуре Тh, между молекулами кислорода и воды и количеством хемосорбированных ионов О2- и ОН в КГС в соответствии с уравнением (7.1). Таким образом, дрейф сопротивления ПОМ в чистом воздухе R0 при постоянной влажности, как в нашем случае, может быть объяснен простым перераспределением количества частиц на поверхности
NVoТ + NO2-Т + NOHТ = NSn4+, (7.6)
где символ означает увеличение количества частиц, символ - уменьшение.
Глава 8. Интерпретация полученных результатов. Физико-химические характеристики исследованных ПОМ: полупроводников, катализаторов и сенсоров (Глава 12 диссертации).
8.1. Механизм взаимодействия газов с поверхностью ПОМ.
В данном разделе будут представлены наиболее вероятные, на наш взгляд, схемы химических превращений и химических реакций газов на каталитически активных поверхностях ПОМ. Кроме того, для каждого газа будут представлены также реакции регенерации или восстановления поверхности катализатора после удаления газов. При описании взаимодействия исследованных газов с «кислородно-гидроксильным» слоем ПОМ и реакций регенерации мы придерживались следующих постулатов:
- При контактах молекул газов с реакционноспособными ион-радикалами О2- и гидроксильными группами ОН «кислородно-гидроксильного» слоя (КГС) первым актом является диссоциация молекул газов. Реакции термической диссоциации газов были заимствованы из химической литературы;
- Продукты диссоциации молекул газов взаимодействуют с указанными ионами КГС с образованием новых гидроксильных групп, дополнительных вакансий кислорода VO* и газов, которые десорбируются с поверхности ПОМ (символ );
- Все реакции будут рассматриваться для температурной области 300 – 5000С во влажном воздухе, когда на поверхности ПОМ наряду с КГС присутствуют свободные вакансии кислорода VO;
- Баланс электронов, образующийся в результате реакций газов с КГС, так и реакций регенерации поверхности ПОМ, должен соответствовать реально наблюдаемому изменению (по знаку) проводимости ПОМ;
- Во всех представленных ниже схемах реакций газов с двухзарядным хемосорбированным ионом кислорода О2- и гидроксильной группой ОН баланс электронов относится к одной молекуле взаимодействующего газа. Количество электронов, участвующих в реакциях каждого продукта диссоциации с ионами О2- и ОН разделяется на доли так, что его общее количество равно количеству электронов в реакциях взаимодействии того же продукта с ионом О2- в сухом воздухе (см. раздел 4.3 Главы 4). Электроны, высвобожденные при взаимодействии с ионом О2-, выделены полужирным курсивом.
Вода (Н2О), влажный воздух. Диссоциация, хемосорбция.
Н2О Н2 + 1/2·О2 и Н2 2·Н (8.1)
2·Н + 2·О2- 2ОН + 2·е ne = + 2·е (8.2)
Регенерация, удаление гидроксилов, десорбция молекул Н2О
2ОН + ·О2 + 2е Н2О + 2О2- ne = - 2е (8.3)
Итог: нулевой баланс электронов и восстановление КГС до состояния сухого воздуха.
Окись углерода (СО) СО С + ·О2 (8.4)
С + 2·О2- СО2+ 2VO* + 4·е ne= + 4е (8.5)
Регенерация после удаления СО
О2 + 2VO* + 4е 2О2- ne = - 4е (8.6)
Итог: нулевой баланс электронов и восстановление КГС до состояния влажного воздуха.
Метан (СН4) СН4 С + 2Н2 С + 4Н (8.7)
С + 2·O2- СO2+ 2·VO* + 4·e ne = + 4е (8.8)
4Н + 4О2- 4ОН + 4e ne = + 4e (8.9)
4Н + 4ОН 4Н2О + 4VO* + 4e ne = + 4e (8.10)
Регенерация
О2 + 2·VO* + 4·e 2О2- ne = - 4е (8.11)
2О2 + 4VO* + 8e 4О2- ne = - 8e (8.12)
4ОН + О2 + 4е 2Н2О + 4О2- ne = - 4е (8.13)
2Н2О 2Н2 + О2 4·Н + О2 (8.14)
4·Н + 4О2- 4ОН + 4·е ne = + 4·е (8.15)
Итог: нулевой баланс электронов и восстановление КГС до состояния влажного воздуха.
Водород (Н2) Н2 2Н (8.16)
2Н + 2О2- 2ОН + 2e ne = + 2e (8.17)
2Н + 2ОН 2Н2О+ 2VO*+ 2е ne = + 2e (8.18)
Регенерация
2ОН +1/2О2 + 2e Н2О + 2О2- ne = - 2e (8.19)
О2 + 2VO* + 4е 2О2- ne = - 4е (8.20)
Н2О Н2 + 1/2О2 2·Н + 1/2О2 (8.21)
2·Н + 2О2- 2ОН + 2·е ne = + 2·е (8.22)
Итог: нулевой баланс электронов и восстановление КГС до состояния влажного воздуха
Аммиак (NH3) NН3 ·N2 + 3/2·Н2 и 3/2·Н2 3Н (8.23)
3Н + 3О2 3ОН + 3·e ne = + 3·e (8.24)
3Н + 3ОН 3Н2О+ 3VO* + 3·e ne = + 3·e (8.25)
Регенерация:
3ОН + 3/4О2 + 3·e 3/2Н2О + 3О2 ne = - 3·e (8.26)
3/2О2 + 3VO* + 6·e 3·О2- ne = - 6·e (8.27)
3/2Н2О 3/2Н2 + 3/2О2 3·Н + 3/2О2 (8.28)
3·Н + 3О2- 3ОН + 3·е ne = + 3·е (8.29)
Итог: нулевой баланс электронов и восстановление КГС до состояния влажного воздуха.
Окись азота (NO) (используются свободные вакансии кислорода VO )
NO ·N2 + ·О2 (8.30)
·О2 + VO + 2·е О2- ne = - 2e (8.31)
·О2 + 2ОН + 2·е Н2О + 2О2- ne = - 2e (8.32)
Регенерация
О2- ·О2+ VO + 2·е ne = + 2e (8.33)
Н2О Н2 + 1/2О2 2·Н + 1/2О2 (8.34)
2·Н + 2О2- 2ОН + 2·е ne = + 2·е (8.35)
Итог: нулевой баланс электронов и восстановление КГС до состояния влажного воздуха.
Как было отмечено в разделе 4.3 Главы 4, при температурах выше 300-4000С с повышением влажности воздуха в КГС начинают превалировать гидроксильные группы ОН на фоне уменьшения концентрации хемосорбированных ионов кислорода О2-. Следствием этого должно быть снижение числа актов продуктов диссоциации газов с ионами О2- и, напротив, повышение числа актов с группами ОН. Поэтому из-за снижения количества электронов, высвободившихся в результате реакций (8.7), (8.8 -8.9), проводимость ПОМ и, соответственно, их чувствительность к СО и СН4 должна уменьшиться, что и наблюдается в действительности. В случае NH3, исходя из реакций (8.24) и (8.25), снижения чувствительности, так же, как в случае с Н2, не должно наблюдаться. Однако, в действительности, как показано в диссертации, влажность воздуха оказывает заметное влияние на чувствительность ПОМ к NH3. Тому причиной является барьерный механизм проводимости, который особенно существенен для полярных молекул, к которым относится NH3 и Н2О (см. раздел 4.2 Главы 4). Проводимость ПОМ при взаимодействии с NO во влажном воздухе согласно реакциям (8.31) и (8.32) должна понизиться из-за образования дополнительных ионов кислорода О2-, а чувствительность S*, напротив, возрасти. Эту закономерность мы и наблюдаем в действительности для чистой SnO2. Для чистой же WO3 мы имеем обратную картину – чувствительность с повышением влажности понижается.
8.2. Каталитическая активность исследованных ПОМ.
Полученные экспериментальные данные позволяют сделать заключение о типе реакции газов с поверхностью ПОМ. Хорошо известно, что скорость реакций всегда возрастает с температурой, т. е. dg/dT > 0. Подтверждением этому являются полученные нами результаты по быстродействию ПОМ. Из зависимостей (T) и 0.9(Т), полученных для всех донорных газов СO, CH4, H2, NH3, H2O, C6H14 и C2H5OH, следует, что в интервале температур 400 – 6000С для всех исследованных ПОМ d/dT>0 и dg/dT ~ - d0.9/dT > 0. Отсюда следует, что dg/d > 0, т.е. скорость реакций симбатно изменяется с проводимостью ПОМ.
Зная характер зависимости скорости реакций (каталитической активности) от проводимости и тип полупроводника, можно, таким образом, сделать заключение о типе реакции газов с поверхностью ПОМ. Чистая SnO2 является полупроводником n – типа. Структуры SnO2 с акцепторными добавками La, Pd, Pt и Cu относятся к полупроводникам р – типа. Поэтому на основании имеющихся фактов можно утверждать, что реакции донорных газов с ПОМ, протекающие с высвобождением электронов в зону проводимости и повышением заряда поверхности, при наличии КГС должны относиться к донорным или р – реакциям независимо от типа полупроводника. Скорость этих реакций тем выше, чем ниже или ближе к валентной зоне расположен уровень Ферми. Однако, сказанное не соответствует данным Волькенштейна, согласно которому при dg/d > 0 в случае n – полупроводника реакция указанных газов должна быть отнесена к акцепторному или n – типу, который, как известно, сопровождается захватом электронов из зоны проводимости и усилением электроотрицательности поверхности.
Для единственного акцепторного газа NО характер реакций с исследованными ПОМ на основе чистых SnO2, WO3, ZnO и структур SnO2 с добавками La, Pt и Pd при температурах выше 3000С наблюдаются те же тенденции, что и для донорных газов. Исследования по быстродействию для NO не проводились, но и для него dg/dT > 0. Для всех указанных выше ПОМ также наблюдается увеличение проводимости с температурой, т. е. d/dT > 0. Таким образом, скорость реакций ПОМ с NО также симбатно должна изменяться с проводимостью ПОМ, dg/d > 0. По этим признакам согласно Волькенштейну реакции акцепторного газа NO с поверхностью полупроводников n – типа (SnO2, WO3, ZnO) должны носить акцепторный или n – характер, а реакции NO с поверхностью полупроводников р – типа SnO2 с добавками La, Pt и Pd должны относиться к донорной или р – реакции. На самом деле это не соответствует действительности. Реакции NO с полупроводниками n – типа и р –типа, как было показано в разделе 5.5 Главы 5, происходят с захватом электронов и отчетливо демонстрируют акцепторный или n – характер с уменьшением проводимости.
Отмеченные несоответствия могут объясняться присутствием на поверхности ПОМ «кислородно-гидроксильного слоя», в то время как Волькенштейн в своем труде, возможно, имел в виду чистые поверхности ПОМ без КГС. Эти обстоятельства вызывают необходимость в нахождении дополнительных критериев по определению типа реакций как для донорных, так и акцепторных газов с ПОМ в условиях присутствия на их поверхности КГС. Такой критерий был найден – это абсолютная величина чувствительности S. В самом деле, для донорных газов S = g/0 > 1 и это условие для всех донорных газов хорошо выполняется, иллюстрацией чего является любая из представленных в Главе 5 зависимостей S(T) для исследованных донорных газов независимо от типа полупроводника. Что касается тенденции чувствительности в зависимости от температуры, то dS/dT может быть как больше нуля (до Smax), так и меньше нуля (после Smax), что наблюдается для исследованных n и р - полупроводников (см. Главу 5). Вместе с тем, для донорного газа СО S может быть, как следует из рис. 5.1, 8.2 и 8.3 меньше единицы, что свидетельствует об акцепторном характере реакции со структурами SnO2 + 1% CuO и SnO2 + 3% Pd + Al2O3 (кат. слой).
Для акцепторного газа NO чувствительность S = 1/S* = g/0 < 1 и dS/dT > 0. Указанные тенденции и наблюдаются в действительности, иллюстрацией чего являются графики зависимостей S(Т) для NO на рис. 8.1 для чистой SnO2, а также для других исследованных в этом газе ПОМ (рис. 5.9). Критерии по определению типа реакций газов с ПОМ в условиях существования на их поверхности КГС представлены в таблице 8.1.
Таблица 8.1. Критерии по определению типа реакций газов с ПОМ в условиях существования на их поверхности КГС.
| n - полупроводник | р - полупроводник | |
| n - реакция | dg/d > 0 S < 1 | dg/d > 0 S < 1 |
| p - реакция | dg/d > 0 S > 1 | dg/d > 0 S > 1 |
8.3. Чувствительность и селективность ПОМ к анализируемым газам.
По результатам температурных исследований чувствительности для каждого типа ПОМ были построены графики S(T), отдельные из которых показаны в Главе 5. Здесь мы ограничимся показом только таких зависимостей, по которым можно сделать выводы о селективности ПОМ к двум газам NO и СО. Исходя из критериев, приведенных в таблице 8.1, акцепторный или n-тип характер реакций взаимодействия NO наблюдается со структурами на основе чистой SnO2 и SnO2 с каталитическими добавками 3% La2O3, 1% Sb2О5 + 3% La2О3 и 1% Pt + 3% Pd.
Чистая SnO2 сохраняет акцепторный характер взаимодействия с NO (рис. 8.1) без изменений вида зависимости S(T) вплоть до температуры 6000С. Отмеченные закономерности особенно характерны для сухого воздуха. Влажность воздуха при RH > 10 – 20% способствует необратимости акцепторного характера взаимодействия NO c поверхностью ПОМ. Это наглядно показано в диссертации на примере структур на основе чистых SnO2 и ZnO и структуры SnO2 + 1% Pt + 3% Pd. Такой же характер взаимодействия NO наблюдается для чистой WO3. Акцепторный или n - тип реакций NO с ПОМ является критерием селективности сенсоров к этому газу по отношению ко всем остальным исследованным газам.
Вторым газом, который демонстрирует аналогичные закономерности в сухом воздухе, является СО. Достаточно посмотреть на рис. 8.2 и 8.3, чтобы в этом убедиться. Реакции СО со
структурами SnO2 + 3 % Pd с каталитическим
Рис. 8.1. Чувствительность чистой SnO2 к различным газам.
слоем из Al2O3 и SnO2 + 1% CuO в интервале температур 150 – 3500С имеют ярко выраженный акцепторный или n – тип характер реакций. В
этой области температур указанные ПОМ селективны к СО по отношению к остальным газам, кроме, может быть, NO.
Из полученных нами графиков S(T) следует, что чувствительность ПОМ к различным донорным газам при температурах выше 4500С имеет сравнительно высокие и вместе с тем достаточно близкие значения. Пожалуй единственным исключением здесь является пара СО–СН4 при взаимодействии со структурой SnO2 + 3% Pd с каталитическим слоем из Al2O3: эта структура практически не чувствует СО в то время как его чувствительность к СН4 имеет значение 4-5 в оптимальной области температур.
Все отмеченные явления относятся к газам с равными концентрациями 200 ppm в сухом воздухе. К сожалению, измерить низкую концентрацию газа (того же СО) на фоне
высокой концентрации другого газа (СН4) на сегодня довольно затруднительно, если характеры реакций газов принадлежат к одному типу. Единственным исключением здесь является структура SnO2 + 1% CuO (рис. 8.3), которая проявляет селективные свойства к различным газам (в том числе к СО) по отношению к СН4 при температурах
ниже 4500С. Для решения той же задачи следует пристальней присмотреться к структуре SnO2 + 3 % Pd с каталитическим слоем из Al2O3 и предложить следующий
Рис. 8.2. Чувствительность структуры SnO2(Pd, Al2O3) к различным газам.
Рис. 8.3. Чувствительность структуры SnO2 + 1% CuO к различным газам.
двух - температурный режим работы сенсора: при нагреве до 200 – 3000С производить измерения СО при акцепторном характере реакции, а при 450 – 5000С – измерения СН4 при донорном характере реакции.
ЗАКЛЮЧЕНИЕ.
В процессе реализации целей и задач, поставленных в Общей характеристике работы, были выполнены исследования, перечень которых отражен в разделах “Научная новизна” и “Основные положения, выносимые на защиту”. Отметим, что большинство исследований и полученных в процессе их выполнения результатов по характеристикам и свойствам исследованных ПОМ представлены впервые. Во избежание повторяемости мы остановимся здесь на наиболее существенных, с нашей точки зрения, выводах, вытекающих из проделанной работы.
1. Разработан универсальный экспериментально измерительный комплекс для исследования и калибровки образцов газочувствительных датчиков разных типов (полупроводниковых, термокаталитических, оптических и т. д.) в газовых смесях воздуха, азота, аргона и т.д. с различными (в том числе токсичными) газами.
2. По результатам исследований образцов ПОМ в азоте, сухом и влажном воздухе установлено, что проводимость является результатом химических превращений молекул
кислорода и воды на каталитически активных поверхностях ПОМ, и однозначно
отображает процесс формирования хемосорбированных ионов О и О2- и гидроксильных
групп ОН в кислородно-гидроксильном слое (КГС) на поверхности ПОМ. По экспериментальным данным дана оценка состава КГС, построены графики хемосорбции ионов кислорода О и О2- и гидроксильных групп ОН в зависимости от температуры. Установлено, что формирование иона О происходит до температур 400-5000С с максимумом в интервале 110 – 2200С, а формирования иона О2- - от температур 250-3000С с максимумом в области 6500С. Показано, что формирование гидроксильных групп происходит во всем исследованном интервале температур от комнатной до 6500С.
Установлено, что концентрация хемосорбированных ионов в КГС определяется концентрацией электронов в зоне проводимости ПОМ. Показано, что, по крайней мере, при температурах выше 350-4000С общее количество активных центров (ионов Sn4+), занятых ионами О2- и группами ОН, будет неизменным и перераспределяется между указанными ионами с изменением влажности. Установлено, что при увеличении влажности воздуха и температуры ПОМ в КГС все более будут превалировать гидроксильные группы и реакции продуктов диссоциации газов с ними.
3. По результатам выполненных систематических исследований структур ПОМ в газовых смесях воздуха с СО, СН4, Н2, NH3, NO в широком диапазоне концентраций и влажности от 0 до 100% RH установлено, что сопротивление и чувствительность образцов ПОМ слабо зависят от влажности газовой среды при RH 0 - 10 %. Определены оптимальные структуры ПОМ для регистрации газов: SnO2 + 1% Sb2O5 + 3% La2O3 (СО, 4500С), SnO2 + 1% Pt + 3% Pd (СН4, 4000С), чистая SnO2 (Н2, 5000С), SnO2 + 3% La2O3 (NН3, 5000С) и чистая WO3 (NO, 3500С). Для всех исследованных газов и ПОМ получены эмпирические концентрационные зависимости, описывающие опытные данные практически во всей области концентраций в диапазоне влажности 0 (10) – 100 % RH с погрешностью до 10 - 15%.
4. По результатам проведенных 129 – суточных испытаний шести типов ПОМ на длительную стабильность и воспроизводимость показаний в газовых смесях воздуха с СО и СН4 при различных температурах нагрева и влажности воздуха 55 % RH показано, что единственной мерой концентрации газовых примесей в воздухе может быть только сопротивление ПОМ, которое гораздо меньше подвержено временным и «биографическим» факторам. Установлено, что для регистрации СО и СН4 наилучшей по стабильности и воспроизводимости показаний является структура SnO2 + 3% La2O3, нагретая до 5000С. Воспроизводимость показаний для этой структуры, по крайней мере, с шестого дня испытаний не превышает 4.5 % для СО и 3 % для СН4.
5. Получены новые данные для порога чувствительности Сmin к анализируемым газам в сухом и влажном воздухе, значения которых во много раз (иногда на порядки) ниже литературных данных для сухого воздуха. Так величина Сmin при чувствительности S = 1.1 в диапазоне влажности 0(10) –100 % RH составляет: 0.80 ppm CO для структуры SnO2 + 1% Sb2O5 +3% La2O3 при температуре 4500С, 10 ppm CН4 для структуры SnO2 + 1% Pt +3% Pd (4000С), 0.06 ppm Н2 для чистой SnO2 (5000С), 0.8 ppm NН3 для структуры SnO2 + 3% La2O3 (5000С) и 1.6 ppm NО для структуры WO3 (3500С).
6. Представлены наиболее вероятные, по мнению автора, химические реакции взаимодействия газов с поверхностью ПОМ, построенные по схеме: диссоциация газа реакции продуктов диссоциации с обоими хемосорбированными ионами О2- и ОН, входящими в состав КГС. Впервые представлены реакции регенерации ПОМ в сухом и влажном воздухе после удаления газов. Для каждой реакции газов с КГС представлен баланс электронов, хемосорбированных ионов и дополнительных вакансий кислорода.
7. На основе анализа экспериментальных данных по проводимости и чувствительности ПОМ определены новые критерии по установлению типа реакций для донорных и акцепторных газов с ПОМ в условиях существования на их поверхности «кислородно-гидроксильного» слоя. Установлено, что реакции СO, CH4, H2, NH3, H2O с поверхностью исследованных ПОМ должны быть отнесены к донорному или р-типу реакции независимо от типа полупроводника, а реакция NО с поверхностью ПОМ к акцепторному или n – типу реакции, особенно, при концентрациях выше 1-10 ppm NО и влажности выше 10% RH.
В Библиографии представлен список цитируемой литературы из 155 наименований.
В Приложении 1 изложены технологические аспекты приготовления образцов ПОМ на основе двуокиси олова с различными каталитическими добавками. В Приложении 2 приведено описание газо-смесительной установки. В Приложении 3 представлено описание универсального газового стенда для прецизионной калибровки приборов по измерению расхода воздуха.
Материалы диссертации представлены в следующих основных публикациях:
1. V. V. Malyshev, A. A. Vasiliev, A. V. Eryshkin, E. A. Koltypin etc, “Gas sensitivity of SnO2 and ZnO thin-film resistive sensors to hydrocarbons, carbon monoxide and hydrogen”, Sens. Actuators B, 10, 1992, 11-14.
2. V. V. Malyshev, A. V. Eryshkin, E. A. Koltypin, A. E. Varfolomeev, A. A. Vasiliev, ”Gas sensitivity of semiconductor Fe2O3 –based thick-film sensors to CH4, H2 and NH3”, Sens. Actuators B, 18-19, 1994, 434-436.
3. А. Е. Варфоломеев, А. А. Васильев, A. В. Ерышкин, В. В. Малышев, А. С. Разумов, “Чувствительность к NH3 как функция потенциального барьера в толстоплёночных сенсорах на основе Fe2O3”, ЖАХ, 50, № 1, 1995, 42-44.
4. V. V. Malyshev, A. V. Pislyakov, ”SnO2-based thick-film-resistive sensor for H2S detection in the concentration range of 1 – 10 mg·m-3”, Sens. Actuators B, 47, 1998, 181-188.
5. В. В. Малышев, А. В. Писляков, “Селективный газовый сенсор метана”, Датчики и системы, № 8, 2000, 46-49.
6. В. В. Малышев, А. В. Писляков, И. Ф. Крестников, В. А. Крутов, С. Н. Зайцев, “Чувствительность полупроводниковых газовых сенсоров к водороду и кислороду в инертной газовой среде”, ЖАХ, 56, № 9, 2001, 976-983.
7. В. В. Малышев, А. В. Писляков, “Быстродействие полупроводниковых металлооксидных толстоплёночных сенсоров и их чувствительность к различным газам в воздушной газовой среде. Часть 1. Технология получения и конструкция газовых сенсоров. Методика эксперимента и обработки данных. Результаты измерений для метана, водорода и окиси углерода”, Сенсор, № 1, 2001, 2-15.
8. В. В. Малышев, А. В. Писляков, “Быстродействие и чувствительность полупроводниковых металлооксидных толстоплёночных сенсоров к различным газам в воздушной газовой среде. Часть 2. Результаты измерений для гексана, этанола, аммиака и сероводорода”, Сенсор, № 3 (5), 2002, 11-22.
9. V. V. Malyshev, A. V. Pislyakov, “Dynamic properties and sensitivity of semiconductor metal-oxide thick-film sensors to various gases in air gaseous medium”, Sens. Actuators B, 96, 2003, 413-434.
10. V. V. Malyshev, A. V. Pislyakov, “Investigation of gas-sensitivity of sensor structures to carbon monoxide in a wide range of temperature, concentration and humidity of gas medium”, Sens. Actuators B, 123, 2007, 71-81.
11. V. V. Malyshev, A. V. Pislyakov, “Investigation of gas-sensitivity of sensor structures to hydrogen in a wide range of temperature, concentration and humidity of gas medium”, Sens. Actuators B, 134, 2008, 913-921.
12. V. V. Malyshev, “Response of Semiconducting Metal Oxides to Water Vapor as a Result of Water Chemical Transformations on Catalytically Active Surfaces”, Rus. J. Phys. Chem. A, 82, № 13, 2008, 2329-2339.
13. В. В. Малышев, А. В. Писляков, “Исследование газочувствительности полупровод-никовых оксидов металлов на основе двуокиси олова к метану в широкой области температур, концентраций и влажности газовой среды”, ЖАХ, 64, № 1, 2009, 99-110 (принята в печать).

