Эндофитные бактерии растений гороха как активный компонент бобово-ризобиальной симбиотической системы
На правах рукописи
Гарифуллина Динара Вакилевна
ЭНДОФИТНЫЕ БАКТЕРИИ РАСТЕНИЙ ГОРОХА
КАК АКТИВНЫЙ КОМПОНЕНТ БОБОВО-РИЗОБИАЛЬНОЙ
СИМБИОТИЧЕСКОЙ СИСТЕМЫ
Специальности 03.02.03 – Микробиология
03.01.06 – Биотехнология (в том числе нанобиотехнология)
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Уфа – 2012
| Работа выполнена в Федеральном государственном бюджетном образовательном учреждении высшего профессионального образования «Башкирский государственный аграрный университет» | ||
| Научные руководители: | доктор биологических наук, профессор Хайруллин Рамиль Магзинурович кандидат биологических наук, доцент Гарипова Светлана Равилевна | |
| Официальные оппоненты: | доктор биологических наук, профессор кафедры биохимии и биотехнологии Федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Башкирский государственный университет» Киреева Наиля Ахняфовна | |
| доктор биологических наук, доцент, ведущий научный сотрудник Федерального государственного бюджетного учреждения науки Института биохимии и генетики Уфимского научного центра Российской академии наук Баймиев Алексей Ханифович | ||
| Ведущая организация: Федеральное государственное бюджетное учреждение науки Институт биохимии и физиологии растений и микроорганизмов Российской академии наук, г. Саратов | ||
| Защита диссертации состоится «25» мая 2012 г. в 14 часов на заседании Объединенного диссертационного совета ДМ 208.006.05 при Государственном бюджетном образовательном учреждении высшего профессионального образования Башкирский государственный медицинский университет Министерства здравоохранения и социального развития Российской Федерации по адресу: 450000, г. Уфа, ул. Ленина, 3. Тел.: (347)273-58-51 | ||
| С диссертацией можно ознакомиться в библиотеке и на официальном сайте www.bgmy.ru | ||
| Автореферат разослан «25» апреля 2012 г. | ||
| Ученый секретарь диссертационного совета | К.А. Лукманова | |
ВВЕДЕНИЕ
Актуальность темы. Экологически безопасным приемом повышения продуктивности и устойчивости растений является предпосевная обработка семян микроорганизмами, способными контролировать развитие фитопатогенов и стимулировать рост растений. В настоящее время большие перспективы связаны с разработкой микробных биопрепаратов на основе эндофитных бактерий, которые населяют внутренние ткани растений без вреда для хозяина [Hallmann J. et al., 1997]. К 2006 г список бактерий-эндофитов включал 219 видов, относящихся к 71 роду [Hallmann J., Berg G., 2006]. Ткани бобовых растений помимо ризобий населены неклубенькообразующими эндофитами, относящимися к родам Aerobacter, Aeromonas, Agrobacterium, Bacillus, Chryseomonas, Curtobacterium, Enterobacter, Erwinia, Flavimonas, Pseudomonas, Sphyngomonas и др. [Gagne S. et al., 1987; Sturz A. V. et al., 1997]. Взаимоотношения эндофитных бактерий с бобово-ризобиальной симбиотической системой практически не изучены. Поскольку известно, что многие эндофитные бактерии обеспечивают защиту растений от болезней [Sturz A.V., Matherson, 1996; Cho C.J. et al., 2003; Недорезков В.Д., 2003; Ziedan E.H.E., 2006; Berg G. et al., 2008; Chen X.-H.et al., 2009], способны к азотфиксации [Reinhold-Hurek B. and Hurek T. 1998; Gyaneshwar P. et al., 2001; Kuklinski-Sorbal J. et al., 2004], продукции фитогормон-подобных соединений [Long H.H.et al., 2008; Широких A.A. и др., 2008; Jha P., Kumar A., 2009; Palaniappan P. et al., 2010], стимулированию клубенькообразования на корнях растений [Bai Y. et al., 2003; Lee K.D. et al., 2005], не исключено, что совместное действие эндофитных микроорганизмов с клубеньковыми бактериями может в большей степени повышать экологическую пластичность макросимбионта, чем при индивидуальном бактериальном воздействии. Выяснение фундаментальных вопросов межмикробных и микробно-растительных отношений позволит познать механизмы формирования высокоэффективных комбинаций макро- и микросимбионтов для повышения продуктивности и устойчивости культурных растений.
Цель исследования:
В бобово-ризобиальной симбиотической системе оценить роль эндофитных бактерий из корней гороха (Pisum sativum L.) как потенциальной основы микробиологических препаратов для растениеводства.
Задачи исследования:
1 Выделить бактериальные эндофиты из внутренних тканей корней гороха и оценить их фунгистатическую активность по отношению к основным грибным фитопатогенам, вызывающим корневые гнили, а также способность регулировать рост растений.
2 Определить характер взаимоотношений эндофитов с бактериями Rhizobium leguminosarum bv. viceae in vitro.
3 Получить штамм эндофитной бактерии с репортерным геном gfp и изучить возможные пути проникновения эндофитов в ткани корня гороха.
4 Выявить штаммы эндофитов, перспективные в качестве основы препаратов для повышения продуктивности растений гороха и их устойчивости к корневым гнилям.
5 Оценить эффективность применения экспериментальных препаратов для повышения семенной продуктивности гороха и защиты растений от корневых гнилей.
Научная новизна исследования.
Установлено, что бактериальные эндофиты корня гороха являются широко распространенными компонентами растительно-микробного сообщества, способными активно влиять на формирование бобово-ризобиального симбиоза, устойчивость макросимбионта к корневым гнилям и его продуктивность. Впервые показано, что такими свойствами обладают как отдельные бактериальные штаммы, так и их ассоциации, населяющие клубеньки, а также другие органы растений гороха. С помощью рекомбинантного штамма Serratia sp. с геном зеленого флуоресцирующего белка выявлена способность этой бактерии заселять внутренние ткани корня растения гороха и её локализация в них. Впервые выделены и охарактеризованы новые эндофитные штаммы бактерий Rh. leguminosarum bv. viceae, а также родов Pseudomonas и Serratia с хозяйственно полезными свойствами.
Практическая значимость работы.
Полученные результаты расширяют представления о составе симбиотических сообществ гороха с бактериальными эндофитами и процессах их формирования, что повышает эффективность поиска новых штаммов бактерий в качестве основы микробиологических препаратов для растениеводства. Выделены новые штаммы Rh. leguminosarum bv. viceae B2, Rh16, Serratia sp. Ent16, эффективно повышающие урожайность растений гороха, а также их устойчивость к корневым гнилям. Выделен новый штамм Serratia sp. Ent16, который по совокупности свойств является перспективным в качестве основы биопрепарата для растениеводства. Получен его трансформированный мутант с геном зеленого флуоресцирующего белка, пригодный для изучения мутуалистических взаимоотношения этих бактерий с растениями гороха.
Положения, выносимые на защиту:
1 Во внутренних тканях растений гороха распространены эндофитные штаммы бактерий с комплексной биологической активностью по отношению к бобово-ризобиальной симбиотической системе.
2 В клубеньках корней гороха встречаются многовидовые бактериальные ассоциации, способные мутуалистически сосуществовать с бактериями Rhizobium leguminosarum bv. viceae.
3 Штамм Serratia sp. Ent16 является эндофитным и способен позитивно влиять на рост и развитие растения-хозяина, стимулировать формирование симбиотической системы гороха с ризобиями и повышать продуктивность растений.
4 Новые штаммы Rh. leguminosarum bv. viceae. Rh16 и Serratia sp. Ent16 могут служить основой для производства микробиологических препаратов с целью повышения урожайности зерна гороха.
Апробация диссертации.
Материалы диссертации были представлены и доложены на: Всероссийской конференции с международным участием «Фундаментальные и прикладные аспекты исследования симбиотических систем» (Саратов, 2007); IV молодежной школе-конференции с международным участием «Актуальные аспекты современной микробиологии» (Москва, 2008); II Всероссийской научно-практической конференции молодых ученых и аспирантов «Молодежная наука и АПК: проблемы и перспективы» (Уфа, 2008); V Всероссийской конференции молодых ученых «Стратегия взаимодействия микроорганизмов и растений с окружающей средой» (Саратов, 2010).
Публикации.
По теме диссертации опубликовано 18 работ, из которых 4 статьи – в журналах, указанных в перечне ВАК.
Структура и объем диссертации.
Диссертация состоит из введения, 3-х глав, включающих обзор литературы, описание объектов и методов исследований, результатов исследований и их обсуждения, выводов, списка литературы (299 наименования, из которых 231 на иностранном языке). Работа изложена на 124 страницах, включая 12 рисунков и 23 таблицы.
Связь с тематическим планом работ ВУЗа.
Исследования выполнялись в рамках заказа Минсельхоза России за счет средств Федерального бюджета в соответствии с тематическим планом работ ВУЗа, утвержденным директором Департамента МСХ РФ по теме: «Разработка полифункциональных биофунгицидов для растениеводства» (№ Госрегистрации 01200853490).
СОДЕРЖАНИЕ РАБОТЫ
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами для выделения эндофитных бактерий являлись растения гороха Pisum sativum L. сортов Чишминский 95 и Орлус. Для оценки ростстимулирующего эффекта эндофитов использовали растения пшеницы Triticum aestivum L. сорта Омская 35, растения рапса Brassica napus L. Штамм бактерии Rhizobium leguminosarum bv. viceae 1078 был получен из ВНИИСХМ (С.-Пб.-Пушкин). Штамм Echerichia coli XL-blu, содержащий плазмиду pRL-gfp 765, использованный для трансформации штамма Serratia sp. Ent16 был получен из коллекции Института биохимии и генетики УНЦ РАН. В качестве возбудителей корневых гнилей использовали грибы Fusarium oxysporum (Schlecht) f.sp. pisi (Hal.), Bipolaris sorokiniana Sacc. (Shoem) и Botrytis byssoidea из коллекции ФГБОУ ВПО «Башкирский ГАУ».
Для выделения бактериальных ассоциаций из клубеньков отбирали здоровые растения гороха в стадии бутонизации, растущие в поле на черноземе выщелоченном. Для выделения эндофитов из тканей других органов гороха растения выращивали в теплице. Клубеньки, части других органов растений помещали на 20 минут в 0,2%-ный раствор диацида (этанолмеркурхлорид + цетилпиридиния хлорид в соотношении 1:2), который затем удаляли пятикратной промывкой материала в стерильной дистиллированной воде. Затем смачивали спиртом, обжигали в пламени спиртовки 2-3 секунды, после чего микроорганизмы выделяли путем переноса тканей на питательный агар. Изоляты хранили на соответствующих их выделению средах. Чистые культуры бактерий получали общепринятым методом [Егоров H.C., 1976].
Способность ассоциаций и штаммов бактерий подавлять рост грибных фитопатогенов определяли методом агаровых блоков, в случае большого количества изолятов, использовали репликатор. Для оценки ростстимулирующих свойств штаммов и их ассоциаций суспензией клеток суточных культур инокулировали семена растений. Затем семена проращивали в темноте и через определенное время измеряли размеры органов. Контрольными были семена, обработанные водой.
Суспензии клеток получали смывом с твердой питательной среды 0,9%-ным раствором NaCl культуры бактерий, растущих на гороховом агаре, или на селективной среде для бактерий рода Рseudomonas (HiMedia, Индия), или на среде LB. Необходимую концентрацию клеток различной плотности, измеряемую по оптической плотности суспензии, получали путем кратного разведения.
Видовую идентификацию бактерий осуществляли по морфолого-культуральным и физиолого-биохимическим свойствам методами, описанными в литературе [Определитель бактерий Берджи, 1997; Скворцова И.Н., 1984; Смирнов В.В., Киприанова Е.А., 1990] при помощи тест-систем «Системы индикаторные бумажные для идентификации микроорганизмов» (ФГУП «НПО «Микроген»).
Видовую принадлежность перспективных штаммов уточняли секвенированием клонированного фрагмента гена 16S рРНК, используя автоматический секвенатор ABI PRISM 310 («Applied Biosystems», США), наборы для секвенирования «Big Dye Terminator v.3.1». RAPD-анализ проводили на амплификаторе МС2 «Терцик» («ДНК-технология», Россия) с использованием произвольных праймеров и стандартных наборов для амплификации ДНК.
Штамм Serratia sp. Ent16 трансформировали плазмидой pRL-gfp по протоколу электротрансформации бактерий вида E. сoli [See Ausubel F.M. et al., 1987, Miller E.M. and Nickoloff J.A., 1995]. Визуализация бактерий проводилась на конфокальном микроскопе «Axio Observer.Z1» SP с лазерным сканирующим модулем, а также флуоресцентном микроскопе «Axio Imager M1».
Полевые опыты проводили согласно методике, описанной Б.А. Доспеховым (1985), в Уфимском районе на черноземе типичном (п. Нурлино), на черноземе выщелоченном (сады «Весна»), а также серой лесной почве в Чишминском районе (п. Алкино). Производственные опыты проводили в ТНВ «Урожай» Илишевского района РБ на выщелоченном черноземе. Норма высева семян гороха 1,25 млн. штук/га. Учетная площадь делянки в мелкоделяночных опытах - 1 м2, в производственном опыте - 2 га. В таблицах указаны средние арифметические и их стандартные ошибки, звездочкой отмечены статистически значимые различия по сравнению с контролем при р0,95.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
1. Фунгистатическая и рострегулирующая активность различных групп эндофитных бактерий
При разработке микробных препаратов комплексного действия для повышения продуктивности и устойчивости бобовых растений предпочтительна стратегия объединения в микросимбионтах свойств азотфиксации и защиты от фитопатогенов. Основная роль клубеньковых бактерий в симбиозе с бобовыми растениями состоит в обеспечении азотного питания растений, поэтому этот симбиоз обычно дополняют ассоциативными стимулирующими рост растений бактериями, к которым относятся также и эндофитные бактерии. Поиск перспективных комбинаций бактерий с комплексной биологической активностью проводили среди различных групп эндофитных бактерий. Первую коллекцию составили клубеньковые бактерии R. leguminosarum bv. viceae; вторую коллекцию – эндофиты корня, выделенные на селективной среде для псевдомонад. Третья коллекция включала изоляты из клубеньков, включающие бактерий R. leguminosarum bv. viceae и их спонтанных эндофитных спутников. При скрининге оценивали фунгистатические свойства и рострегулирующую активность бактерий in vitro, а также способность повышать семенную продуктивность макросимбионта и его устойчивость к корневым гнилям в поле. Среди клубеньковых бактерий три штамма из восьми изученных стимулировали рост корня на 22-35% и четыре штамма показали различную активность по отношению к грибным фитопатогенам (Табл. 1). Это согласуется с данными других авторов о встречающейся у ризобий фунгистатической и ростстимулирующей активности [Arfaoui А. et al., 2006, Hossain M.S., Martensson A., 2008, Vargas P.A. et al., 2009]. Однако в системе in planta в полевых условиях это свойство не коррелировало с продуктивностью растений. Инокуляция семян гороха клетками выделенных ризобий в полевых условиях благоприятного по агрометеорологическим условиям 2008 г. способствовала снижению заболеваемости растений во всех вариантах опыта, а наибольший урожай (прибавка урожайности 25% по сравнению с контролем) обеспечило применение штамма RhВ2.
Таблица 1 - Биологическая активность бактерий R. leguminosarum bv. viceae
| Штаммы | In vitro | В поле (чернозем выщелоченный, 2008 г.) | ||||
| Длина корня проростков гороха, % | Зона подавления, мм | Семенная продуктив-ность, г/растение | Масса семян, г/м2 | Распрос-транение корневых гнилей, % | ||
| F. oxy-sporum | B. soro-kiniana | |||||
| RhВ1 | 126 | 0 | 1 | 3,9±0,2 | 351 | 7,3±2,5* |
| RhВ2 | 71 | 0 | 1 | 5,0±0,3* | 475 | 11,7±4,2 |
| RhВ3 | 59 | 3-5 | 0 | 4,5±0,3 | 450 | 11,4±3,1 |
| RhВ4 | 94 | 0 | 0 | 3,9±0,3 | 371 | 13,2±5,9 |
| RhВ10 | 123 | 0 | 2-7 | 3,5±0,3 | 280 | 8,8±5,1 |
| RhВ21 | 94 | 10-18 | 0 | 4,1±0,3 | 349 | 13,9±6,1 |
| Rh16 | 135* | 1-3 | 5-6 | 4,6±0,3 | 391 | 7,7±4,4* |
| 1078 | 72 | 0 | 0 | 4,0±0,3 | 360 | 13,1±5,7 |
| Контроль | 100 | 0 | 0 | 4,0±0,3 | 360 | 19,0±4,8 |
Вторую коллекцию эндофитных бактерий выделяли из корней внешне здоровых хорошо развитых растений, выращенных в теплице. Во внутренних тканях большинства растений встречались бактерии, способные расти на картофельно-глюкозном агаре (КГА) и бобово-глюкозном агаре (БГА). 70% растений содержали бактериальные изоляты, растущие на селективной среде для псевдомонад, свойства которых анализировали более детально. Среди таких растений 100% содержали бактерии в корневой шейке, 25% – в тканях корня, 20% – в клубеньках.
Фунгистатические и ростстимулирующие свойства оценивали у 34 изолятов, изолированных из разных частей корня. Половина изолятов были способны стимулировать рост корней, пятая часть увеличивала длину корней более, чем в 2 раза. Около 40% изолятов активно подавляли развитие одного или двух фитопатогенных грибов. Сочетание ростстимулирующих свойств и антагонистической активности к грибным фитопатогенам обнаружено почти у 60% изолятов, из них сравнительно высокие значения этих показателей отмечены у 19%.
Для инокуляции в полевых условиях из сформированной коллекции было отобрано 8 изолятов, выделенных из прикорневой шейки, корня и клубеньков (Табл. 2). Все изоляты способствовали снижению распространения корневых гнилей растений и увеличению массы корня, но в связи с крайне засушливым вегетационным периодом 2010 г. продуктивность гороха в целом была очень низкой. В этих условиях при инокуляции семян изолятом 6Ш урожайность возросла на 8%, остальные штаммы в этом отношении были неэффективны.
Таблица 2 - Биологическая активность эндофитов корней гороха, выделенных на селективной среде для псевдомонад
| Штамм-мы | In vitro | В поле (серая лесная почва, 2010 г.) | ||||
| Длина корня про-ростков гороха, мм | Зона подавления, мм | Семенная продукти-вность, г/растение | Коли-чество кубень-ков, шт./раст | Распрос-транение корневых гнилей, % | ||
| F. oxysporum | B. byssoidea | |||||
| Эндофиты клубеньков | ||||||
| 17П | 58,1±2,2* | 0 | 0 | 1,6±0,1 | 8,7±1,0 | 0 |
| 8П | 17,1±1,6 | 7-10 | 5-7 | 1,3±0,1* | 8,4±0,6 | 0,7±0,5 |
| 17С | 46,6±2,2* | 0 | 0 | 1,6±0,1 | 11,1±1,4* | 0,7±0,5 |
| Эндофиты корня | ||||||
| 14К | 60,3±3,1* | 0 | 0 | 1,5±0,1 | 11,4±1,2* | 4,7±2,5 |
| Эндофиты корневой шейки | ||||||
| 2Ш | 53,2±2,7* | 2-4 | 5-7 | 1,6±0,1 | 10,8±4,6* | 12,3±4,6 |
| 6Ш | 22,9±1,8 | 4 | 7-10 | 2,0±0,1 | 11,6±1,2* | 0,3±0,2 |
| 16Ш | 47,8±3,1* | 2-5 | 2-5 | 1,9±0,5 | 9,6±1,2 | 3,3±1,8 |
| 17Ш | 37,0±2,5* | 0 | 0 | 1,3±0,1* | 10,9±1,3 | 1,7±0,7 |
| Контроль | 17,4±2,0 | 0 | 0 | 1,9±0,1 | 8,7±0,8 | 12,7±0,1 |
Возможно, по причине неблагоприятного абиотического фактора вклад коллекционных эндофитных бактерий группы псевдомонад оказался недооцененным. Но причиной невыраженного мутуалистического эффекта мог служить и биотический фактор – отсутствие в бактериальном инокулюме ризобиального компонента, как это было показано в других исследованиях [Sturz A.V. et al., 1997], играющего, по-видимому, важную сигнальную и регулирующую роль для реализации мутуалистического влияния эндофитных бактерий. В этой связи нам представлялся перспективным поиск природных бактериальных сообществ ризобий с их естественными спутниками, попавшими в клубенек в природных условиях.
Такие ассоциации бактерий составили третью коллекцию изолятов, выделенных на БГА из клубеньков. Из 120 изолятов примерно четверть проявила антагонизм к фитопатогенам: 23% – к F. oxysporum и 33% – к B. sorokiniana. Однако сильных антагонистов (зона подавления 5 и более мм) среди эндофитов обнаружено не более 3%. Неспецифический ростстимулирющий эффект по отношению к растениям рапса показали 23% изолятов, при этом 15% стимулировали рост корней в 1,5-2 раза, 3% – более, чем в 2 раза в сравнении с контролем. Сочетание антагонистических свойств со способностью стимулировать рост корней было обнаружено у 16% ассоциаций. В результате скрининга была создана коллекция из 57 изолятов клубеньков гороха, у которых был изучен состав и свойства штаммов. Каждый изолят клубеньков представлял собой бактериальные ассоциации из 3-6 морфотипов клеток. При пересевах и хранении на микробиологических средах между разными штаммами этих ассоциаций наблюдались проявления конкурентного исключения и изменения свойств колоний и биологической активности. Ассоциация Ч16, сохранившая стабильный состав и свойства в течение 6 месяцев хранения, стала объектом дальнейших наших исследований.
2. Изучение взаимоотношений микроорганизмов в ассоциации Ч16
и с макросимбионтом
Ассоциация Ч16 представляла 4 отдельных штамма бактерий. Согласно морфолого-культуральным и физиолого-биохимическим свойствам [Определитель бактерий Берджи, 1997; Скворцова И.Н., 1984; Смирнов В.В., Киприанова Е.А., 1990] и данным секвенирования фрагментов генов 16S рРНК, штаммы были идентифицированы как представители родов Rhizobium, Pseudomonas, Serratia и Bacillus. Первые три названы, соответственно, Rh16, Ps16, Ent16. Штамм Bacillus sp. в дальнейшем исследовался в лаборатории специализированной научной группой, изучающей бактерии этого рода.
Для выяснения эндофитной природы штамма Ent16 из отдельных клубеньков растений, инокулированных в полевых условиях этим штаммом и его комбинацией с Rh16, получали реизоляты и сравнивали с помощью ПДРФ-анализа 16S рРНК их ДНК со штаммами исходных культур. Четыре изолята 8.1R, 12.1R, 12.1Р, 8.1Р, выделенные из клубеньков растений, обработанных штаммом Ent16 автономно и в комбинации со штаммом Rh16, на селективной среде для псевдомонад характеризовались сходными с Ent16 морфолого-культуральными свойствами колоний и клеток, а также электрофоретическим спектром фрагментов ДНК при ПДРФ-анализе (Рис. 1).
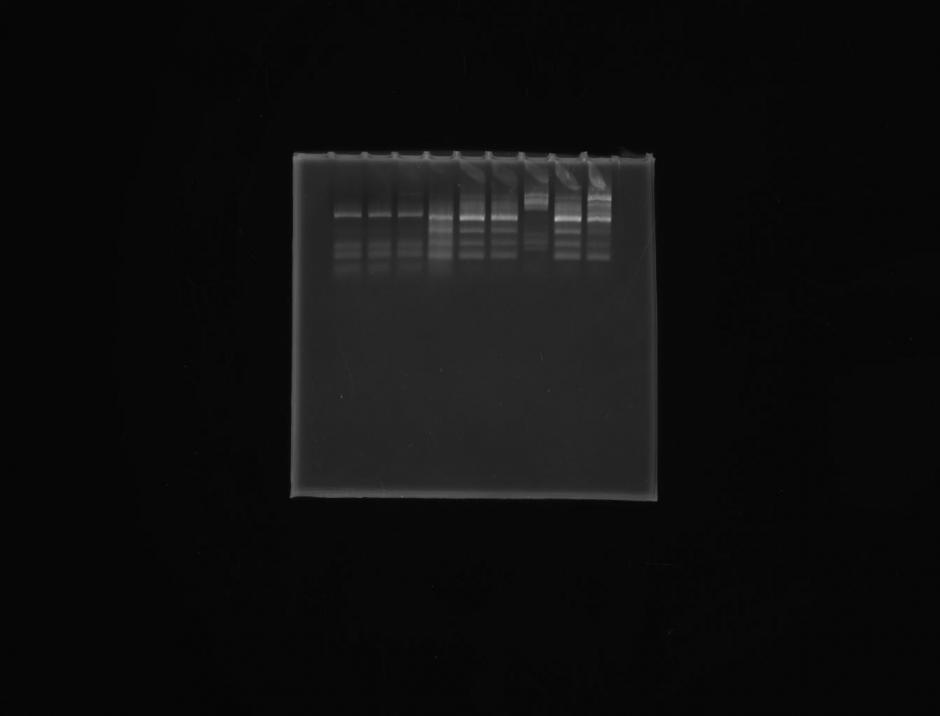
1 2 3 4 5
Рисунок 1 - Электрофореграмма ПДРФ анализа генов 16S рРНК, где 1 – 8.1R; 2 – 12.1R; 3 – Ent16; 4 – 12.1Р; 5 – 8.1Р
Поиск сходных последовательностей в базе данных генов, показал, что секвенированные фрагменты длиной около 300 пн, у штаммов 8.1R, 12.1R, 12.1Р, 8.1Р были филогенетически близки представителям семейства Enterobacteriaceae. Штаммы 8.1R, 12.1R, 12.1Р и Ent16 – близки к Serratia sp., а штамм 8.1Р – к Pantoea agglomerans.
С целью выяснения путей колонизации тканей растения штаммом Serratia sp. Ent16 он был трансформирован плазмидой, несущей ген зеленого флуоресцирующего белка (Ent16gfp). При инокуляции помещенных на агаризованную среду семян гороха суспензией клеток штамма Serratia Еnt16gfp в концентрации 106 кл/семя на третьи сутки бактерии были обнаружены на поверхности волосков и в их основаниях (Рис. 2), но не во внутренних тканях корня. По-видимому, микроорганизм получал достаточное питание на поверхности корня, контактирующего с богатой агаровой средой, и поэтому не проникал внутрь растения.
При асептическом выращивании инокулированных растений в чашках Петри на фильтровальной бумаге, смоченной только водой, начиная с третьих суток, отмечено присутствие единичных бактерий на поверхности корня и волосках (Рис. 3). В отличие от предыдущего эксперимента, бактерии были зафиксированы также и на продольных срезах через сосуды корня, что свидетельствовало о способности штамма проникать внутрь корня и распространяться по тканям. Серия сканированных срезов через примордий корня проростков показала, что бактерии находятся внутри тканей и, вероятно, таким образом проникают в растения по мере роста корня. Таким образом, данные экспериментов доказали эндофитную природу штамма Serratia Ent16.
 |  |  | |
| А | Б | В | |
| Рисунок 2 - Продольные срезы корня гороха. А, Б – бактерии Serratia Еnt16gfp на поверхности корневых волосков; В – в проводящих сосудах. | |||
Межмикробные взаимоотношения бактерий ассоциации Ч16 были изучены in vitro методом агаровых блочков (Табл. 3). Выяснилось, что к фитопатогену F. oxysporum ассоциация Ч16 обладает большей антагонистической активностью, чем отдельные ее штаммы (возможно за счет бацилльного штамма, входившего в исходный состав). Кроме того, активным к F. oxysporum был ризобиальный штамм Rh16 и Serratia Ent16. Примечательно, что последний штамм активно подавлял не только развитие фитопатогена B. sorokiniana, но и рост эталонного ризобиального штамма Rh. leguminosarum bv. viceae 1078, однако был менее агрессивен к Rh. leguminosarum bv. viceae Rh16 из этой же ассоциации.
Влияние штаммов ассоциации на рост растения-хозяина оценивали по увеличению длины корней трехсуточных проростков. Ассоциация Ч16 в исследованной концентрации клеток ингибировала рост корней, тогда как отдельные штаммы Ent16 и Rh16 проявляли ростстимулирующие свойства, которые определялись концентрацией клеток (Рис. 3).
Таблица 3 - Антагонистическая активность штаммов ассоциации Ч16 к фитопатогенам и штаммам Rh. leguminosarum bv. viceae
| Тест-объект | Зона подавления роста тест-объекта, мм | |||
| Ent16 | Ps16 | Rh16 | Ч16 | |
| F. oxysporum | 2 | 0 | 3 | 5 |
| B. sorokiniana | 12 | 0 | 5 | 0 |
| Rh16 | 3 | 0 | 0 | 0 |
| Rh1078 | 12 | 4 | 0 | 0 |
Так как штаммы бактерий были выделены из клубенька растений гороха, может возникнуть вопрос о хозяйской специфичности микроорганизмов и, соответственно, специфичности ответа вида растения. В связи с этим мы оценивали эффект инокуляции семян штаммом Serratia Ent16, на рост проростков пшеницы. Результаты показали (Рис. 4), что штамм стимулировал рост проростков пшеницы на 15-35% в широком диапазоне концентраций.

Рисунок 3 - Влияние различной плотности клеток штаммов ассоциации Ч16 на длину корня растений гороха. Примечание: 105, 106, 107, 108, 109 107 – концентрация клеток/семя
Сравнение стимулирующих свойств штамма Serratia Ent16 с коммерческим препаратом «ЕЛЕНА» (основа – штамм P. aureofaciens ИБ51) в концентрациях 106, 107 клеток/семя показало, что штамм Ent16 не уступает ему по активности и даже более эффективен. Штамм Ps16 не проявлял ни одно из исследуемых нами свойств.
 А А |  Б Б |
 В В |  Г Г |
Рисунок 4 - Влияние различной плотности клеток штамма Serratia Ent16 на длину эпикотиля (А) и корня (Б) 3-х суточных проростков пшеницы, сравнение влияния штамма с препаратом «Елена» на длину эпикотиля (В) и корня (Г).
Примечание: 105, 106, 107, 108, 109 107 – концентрация клеток/семя
3. Влияние инокуляции семян клетками штаммов ассоциации Ч16 на продуктивность растений гороха и их устойчивость к корневым гнилям
Результаты трехлетних полевых экспериментов (Табл. 4-6) показали, что инокуляция семян гороха бактериальными препаратами в целом положительно сказалась на урожайности культуры. Как семенная продуктивность растений, так и урожайность зерна ни в одном из вариантов инокуляции не были статистически ниже контроля (без обработки семян).
Таблица 4 - Влияние инокуляции семян гороха штаммами ассоциации Ч16 на продуктивность растений (чернозем выщелоченный, 2008 г)
| Варианты | Масса в фазу бутонизации, г | Распростра-нение корневых гнилей, % | Продуктивность | |||
| побега | корня | клубеньков | г/растение | г/м2 | ||
| Контроль | 16,01±1,9 | 0,59±0,05 | 0,490±0,053 | 18,9±4,8 | 4,0±0,3 | 360 |
| Rh1078 | 14,2±0,9 | 0,68±0,03 | 0,515±0,053 | 13,1±5,7 | 4,0±0,3 | 360 |
| Ч16 | 12,8±1,0 | 0,53±0,03 | 0,410±0,038 | 7,2±3,7* | 4,4±0,3 | 330 |
| Rh16 | 10,8±0,9* | 0,59±0,04 | 0,354±0,035 | 7,7±4,4* | 4,6±0,3 | 391 |
| Ent16 | 12,8±1,1 | 0,66±0,04 | 0,397±0,050 | 12,3±5,6 | 4,7±0,3* | 376 |
| Ps16 | 13,6±1,4 | 0,61±0,06 | 0,432±0,026 | 13,1±5,7 | 4,2±0,2 | 336 |
| Ent16+ Rh16 | 13,6±1,3 | 0,55±0,05 | 0,419±0,047 | 3,6±1,3* | 4,9±0,2* | 441 |
Таблица 5 – Показатели продуктивности растений гороха при инокуляции семян штаммами ассоциации Ч16 (серая лесная почва, 2009 г)
| Варианты | Масса в фазу бутонизации, г | Распростра-нение корневых гнилей, % | Продуктивность | |||
| побега | корня | клубеньков | г/растение | г/м2 | ||
| Контроль | 7,9±0,5 | 0,24±0,02 | 0,071±0,08 | 24,4±5,4 | 1,80±0,10 | 200 |
| Rh1078 | 7,7±0,6 | 0,31±0,02* | 0,065±0,06 | 31,1±8,8 | 2,2±0,10* | 245 |
| Rh16 | 9,6±0,9 | 0,23±0,03 | 0,060±0,04 | 16,1±4,7 | 2,19±0,10 | 243 |
| Ent16 | 9,4±0,6 | 0,36±0,04* | 0,110±0,03* | 42,8±6,5 | 1,96±0,09 | 218 |
| Ent16+ Rh16 | 8,9±0,7 | 0,30±0,02* | 0,100±0,03* | 16,1±5,5 | 2,0±0,10 | 222 |
| Ent16+ Rh1078 | 11,2±0,8* | 0,28±0.03 | 0,050±0,03 | 22,2±7,0 | 2,2±0,11* | 239 |
Таблица 6 - Влияние инокуляции семян гороха штаммами ассоциации Ч16 на морфометрические параметры растений в фазу бутонизации и их продуктивность (серая лесная почва, 2009 г)
| Варианты | Масса побега, г | Высота растения, см | Количество клубеньков | Распростра-нение корневых гнилей, % | Продуктивность | |
| г/рас-тение | г/м2 | |||||
| Контроль | 3,4±0,2 | 25,7±1,0 | 13,7±1,1 | 15,0±3,7 | 1,5±0,1 | 164 |
| Rh1078 | 4,0±0,4* | 26,6±1,3 | 13,1±1,0 | 11,3±4,5 | 1,3±0,1 | 144 |
| Rh16 | 3,5±0,3 | 26,6±1,2 | 13,0±1,0 | 7,6±3,1 | 1,4±0,1 | 181 |
| Ent16 | 3,6±0,3 | 28,1±1,2* | 13,9±1,3 | 7,0±2,8 | 1,2±0,3 | 149 |
| Ent16+ Rh16 | 3,4±0,2 | 25,5±1,1 | 16,4±1,1* | 3,7±1,7* | 1,4±0,1 | 189* |
При обработке семян, например, клетками Rh16 и комбинацией штаммов [Ent16+Rh16], все три года стабильно семенная продуктивность растений была выше (на 15-23%), в сравнении с контрольными. Эффективность применения эталонного штамма Rh. leguminosarum bv. viceae 1078 и Serratia Ent16 варьировала в разные годы. Применение клеток штаммов Rh16 и комбинации [Ent16+Rh16] во всех трех полевых экспериментах стабильно снижало степень поражения растений корневыми гнилями (Табл. 4-6).
Ростстимулирующий эффект бактериальных обработок зависел от агроклиматических условий сезона. В достаточном по влагообеспеченности 2008 году на черноземе выщелоченном в фазу бутонизации значения массы побега, корня и клубеньков в большинстве варинтов были на уровне или ниже контроля. По-видимому, затраты на формирование симбиоза с внесенными эндофитными бактериями для растения оказались выше, чем использование доступного минерального питания в почве у контрольных растений. Однако в засушливых условиях 2009 г и в более бедной азотом серой лесной почве преимущества симбиоза проявлись в стимуляции роста корня от 17% до 50%, клубеньков – до 55%, побега – до 42% в отдельных вариантах инокуляции в сравнении с контролем.
Поскольку по результатам 2008 г на выщелоченном черноземе наибольшую семенную продуктивность обеспечила инокуляция гороха комбинацией клеток штаммов [Ent16+Rh16] и ризобиального штамма RhB2, эффективность применения препаратов на основе этих микроорганизмов испытывалась в производственных условиях ТНВ «Урожай» Илишевского района Республики Башкортостан в 2009 г. Семена гороха сорта Чишминский 95 обрабатывали суспензией клеток бактерий Serratia Ent16 и Rh. leguminosarum bv. viceae Rh16, полученной смешиванием суточных культур из расчета концентраций, соответственно 106 клеток/семя и 107 клеток/семя. Расход препарата 1 л/т, рабочей жидкости – 10 л/т семян. Агротехника возделывания культуры была общепринятой для данной природно-сельскохозяйственной зоны. Уборка урожая проводилась комбайном. Оценивали бункерную массу зерна. Результаты испытаний показали (Табл. 7), что обработка семян экспериментальными препаратами была эффективна.
Таблица 7 - Хозяйственная эффективность предпосевной инокуляции семян гороха клетками новых штаммов бактерий
(ТНВ «Урожай» Илишевского района Республики Башкортостан, 2009 г)
| Показатели | Варианты | ||
| Контроль | Ent16+Rh16 | RhВ2 | |
| Урожайность зерна, т/га | 1,5 | 1,7 | 1,6 |
| Прибавка урожайности, т/га | 0 | 0,2 | 0,1 |
Наибольшая прибавка урожайности – 0,2 т/га или 13,3% в сравнении с контролем получена при обработке семян смесью клеток культур бактерий [Ent16+Rh16]. Расчет затрат на применение препарата, содержащего клетки этих штаммов бактерий для предпосевной обработки семян гороха выявил экономическую эффективность данного агротехнического приема.
Выводы
1 Среди клубеньковых бактерий Rhizobium leguminosarum bv. viceae встречаются штаммы с комплексной биологической активностью, проявляющие антагонизм к грибным фитопатогенам и стимулирующие рост растений гороха.
2 Во внутренних тканях корней гороха с частотой не менее 60% распространены неклубеньковые эндофитные бактерии, способные стимулировать рост проростков этого и других видов растений, а также проявлять антагонизм к грибным фитопатогенам, вызывающим корневые гнили сельскохозяйственных культур.
3 В клубеньках гороха обнаружены многовидовые ассоциации эндофитных бактерий с сохраняющимся в течение определенного времени стабильным составом, несмотря на парные антагонистические взаимоотношения друг с другом in vitro. Обработка семян гороха клетками отдельных представителей ассоциации, а также их искусственных объединений способна приводить к стимуляции роста макросимбионта и биоконтролю над распространением корневых гнилей.
4 Выделен новый штамм Serratia sp. Ent16, способный стимулировать рост растений и подавлять развитие некоторых грибных фитопатогенов in vitro. Установлено, что этот эндофит может проникать в корни гороха через примордия и распространяться в растении по сосудам.
5 Предпосевная обработка семян гороха комбинацией эндофитных бактерий Serratia sp. Ent16 и Rh. leguminosarum bv. viceae Rh16 позволяет получить в производственных условиях прибавку урожайности зерна до 2 ц/га. Указанные штаммы могут служить основой микробиологических препаратов для растениеводства.
Список работ, опубликованных по теме диссертации
Статьи в журналах, рекомендованных ВАК РФ
- Иванчина Н.В., Гарипова С.Р., Шавалеева Д.В., Уразбахтина Н.А., Захарова Р.Ш., Хайруллин Р.М. Влияние штаммов Bacillus subtilis на продуктивность растений гороха при автономной и совместной инокуляции со штаммом Rhizobium leguminosarum bv. viceae 1078 // Агрохимия, 2008. № 10. С. 34-39.
- Гарипова С.Р., Шавалеева Д.В., Иванчина Н.В., Маркова О.В., Хайруллин Р.М. Влияние ассоциаций эндофитных бактерий с ризобиями на продуктивность бобовых растений // Бюллетень МОИП, 2009. Т. 114. Выпуск 2. С. 36-37.
- Иванчина Н.В., Шавалеева Д.В. Поиск эндофитных штаммов Bacillus subtilis с комплексной биологической активностью для повышения продуктивности и устойчивости растений гороха // Аграрная Россия, 2009. Специальный выпуск. С. 85.
- Гарипова С.Р., Гарифуллина Д.В., Маркова О.В., Иванчина Н.В., Хайруллин Р.М. Изучение бактериальных ассоциаций эндофитов клубеньков, способствующих увеличению продуктивности бобовых растений // Агрохимия, 2010, – № 11, с. 50–58.
Статьи в других изданиях
- Гарипова С.Р., Шавалеева Д.В., Иванчина Н.В., Хайруллин Р.М. Выделение из клубеньков гороха бактерий, подавляющих корневые гнили и стимулирующих рост растений // Современная физиология растений: от молекул до экосистем: Материалы докладов Международной конференции. Часть 3. Сыктывкар, 2007. С. 322-323.
- Иванчина Н.В., Шавалеева Д.В. Оценка фунгистатической активности штаммов бактерий, выделенных из клубеньков гороха // Современные проблемы экологии, микробиологии и иммунологии: Региональная конференция молодых ученых с международным участием. Екатеринбург – Пермь, 2007. С. 59-61.
- Иванчина Н.В., Гарипова С.Р., Шавалеева Д.В., Уразбахтина Н.А., Минина Т.С., Лукьянцев М.А., Хайруллин Р.М. Влияние штаммов Bacillus subtilis на продуктивность растений гороха (Pisum sativum L.) при автономной инокуляции и в сочетании со штаммом Rhizobium leguminosarum bv. viceae 1078 и молибденом // Влияние физических, химических и экологических факторов на рост и развитие растений: Материалы 4-ой Всероссийской научной конференции в МГОПИ. Орехово-Зуево, 2007. С. 76-79.
- Шавалеева Д.В., Иванчина Н.В., Маркова О.В. Морфология клеток и колоний бактерий, выделенных из клубеньков гороха и фасоли // Актуальные аспекты современной микробиологии: II Международная молодежная школа-конференция. М., 2007. – С. 129-130.
- Шавалеева Д.В. Морфо-физиологическая характеристика ассоциаций микроорганизмов, выделенных из тканей гороха // Молодежь и наука на Севере: I Всероссийская молодежная научная конференция. Сыктывкар, 2008. – С. 326-327.
- Иванчина Н.В., Шавалеева Д.В., Гарипова С.Р. Связь между ростстимулирующими свойствами штаммов Bacillus subtilis in vitro и семенной продуктивностью растений in situ при различных вариантах обработок гороха // Современные проблемы иммунитета растений к вредным организмам: Вторая Всероссийская конференция. Санкт-Петербург, 2008. С. 253-255.
- Маркова О.В., Шавалеева Д.В., Ахмадеева Э.М. Эффективность инокуляции гороха (Pisum sativum L.) и фасоли (Phaseolus vulgaris L.) ассоциациями эндофитных бактерий, выделенных из клубеньков бобовых растений // Молодежная наука и АПК: проблемы и перспективы: II Всероссийская научно-практическая конференция молодых ученых и аспирантов. Уфа, 2008. – С. 14-16.
- Шавалеева Д.В., Иванчина Н.В., Гарипова С.Р. Идентификация и оценка ростстимулирующей, антагонистической активности и безопасности штаммов рода Pseudomonas, перспективных для инокуляции гороха // Современные проблемы иммунитета растений к вредным организмам: Вторая Всероссийская конференция. Санкт-Петербург, 2008. С. 280-282.
- Шавалеева Д.В., Иванчина Н.В., Гарипова С.Р., Хайруллин Р.М. Биоразнообразие микроорганизмов в клубеньках и тканях гороха (Pisum sativum L.) // Биоразнообразие, охрана природы и здоровье населения в республике Башкортостан: Сб. материалов заочной международной науч.-практ. конф. Стерлитамак, 2008. С. 35-36.
- Шавалеева Д.В. Ростстимулирующая и антагонистическая активность эндофитов, выделенных из разных тканей гороха // Экология и научно-технический прогресс: Вторая Всероссийская конференция с международным участием конгресса студентов и аспирантов-биологов. Пермь, 2009. – С. 85-86.

