Клинико - генетические ассоциации при алкогольно й болезни печени 14. 01.04 - внутренние болезни
На правах рукописи
Лукманова Лима Ильгизовна
Клинико - генетические ассоциации при алкогольной болезни печени
14. 01.04 - внутренние болезни
03.02.07 - генетика
автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Уфа – 2012
Работа выполнена в Федеральном Государственном бюджетном Учреждении науки Институт биохимии и генетики Уфимского научного центра РАН и Государственном бюджетном образовательном учреждении высшего профессионального образования «Башкирский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации
Научные руководители:
доктор медицинских наук, профессор Давлетшин Рашит Ахметович
доктор медицинских наук, профессор Викторова Татьяна Викторовна
Официальные оппоненты: доктор медицинских наук, профессор кафедры
терапии и клинической фармакологии
Институт последипломного образования ГБОУ
ВПО «Башкирский государственный медицинский университет» Минздравсоцразвития России
Калимуллина Дилара Хатимовна
доктор биологических наук, профессор,
зав. отделом геномики
Институт биохимии и генетики
Уфимского научного центра РАН
Хуснутдинова Эльза Камилевна
Ведущая организация: Государственное бюджетное образовательное учреждение высшего профессионального образования «Первый Московский государственный медицинский университет имени И.М. Сеченова» Министерства здравоохранения и социального развития Российской Федерации
Защита состоится 23 мая 2012 г.__ часов на заседании диссертационного совета Д 208.006.03 при Государственном бюджетном образовательном учреждении высшего профессионального образования «Башкирский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации по адресу: 450000, г. Уфа, ул. Ленина, 3.
С диссертацией можно ознакомиться в библиотеке Государственного бюджетного образовательного учреждения высшего профессионального образования «Башкирский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации.
Автореферат разослан 21 апреля 2011 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Г.Х. Мирсаева
Общая характеристика работы
Актуальность исследования. Алкогольная болезнь печени – дегенеративное воспалительное заболевание, обусловленное воздействием алкоголя и потенциально способное прогрессировать или подвергаться обратному развитию (Ивашкин В.Т., Буеверов А.О., 2009).
Медицинская и социальная значимость алкогольной болезни печени связана с широким вовлечением в потребление алкоголя населения, значительным распространением и ростом доли данной патологии в структуре заболеваемости и смертности (Комкова И.И. и соавт., 2011).
В настоящее время этанол признан гепатотропным токсином, метаболиты которого оказывают на печень как прямое повреждающее, так и опосредованное действие. К токсическим эффектам метаболита этанола ацетальдегида - относятся: усиление перекисного окисления липидов, разрушение клеточных мембран, повреждение микротрубочек цитоскелета, истощение запасов глутатиона, высвобождение цитокинов, нарушение репаративных процессов в ядре (Маевская М.В. и соавт., 2011; Буеверов А.О. и соавт., 2011). В результате инициируются свободнорадикальные процессы и оксидативный стресс, повреждаются нуклеиновые кислоты и белки, угнетается активность процессов восстановления ДНК (Антонян А.А. и соавт., 2010; Лелевич А.В. и соавт., 2011).
Действие алкоголя не всегда сопровождается повреждением клеток печени, поскольку одновременно осуществляются процессы детоксикации, антиоксидантной защиты и репарации ДНК. При недостаточности защитных механизмов развиваются тяжелые поражения печени – фиброз и цирроз (Ивашкин В.Т., 2005; Маевская М.В., Буеверов А.О., 2009).
На сегодняшний день важной остается проблема прогнозирования развития алкогольной болезни печени. Для определения неблагоприятного исхода заболевания разработано большое количество различных индексов и шкал оценки (Пирогова И.Ю., Пышкин С.А., 2011). Существенным недостатком является то, что в них не учитывается значимость генетических факторов в развитии алкогольного гепатита и цирроза печени. В настоящее время доказана роль полиморфизма генов-кандидатов в патогенезе этой болезни (Спицин В.А., 2008; Антонян А.А. и соавт., 2010; Гончарова И.А. и соавт., 2010; Miranda-Mendez A., 2010). Проведенные в 90-х годах прошлого века исследования на близнецах установили наследственную предрасположенность к алкогольной болезни печени (Reed T., et al., 1996). О значении генетических факторов свидетельствует повышенная частота специфичностей HLA В8, В40, В31 у больных алкогольными поражениями печени (Герок В., Блюм Х.Е., 2009).
Цель исследования: выявить клинико-генетические маркеры, ассоциированные с развитием алкогольной болезни печени на основе комплексного исследования клинико-лабораторных показателей и результатов молекулярно-генетического обследования лиц, злоупотребляющих алкоголем.
Задачи исследования:
- Охарактеризовать клинико-лабораторные критерии алкогольной болезни печени;
- Провести сравнительный анализ клинико-лабораторных показателей больных алкогольным гепатитом с учетом основных клинических синдромов и вариантов течения;
- Изучить распределение частот генотипов и аллелей полиморфных локусов генов ферментов биотрансформации ксенобиотиков (CYP2E1, GSTT1, NAT2), провоспалительного цитокина (TNFA) и репарации повреждений ДНК (XPD, XRCC1, XRCC3) у больных алкогольной болезнью печени и в контроле;
- Провести анализ ассоциаций полиморфных локусов генов-кандидатов с риском развития и вариантами клинического течения алкогольной болезни печени;
- Разработать алгоритм прогнозирования повышенного риска развития алкогольной болезни печени на основании комплексного анализа клинико-лабораторных показателей и полиморфных вариантов изученных генов.
Научная новизна. Впервые у лиц, злоупотребляющих алкоголем, на основании анализа полиморфизма генов детоксикации ксенобиотиков (CYP2E1, GSTT1, NAT2), провоспалительного цитокина (TNFA) и репарации ДНК, (XPD, XRCC1, XRCC3) выявлены генетические маркеры, ассоциированные с вариантами клинического течения и основными синдромами алкогольной болезни печени.
Выявлено, что алкогольный гепатит с преобладанием желтушного варианта течения ассоциируется с делецией гена GSTT1 и генотипом GА гена TNFA; выраженность синдромов цитолиза - с генотипом GА гена XRCC1 и СС гена XRCC3; воспаления - с генотипом GА гена TNFA; печеночно-клеточной недостаточности - с генотипом СТ гена XRCC3 и гепаторенального - с генотипом АА гена TNFA.
У лиц, длительно употребляющих алкоголь, на основе комплексного анализа клинико-лабораторных показателей и полиморфных вариантов изученных генов предложено формировать группы повышенного риска развития алкогольного гепатита и прогнозировать характер течения заболевания.
Научно-практическая значимость. Результаты исследований вносят вклад в общее представление о генетических основах формирования предрасположенности к алкогольной болезни печени.
Предложено среди лиц, длительно употребляющих алкоголь, выделять группы повышенного риска развития алкогольного гепатита и прогнозировать характер течения заболевания с помощью комплексного анализа клинико-лабораторных показателей и полиморфных вариантов генов CYP2E1, GSTT1, TNFA, XPD, XRCC1, XRCC3.
Внедрение результатов в практику. Результаты проведенных исследований внедрены в учебный процесс кафедр биологии и госпитальной терапии №2 ГБОУ ВПО БГМУ Минздравсоцразвития России.
Основные положения, выносимые на защиту:
- У лиц, длительно употребляющих алкоголь, комбинации генотипов С1С1/GA генов CYP2E1(-1019С>T), TNFA(-308G>A) и генотипов С1С1/АС генов CYP2E1, XPD(-35931А>C) являются генетическими маркерами предрасположенности к алкогольному гепатиту.
- К генетическим маркерам, ассоциированным с повышенным риском развития алкогольного гепатита с преобладанием желтушного варианта течения относятся делеция гена GSTT1 и генотип GА гена TNFA; с выраженностью синдромов цитолиза - генотип GА гена XRCC1 и СС гена XRCC3; воспаления – генотип GА гена TNFA; печеночно-клеточной недостаточности - генотип СТ гена XRCC3 и гепаторенального – генотип АА гена TNFA.
- Данные о вкладе полиморфных вариантов генов в развитие алкогольной болезни печени могут быть использованы при прогнозировании характера течения заболевания и формировании групп повышенного риска.
Апробация работы. Основные положения диссертационной работы представлены на 10-й юбилейной Республиканской конференции ученых Республики Башкортостан с международным участием «Научный прорыв» (Уфа, 2011); 1 Съезд терапевтов Поволжского Федерального округа России (Пермь, 2011); VI Национальном конгрессе терапевтов (Москва, 2011); Второй Международной научно-практической конференции «Высокие технологии, фундаментальные и прикладные исследования в физиологии, фармакологии и медицине» (Санкт-Петербург, 2011); итоговой научно-практической конференции студентов и молодых ученых Республики Башкортостан с международным участием «Вопросы теоретической и практической медицины» (Уфа, 2012); доложены и обсуждены на межлабораторных семинарах ИБГ УНЦ РАН (Уфа, 2010, 2011, 2012). Апробация состоялась 16.04.2012 г. на совместном межлабораторном и межкафедральном заседании Института биохимии и генетики Уфимского научного центра РАН.
Публикации. Результаты диссертационной работы опубликованы в 8 научных изданиях, в том числе 2 работы в ведущих рецензируемых научных журналах, рекомендованных Высшей аттестационной комиссией Российской Федерации для публикации материалов диссертаций.
Связь задач исследования с планами научно-исследовательских работ. Диссертационная работа выполнена в соответствии с планами научно-исследовательских работ Института биохимии и генетики Уфимского научного центра РАН по теме «Молекулярные основы адаптации и дезадаптации человека к факторам окружающей среды» (государственная регистрация №01201052602).
Личный вклад автора в получении научных результатов. Личный вклад автора заключается в планировании и организации всех этапов выполнения диссертационной работы. Автором самостоятельно проведены: отбор пациентов с алкогольной болезнью печени и лиц контроля, анкетирование, молекулярно-генетические исследования, обработка результатов методом статистического анализа и их интерпретация, оформление диссертации, формулировка выводов и практических рекомендаций, а также подготовка основных публикаций по выполненной работе.
Объем и структура диссертационной работы. Диссертация изложена на 129 страницах, иллюстрирована 23 рисунками и 17 таблицами. Состоит из введения, пяти глав собственных исследований, заключения, выводов, практических рекомендаций, списка литературы (106 отечественных и 104 зарубежных публикаций).
Содержание работы
Материал и методы исследований. В исследования включены 178 неродственных индивидов, страдающих хроническим алкоголизмом с проявлениями алкогольной болезни печени (АБП), в возрасте 28-62 лет, проходившие курс стационарной терапии в ГКБ №18, ГКБ №21, ГУЗ Республиканский наркологический диспансер №2 МЗ РБ, г. Уфы в 2009-2011 гг. Среди них мужчин 148 (83,1%), женщин 30 (16,9%). Диагноз был выставлен в соответствии с международной классификацией болезней десятого пересмотра (МКБ-10). Длительный алкогольный анамнез и отсутствие маркеров вирусных гепатитов являлось обязательным условием отбора в группу. Все обследуемые - жители Республики Башкортостан (РБ).
В качестве объекта для молекулярно-генетических исследований использовали образцы ДНК, полученные из цельной крови. В исследования были включены 107 лиц, мужского пола с алкогольным гепатитом и 27 – со стеатозом. Группа контроля сформирована случайным образом из 105 здоровых лиц мужского пола подобранных по возрасту и этнической принадлежности, не состоящих на учете у нарколога и отрицающих злоупотребление алкоголем.
Проведенное исследование было одобрено комитетом по этике Учреждения Российской Академии Наук Института биохимии и генетики Уфимского научного центра РАН. Работа проводилась согласно предварительно разработанного протокола и осуществлялась с осознанного согласия обследуемых лиц на участие в исследовании.
Сведения о клинико-лабораторных данных больных алкогольной болезнью печени были получены при анализе историй болезни.
Молекулярно-генетический анализ полиморфизма генов проводили на образцах ДНК, выделенных из лимфоцитов периферической крови стандартным методом фенольно-хлороформной экстракции (Mathew, 1984). Делеционный полиморфизм гена GSTT1 изучали методом ПЦР-анализа. Полиморфизм генов CYP2E1 (-1019С>Т, rs2031920), NAT2 (-590 G>A, rs1799930), TNFA (-308 G>A, rs1800629), XRCC1 (28152G>A, rs25487); XPD (35931А>C, rs13181); XRCC3 (18067С>Т, rs861539) изучали методом анализа полиморфизма длин рестрикционных фрагментов продуктов полимеразной цепной реакции синтеза ДНК.
ПЦР проводили при помощи программируемого термоциклера «Терцик» производства компании "ДНК-технология" (Россия) с использованием термостабильной ДНК-полимеразы («Сибэнзим», Россия).
Статистическую обработку полученных данных проводили с использованием пакетов статистических программ STATISTICA v. 6.0, “Rows and Collumns” (RxC – статистика), а также в программах Microsoft Excel v.2000.
Вычислялись среднее значение (М), средняя ошибка среднего значения (m) в Microsoft Excel. Для сравнения распределения частот аллелей и генотипов в различных группах, использовали критерий с поправкой Йетса на непрерывность с помощью программы RxC-статистика (Rows and Columns). Достоверность различий между двумя средними определялась с помощью формулы t-критерия Стьюдента. Статистически значимыми считали различия при р<0,05.
Для количественной оценки относительного риска заболевания по конкретной аллели или генотипу вычисляли показатель отношения шансов (odds ratio - OR) (Schlesselman, 1982).
Результаты исследования и обсуждение
Клинико-лабораторные данные больных алкогольной болезнью печени
Используя опросник «CAGE» и «Сетку LeGo» (Моисеев В.С. и соавт., 1990) у всех обследуемых пациентов была определена хроническая алкогольная интоксикация, и признаки алкогольной зависимости: патологическое влечение к алкоголю; изменение толерантности к спиртным напиткам; сформированный абстинентный синдром; отрицательные социальные последствия.
Для всех пациентов было характерно употребление большого количества спиртсодержащих напитков (в перерасчете на чистый этанол - более 80 г в сутки) в течение 8 и более лет.
Алкогольная жировая дистрофия печени (стеатоз) была установлена у 34,3% больных, алкогольный гепатит (АГ) - у 65,7% больных.
Среди больных стеатозом характерной жалобой было чувство тяжести или переполнения в правом подреберье, иногда на непереносимость жирной пищи. Болевой синдром отмечали 42,6% пациентов. В анамнезе были указания на неоднократные рецидивы заболевания. При объективном обследовании у всех больных выявлено умеренное увеличение печени, болезненной при пальпации. У 60,7% наблюдалось снижение аппетита, тошнота. У 50,8% обследуемых пациентов отмечалась быстрая утомляемость и слабость. При ультразвуковом исследовании у 93,4% пациентов установлены диффузные изменения печени на основании обнаруженного увеличения размеров органа и гиперэхогенности его структуры.
Таким образом, признаки стеатоза у лиц, злоупотребляющих алкоголем, характеризовались болевым, диспепсическим синдромами; несоответствием между заметным увеличением размеров печени на УЗИ и отсутствием изменений клинико-лабораторных показателей.
Для обследуемых больных с алкогольным гепатитом (АГ) характерными были жалобы на боль в правом подреберье, тошноту, рвоту, слабость, быструю утомляемость, потливость.
В результате проведенных исследований среди обследуемых больных с АГ астенический синдром наблюдался у 60,7%; диспепсический - у 76,1%, болевой - 94,9%; анорексия – 59,8%, гепатомегалия – 94,9%, желтушное окрашивание кожи – 12,8%, признаки энцефалопатии – 15,4%.
Изменения лабораторных показателей обнаружены у всех больных с АГ. Умеренный лейкоцитоз встречался у 55,6%, ускореное СОЭ – 29,9%; уменьшение общего белка – 29,9%; повышение общего билирубина – 53,8%; холестерина – 35,0%; тимоловой пробы – 19,7%; креатинина – 23,1%; мочевины – 65,8%; активности АлАТ – 85,5%; АсАТ – 77,8%; высокий показатель де Ритиса (более 1,5) – у 38,5%; пациентов.
Таким образом, основными патологическими синдромами, формирующими клинико-лабораторную диагностику заболевания АГ являются: синдром цитолиза, холестаза, воспаления, гепаторенальный и печеночно-клеточной недостаточности.
Высокая активность трансаминаз характеризует нарушение целостности гепатоцитов, в легкой степени проявляясь изменением проницаемости мембран, в тяжелых случаях – некрозом клетки. Повышенный уровень АлАТ и АсАТ у 77,8% обследуемых больных АГ указывает на формирование синдрома цитолиза. Показателем более тяжелого течения алкогольного гепатита считается индекс де Ритиса АсАТ/АлАТ>2. Выраженный синдром цитолиза с высоким индексом де Ритиса установлен у 38,5% обследуемых больных АГ.
У 10,3% пациентов выявлены признаки холестатического синдрома, для которого были характерны жалобы на кожный зуд; объективных данных (у всех обследуемых наблюдалось увеличение печени и субъэктеричность склер, у 8,5% - желтушное окрашивание кожи); изменений биохимических показателей (значительное повышение уровня билирубина и холестерина в крови, наряду с нормальной или умеренно повышенной активностью трансаминаз).
Синдром печеночно-клеточной недостаточности установлен у 31,6% больных АГ. Он отражает изменения основных функциональных проб печени, оценивающих экскреторную, метаболизирующую и синтетическую функции печени (Подымова С.Д., 2005). Синдром характеризовался уменьшением содержания общего белка, холестерина, триглицеридов, повышением содержания билирубина и мочевины, повышенной активностью АлАТ и невысоким показателем АсАТ.
Признаки воспаления наблюдались у большинства из обследуемых больных АГ (55,6%). Развитие воспалительных реакций является одним из наиболее важных критериев перехода стеатоза в АГ. У 19,6% пациентов наблюдались выраженные признаки воспалительного синдрома, проявляющиеся лейкоцитозом, повышением уровня тимоловой пробы. Тимоловая проба является одним из наиболее чувствительных и надежных функциональных показателей активности патологического процесса в печени (Подымова С.Д., 2005).
У 17,9% пациентов установлен гепаторенальный синдром. Гепаторенальный синдром характеризует развитие прогрессирующей почечной недостаточности у больных с заболеваниями печени в отсутствие органической патологии почек. Как правило, он развивается у больных с тяжелой печеночной недостаточностью (Мухин Н.А., 2009). Критериями синдрома являются повышение содержания сывороточного креатинина и мочевины.
На основании анализа объективных и клинико-лабораторных данных клиническое течение АГ с преобладанием латентного варианта установлено у 49,6%; желтушного – у 37,6% и холестатического – у 12,8% пациентов.
У всех пациентов с латентным вариантом наблюдалось увеличение печени, болевой синдром; более чем у половины обследуемых был астенический синдром. При лабораторном исследовании выявлено повышение АсАТ (100%) и лейкоцитоз (32,8%).
При желтушном варианте отмечался болевой, выраженный диспепсический и астенический синдромы; анорексия и похудание; эктеричность склер. В биохимическом анализе крови наблюдалось повышение уровня общего билирубина, увеличение активности трансаминаз.
Холестатический вариант сопровождался кожным зудом, эктеричностью склер, желтушным окрашиванием кожи, потемнением мочи и осветлением кала. Наблюдалось резкое повышение билирубина более чем в 3 раза и увеличение холестерина наряду с невысокой активностью трансаминаз.
Анализ полиморфных вариантов генов ферментов биотрансформации ксенобиотиков с развитием алкогольной болезни печени
Анализ полиморфного локуса -1019С>T (rs2031920) гена цитохрома Р450 2Е1 – CYP2E1(pst1) статистически достоверных различий по распределению частот генотипов и аллелей между обследованными группами больных АГ, стеатозом и в контроле не выявил (p>0,05).
Анализ делеционного полиморфизма N/del (rs71748309) гена глутатион S-трансферазы Т1 GSTT1 в группах больных АГ и в контроле не выявил существенных отличий (2=0,015; p=0,903). При анализе распределения частот генотипов GSTT1 у больных АГ в сравнении с группой стеатоза достоверных отличий не выявлено (2=0,162; p=0,688).
Изучено распределение генотипов GSTT1 у больных АГ с учетом вариантов клинического течения (табл. 1).
Таблица 1 - Распределение частот генотипов полиморфного локуса N/del гена GSTT1 с учетом клинических вариантов АГ и в контроле
| Показатель | Генотипы GSTТ1 | |
| N/N и N/del | del/del | |
| латентный вариант | ||
| абс/% | 46/88,46% | 6/11,54% |
| 2/p | 2=3,169; p=0,075; | 2=3,169; p=0,075; |
| желтушный вариант | ||
| абс/% | 21/55,26 | 17/44,74* |
| 2/p | 2=4,1; p=0,043; | 2=4,1; p=0,043; |
| OR; 95% CI: | OR=0,418; CI 0,192-0,91 | OR=2,398; CI 1,101-5,225 |
| холестатический вариант | ||
| абс/% | 11/91,67% | 1/8,33 |
| 2/p | 2=0,899; p=0,344 | 2=0,899; p=0,344 |
| контроль | ||
| абс% | 77/74,76% | 26/25,24% |
Примечание здесь и в других таблицах:
*- различия между группами АГ и контроля статистически достоверны при p<0,05
Выявлено статистически достоверное отличие частоты делеции гена у пациентов с преобладанием желтушного варианта АГ от контроля (2=4,10; p=0,043). Высокий показатель отношения шансов (OR=2,398; 95% CI: 1,101-5,225) позволяет считать, что делеция гена GSTT1 является генетическим маркером алкогольного гепатита с преобладанием желтушного клинического варианта течения.
Сравнительный анализ распределения частот генотипов у больных с разными клиническими синдромами АГ не выявил достоверных отличий (p>0,05).
Анализ полиморфного локуса -590G>A (rs1799930) гена ариламин-N-ацетилтрасферазы 2 NAT2 по распределению частот генотипов и аллелей у больных АГ, стеатозом и в контроле не выявил статистически значимых отличий (p>0,05).
Сравнительный анализ распределения частот генотипов с учетом клинических вариантов АГ и клинико-лабораторных синдромов не выявил существенных различий (р>0,05).
Анализ полиморфного локуса -308G>A (rs180629) гена фактора некроза опухоли альфа TNFA выявил существенные различия в распределении частот генотипов и аллелей у больных АГ и в контроле (рис. 1).

Рисунок 1 - Распределение частот генотипов и аллелей полиморфного локуса -308G>A гена TNFA у больных АГ и в контроле
В результате сравнительного анализа обнаружено достоверное увеличение комбинации генотипов С1С1/GA полиморфных локусов генов CYP2E1(-1019С>T) и TNFA(-308G>A) у больных АГ по сравнению с контролем (2=4,385; p=0,036). Высокий показатель отношения шансов (OR=1,936; 95% CI 1,083-3,463) позволяет считать его генетическим маркером предрасположенности к алкогольному гепатиту
У больных АГ значительно чаще, чем в контроле определялся и аллель А (2=6,087; p=0,014; OR=1,888; 95% CI 1,162-3,067). Полученные результаты согласуются с литературными данными о том, что транзиция G/A в -308 позиции промоторной области гена TNFA приводит к повышенной экспрессии гена, а присутствие аллеля А вдвое увеличивает продукцию цитокина по сравнению с аллелем G (Wilson A.G. et al., 1997).
Установлено, что у больных АГ значительно чаще встречался генотип GА, чем в группе больных стеатозом (2=4,497; p=0,034; OR=3,338; 95% CI 1,172-9,513) (рис.2).
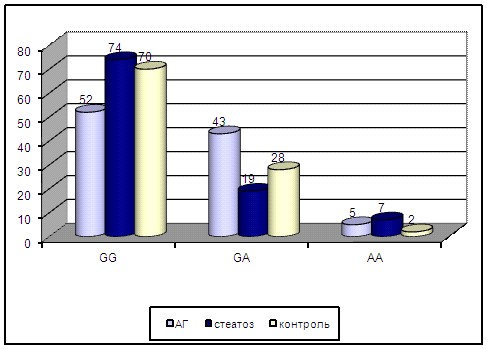
Рисунок 2 - Распределение частот генотипов полиморфного локуса -308G>A гена TNFA у больных АГ, стеатозом и в контроле
Выявлены статистически значимые различия в распределении частоты гетерозиготного генотипа GА у больных с преобладанием желтушного варианта АГ и в контроле (табл. 2).
Таблица 2 - Распределение частот генотипов полиморфного локуса -308G>A гена TNFA с учетом клинических вариантов АГ и в контроле
| Показатель | Генотипы | ||
| GG | GА | АА | |
| латентный вариант | |||
| абс/% | 31/59,62% | 19/36,54% | 2/3,85% |
| 2/p | 2=1,211; p=0,272 | 2=0,569; p=0,451 | 2=0,371; p=0,542 |
| желтушный вариант | |||
| абс/% | 17/44,74%* | 19/50,00%* | 2/5,26% |
| 2/p | 2=6,51; p=0,012 | 2=4,453; p=0,035 | 2=0,827; p=0,364 |
| OR; 95% CI: | OR=0,349; 95% CI 0,162-0,751 | OR=2,434; 95% CI 1,133-5,23 | OR=5,667; 95% CI 0,499-6,398 |
| холестатический вариант | |||
| абс/% | 5/41,67% | 6/50,00% | 1/8,33% |
| 2/p | 2=2,702; p=0,1; | 2=1,315; p=0,252 | 2=0,462; p=0,497 |
| контроль | |||
| абс% | 72/69,90% | 30/29,13% | 1/0,97% |
На основании высокого показателя отношения шансов (OR=2,434; 95% CI 1,133-5,23) генотип GА полиморфного локуса гена TNFA(-308G>A) можно считать генетическим маркером повышенного риска развития алкогольного гепатита с преобладанием желтушного варианта течения.
Проведен сравнительный анализ распределения частот генотипов TNFA у пациентов с учетом синдромов, сопровождающих течение АГ. Выявлена ассоциация генотипа АА с развитием гепаторенального синдрома (2=0,039; p=0,844; OR=1,836; 95% CI 0,328-10,27). У больных АГ с выраженным синдромом воспаления обнаружено значительное увеличение частоты генотипа GА (2=3,853; p=0,05; OR=3,277; 95% CI 1,101-9,751).
Таким образом, выявлены ассоциации генотипа GА с развитием желтушного клинического варианта АГ и воспалительным синдромом, ассоциация генотипа АА с гепаторенальным синдромом. Известно, что в алкоголь индуцированном повреждении печени значительная роль отводится активности провоспалительных цитокинов, в том числе и фактора некроза опухолей альфа (Мухин Н.А., 2009; Буеверов А.О. и соавт., 2011; Zindy P., 2004) Повышение экспрессии провоспалительных цитокинов, в том числе и фактора некроза опухолей альфа, стимулирует звездчатые клетки печени, способствуя развитию печеночного фиброза и цирроза (Никитин И.Г., 2005; Буеверов А.О. и соавт., 2011). Накопленные в последнее время данные о роли провоспалительных цитокинов в развитии алкогольного цирроза явились основанием для внедрения в клиническую практику препаратов с антицитокиновыми свойствами. Клиническую эффективность при тяжелых формах АГ продемонстрировал препарат инфликсимаб, содержащий химерные антитела к ФНО- (Бабак О.Я., 2006), этанерсепт, препятствующий связыванию ФНО- с мембранным рецептором (Narayanan Menon K.V. et al., 2004), пентоксифиллин, подавляющий синтез ФНО- активированными клетками Купффера (Мухин Н.А., 2009).
Анализ полиморфного локуса -35931 A>C (rs13181) гена репарации повреждений ДНК XPD (ERCC2 - excision repair cross-complementing rodent repair deficiency, complementation group 2; xeroderma pigmentosum, complementation group D) выявил существенные различия в распределении частот генотипов у больных АГ и в контроле.
В результате сравнительного анализа обнаружено достоверное увеличение комбинации генотипов С1С1/АС полиморфных локусов генов CYP2E1(-1019С>T) и XPD(-35931А>C) у больных АГ по сравнению с контролем (2=4,104; p=0,043). Высокий показатель отношения шансов (OR=1,844; 95% CI 1,058-3,213) позволяет считать его генетическим маркером предрасположенности к алкогольному гепатиту (рис. 3).

Рисунок 3 - Распределение частот генотипов и аллелей полиморфного локуса -35931А>C гена XPD у больных АГ и в контроле
Продукт гена XPD функционирует на начальном этапе синтеза всех белков клетки. Мутации XPD нарушают процессы эксцизионной репарации нуклеотидов (NER), снижают транскрипционную активность (van Brabant A.J. et al., 2000; Chen S. et al., 2002). На экспериментальных моделях, при изучении биоптатов печени показано, что подавление репарации ДНК при хроническом употреблении этанола ведет к усилению апоптоза гепатоцитов (Буеверов А.О. и соавт., 2011). Выявленные в работе ассоциации согласуются с данными литературы.
Анализ полиморфного локуса -28152 G>A (rs25487) гена репарации повреждений ДНК XRCC1 (Х-ray cross-complementing group 1) статистически значимых отличий по распределению частот генотипов и аллелей в группе больных АГ и контроля не обнаружил (р>0,05).
Установлена ассоциация гетерозиготного генотипа GА полиморфного локуса -28152 G>A гена XRCC1 c выраженным синдромом цитолиза у больных АГ (2=6,264; p=0,013; OR=3,233; 95% CI 1,362-7,675).
Согласно данных литературы индивиды, несущие полиморфный вариант -399Gln гена XRCC1, обладают более низкой способностью к репарации повреждений ДНК (Krajinovic M. et al., 2002). Zindy P., et al. в своей работе показали наличие ассоциации мутантного варианта гена XRCC1 с повышенным риском развития алкогольного цирроза (Zindy P. et al., 2005).
Анализ полиморфного локуса -18067 C>T (rs861539) гена репарации повреждений ДНК XRCC3 (X–ray-repair cross-complementing group 3) статистически значимых отличий по распределению частот генотипов и аллелей в группе больных АГ и контроля не обнаружил (р>0,05).
Выявлено, что у больных АГ c выраженным синдромом цитолиза гомозиготный генотип СС гена XRCC3 статистически достоверно чаще встречался, чем у больных АГ без этого синдрома (2=5,512; p=0,019; OR=2,813; 95% CI 1,248-6,341). При печеночно-клеточной недостаточности частота гетерозиготного генотипа СТ была существенно больше, чем у больных АГ без этого синдрома (2=12,011; p=0,001; OR=5,048; 95% CI 2,07-12,313).
Продукт гена XRCC3 участвует в репарации двуцепочечных разрывов ДНК, поддержании стабильности хромосом в процессе гомологичной рекомбинации (Stern M.C. et al., 2006). Клетки с недостаточной активностью XRCC3 обнаруживают повышенную чувствительность к ДНК - повреждающим агентам (Shen M.R. et al., 1998).
Выводы
- Признаки стеатоза у лиц, длительно употребляющих алкоголь, характеризовались диспепсическим (60,7%) и астеническим (50,8%) синдромами; увеличением размеров печени, не сопровождающееся изменением клинико-лабораторных показателей.
- В клинической картине алкогольного гепатита наиболее часто отмечаются выраженный астенический (60,7%), диспепсический (76,1%) и болевой синдромы (94,9%). Нарушение основных функций печени при алкогольном гепатите чаще формируют клинико-лабораторные синдромы цитолиза (77,8%), воспаления (55,6%) и печеночно-клеточной недостаточности (31,6%).
- У лиц, длительно употребляющих алкоголь, генетическими маркерами предрасположенности к алкогольному гепатиту являются комбинации генотипов С1С1/GA генов CYP2E1(-1019С>T), TNFA(-308G>A) и генотипов С1С1/АС генов CYP2E1, XPD(-35931А>C);
- К генетическим маркерам, ассоциированным с повышенным риском развития алкогольного гепатита с преобладанием желтушного варианта течения относятся делеция гена GSTT1 и генотип GА полиморфного локуса гена TNFA(-308G>A);
- Выраженность синдромов цитолиза ассоциируется с генотипами GА гена XRCC1(-28152G>A) и СС гена XRCC3(-18067С>Т); воспаления – с генотипом GА гена TNFA(-308G>A); печеночно-клеточной недостаточности – с генотипом СТ гена XRCC3(-18067С>Т) и гепаторенального – с генотипом АА гена TNFA(-308G>A).
Практические рекомендации
- Использование генетических маркеров риска, выявленных среди полиморфных локусов генов ферментов биотрансформации ксенобиотиков (GSTT1, NAT2), провоспалительного цитокина (TNFA) и репарации повреждений ДНК (XPD, XRCC1, XRCC3) может быть целесообразным при установлении прогноза и профилактики алкогольного гепатита.
- При планировании лечения алкогольного гепатита антиоксидантами и антицитокинами рекомендуется проводить типирование полиморфных локусов генов TNFA(-308G>A) и GSTT1(N/del).
Список работ опубликованных по теме диссертации:
- Лукманова Л.И. «Полиморфизм генов репарации ДНК при алкогольной болезни печени» /Л.И. Лукманова // Аспирантский вестник Поволжья - 2011. - № 5-6. - С. 247 – 250.
- Лукманова Л.И. «Поиск ассоциаций полиморфных вариантов генов XRCC1, XPD и XRCC3 с повышенным риском развития алкогольного гепатита» / Л.И. Лукманова, Р.А. Давлетшин, В.Л. Юлдашев, О.В. Кочетова, А.Р. Асадуллин, Т.В. Викторова // Медицинская генетика – 2011. - № 9. –С. 31 – 35.
- Лукманова Л.И. Изучение ассоциаций генов ферментов биотрансформации ксенобиотиков с развитием алкогольного гепатита / Л.И. Лукманова, Р.А. Давлетшин, В.Л. Юлдашев, А.Р. Асадуллин, Т.В. Викторова // Мат. VI Национального конгресса терапевтов, 23-25 ноября 2011. - Москва, 2011. – М.: ООО «Издательский дом «Бионика» – С. 129.
- Лукманова Л.И. Анализ полиморфизма гена фактора некроза опухолей - у больных алкогольным гепатитом / Л.И. Лукманова, Р.А. Давлетшин, В.Л. Юлдашев, Х.Х. Мурзабаев, А.Р. Асадуллин Т.В. Викторова // Мат. 1 Съезда терапевтов Поволжского Федерального округа России. - Пермь, 2011. - М.: ООО «Издательский дом «Бионика». – С.60.
- Лукманова Л.И. Прогнозирование риска развития алкогольной болезни печени / Л.И. Лукманова, Р.А. Давлетшин, В.Л. Юлдашев, Д.О. Каримов, Г.Ф. Максютова, Т.В. Викторова // Сб. статей Второй Международной научно-практической конференции «Высокие технологии, фундаментальные и прикладные исследования в физиологии, фармакологии и медицине» Санкт-Петербург. - 2011. - Т. 2. - СПб.: Изд-во Политехн. Ун-та - С. 222 -224.
- Лукманова Л.И., Викторова Т.В. Генетические основы предрасположенности к алкогольному гепатиту и циррозу печени / Л.И. Лукманова, Т.В. Викторова // Сб. научных трудов Республиканской конференции «Медицинская наука-2010». Уфа: Изд-во БГМУ, 2010.
- Лукманова Л.И. Анализ полиморфизма гена ариламин N-ацетилтрасферазы у больных алкогольной болезнью печени / Л.И. Лукманова, Р.А. Давлетшин, В.Л. Юлдашев, А.Р. Асадуллин, Д.О. Каримов, Т.В. Викторова // Сб. научных трудов 10 юбилейной конференции ученых Республики Башкортостан с международным участием «Научный прорыв - 2011». Уфа: Изд-во БГМУ, 2011. – С.20-21.
- Lukmanova L.I., Karimov D.O. Clinical and genetic association for alcoholic liver disease // Матер. итоговой научной конференции студентов и молодых ученых Республики Башкортостан с международным участием «Вопросы теоретической и практической медицины». – Уфа: Изд-во БГМУ, Т2. - 2012. - С. 308-312.
Лукманова Лима Ильгизовна
Клинико - генетические ассоциации при алкогольной болезни печени
автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Подписано в печать 21.04.2012 г.
Формат 6084 1/16. Гарнитура Times New Roman.
Бумага офсетная. Отпечатано на ризографе.
Усл. печ. л. 1,41. Уч.-изд. л. 1,23.
Тираж 100. Заказ № 085.
Отпечатано в типографии ООО «ФЕНИКС»
450054, г. Уфа, Проспект Октября,71/1
Телефон 8-901-441-83-52, e-mail:[email protected]

