Рост растяжением и водный обмен в условиях дефицита воды
На правах рукописи
ВЕСЕЛОВ ДМИТРИЙ СТАНИСЛАВОВИЧ
РОСТ РАСТЯЖЕНИЕМ И ВОДНЫЙ ОБМЕН В УСЛОВИЯХ
ДЕФИЦИТА ВОДЫ
Специальность 03.00.12 – Физиология и биохимия растений
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора биологических наук
Уфа-2009
Работа выполнена в Лаборатории физиологии растений
Учреждения РАН Института биологии Уфимского научного центра РАН
Официальные оппоненты: Вахитов Винер Абсатарович
доктор биологических наук, профессор
Титов Александр Федорович
доктор биологических наук, ч-кор РАН, профессор
Хайруллин Рамиль Магзинурович
доктор биологических наук, профессор
Ведущая организация – С-Петербургский госуниверситет
Защита состоится «19 » ноября__ 2009 г. в 1400 часов на заседании диссертационного совета Д 212.013.11 в ГОУ ВПО Башкирский государственный университет по адресу: 450074, г. Уфа, ул. Заки Валиди, 32, биологический факультет БашГУ, ауд. 332.
Факс (347) 273-67-78, email: [email protected]
Официальный сайт БашГУ: http://www.bashedu.ru/firstbgu_r.htm
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Башкирский государственный университет.
Автореферат разослан «____»________________2009 г.
Ученый секретарь
диссертационного совета, д.б.н. М.Ю. Шарипова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы исследования. Недостаток воды в почве и воздухе, засоление и присутствие в почве ионов тяжелых металлов - наиболее распространенные неблагоприятные абиотические факторы окружающей среды, которые создают угрозу жизни растений, тормозят их рост и снижают урожайность. Общим для данных факторов является то, что они нарушают водный обмен растений и вызывают торможение роста растяжением поделившихся клеток. Вместе с тем, было показано, что при резком возрастании дефицита воды вслед за торможением роста происходит его возобновление, что является важным свойством растений, обеспечивающим их выживание (Serpe, Matthews, 1992; Salah, Tardieu, 1996; Кудоярова и др., 1998; Munns et al., 2000).
Хорошо известно, от чего зависит растяжение клеток (Cosgrove, 2000; Шарова, 2004). Это осмотический потенциал и тургор, растяжимость клеточной стенки и доступность воды для роста. Гораздо меньше сведений о роли каждого из них в приспособлении процесса роста растяжением к условиям обитания растений (Nonami, Boyer, 1999), и особенно скудна информация о механизмах быстрого реагирования на внезапные изменения окружающей среды (Serpe, Matthews, 1992, Hsiao et al., 1998; Munns et al., 2000). Необходимо было также понять, как осуществляется регуляция быстрых ростовых реакций. В литературе много внимания уделяется сигнальной роли гормонов в реакции на внешние воздействия (Шакирова, 2001; Титов и др., 2006). Существует мнение, что быстрые ростовые реакции в ответ на засоление не связаны с гормонами (Munns et al., 2000). Тем не менее, некоторые воздействия уже через несколько минут вызывали изменения концентрации гормонов в растениях (Кудоярова и др., 1999), что привлекает интерес к изучению возможной роли гормонов в обеспечении быстрых адаптивных реакций у растений. Много внимания уделяется роли абсцизовой кислоты (АБК) в качестве корневого сигнала, продуцируемого корнями в неблагоприятных условиях (Davies et al., 2005). Наряду с корневой АБК, важную роль при дефиците воды может играть абсцизовая кислота, синтезируемая в самом листе (Popova et al., 2000). Серьезным пробелом в этой области является отсутствие сведений о том, в какой части листа может запускаться синтез АБК в ответ на водный стресс (Meinzer, 2000).
Закрытие устьиц не только способствует поддержанию водного баланса при дефиците воды, но и потенциально может снижать пассивный приток токсичных ионов в растение с транспирационным потоком. Вместе с тем, сведения о связи скорости транспирации с действием на растение токсичных ионов противоречивы (James et al., 2008), что указывает на необходимость дальнейших исследований в этой области.
С открытием водных каналов аквапоринов не утихают дискуссии об их роли в регуляции транспорта воды в растении (Trofimova et al., 2003; Sade et al., 2009; Parent et al, 2009). По некоторым данным, повышение их активности способствует возрастанию засухоустойчивости, а по другим – ее снижению (Aroca et al., 2005). Само существование противоположных точек зрения по данному вопросу указывает на актуальность изучения участия водных каналов в регуляции гидравлической проводимости на уровне целого растения и ее роли в поддержании водного обмена при дефиците воды.
Цель данной работы - выявить механизмы, обеспечивающие регуляцию роста растяжением и водного обмена у злаковых растений при действии внешних факторов, вызывающих дефицит воды. Для ее решения были поставлены следующие задачи:
- Изучение способности растений поддерживать рост и оводненность при воздействиях, повышающих дефицит воды в растениях: осмотическом шоке, засолении, неоптимальной температуре и действии тяжелых металлов.
- Исследование роли осмотической регуляции в возобновлении роста и его поддержании при дефиците воды, вызванном действием непроникающих осмотически активных веществ и засолением.
- Оценка характера и степени изменения растяжимости листьев при осмотическом стрессе и возможной роли экспрессии генов экспансинов как фактора, определяющего скорость роста растяжением при внешних воздействиях.
- Сравнительное изучение динамики эндогенных гормонов и скорости роста растений при стрессе с целью выявления возможной роли гормонов в регуляции быстрого ростового ответа на внешние воздействия.
- Выявление степени влияния устьичной проводимости на оводненность листьев и поддержание ростовых процессов при возрастании дефицита воды, а также возможности быстрого накопления АБК как фактора, обеспечивающего закрытие устьиц.
- Сравнительное изучение влияния кратковременного и длительного засоления на устьичную проводимость растений, различающихся по солеустойчивости.
- Выявление зависимости уровня накопления токсичных ионов от скорости транспирации путем сравнения этих показателей у растений, различающихся по солеустойчивости.
- Изучение влияния осмотического стресса на содержание аквапоринов, экспрессии их генов и сопоставление этих показателей с гидравлической проводимостью растений и изменением скорости транспирации.
Основные положения диссертации, выносимые на защиту:
Восстановление водного баланса и роста достигается как за счет закрытия устьиц, так и повышения гидравлической проводимости. Выбор между этими альтернативными механизмами зависит от места накопления АБК в растении: увеличение содержания в листьях обеспечивает закрытие устьиц, в корнях – повышение гидравлической проводимости.
Быстрое возрастание растяжимости листа связано с накоплением ИУК и повышением экспрессии генов экспансинов и способствует поддержанию роста при осмотическом стрессе. Отсутствие возрастания растяжимости листа при засолении является признаком низкой солеустойчивости.
Снижение скорости транспирационного потока уменьшает поступление и накопление токсичных ионов при кратковременном засолении.
Закрытие устьиц повышает устойчивость растений только в первое время действия на растения дефицита воды и засоления, а при их более продолжительной экспозиции устойчивость зависит от способности растений поддерживать устьица открытыми.
Изменение гидравлической проводимости растения зависит от уровня экспрессии генов аквапоринов в клеточных мембранах корней.
Научная новизна. Выявлено, что повышение осмоляльности клеточного сока начинается после первого часа осмотического стресса, что происходит не за счет снижения оводненности тканей, а за счет активного накопления осмотически активных веществ. Впервые показано значение быстрого (в течение первых минут действия стрессовых факторов) закрытия устьиц в возобновлении роста и поддержании оводненности листьев при резком возрастании дефицита воды. Установлено, что сигналом для снижения устьичной проводимости является повышение уровня АБК, которое становится заметным уже через 10 минут после начала действия стресса. Наибольшее возрастание концентрации абсцизовой кислоты обнаружено в зоне роста листьев однодольных растений, где происходит сжатие клеток. С помощью метода иммунолокализации выявлено накопление АБК при засолении в области устьичных клеток. Впервые показано увеличение коэффициента растяжения листа параллельно с накоплением ИУК на протяжении 40 минут осмотического стресса, что способствует поддержанию роста листьев и обусловлено возрастанием экспрессии гена экспансина альфа Exp1. Сравнение реакции на засоление и действие нейтрального непроникающего осмотика ПЭГ у относительно солеустойчивых растений ячменя и чувствительных к засолению растений пшеницы позволило впервые выявить быстрые проявления токсического (ион-специфического) компонента уже в течение первого часа действия засоления. Обнаружено противоположное действие осмотического стресса на уровень экспрессии генов аквапоринов у растений ячменя и кукурузы, что связано с различным вкладом апопластного пути транспорта воды у растений этих видов.
Научно-практическая значимость работы. Выявлены основные механизмы поддержания роста и оводненности растений в условиях возрастания дефицита воды за счет быстрого снижения устьичной и возрастания гидравлической проводимости растений, накопления осмотически активных веществ и повышения растяжимости листа, что имеет важное значение для понимания процессов, обеспечивающих получение стабильного урожая в изменяющихся условиях обитания. Выявленные в начале действия засоления различия в ростовой реакции у растений с разным уровнем устойчивости могут быть использованы для разработки биотеста для ее ранней диагностики у растений. Показана также перспективность использования показателей устьичной реакции растений на кратковременное действие засоления как физиологического признака в селекции на солеустойчивость. Основные результаты работы используются при обучении студентов кафедры физиологии растений (включены в учебное пособие «Гормоны и адаптация растений к условиям обитания»).
Связь работы с плановыми исследованиями и научными программами. Исследования проводились в рамках планов НИР лаборатории физиологии растений Института биологии УНЦ РАН: «Оптимизация и стабилизация продукционного процесса растений в условиях стресса уровнем минерального питания и регуляторами роста» (1996-1998), «Исследование системы регуляции концентрации фитогормонов как фактора интеграции растительного организма» (1999-2003), «Механизмы передачи сигналов между органами растения и согласования процессов, обеспечивающих рост и водный обмен в изменяющихся условиях внешней среды» (2004-2006), «Регуляция роста и водного обмена растений в изменяющихся условиях внешней среды» (2007-2009).
Декларация личного участия. Автором была определена тема исследования и проведен подбор экспериментальных моделей. Часть результатов, представленных в 3.1-3.3 главах диссертации получены в совместной работе с к.б.н. Г.Р. Ахияровой, к.б.н. И.Б. Сабиржановой и к.б.н. Г.В. Шариповой. Автор был научным руководителем их диссертаций. Автору принадлежит замысел и окончательный текст диссертации. В диссертации использованы работы, опубликованные в соавторстве.
Апробация работы. Материалы диссертации были представлены на 20 конференциях, наиболее важные из которых: III, IV, VI съезд обществ физиологов растений (Москва, 1997; Москва, 1999; Сыктывкар 2007), XI-XIV конгрессы европейских обществ физиологов растений (Варна, 1998; Будапешт, 2000; Крит, 2002; Краков, 2004), 5-й междунар. симпозиум общества по изучению корней растений (Южная Каролина, 1998), 5-й междунар. симпозиум по структуре и функции корней (Словакия, 1998), 3-я всеросс. конф. «Иммуноанализ регуляторов роста в решении проблем физиологии растений, растениеводства и биотехнологии» (Уфа, 2000), межд. конф. «Environmental Stress and Sustainable Agriculture» (Варна, 2002), 5-я экологическая конф. (Казань, 2002), Межд. симпозиум «Сигнальные системы растений: роль в адаптации и иммунитете» (Казань, 2006), Всеросс. конф. «Биомика – наука XXI века» (Уфа, 2007), Междунар. конф. «Физико-химические основы структурно-функциональной организации растений» (Екатеринбург, 2008).
Исследования были выполнены при поддержке грантов РФФИ № 97-04-49962, № 99-04-49291, № 02-04-97908-р2002агидель; № 03-04-49780; № 06-04-49166; № 06-04-49276, персональных грантов Президента РФ № МК-7418.2006.4 и «Фонда содействия отечественной науке» по программе «Молодые кандидаты и доктора наук РАН»; программ ГНТП АН РБ.
Публикации. По теме диссертации опубликованы 42 работы, в том числе 1 монография, 19 статей в научных журналах, рекомендованных ВАК РФ для защиты докторских диссертаций, 12 статей в крупных региональных изданиях, 1 патент.
Структура и объем работы. Диссертация изложена на 283 страницах машинописного текста (включая иллюстрации и список литературы) и состоит из введения, обзора литературы, 4 глав экспериментальной части, заключения и выводов. В работе представлено 12 таблиц и 77 рисунков. Список литературы включает 408 наименований, из них 357 иностранных.
Благодарности. Автор благодарит к.б.н. Ахиярову Г.Р., к.б.н. Сабиржанову И.Б., к.б.н. Шарипову Г.В. за помощь в сборе и обработке материала, к.б.н. Высоцкую Л.Б., д.б.н. Трапезникова В.К. за ценные советы и рекомендации, д.б.н. Кудоярову Г.Р. за чуткое руководство и предоставление всех необходимых условий для выполнения экспериментов и весь замечательный коллектив нашей лаборатории за всестороннюю поддержку и помощь. А также жену и родителей за чуткость, помощь и понимание.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Исследования проводили на растениях ячменя (Hordeum vulgare: сорта Golf, Михайловский и Прерия и дефицитных по АБК мутантных растений Az34; Hordeum spontaneum: линии Т-1 и 20-45), яровой твердой пшеницы (Triticum durum, сорта Безенчукская 139), яровой мягкой пшеницы (Triticum aestivum, сорта Казахстанская 10, Ирень) и кукурузы (Zea мays, гибрид Харьковский 310 МВ и линия B73) в лабораторных условиях на водной культуре. Растения ячменя линии T-1 были получены из популяции, отобранной в Турции, а 20-45 – в Израиле (Nevo et al. 1986). Эти линии были отобраны как морфологически сходные, но имеющие контрастную устойчивость к засолению по предварительным данным, полученным в опытах в гидропонической культуре.
Семена проращивали в темноте в течение 2-3 суток на дистиллированной воде с добавлением 10-5 M CaCl2, при температуре 24 С. На четвертые сутки проростки пересаживали на 10 %-ную среду Хогланда-Арнона-I и выращивали при освещенности 18000 лк и 14-часовой продолжительности светового дня. Опыты в основном проводили с растениями, у которых активно рос первый лист. В более длительных опытах растения переносили на 100 %-ную среду Хогланда-Арнона.
Температуру воздуха повышали на 4+1оС за несколько минут потоком горячего воздуха от тепловентилятора “Ветерок-2” и поддерживали на постоянном уровне в течение 1,5 ч. Действие нейтрального осмотика ПЭГ 6000 изучали путем его добавления в питательную среду до конечной концентрации 12 %, что соответствует осмотическому потенциалу -0,73 МПа. Засоление вызывали внесением в питательную среду хлорида натрия до конечной концентрации 100 мМ.
Рост растений регистрировали с помощью датчика роста на основе линейного дифференциального трансформатора с подвижным сердечником ДЛТ-2. Для измерения растяжимости листа дополнительный груз массой 2 г подвешивали к коромыслу датчика роста со стороны сердечника. Коэффициент растяжения (m) рассчитывали по формуле (Thomas et al, 1999): m=(Х1-Х0)/(Lgr * ) (сек-1* Па), где - Х0 (м/сек)- скорость роста без груза, Х1 (м/сек)- стабильная скорость роста после добавления груза, Lgr (м) - длина зоны растяжения листа, - изменение тянущего усилия.
Транспирацию определяли весовым методом. Для измерения устьичного сопротивления был использован порометр (MK Delta-T). Осмотическое давление в ксилемном соке и соке, отжатом из тканей растений определяли на цифровом микроосмометре (CAMLAB Limited, UK) по температуре замерзания. Относительное содержание воды определяли в дифференцированной части листа по формуле: ОСВ=100%х(сырой вес–сухой вес)/(тургорный вес–сухой вес).
Гидравлическую проводимость корня рассчитывали по формуле Lp=V/(x – 0), где Lp – гидравлическая проводимость; V – поток воды из корней; x – осмотическое давление пасоки; 0 – осмотическое давление питательной среды.
Концентрацию ионов натрия и калия в клеточном соке определяли с помощью пламенно-жидкостного хроматографа PHP7 (JENWAY Великобритания), ионов хлора - с помощью метода капиллярного электрофореза на ионном анализаторе «Нанофор 01».
Содержание хлорофиллов a и b определяли спектрофотометрически в аликвоте 96% этилового спирта, полученной из навески побегов. Расчет вели по формулам Реббелена (Методы биохимического анализа, 1978). Скорость фотосинтеза измеряли с помощью газового анализатора CIRAS 1 (PP Systems, Hitchin, Herts, UK).
Для определения содержания гормонов в тканях растительный материал гомогенизировали и экстрагировали 80%-ным этанолом. Спиртовой экстракт отделяли центрифугированием и упаривали до водного остатка. Ксилемный сок для определения гормонов собирали, как описано (Vysotskaya et al., 2004). Очистку АБК и ИУК проводили по модифицированному экстракционному методу (Veselov et al., 1992). Цитокинины разделяли с помощью ТСХ как описано (Kudoyarova et al., 1998). Иммуноферментный анализ и иммунолокализацию проводили с помощью специфических антител к гормонам (Веселов, 1998), активность цитокининокидазы – как описано (Веселов, Симонян, 2004).
Транскрипционную активность гена экспансина оценивали с помощью метода дот-блот анализа (Sabirzhanova et al., 2005) в гибридизационной камере Micro-4 (Hybaid) при 65 °C. Фрагмент 3'-UTR гена alpha-expansin 1 ( Expa1) использовали в качестве специфической гибридизационной пробы (Wu et al., 2001). Его амплифицировали с помощью ПЦР, используя праймеры Exp1 For 5'CTACTACTACTCCATCGACG3' и Exp1 Rev 5'ATTAAGTTGCACGACACC3' [Wu et al., 2001]. Синтез равномерно меченной пробы ДНК проводили с использованием упомянутых выше праймеров в присутствии [-32P] дЦТФ (Feinberg et al., 1983).
Для выявления гена аквапорина ячменя HvPIP2;4 использовали следующие праймеры: For: ggcttcgcggtgttcatg; Rev: ggccttctcgttgttgtagatca and 26S rRNA (For: gaagagccgacatcgaagga; Rev: gaaaagttcccacagggataactg), подобранные для соответствующей 3’-нетранслируемой области. Реакционная смесь для ПЦР реакции: QuantiTect SYBR Green PCR Master Mix (Qiagen), 1 мкM каждого праймера, 5 нг кДНК в объеме 25 мкл. РТ-ПЦР в реальном времени проводили с помощью ABI PRISM7700 (Applied Biosystems), сначала при 95°C в течение15 мин, за которым следовало 40 циклов (95°C, 15 сек; 58°C, 30 сек; 72°C, 30 сек). Относительную количественную оценку проводили с использованием 26S rRNA для нормализации выхода РНК как описано (PE Applied Biosystems (2001) User Bulletin#2).
Определение транскрипционной активности генов ZmPIP проводили как описано (Chaumont et al., 2001).
Статистическую обработку проводили по стандартным программам.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1. Ростовая реакция растений пшеницы и ячменя на дефицит воды
Представляло интерес проследить, как скажутся на росте растений воздействия, которые могли повлиять на скорость поглощения и испарения воды. Все четыре воздействия приводили к очень быстрому (в течение первых минут) прекращению роста листьев растений пшеницы и ячменя (рис.1). Во всех случаях происходило сжатие листа, которое было более выражено у растений пшеницы при повышении температуры воздуха и у растений ячменя – при осмотическом стрессе.
Прекращение роста свидетельствует об исчезновении градиента водного потенциала между растущими клетками и ксилемой, а сжатие листа - о реверсии градиента, поддерживающего уже обратный ток воды, т.е. свидетельствует о более низком водном потенциале ксилемы по сравнению с растущими клетками. Факт снижения оводненности листьев при данных воздействиях подтвердили результаты определения относительного содержания воды, которое уменьшалось через 15 минут после начала воздействия от 94-95 % в контроле до 88, 92 и 92 % при повышении температуры воздуха, осмотическом стрессе и охлаждении питательного раствора соответственно. Снижение ОСВ свидетельствует о возрастании дефицита воды в растении, поскольку дефицит воды, рассчитывается как (100-ОСВ) %.
Причина нарушения водного баланса заключалась как в увеличении скорости потери воды (при повышении температуры воздуха), так и в снижении скорости ее поступления из корней (при осмотическом и локальном холодовом стрессах). Результат в обоих случаях был один – снижение оводненности листа и прекращение его роста.
Как видно из рисунка 1, при большинстве из испытанных воздействий (исключение составило лишь охлаждение корней) растения оказались способны возобновлять рост через некоторое время после его временной остановки. При повышении температуры воздуха восстановление скорости роста было полным, а при осмотическом стрессе – частичным.

Рис. 1. Скорость роста первого листа 7-сут растений твердой пшеницы сорта Безенчукская-139 (А-Г) и ячменя сорта Golf (Д, Е) при охлаждении питательного раствора до 6 градусов (А), повышении температуры воздуха на 4 градуса (Б), добавлении в питательный раствор ПЭГ до конечной концентрации 12 % (В, Д), и 100 mM NaCl (Г, Е). Стрелками во всех случаях указано время начала воздействия. На графиках представлены средние значения из 5 независимых экспериментов и их стандартные ошибки.
Поскольку действие стрессовых факторов не прекращалось, очевидно, что в самих растениях происходили процессы, позволившие им возобновить рост. Изучение механизмов поддержания роста в изменяющихся условиях окружающей среды представляет интерес, поскольку от них зависит формирование фотоассимилирующей поверхности, листового покрытия и обеспечение конкурентоспособности растений (Quarrie et al., 1999).
В отличие от растений ячменя (рис. 1), у растений твердой пшеницы степень восстановления роста листа была ниже на фоне засоления по сравнению с действием ПЭГ (30 и 50 % от исходной скорости роста при добавлении в среду ПЭГ и NaCl соответственно). Таким образом, уже в быстрой ростовой реакции растений твердой пшеницы проявлялись признаки низкого уровня их солеустойчивости. Из литературы известна высокая чувствительность растений твердой пшеницы к засолению (Munns et al., 2000), что в наших опытах проявляется в меньшей способности адаптироваться к ионному стрессу по сравнению с осмотическим. Однако для того, чтобы сконцентрироваться на модели быстрых реакций растений, важно было убедиться, что сорта, оказавшиеся в нашем распоряжении, действительно различались по солеустойчивости, для чего необходимо было изучить их реакцию на более длительное действие засоления. Как видно из рисунка 2, ростингибирующее влияние засоления проявлялось не только при кратковременном, но и при его длительном действии. При этом через 8 суток после добавления соли в питательный раствор степень подавления накопления биомассы
 | Рис. 2. Масса побега в целом и отдельных листьев растений пшеницы сорта Безенчукская-139 и ячменя сорта Golf через 8 суток роста на растворе 100 мМ NaCl (n=6). |
отдельных листьев и побега в целом была выше у растений пшеницы по сравнению с растениями ячменя. Таким образом, изучение более длительного действия засоления подтвердило, что у растений ячменя сорта Golf ингибирование роста при засолении проявлялось в меньшей степени, и, следовательно, они были более солеустойчивыми, чем растения твердой пшеницы сорта Безенчукская-139. Различия между сортами ячменя также проявлялись как в кратковременных, так и более длительных опытах (сорт Прерия был более устойчивым по сравнению с сортом Михайловский, данные приводятся в диссертации).
2. Роль осмотического приспособления в ростовой реакции растений на дефицит воды
Хотя в литературе описано быстрое возобновление роста после его прекращения при снижении оводненности листа (Munns et al., 2000), комплексного исследования механизмов, лежащих в его основе не проводилось. В отдельных работах лишь высказывается предположение о возможной роли осмотического приспособления (Salah, Tardieu, 1996). Хорошо известно, что накопление осмотически активных веществ обеспечивает поддержание тургора и роста при длительном действии засухи и засоления (Zhang et al., 1999). Нами предпринята попытка выявить возможную роль осмотического приспособления в быстрых ростовых реакциях. Возрастание осмоляльности сока из зоны роста листа у ячменя можно было заметить через 75 минут после добавления осмотически активных веществ в питательный раствор (у пшеницы на засолении увеличение осмоляльности было заметно уже через 45 минут) (рис. 3). Вместе с тем, возобновление роста происходило на 25 минут раньше, чем повышалась концентрация осмотически активных веществ. Кроме того, увеличение осмоляльности клеточного сока на 30-80 Мосмоль не могло быть достаточным для того, чтобы сбалансировать возрастание осмоляльности питательного раствора на 150 Мосмоль, которое было результатом добавления в него осмотиков. Но все же, накопление осмотически активных веществ, которое продолжалось в процессе дальнейшей экспозиции растений на растворе с ПЭГ и NaCl, могло способствовать поддержанию роста при длительном действии осмотического стресса, (данные приводятся в диссертации).

Рис. 3. Осмоляльность клеточного сока растущей зоны листьев 7-сут растений пшеницы сорта Безенчукская-139 и ячменя сорта Golf через разные промежутки времени после начала засоления (100 мМ NaCl) и действия 12 % ПЭГ. Цифры над столбцами на гистограмме показывают абсолютные значения осмоляльности (Мосмоль/л). На рисунке представлены средние значения (n=6) и их ошибки.
Определение содержания отдельных ионов в разных зонах листа показало, что у растений ячменя осмотическая регуляция в первоначальный период действия засоления связана с накоплением ионов калия в зоне роста (их концентрация возрастала на 40 мМ через 7 часов). Это соответствует данным литературы о роли калия в качестве основного осмолита при возрастании дефицита воды (Shabala, Cuin, 2007).
3. Растяжимость клеток как фактор, способствующий поддержанию роста при кратковременном действии дефицита воды в питательном растворе
При стрессовых воздействиях поддержание ростовых процессов может быть связано с изменением свойств клеточной стенки (Hsiao et al., 1998). Это предположение появилось только на основании того, что не было обнаружено увеличения тургора при возобновлении роста (Serper, Matthews, 1992). Важно было проверить экспериментально, может ли коэффициент растяжения листа быстро изменяться при осмотическом стрессе. Из таблицы 1 видно, что после добавления полиэтиленгликоля в питательную среду значения коэффициента растяжения увеличивались. Через 30 мин коэффициент растяжения был в 2 раза выше, чем через 10 минут после начала воздействия. Таким образом, возобновлению роста на фоне добавления в питательный раствор полиэтиленгликоля предшествовало увеличение растяжимости тканей листа (табл. 1) как у растений пшеницы, так и у ячменя.
Хорошо известно, что ауксины вызывают разрыхление клеточной стенки, и, соответственно, растяжимость клеток возрастает (Полевой, Саламатова, 1977; Cleland, 1983; Шарова, 1987; Romanto et al, 1995; Gray at el, 1998). Для того, что бы ответить на вопрос, принимает ли ИУК участие в снижении жесткости клеточной стенки, мы измерили концентрацию этого гормона в побеге растений пшеницы и ячменя при добавлении ПЭГ. Из рисунка 4 видно, что при
Таблица 1
Коэффициент растяжения (m, сек-1*ГПа-1) первого листа 7-сут растений пшеницы сорта Безенчукский-139 и ячменя сорта Golf, измеренный во время отсутствия роста через 10, 20 и 30 минут после добавления ПЭГ в среду до конечной концентрации 12 %. В таблице представлены средние значения (n=6) и ошибки средних.
| 10 мин | 20 мин | 30 мин | |
| Ячмень | 0,22±0,04 | 0,25±0,04 | 0,46±0,02 |
| Пшеница | 0,14±0,03 | 0,27±0,11 | 0,34±0,08 |
добавлении в питательную среду осмотика наблюдается быстрое накопление ИУК в побеге пшеницы и ячменя.
Вызванное осмотическим шоком возрастание концентрации ИУК в побегах может быть тем фактором, который способствует увеличению растяжимости листа и возобновлению роста. Судя по данным литературы, влияние ауксинов на рост растений может реализоваться через их способность активировать поглощение ионов калия (Шишова и др., 1997; Yamagami et al., 2004). Вместе с тем, накопление осмотически активных веществ происходило слишком медленно по сравнению с возрастанием коэффициента растяжения и возобновлением роста. Поэтому больший интерес представляет обсуждение возможной роли ауксинов как фактора, регулирующего растяжимость клеточных стенок.

Рис. 4. Влияние добавления в питательную среду ПЭГ до конечной концентрации 12 % на концентрацию ауксинов в листьях 7-сут растений пшеницы сорта Безенчукская-139 (А) и ячменя сорта Golf (Б). На графиках представлены средние значения (n=4) и ошибка средней.
Одним из факторов, который способствует разрыхлению клеточной стенки, может быть белок экспансин. Показано, что активность экспансинов была высокой в быстро растущих тканях и уменьшалась по мере снижения скорости роста (McQueen-Mason, Rochange, 1999). Связь между скоростью роста корней и экспансинами обнаружена при действии засухи на растения кукурузы (Wu et al, 1996). В качестве объекта нами также была выбрана кукуруза, так как в литературе имеется большое количество данных об экспансинах, идентифицированных в этих растениях (Wu et al., 2001).
Принципиальных различий в ростовой реакции растений кукурузы на водный дефицит по сравнению с растениями пшеницы и ячменя не было обнаружено (данные приводятся в диссертации). Было установлено, что растяжимость листа растений кукурузы возрастает при действии ПЭГ (рис. 5). Это увеличение по времени совпадает с возобновлением роста побега (рис. 1).
Используя опубликованные ранее данные о последовательности нуклеотидов в гене экспансина EXPA1, были подобраны праймеры и получен клон данного гена. Выбор этого гена из семейства экспансинов кукурузы был основан на том, что по данным литературы его экспрессия была характерна для молодых листьев растений (Wu et al., 2001). Сравнение полученной нами последовательности с опубликованной ранее (Wu et al., 2001), подтвердило, что мы действительно имеем дело с интересующим нас геном.
 | Рис. 5. Коэффициент растяжения первого листа 7-сут растений кукурузы (Харьковский-310 МВ), измеренный во время отсутствия роста растений через 10, 20 и 30 мин после добавления ПЭГ (n=6). |
Используя дот-блот анализ транскриптов мРНК с 33Р-меченой ДНК пробой, мы обнаружили быстрое накопление транскрипта гена EXPA1в побегах кукурузы при обработке ПЭГ (рис. 6).
Максимальное накопление транскрипта наблюдалось уже к 30 минутам действия ПЭГ. Следовательно, увеличение растяжимости листа и восстановление роста побега при добавлении ПЭГ могло быть связано с повышением экспрессии гена, кодирующего экспансин.
Недавно были опубликованы данные об экспрессии экспансинов в зоне роста листа кукурузы в норме и при стрессе (Muller et al., 2007). Однако нам не удалось встретить работы, где бы активность экспансинов в листе связывали с быстрым изменением свойств клеточных стенок при внешних воздействиях. В этом новизна полученных нами результатов. Представляло интерес проверить, влияют ли ауксины на экспрессию гена EXPA1. Сначала мы должны были убедиться, что побеги кукурузы накапливают ауксины, так же как и побеги пшеницы и ячменя. Так, анализ содержания ИУК в проростках кукурузы показал, что оно возрастало уже через 25 минут экзогенного гормона (с 72 до 120 нг/г сырой массы). Важно было выяснить, есть ли связь между накоплением ауксинов
 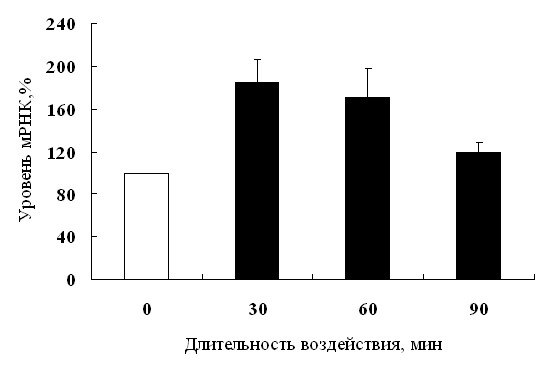 | Рис. 6. Результаты дот-блот анализа транскриптов мРНК гена экспансина в листьях 7-сут растений кукурузы до и после добавления ПЭГ в питательную среду до конечной концентрации 12 %. Денситометрические измерения, представленные как процент от данных, полученных для растений, необработанных ПЭГ (n=4). |
и изменением уровня экспрессии гена экспансина. Оказалось, что при добавлении в питательную среду ИУК в концентрации 10 мг/л через час после начала обработки наблюдалось накопление транскриптов мРНК гена, кодирующего Exp1 (рис. 7). Эти результаты подтверждают предположение о связи между экспансинами и уровнем ауксинов, и, что ауксины могут не только регулировать активность экспансинов, изменяя рН клеточной стенки, но и влиять на уровень их экспрессии (Link and Cosgrove, 1998).
Влияние ауксинов на рост клеток растяжением было показано в основном на отрезках колеоптилей или гипокотилей растений (Cleland, 1983). Гораздо меньше в литературе сведений о стимуляции роста листьев под влиянием экзогенной ИУК, хотя их тоже можно встретить (Keller, Volkenburgh, 1997).
Таким образом, показано, что в листьях растений кукурузы происходит быстрое повышение содержания транскрипта гена экспансина Expa1, что может быть одним из механизмов, способствующих быстрому разрыхлению клеточной стенки и поддержанию роста клеток листа растяжением в условиях дефицита воды. Накопление ИУК в листьях растений при действии засоления и способность экзогенной ИУК повышать уровень экспрессии генов экспансинов свидетельствуют о возможном участии ИУК в разрыхлении стенок клеток листа при действии дефицита воды.
 | Рис. 7. Результаты дот-блот анализа транскриптов мРНК гена экспансина в листьях 7-сут растений кукурузы (Харьковский-310 МВ), до и после добавления ИУК (n=3). |
После того, как был установлен вклад изменения растяжимости тканей листа в быстрый ответ растений на дефицит воды и выяснено, что реакция растений твердой пшеницы и ячменя имеет сходный характер, следующим этапом нашей работы стало сравнение этих растений при действии засоления.
4. Сравнительный анализ растяжимости листа у растений твердой
пшеницы и ячменя при засолении
Для того чтобы выяснить, не связаны ли различия в степени восстановления роста листа у растений с изменением их жесткости, мы измерили растяжимость листьев твердой пшеницы и ячменя при действии засоления. Как видно из рисунка 8, через 30 мин после добавления NaCl в питательный раствор растяжимость первого листа ячменя увеличивалась, как и при действии ПЭГ. Следовательно, у растений ячменя изменение растяжимости листа при засолении способствовало возобновлению роста, так же как и при действии ПЭГ.
У растений твердой пшеницы мы не наблюдали возрастания растяжимости клеточных стенок. Скорее всего, именно поэтому скорость роста растений пшеницы после добавления NaCl в питательный раствор была ниже, чем у растений ячменя. Чем же объяснить различия между растениями пшеницы и ячменя по характеру действия ПЭГ и засоления на коэффициент растяжения листа? В литературе доминирует мнение о том, что в первое время действия засоления растения испытывают лишь влияние осмотического компонента этого неблагоприятного фактора, (что является результатом присутствия соли в растворе, но не в растении) (Munns, 2005). Это соответствует поведению растений ячменя, реакция которых на непроникающий в растения осмотик ПЭГ была такой же, как и реакция на хлорид натрия. Однако растения пшеницы иначе реагировали на NaCl, чем на ПЭГ. Это указывает на то, что растения этого вида, более высокая чувствительность которых к засолению известна из литературы (Ellis et al., 1997; James et al., 2006), реагировали на токсический компонент засоления уже в первый час его действия.
 | Рис. 8. Коэффициент растяжения первого листа 7-сут растений ячменя и пшеницы, измеренный во время отсутствия роста растений через 10, 20 и 30 минут после добавления 100 мМ хлорида натрия (n=6). |
Можно предположить, что растения твердой пшеницы, являясь менее солеустойчивой культурой, чем ячмень, уже в течение часа могут накапливать определенное количество токсических ионов Na+ и Cl+, способных ингибировать действие ферментов. Чтобы проверить наше предположение, мы измеряли концентрацию ионов Na+ в клеточном соке из зоны роста листьев твердой пшеницы и ячменя. Результаты измерений показали, что уже через один час растения пшеницы накапливают в десять раз больше ионов Na+, чем растения ячменя (около 2 и 11 мМ в отжатом из листа соке у растений ячменя и пшеницы соответственно).
5. Регуляция водного обмена при возрастании дефицита воды
в растении
Несмотря на то, что коэффициент растяжения листьев растений пшеницы не менялся при засолении, их рост возобновлялся. Это указывает на зависимость возобновления роста от еще каких-то факторов. Анализируя ростовую реакцию растений на изменение внешних условий, мы отмечали, что быстрое прекращение роста было следствием снижения оводненности тканей листа, о чем свидетельствовало уменьшение относительного содержания воды (ОСВ). Было интересно проследить, как в дальнейшем менялась оводненность листьев. Как видно из рисунка 9, при повышении температуры воздуха, снижении
 | Рис. 9. Динамика относительного содержания воды (ОСВ) у листьев 7-сут растений пшеницы сорта Безенчукская-139 при засолении, охлаждении питательного раствора до 6 градусов, повышении температуры воздуха на 4 градуса. (n=5) |
температуры питательного раствора и обоих видов осмотического стресса (данные по полиэтиленгликолю не отличались от результатов на засолении), т.е. при всех испытанных воздействиях, вслед за снижением оводненности листа происходило ее восстановление, о чем свидетельствуют данные по ОСВ. Возрастание оводненности сопровождалось возобновлением роста во всех случаях, кроме охлаждения питательного раствора.
Поскольку водный потенциал питательного раствора оставался таким же при возобновлении роста, как и при его прекращении, низкий уровень притока воды должен был сохраняться на протяжении всего эксперимента, и восстановление водного баланса тканей скорее могло происходить за счет изменения скорости транспирации. Важно было проследить, как она менялась при возобновлении роста на фоне засоления и добавления ПЭГ.
В первые 15 мин после добавления ПЭГ в питательный раствор транспирация снижалась незначительно, и листья пшеницы и ячменя продолжали терять за счет транспирации столько же воды, как и до воздействия, что неизбежно должно было привести к снижению водного потенциала ксилемы и торможению роста, что мы и наблюдали (рис. 10).

Рис. 10. Влияние добавления в питательный раствор полиэтиленгликоля (А) и хлорида натрия (Б) до конечной концентрации 12 % и 100 мМ соответственно на транспирацию 7-дневных растений ячменя и пшеницы сорта Безенчукская-139. На графиках представлены средние значения (n=5) и их ошибки.
Однако затем транспирация снижалась. Очевидно, это происходило за счет закрытия устьиц, о чем говорят данные, полученные с помощью порометра (рис. 11). Снижение транспирации и устьичной проводимости при длительном действии засоления описано в литературе (Sohan et al, 1999). Но нами впервые показано, что это был быстрый эффект, который мог обеспечивать возобновление и поддержание роста при засолении и действии ПЭГ.
Еще одним аргументом в пользу значимости ограничения транспирации для восстановления роста растений при осмотическом стрессе были результаты сравнения степени ингибирования транспирации и восстановления роста у двух сортов ячменя, различающихся по реакции на засоление. Как видно из рисунка 12, у растений сорта Прерия степень восстановления роста после 30-

Рис. 11. Влияние добавления в питательный раствор полиэтиленгликоля (А) и хлорида натрия (Б) до конечной концентрации 12 % и 100 мМ соответственно на устьичную проводимость 7-сут растений ячменя сорта Golf и пшеницы сорта Безенчукская-139. На графиках представлены средние значения (n=5) и их ошибки.
минутной экспозиции на растворе NaCl была выше, чем у сорта Михайловский и соответственно именно у растений сорта Прерия в большей степени было выражено ингибирование транспирации (на 40 и 15 % по сравнению с исходным уровнем у растений сорта Прерия и Михайловский соответственно). Связь между степенью снижения транспирации и скоростью роста проявлялась и при более длительном действии засоления (данные приводятся в диссертации).

Рис. 12. Влияние засоления (добавления NaCl в питательный раствор до конечной концентрации 100 мМ) на рост первого листа (А) и транспирацию (Б) двух сортов ячменя (Прерия и Михайловский). На ростовом графике представлены средние значения и их ошибки из 5 независимых экспериментов. На графике с интенсивностью транспирации представлены средние значения (n=8) и их ошибки.
Таким образом, в начальный период действия засоления (первые часы и сутки после добавления NaCl в питательный раствор) именно восстановление и сохранение водного баланса в первую очередь определяло способность растений поддерживать рост на фоне дефицита воды.
6. Роль АБК в регуляции устьичной проводимости при возрастании дефицита воды
Важно было попытаться выяснить, как регулируется закрытие устьиц при снижении притока воды из корней. Определение содержания АБК в дифференцированной части листьев растений пшеницы и ячменя при воздействии ПЭГ и хлорида натрия показало возрастание уровня этого гормона, которое предшествовало закрытию устьиц (рис. 13)

Роль АБК в закрытии устьиц обсуждается в основном при длительном действии засоления (например, De Costa et al., 2007: через двое суток после начала действия засоления). При обсуждении быстрых ростовых реакций (восстановление роста вслед за его прекращением в начале действия засоления) не брали в расчет ни возможное закрытие устьиц, ни накопление АБК (Munns et al., 2000). В работе В.В. Талановой (2009) показано увеличение содержания АБК после двух часов действия засоления на растения огурца и обсуждается роль этого гормона в закрытии устьиц. В лаборатории проф. Шакировой накопление АБК при засолении обнаружено через несколько часов (Шакирова, Безрукова, 1998). В наших опытах мы зарегистрировали как накопление АБК, так и закрытие устьиц уже через несколько минут после начала действия засоления (рис. 13, Б). Для того, чтобы доказать, что при дегидратации АБК накапливается именно в области устьиц, мы использовали метод иммуногистохимической локализации (Sotta et al., 1985; Pastor et al., 1999; Веселов, 1998). Как видно из рисунка 14,

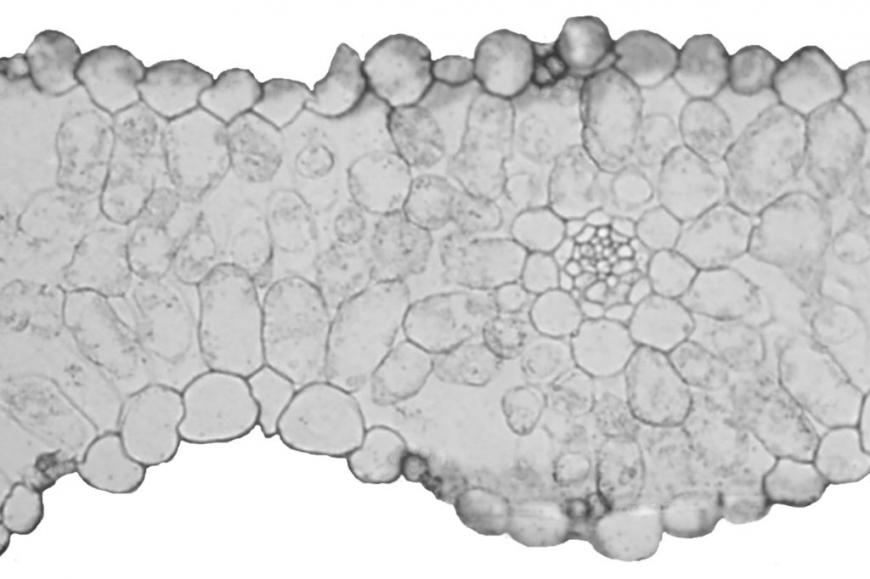

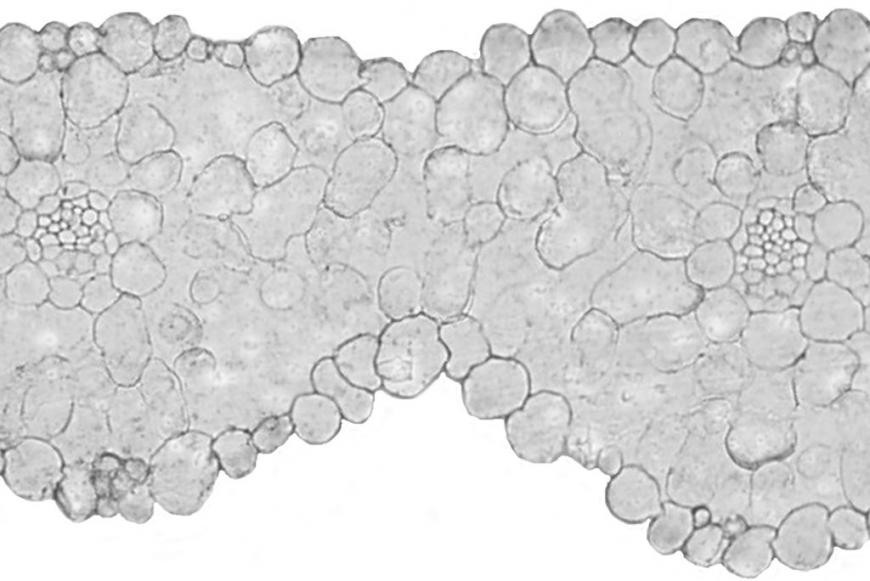
Рис. 14. Картина характерного распределения абсцизовой кислоты в клетках листа ячменя сорта Golf через 30 минут действия засоления, полученная с помощью метода иммунолокализации. А – опыт (срез листа растений, подвергнутых действию засоления), Б – опыт (срез, обработанный неиммунной сывороткой), В – контроль (срез листа контрольных растений), Г – контроль (срез, обработанный неиммунной сывороткой).
метод иммунолокализации выявил присутствие АБК в клетках мезофилла, обкладочных клетках сосудов и устьиц. Специфичность окрашивания подтверждается ее отсутствием при использовании неимунной сыворотки. В срезах листьев растений ячменя, фиксированных через 30 минут после добавления хлорида натрия в питательный раствор, зарегистрировано усиление окрашивания устьичных клеток. Таким образом, данные иммуногистохимического окрашивания свидетельствуют о том, что накопление АБК при засолении происходит именно в устьичных клетках, что должно обеспечивать их быстрое закрытие.
Выше упоминалось об обнаруженном нами различии между сортами ячменя по степени закрытия устьиц при засолении. Представляло интерес выяснить, каков был уровень накопления у них АБК. Как видно из рисунка 15,
 | Рис. 15. Влияние засоления (добавление NaCl в питательный раствор до конечной концентрации 100 мМ) на содержание АБК в листьях 7-сут растений двух сортов ячменя (Прерия и Михайловский) (n=4). |
растения сорта Прерия накапливали больше АБК по сравнению с растениями сорта Михайловский. Растения сорта Прерия также отличались более высокой устойчивостью ростовых процессов к действию засоления (данные приведены в диссертации). Таким образом, способность растений быстро накапливать АБК помогала им противостоять ростингибирующему действию засоления. Данные о роли накопления АБК при засолении довольно противоречивы. Некоторые исследователи, как и мы, обнаружили более высокий уровень накопления АБК у солеустойчивых растений (Moons et al., 1995; De Costa et al., 2007). Вместе с тем, были и сообщения об обратной зависимости. Так, было обнаружено (Cramer, Quarrie, 2002), что у нетранспирирующих растений кукурузы уровень накопления АБК в зоне роста листьев на фоне засоления был выше у менее устойчивых сортов. Эти результаты объясняли непосредственным ингибирующим действием АБК на удлинение клеток.
Необходимо отметить, что мы имели дело с транспирирующими растениями. Очевидно, в этих условиях на первый план выходила роль АБК как фактора, регулирующего восстановление водного баланса и оводненности тканей растений при засолении, что в свою очередь обеспечивало поддержание роста растяжением.
7. Источник быстрого накопления АБК при резком возрастании
дефицита воды
Где могла синтезироваться АБК при осмотическом стрессе? В литературе широко обсуждается сигнальная роль корневой АБК (Jackson, 1993; Davies et al., 2005). Однако в наших опытах мы не обнаружили увеличения притока АБК из засоленных корней растений ячменя (данные приводятся в диссертации). Оставалось предположить, что она синтезировалась в самом листе. В литературе обсуждается возможная роль листа в синтезе АБК при стрессе (Popova et al., 2000). Однако не известно, в какой части листа происходит ее синтез (Meinzer, 2000). Как видно из рисунка 16, наиболее высокий уровень накопления АБК был в зоне роста листа, как у растений ячменя, так и пшеницы.
Из литературы известно, что стимулом для синтеза АБК может быть уменьшение объема клеток. В наших экспериментах мы зарегистрировали сжатие листа при возрастании дефицита воды. Для того, чтобы проверить, в какой части листа происходит сжатие при потере тургора, мы провели замораживание и оттаивание равных по длине отрезков из зоны роста и дифференцированной зоны листа. При этом клетки разрушаются, что приводит к исчезновению тургорного давления на клеточную стенку (имитация падения тургора при возрастании дефицита воды) и может происходить их сжатие за счет эластичности клеточных стенок. Оказалось, что при этом длина уменьшается только у отрезков из зоны роста листа. Эти результаты свидетельствуют о том, что при потере тургора в результате возрастания дефицита воды сжимаются клетки зоны роста листа, и соответственно именно там должен происходить синтез АБК. Сравнение степени сжатия листа и уровня накопления АБК у растений пшеницы и ячменя показало, что лист сжимался в большей степени у растений ячменя сорта Гольф, у которых при осмотическом стрессе накапливается больше АБК (по
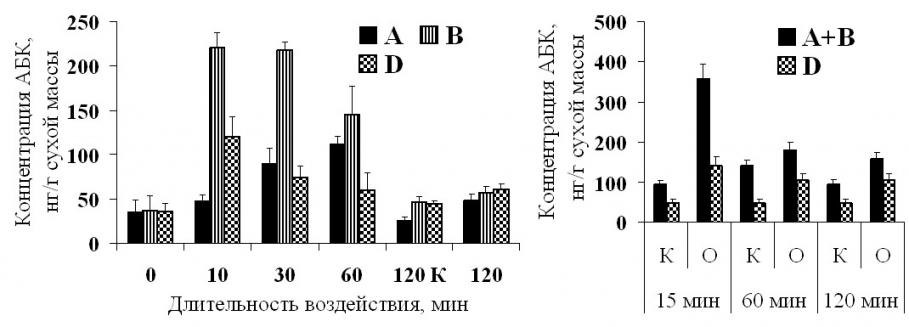
Рис. 16. Уровень содержания АБК в растущих (A, B), дифференцированной (D) зонах листьев и корнях растений ячменя сорта Golf (1) и пшеницы cорта Безенчукская-139 в фазе выхода третьего листа (2). На оси абсцисс представлено время действия засоления. На графиках представлены средние значения и их ошибки из 4 независимых экспериментов.
сравнению с контролем у растений ячменя содержание АБК в зоне роста листа возрастало в 5 раз, у а пшеницы – в 3 раза, рис. 16). Сравнение степени сжатия листа при действии засоления у пары сортов ячменя показало, что оно было выше у сорта Прерия, чем у Михайловского (рис. 13А). При этом уровень последующего накопления АБК был выше у сорта Прерия по сравнению с Михайловским (рис. 16). Таким образом, прослеживается четкая корреляция между уровнем сжатия листа и накоплением АБК при осмотическом стрессе: больше АБК накапливается у растений, у которых сильнее сжимается лист. Это указывает на то, что именно сжатие листа является стимулом для накопления АБК.
8. Роль цитокининов в регуляции устьичной проводимости при
возрастании дефицита воды
Наряду с ролью АБК выявлено также участие цитокининов в регуляции устьичной проводимости. Показано, что под влиянием соли кадмия происходит резкое снижение содержания цитокининов в листьях растений пшеницы как за счет уменьшения их притока из корней, так и распада цитокининов в самом побеге под влиянием фермента цитокининоксиды. В эксперименте in vitro показано, что ионы кадмия активируют цитокининоксидазу (с [315,2±11,0] до [450,0±18,3] пмоль/мг белка в час). Поскольку известно, что цитокинины поддерживают устьица открытыми (Davies et al., 2005), снижение их содержания в листьях способствует закрытию устьиц. Со временем содержание цитокининов в листьях восстанавливается параллельно с восстановлением транспирации (данные приводятся в диссертации). Тем не менее, снижение скорости транспирации сразу же после добавления в питательную среду токсичных ионов может способствовать уменьшению притока токсинных ионов в растения. Это предположение было трудно проверить из-за низкой концентрации кадмия, которая не позволяла оценить уровень его поглощения за такой короткий период (несколько часов).
9. Роль скорости транспирации в регуляции притока ионов натрия и хлора при действии засоления
В ряде опытов не удалось обнаружить зависимости накопления токсичных ионов от скорости транспирации. Так, засоление снижало транспирацию у растений чувствительного к нему вида Arabidopsis thaliana, в то время как она слабо снижалась у растений Thellungiella halophila (солеустойчивого родственного вида) (Volkov et al., 2003). Нам казалось логичным предположить, что у гликофитов роль транспирационного потока как фактора, определяющего скорость накопления токсичных ионов в растениях, может более явно проявляться в начале его действия на растения. Поэтому мы сосредоточили свое внимание на особенностях кратковременного действии засоления.
Выше упоминалось о различиях между сортами ячменя по скорости транспирации. Представляло интерес сопоставить скорость накопления в них ионов натрия и хлора. Как видно из рисунка 17, через 4 дня после начала действия засоления содержание ионов было выше у растений сорта Михайловский, по сравнению с Прерией. И именно у растений первого из них скорость транспирации при засолении снижалась в меньшей степени (рис. 20). Таким образом, здесь явно проявлялась связь между уровнем транспирации и накоплением токсичных ионов. Работа специализированных ионных каналов обеспечивает снижение поступления токсичных ионов в растения (Davenport, Tester, 2000; Essah et al., 2003; Davenport et al., 2003). Ряд исследователей отмечает, что при этом вода поступает в растения, а токсичные ионы остаются вне растения. Вместе с

Рис. 17. Концентрация (мМ) ионов хлора (А) и натрия (Б) в третьем листе 16-дневных растений ячменя сорта Михайловский и Прерия через 4 суток после добавления в питательный раствор NaCl до конечной концентрации 100 мМ. На графике представлены средние значения (n=6) и их ошибки.
тем поступление к поверхности корней с транспирационным потоком токсичных ионов обеспечивает возрастание их концентрации и создание градиента, поддерживающего их проникновение в растения по неселективным ионным каналам (Yeo, 1998). Эти данные литературы позволяют объяснить более высокий уровень накопления ионов натрия и хлора, который мы наблюдали у растений с относительно более высокой скоростью транспирации (у растений сорта Михайловский по сравнению с растениями сорта Прерия). Таким образом, в начале действия засоления снижение транспирации обеспечивало поддержание роста растений не только за счет восстановления оводненности тканей, необходимой для роста, но и за счет снижения притока токсичных ионов, которые могут отрицательно влиять на рост растений. Соответственно уровень накопления АБК положительно сказывается на поддержании роста растений на этой фазе действия засоления. Стимулируя закрытие устьиц, АБК не только поддерживает тем самым оводненность растений, но и уменьшает пассивное поступление токсичных ионов с транспирационным потоком.
10. Регуляция устьичной проводимости и роста растений при более длительном действии засоления
Из полученных нами результатов, которые были обсуждены в предыдущих разделах, очевидно благоприятное действие на растения снижения транспирации при осмотическом стрессе, вызванном действием ПЭГ и засолением. Вместе с тем, закрытие устьиц, которое лежит в основе этого эффекта, не может быть однозначно положительным процессом. Совершенно очевидно, что закрытие устьиц и нарушение газообмена снижает поступление в растения углекислого газа и тем самым подавляет фотосинтез. В наших опытах мы также наблюдали резкое снижение уровня фотоассимиляции углекислого газа при добавлении ПЭГ в питательный раствор растений кукурузы (рис. 18).
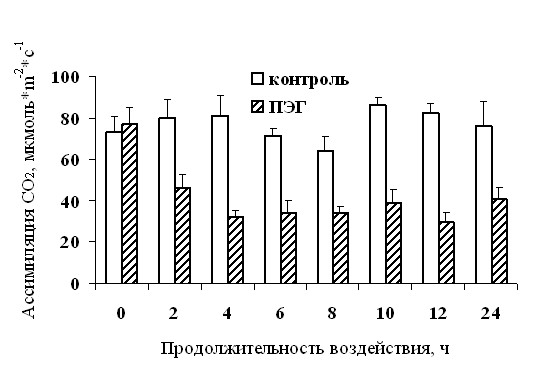 | Рис. 18. Влияние добавления в питательный раствор ПЭГ до концентрации 12 % на уровень ассимиляции углекислого газа у 7- сут растений кукурузы линии B73 (n=6). |
Закрытие устьиц может приводить и к другим отрицательным последствиям. Так, при длительном сохранении низкого уровня газообмена у растений начинается оксидативный стресс (Asada, 1999), что, в частности, проявляется в разрушении хлорофилла (Krieger-Liszkay, 2005).
Определение уровня содержания хлорофилла в наших опытах показало, что по сравнению с контролем на фоне длительного (девять суток) действия засоления оно сильнее снижалось у растений твердой пшеницы по сравнению с растениями ячменя (рис. 19). Это свидетельствует о том, что уровень повреждения фотосинтезирующих пигментов был выше у растений пшеницы. Важно было проверить, какая при этом у растений была устьичная проводимость.
 | Рис. 19. Содержание хлорофилла в листьях 16 суточных растений твердой пшеницы сорта Безенчукская-139 и ячменя сорта Golf после 9 суток их экспозиции на 100 мМ растворе NaCl (n=5). |
Как видно из рисунка 20, в процессе действия засоления сначала устьичная проводимость была выше у растений твердой пшеницы, а затем – у растений ячменя. При этом скорость роста оставалась более высокой у растений ячменя по сравнению с растениями пшеницы (рис. 1 и 2). Полученные нами данные
 | Рис. 20. Влияние 100 мМ хлорида натрия на устьичную проводимость 7-сут растений ячменя сорта Golf и пшеницы сорта Безенчукская-139 (n=8). |
свидетельствуют о том, что при длительном действии засоления способность растений поддерживать более высокую устьичную проводимость была характерна для более устойчивых растений. Это обеспечивало меньшее повреждение фотосинтетического аппарата и более высокий уровень фотосинтеза.
Такая же закономерность была обнаружена и у растений разных сортов ячменя (рис. 21). При более длительном действии засоления устьичная проводимость, которая сначала была выше у растений сорта Михайловский, затем стала более высокой у растений сорта Прерия (первый сорт отличался на засолении более низкой скоростью роста по сравнению со вторым).
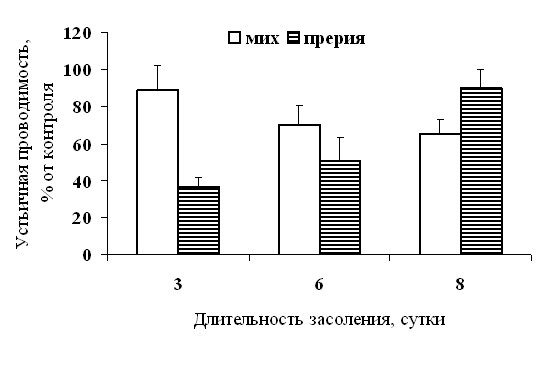 | Рис. 21. Динамика устьичной проводимости у растений ячменя сорта Михайловский (Мих) и Прерия после того, как в питательный раствор 7-сут растений добавили хлорид натрия до конечной концентрации 100 мМ (n=8). |
Важно то, что при более длительной экспозиции на засолении, как и в начале его действия, удается выявить связь между уровнем накопления АБК и устьичной проводимостью растений. Сначала засоление вызывало более резкое накопление АБК у растений сорта Прерия (рис. 15) и соответственно у них сильнее снижалась устьичная проводимость (рис. 21). При более продолжительном действии засоления устьичная проводимость была снова выше у растений с более низким уровнем АБК, но это были уже не растения сорта Михайловский, а Прерии: у растений сорта Прерия содержание АБК в листьях, как и устьичная проводимость были ближе к контролю, в то время как уровень АБК резко возрастал у растений сорта Михайловский, а их устьичная проводимость падала по сравнению с контролем (рис. 22). При этом оводненность тканей была выше у растений сорта Прерия (97 и 92 % от уровня контроля у растений Прерии и Михайловского соответственно), и они накапливали меньше токсичных ионов. Очевидно, при более длительном действии засоления поддержание притока воды и предотвращение притока токсичных ионов достигалось не за счет снижения транспирации, а другими путями (изменение архитектуры корней, способствующее повышению их поглотительной способности, формирование
 | Рис. 22. Содержание АБК в 15-сут растениях ячменя сорта Михайловский и Прерия через 8 суток после добавления NaCl в питательный раствор до конечной концентрации 100 мМ (n=9). |
барьеров на пути токсичных ионов в виде поясков Каспари, изменение уровня экспрессии генов селективных каналов, обеспечивающих поддержание ионного гомеостаза). То, что растения сорта Прерия сохраняли более высокий уровень ОСВ при длительной экспозиции на 100 мМ NаCl, несмотря на то, что теряли больше воды с транспирацией, возвращает нас к вопросу о роли притока воды из корней в поддержании роста и водного баланса.
11. Регуляция гидравлической проводимости при возрастании
дефицита воды в растениях
При повышении температуры воздуха транспирация растений пшеницы сорта Безенчукска-139 возрастала в 3 раза по сравнению с исходным уровнем и оставалась высокой на протяжении всего эксперимента (данные приведены в диссертации), что сначала приводило к снижению ОСВ и прекращению роста (рис. 1), но затем оводненность тканей и рост растяжением (рис. 10) полностью восстанавливались. Измерение гидравлической проводимости корней показало, что она возрастала при повышении температуры воздуха (598±86 и 1608±176 мг*ч-1*г-1*МПа-1 при исходной и после 30 минут экспозиции соответственно). Результаты свидетельствуют о том, что есть еще один способ поддержания оводненности и скорости роста при возрастании дефицита воды: изменение притока воды из корней за счет снижения гидравлического сопротивления.
Определение гидравлической проводимости в корнях обусловлено тем, что именно здесь сосредоточена, по данным литературы, область наиболее высокого сопротивления току воды, что связано с присутствием поясков Каспари и большого количества мелких клеток на пути воды по коре и через клетки обкладки ксилемных сосудов (Steudle, Peterson, 1998).
Повышение гидравлической проводимости у растений Безенчукской-139 происходило на фоне накопления АБК в корнях (рис. 23). Поскольку известна способность АБК увеличивать гидравлическую проводимость (Hose et al., 2000), накопление АБК в корнях может способствовать повышению их способности проводить воду.
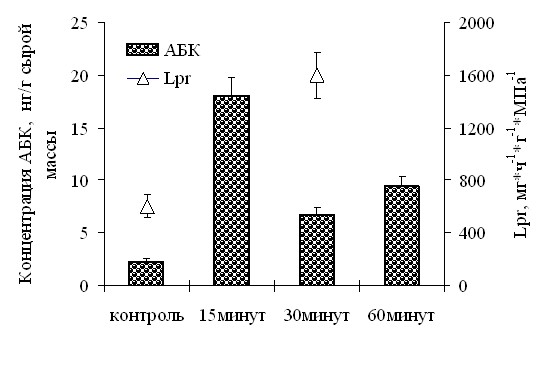 | Рис. 23. Содержание АБК и гидравлическая проводимость (Lpr) в корнях 7-сут растений пшеницы сорта Безенчукская-139 до (контроль) и 30 мин после (опыт) повышения температуры воздуха на 40 С. (n=4) |
Снижение гидравлической проводимости было причиной торможения роста при охлаждении корней. Результаты, полученные при обоих температурных воздействиях (повышения температуры воздуха на 40 С и снижение температуры питательного раствора до 60 С), свидетельствуют о важной роли изменений гидравлической проводимости в регуляции оводненности и роста растений. Представляло интерес выяснить, как менялась гидравлическая проводимость при действии на растения засоления.
Поскольку при определении гидравлической проводимости отключение «верхнего концевого двигателя» резко снижает транспирацию, было практически не возможно измерить ее на фоне 100мМ NaCl. Поэтому в этих экспериментах концентрацию хлорида натрия повышали ежедневно на 25 мМ. Под влиянием засоления гидравлическая проводимость снижалась, что было не так просто понять, поскольку при добавлении соли в питательный раствор у растений и так возникали проблемы с поглощением воды. Сравнение этого показателя у двух линий ячменя показало, что сильнее гидравлическая проводимость снижалась у растений линии 20-45 (в 2 раза по сравнению с контролем, в то время как у растений Т1 – на 20 %). И именно растения, которые снижали гидравлическую проводимость в большей степени, отличались более высокой солеустойчивостью (данные по влиянию длительной экспозиции на растворе NaCl на рост этих двух линий растений приведены в диссертации). Снижение гидравлической проводимости при дефиците воды описано в литературе (Aroca et al., 2005). Считается, что таким образом клетки корней защищаются от обезвоживания. Мы также обнаружили, что у растений линии 20-45 содержание воды в корнях при засолении снижалась в меньшей степени, чем у линии Т1 (табл. 2).
Таблица. 2
Показатели водного обмена у 7-сут растений ячменя линии 20-45 и Т-1 через 3 часа экспозиции растений на 25 мМ NaCl. Представлены средние значения и их ошибки (n=5)
| Показатели | Т1 | 20-45 | ||
| Контроль | NaCl | Контроль | NaCl | |
| Содержание воды в корнях (%) | 92.8+0.4 | 89.8+0.8* | 92.6+0.5 | 91.9+0.7 |
| ОСВ в побеге (%) | 92.7±0.8 | 89.7±1* | 92±0.7 | 89±0.5** |
* Различия между контролем и опытом достоверны (t-test, P<0.05)
** Различия между контролем и опытом достоверны (t-test, P<0.01)
Выявлен еще один положительный результат снижения гидравлической проводимости – это закрытие устьиц и снижение транспирационного потока, с которым в растение попадают токсичные ионы. Оно также было сильнее выражено у растений 20-45 (транспирация снижалась на 20 % у растений линии 20-45 и на 5 % у растений линии Т1). Само по себе добавление небольшого количества соли было слабым сигналом, но снижение гидравлической проводимости его усилило и привело к большему закрытию устьиц.
Каким образом у растений может снижаться гидравлическая проводимость? Открытие у растений белков водных каналов аквапоринов и кодирующих их генов позволяет ответить на этот вопрос (Maurel, 1997). Мы изучили экспрессию гена аквапорина PIP2;4 в корнях растений. Оказалось, что она снижалась в большей степени у растений 20-45 (рис. 24). Таким образом, показана роль аквапоринов в регуляции гидравлической проводимости. Сравнительные данные для разных генотипов растений ячменя получены впервые.
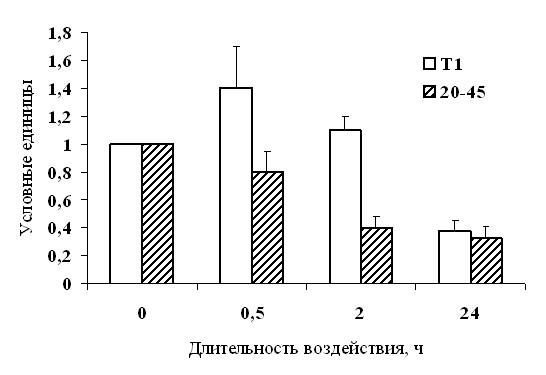 | Рис. 24. Динамика экспрессии гена аквапорина PIP2;4 (экспрессия представлена по отношению к необработанному контролю) у 7-сут растений ячменя линии 20-45 и Т-1 при засолении (n=5). |
Роль аквапоринов в регуляции суммарной гидравлической проводимости дискутируется (Aharon et al., 2003). Наряду с данными, свидетельствующими о роли аквапоринов в регуляции тока воды по растению (Vandeleur et al., 2005), встречается и критика в адрес данной точки зрения (Hill et al., 2004), которая опирается на отсутствие корреляции между гидравлической проводимостью и активностью генов аквапоринов, обнаруженной в некоторых экспериментах. Из-за композитного характера транспорта воды (Steudle, Peterson, 1998), когда часть ее идет не через мембраны, а по апопласту, роль мембранного транспорта и участие в нем аквапоринов может маскироваться. Наши данные, полученные с использованием растений ячменя, для которых характерен высокий уровень использования мембранного пути транспорта воды (Steudle, Jescke, 1983), представляют интерес, поскольку они указывают на роль аквапоринов в регуляции гидравлической проводимости при засолении и значение транскрипционного уровня в контроле активности аквапоринов.
12. Экспрессия генов аквапоринов у растений кукурузы при
осмотическом стрессе
То, что нам удалось выявить связь между уровнем экспрессии одного из генов аквапоринов и гидравлической проводимостью можно считать большой удачей, поскольку аквапорины представлены целым семейством генов (Chaumont et al., 2001). Удачный выбор гена был основан на данных литературы о повышении именно его экспрессии при засолении у растений кукурузы (Zhu et al., 2005). Дальнейшая работа проводилась с полным набором генов аквапоринов клеточных мембран (ZmPIP генов) растений кукурузы. В нашем распоряжении также были антитела к нескольким аквапоринам, что позволило оценить не только уровень экспрессии генов, но и содержание их продукта с помощью метода Вестерн-Блоттинга (данные приведены в диссертации). Было изучено влияние на растения добавления ПЭГ в питательный раствор. Выбор кукурузы был обусловлен тем, что аквапорины наиболее хорошо изучены у растений этого вида (Chaumont et al., 2001).
В отличие от растений ячменя у растений кукурузы было обнаружено не снижение, а повышение уровня экспрессии нескольких генов аквапоринов в ответ на ПЭГ (рис. 25). Это можно объяснить различиями в транспорте воды у растений ячменя и кукурузы. У растений ячменя доминирует транспорт через мембраны клеток, и гидравлическая проводимость определяется активностью аквапоринов (Steudlе, Jescke, 1983). У кукурузы в норме доминирует транспорт по межклетникам, который отличается более высокой проводимостью (Steudle, Peterson, 1998). Поэтому закрытие устьиц и уменьшение доли пути по межклетникам автоматически приводит к снижению гидравлической проводимости у растений кукурузы (Steudle, 2000). Соответственно у растений этого вида повышение количества аквапоринов может способствовать поддержанию транспирационного потока.
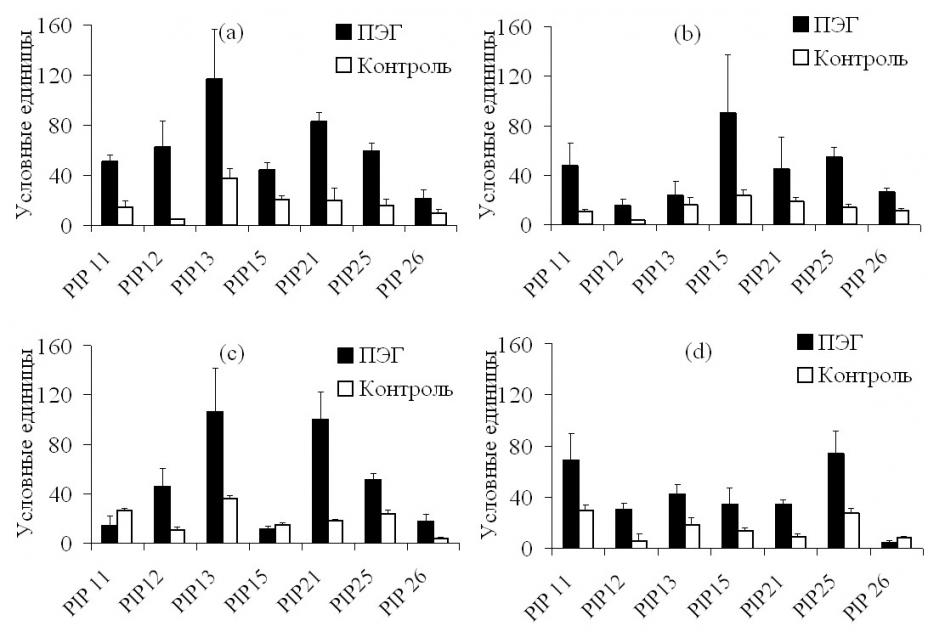
Рис. 25. Уровень транскрипции PIP генов аквапоринов в корнях кукурузы 7-сут растений кукурузы линии B73 при температуре воздуха 230 С (а, b) и 280 С (c, d) спустя 2 (а, c) и 8 (b, d) часов после добавления ПЭГ в питательный раствор до конечной концентрации 12 %. Приведены средние значения и их ошибки (n=4).
***
Таким образом, нами впервые показано, насколько быстро растения реагируют на воздействия, нарушающие водный обмен и рост клеток растяжением. Обнаружено поразительное разнообразие реакций растений, направленных на восстановление оводненности тканей и поддержание роста растяжением, при разных воздействиях. Так, при осмотическом стрессе возобновление роста растяжением связано с быстрым закрытием устьиц и возрастанием растяжимости листа, а в дальнейшем поддержанию роста способствует осмотическое приспособление. При изменении температуры выявлен иной механизм регуляции оводненности тканей и роста растяжением – это изменение гидравлической проводимости и притока воды из корней, в котором важную роль играет экспрессия аквапоринов. Но при всем разнообразии ответных реакций в их запуске участвует гормональная система. Закрытие устьиц индуцируется как быстрым накоплением АБК в листьях, так и снижением содержания в них цитокининов. Повышение растяжимости листа связано с накоплением ауксинов в зоне роста листа и возрастанием экспрессии генов экспансинов, а снижение гидравлического сопротивления – с притоком АБК в корни и увеличением уровня аквапоринов в мембранах. Быстрый запуск процессов, обеспечивающих поддержание роста листьев растяжением в изменяющихся внешних условиях, является важной адаптивной реакцией, направленной на формирование фотоассимилирующей поверхности и обеспечение жизнеспособности растений.
Рис. 26. Схема работы механизмов, участвующих в возобновлении роста и оводненности растений при осмотических и температурных воздействиях.
Выводы
1. Выявлен двухфазный характер ответной реакции злаковых растений на быстрое нарастание дефицита воды: за резким ингибированием роста листьев растяжением следует фаза восстановления данной функции.
2. В зависимости от характера воздействия и вида растений в возобновлении роста и его дальнейшем поддержании участвуют различные механизмы:
(а) быстрое закрытие устьиц приводит к восстановлению водного баланса и повышению уровня обеспеченности листьев водой, достаточного для роста клеток растяжением при осмотическом стрессе;
(б) повышение гидравлической проводимости тканей растений увеличивает приток воды в листья при возрастании температуры воздуха в условиях высокой устьичной проводимости;
(в) увеличение растяжимости клеточных стенок способствует поддержанию роста листа у растений пшеницы, ячменя и кукурузы при осмотическом стрессе, вызванном действием нейтрального осмолита (ПЭГ). При засолении растяжимость клеточной стенки увеличивается только у растений ячменя;
(г) активное накопление осмолитов в клетках листа (осмотическое регулирование) происходит уже после возобновления роста растяжением и, следовательно, не является механизмом, от которого зависит возобновление роста. Положительное влияние осмотической регуляции на рост растяжением проявляется при более длительном действии дефицита воды.
3. Выбор между альтернативными механизмами поддержания водного баланса и роста клеток растяжением зависит от уровня абсцизовой кислоты и места ее накопления в растении: увеличение содержания гормона в листьях обеспечивает быстрое закрытие устьиц, а в корнях - способствует повышению гидравлической проводимости и притока воды из корней. Сигналом для накопления АБК при возрастании дефицита воды может быть сжатие клеток зоны роста листа.
4. В отличие от более солеустойчивых растений ячменя, у растений твердой пшеницы быстрое увеличение растяжимости листьев происходит только при действии ПЭГ, но не при засолении, что является ранним проявлением ион-специфического действия засоления на рост чувствительных к засолению растений.
5. Повышение растяжимости листьев происходит на фоне накопления ауксинов и повышения экспрессии гена альфа EXPA1, что указывает на важную роль экспансина и ИУК в регуляции быстрой ростовой реакции растений на возрастание дефицита воды.
6. Снижение устьичной проводимости в начале действия засоления не только поддерживает рост, но и является механизмом ограничения поступления токсичных ионов в растения с транспирационным потоком. Снижение устьичной проводимости и транспирации у растений ячменя связано с уменьшением уровня экспрессии гена аквапорина HvPIP2;4.
7. В отличие от кратковременного засоления, при котором закрытие устьиц сильнее выражено у более устойчивых к нему растений, при его более длительном действии, напротив, солеустойчивые растения способны поддерживать относительно высокую устьичную проводимость, что обеспечивает газообмен и фотосинтез.
8. В отличие от растений ячменя у растений кукурузы происходит повышение уровня экспрессии генов аквапоринов в корнях при осмотическом стрессе, что необходимо для поддержания транспирационного потока у растений данного вида, у которых закрытие устьиц приводит к переключению транспорта воды с апопластного пути на мембранный, отличающийся высоким гидравлическим сопротивлением.
Список основных работ, опубликованных по теме диссертации
Монографии
- Веселов Д.С., Веселов С.Ю., Высоцкая Л.Б., Кудоярова Г.Р., Фархутдинов Р.Г. Гормоны растений. Регуляция концентрации и связь с ростом и водным обменом. М.: Наука. - 2007. - 157 с.
Статьи в научных журналах, рекомендованных ВАК РФ
для защиты докторских диссертаций
- Веселов Д.С., Фахрисламов Р.Г. Влияние кадмия на поглощение ионов, транспирацию и содержание цитокининов в проростках пшеницы // Агрохимия. - 1999. - № 10. - С. 420-426.
- Veselov D.S., Mustafina A.R., Sabirjanova I.B., Akhiyarova G.R., Dedov A.V., Veselov S.U., Kudoyarova G.R. Effect of PEG-treatment on the leaf growth response and auxin content in shoots of wheat seedlings // Plant Growth Regulation. – 2002. - V. 38(2). - P. 191-194.
- Веселов Д.С., Сабиржанова И., Ахиярова Г., Веселова С.В., Фархутдинов Р.Г., Мустафина А.Р., Митриченко А.Н., Дедов А.В., Веселов С.Ю., Кудоярова Г.Р. Роль гормонов в быстром ростовом ответе растений пшеницы на осмотический и холодовой шок // Физиология растений. - 2002. - Т. 49. - С. 572-576.
- Фархутдинов Р., Веселова С., Веселов Д.С., Митриченко А., Дедов А., Кудоярова Г.Р. Регуляция скорости роста листьев пшеницы при быстром повышении температуры // Физиология растений. -2003. - Т.50. - №2. - С. 275-279.
- Fricke W., Akhiyarova G., Veselov D., Kudoyarova G. Rapid and tissue-specific changes in ABA and in growth rate in response to salinity in barley leaves // Journal of Experimental Botany. - 2004. - V. 55. - P. 1115-1123.
- Ахиярова Г.Р., Сабиржанова И.Б., Веселов Д.С., Фрике В. Участие гормонов в возобновлении роста побегов пшеницы при кратковременном натрий – хлоридном засолении // Физиология растений. – 2005. - Т. 52. - № 6. – С. 891-896.
- Veselova S.V., Farhutdinov R.G., Veselov S.Yu., Kudoyarova G.R., Veselov D.S., Hartung W. The effect of root cooling on hormone content, leaf conductance and root hydraulic conductivity of durum wheat seedlings (Triticum durum L.) // Journal of Plant Physiology. – 2005. - V. 162. – P. 21–26.
- Sabirzhanova I.B., Sabirzhanov B.E., Chemeris A.V., Veselov D.S., Kudoyarova G.R. Fast changes in expression of expansin gene and leaf extensibility in osmotically stressed maize plants // Plant Physiology and Biochemistry. – 2005. – V. 43. – P. 419-422.
- Ахиярова Г.Р., Фрике В., Веселов Д.С., Кудоярова Г.Р., Веселов С.Ю. Накопление и распределение АБК в тканях листа и устьичная проводимость при водном стрессе, индуцированном засолением // Цитология. - 2006. - Т. 48. - № 11. - С. 918-923.
- Веселова С.В., Фархутдинов Р.Г., Веселов Д.С., Кудоярова Г.Р. Роль цитокининов в регуляции устьичной проводимости проростков пшеницы при быстром локальном изменении температуры // Физиология растений. - 2006. - Т. 53. - № 6. - С. 857-862.
- Fricke W., Akhiyarova G., Wei W., Alexandersson E., Miller A., Kjellbom P-O., Richardson A., Wojciechowski T., Schreiber L., Veselov D., Kudoyarova G., Volkov V. The short-term growth response to salt of the developing barley leaf // Journal of Experimental Botany. – 2006. – V. 57. P. 1079 - 1095.
- Иванов Е.А., Фархутдинов Р.Г., Веселов Д.С., Золотов А.Л., Никонов В.И., Трапезников В.К., Фаизов Р.Г., Кудоярова Г.Р. Реакция устьиц растений разных сортов яровой мягкой пшеницы на увеличение дефицита воды в воздухе как диагностический признак в селекции на засухоустойчивость // Сельскохозяйственная биология. - 2007. - № 1. - C. 72-77.
- Кудоярова Г.Р., Веселов Д.С., Фаизов Р.Г., Веселова С.В., Иванов Е.А., Фархутдинов Р.Г. Реакция устьиц на изменение температуры и влажности воздуха у растений разных сортов пшеницы, районированных в контрастных климатических условиях // Физиология растений. - 2007. - Т. 54. - № 1. - C. 54-58.
- Веселов Д.С., Шарипова Г.В., Кудоярова Г.Р. Сравнительное изучение реакции растений ячменя (Hordeum vulgare) и пшеницы (Triticum durum) на кратковременное и длительное действие натрий хлоридного засоления // Агрохимия. - 2007. - № 7. - С. 41-48.
- Веселов Д.С., Маркова И.В., Кудоярова Г.Р. Реакция растений на засоление и формирование солеустойчивости // Успехи современной биологии. - 2007. - Т. 127. - № 5. - С. 482-493.
- Веселов Д.С., Сабиржанова И.Б., Сабиржанов Б.Е., Чемерис А.В. Изменения эспрессии гена экспансина, содержания ИУК и скорости растяжения клеток листа растений кукурузы при засолении // Физиология растений. - 2008. - Т. 55. - № 1. – С. 108-113.
- Шарипова Г.В., Веселов Д.С. Влияние NaCl засоления на реакции сортов ячменя, различающихся по засухоустойчивости // Агрохимия. - 2008. - №10. – С. 18-26.
- Veselov D.S., Sharipova G.V., Veselov S.U., Kudoyarova G.R. The effects of NaCl treatment on water relations, growth and ABA content in barley cultivars differing in drought tolerance // Journal of Plant Growth Regulation. - 2008. - V.27. - P.380-386.
- Veselov D.S., Sharipova G.V., Akhiyarova G.R., Kudoyarova G.R. Fast growth responses of b arley and durum wheat plants to NaCl- and PEG-treatment: resolving the relative contributions of water deficiency and ion toxicity // Plant Growth Regulation. - 2009. - V. 58. - P. 125-129.
Статьи в крупных региональных изданиях и сборниках трудов
- Mustafina A.R., Kudoyarova G.R., Veselov D.S., Veselov S.Yu. Hormonal and growth response of wheat seedlings on PEG-induced water stress // Proceedings of the 5-th Symposium of the International Society of Root Research. / Kluwer Acad. Publ.: Dorecht. - 1998. - P.619-625.
- Веселов Д.С., Мустафина А.Р. Быстрый ответ побегов проростков пшеницы на кратковременное действие полиэтиленгликоля // В сб.: Биологические науки в высшей школе. Проблемы и решения. / Материалы Всероссийской научно-практической конференции. - 1998. - С.45-47.
- Сабиржанова И.Б., Мустафина А.Р., Веселов Д.С., Дедов А.В., Кудоярова Г.Р., Веселов С.Ю. Быстрые изменения концентрации цитокининов в побегах, корнях и ксилемном соке проростков пшеницы после добавления полиэтиленгликоля в питательную среду // Материалы конф. «Иммуноанализ регуляторов роста в решении проблем физиологии растений, растениеводства и биотехнологии». – Уфа, 2000. - С. 101-106.
- Митриченко А.Н., Веселова С.В., Иванов Е.А., Веселов Д.С., Дедов А.В., Фархутдинов Р.Г. Влияние повышения температуры воздуха на рост, содержание гормонов и водный режим проростков пшеницы // Материалы конф. «Иммуноанализ регуляторов роста в решении проблем физиологии растений, растениеводства и биотехнологии». – Уфа, 2000. - С. 122-126.
- Kudoyarova G., Veselov D., Symonyan M., Mustafina A., Dedov A., Vysotskaya L., Veselov S. Fast shoot responses to root treatment. Are hormones involved? // Recent Advances of Plant Root Structure and Function / Еds. Gasparikova O., Ciamporova M., Mistrik I., Baluska F. Dordreht: Kluwer. - 2001. - P.135141.
- Veselov D. Kudoyarova G., Symonyan M., Veselov S. Effect of cadmium on ion uptake, transpiration and cytokinin content in wheat seedlings // Bulgarien Journal Plant Physiology. - 2003. - SI. – P. 353-359.
- Веселов Д.С., Симонян М.В., Архипова Т.Н., Веселов С.Ю. Влияние ионов кадмия на содержание цитокининов и активность цитокининоксидазы в растениях пшеницы // Башкирский государственный университет. Итоги биологических исследований. - 2004. - Т. 7. - С. 145-152.
- Иванов Е.А., Фархутдинов Р.Г., Веселов Д.С., Золотов А.Л., Никонов В.И., Трапезников В.К., Веселов С.Ю., Кудоярова Г.Р. Реакция устьиц растений разных сортов пшеницы на увеличение транспирационного запроса как диагностический признак в селекции на засухоустойчивость // Вестник Башкирского университета. - 2005. - №1. – C. 65-68.
- Веселов Д.С., Высоцкая Л.Б. Значение изменения экспрессии генов экспансинов и аквапоринов для поддержания роста и оводненности растений кукурузы и ячменя при осмотическом стрессе // Материалы конф. «Современная физиология растений: от молекул до экосистем». – Сыктывкар, 2007. - С. 176-178.
- Шарипова Г.В., Веселов Д.С. Сравнение чувствительности водного обмена и роста растений ячменя и пшеницы к натрий-хлоридному засолению // Материалы конф. «Современная физиология растений: от молекул до экосистем». - Сыктывкар, 2007. - С. 66-67.
- Шарипова Г.В., Веселов Д.С., Чернов В.Е., Пендинен Г.И. Кудоярова Г.Р. Ростовая реакция на засоление у растений разных сортов ячменя и ее связь с соотношением массы побег/корень и характером изменения транспирации // Материалы конф. «Современная физиология растений: от молекул до экосистем». – Сыктывкар, 2007. - С. 427-429.
- Веселов Д.С., Шамонт Ф. Изменение экспрессии генов аквапоринов и адаптация растений кукурузы к дефициту воды // Материалы конф. «Биомика - наука ХХI века». – Уфа, 2007. - С. 21-23.
Патенты:
1. Фархутдинов Р.Г., Кудоярова Г.Р., Веселов Д.С., Веселова С.В., Фаизов Р.Г. Способ диагностики засухоустойчивости и продуктивности злаковых сельскохозяйственных культур: Пат. 2339215, РФ // Б.И. 2008. № 33. С. 2.
Список сокращений:
АБК – абсцизовая кислота
ПЭГ – полиэтиленгликоль
ОСВ – относительное содержание воды
ИУК – индолилуксусная кислота

