Кандидоз кишечника у пациентов с гастроинтестинальной патологией (особенности патогенеза, диагностика, лечение, профилактика)
На правах рукописи
АВАЛУЕВА
Елена Борисовна
КАНДИДОЗ КИШЕЧНИКА У ПАЦИЕНТОВ С
ГАСТРОИНТЕСТИНАЛЬНОЙ ПАТОЛОГИЕЙ
(ОСОБЕННОСТИ ПАТОГЕНЕЗА, ДИАГНОСТИКА,
ЛЕЧЕНИЕ, ПРОФИЛАКТИКА)
14.01.28 – гастроэнтерология
03.02.12 – микология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
доктора медицинских наук
Санкт-Петербург – 2010
Работа выполнена на кафедре пропедевтики внутренних болезней с курсами нутрициологии и клинического питания ФПК Государственного образовательного учреждения высшего профессионального образования «Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова Федерального агентства по здравоохранению и социальному развитию».
Научные консультанты:
доктор медицинских наук, профессор Успенский Юрий Павлович
доктор медицинских наук Шевяков Михаил Александрович
Официальные оппоненты:
доктор медицинских наук, профессор Радченко Валерий Григорьевич
доктор медицинских наук, профессор Гордиенко Александр Волеславович
доктор медицинских наук Соболев Алексей Владимирович
Ведущая организация ГОУ ВПО «Московская медицинская академия им. И.М. Сеченова» Росздрава
Защита состоится «23» декабря 2010 г. в ___ час. на заседании диссертационного совета Д 208.086.01 при Государственном образовательном учреждении высшего профессионального образования «Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова Федерального агентства по здравоохранению и социальному развитию» (195067, Санкт-Петербург, Пискаревский проспект, д.47).
С диссертацией можно ознакомиться в библиотеке Государственного образовательного учреждения высшего профессионального образования «Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова Федерального агентства по здравоохранению и социальному развитию» (195067, Санкт-Петербург, Пискаревский проспект, д.47).
Автореферат разослан «____»____________________________2010
Ученый секретарь
диссертационного совета
доктор медицинских наук, профессор Успенский Ю. П.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Заболевания органов пищеварения, такие как язвенная болезнь, хронический гастродуоденит, воспалительные заболевания кишечника (язвенный колит, болезнь Крона) широко распространены и имеют не только клиническую, но и социальную значимость. Ими чаще болеют лица молодого, наиболее трудоспособного возраста (средний возраст заболевших 20-40 лет), что обусловливает большое количество случаев трудопотерь. Характерными особенностями являются непредсказуемость периодов обострения, частое прогрессирование, возникновение различных осложнений во время течения болезни (Барановский А.Ю., 2001, Белоусова Е.А., 2002, Ткаченко Е.И., 2003, Malfertheiner P., 2007).
При язвенной болезни, хроническом гастродуодените, воспалительных заболеваниях кишечника (ВЗК) важным фактором патогенеза является интестинальная флора. Комплексные взаимоотношения между генетическими, микробными факторами, факторами окружающей среды являются значимыми в возникновении и течении патологического процесса (Ткаченко Е.И., 2004, Барановский А.Ю., 2007, Shanahan F., 2001, Endo K., 2009). Признание важной роли кишечной микрофлоры в регуляции метаболических процессов организма и физиологических функций, в том числе барьерных, является одним из основных представлений, сформулированных в последние десятилетия (Шендеров Б.А., 1998). В настоящее время доказано, что изменения в составе нормальной кишечной микрофлоры ухудшают течение основного заболевания, способствуют более частым рецидивам и развитию осложнений (Linskens et al. 2001, Успенский Ю.П., 2004, Chichlowski M., Hale L. P., 2008, Sokol H., 2006, Seksik P., 2006).
Однако, роль микрофлоры желудочно-кишечного тракта в патоморфозе различных гастроинтестинальных заболеваний, несмотря на позитивные результаты, достигнутые в понимании ряда важных этиопатогенических механизмов, изучена не полностью (Guarner F., 2006, Zwolinska-Wsislo M., 2009). Малоизученными являются вопросы о роли грибов - представителей оппортунистической флоры в составе гастроинтестинального микробиоценоза, способных проявлять свои патогенные свойства только при определенных условиях (Шевяков М.А., 2007).
Гастроинтестинальный кандидоз стал активно исследоваться в последние 10-15 лет и фундаментальные работы в данной области пока имеют единичный характер (Шевяков М.А., 2000). Клинически феномен роста грибов в кишечнике – кандидоз кишечника, шифр по МКБ Х: В37.8. - может представлять собой либо носительство, либо неинвазивный микотический процесс, либо инвазивный кандидоз, причем иногда эти отдельные клинические формы суть есть соответствующие этапы развития кандидозной инфекции (Хмельницкий О.К., 1996, Шевяков М.А., Авалуева Е.Б., 2007). Варианты существования кандидоза кишечника, определяемые особенностями иммунобиологического конфликта в просвете органов пищеварительного тракта и состоянием желудочно-кишечного микробиоценоза, индивидуальны и вариабельны (Хмельницкий О.К., 1996).
За последние годы прогрессивно увеличивается число случаев микотических поражений, связанных с избыточной пролиферацией грибов рода Candida в результате применения современных медикаментозных вмешательств, прежде всего, антибактериальной и гормональной терапии. Характер развития таких «терапевтических инфекций» (Ткаченко Е.И., 1999) предугадать очень сложно. Используемые схемы лечения гастродуоденитов, ассоциированных с Helicobacter pylori (H. pylori), как и схемы лечения язвенной болезни, предусматривают назначение антибактериальных препаратов и их комбинаций (Malfertheiner P. et al, 2007). Представления о том, что степень обсемененности антрального отдела желудка H. pylori прямо пропорциональна содержанию дрожжевых грибов в кишечнике (Гриневич В.Б., Успенский Ю.П., 2004), позволяют предположить, что при проведении антибактериальной терапии создаются условия для более интенсивного распространения кандидоза на всем протяжении пищеварительного тракта. Для лечения ВЗК в схемах базисной терапии используются препараты глюкокортикостероидных гормонов (ГКС) и цитостатики (Адлер Г., 2001, Белоусова Е.А., 2007, Воробьев Г.И., 2008, Sartor R.B., 2004, Perencevich M., Burakoff R., 2006). Неизбежным исходом длительного применения ГКС, назначаемых для индукции ремиссии заболевания, является увеличение пролиферации дрожжевых микромицетов, в первую очередь, в пищеварительном тракте (Авалуева Е.Б., 2010). При этом поддержание уровня Candida spp. происходит через персистенцию микроорганизма вследствие ятрогенного воздействия. В результате изменения микробных взаимодействий возникает эффект «quorum sensing» (Hentzer M., Givskov M., 2003) грибов рода Candida и дальнейшее ступенчатое углубление нарушений в системе резистентности макроорганизма (Шевяков М.А., 2007) – «терапевтическая инфекция» манифестирует. В условиях пролонгированного действия факторов риска (антибактериальной и глюкокортикоидной терапии, сопутствующей патологии), негативные последствия возникновения такой инфекции велики.
При этом малоизвестным остается ответ на вопрос - каким образом реализуется патогенный потенциал грибов рода Candida при гастроинтестинальной патологии. Данные литературы, особенно экспериментальные, достаточно противоречивы. Характер изменений композиции микрофлоры толстой кишки, сопутствующий избыточной пролиферации грибов рода Candida в кишечнике, взаимодействие дрожжевых микромицетов с гастроинтестинальной слизистой не изучены в полной мере, механизмы инвазии и системной диссеминации не идентифицированы (Kennedy M.J., 1987, Cole G. T. 1998, Успенский Ю.П., 2004). Важно и то, что в не экспериментальных моделях свойства различных видов Candida spp. изучены недостаточно, в том числе, адгезивные свойства, определяющие патогенность дрожжевых микромицетов и возможность колонизации слизистых поверхностей пищеварительного тракта в разных условиях и при разных патологических состояниях.
В настоящее время у пациентов с заболеваниями пищеварительного тракта имеют место трудности клинической практики, обусловленные необходимостью проведения дифференциального диагноза между кандидоносительством и неинвазивным кандидозом кишечника, выбором критериев диагностики и определением тактики терапии (Шевяков М.А.,2003). Подобные вопросы диагностики, лечения и профилактики кандидоза кишечника особенно актуальны в ситуациях, когда необходимо пролонгирование антибактериальной или иммуносупрессивной терапии, способствующей поддержанию избыточной пролиферации грибов рода Candida в кишечнике и развитию неинвазивного кандидоза кишечника, или, когда имеются другие факторы риска развития кандидоза слизистых оболочек.
Существующие сегодня проблемы лечения неинвазивного кандидоза кишечника связаны не только с рациональным выбором антифунгальных препаратов, часто вызывающих нежелательные явления и влияющих на течение основного заболевания, но и с выбором продолжительности лечения, а также с адекватностью оценки эффективности терапии. Несмотря на определенный прогресс, в схемах антимикотической терапии мало используются препараты, действие которых направлено на гармонизацию интестинального биоценоза, что объясняется противоречивостью и неоднозначностью сведений об изменении композиции микроорганизмов в биотопах пищеварительного тракта при развитии различных патологических процессов (Guarner F., 2002, Sartor R.B., 2008, Ksiadzyna D., 2009).
Таким образом, очевидно, что изучение проблемы кандидоза кишечника при заболеваниях пищеварительной системы требует комплексного подхода к выявлению, оценке и коррекции диагностированных нарушений. Актуальным, оправданным и целесообразным представляется поиск новых диагностических технологий, на основании которых возможно бы было не только своевременно диагностировать кандидозный микроэкологический дисбаланс кишечника, но и контролировать проводимое антифунгальное лечение.
Цель исследования: уточнить особенности патогенеза и усовершенствовать технологии диагностики, лечения и профилактики кандидоза кишечника при хроническом гастрите, язвенной болезни, болезни Крона и язвенном колите.
Задачи исследования:
1. Оценить частоту встречаемости и степень выраженности кандидоза кишечника при поражении верхних отделов пищеварительного тракта (при язвенной болезни и хроническом гастродуодените);
2. Оценить частоту встречаемости и степень выраженности кандидоза кишечника при поражении нижних отделов пищеварительного тракта (язвенный колит и болезнь Крона);
3. Провести сравнительный анализ изменений клинического течения язвенной болезни, хронического гастродуоденита, воспалительных заболеваний кишечника (язвенный колит и болезнь Крона) в зависимости от наличия кандидоза кишечника;
4. Определить видовой состав грибов рода Candida у пациентов с выявленным кандидозом кишечника и установить взаимосвязи видового состава и адгезивных свойств грибов;
5. Провести анализ некоторых генетических свойств грибов рода Candida у пациентов с гастроинтестинальной патологией, получаю терапию антибактериальными препаратами или глюкокортикостероидами;
6. Выявить характерные микробиологические изменения в составе кишечного биотопа при кандидозе кишечника и исследовать взаимосвязь между изменением содержания различных групп микроорганизмов и грибами рода Candida в составе биотопа толстой кишки в зависимости от факторов риска кандидоза кишечника;
7. Усовершенствовать и оценить эффективность лечения и профилактики кандидоза кишечника, предусматривающие назначение антифунгальных препаратов и/или средств коррекции нарушений микробиоценоза кишечника.
Научная новизна исследования. Впервые проведен сравнительный анализ встречаемости избыточного роста грибов рода Candida в кишечнике у пациентов с гастроинтестинальной патологией в нижних и верхних отделах ЖКТ, в том числе при таких заболеваниях как хронический гастродуоденит, язвенная болезнь, болезнь Крона и язвенный колит.
Впервые показано на не экспериментальных моделях, что у пациентов с заболеваниями органов пищеварения имеет место неинвазивный кандидоз кишечника, проявляющийся увеличением не только представительства грибов в кишечнике, но и усилением их адгезивных свойств.
Подтверждено, что развитие неинвазивного кандидоза кишечника у пациентов с заболеваниями гастроинтестинальной системы происходит на фоне оппортунистической микст – инфекции, что ухудшает клиническое течение болезни.
Впервые установлено, что развитие неинвазивного кандидоза кишечника у пациентов с гастроинтестинальной патологией сопровождается увеличением кандидоносительства в других основных биотопах пищеварительной системы (полость рта, желудок).
Уточнено, что при назначении антибактериальных препаратов или глюкокортикостероидов увеличивается пролиферация грибов рода Candida не- albicans видов.
Впервые разработана, апробирована и внедрена в клиническую практику схема терапии неинвазивного кандидоза кишечника.
Впервые проведенное лечение неинвазивного кандидоза кишечника с помощью нерезорбируемого антимикотического препарата позволило изучить и продемонстрировать эффект данного средства в отношении грибов рода Candida не- albicans видов.
Уточнено, что использование пробиотических препаратов оказывает положительный эффект в элиминации грибов рода Candida, способствует регрессии симптомов основного заболевания, улучшению клинической картины и качества жизни.
Впервые предложено проводить профилактику развития неинвазивного кандидоза кишечника при назначении глюкокортикостероидной терапии.
Теоретическая и практическая значимость исследования. Теоретическая значимость исследования связана с изучением и выявлением факта маскировки оппортунистических (терапевтических) инфекций симптомами основного заболевания.
Установлено, что в патогенезе поражения верхних и нижних отделов пищеварительного тракта грибы рода Candida способствуют развитию неинвазивного кандидоза кишечника, что ухудшает клиническую картину заболевания.
Выявлено, что назначение антибактериальных препаратов или глюкокортикостероидов способствует развертыванию клинических проявлений оппортунистической микст-инфекции, ухудшающей течение основного заболевания и пролонгирующей период обострения.
Установлено, что этиологическим фактором неинвазивного кандидоза кишечника при патологии гастроинтестинальной системы являются как дрожжевые грибы вида Candida albicans, так и виды не- albicans.
Доказано, что при неинвазивном кандидозе кишечника усиливается способность клеток дрожжевых грибов к презентации генов адгезии и инвазии, возникающая при нарушениях гомеостатических механизмов локального биотопа, в частности, биотопа толстой кишки, в условиях, способствующих пролиферации различных условно-патогенных микроорганизмов.
Разработана унифицированная программа диагностики неинвазивного кандидоза кишечника и кандидоносительства, сущность которой заключается в определении степени активности неинвазивного кандидоза кишечника. Основанием для этого является исследование предложенного индекса адгезивной активности неинвазивного кандидоза кишечника, что позволяет своевременно выявлять исследуемое патологическое состояние на ранних этапах и обеспечивает проведение динамического контроля над эффективностью лечения.
Разработана, апробирована и внедрена в клиническую практику схема терапии неинвазивного кандидоза кишечника.
Установлено, что элиминации видов грибов рода Candida могут способствовать не только нерезорбируемые антимикотические препараты, но и препараты пробиотического действия, в частности естественные конкуренты микромицетов и лактосодержащие пробиотики.
Проведена профилактика развития неинвазивного кандидоза кишечника препаратом на основе взаимопотенцирующих штаммов Lactobacillus acidophilus у пациентов, получающих глюкокортикостероидную терапию. Показано, что одновременно с назначением глюкокортикостероидных препаратов для профилактики избыточной пролиферации Candida spp. при гастроинтестинальной патологии, должно осуществляться назначение средств коррекции кандидоза кишечника.
Личный вклад автора. На основании проведенного анализа отечественной и зарубежной литературы автором определена концепция настоящего исследования – сформулированы тема, цель, задачи, выбраны оптимальные методы. Автор принимал непосредственное участие в клиническом обследовании больных, собирал анамнез, вел клиническое наблюдение, формировал базу данных. Доля участия автора в сборе информации по теме диссертационного исследования составила 80%. Статистическая обработка материалов исследования, обобщение полученных результатов, представление их в виде таблиц, рисунков, диаграмм выполнены автором лично, доля участия автора 100%.
Основные положения, выносимые на защиту
- Обнаружение избыточного роста грибов рода Candida в фекалиях у пациентов с поражением верхних отделов пищеварительного тракта (язвенная болезнь и хронический гастродуоденит) как правило, свидетельствует о кандидоносительстве, тогда как у пациентов с поражением нижних отделов пищеварительного тракта (болезнь Крона и язвенный колит) при выявлении избыточной пролиферации грибов рода Candida в большинстве случаев имеет место неинвазивный кандидоз кишечника.
- В результате использования антибактериальных препаратов для эрадикационной терапии H.pylori-ассоциированных заболеваний верхних отделов пищеварительного тракта или глюкокортикостероидов в качестве средства базисной терапии воспалительных заболеваний кишечника происходит модификация интестинального биотопа и индукция пролиферации пула грибов рода Candida в составе просветной микрофлоры толстой кишки, что способствует не только увеличению кандидоносительства, но и изменению формы взаимодействия грибов рода Candida с макроорганизмом и развитию неинвазивного кандидоза кишечника.
- Клиническая диагностика неинвазивного кандидоза кишечника у пациентов с гастроинтестинальной патологией, получающих антибактериальную терапию или глюкокортикостероидные препараты, представляет определенные трудности вследствие неспецифичности симптомов кишечной диспепсии, которые могут являться как признаками основного заболевания, так и маскировать развитие неинвазивного кандидоза кишечника. Усугубление и/или персистенция данных симптомов могут быть связаны с развитием неинвазивного кандидоза кишечника.
- На фоне лечения антибактериальными препаратами или глюкокортикостероидными средствами изменяется видовой состав грибов рода Candida в биотопах пищеварительного тракта - возрастает частота обнаружения дрожжевых микромицетов видов не- albicans, которые обладают сходными с видом Candida albicans адгезивными свойствами, но являются более устойчивыми к антимикотической терапии.
- Неинвазивный кандидоз кишечника при гастроинтестинальной патологии характеризуется не только избыточным ростом грибов рода Candida и их высокой адгезивной и инвазивной способностью, но и наличием дисбиоза кишечника, проявляющегося увеличением количества условно-патогенных микроорганизмов и их ассоциаций на фоне снижения количества облигатных представителей микрофлоры кишечника.
- Проведение антибактериальной терапии у пациентов с гастроинтестинальной патологией влечет изменение генетических свойств грибов с увеличением презентации генов адгезии, тогда как при назначении стероидной терапии увеличивается презентация генов, ответственных как за морфологическую трансформацию гриба из дрожжевой формы в псевдомицелиальную, так и за инвазивные свойства грибов рода Candida.
- Лечение неинвазивного кандидоза кишечника целесообразно осуществлять с помощью нерезорбируемых антимикотических препаратов и/или лекарственных средств, способствующих элиминации дрожжевых микромицетов и восстановлению микрофлоры толстой кишки. Посредством одновременного назначения антибактериальных препаратов или глюкокортикостероидов и пробиотических препаратов, созданных на основе конкурентных антагонистов дрожжевых микромицетов, возможно осуществить профилактику развития неинвазивного кандидоза кишечника и увеличить эффективность терапии гастроинтестинальных заболеваний.
Апробация результатов работы. Основные результаты и положения диссертационного исследования доложены и обсуждены на: «10-м юбилейном Международном Славяно-Балтийском форуме «Гастро-2008» (г. Санкт-Петербург, 2008), «11-м Международном Славяно-Балтийский форуме «Гастро-2009» (г.Санкт-Петербург, 2009), Международном Конгрессе «Пробиотики, пребиотики, синбиотики и функциональные продукты питания. Фундаментальные и клинические аспекты» (г. Санкт-Петербург, 2008), II Международном Конгрессе «Пробиотики, пребиотики, синбиотики и функциональные продукты питания. Фундаментальные и клинические аспекты» (г. Санкт-Петербург, 2009), XXXII Международном Конгрессе SOMED (г. Санкт-Петербург, 2009), 6-ой объединенной научной сессии и 2-м Международном конгрессе по пробиотикам «Санкт-Петербург - Пробиотики 2009» (г. Санкт-Петербург, 2009), X-м Съезде Научного общества гастроэнтерологов России (НОГР) (Москва, 2009), 3-ей Северо-Западной научно-практической конференции «Санкт-Петербург – Фармакотерапия-2009» (г. Санкт-Петербург, 2009), 4-м междисциплинарном Российском конгрессе «Человек и проблемы зависимостей» (г. Архангельск, 2010), 12-м Международном Славяно-Балтийском форуме «Гастро-2010» (г. Санкт-Петербург, 2010).
Внедрение. Результаты исследования, проведенного по теме диссертации, внедрены в практику в гастроэнтерологическом отделении больницы Петра Великого (г. Санкт-Петербург), ГУ «Научный центр реконструктивной и восстановительной хирургии Сибирского Отделения РАМН» (г. Иркутск), отделении терапии Центральной клинической больницы гражданской авиации (г. Москва), в гастроэнтерологическом отделении 1472 окружного госпиталя (г. Севастополь, Украина), гастроэнтерологическом отделении ГУЗ "Республиканская клиническая больница" МЗ РТ (г. Казань), в микологической клинике НИИ медицинской микологии им. П.Н. Кашкина (г. Санкт-Петербург). Полученные в результате исследования данные используются в учебном процессе на кафедре внутренних болезней ГОУ ВПО МГМСУ Росздрава (г. Москва), на кафедре клинической микологии, иммунологии и аллергологии ГОУ ДПО СПбМАПО Росздрава (г. Санкт-Петербург), на кафедре госпитальной терапии ГОУ ВПО «Казанский ГМУ Росздрава» (г. Казань), на кафедре пропедевтики внутренних болезней ГОУ ВПО СПбГМА им. И.И. Мечникова Росздрава (г. Санкт-Петербург), на кафедре гастроэнтерологии ГИУВ МО РФ (г. Москва).
Структура и объем диссертации. Диссертация изложена на 380 страницах машинописи и состоит из введения, обзора литературы, описания материалов и методов исследования, 6 глав собственных исследований, заключения, выводов и практических рекомендаций. В работе использовано 85 отечественных и 485 иностранных источников литературы. Диссертация содержит 108 таблиц, 50 рисунков, 17 Приложений.
Материалы и методы исследования
Под наблюдением было 386 больных с патологией органов пищеварения (хронический гастродуоденит, язвенная болезнь, язвенный колит и болезнь Крона) в возрасте от 18 до 80 лет, которые находились на стационарном и амбулаторном обследовании в клинике гастроэнтерологии кафедры пропедевтики внутренних болезней с курсом нутрициологии и клинического питания ФПК Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова в период с 2005 г. по 2009 г. Среди пациентов было 174 мужчины и 214 женщин. Средний возраст больных составил 43,9±4,6 лет.
Способ организации выборки обследованных больных носил характер рандомизированного отбора с формированием простой случайной выборки больных. В целях придания выборке максимальной клинической однородности, в ее состав были включены больные, не имеющие клинически значимой сопутствующей общесоматической патологии.
До начала исследования все пациенты были проинформированы о необходимости заполнения специальных опросников, выполнения анализов крови, мочи, кала, фиброскопии с биопсией и последующего лечения и добровольно подписали информированное согласие. Все проведенные исследования соответствовали этическим нормам Хельсинской декларации (2000г.) и Приказу Министерства здравоохранения РФ № 266 от 19.06.2003.
В исследование было включено 80 пациентов с хроническим, H. pylori - ассоциированным гастродуоденитом и 60 пациентов с неосложненным течением ЯБ. Соотношение мужчин и женщин в группе ХГД составило 38:42, в группе ЯБ - 30:30, средний возраст составил 49,0±5,0 лет и 46,6±4,9 года соответственно. Продолжительность течения ЯБ составила 8,6±2,73 лет, продолжительность течения ХГД – 8,2±3,11 лет. Группы пациентов ЯБ и ХГД, в целом, не отличались по наличию сопутствующей патологии. Частота встречаемости сопутствующей патологии не превышала 35% в каждой из групп обследованных. В исследование не включали лиц с ХГД или ЯБ с органической патологией пищевода (дивертикулы, пищевод Барретта, эрозивно-некротический эзофагит). 50 пациентам с ХГД и высоким уровнем H. pylori и всем пациентам группы ЯБ была проведена эрадикационная терапия первой линии. Терапия включала ингибитор протонной помпы (ИПП) - препарат омепразол 20 мг два раза в день, антибиотики кларитромицин 0,5 г в сутки два раза в день и амоксициллин 1 г в сутки 2 раза в день, назначаемых в течение 10 дней. 30 пациентов ХГД антихеликобактерной терапии не получали.
В исследование было включено 186 пациентов с язвенным колитом (ЯК) и 60 пациентов с болезнью Крона (БК). Возраст пациентов с ЯК составил 41,97±2,51 лет, пациентов с БК 39,13±0,15 лет. Соотношение мужчин и женщин в группе ЯК было 96:90, в группе БК 10:50. Продолжительность болезни у пациентов ЯК составила 6,85±2,20 лет, у пациентов с БК - 3,5 ±0,87 года. У всех пациентов с ВЗК клинический диагноз не противоречил данным лабораторно-инструментального обследования. Внекишечной локализации процесса у пациентов БК не было. В исследование не включали пациентов, которым по данным лабораторно-инструментальных исследований, было бы необходимо назначение антибактериальных препаратов в течение последующего курса лечения.
На момент начала исследования внекишечные проявления были выявлены у 47 пациентов (25,3%) с ЯК и у 24 пациентов (40%) с БК. Учет данных о сопутствующих заболеваниях проводили без включения патологических состояний, имеющих отношение к внекишечным проявлениям основного заболевания. У пациентов с ВЗК среди сопутствующих заболеваний наиболее часто встречались поражения верхних отделов пищеварительного тракта (выявлены у 80,1% больных с ЯК и у 66,7% обследованных пациентов с БК). В группе пациентов с БК у 48,3% больных было выявлено поражение мочевыделительной системы. Удельный вес других заболеваний органов и систем у пациентов ЯК не превышал 25%. Низкий удельный вес патологии других органов и систем у пациентов ВЗК был связан, по-видимому, с достаточно молодым контингентом обследованных.
Все пациенты ЯК получали лечение салазосодержащими препаратами. 91,4% пациентов получали препараты 5-аминосалициловой кислоты (5АСК) (месалазин от 1 до 4 г в сутки), 8,6 % получали препарат сульфасалазин (от 2 до 3 г). Средняя суточная доза салазопрепаратов составила 3,0 г в сутки. При этом 73,1% пациентов ЯК получали базисную терапию ГКС, 26,9% пациентов принимали только салазопрепараты. ГКС назначались пациентам ЯК парентерально, per os и per rectum в зависимости от степени тяжести заболевания, доза ГКС варьировала от 20 до 40 мг/сутки. Доза ГКС была стабильной, как минимум 10 дней до включения в исследование, средняя продолжительность приема ГКС пациентами ЯК до начала наблюдения составила 12+4 дня.
16,7% пациентов с БК не получали никаких поддерживающих средств терапии, 23,3% больных получали лечение салазосодержащими препаратами (все принимали таблетки месалазина, средняя доза 1 г/сутки), 60% больных получали лечение препаратами ГКС per os. Средняя суточная доза будесонида составила 6,0 мг (препарат получали 13,3% пациентов с БК), средняя суточная доза преднизолона варьировала от 5 до 10 мг/сутки (данное средство получали 46,7% пациентов с БК).
Для оценки данных, полученных в результате исследования, пациенты ЯК и БК, согласно целям и задачам исследования, были разделены на группы (Csp- и Csp+). Группы Csp- составили пациенты, при бактериологическом анализе фекалий которых грибы рода Candida определялись в количестве не более 3 –Lg КОЕ/г фекалий или не определялись (85 больных с ЯК и 36 пациентов с БК), группы Csp+ составили пациенты, пролиферация Candida spp. в кале у которых превышала значения 3 –Lg КОЕ/г фекалий (101 пациент с ЯК и 24 больных с БК).
Для оценки влияния терапии ГКС на различные показатели клинического статуса, пациентов с ВЗК также подразделяли на группы, принципиальным отличием в которых считали назначение ГКС в схемах терапии (группа ГКС+). Группу ГКС+ составили 136 пациентов с ЯК и 36 пациентов с БК. В альтернативную группу вошли пациенты ЯК и БК которые не получали препаратов ГКС (группа ГКС-), в данной группе допускался прием больными салазосодержащих препаратов в стабильной дозе минимум 5 дней до настоящего обследования, данную группу составили 50 пациентов ЯК и 24 пациента БК.
В исследование не включали пациентов, которые принимали бы антибактериальные препараты в течение 30 последовательных календарных дней, предшествующих включению в исследование. Антибактериальные препараты в течение всего периода наблюдения дополнительно не назначали.
После проведенного обследования пациенты получали или не получали антимикотическую или пробиотическую терапию, в зависимости от дальнейшего лечения были сформированы три группы пациентов. Пациенты группы 1 - 15 пациентов ЯБ и ХГД и 30 пациентов ЯК и БК - получали препарат натамицин по 100 мг 4 раза в сутки 10 дней. Пациенты группы 2 - 20 пациентов ЯБ и ХГД и 65 пациентов ЯК и БК - получали пробиотические препараты: препарат на основе Saccharomyces boulardii по 1 капсуле 2 раза в день 14 дней или лактосодержащий пробиотик (содержащий взаимопотенцирующие штаммы Lactobacillus acidophilus (штаммы 75 и 76) по 2 кишечнорастворимые капсулы 2 раза в день). В группе 3, куда вошли 15 пациентов ЯБ и ХГД или 30 пациентов ЯК и БК, составившие группу сравнения, антифунгальной и пробиотической терапии не проводилось. Распределение пациентов в группы лечения антимикотическим препаратом или пробиотиком производилось после оценки выраженности кандидоза кишечника и зависело от величины индекса активности неинвазивного кандидоза кишечника (АННКИ).
30 пациентов ЯК получали с целью профилактики кандидоза кишечника с момента начала терапии ГКС лактосодержащий пробиотик по 1 кишечнорастворимой капсуле 2 раза в день 21 день. Группу сравнения пациентам, получающим профилактически пробиотический препарат, составили больные с аналогичной нозологической формой: 30 человек с язвенным колитом, получающие лечение ГКС, но не получавшие лактосодержащий препарат, или препараты, содержащие лактобактерии или другие пробиотики.
Все используемые лекарственные средства или пробиотические препараты были разрешены к применению в медицинской практике на территории РФ.
Всем больным проводилось стандартизированное клиническое и лабораторное обследование. В качестве методов исследования были выбраны: стандартизированный опрос, оценка активности болезни по традиционным шкалам, исследование качества жизни, клинический анализ крови, анализ мочи, исследование копрограммы, биохимическое исследование крови, фиброгастродуоденоскопия и/или фиброколоноскопия, гистологическое и молекулярно-генетическое исследование биоптатов слизистой оболочки желудка, двенадцатиперстной кишки (ДПК) и кишечника, бактериологическое исследование кала на дисбактериоз, исследование свойств грибов рода Candida в фекалиях и биологическом материале слизистой полости рта.
Стандартизированный опросник был разработан с целью детального изучения жалоб пациентов, данных их анамнеза. Для унифицирования полученных данных была использована условная шкала оценки имеющегося патологического состояния, выражаемая в баллах. Так, отсутствие признака полагали как 0 баллов, наличие неярко выраженного признака болезни или симптома признака расценивали как 1 балл, 2 балла отражали умеренную интенсивность симптома, 3 балла – его значительную интенсивность. Учитывая необходимость выявления признаков, которые могли бы быть возможными факторами риска микотического поражения, немаловажная роль была отведена вопросам о пищевых предпочтениях, микотических поражениях в прошлом, большое значение уделяли сопутствующим заболеваниям и приему лекарственных препаратов, особенно антибиотиков.
Для оценки степени тяжести язвенного колита и динамики терапии использовали индекс Майо – индекс клинической активности язвенного колита (КАИ). Динамику заболевания и эффективность проводимой дополнительной терапии оценивали по частичной шкале Майо, в которую не входят результаты эндоскопического исследования, так как повторное эндоскопическое исследование (колоноскопия или сигмоскопия) выполнялись в разные сроки и не всем пациентам. Подсчет индекса заболевания по частичной шкале Майо производили перед назначением дополнительной терапии и через 28 (+ 2) дней. Для оценки тяжести течения и динамики клинических проявлений БК применялся индекс активности болезни Крона по Бесту (индекс Беста). Оценка производилась по стандартной шкале с учетом таблиц идеального веса. Оценивали количественное изменение индекса активности болезни Крона в начале наблюдения и через 28 (+ 2) дня.
Исследование показателей крови (клинический и биохимический анализы), анализов мочи и копрограммы проводили по общепринятым методикам в центральной клинической лаборатории СПбГМА им. И.И. Мечникова. Иммунологическое исследование крови проводилось в центральной лаборатории клинической иммунологии СПбГМА им. И.И. Мечникова и в лаборатории иммунологии НИИ ОЧБ ФМБА России, Санкт-Петербург. Проводилась идентификация клеток с помощью моноклональных антител (анти-CD) против маркерных антигенов популяций и субпопуляций лимфоцитов с использованием проточного цитофлуориметра. Оценивались количественные и функциональные характеристики основных звеньев иммунной системы (CD3+, СD4+, СD8+, СD16+, D20+), определение экспрессии HLA-DR антигенов. Проводилась оценка фагоцитарной активности нейтрофилов с определением процента нейтрофилов с фагоцитированным материалом – фагоцитарное число (ФЧ) и количества поглощенных частиц на один нейтрофил – фагоцитарный индекс (ФИ). Исследовалось торможение миграции лейкоцитов (РТМЛ) по общепринятой методике с определением индекса миграции (ИМ) и скорости миграции (СМ). Определялось содержание сывороточных глобулинов G, A, M методом простой иммунодиффузии по Манчини, проводилось определение циркулирующих иммунных комплексов (ЦИК).
Фиброскопические исследования были выполнены в эндоскопическом отделении больницы им. Петра Великого Берестом Д.Г. и к.м.н. Лоевой И.А. Использовали гибкий видеогастроскоп Olympus GIF type 160, год выпуска 2005. Фиброгастродуоденоскопию выполняли по общепринятой методике. Колоноскопию или сигмоскопию проводили гибким видеоколоноскопом Olympus CF-Q тип 160 AI, год выпуска 2005. Биоптаты из слизистой оболочки пищеварительного тракта были получены с помощью стандартных биопсийных щипцов. Определение уреазной активности в биоптате слизистой оболочки антрального отдела желудка проводилось помощью HelPil-тестирования (HelPil – тесты фирмы “Sintana SM”, Санкт-Петербург). Колонобиоптаты из толстой кишки для морфологического исследования были взяты, как из видимо измененных, так и из видимо неизмененных участков слизистой оболочки.
Все бактериологические исследования были выполнены ст. науч. сотр. кафедры микробиологии СПбГМА им. И. И. Мечникова, к.м.н. Ниловой Л.Ю. на базе микробиологической лаборатории СПбГМА им. И.И. Мечникова. Исследование кала на дисбактериоз, исследование материала соскоба со слизистой полости рта на предмет выявления грибов рода Candida и оценка результатов бактериологического исследования проводилось при помощи бактериологического метода с применением строгой анаэробной техники и специальных питательных сред в соответствии с Отраслевым стандартом «Протокол ведения больных. Дисбактериоз кишечника», утвержденным приказом Минздрава РФ от 9 июня 2003(приложение). Материалом для исследования служили фекалии пациентов или материал соскоба слизистой коренного зуба полости рта, полученные утром в день исследования. Доставка в лабораторию материала для бактериологического исследования в целях выявления грибов рода Candida осуществлялась в жидкой среде Сабуро, посев производили на плотную среду Сабуро. Использовали стандартные среды, производство HiMedia (Индия). Доставка в лабораторию одного из биоптатов слизистой оболочки антрального отдела желудка для бактериологического исследования и идентификации Candida spp. осуществлялась в транспортной среде Кэрри-Блэра. Учитывая возможность малого количества микроорганизмов в биоптате и низкую чувствительность метода при прямом посеве на плотную среду, доставка и первичная инкубация второго биоптата происходила на жидкой среде Сабуро. Идентификацию грибов рода Candida до вида производили с помощью коммерческих хромогенных сред HiCrome Candida Differential Agar Base, Modified M1456A производства HiMedia (Индия), позволяющих дифференцировать следующие виды по окрашиванию и морфологии. Candida albicans, Candida glabrata, Candida tropicalis и Candida krusei, результаты исследования получали через 48 часов.
При определении степени адгезии высеянных из кала или материала полости рта Candida spp. к клеткам буккального и кишечного эпителия использовали методику Бойцова А.Г. Адгезия грибов рода Candida осуществлялась на кишечные и буккальные эпителиальные клетки больных, у которых были выделены данные микроорганизмы. При последующей микроскопии подсчитывали количество прикрепившихся клеток гриба к одной эпителиальной клетке. В каждом препарате анализировали не менее пяти эпителиальных клеток. Результат, называемый средним индексом адгезии (СИА), выражали в виде среднеарифметического числа адгезированных микроорганизмов Candida spp. на одной эпителиальной клетке (АКС). Интенсивность адгезии грибов рода Candida подразделяли на 3 степени. Низкой считалась степень адгезии при прилипании от 1 до 5 клеток гриба на одну эпителиальную клетку (СИА 1- 5 АКС); средней - при выявлении СИА от 5 до 10 АКС, высокой – при СИА> 10 АКС одной эпителиальной клетке.
Молекулярно-генетическое исследование биоптатов слизистой оболочки желудка и кишечника проводилось к.м.н. Суворовой М.А. в НИЛ «Диагностика», Санкт-Петербург, НИИЭМ. Исследовали биоптаты из антрального отдела желудка и биоптаты из ректального отдела кишечника, взятые на расстоянии 5 см от ануса, на предмет выявления генов Н.pylori и генов Candida albicans. Проводилась детекция генов CagA, UreC Н.pylori и генов Sap2, Hwp1 и Alp7 Candida albicans посредством ПЦР.
Все клинические и лабораторно-инструментальные показатели, зарегистрированные у обследованных больных, были адаптированы для математической обработки и изучались с использованием методов многомерного статистического анализа на ПЭВМ. Использовался наиболее оптимальный метод дуального шкалирования в отношении качественных переменных, а количественные переменные изучались в абсолютном выражении. Изучаемые переменные и их кодовые наименования были занесены в дескрипторный словарь, который в расширенном варианте включал адаптированные к дескриптору жалобы больных, анамнестические данные, результаты объективного обследования, данные лабораторных, инструментальных исследований и некоторые другие интересующие данные.
На каждом обследованном из состава выборки была произведена регистрация всех показателей, закодированных в дескрипторном словаре.
Исходные данные накапливались и подвергались статистической обработке на персональном компьютере с помощью пакета прикладных программ Statistica 8.0 для Windows. Математическая обработка данных начиналась с оценки вида распределения признака в выборке путем изучения параметров, характеризующих центральную тенденцию и рассеяние наблюдений по области значений признака. При этом были отслежены и исключены из матрицы наблюдений выскакивающие (анормальные) значения результатов, выходящие за пределы 99% интервала возможных значений по закону нормального распределения. Далее проводился расчет средних числовых характеристик клинико-лабораторных и морфологических показателей и стандартной ошибки среднего; оценка значимости различных средних значений показателей в независимых выборках с помощью t-критерия Стьюдента (для количественных признаков с нормальным распределением). Средние величины выражали в виде M±s, где М - среднее значение показателя, s - среднее квадратичное отклонение. Достоверными считали различия при р<0,05. Для проверки значимости проводимых в работе линейных дискриминантных функций использовался параметрический корреляционный анализ Пирсона (коэффициент корреляции – r). Для оценки качественных признаков с нормальным распределением использовался непараметрический критерий Пирсона 2. Среди вероятностно-статистических методов использовался множественный регрессионный анализ, позволяющий не только устанавливать статистически значимые связи, но и выявлять причинно-следственные взаимоотношения между объясняющими переменными и результирующими показателями. Для проверки качества уравнений регрессии использовался коэффициент множественной детерминации R2, характеризующий информационную способность моделей. Его значимость оценивалась путем сравнения расчетной величины показателя достоверности F (факт) со стандартным значением F преобразования Фишера (F(таб)). Проверка значимости регрессионных моделей осуществлялась при помощи F критерия Фишера, а значимости отдельных коэффициентов уравнения регрессии – при помощи t-критерия Стьюдента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Особенности кандидоза кишечника у пациентов с хроническим гастродуоденитом
Результаты обследования пациентов с ХГД до и после проведенной антихеликобактерной терапии продемонстрировали достоверную положительную динамику клинической и эндоскопической картины хронического гастродуоденита у наблюдаемых больных (уменьшение болевого синдрома и регрессия явлений желудочной диспепсии, р <0,05; различия достоверны; уменьшение эрозий в антральном отделе, признаков гастродуоденита, явлений очаговой гиперемии слизистой оболочки желудка, уменьшение отека слизистой оболочки луковицы двенадцатиперстной кишки (СОЛДПК), р <0,05, различия достоверны). Эрадикационная терапия была эффективной - после проведенной терапии, по данным уреазного теста, эрадикация Н.pylori составила 76% (Н.pylori выявлен до лечения у 92,5% пациентов с ХГД, после лечения у 24% пациентов, 2=12,4, р<0,01), по данным молекулярно-генетического анализа- 84% (2=14,3, р<0,01). После приема антибиотиков у 54% больных ХГД возникли признаки ухудшения самочувствия, связанные с возникновением симптомов кишечной диспепсии. Эпизоды возникших после лечения явлений кишечной диспепсии были тесно взаимосвязаны с приемом антибактериальных препаратов (r=0,7234, p<0,001). При этом у пациентов, ХГД, даже не имеющих признаков кишечной диспепсии, наблюдались изменения композиции кишечной флоры, которые характеризовались снижением представительства бифидофлоры, снижением уровня лактобацилл, бактероидов, кишечной палочки с нормальными ферментативными свойствами, увеличением количества эшерихий с измененными свойствами и представительства условно-патогенных микроорганизмов (УПМ), в том числе грибов рода Candida.
Частота обнаружения Candida spp. при бактериологическом исследовании кала после антихеликобактерной терапии составила 42% против 25% до лечения (2=4,11, р<0,05, различия достоверны). Дрожжевые микромицеты после лечения у пациентов ХГД были выявлены в количестве, превышающем референтные значения 3 -Lg КОЕ/г и достоверно большем, чем до лечения (табл. 1). После проведенной антибактериальной терапии, несмотря на сохраняющиеся невысокие показатели, адгезивные свойства грибов достоверно увеличивались (табл. 1) и степень адгезии прямо коррелировала с количеством Candida spp, выявленных в фекалиях (r=0,8016, p=0,017). Сравнительный анализ симптомов заболевания у пациентов ХГД показал, что у пациентов с избыточным ростом Candida spp. в кишечнике после проведенной антибактериальной терапии достоверно чаще (p<0,05) встречались такие симптомы кишечной диспепсии, как тяжесть в эпигастрии, боли по ходу толстой кишки, вздутие и урчание в животе.
Таблица 1
Результаты бактериологического исследования грибов рода Candida в фекалиях у пациентов ХГД, имеющих избыточный рост микромицетов в кале до и после эрадикационной терапии
| Показатель | До лечения, n=80 | После лечения, n=50 | р | |
| Частота выявления избыточного роста Candida spp., абс.(%) | 20 (25%) | 21 (42%) | <0,05 | |
| Количество грибов рода Candida выявленных при посеве фекалий у пациентов с избыточным ростом, M±s, -Lg КОЕ/г | 3,25±0,61 | 4,41±0,63 | <0,05 | |
| Виды грибов рода Candida, абс (%)* | Candida albicans | 16 (80%) | 14 (66,7%) | >0,05 |
| Candida tropicalis | 4 (20%) | 5 (23,8%) | >0,05 | |
| Candida glabrata | 0 | 2 (9,5%) | >0,05 | |
| Candida krusei | 0 | 0 | ||
| Частота встречаемости видов не albicans, абс.(%)* | 4 (20%) | 7 (33,3%) | >0,05 | |
| СИА буккальный эпителий, M±s, АКС | 2,90±1,17 | 4,69 ±0,52 | <0,01 | |
| СИА кишечный эпителий, M±s, АКС | 3,63±0,49 | 4,63±0,57 | <0,05 | |
| Candida albicans, СИА кишечный эпителий, M±s, АКС | 3,8±0,52 | 4,72±0,44 | <0,05 | |
| Не-Candida albicans, СИА кишечный эпителий, M±s, АКС | 3,0± 1,1 | 4,51±0,59 | <0,05 | |
Примечание: * - здесь и далее указана частота встречаемости видов грибов рода Candida у пациентов имеющих избыточную пролиферацию.
При определении видов дрожжевых микромицетов, выявленных у пациентов группы ХГД в избыточном количестве, отмечено превалирование вида Candida albicans и до и после лечения, но в результате использования антибактериальных препаратов имела место тенденция к увеличению частоты встречаемости видов не-albicans. После лечения, адгезивные свойства видов дрожжевых грибов вида Candida albicans и не-albicans достоверно возрастали (таблица 1).
У 30% пациентов с ХГД после антихеликобактерной терапии были обнаружены ассоциации грибов рода Candida в фекалиях c какими-либо представителями УПМ и выявлены прямые достоверные и устойчивые взаимосвязи между увеличением Candida spp. и количеством Streptococcus parvulus (r=0,529, p=0,007), Enterobacter spp. (r=0,5338, p=0,048), Staphylococcus spp. (r=0,6352, p=0,010), Enterococcus (r=0,8937, p<0,001), измененной Escherichia coli (E. coli) (r= 0,6948, p<0,001), в то время как количество E. coli с неизмененной ферментативной активностью находилось в обратных корреляционных отношениях с дрожжевыми микромицетами (r= -0,5487, p=0,034). Взаимоотношения между ассоциантами не были однозначными, а сложными и часто конкурентными. Так, например, при увеличении количества энтерококков адгезия грибов видов Candida albicans и Candida tropicalis увеличивалась (r=0,5061, p=0,02 и r=0,999, p<0,001, соответственно), тогда как при увеличении количества измененной E. coli адгезивные свойства грибов видов Candida albicans и Candida tropicalis уменьшались (r=- 0,999, p=0,010 и r=- 0,9219, p=0,009, соответственно).
После проведенной антихеликобактерной терапии, кроме увеличения презентации грибов рода в фекалиях, было отмечено увеличение презентации дрожжевых микромицетов в составе других биотопов пищеварительного тракта. При бактериологическом исследовании материала, полученного при соскобе со слизистой оболочки полости рта, было выявлено, что у пациентов с ХГД после проведенной антибактериальной терапии частота встречаемости Candida spp в составе биотопа полости рта достигала 72% (до лечения частота встречаемости составила 33,8%, 2=142,08, р<0,001, различия в высшей степени достоверны), у пациентов с избыточным ростом грибов в фекалиях частота выявления дрожжевых микромицетов в полости рта составила 76% (Candida spp. были выявлены в 40% случаев у пациентов с избыточным ростом Candida spp до лечения, 2=10,75, р<0,01, различия высоко достоверны). Как до, так и после лечения среди выделенных видов грибов в полости рта преобладали представители Candida albicans, адгезивные свойства которых достоверно увеличивались после приема антибиотиков (СИА к буккальным эпителиоцитам до лечения 4,18±1,1 АКС, после лечения, 5,90±1,02, р<0,05, различия достоверны). Следует отметить, что степень адгезии дрожжевых микромицетов, выявленных в полости рта, к буккальному эпителию устойчиво и в высшей степени достоверно коррелировала с количеством грибов Candida spp. в кишечнике (прямая устойчивая связь, r= 0,9166, p=0,001).
Изучение генетических свойств грибов в биоптатах желудка и кишечника показало, что также как и в кишечнике, после проведенной терапии с использованием антибиотиков, у пациентов с ХГД увеличивается презентация генов Candida albicans в слизистой оболочке желудка. Если до начала антибактериальной терапии гены грибов Candida albicans были выявлены в у 53,8% пациентов биоптатах из антрального отела желудка, у 50% пациентов в биоптатах из прямой кишки, то после антихеликобактерной терапии в биоптатах из желудка у всех больных (100%) с ХГД были обнаружены гены микромицетов (различия высшей степени достоверности, 2=32,37, р<0,001) и у 80% пациентов обнаружено присутствие генов в биоптатах из прямой кишки (различия высоко достоверны, 2=11,7, р<0,01). До лечения в биоптатах из антрального отдела желудка и прямой кишки у пациентов с ХГД преобладали гены Sap2. Превалирование генов Sap2 (генов вирулентности, кодирующих белок кислой аспартилпротеиназы и отвечающих за адгезивность дрожжевых микромицетов в меньшей степени, чем другие исследуемые гены) подтверждало невысокие адгезивные свойства микромицетов до начала эрадикационной терапии. После лечения в биоптатах желудка и кишечника отмечалось значительное и достоверное увеличение не только генов Sap2, но и увеличение презентации генов семейства Alp (рисунок 1), указывающее на возрастание адгезивных свойств дрожжевых микромицетов после проведенной антихеликобактерной терапии.
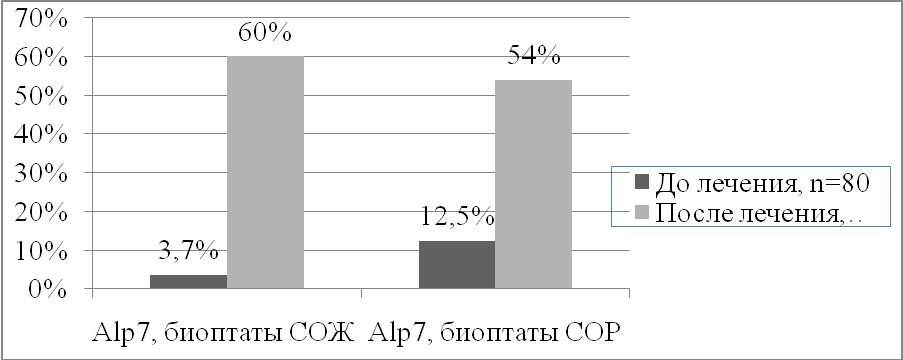 Рисунок 1. Частота выявления генов Alp7 в биоптатах из антрального отдела желудка и прямой кишки у пациентов ХГД до и после проведенной эрадикационной терапии. По оси абсцисс - ген Alp7 в биоптатах СОЖ и СОР до и после лечения, по оси ординат - частота встречаемости данного гена. Примечание: различие до и после лечения статистически достоверно с уровнем достоверности р<0,01.
Рисунок 1. Частота выявления генов Alp7 в биоптатах из антрального отдела желудка и прямой кишки у пациентов ХГД до и после проведенной эрадикационной терапии. По оси абсцисс - ген Alp7 в биоптатах СОЖ и СОР до и после лечения, по оси ординат - частота встречаемости данного гена. Примечание: различие до и после лечения статистически достоверно с уровнем достоверности р<0,01.
Таким образом, несмотря на позитивные результаты лечения основного заболевания посредством назначения терапии, включающей антибактериальные средства, у пациентов с ХГД после лечения изменялась клиническая картина заболевания. На основании клинических и лабораторных данных можно констатировать, что у 54 % пациентов с ХГД после применения антибактериальных препаратов имела место антибиотикоассоциированная кишечная диспепсия, вызванная, по-видимому, усиленной пролиферацией условно-патогенной микрофлоры на фоне снижения пула облигатных представителей кишечной микробиоты, и ассоциированная у 42% больных с избыточным количеством грибов Candida spp. в кишечнике. После проведенной антибактериальной терапии не только в биотопе толстой кишки, но и в биотопах полости рта и желудка, в которых также наблюдалось увеличение презентации грибов Candida spp., в том числе, видов не-albicans, возрастали адгезивные свойства выявленных дрожжевых микромицетов.
Особенности кандидоза кишечника у пациентов с язвенной болезнью
У всех пациентов с язвенной болезнью двенадцатиперстной кишки (ЯБ) прием лекарственных средств терапии первой линии способствовал положительной динамике симптомов заболевания, уменьшению размера язвенного дефекта и признаков воспаления гастродуоденальной зоны согласно данным эндоскопического исследования. Средний размер язвенного дефекта через 10 дней терапии составил 0,21±0,03 см против 0,43±0,014 см до лечения (различия достоверны, р<0,01). До начала антихеликобактерной терапии у 96,7% пациентов ЯБ уреазный тест был положительным, гены Н.pylori UreC и CagA были определены у 80% больных при анализе биоптатов из антрального отдела желудка. После проведенной терапии по данным уреазного теста эрадикация Н.pylori наблюдалась у 61,7% пациентов с ЯБ, по данным цитогенетического анализа - у 66,7% больных. Различная эффективность эрадикации у пациентов с ХГД и ЯБ по данным молекулярно-генетического исследования, по-видимому, объяснялась тем, что у пациентов с ЯБ в большом количестве случаев, несмотря на достоверное снижение, сохранялась высокая детекция гена CagA в биоптатах антрального отдела (ген обнаружен у 65% пациентов до лечения и у 33,3% пациентов после 10-дневной терапии, различия высоко достоверны 2=12,04, р<0,01).
Уже ко 2-3-му дню эрадикационной терапии у 73,3% пациентов ЯБ был купирован болевой синдром, средняя продолжительность болевого синдрома в группе пациентов ЯБ составила 5,1±0,82 дня. У 50% пациентов ЯБ явления желудочной диспепсии (изжога, отрыжка, тяжесть в эпигастрии, чувство дискомфорта после еды) исчезли к 5 дню лечения, а у 50% пациентов к 5-му дню лечения явления желудочной диспепсии уменьшились, средняя продолжительность симптомов желудочной диспепсии у пациентов ЯБ составила 6,7±0,32 дня. Но, на фоне и после получаемой эрадикационной терапии, интенсивность жалоб у пациентов ЯБ со стороны кишечника возрастала. Через 10 дней лечения у 45% пациентов ЯБ отмечался неустойчивый стул с остатками не переваренной пищи 5-6 типа по Бристольской шкале, с частотой до 2-3-х раз в сутки (среднее количество дефекаций составило 2,3±0,25 раза в сутки), нарастали явления кишечной диспепсии (усиливалось ощущение вздутия живота, газообразование).
При бактериологическом анализе фекалий было обнаружено, что у пациентов с ЯБ до начала терапии наблюдались изменения композиции бактериальной флоры толстой кишки, уменьшение количества представителей облигатной составляющей кишечной флоры - снижение бифидобактерий, уменьшение количества бактероидов, уменьшение количества энтерококков, наблюдались изменения в качественном и количественном составе E.coli. У 36,7% пациентов с ЯБ до начала терапии в фекалиях определялись представители УПМ, преимущественно, различные стафилококки, энтеробактерии, клебсиеллы, протей, у 16,7% больных выявлялись ассоциации УПМ в составе кишечной просветной микрофлоры. До начала эрадикационной терапии грибы рода Candida были выявлены в значениях превышающих референтные у 15% пациентов с ЯБ. Прием антибактериальных препаратов способствовал усугублению имеющихся нарушений в составе толстокишечного биотопа у пациентов с ЯБ: отмечалось еще большее снижение уровня бифидобактерий, лактобацилл, бактероидов, уменьшение кишечной палочки с нормальными ферментативными свойствами (р0,01, различия достоверны) и почти в два раза увеличилось количество эшерихий с измененными свойствами (р<0,01, различия достоверны), выявлялись гемолитические микроорганизмы, увеличилось количество грибов рода Candida (4,79±0,45 -Lg КОЕ/г против 1,9±0,82 -Lg КОЕ/г до начала антихеликобактерной терапии, р<0,001, различия в высшей степени достоверны (таблица 2)) и условно-патогенной флоры. Представители УПМ были обнаружены в фекалиях у 70% больных с ЯБ после лечения, представители Candida spp. определялись в избыточном количестве у 36,7% больных, что достоверно отличалось от частоты встречаемости дрожжевых микромицетов у пациентов ЯБ до начала эрадикационной терапии (2= 7,35, р<0,01), ассоциации УПМ были выявлены у 51,7% больных, в том числе у 23,3 % пациентов обнаружены ассоциации представителей УПМ и Candida spp., что было достоверно выше, чем до лечения (2=16,3, p< 0,01, различия высоко достоверны). Были установлены прямые взаимосвязи между количеством грибов рода Candida и количеством E. coli с измененными свойствами (r=0,4898, p=0,043), Enterobacter spp. (r=0,55, p=0,034), количеством Staphylococcus aureus (r=0,4821, p=0,004). В иммунологическом анализе крови у пациентов ЯБ после лечения достоверно увеличилось количество иммуноглобулина А, уменьшилось количество цитотоксических лимфоцитов CD8+ и увеличились значения иммунорегуляторного индекса, что свидетельствовало об адекватном иммунном ответе у большинства пациентов, по-видимому, связанным с реакцией на пролиферацию УПМ кишечника.
Был проведен сравнительный анализ симптомов заболевания, выявленных у пациентов ЯБ с избыточным ростом грибов Candida spp. и у пациентов, у которых рост дрожжевых микромицетов в фекалиях не определялся или был в пределах референтных значений. У пациентов ЯБ, в фекалиях которых рост дрожжевых грибов был избыточным, чаще, чем в группе с неизмененным или низким уровнем пролиферации микромицетов выявлялись симптомы кишечной диспепсии. Были установлены устойчивые и достоверные взаимосвязи между избыточным ростом грибов рода Candida в кале и такими симптомами кишечной диспепсии, как вздутие живота (r=0,5992, p=0,0034), урчание в животе (r=0,5499, p=0,0067), повышенное газообразование (r=0,7657, p<0,001), послабления стула (r=0,7693, p<0,001).
Таблица 2
Результаты бактериологического исследования Candida spp. в фекалиях у пациентов язвенной болезнью до и после антибактериальной терапии
| Показатель | До лечения, n=9 | После лечения, n=22 | р | |
| Количество грибов рода Candida, M±s, -Lg КОЕ/г | 3,66±0,29 | 4,79±0,45 | <0,01 | |
| Виды грибов рода Candida, абC.(%) | Candida albicans | 7 (77,8%) | 15 (68,2%) | >0,05 |
| Candida tropicalis | 2 (22,2%) | 4 (18,2%) | >0,05 | |
| Candida glabrata | 0 | 2 (9,1%) | >0,05 | |
| Candida krusei | 0 | 1 (4,5%) | >0,05 | |
| Частота встречаемости видов не- albicans, абс(%) | 2 (22,2%) | 7 (31,8%) | >0,05 | |
| СИА буккальный эпителий, M±s, АКС | 4,1±2,1 | 7,67±1,16 | <0,01 | |
| СИА кишечный эпителий, M±s, АКС | 5,67±1,4 | 9,11±2,74 | <0,01 | |
| Candida albicans, СИА кишечный эпителий, M±s, АКС | 6,2±1,6 | 9,2±1,23а | < 0,01 | |
| Не-Candida albicans, СИА кишечный эпителий, M±s, АКС | 3,2±1,1 | 8,3±1,9 а | < 0,01 | |
Примечание: а - различия между группами недостоверны, р>0,05
Адгезивные свойства микромицетов, характеризующие их патогенность, до лечения не были высокими - в нашем исследовании у пациентов с хроническим гастродуоденитом и язвенной болезнью адгезивность выявленных штаммов Candida spp. варьировала в пределах невысокой или умеренной адгезии, близкой к референтным значениям - между легкой и умеренной степенью адгезии. Эрадикационная терапия у пациентов тс ЯБ способствовала не только увеличению количества грибов рода Candida в составе кишечного биотопа – после проведенного лечения с включением антибактериальных средств адгезивные свойства дрожжевых микромицетов значительно и достоверно возрастали (таблица 2).
После проведенной терапии с включением антибактериальных препаратов у пациентов группы ЯБ, как и у пациентов с ХГД, имела место тенденция к увеличению частоты обнаружения видов грибов не- albicans в фекалиях, при этом отмечено достоверное увеличение адгезивных свойств грибов видов не- albicans (таблица 2). Дрожжевые микромицеты видов не- albicans, изначально имеющие невысокие адгезивные свойства по сравнению с видом Candida albicans, после проведенной антибактериальной терапии обладали свойствами к адгезии, достоверно (р>0,05) не отличающимися от таковых у вида Candida albicans (таблица 2).
Так же как у пациентов с ХГД, после проведенной эрадикационной терапии у больных с ЯБ отмечено увеличение представительства грибов рода Candida в составе биотопа полости рта и желудка. После лечения интенсивность заселения биотопа полости рта Candida spp. достоверно увеличивалась - у 76,7% пациентов с ЯБ выявлено наличие колоний Candida spp. при посеве соскоба со слизистой оболочки полости рта (СОПР) (обнаружены у 40% больных до лечения, 2=16,59, р<0,05). Как до, так и после лечения в полости рта у пациентов с ЯБ среди выявленных дрожжевых микромицетов преобладали Candida albicans. Адгезивные свойства Candida spp., выявленных при бактериологическом анализе содержимого полости рта, после лечения соответствовали средней степени адгезии (СИА к клеткам буккального эпителия составил до лечения 2,78±1,5 АКС, после лечения 6,01±2,4 АКС, р<0,01).
Увеличение представительства грибов рода Candida в биотопе желудка характеризовалось увеличением количества грибов рода Candida, обнаруженных в биоптатах из края язвенного дефекта при посеве на плотную среду Сабуро. Если до лечения количество обнаруженных колоний составило 808,2±350,1 КОЕ/мл, то после проведения эрадикационной терапии -1303,1±239,6 КОЕ/мл (р<0,01). Наличие роста колоний грибов при посеве биоптата из края язвы двенадцатиперстной кишки на плотную среду Сабуро прямо и достоверно коррелировало с количеством Candida spp. в фекалиях у пациентов ЯБ (r=0,7591, p<0,001).
Таблица 3
Частота встречаемости генов грибов Candida albicans в биоптатах антрального отдела и прямой кишки до и после 10-дневного курса эрадикационной терапии у пациентов с язвенной болезнью
| Гены | До лечения, n =60, абс (%) | После лечения, n =60, абс (%) | 2 | р | |
| Биоптаты из антрального отдела желудка | |||||
| Hwp 1 | 5 (8,3%) | 24(40%) | 13,25 | <0,01 | |
| Sap 2 | 19 (31,7%) | 37 (61,7%) | 10,85 | <0,01 | |
| Alp 7 | 7(11,7%) | 43(71,7%) | 44,43 | <0,001 | |
| Не выявлен ни один ген Candida albicans | 34 (56,7%) | 7(11,7%) | 27,00 | <0,001 | |
| Биоптаты из прямой кишки | |||||
| Hwp 1 | 6(18,3%) | 16 (26,7%) | 5,57 | <0,05 | |
| Sap 2 | 11 (18,3%) | 35 (58,3%) | 20,3 | <0,001 | |
| Alp 7 | 4(6,67%) | 33(55%) | 32,86 | <0,001 | |
| Не выявлен ни один ген Candida albicans | 41 (68,3%) | 15(25%) | 22,6 | <0,001 | |
При молекулярно - генетическом исследовании биоптата из желудка и кишечника на предмет выявления генов адгезии и инвазии Candida albicans после проведения эрадикационной терапии у пациентов с ЯБ было обнаружено увеличение презентации генов вирулентности и патогенности всех трех семейств (таблица 3). Данные исследования подтверждали увеличение адгезивных свойств дрожжевых микромицетов в биотопах желудка и кишечника после приема антибактериальных средств. Более значительным, как и у пациентов с ХГД, у пациентов с ЯБ после лечения было увеличение представительства генов семейства Alp 7, определяющих способности патогена к адгезии, и Sap2, принадлежащего к семейству основных генов вирулентности, по сравнению с увеличением количества генов Hwp1 (таблица 3). При анализе факторов патогенности дрожжевых микромицетов установлен факт прямых и высоко достоверных корреляций между количеством Candida spp. в кишечнике и наличием генов Alp7 (r=0,5897, p=0,008) и Hwp1 (r=0,56, p=0,001) в биоптатах из прямой кишки.
Полученные данные свидетельствуют, что у 37% пациентов с ЯБ после применения антибактериальных препаратов имело место изменение клинической картины заболевания и развитие симптомов кишечной диспепсии, ассоциированной с избыточным количеством грибов Candida spp. в кишечнике. Результаты, полученные при обследовании пациентов с ЯБ, как и пациентов с ХГД, показали увеличение экспансии дрожжевых микромицетов и возрастание их патогенных и вирулентных свойств в биотопах пищеварительного тракта после антибактериальной терапии.
В целях выявления факторов, определяющих выраженность колонизации кишечника грибами рода Candida, определения направленности их влияния, был выполнен множественный регрессионный анализ. При этом наиболее полно объясняющими дисперсию целевой переменной «содержание грибов рода Candida в кишечнике» для ХГД и ЯБ явилась следующая модель:
Y=53,6+1,5Х1+0,87Х2+0,49Х3+0,05Х4+0,19Х5-3,0Х6+ 0,48Х7
Y – Содержание грибов рода Candida в кишечнике, -LgКОЕ/г
Х1 - Повышение аппетита (нет-0, есть-1)
Х2 - Грыжа пищеводного отверстия диафрагмы (нет-0, есть-1)
Х3 –Наличие у пациента отека слизистой оболочки ДПК (0-нет, 1-есть)
Х4- СИА Candida spp. на эпителиоцитах, АКС
Х5- Содержание Escherichia. coli с измененными свойствами в фекалиях, LgКОЕ/г
Х6- Содержание Lactobacillus spp. в фекалиях, -LgКОЕ/г
Х7 – Содержание Enterobacter spp., -LgКОЕ/г
* Примечание: все представленные здесь и далее в тексте уравнения значимы со значимыми коэффициентами членов уравнения регрессии
В этой модели высокий коэффициент множественной детерминации R = 0,960 свидетельствует о тесной связи факторных признаков с результативным. F критерий Фишера (факт) =40,58, F критерий Фишера (таб) = 1,60, F(факт)> F (таб), p<0,0001.
Данное уравнение показывает, что количество дрожжевых микромицетов в кишечнике у пациентов с ЯБ и ХГД является зависимым от следующих признаков и компонентов: увеличению пролиферации дрожжевых грибов рода Candida в кишечнике способствовали повышение аппетита, наличие скользящей грыжи пищеводного отверстия диафрагмы, воспалительные изменения слизистой оболочки двенадцатиперстной кишки; адгезивные свойства грибов рода Candida на эпителиоцитах полости рта и кишечника, степень дисбиоза и увеличение представителей кишечной флоры в составе биотопа толстой кишки, таких как E.coli с измененными ферментативными свойствами, Enterobacter spp. Снижение интенсивности роста Candida spp. в составе кишечной микрофлоры у пациентов с ЯБ и ХГД отмечалось при увеличении количества представителей Lactobacilli в составе кишечного биотопа.
Особенности кандидоза кишечника у пациентов с язвенным колитом
КАИ и индекс эндоскопической активности заболевания у пациентов ЯК соответствовали обострению процесса. У пациентов с ЯК КАИ составил 7,06±0,21баллов, эндоскопический индекс активности по шкале Рахмилевича составил 8,11±0,21 баллов, что соответствовало обострению заболевания и умеренной активности процесса. 67,7% обследованных пациентов ЯК страдали левосторонним колитом. Умеренная клинико-эндоскопическая активность язвенного колита была подтверждена серией гистологических исследований. У всех пациентов при эндоскопическом исследовании не выявлено признаков микотического поражения толстой кишки. У пяти пациентов была выявлена мацерация перианальной зоны, были выполнены соскобы из этой области и соскобы из области прямой кишки с расстояния 5 см. Для определения роста грибов Candida spp. выполнен посев на среду Сабуро. Ни в одном из случаев роста колоний на среде Сабуро получено не было.
У пациентов ЯК в клиническом анализе крови отмечалась умеренная неспецифическая воспалительная реакция: лейкоцитоз 10,3х109/л, ускорение СОЭ до 22 мм/ч. Средний уровень гемоглобина до лечения в группе пациентов ЯК составил 118,1 г/л, что было ниже референтных значений и соответствовало анемии легкой степени. Показатели биохимического анализа крови у обследованных пациентов не были изменены значительно. При определении иммунного статуса было выявлено увеличение количества циркулирующих иммунных комплексов у 91,4% пациентов и количества Ig М у 72,9% больных, что указывало на увеличение антигенемии и возможные аутоиммунные нарушения. Значение иммунорегуляторного индекса (CD4/ CD8) превышало референтные значения. Наблюдалось увеличение индекса CD4/ CD8 до уровня 2,7±0,83.
При оценке количества микроорганизмов, обнаруженных при бактериологическом исследовании фекалий, у пациентов с ЯК были выявлены значительные изменения в составе кишечной микрофлоры: количество представителей бифидофлоры было сниженным на 3 порядка, лактобацилл на 1 порядок, бактероидов и кишечной палочки с неизмененными свойствами на 1-2 порядка. Количество кишечной палочки с измененными свойствами у пациентов с язвенным колитом превышало референтные значения и в среднем составило 6,04±0,35 -Lg КОЕ/г (увеличено на 1-2 порядка). Количество представителей условно-патогенной флоры, в том числе грибов рода Candida было выше референтных показателей на 1-2 порядка. Снижение количества представителей бифидофлоры наблюдали у 88,2% ЯК, у 58,1% отмечено уменьшение лактобацилл, бактероиды были снижены у в 97,3% случаев, у 3,3% отмечалось снижение количества неизмененной кишечной палочки и у 69,9% отмечен рост E. сoli с измененными ферментативными свойствами, в том числе и гемолитической. У 62,9% пациентов c язвенным колитом в кале были выявлены представители УПМ. В значительном количестве присутствовали следующие представители оппортунистической составляющей микробиоты: Candida spp., Klebsiella spp., Enterobacter spp., Citrobacter spp., Proteus vulgaris. Был проведен анализ встречаемости ассоциаций условно-патогенных микроорганизмов. У 36,6% пациентов с ЯК обнаружены сочетания двух и более различных представителей УПМ. При оценке частоты встречаемости отдельных представителей УПМ в составе кишечного микробиоценоза было обнаружено, что наиболее часто у пациентов в анализах кала определялись Candida albicans, Staphylococcus epidermalis or saprophyticus C101, Enterobacter agglomerans, Klebsiella terrigena, Proteus vulgaris. Грибы рода Candida были обнаружены у 54,3% больных. Среди представителей Candida spp. преобладал вид грибов Candida albicans, второе место занимали грибы Candida glabrata. Адгезивные свойства дрожжевых микромицетов, выделенных из кала к клеткам кишечного эпителия соответствовали высокой степени адгезии (таблица 4).
Кроме увеличения представительства грибов рода Candida в кишечнике наблюдали увеличение пролиферации и адгезивных свойств Candida spp. в других биотопах пищеварительного тракта. Дрожжевые микромицеты в полости рта у пациентов с ЯК были обнаружены у 67,0% обследованных. У пациентов с ЯК в полости рта, так же как и в кале, преобладали виды грибов Candida albicans, которые обладали средними адгезивными свойствами к буккальным и кишечным эпителиоцитам (таблица 4). У пациентов с ЯК в полости рта достоверно чаще (р<0,01), чем в фекалиях встречались виды не - albicans и сочетания двух видов грибов.
Таблица 4
Результаты бактериологического исследования грибов рода Candida в фекалиях и полости рта у пациентов с язвенным колитом
| Показатель | Фекалии, n=186 | Полость рта, n=103 | р | |
| Частота выявления грибов рода Candida, абс.(%) | 106(56,9%) | 69(67%) | >0,05 | |
| Количество грибов рода Candida, -Lg КОЕ/г, M±s | 4,50±0,40 | Не определялось | ||
| Виды грибов рода Candida, абс(%)* | Candida albicans | 74 (69,8%) | 54 (78,26%) | <0,05 |
| Candida tropicalis | 10 (9,5 %) | 8 (11,6%) | >0,05 | |
| Candida glabrata | 20 (18,9%) | 18 (26,1%) | >0,05 | |
| Candida krusei | 2 (1,9%) | 0 | >0,05 | |
| Выявление 2-х видов грибов, абс(%) | 5(4,95%) | 11 (15,9%) | <0,01 | |
| СИА буккальный эпителий, АКС | 8,3±1,56 | 5,3±0,74 | <0,0 | |
| СИА кишечный эпителий, АКС | 10,6±1,2 | 5,98±1,11 | <0,01 | |
Примечание: * - частота встречаемости в группе пациентов, имеющих избыточный рост дрожжевых микромицетов.
В биоптатах антрального отдела желудка у пациентов с ЯК гены Candida albicans определялись у 81,9% больных. Наиболее часто в биоптатах из антрального отдела желудка встречались гены Sap 2 и Hwp1, частота выявляемости генов семейства Аlp (Аlp7) была более низкой. У 45,7% пациентов присутствовали два гена, преобладали сочетания Sap 2 и Hwp1. Гены Candida albicans в биоптатах из прямой кишки определялись у 78% больных, у 24% пациентов присутствовали два гена. Наиболее часто в биоптатах из прямой кишки обнаружены гены Sap 2 и Hwp1 Candida albicans, частота выявляемости генов семейства Аlp (Аlp7) также, как и в биоптатах из антрального отдела желудка, была более низкой. Частота обнаружения генов Hwp1 в биоптатах антрального отдела желудка была более высокой, чем в биоптатах из прямой кишки (р<0,05).
Был проведен анализ неспецифических симптомов и опрос на предмет выявления жалоб, которые косвенно могли свидетельствовать о наличии кандидозного поражения – оценивали наличие признаков кожного зуда, наличие опрелостей, зуда в анальной области, высыпаний в полости рта. Данные субъективного обследования группы пациентов ЯК показали, что подобные специфические симптомы беспокоили около 1/3 всех пациентов.
Достоверные различия были выявлены и при сравнении симптомов болезни в группах пациентов ЯК с различным уровнем пролиферации дрожжевых грибов в толстой кишке. Так, у пациентов с избыточным ростом грибов рода Candida фекалиях отмечено более частое появление таких жалоб, как кожный зуд (беспокоил 56,5% пациентов группы Csp+ против 24,8% больных из группы Csp-, р<0,01), появление опрелостей различной локализации (паховая зона, зона под грудными и молочными железами, зона анального сфинктера) – у пациентов ЯК с избыточным ростом дрожжевых микромицетов данный признак выявлялся в 38,6% случаев, в группе Csp- встречался только у 21,2% (р<0,05); зуд анальной области беспокоил 47,5% пациентов с избыточным ростом грибов в толстой кишке и только 11,8% больных, у которых грибы рода Candida выявлялись в небольшом количестве или не выявлялись (р<0,01). Были установлены прямые сильные достоверные корреляционные зависимости между степенью адгезии грибов к клеткам эпителия и явлениями высыпаний во рту (r=0,7063, p=0,012), курением (r=0,6442, p=0,002), зудом во влагалище (r=0,7072, p=0,004).
У пациентов с высоким уровнем микромицетов в кале достоверно чаще встречались симптомы кишечной диспепсии (рисунок 2). Наличие избыточного количества дрожжевых грибов в кишечнике прямо коррелировало с наличием у пациентов с ложными позывами на дефекацию (r=0,5401, p=0,008), ощущением неполного опорожнения кишки (r=0,5796, p=0,004), зудом в анальной области (r=0,4799, p=0,001).
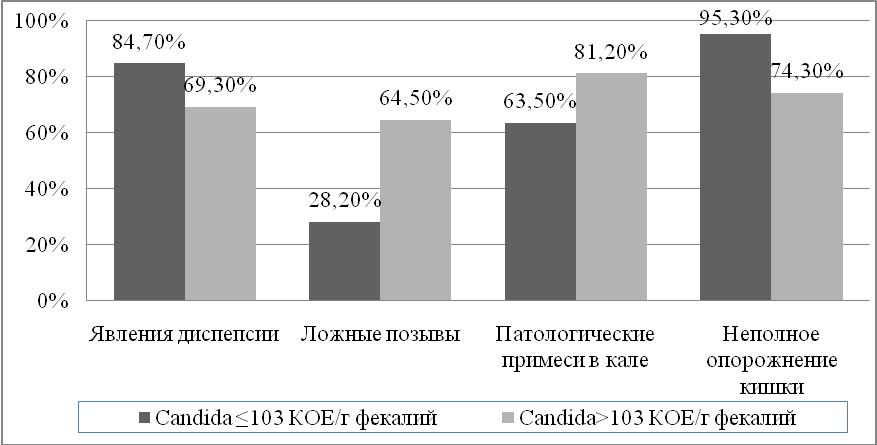
Рисунок 2. Частота встречаемости симптомов кишечной диспепсии у пациентов язвенным колитом с низким и высоким уровнем грибов Candida spp. в фекалиях. По оси абсцисс – симптом в группах с разным уровнем пролиферации дрожжевых микромицетов, по оси ординат - частота встречаемости симптома у пациентов с ЯК
Примечание: Показаны симптомы, при которых различия по частоте встречаемости в группах с разным уровнем пролиферации грибов достоверны (р<0,05)
При оценке иммунологических показателей у пациентов в группе с избыточной пролиферацией микромицетов (Csp+) уровень секреторного иммуноглобуллина в периферической крови был достоверно выше, чем у пациентов группы Csp– 1,87±0,12 г/л и 1,68±0,06 г/л соответственно (р<0,01). В группе Csp+ были отмечены более высокие значения IgM, чем в группе Csp- (2,11±0,15 г/л и 1,85±0,14 г/л соответственно, р<0,01). Выявлены следующие корреляционные взаимосвязи между иммунологическими показателями и наличием избыточного роста грибов рода Candida в кале: прямая связь с числом нейтрофилов периферической крови (r=0,9352, p=0,006), РТМЛ, СМ (r=0,9078, p=0,03), количеством CD 19+(r=0,8292, p=0,04).
По данным бактериологического исследования фекалий у пациентов ЯК в группе Csp+ изменение облигатной составляющей микрофлоры толстой кишки было более выраженным, чем у пациентов в группе Csp-, несмотря на то, что явления дисбиоза отмечены у пациентов обеих групп. Обнаружено снижение количества лактобацилл (снижены в группе Csp+ у 67,3% пациентов, в группе Csp- у 47,1 %, р<0,01), снижение количества кишечной палочки с неизмененными ферментативными свойствами (снижена у 91,1% пациентов группы Csp+, в группе Csp- снижение отмечено у 74,1% больных, р<0,01). Представители условно-патогенной флоры в фекалиях у пациентов с ЯК группы Csp+ были обнаружены у 64,4% больных, в то время как у пациентов группы Csp- только у 38,8% обследованных (р<0,01). Количество представителей условно-патогенной флоры превышало нормативные показатели в группе Csp+ и составило 5,23±0,89, в группе Csp- было неизмененным - 2,5±0,59 -LgКОЕ/г (р<0,05). У пациентов с ЯК были обнаружены прямые корреляционные взаимодействия между наличием УПМ и количеством грибов рода Candida (r= 0,8791, p< 0,001). При анализе взаимосвязей между отдельными представителями УПМ выявлены следующие данные: прямая устойчивая связь между количеством Candida spp и количеством Enterococcus faecalis (r=0,998, p= 0,04), обратные корреляционные взаимосвязи Candida spp. с Enterobacter agglomerans (r= -0,7842, p= 0,03) и Enterobacter asburial (r= -0,8623, p= 0,01).
У 42,4% больных группы Csp- и у 82,5% пациентов группы Csp+ при бактериологическом исследовании был выявлен рост колоний дрожжевых грибов в полости рта (р<0,01). Уровень адгезивной активности микромицетов, выявленных в полости рта, был достоверно более высоким у пациентов группы Csp+ (таблица 5).
Таблица 5
Данные бактериологического исследования дрожжевых микромицетов в материале из полости рта у пациентов ЯК с разным уровнем пролиферации микромицетов
| Показатель | Группа Csp-, n=40 | Группа Csp+, n=63 | р | |
| Частота выявления роста грибов рода Candida в полости рта, абс.(%) | 17 (42,5%) | 52 (82,5%) | <0,01 | |
| Виды грибов рода Candida, абс(%) | Candida albicans | 14 (35%) | 40 (63,5%) | <0,05 |
| Candida tropicalis | 4 (10%) | 4 (6,4%) | >0,05 | |
| Candida glabrata | 3 (7,5%) | 15 (23,8%) | <0,05 | |
| Candida krusei | 0 | |||
| СИА, буккальный эпителий, M±s, АКС | 5,66±1,60 | 5,39±1,23 | >0,05 | |
| СИА кишечный эпителий, M±s, АКС | 2,33±0,7 | 6,16±0,17 | <0,01 | |
У пациентов группы ЯК Csp+ гены Candida albicans в биоптатах и антрального отдела, и прямой кишки были обнаружены в 100% случаев. У пациентов с ЯК в группе Csp- гены Candida albicans определялись в биоптатах антрального отдела желудка у 48,6% и у 56% пациентов в биоптатах из прямой кишки. В биоптатах антрального отдела и в биоптатах из прямой кишки в обеих группах преобладали гены Sap 2. Гены Hwp1, кодирующий активность гифальной формы дрожжевых грибов Candida albicans, у пациентов группы Csp- в биоптатах антрального отдела желудка были выявлены у 16,7% больных, у пациентов группы Csp+ - у 72,9% пациентов (2=21,39, р0,01). В биоптатах из прямой кишки данные гены выявлялись в 20% случаев у пациентов группы Csp- и в 56% у пациентов группы Csp+. Выявление генов адгезии Alp7 у пациентов с ЯК было невысоким и в группе Csp-, и в группе Csp+.
При корреляционном анализе были выявлены прямые связи между наличием генов адгезии и инвазии Candida albicans в биоптатах слизистой оболочки желудка (гены Hwp1, r=0,6549, p=0,012) и прямой кишки (гены Sap2, r= 0,7769, p=0,002) и количеством микромицетов в фекалиях; прямые корреляционные взаимодействия между наличием генов Candida albicans в биоптате желудка и выраженностью адгезии грибов рода Candida, выделенных из кала (Sap2 и выраженность адгезии к кишечному эпителию (r=0,7886, p=0,004), Hwp1 и выраженностью адгезии к кишечному эпителию (r= 0,60259, p= 0,02)). Выявление генов Alp7 в биоптатах у пациентов с ЯК было достоверно более редким в сравнении с пациентами ЯБ, получившими курс эрадикационной терапии (2=73,01, р0,001 для биоптатов антрального отдела и 2=9,29, р<0,01 для биоптатов из прямой кишки).
Использование глюкокортикоидных гормонов для лечения пациентов с воспалительных воспалительными заболеваниями кишечника (ВЗК) является частью стандартных схем терапии при данной патологии. Глюкокортикостероиды (ГКС) были и остаются основными средствами для лечения пациентов при среднетяжелом и тяжелом течении ВЗК, в случае неэффективности салазопрепаратов. Недостатком схем лечения ВЗК являются большое число противопоказаний и осложнений, особенно связанных с длительным приемом ГКС. Снижение дозы ГКС и сохранение небольшой поддерживающей дозы занимает длительный период времени, так как при экзогенном введении ГКС внезапное прекращение приема часто способствует развитию осложнений. С нашей точки зрения представлялось необходимым изучение влияния лечения ГКС на уровень пролиферации дрожжевых грибов в кишечнике.
Характер изменений кишечного биотопа в группах ГКС+ и ГКС- был подобен выявленным дисбиотическим изменениям при обследовании всей группы пациентов с ЯК: наблюдали снижение среднего количества представителей бифидофлоры, лактобацилл, бактероидов, кишечной палочки с неизмененными свойствами, увеличение количества кишечной палочки с измененными свойствами и представителей УПМ. У пациентов группы ГКС+ наиболее часто выявляемым представителем УПМ были дрожжевые грибы (обнаружены в 63,9% случаев), у пациентов группы ГКС- частота выявляемости дрожжевых грибов была такой же, как и некоторых других условно-патогенных представителей УПМ. Других достоверных различий по спектру выявленных микроорганизмов не обнаружено.
Количество грибов рода Candida, по данным бактериологического исследования кала, достоверно выше было в группе пациентов, получающих лечение препаратами ГКС: количество выделенных Candida spp. составило + 4,66±0,41 Lg КОЕ/г, в группе ГКС- 3,66±0,810 Lg КОЕ/г (р<0,05) (таблица 6). У пациентов, получающих терапию ГКС, сочетания различных представителей УПМ и грибов рода Candida были обнаружены достоверно чаще: у пациентов группы ГКС+ сочетания представителей УПМ выявлены в 50,7% случаев, у пациентов группы ГКС- только у 18,0% пациентов (2=16,1, р<0,01). Наиболее часто встречались сочетания представителей Enterobacter spp. и Candida spp., Klebsiella spp.и Candida spp.
Была определена частота встречаемости различных видов грибов рода Candida в кале и полости рта в группах ГКС+ и ГКС- у пациентов с язвенным колитом (таблицы 6, таблица 7). В кале у пациентов в обеих группах среди представителей Candida spp. преобладал вид грибов Candida albicans. У пациентов группы ГКС+ частота встречаемости представителей видов не albicans составила 29,9%, преобладал вид Candida glabrata. У 5,75% группы ГКС+ были выявлены колонии двух видов Candida spp. У пациентов группы ГКС- виды грибов не-albicans встречались реже (таблица 6). У пациентов в группе ГКС+ уровень адгезии клеток Candida spp., выделенных из кала к клеткам кишечного эпителия был выше, чем у пациентов группы ГКС- соответствовал высоким адгезивным свойствам дрожжевых микромицетов (р<0,01) (таблица 6). При этом у 69 пациентов (79,3%) отмечены высокие адгезивные свойства микромицетов (СИА <10 АКС). Адгезивные свойства видов грибов не-albicans у пациентов, получающих ГКС, соответствовали высокой степени адгезии (таблица 6).
Таблица 6
Результаты бактериологического исследования Candida spp. в фекалиях у пациентов с язвенным колитом, получающих различную базисную терапию
| Показатель | Группа ГКС+, N=136 | Группа ГКС-, N=50 | р | |
| Частота выявления грибов рода Candida в фекалиях, абс (%) | 87(63,97%) | 14(28%) | <0,01 | |
| Количество грибов рода Candida, M±s, -Lg КОЕ/г | 4,66±0,41 | 3,66±0,81 | <0,05 | |
| Виды грибов рода Candida, абс (%) | Candida albicans | 61(70,1%) | 13 (92,8%) | <0,05 |
| Candida tropicalis | 10 (7,4%) | 0 | >0,05 | |
| Candida glabrata | 19(21,8%) | 1 (7, 2%) | >0,05 | |
| Candida krusei | 2 (2,2%) | 0 | >0,05 | |
| Выявление 2-х видов грибов, абс(%) | 5 (5,75%) | 0 | >0,05 | |
| СИА буккальный эпителий, M±s, АКС | 9,7±0,9 | 8,16±0,19 | <0,05 | |
| СИА кишечный эпителий, M±s, АКС | 11,4±0,8 | 9,28±0,95 | <0,01 | |
| Candida albicans, СИА кишечный эпителий, M±s, АКС | 11,9±0,46 | 9,34±0,85 | < 0,01 | |
| Не-Candida albicans, СИА кишечный эпителий, M±s, АКС | 10,5±0,65 | 7,6±1,1 | < 0,01 | |
При анализе данных бактериологического исследования материала полости рта было установлено, что у пациентов ЯК в обеих группах в полости рта преобладали виды Candida albicans, но у пациентов, получающих ГКС, в 28,9% случаев выявлены грибы вида Candida glabrata, что не отмечалось в группе ГКС- (2=4,31, р<0,05). У пациентов группы ЯК ГКС+ в полости рта в 22,5% случаев выявлены сочетания грибов рода Candida – преобладало сочетание Candida albicans и Candida glabrata. У пациентов в группе ГКС+ дрожжевые грибы, обнаруженные в полости рта, обладали средними адгезивными свойствами (таблица 7). Адгезивные свойства грибов видов не-albicans достоверно не отличались от свойств грибов вида Candida albicans.
Данные анализа генов адгезии и инвазии грибов рода Candida в биоптатах слизистой оболочки желудка и прямой кишки у пациентов ЯК в группах ГКС+ и ГКС- представлены в таблицах 8 и 9. В группе ГКС+ гены Candida albicans в биоптатах антрального отдела желудка определялись у всех пациентов, у 64,3% пациентов присутствовали два гена. В группе ГКС- гены дрожжевых микромицетов Candida albicans были выявлены у 47,2% больных – выявлялись значительно реже, чем у пациентов в группе ГКС+ (р<0,01), два гена одновременно выявлены у 8,3% пациентов (таблица 8). Детекция генов Candida albicans Sap 2 и Hwp1в биоптатах из прямой кишки в группе ГКС+ была более частой, чем у пациентов группы ГКС- (р<0,05) (таблица 9).
Таблица 7
Данные бактериологического исследования Candida spp. в материале соскоба из полости рта у пациентов с язвенным колитом, получающих различную базисную терапию
| Показатель | Группа ГКС+, N=70 | Группа ГКС-, N=33 | р | |
| Частота выявления Candida spp., абс (%) | 49(70%) | 20(60,1) | <0,05 | |
| Виды грибов рода Candida, абс (%)* | Candida albicans | 40 (81,6%) | 14 (70%) | >0,05 |
| Candida tropicalis | 4 (8,2%) | 4 (20%) | <0,05 | |
| Candida glabrata | 16 (28,9%) | 2 (10%) | <0,05 | |
| Candida krusei | 0 | 0 | <0,05 | |
| Выявление 2-х видов грибов | 11 (22,5%) | 0 | 0 | |
| СИА буккальный эпителий, АКС | 5,76±1,41 | 4,33±2,06 | <0,05 | |
| СИА кишечный эпителий, АКС | 5,83±1,7 | 6,2±2,56 | <0,05 | |
Таблица 8
Частота выявления генов Candida albicans, кодирующих синтез факторов агрессии и инвазии, в биоптатах антрального отдела желудка в группах пациентов, получающих различную базисную терапию
| Гены | Группа ГКС+, n=69 | Группа ГКС-, n=36 | 2 | p |
| Sap 2 | 62 (89,9%) | 11 (30,6 %) | 39,26 | <0,05 |
| Hwp1 | 52 (75,4%) | 8 (22,2%) | 27,28 | <0,01 |
| Аlp7 | 8 (11,6%) | 1 (2,8%) | 2,35 | <0,05 |
| Гены Candida albicans не выявлены | 0 | 19 (52,8%) | 44,46 | <0,01 |
Таблица 9
Частота обнаружения генов грибов Candida albicans, кодирующих синтез факторов агрессии и инвазии, в биоптатах из прямой кишки у пациентов ЯК в группах пациентов, получающих различную базисную терапию
| Гены | Группа ГКС+, N=30 | Группа ГКС-, N=20 | 2 | p |
| Sap 2 | 20 (66,7%) | 7 (35,0%) | 4,844 | <0,05 |
| Hwp1 | 15 (50,0%) | 4 (20,0%) | 4,584 | <0,05 |
| Аlp7 | 5 (16,7%) | 0 | 3,704 | >0,05 |
| Гены Candida не выявлены | 2 (6,7%) | 9 (45,0%) | 10,276 | <0,01 |
Таким образом, у пациентов с ЯК при анализе данных бактериологического исследования фекалий было выявлено изменение композиции кишечной флоры, уменьшение количества представителей облигатной флоры и увеличение количества представителей комменсальной флоры и ассоциаций УПМ. У 54,3% пациентов с язвенным колитом обнаружена избыточная пролиферация грибов рода Candida в кишечнике. При этом у пациентов с выявленным избыточным ростом грибов рода Candida в фекалиях достоверно чаще, чем у пациентов с уровнем микромицетов в фекалиях 3-LgКОЕ/г выявлены симптомы кишечной диспепсии, которые прямо и достоверно коррелировали с уровнем пролиферации дрожжевых микромицетов в кале. Данное обстоятельство значительно затрудняло диагностику неинвазивного кандидоза кишечника, основанную на триаде признаков, таких как наличие синдрома кишечной диспепсии, наличие лабораторно подтвержденного дефицита облигатной микрофлоры кишечника при посеве кала, избыточного роста Candida spp. в фекалиях свыше 1000 КОЕ/г, необходимых для установления данного патологического состояния (Климко Н.Н., 2001). У пациентов с ЯК дрожжевые микромицеты, выявленные в фекалиях и полости рта, обладали высокими патогенными и вирулентными свойствами, что подтверждалось данными и микробиологического, и молекулярно-генетического исследования. Назначение терапии ГКС способствовало увеличению факторов патогенности грибов рода Candida, в том числе возрастанию их адгезивных свойств, и пролиферации видов не-albicans, как в биотопе кишечника, так и в биотопе полости рта.
Наиболее полно объясняющей дисперсию целевой переменной «содержание грибов рода Candida в кишечнике» по данным множественного регрессионного анализа для ЯК явилась следующая модель:
Y=-90,8+0,69Х1 +0,87 Х2 -0,38Х3+2,71Х4+1,05Х5+0,36Х6+17,9Х7+ 0,54Х8
Y – Содержание грибов рода Candida в кишечнике, -LgКОЕ/г
Х1 -Ложные позывы (0 –нет, 1-есть)
Х2 - Зуд в анальной области (0 –нет, 1-есть)
Х3 -Снижение аппетита (0 –нет, 1-есть)
Х4- Дуоденит (0-нет, 1-есть, умеренный, 2-выраженный)
Х5 –Количество нейтрального жира в копрограмме (0 –нет, 1-1 балл, 2 – 2 балла, 3 – 3 балла)
Х6-Содержание УПМ, в фекалиях, -LgКОЕ/г
Х7- Содержание Enterococcus faecalis в фекалиях, -LgКОЕ/г
Х8- Содержание Staphylococcus aureus в фекалиях, -LgКОЕ/г
Для этой модели высокий коэффициент множественной детерминации R = 0, 781 свидетельствует о тесной связи факторных признаков с результативным. F критерий Фишера (факт) =14,28, F критерий Фишера (таб) = 1,86, F(факт)> F (таб), p<0,001.
Как следует из данного уравнения, количество грибов рода Candida в кишечнике у пациентов ЯК увеличивалось пропорционально следующим компонентам: жалобам на ложные позывы на дефекацию и зуду в анальной области, снижению аппетита, выраженности дуоденита; содержанию УПМ в фекалиях и пролиферации представителей УПМ, обнаруженных при бактериологическом исследовании кала: Enterococcus faecalis и Staphylococcus aureus, количеству нейтрального жира в копрограмме.
Особенности кандидоза кишечника у пациентов с болезнью Крона
У больных БК на момент включения в исследования средний индекс активности по Бесту составил 241,5±5,9 баллов, что соответствовало умеренной активности процесса. Данные анализов клинической крови показали наличие умеренной неспецифической воспалительной реакции: лейкоцитоз 10,31х109/л, ускорение СОЭ до 22 мм/ч. У пациентов БК была выявлена анемия легкой степени – средний уровень гемоглобина до лечения составил 117,5±5,48 г/л. При определении иммунного статуса выявлено увеличении количества циркулирующих иммунных комплексов у 42% пациентов и количества IgМ у 95%больных. Значение иммунорегуляторного индекса (CD4/CD8) превышало референтные значения. У 56% пациентов наблюдалась увеличение индекса CD4/CD8 = 2,7±0,083.
В анализах кала на дисбактериоз у всех пациентов с БК изменения микробиоценоза толстой кишки отмечены как в анаэробной, так и в аэробной составляющей более у всех пациентов. Обнаружено снижение уровней облигатной микрофлоры: бифидобактерий (снижение на 3-4 порядка), лактобацилл (снижены на 1-2 порядка), бактероидов (снижены на 3-4 порядка), кишечной палочки с неизмененными ферментативными свойствами (снижена на 2-3 порядка). У пациентов с БК в фекалиях в большом количестве определялись представители условно-патогенной флоры в количестве >5 -Lg КОЕ/г (референтные значения < 4 -Lg КОЕ/г, увеличение более чем на 1 порядок). Представители УПМ при БК обнаружены у 65% пациентов. Преобладали представители семейства Enterobacter (выявлены Enterobacter agglomerans, Enterobacter aerogenes, Enterobacter amnigenus), Proteus vulgaris, представители Klebsiella spp. Сочетания представителей УПМ встречались у 30% пациентов. Количество грибов рода Candida определялось в значении 2,85±1,02 -Lg КОЕ/г (референтные значения 3 -Lg КОЕ/г).
Сочетания Candida spp. и УПМ при БК были выявлены у 67,7% пациентов с избыточной пролиферацией грибов в кишечнике. Наиболее часто встречались сочетания представителей Enterobacter spp. и Candida spp., Staphylococcus spp. и Candida spp. Среди представителей Candida spp. в фекалиях преобладали виды грибов Candida albicans – они встречались среди всех выявленных видов чаще, второе место занимали грибы Candida tropicalis. Колонии двух видов грибов не выявлены. У пациентов БК с избыточным ростом дрожжевых микромицетов в кишечнике определялся высокий уровень адгезии клеток грибов, выделенных из кала, к клеткам буккального и кишечного эпителия. У пациентов с БК частота встречаемости Candida albicans также была самой высокой, на втором месте обнаруживались грибы видов Candida glabrata и Candida tropicalis. Адгезивные свойства различных видов Candida spp. у пациентов с БК достоверно не отличались, что подтверждало увеличение адгезивных свойств грибов вида не-albicans у данной категории пациентов (таблица 10).
Таблица 10
Данные бактериологического исследования Candida spp. в фекалиях и материале из полости рта у пациентов с болезнью Крона
| Показатель | Фекалии, n=60 | Полость рта, n=30 | р | |
| Частота выявления грибов рода Candida, абс (%) | 24(40%) | 18(60%) | >0,05 | |
| Количество грибов рода Candida, -Lg КОЕ/г, M±s | 5,83 ± 0,67 | - | ||
| Виды грибов рода Candida, абс (%) | Candida albicanss | 14(58,3%) | 10 (56,7%) | >0,05 |
| Candida tropicalis | 6(25%) | 5 (27,8%) | >0,05 | |
| Candida glabrata | 4(16,7%) | 3 (16,7%) | >0,05 | |
| Candida krusei | 0 | 0 | 0 | |
| Выявление 2-х видов грибов | 0 | 0 | 0 | |
| СИА буккальный эпителий, АКС | 12,28±0,17 | 10,14±2,93 | <0,01 | |
| СИА кишечный эпителий, АКС | 13,25±0,17 | 10,53±1,28 | <0,01 | |
В полости рта виды грибов рода Candida были обнаружены у 60% обследованных пациентов (таблица 10). У пациентов БК в полости рта, так же как и в кале, преобладали виды грибов Candida albicans. Виды дрожжевых микромицетов не-albicans в полости рта выявлены у 44 % пациентов с болезнью Крона. У пациентов БК дрожжевые грибы, обнаруженные в полости рта, обладали высокими адгезивными свойствами как клеткам буккального эпителия, так и к клеткам кишечного эпителия.
Достоверные различия были выявлены при сравнении субъективных симптомов болезни в группах пациентов БК с различным уровнем пролиферации дрожжевых грибов в толстой кишке. У пациентов с БК и высоким уровнем пролиферации микромицетов в кишечнике отмечены более частые жалобы на недомогание (в 66,7% случаев против 55,6% в группе Csp-), раздражительность (70,8% и 52,8% соответственно, р<0,01), головокружение (83,3% против 80,6%, р<0,01).
В биоптатах антрального отдела желудка гены Candida albicans у пациентов с БК определялись у всех больных. Наиболее часто в биоптатах из антрального отдела желудка встречались гены грибов Candida albicans Sap 2 и Hwp1, частота обнаружения генов семейства Аlp (Аlp7) была более низкой. В биоптатах из прямой кишки, так же как и в биоптатах из желудка, часто встречались гены грибов Candida albicans Sap 2 и Hwp1, частота выявляемости гена семейства Аlp (Аlp7) была низкой (таблица 11).
Таблица 11
Частота выявления генов Candida albicans, кодирующих синтез факторов агрессии и инвазии в биоптатах антрального отдела желудка и прямой кишки у пациентов с болезнью Крона
| Гены | Биоптаты из желудка, n=60, абс.(%) | Биоптаты из прямой кишки, n=30, абс.(%) | 2 | р |
| Sap 2 | 49 (85,5%) | 21 (70%) | 1,58 | >0,05 |
| Hwp1 | 54 (90%) | 22 (73%) | 4,23 | 0,05 |
| Аlp7 | 16 (26,7%) | 7 (23%) | 0,116 | >0,05 |
| Гены Candida albicans не выявлены | 0 | 5 (16,7%) | 10,68 | >0,05 |
Пациентов в группе Csp+ чаще беспокоили вздутие живота, урчание в животе, повышенное газообразование, но эти различия не были достоверными. Ложные позывы, патологические примеси в кале достоверно чаще встречались у пациентов с БК в группе Csp+. У пациентов в группе Csp+ отмечался более частый стул (частота стула 65,67±11,2 раз в неделю), чем у пациентов группы Csp- (частота стула 24,3±4,7 раз в неделю, р<0,001) и частые эпизоды послаблений стула. Наличие избыточного количества грибов в кишечнике прямо коррелировало с количеством дефекаций у пациентов в неделю (r=0,6240, p=0,004), ощущением ложных позывов к дефекации (r=0,8105, p=0,004), массой тела (r=0,7347, p<0,001) (рисунок 3).
При анализе показателей индекса Беста было выявлено, что у пациентов, имеющих высокий и низкий уровень пролиферации микромицетов, достоверно различаются показатели клинической активности болезни. У пациентов группы Csp- значения индекса Беста были достоверно ниже, чем у пациентов группы Csp+, и составили 215,16±28,9 баллов против 297,17±30,6 баллов соответственно, р<0,05. Корреляционные взаимосвязи были выявлены между наличием избыточного роста и величиной индекса клинической активности заболевания (r=0,6267, p=0,004).
 Рисунок 3. Частота встречаемости симптомов кишечной диспепсии у пациентов болезнью Крона с низким и высоким уровнем грибов Candida spp. в фекалиях. По оси абсцисс - симптом заболевания в группах пациентов, по оси ординат - частота встречаемости симптома в %
Рисунок 3. Частота встречаемости симптомов кишечной диспепсии у пациентов болезнью Крона с низким и высоким уровнем грибов Candida spp. в фекалиях. По оси абсцисс - симптом заболевания в группах пациентов, по оси ординат - частота встречаемости симптома в %
Примечание: Показаны симптомы, при которых различия по частоте встречаемости в группах с разным уровнем пролиферации грибов достоверны, уровень достоверности р<0,05
Достоверных различий по показателям клинического и биохимического анализа крови у пациентов групп Csp+ и Csp- БК получено не было, в обеих группах у пациентов сохранялись явления анемии и снижение гематокрита. При иммунологическом исследовании было выявлено, что у пациентов группы Csp+ количество натуральных киллеров (CD16+), было достоверно ниже (p<0,05), чем у пациентов группы Csp– - уровень данных клеток в периферической крови составил 145,6±56,4 кл/мкл против средних значений СD16+ в группе Csp- 297,9±20,58 кл/мкл, р<0,05. Других достоверных различий при сравнении показателей иммунологического статуса у пациентов в группах с различным уровнем пролиферации дрожжевых микромицетов получено не было.
У пациентов с БК в группе Csp+ средние значения показателей облигатной составляющей микрофлоры толстой кишки достоверно не отличались от показателей, полученных у пациентов группы Csp-. У пациентов группы БК Csp+ более часто, чем в группе Csp- было выявлено уменьшение количества лактобацилл (частота встречаемости измененного показателя в группе Csp+ составила 54,7%, в группе Csp- – 16,7%, р<0,01). В группе Csp+ выявлены более частые изменения количества энтерококков в сторону снижения показателя - изменения обнаружены у 33,3% пациентов в группе Csp+ и только у 11,1% больных в группе Csp- (р<0,05).
У пациентов БК Csp+ частота встречаемости микромицетов в полости рта не отличалась от частоты встречаемости дрожжевых грибов у пациентов альтернативной группы. Выявляемость грибов в группах была высокой, адгезивная активность патогена практически одинаковой, при этом адгезивная активность грибов к клеткам эпителия соответствовала высокому уровню. Уровень адгезивной активности микромицетов, выявленных в полости рта, к клеткам буккального эпителия у пациентов группы Csp+ составил 10,25±1,7 АКС, а у пациентов группы Csp- – 10,66±3,7 АКС. Адгезивная активность грибов видов не- albicans у пациентов обоих групп была достоверно ниже, чем у вида Candida albicans (7,95±2,7 АКС на одной эпителиальной против 13,8±3,3 АКС на одной эпителиальной, р0,05). При этом были выявлены прямые сильные и достоверные корреляционные связи между количеством грибов в кишечнике и степенью их адгезии к эпителию полости рта (r= 0,7621, p= 0,04) и к кишечному эпителию (r= 0,9651, p<0,01).
Гены Candida albicans определялись у пациентов группы Csp- в биоптатах из антрального отдела желудка у всех пациентов (100%), в биоптатах из прямой кишки у 66,7%. У пациентов группы Csp+ гены грибов в биоптатах и антрального отдела, и прямой кишки были обнаружены в 100% случаев. Наиболее часто определялись гены Sap2 и Hwp1 у пациентов в обеих группах. Гены Alp7 у пациентов с БК в биоптатах из антрального отдела желудка выявлялись у 37,5% больных, в биоптатах из кишечника - в 6,7%, что было достоверно реже, чем частота встречаемости других генов (p<0,01, различия высоко достоверны). Были обнаружены прямые корреляции между наличием избыточного роста микромицетов в фекалиях и наличием генов адгезии и инвазии грибов Candida albicans в биоптатах слизистой оболочки желудка (гены Hwp1, r=0,6667, p=0,023) и прямой кишки (гены Sap2, r=0,7769, p=0,002); прямые корреляционные взаимосвязи между выраженностью адгезии грибов рода Candida, выделенных из кала и наличием генов грибов в биоптате желудка (наличие генов Sap2 и выраженность адгезии к кишечному эпителию (r=0,8052, p=0,008), наличие генов Alp7 и выраженность адгезии к кишечному эпителию(r=0,732, p=0,004)).
При анализе индекса клинической активности заболевания получены достоверные различия между группами ГКС+ и ГКС-. У пациентов, которые получали стероидные гормоны, индекс Беста был достоверно выше (группа ГКС+ 268,92 ±41,1 баллов, группа ГКС- – 193,1±27,3 баллов, р<0,01). Но достоверных различий по частоте встречаемости признаков кишечной диспепсии в группах ГКС+ и ГКС- получено не было.
Таблица 12
Данные бактериологического исследования Candida spp. в фекалиях у пациентов с болезнью Крона, получающих различную базисную терапию
| Показатель | Группа ГКС+, n=36 | Группа ГКС-, n=24 | р | |
| Частота выявления грибов рода Candida, в фекалиях, абс (%) | 19(52,8) | 5(20,8%) | <0,05 | |
| Количество грибов рода Candida, -Lg КОЕ/г, M±s | 5,75±0,67 | 2,58±1,2 | <0,01 | |
| Виды грибов рода Candida, абс (%) | Candida albicans | 9(47,4%) | 5 (100%) | <0,05 |
| Candida tropicalis | 6(31,6%) | 0 | >0,05 | |
| Candida glabrata | 4 (21%) | 0 | >0,05 | |
| Candida krusei | 0 | 0 | >0,05 | |
| СИА буккальный эпителий, M±s, АКС | 12,67±2,7 | 10,2±4,5 | >0,05 | |
| СИА кишечный эпителий, M±s, АКС | 15,6±1,9 | 10,3±2,5 | <0,05 | |
| Candida albicans, СИА кишечный эпителий, M±s, АКС | 15,9±1,94 | 10,12±0,93 | < 0,05 | |
| Не-Candida albicans, СИА кишечный эпителий, M±s, АКС | 14,7±1,45 | 8,11±2,9 | < 0,01 | |
При назначении гормональной терапии у пациентов с БК было отмечено значительное увеличение частоты обнаружения различных представителей УПМ в фекалиях (УПМ обнаружены у 83,3% у пациентов группы ГКС+ и у 37,9% пациентов группы ГКС-, p<0,05) и грибов рода Candida в избыточном количестве (обнаружены у 52,8% в группе пациентов ГКС+ и у 20,8% в группе ГКС-, p<0,01). Сочетания различных представителей УПМ и грибов рода Candida были обнаружены достоверно чаще в группе пациентов ГКС+ (у 38,8% пациентов с БК), чем в группе ГКС- (у 12,5% пациентов, р<0,01). Количественный состав и частота встречаемости представителей облигатной кишечной флоры в группах ГКС+ и ГКС- у пациентов с БК при этом достоверно не различались.
Количество грибов рода Candida в фекалиях было достоверно выше референтных показателей в группе БК ГКС+ и составило 5,75±0,67- LgКОЕ/г, в группе ГКС- 2,58±1,2- LgКОЕ/г (р<0,01) (таблица 12). Дрожжевые грибы проявляли свои высокие адгезивные свойства, подтвержденные данными бактериологического анализа (увеличение СИА) и данными цитогенетического исследования биоптатов прямой кишки (увеличение презентации генов адгезии и инвазии дрожжевых грибов в кишечнике и их сочетаний). Важно, что адгезивные свойства грибов у пациентов, получающих ГКС в схемах терапии, были высокими и достоверно превышали (р<0,01) адгезивные свойства микромицетов у пациентов, не получающих терапию ГКС (таблица 12). У пациентов с БК ГКС+ в фекалиях отмечалось значительное увеличение роста дрожжевых микромицетов видов не-albicans - видов Candida tropicalis и Candida glabrata (таблица 12). Адгезивные свойства микромицетов видов не- albicans, были сходными с адгезивными свойствами Candida albicans. Посев соскоба корня зуба на среду Сабуро и идентификация видов грибов, выделенных из ротовой полости, продемонстрировали избыточный рост грибов рода Candida у 38,9% пациентов с БК в группе ГКС+ и у 20,8% пациентов группы ГКС-, различия не были достоверными (p>0,05).
Гены грибов вида Candida albicans в биоптатах антрального отдела желудка определялись у всех больных с БК в группах ГКС+ и ГКС-. В биоптатах из прямой кишки в группе ГКС+ гены Candida albicans определялись у 93,3% пациентов, в группе ГКС- у 33,3% пациентов.
В подтверждении гипотезы о роли микробного фактора в патогенезе ВЗК, анализ данных, полученных при обследовании пациентов с БК, показал, что у всех обследованных пациентов при бактериологическом анализе кала имели место признаки нарушений композиции фекальной флоры, проявляющиеся в глубоком угнетении представительства облигатной составляющей микрофлоры и значительной пролиферации представителей - комменсалов. У 40% пациентов с БК обнаружены избыточная пролиферация грибов рода Candida в кишечнике и увеличение частоты выявления грибов видов не-albicans в фекалиях и полости рта, адгезивные свойства выявленных микромицетов соответствовали высокой степени адгезии. При назначении ГКС у пациентов с БК происходило увеличение пролиферации и возрастание патогенных и вирулентных свойств грибов Candida spp, в том числе и генов семейства Hwp. Как и у пациентов с ЯК, у пациентов с БК выявленные признаки кишечной диспепсии, являющиеся проявлением основного заболевания, достоверно чаще встречались у пациентов с избыточной пролиферацией дрожжевых микромицетов в фекалиях.
Наиболее полно объясняющей дисперсию целевой переменной «содержание грибов рода Candida в кишечнике» по данным множественного регрессионного анализа для БК явилась следующая модель:
Y=-10,03+1,49Х1+0,06Х2+1,33Х3-1,43Х4+5,23Х5- 0,53Х6+2,57Х7 +1,32Х8+1,51Х9+0,77Х10
Y – Содержание грибов рода Candida в кишечнике, -LgКОЕ/г
Х1 -Ложные позывы на дефекацию (0 –нет, 1-есть)
Х2 - Частота стула, количество раз в неделю
Х3 – Боли в животе (0-нет, 1-слабо, 2-умерен, 3-сильно)
Х4 - Количество эритроцитов в периферической крови, абс (1012/л)
Х5 - Количество моноцитов в периферической крови, абс (109/л)
Х6 - Уровень альфа -2 глобулинов в периферической крови, г/л
Х7 – Уровень триглицеридов в периферической крови, ммоль/л
Х8 - Количество переваренных растительных волокон в фекалиях (0-нет, 1 балл, 2 балла, 3 балла)
Х9 – Наличие лимфоидных фолликулов при гистологическом исследовании биоптатов (0-нет, 1-да), -LgКОЕ/г фекалий
Х10 - Содержание Enterobacter agglomerans в фекалиях, -LgКОЕ/г
Для этой модели высокий коэффициент множественной детерминации R = 0, 987 свидетельствует о тесной связи факторных признаков с результативным. F (факт) критерий Фишера =53,51, F(таб.) критерий Фишера = 1,95, F(факт)> F (таб), p<0,0001.
Из полученных данных следует, что количество грибов рода Candida в кишечнике у пациентов с БК было связано со следующими признаками: увеличение количества зависело от ложных позывов на дефекацию, частоты стула в неделю, интенсивности болей в животе, количества моноцитов в периферической крови и триглицеридов, количества переваренных волокон растительной клетчатки в фекалиях, обнаружения лимфоидных фолликулов при гистологическом исследовании биоптатов из кишечника, количества выявленных Enterobacter agglomerans при бактериологическом исследовании кала; уменьшение количества дрожжевых микромицетов было связано с уровнем эритроцитов в периферической крови и уровнем альфа 2 глобулинов.
Диагностика и лечение кандидоза кишечника
В настоящее время в повседневной клинической практике в стационарах, в поликлиниках назначение антимикотических препаратов пациентам для лечения неинвазивного кандидоза кишечника не осуществляется, а профилактическое использование средств деконтаминации грибов, даже в группах больных имеющих факторы риска развития неинвазивного кандидоза кишечника часто игнорируется. Возможно, это связано с трудностями дифференциального диагноза и определения стратегии выбора антимикотического препарата и тактики терапии. Для диагностики неинвазивного кандидоза кишечника нами был предложен индекс активности неинвазивного кандидоза кишечника (АННКИ), который на основании клинических и лабораторных данных позволяет облегчить дифференциальную диагностику кандидоносительства и неинвазивного кандидоза кишечника и сделать выбор лекарственного средства в зависимости от степени тяжести микотического процесса. Компоненты индекса для шкалирования были выбраны после оценки данных множественного регрессионного анализа.
Расчет индекса АНКК проводился для каждого больного, у которого определялся рост грибов рода Candida в кишечнике до и после проведенной терапии (таблица 13, таблица 14). На основании использования индекса АНКК была проведена дифференциальная диагностика и оценена частота встречаемости различных вариантов кандидоза кишечника у обследованных пациентов с гастроинтестинальной патологией. При первичном определении лечебного средства для деконтаминации грибов в кишечнике мы руководствовались величиной АНККИ, дальнейшая лечебная тактика основывалась на динамике данного индекса (таблица 14).
При подсчете индекса АННК учитывали данные, полученные при обследовании пациентов, у которых был выявлен рост дрожжевых микромицетов в фекалиях и тех пациентов, у которых не было избыточного роста дрожжевых микромицетов в фекалиях, но обнаружена контаминация кишечника Candida spp.
Таблица 13
Шкала оценки АНККИ
| Признак | Выраженность признака | Количество баллов |
| Количество дефекаций в течение суток | Не изменено | 0 баллов |
| На 1-3 раза больше для данного пациента | 2 балла | |
| На 4 и более раз больше для данного пациента | 4 балла | |
| Наличие симптомов кишечной диспепсии | Нет | 0 баллов |
| Слабо выраженные симптомы | 1 балл | |
| Умеренно выраженные симптомы | 2 балла | |
| Значительно выраженные симптомы | 3 балла | |
| Количество грибов при бактериологическом посеве кала, -LgКОЕ/г | Нет или не более 3 | 0 баллов |
| Более 3, но не более 4 | 2 балла | |
| Более 3 | 4 балла | |
| Адгезивные свойства грибов | СИА 0 АКС | 0 баллов |
| СИА 1-6 АКС на 1 эпителиальной клетке | 1 балл | |
| СИА 6-10 АКС на 1 эпителиальной клетке | 2 балла | |
| СИА > 10 АКС на 1 эпителиальной клетке | 4 балла | |
| Всего баллов |
Таблица 14
Оценка значений АНККИ
| Количество баллов | Интерпретация |
| 1 – 5 | Кандидоносительство |
| 5 – 10 | Неинвазивный кандидоз кишечника, легкая степень активности |
| 10 – 15 | Неинвазивный кандидоз кишечника, умеренная степень активности |
| 15 баллов | Кандида-ассоциированная диарея, тяжелый неинвазивный кандидоз кишечника |
У пациентов с ХГД до начала эрадикационной пролиферации грибов Candida spp в кишечнике не было у 63,7% пациентов, после использования антибактериальных препаратов – только у 36% больных (2= 4,07, р<0,05). Неинвазивный кандидоз кишечника до лечения встречался только у 25% пациентов с ХГД, у которых в фекалиях определялся рост грибов рода Candida, у остальных пациентов имело место кандидоносительство. После проведенной эрадикационной терапии у пациентов ХГД при выявлении пролиферации Candida spp. частота встречаемости неинвазивного кандидоза кишечника у пациентов возрастала до 44% (2=5,07, р<0,05). У пациентов с ЯБ до начала эрадикационной признаков кандидозного поражения не было у 75% пациентов, после использования антибактериальных препаратов – только у 13,3% (2=29,7, р<0,001). После лечения у пациентов с ЯБ частота встречаемости неинвазивного кандидоза при выявлении пролиферации дрожжевых микромицетов в кишечнике увеличивалась до 33,3% против 8,3% до лечения (2=16,01, р<0,001).
У пациентов с ЯК и БК частота встречаемости контаминации кишечника Candida spp. была значительно выше, чем у пациентов с патологией верхних отделов пищеварительного тракта: Candida spp. в фекалиях не определялись только у 30,1% пациентов ЯК и 28,3% пациентов с БК. При этом более чем в 50% случаев у пациентов ЯК и БК наблюдали неинвазивный кандидоз кишечника. При оценке влияния фактора риска развития кандидоза – использования глюкокортикостероидов – было выявлено, что у пациентов ЯК, в группе пациентов ГКС+ достоверно чаще, чем в группе пациентов ГКС- (67,7% против 55,9% (2=4,54, р<0,05) встречался неинвазивный кандидоз кишечника, а не кандидоносительство. У пациентов с болезнью Крона наблюдали тенденцию к увеличению случаев неинвазивного кандидоза кишечника после назначения ГКС, но достоверными эти данные не были. Следует отметить, что у пациентов с БК изначально более часто, чем во всех остальных группах обследованных пациентов выявляли признаки кандидоза кишечника - как кандидоносительство, так и неинвазивный кандидоз.
У 8 пациентов ВЗК был выявлен тяжелый неинвазивный кандидоз кишечника. Данные пациенты все получали терапию ГКС в составе базисного лечения, средняя доза преднизолона составила 33,75±5,0 мг/сутки.
При установлении диагноза неинвазивного кандидоза кишечника возникал естественный вопрос о необходимости назначения варианта терапии и разработки единой схемы терапии данного патологического состояния, позволяющей проследить динамику клинических и лабораторных показателей заболевания и улучшить качество жизни пациентов.
Трудности выработки данной схемы заключались в том, что выраженность кандидозного дисбиоза кишечника у пациентов была разной и определялась не только исходным микологическим статусом, но и нозологической формой основного заболевания, состоянием иммунной системы, длительностью приема антибактериальных или глюкокортикоидных препаратов, развитием неинвазивного кандидоза, вызванного различными видами дрожжевых микромицетов не- albicans. Пилотные исследования эффективности различных антимикотических средств на малых группах пациентов показали, что использование системных антимикотиков для лечения неинвазивного кандидоза кишечника малоэффективно, так как ограничено высокой биодоступностью данных средств и низкой концентрацией в просвете толстой кишки. Кроме того, при назначении данных препаратов у пациентов с ВЗК в условиях постоянного приема базисной терапии, в т.ч. салазосодержащими, высока вероятность развития побочных эффектов, в первую очередь, со стороны системы мочевыделения. Применение нерезорбируемых антимикотиков, например нистатина, было ограниченным из-за частого развертывания побочных эффектов препарата и усугубления клинической картины основного заболевания.
Лечение неинвазивного кандидоза кишечника пробиотическими препаратами разных групп (бифидосодержащими пробиотиками, лактосодержащими пробиотиками и антагонистам микромицетов) так же не всегда являлось высокоэффективным: эффект терапии в наших исследованиях снижался при значительной контаминации фекалий пациента Candida spp. и/или при выявлении двух и более генов вирулентности дрожжевых микромицетов посредством ПЦР в биоптатах слизистой оболочки кишечника, при длительном назначении ГКС в больших дозах, у пациентов с ВЗК при наличии выраженных нарушений моторной функции кишечника. Кроме того, был отмечен низкий антимикотический эффект ряда пробиотических препаратов на основе бифидумбактерий, что так же ограничивало использование данных средств, несмотря на их позитивный эффект в купировании симптомов диареи и улучшении микробного пейзажа толстокишечной биоты. У некоторых пациентов с болезнью Крона, кроме того, была отмечена плохая переносимость ряда антимикотических и пробиотических препаратов.
Выбор лекарственного средства производили после подсчета АНККИ по вышеприведенной шкале. Антимикотический препарат назначали пациентам с диагностированным умеренным или тяжелым неинвазивным кандидозом, пробиотические препараты назначали пациентам с неинвазивным кандидозом кишечника легкой степени тяжести. При активности 6-10 баллов пациентам назначали пробиотический препарат (препарат на основе Saccharomyces boulardii по 1 капсуле 2 раза в день 14 дней или Lactobacillus acidophilus по 2 кишечнорастворимых капсуле 2 раза в день 14 дней) – группа 2, при активности более 10 баллов до 15 баллов – нерезорбируемый антимикотический препарат натамицин 100 мг 4 раза в сутки 10 дней – группа 1. При активности АНККИ 15 баллов 8 пациентов с ВЗК получали симптоматические средства, антимикотический препарат натамицин и препарат на основе Saccharomyces boulardii одновременно в течение 10 дней. Во время апробации данного индекса для оценки эффективности терапии неинвазивного кандидоза кишечника параллельно проводилась оценка динамики клинических, лабораторных и микробиологических показателей и оценка качества жизни пациентов.
Нами было проведено исследование эффективности нерезорбируемого антимикотика натамицина и пробиотических средств. После проведенного лечения и в группе пациентов, получающих натамицин, и в группе пациентов, получающих пробиотические препараты, было отмечено улучшение клинических и лабораторных показателей: достоверно уменьшилась выраженность симптомов кишечной диспепсии; отмечено достоверное улучшение некоторых показателей композиции микрофлоры толстой кишки. В группе пациентов ЯБ и ХГД, получающих нерезорбируемый антимикотический препарат натамицин для лечения неинвазивного кандидоза кишечника умеренной степени активности, отмечено значительное уменьшение частоты встречаемости грибов рода Candida. Эффективность данного препарата составила 86,7%. После проведенной терапии АНККИ в баллах в группе пациентов ЯБ и ХГД соответствовал отсутствию кандидоза кишечника - в группе 1 АНККИ составил 4,11±0,23 баллов (исходный индекс 13,3±0,64 баллов, р<0,01). В этой группе было отмечено улучшение клинических показателей. Значительно уменьшилась частота встречаемости и интенсивность таких симптомов, как сухость кожи и волос, частые изменения настроения, боли в животе, кожный зуд, зуд в анальной области, уменьшились опрелости, достоверно уменьшилась интенсивность ложных позывов на дефекацию, патологические примеси в кале, уменьшились боли в животе, частота дефекаций. После проведенного лечения активность заболевания у пациентов ЯК, входящих в состав данной группы уменьшилась на 2,08 баллов по неполной шкале КАИ, КАИ составил после лечения 3,40±0,08 баллов против исходного значения 5,48±0,28 баллов (р<0,01). Активность заболевания у пациентов с БК также снизилась до лечения величина индекса Беста составила 215,2±11,1 баллов, после проведенной терапии -143,4±15,4 баллов (уменьшение на 71,84 балла, р<0,01). У пациентов достигнуто уменьшение колоний дрожжевых грибов, обнаруженных в фекалиях, по сравнению с данными, полученными до лечения - среднее количество выделенных в фекалиях микромицетов уменьшилось с 5,69±0,59 -LgКОЕ/г до 2,66±0,45 -LgКОЕ/г (р<0,01). При анализе данных бактериологического исследования грибов рода Candida в фекалиях у пациентов данной группы после лечения натамицином отмечено практически полное исчезновение грибов видов не Candida albicans - только у 1-го пациента (3,3%) группы 1 был обнаружен рост колоний грибов Candida tropicalis. Индекс АНКК в группе 1 у пациентов ЯК и БК уменьшился после терапии в среднем на 8,7 баллов (до лечения 12,6±0,96 баллов, после лечения 3,9±1,26 баллов, р<0,01) у 8 больных (26,7%) из группы 1, у которых сохранялся рост дрожжевых грибов после лечения, микологический статус был определен как кандидоносительство по данным АНККИ (индекс 4,88±1,79 баллов). Эффективность терапии с использованием препарата натамицин отмечена у 73,3% пациентов с поражением нижних отделов пищеварительного тракта. Нежелательных явлений во время приема препарата отмечено не было. 1 пациент с болезнью Крона отказался принимать натамицин на 7 день лечения, мотивировав отказ появлением дурноты и неприятных ощущений. При анализе данных бактериологического исследования кала у пациентов группы 1 (ЯБ, ХГД; ЯК, БК) после лечения натамицином имела место тенденция к увеличению количества облигатных представителей микробиоценоза, таких как кишечная палочка с неизмененными ферментативными свойствами, и уменьшение количества лактозонегативной и гемолитической кишечной палочки, уменьшение количества представителей УПМ. После проведенного лечения с использованием препарата натамицин у пациентов ЯБ и ХГД отмечено исчезновение грибов видов не –albicans, у пациентов ЯК и БК было обнаружено положительное действие препарата натамицин на элиминацию различных видов грибов – только у 3,3% пациентов сохранялась пролиферация в фекалиях дрожжевых грибов не-albicans после лечения.
У 80% пациентов группы 2 ЯБ и ХГД (n=20), получающих пробиотические препараты для лечения легкой степени активности неинвазивного кандидоза кишечника, была достигнута элиминация дрожжевых микромицетов. При этом отмечалось достоверное увеличение количества бифидобактерий (увеличились с 5,87±0,76 -LgКОЕ/г до 8,2±0,7 - LgКОЕ/г, р<0,01), лактобацилл (увеличение с 5,9±0,88 LgКОЕ/г до 7,76±0,76 LgКОЕ/г, р<0,01). В группе 2 у пациентов, получающих пробиотические препараты, было достигнуто более значимое улучшение клинических показателей, по сравнению с пациентами группы 1, получающими антимикотик. Симптомы кишечной диспепсии после проведенной терапии с использование пробиотика сохранялись только у 1-го пациента (5%) группы 2, в то время как у пациентов в группе 1, получающих нерезорбцируемый антимикотический препарат, симптомы кишечной диспепсии после лечения сохранялись у 5 пациентов (33,3%, 2=4,84, р0,05). После проведенной терапии в группе 2 у пациентов ХГД и ЯБ отмечено достоверное уменьшение количества дрожжевых микромицетов в фекалиях и значительное достоверное снижение индекса АНКК. После проведенной терапии АНККИ в баллах соответствовал отсутствию кандидоза кишечника - в группе 2 АНККИ составил- 4,87±0,79 баллов (исходный индекс 8,72±1,02 баллов, р<0,01). АНККИ в группе 2 ЯБ и ХГД достоверно уменьшился по сравнению с исходными данными, но уровень 4,9±1,19 баллов после лечения в группе 2 соответствовал пограничным значениям между кандидоносительством и неинвазивным кандидозом кишечника. Четкий положительный эффект при использовании пробиотических препаратов был выявлен только у 40 больных - эффективность комбинированной терапии с включением пробиотиков у пациентов ВЗК составила 61,54%.
У пациентов ЯК и БК в группе 2 (n=65), получающих пробиотические препараты с целью лечения неинвазивного кандидоза кишечника легкой степени активности, после проведенного курса терапии наблюдали уменьшение частоты встречаемости симптомов кишечной диспепсии. Достоверно уменьшилась частота встречаемости жалоб на тяжесть и боли в животе, сухость кожи и волос, кожный зуд, патологические примеси в кале, количество дефекаций в день. Активность заболевания у пациентов ЯК в группе 2 после приема пробиотиков по данным КАИ (неполная шкала) уменьшилась на 2,24 балла (с 5,54±0,19 баллов до 3,30±0,08 баллов, р<0,01,). У пациентов группы 2 с БК после лечения индекс Беста снизился с 238, 17±4,4 баллов до 141,37±10,5 баллов, р<0,01 (уменьшение индекса Беста на 96,8 баллов). Количество грибов рода Candida после проведенной пробиотической терапии снизилось до 4,1±0,17 -LgКОЕ/г против 4,52±0,27 -LgКОЕ/г до лечения (р<0,05). При анализе бактериологического исследования фекалий было выявлено, что у пациентов группы 2 сохранялся рост колоний грибов видов не-Candida albicans, при этом сохранялась средняя адгезивная активность патогена. Следует отметить, что, несмотря на клиническое улучшение в группе 2, в 55,38% случаев сохранялся рост колоний грибов рода Candida в кишечнике, рост колоний дрожжевых микромицетов был избыточным у 24,6% пациентов. У этих пациентов с сохраняющимся избыточным ростом грибов рода Candida отмечено снижение адгезивных свойств грибов по сравнению с исходными - АНККИ составил 6,18±0,78 баллов, что было меньше по сравнению с данными, полученными у пациентов группы 2 до лечения (АНККИ до лечения в группе 2 составил 8,86±0,76 баллов, р<0,05), но соответствовало сохраняющемуся неинвазивному кандидозу кишечника. При использовании пробиотических средств у пациентов ЯБ и ХГД рост дрожжевых микромицетов не-albicans в фекалиях после лечения не определялся. В группе 2 у пациентов ЯК и БК у 8 больных (12,3%) сохранялась пролиферация различных видов дрожжевых грибов не-albicans. При анализе данных микробиологического исследования кала в группе 2 (ЯБ, ХГД, ЯК, БК) отмечено значимое улучшение композиции микрофлоры толстой кишки - достоверно увеличилось количество бифидобактерий, лактобацилл, кишечной палочки с неизмененными свойствами, уменьшилось количество кишечной палочки с измененными ферментативными свойствами и представителей УПМ.
У пациентов, не получающих дополнительной терапии, кроме базисной (группа 3), через 14 дней наблюдения также отмечалась положительная тенденция в клинической картине заболевания: уменьшились признаки кишечной диспепсии, уменьшились симптомы заболевания. Изменение частоты встречаемости симптомов и их интенсивности не были значительными и достоверными в группе пациентов ВЗК, что подтверждалось и умеренным, по сравнению с другими группами, изменением показателей неполной шкалы Майо у пациентов с ЯК и более медленной динамикой индекса Беста. У пациентов группы 3 было отмечено длительное персистирование симптомов неинвазивного кандидоза кишечника, пролонгирование признаков обострения заболевание. По данным бактериологического исследования кала у пациентов ВЗК через 14 дней в группе 3 отмечено усугубление имеющихся дисбиотических нарушений. Количество дрожжевых грибов у пациентов группы 3 на фоне продолжающейся терапии ГКС возросло до 4,47 -LgКОЕ/г, при этом у всех пациентов микромицеты выявлялись в избыточном количестве, у 30% пациентов сохранялся рост колоний дрожжевых микромицетов видов не- albicans.. Отмечена тенденция к уменьшению АНККИ у пациентов группы 3, через 14 наблюдения АНККИ соответствовал легкой степени неинвазивного кандидоза кишечника.
Проведенное лечение пациентов и с патологией верхних отделов пищеварительного тракта, и с патологией нижних отделов пищеварительного тракта оказало положительный эффект на клиническое течение основного заболевания и способствовало регрессии признаков неинвазивного кандидоза кишечника у большинства наблюдаемых пациентов, подтвержденное, в том числе и положительной динамикой АННКИ.
Накопленные данные об эффективности антимикотической терапии при лечении пациентов с заболеваниями пищеварительной системы позволили создать схему лечения больных с неинвазивным кандидозом кишечника. Данная схема включает несколько этапов:
Этап 1: Определение АНККИ и принятие тактического решения о назначении терапии.
При АНККИ <6 баллов лекарственные препараты не назначаются.
При АНККИ 6-10 баллов – показано назначение пробиотического препарата с антифунгальной активностью. Используют препараты на основе Saccharomyces boulardii по 1 капсуле 2 раза в сутки per os и препараты на основе Lactobacillus acidophilus по 2 кишечнорастворимые капсулы 2 раза в сутки per os.
АНККИ 10-15 баллов – показано назначение натамицина 10 дней в дозе 100мг 4 раза в сутки per os.
АНККИ >15 баллов – показано назначение комбинации натамицина и пробиотического препарата: натамицин в дозе 100мг 4 раза в сутки per os 10 дней и препараты на основе Saccharomyces boulardii по 1 капсуле 2 раза в сутки per os или препараты на основе Lactobacillus acidophilus по 2 кишечнорастворимые капсулы 2 раза в сутки per os 14 дней.
Этап 2: Повторное определение АНККИ после завершения лечения.
При АНККИ <6 баллов лекарственные препараты не назначаются.
При АНККИ 6-10 баллов – показано назначение пробиотического препарата с антифунгальной активностью. Используют препараты на основе Saccharomyces boulardii по 1 капсуле 2 раза в сутки per os и препараты на основе Lactobacillus acidophilus по 2 кишечнорастворимые капсулы 2 раза в сутки per os.
АНККИ >10 баллов – показано назначение комбинации натамицина и пробиотического препарата: натамицин в дозе 100мг 4 раза в сутки per os 10 дней и препараты на основе Saccharomyces boulardii по 1 капсуле 2 раза в сутки per os или препараты на основе Lactobacillus acidophilus по 2 кишечнорастворимые капсулы 2 раза в сутки per os 14 дней.
Этап 3: Определение АНККИ после завершения лечения.
При АНККИ <6 баллов лекарственные препараты не назначаются.
При АНККИ >6 баллов – проводят обследование пациента для исключения микологического поражения слизистых оболочек и внутренних органов и назначают консультацию клинического миколога для изучения данных обследования и выбора дальнейшей тактики ведения больного.
Важно подчеркнуть, что достаточно часто при пролонгировании факторов риска, таких как прием ГКС, длительное назначение нерезорбируемых антимикотических препаратов нежелательно из-за возможного развития побочных эффектов препарата (диареи, болей и тяжести в животе, появления и усугубления симптомов кишечной диспепсии). Данное обстоятельство совершенно неприемлемо для пациентов с патологией пищеварительной системы, у которых развертывание нежелательных явлений, связанных с приемом нерезорбируемых антимикотиков, может приводить к усугублению имеющихся подобных симптомов и ухудшению клинической картины основного заболевания. Тем не менее, риск развития кандидоза кишечника у пациентов с ВЗК длительно принимающих ГКС многократно возрастет. Нами была предложена модель профилактического лечения кандидоза кишечника и прием пробиотического препарат с целью предотвращения неинвазивного кандидоза кишечника с первого дня назначения ГКС и до окончания курса приема стероидов. Модель была апробирована у пациентов с ЯК, получающих ГКС в схемах лечения, с помощью пробиотического препарата, созданного на основе двух взаимопотенцирующих штаммов Lactobacillus acidophilus и получены сведения о ее высокой эффективности.
Больным НЯК, получающим ГКС терапию, была проведено профилактическое лечение пробиотическим препаратом на основе штаммов Lactobacillus acidophilus per os по 1 капсуле, покрытой кишечнорастворимой оболочкой, два раза в день в течение периода лечения ГКC У пациентов, получающих препарат пробиотик на основе штаммов Lactobacillus acidophilus в качестве профилактического средства через 21 день терапии индекс АНКК достоверно снизился (р<0,01). У пациентов, не получающих пробиотических препаратов с целью профилактики пролиферации дрожжевых грибов в кишечнике сохранялись высокие значения индекса, соответствующие неинвазивному кандидозу, при этом частота встречаемости дрожжевых грибов в группе пациентов, не получающих препарат увеличилась до 90% (таблица 15). Анализ спектра Candida spp. выделенных из фекалий у пациентов ЯК и БК, получающих пробиотическую терапию для профилактики неинвазивного кандидоза кишечника показал, что при длительном применении пробиотических средств происходит угнетение роста дрожжевых микромицетов, в том числе видов не- albicans.
Таблица 15
Данные бактериологического исследования Candida spp. в фекалиях у пациентов язвенным колитом до и после профилактического лечения пробиотическим препаратом на основе штаммов Lactobacillus acidophilus
| Показатель | До лечения, n=60 | На фоне лечения, 21 день группа 1, n=30 | На фоне лечения, 21 день группа 2, n=30 | |
| Частота выявления роста грибов Candida spp. при посеве кала, % | 28 (46,7%) | 6 (20%) | 27(90%) | |
| Частота выявления избыточного роста Candida spp | 23(38,3%) | нет | 21(70%) | |
| Количество Candida spp. (посев кала), -lg КОЕ/г, M+ s | 3,32±0,69 | 2,48±0,59 | 4,57±0,77 | |
| Виды грибов рода Candida, абс (%) | Candida albicans | 18(78,3%) | 6 (100%) | 12(40%) |
| Candida tropicalis | 4(17,4%) | Нет | 6(20%) | |
| Candida glabrata | 1(4,3%) | Нет | 5(16,7%) | |
| Candida krusei | нет | нет | 1(3,3%) | |
| СИА кишечный эпителий, АКС, M+ s | 9,14±1,34 | 5,38±0,56 | 13,91±3,34 | |
| АНККИ, баллы | 9,16±0,56 | 5,0±0,67 | 10,21±1,37 | |
Результаты профилактического лечения пациентов с ЯК, получающих ГКС длительно, показали антимикотическую направленность действия лактосодержащего пробиотического препараты, положительное воздействие на пролиферацию облигатных представителей кишечной флоры, редкое развитие побочных эффектов терапии и улучшение показателей облигатной оставляющей толстой кишки.
ВЫВОДЫ
- Частота обнаружения грибов рода Candida в кишечнике при заболеваниях верхних отделов пищеварительного тракта (хронический гастродуоденит и язвенная болезнь) варьирует от 25 до 35%, при этом наиболее характерным вариантом существования Candida spp. является кандидоносительство. При воспалительных заболеваниях нижних отделов пищеварительного тракта (язвенный колит и болезнь Крона) частота встречаемости грибов рода Candida в кишечнике увеличивается до 70% с преобладанием неинвазивного кандидоза кишечника, который выявляется у 50% пациентов, в то время как у остальных больных имеет место кандидоносительство.
- Назначение антибиотических средств с целью эрадикационной терапии H. pylori при хроническом гастродуодените и язвенной болезни способствует увеличению частоты встречаемости кандидоносительства и развитию неинвазивного кандидоза кишечника. У пациентов с воспалительными заболеваниями нижних отделов пищеварительного тракта увеличению частоты встречаемости неинвазивного кандидоза кишечника способствует назначение глюкокортикостероидов в схемах лечения.
- При развитии неинвазивного кандидоза кишечника ухудшается клиническое течение заболеваний верхних и нижних отделов пищеварительного тракта, а клиническая картина кишечной диспепсии у пациентов с патологией пищеварительной системы может маскировать симптомы неинвазивного кандидоза кишечника.
- При лечении антибактериальными препаратами или глюкокортикостероидами имеет место изменение видового состава грибов рода Candida не только в биотопе толстой кишки, но и других биотопах пищеварительного тракта, в частности, биотопе полости рта. Изменение видового состава Candida spp. характеризуется увеличением частоты встречаемости дрожжевых микромицетов видов не-albicans, которые в данных условиях обладают повышенными адгезивными свойствами и более устойчивы к антимикотической терапии, чем вид Candida albicans.
- Неинвазивный кандидоз кишечника, сопровождающийся увеличением адгезивных и инвазивных свойств Candida spp., у пациентов с гастроинтестинальной патологией характеризуется изменениями в видовом и количественном составе представителей кишечной микробиоты. Основными изменениями являются увеличение пролиферации условно-патогенных микроорганизмов и возникновение различных ассоциаций комменсалов на фоне снижения количества представителей облигатной микрофлоры.
- При назначении антибактериальных препаратов модификация генетических свойств дрожжевых микромицетов в биотопах пищеварительного тракта отличается увеличением презентации генов адгезии и инвазии Candida albicans, в то время как при назначении глюкокортикостероидных средств увеличивается презентация генов инвазии и генов, ответственных за морфологическую трансформацию гриба из дрожжевой формы в псевдомицелиальную.
- При использовании антимикотических средств пациентами с патологией пищеварительной системы и выявленным неинвазивным кандидозом кишечника улучшается клиническая картина основного заболевания. Нерезорбируемый антимикотический препарат натамицин, применяемый для лечения неинвазивного кандидоза кишечника, обладает высокой способностью к элиминации грибов рода Candida из кишечника и снижению их патогенных свойств. Пробиотические препараты на основе Saccharomyces boulardii и препараты на основе Lactobacillus acidophilus отличаются опосредованным антимикотическим действием за счет конкурентного антагонизма, улучшают количественный и качественный с остав микробиоценоза кишечника, что также позволяет их использовать в качестве средств профилактики неинвазивного кандидоза кишечника.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Для дифференциальной диагностики кандидоносительства и неинвазивного кандидоза кишечника рекомендуется определение индекса активности неинвазивного кандидоза кишечника. В план обследования пациентов с патологией пищеварительной системы, получающих лечение антибактериальными или глюкокортикостероидными препаратами, необходимо включать не только микробиологическое исследование фекалий, но и определение адгезивных свойств штаммов выявленных микромицетов к клеткам кишечного или буккального эпителия.
- Выбор лечебного воздействия при выявлении неинвазивного кандидоза кишечника у пациентов декретируемых групп следует осуществлять после определения степени тяжести данного патологического состояния на основании индекса активности неинвазивного кандидоза кишечника. При этом средством терапии первой линии, для пациентов с умеренной и тяжелой степенью тяжести неинвазивного кандидоза кишечника, является нерезорбируемый в кишечнике препарат натамицин, применяемый в дозе 400 мг в сутки в течение 10 дней; пациентам с легкой степенью тяжести возможно назначение пробиотиков на основе Saccharomyces boulardii по 1 капсуле 2 раза в сутки или препаратов Lactobacillus, предписываемых в стандартных дозировках в виде кишечнорастворимых капсул, в течение 14-21 дней.
- При выявлении в бактериологическом анализе кала видов грибов не-Candida albicans терапию неинвазивного кандидоза кишечника целесообразно начинать с назначения натамицина в дозе 400мг в сутки в течение 10 дней с последующим тактическим решением о прекращении антимикотической терапии, либо о дополнительном назначении пробиотического препарата в течение 10-14 дней в стандартной терапевтической дозе. Основанием для выбора терапии служит определение индекса активности неинвазивного кандидоза кишечника.
- В целях предупреждения развития неинвазивного кандидоза кишечника в условиях длительной антибактериальной или глюкокортикостероидной терапии, увеличивающей риск микотических осложнений, рекомендуется назначение пробиотических препаратов в стандартных терапевтических дозах в течение всего курса лечения.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Авалуева Е.Б. Влияние различных факторов на сроки заживления язв / Е.Б. Авалуева, Е.В. Сказываева, В.А. Горшков, В.М. Аврамова // Тез. докл. 1-ой Российской научно-практической конференции терапевтов- 1998. - С.24-25
- Авалуева Е.Б. Опыт использования первого отечественного ингибитора протонной помпы гастрозола в лечении язвенной болезни / Е.Б. Авалуева, И.С. Алимова, Е.И. Ткаченко // Сб.: «Медико-санитарные проблемы профилактики, диагностики и лечения заболеваний» - СПб: СПбГМА им. И.И. Мечникова, 2000.- С.13
- Авалуева Е.Б.Питание и кислотно-протеолитическая агрессия в желудке при дуоденальной язве / Е.Б. Авалуева, В.А. Горшков, М.О. Шабалина // Российский журнал гастроэнтерологии, гепатологии.- 2000. –Т.ХХI, №1. – С.22-26.
- Авалуева Е.Б. Опыт применения препарата «Санта-Русь» у больных с нарушениями процессов пищеварения / Е.Б. Авалуева, Г.П. Кудряшова, О.И. Медведева // Сб.: «Актуальные вопросы клинической и экспериментальной медицины» - СПб:СПбГМА им. И.И. Мечникова, 2001.-С. 64
- Авалуева Е.Б. Новые показания к назначению Хилак-форте / Е.Б. Авалуева, Г.П. Кудряшова, О.И. Медведева, Л.В. Черемухина // Тез. докл. I медико-фармацевтической ассамблеи в рамках «Аптека-Санкт-Петербург-2001» - СПб, 2001.-С.73
- Авалуева Е.Б. Побочные эффекты антихеликобактерной терапии и пути их коррекции / Е.Б. Авалуева, В.А. Горшков, Г.П. Кудряшова, И.С. Алимова, Е.В. Сказываева // Тез. докл. IX Российского национального конгресса «Человек и лекарство» - М., 2002.- С.239-240
- Авалуева Е.Б. Отдаленные результаты эрадикации Н.pylori у больных с дуоденальной язвой / Е.Б. Авалуева, И.С. Алимова, В.А. Горшков // Гастроэнтерология Санкт-Петербурга. Материалы 5-го Славяно-Балтийского Форума - 2003.- № 2-3.- С.1
- Авалуева Е.Б. Побочные эффекты на фоне проведения эрадикационной терапии у больных язвенной болезнью и способы их коррекции / Е.Б. Авалуева, И.С. Алимова, Е.В. Сказываева // Гастроэнтерология Санкт-Петербурга. Материалы 5-го Славяно-Балтийского Форума - 2003.-№ 2-3.- С.5
- Авалуева Е.Б. Возможности коррекции побочных эффектов эрадикационной терапии у больных язвенной болезнью / Е.Б. Авалуева, И.С. Алимова, Е.В Сказываева // Гастроэнтерология Санкт-Петербурга. Материалы 6-го Научного Славяно-Балтийского Форума «Санкт-Петербург-Гастро 2004» –2004.- № 2-3.- С.3
- Авалуева Е.Б. Клиническая эффективность биологической активной добавки «Fly’s» для купирования побочных эффектов антихеликобактерной терапии / Е.Б. Авалуева, Н.В. Барышникова, Е.В. Сказываева, О.И. Медведева // Материалы Санкт-Петербургской ассамблеи –2004 «Врач-Провизор-Пациент» -2004.- С.6
- Авалуева Е.Б. Клиническое значение коррекции нарушений биоценоза кишечника у больных с кислотозависимыми заболеваниями органов пищеварения / Е.Б. Авалуева, Е.И., Ю.П. Успенский, М.М. Захарченко //Экспериментальная и клиническая гастроэнтерология – 2004. -№6. – С.54-56
- Авалуева Е.Б. Коррекция диспепсических явлений препаратом «Бактистатин» у больных эрозивным антральным гастритом, получавших эрадикационную терапию / Е.Б. Авалуева, Е.В. Сказываева, Н.А. Кичигина, Л.В. Черемухина // Гастроэнтерология Санкт-Петербурга. Материалы 7-ого Международного Славяно-Балтийского научного форума «Санкт-Петербург-Гастро-2005» – 2005. - № 1-2. - С. М3 (6)
- Авалуева Е.Б. Коррекция нарушений микробиоценоза кишечника препаратом «Бактистатин» у больных эрозивным антральным гастритом, получавших эрадикационную терапию // Е.Б. Авалуева, Н.В. Барышникова, Е.В. Сказываева, Н.А. Кичигина, Е.А. Нилова // Гастроэнтерология Санкт-Петербурга. Материалы 7-ого Международного Славяно-Балтийского научного форума «Санкт-Петербург-Гастро-2005» – 2005. - № 1-2. - С. М11 (33)
- Авалуева Е.Б. Коррекция нарушений кишечного микробиоценоза пробиотиком на основе природного адсорбента / Е.Б. Авалуева, Е.И.Ткаченко, Ю.П. Успенский, Л.С. Орешко и др. // Методические рекомендации - СПб, 2005- 11с.
- Авалуева Е.Б. Сравнение динамики данных эндоскопического исследования у больных эрозивным антральным гастритом, получающих эрадикационную терапию в комбинации с препаратом «Бактистатин» / Е.Б. Авалуева, Н.А. Кичигина, Н.В. Барышникова, Е.В. Сказываева, И.А. Лоева // Гастроэнтерология Санкт-Петербурга. Материалы 7-ого Международного Славяно-Балтийского научного форума «Санкт-Петербург-Гастро-2005» – 2005. - № 1-2. - С. М59 (206)
- Авалуева Е.Б. Влияние тройной эрадикационной терапии в комбинации с препаратом «Бактистатин» на патогистологические изменения в слизистой оболочке желудка у больных эрозивным антральным гастритом / Е.Б. Авалуева, Е.В. Сказываева, Н.В. Барышникова, Н.А. Кичигина, Л.Н. Белоусова // Гастроэнтерология Санкт-Петербурга Материалы 7-ого Международного Славяно-Балтийского научного форума «Санкт-Петербург-Гастро-2005» – 2005. - № 1-2. - С. М131 (463)
- Авалуева Е.Б.Оптимизация лечения пробиотиками больных целиакией / Е.Б. Авалуева, Е.И. Ткаченко, Л.С. Орешко, Ю.А. Фоминых // Клиническое питание- 2005.- №1.- С.25-28
- Авалуева Е.Б. Эрадикационная терапия, включающая пробиотики: консенсус эффективности и безопасности / Е.Б. Авалуева, Е.И. Ткаченко, Ю.П. Успенский, М.Ю. Волков и др.// Клиническое питание- 2005.- № 1.- С. 14-20
- Авалуева Е.Б. Возможность применения синбиотиков для профилактики и купирования побочных явлений антихеликобактерной терапии / Е.Б. Авалуева, Е.В. Сказываева, Н.В. Барышникова, Н.А. Кичигина // Донозология – 2005. Экологические и медицинские проблемы возникновения донозологических и патологических состояний в условиях мегаполисов: материалы первой международной конференции / Под. Общей редакцией проф. Захарченко М.П., проф. Редько А.А. – СПб, 2005. – С. 166-168
- Авалуева Е.Б. Современные подходы и перспективы в лечении целиакии / Е.Б. Авалуева, Е.И. Ткаченко, Л.С. Орешко, Ю.А. Фоминых и др. // «Фарминдекс ПРАКТИК»- 2006- выпуск 9.- С.44-48
- Авалуева Е.Б. Использование продуктов специализированного питания в лечении заболеваний органов пищеварения, ассоциированных с метаболическим синдромом и дисбиозом кишечника / Е.Б. Авалуева, Ю.П. Успенский, Е.И. Ткаченко, Т.Н. Жигалова Н.В. Барышникова // Методические рекомендации - СПб, 2005- 11с.
- Авалуева Е.Б. Язвенная болезнь / Е.Б. Авалуева, Е.И. Ткаченко // Terra Medica- 2007 - №4.- С.3-9
- Авалуева Е.Б. Кандидозный дисбиоз как особая форма дисбиоза кишечника / Е.Б. Авалуева, М.А. Шевяков // В кн. «Дисбиоз кишечника». Руководство по диагностике и лечению /под ред. проф.Ткаченко Е.И. и проф.Суворова А.Н.– СПб:«СпецЛит», 2007.-С.63-76.
- Авалуева Е.Б. Способ коррекции нарушений психоэмоционального статуса у больных целиакией. Патент на изобретение RO2302242, зарегистрирован 10 июля 2007 г. / Е.Б. Авалуева, Л.С. Орешко, Е.И. Ткаченко, Ю.А. Фоминых // Бюлл. №19 -2007. - С.3.
- Авалуева Е.Б. Перспективы оптимизации лечения кандидоза органов пищеварения / Е.Б. Авалуева, А.Н. Суворов, Ю.П. Успенский, Н.В. Барышникова, Н.В. Матвеева // Материалы 9-ого Международного Славяно-Балтийского научного форума «Санкт-Петербург-Гастро-2007» / Гастроэнтерология Санкт-Петербурга.- 2007.- № 1-2.- С. М111-112 (395)
- Авалуева Е.Б. Ассоциация Helicobacter pylori и грибов рода Candida в слизистой оболочке желудка у больных язвенной болезнью / Е.Б. Авалуева, Е.И. Ткаченко, Н.В. Барышникова, Н.В. Матвеева, А.С. Смирнова // Приложение №1 к журналу «Экспериментальная и клиническая гастроэнтерология». Тезисы VIII съезда научного общества гастроэнтерологов России, совместной школы последипломного образования AGA и НОГР, XXXIV сессии ЦНИИГ. Москва, 4-7 марта 2008 г. - 2008. - №1. -С. 66-67
- Авалуева Е.Б. Candida species в кишечнике - клинические аспекты // Е.Б. Авалуева, М.А. Шевяков, Н.В. Барышникова // Проблемы медицинской микологии. – 2007. – Т.9, № 4. – С. 4-11
- Авалуева Е.Б. Сравнительный анализ частоты встречаемости Candida albicans в желудке и толстой кишке у больных язвенной болезнью, ассоциированной с Helicobacter pylori / Е.Б. Авалуева, Н.В. Матвеева // Гастроэнтерология Санкт-Петербурга. Материалы 10-ого Юбилейного Славяно-Балтийского научного форума «Санкт-Петербург-Гастро-2008» – 2008.- № 2-3.- С. М2 (5)
- Авалуева Е.Б. Helicobacter pylori и грибы рода Candida: взаимосвязь и генетические особенности микроорганизмов у больных язвенной болезни двенадцатиперстной кишки / Е.Б. Авалуева, А.Н. Суворов, М.А. Шевяков, Н.В. Матвеева // Гастроэнтерология Санкт-Петербурга. Материалы 10-ого Юбилейного Славяно-Балтийского научного форума «Санкт-Петербург-Гастро-2008» – 2008.- № 2-3.- С. М11-112(389)
- Авалуева Е.Б. Helicobacter pylori и Candida spp. у больных язвенной болезнью: взаимосвязь, молекулярно-генетические особенности и взаимоотношения с микробиотой кишечника / Е.Б. Авалуева, А.Н. Суворов, М.А. Шевяков, Н.В. Барышникова, Ю.П. Успенский // Проблемы медицинской микологии. – 2008. – Т.10, № 1. – С. 16-22
- Авалуева Е.Б. Объем обследования и выбор антифунгального препарата при кандидозе пищевода / Е.Б. Авалуева, М.А. Шевяков // Современная микология в России. -2008.-Т. 2.- С.505-506
- Авалуева Е.Б. Хеликобактериоз и дисбиоз желудочно-кишечного тракта: биологические и клинические проблемы сосуществования / Е.Б. Авалуева, Е.И. Ткаченко, Ю.П. Успенский, Н.В. Барышникова // Вестник СПбГМА им. И.И. Мечникова -2008.- №3 -С.115-120
- Авалуева Е.Б. Частота встречаемости грибов рода Candida у больных язвенной болезнью 12-перстной кишки, ассоциированной с Helicobacter pylori / Е.Б. Авалуева, Н.В. Барышникова, Н.В. Матвеева // Гастроэнтерология Санкт-Петербурга. Материалы XI Международного Славяно-Балтийского Форума «Санкт-Петербург-Гастро-2009» - 2009. - №2-3. - А 03
- Авалуева Е.Б. Использование БАД «Витафлор» для коррекции кишечного дисбиоза у больных с неспецифическим язвенным колитом / Е.Б. Авалуева, Е.В. Сказываева. Л.Ю. Нилова и др. // Гастроэнтерология Санкт-Петербурга. Материалы XI Международного Славяно-Балтийского Форума «Санкт-Петербург-Гастро-2009» - 2009. - №2-3. - А 04
- Авалуева Е.Б. Использование БАД «Витафлор» в форме суппозиториев в терапии больных неспецифичесикм язвенным колитом / Е.Б. Авалуева, Т.Н. Жигалова, Е.В. Сказываева и др. // Гастроэнтерология Санкт-Петербурга. Материалы XI Международного Славяно-Балтийского Форума «Санкт-Петербург-Гастро-2009» - 2009. - №2-3. - Ж101
- Авалуева Е.Б. Кандидозный дисбиоз кишечника у пациентов с неспецифическим язвенным колитом / Е.Б. Авалуева, Л.Ю. Нилова, М.А. Шевяков // Проблемы медицинской микологии. XII Кашкинские чтения. Тезисы докладов – 2009.- Т.11, №2.- С.50-51
- Авалуева Е.Б. Определение некоторых генов рода Candida у пациентов с неспецифическим язвенным колитом / Е.Б. Авалуева, Н.В. Барышникова, А.Н. Суворов // Проблемы медицинской микологии. XII Кашкинские чтения. Тезисы докладов.- 2009.- Т.11, №2.- С.51
- Авалуева Е.Б. Использование препарата «Витафлор» в терапии больных с синдромом рздраженного кишечника и язвенным колитом / Е.Б. Авалуева, Е.В. Сказываева Т.Н. Жигалова и др. // Сб.: «Исследования по приоритетным направлениям в медицине и биологии» - СПб: СПбГМА им. И.И. Мечникова, 2009.- С. 67-68
- Авалуева Е.Б. Frequency of the Candida species determinationin mucous layer of the gastroduodenal associated with Helicobacter pylori / E.Avalueva, E. Tkachenko, Y.P Uspenskiy. N.Baryshnikova, A.N. Suvorov // Гастроэнтерология Санкт-Петербурга. Materials of XXXII International Congress of the Society for Microbial Ecology and Disease (SOMED) – 2009.- №4. -107е
- Авалуева Е.Б. Использование симбиотического препарата «Витафлор» для коррекции кандидозного дисбиоза кишечника у пациентов с язвенным колитом, получающими лечение глюкокортикостероидными препаратами / Е.Б.Авалуева, М.А.Шевяков, Т.Н. Жигалова и др. // Гастроэнтерология Санкт-Петербурга. Материалы 2-го Международного конгресса по пробиотикам и 6-ой Объединенной Сессии Института гастроэнтерологии и клинической фармакологии СПбГМА им. И.И. Мечникова, ФГУП «Гос НИИОЧБ» ФМБА России «Санкт-Петербург - Пробиотики -2009» – 2009.- №4. – М1 (1)
- Авалуева Е.Б. Использование препарата «Витафлор» в схемах лечения пациентов с язвенным колитом / Е.Б. Авалуева, Е.И Ткаченко, Т.Н. Жигалова. и др. // Гастроэнтерология Санкт-Петербурга. Материалы 2-го Международного конгресса по пробиотикам и 6-ой Объединенной Сессии Института гастроэнтерологии и клинической фармакологии СПбГМА им. И.И. Мечникова, ФГУП «Гос НИИОЧБ» ФМБА России «Санкт-Петербург- Пробиотики -2009» – 2009.- №4. – М40 (143)
- Авалуева Е.Б. Частота встречаемости грибов рода Candida при язвенной болезни двенадцатиперстной кишки, ассоциированной с Helicobacter pylori / Е.Б. Авалуева, Ю.П. Успенский, М.А. Шевяков и др. // Гастроэнтерология Санкт-Петербурга. Материалы 2-го Международного конгресса по пробиотикам и 6-ой Объединенной Сессии Института гастроэнтерологии и клинической фармакологии СПбГМА им. И.И. Мечникова, ФГУП «Гос НИИОЧБ» ФМБА России «Санкт-Петербург - Пробиотики - 2009» – 2009.- №4. – М141 (146)
- Авалуева Е.Б. Адгезивные свойства грибов рода Candida у пациентов с язвенным колитом, получающих глюкокортикостероиды в схемах терапии / Е.Б.Авалуева, Ю.П.Успенский, М.А. Шевяков, Л.Ю.Нилова // Донозология – 2009. Проблемы здорового образа жизни. Материалы пятой международной научной конференции /Под. Общей редакцией проф. Захарченко М.П., проф. Щербука Ю.А. – СПб, 2009. – С. 440
- Авалуева Е.Б. Использование препарата «Витафлор» в коррекции кандидозного дисбиоза у пациентов с язвенным колитом / Е.Б.Авалуева, С.И.Ситкин, О.И.Медведева и др. // Донозология – 2009. Проблемы здорового образа жизни. Материалы пятой международной научной конференции /Под. Общей редакцией проф. Захарченко М.П., проф. Щербука Ю.А. – СПб, 2009. – С. 312
- Авалуева Е.Б. Использование белковой композитной смеси «Реалакт» для коррекции нутриционного статуса больных в гастроэнтерологической практике / Е.Б. Авалуева, Е.И.Ткаченко, С.В.Иванов // Донозология – 2009. Проблемы здорового образа жизни. Материалы пятой международной научной конференции /Под. Общей редакцией проф. Захарченко М.П., проф. Щербука Ю.А. – СПб., 2009. – С. 356
- Авалуева Е.Б. Кандидозный дисбиоз как особая форма дисбиоза кишечника / Е.Б.Авалуева, М.А.Шевяков // В кн. «Дисбиоз кишечника.». Руководство по диагностике и лечению /под ред. Проф.Ткаченко Е.И. и проф.Суворова А.Н. 2-ое изд. испр. и доп - СПб: «ИнформМед», 2009.-С 71-86
- Авалуева Е.Б. Диагностика кандидозного поражения нижних отделов пищеварительного тракта у больных с воспалительными заболеваниями кишечника / Е.Б. Авалуева, Ю.П. Успенский, М.А.Шевяков, Т.Н. Жигалова // Усовершенствованная медицинская технология - СПб, 2009.-22с.
- Авалуева Е.Б. Особенности кандидозного дисбиоза кишечника у пациентов с язвенным колитом, получающих лечении глюкокортикостероидами в схемах стандартной терапии / Е.Б. Авалуева // Ученые записки СПбГУ -2009.- Т. XVI, №4 – С. 25-28
- Авалуева Е.Б. Кандидозный дисбиоз у пациентов с воспалительными заболеваниями кишечника и адгезивные свойства Candida spp. / Е.Б. Авалуева, М.А.Шевяков, Ю.П. Успенский // Проблемы медицинской микологии -2010.- №1.- С-16 -21
- Авалуева Е.Б. Применение Энтерола в клинической практике / Е.Б. Авалуева, Е.И.Ткаченко, Е.В. Сказываева, С.И. Ситкин // Новые Санкт-Петербургские врачебные ведомости – 2010.- №1 – С.40-42
- Авалуева Е.Б. Детекция генов грибов рода Candida для диагностики кандидоза кишечника / Е.Б. Авалуева, Ю.П.Успенский, Т.Н. Жигалова, Н.В. Матвеева, М.А.Суворова // Материалы 10-го юбилейного съезда научного общества гастроэнтерологов России «Российские научные школы. Технологии качества», III совместной школы для врачей AGA и НОГР- М, 2010. – С.99-100
- Авалуева Е.Б. Saccharomyces boulardii в терапии воспалительных заболеваний кишечника / Е.Б. Авалуева, Е.И.Ткаченко, С.И. Ситкин // Материалы 10-го юбилейного съезда научного общества гастроэнтерологов России «Российские научные школы. Технологии качества», III совместной школы для врачей AGA и НОГР - М, 2010. – С.100-101
- Авалуева Е.Б. Исследование выраженности кандидозного дисбиоза у пациентов с воспалительными заболеваниями кишечника / Е.Б. Авалуева, Ю.П. Успенский, Е.А. Иванова, Т.Н. Жигалова, М.А. Суворова // Сб.: «Актуальные проблемы медицины и биологии» / под ред. акад. РАМН Шаброва, проф. В.Г. Маймулова. – СПб: СПбГМА им. И.И. Мечникова., 2010. –С.129-130
- Авалуева Е.Б. Исследование гастроинтесинального кандидозного дисбиоза у пациентов с кислотозависимыми заболеваниями верхних отделов пищеварительного тракта / Е.Б. Авалуева, М.А.Шевяков, Н.В. Барышникова, С.В. Иванов // Сб.: «Актуальные проблемы медицины и биологии» / под ред. акад. РАМН Шаброва, проф. В.Г. Маймулова. – СПб: СПбГМА им. И.И. Мечникова, 2010. – С.131-132
- Авалуева Е.Б. Изучение адгезивности при диагностике дисбактериозов / Е.Б. Авалуева Е.А. Оришак, Л.Ю. Нилова // Клинико-лабораторный консилиум. – 2010.- №1 (32). – С.49-57
- Авалуева Е.Б. Условно-патогенные микроорганизмы при дисбактериозе кишечника / Е.Б. Авалуева, Е.А Оришак., Л.Ю. Нилова, А.Г. Бойцов // Ученые записки СПбГМУ им. акад. И.П. Павлова -2010.- Т. XVII, №2. – С. 24-27
- Авалуева Е.Б. Грибы рода Candida, алкоголь, курение / Е.Б. Авалуева, М.А.Шевяков // Экология человека – 2010.- №4 – С. 46-53
- Авалуева Е.Б. Использование Saccharomyces boulardii при лечении больных воспалительными заболеваниями кишечника / Е.Б. Авалуева, Ю.П. Успенский, Е. И. Ткаченко, С. И. Ситкин // Экспериментальная и клиническая гастроэнтерология. – 2010.- №7 - С. 54-60
СПИСОК ИСПОЛЬЗОВАННЫХ СОКРАЩЕНИЙ
ЯБ- язвенная болезнь
ХГД- хронический гастродуоденит
ВЗК –воспалительные заболевания кишечника
ЯК- язвенный колит
БК – болезнь Крона
5-АСК – 5-аминосалициловая кислота
ГКС-глюкокортикостероидные средства
ПЦР- полимеразная цепная реакция
СИА- средний индекс адгезии
АКС- адгезированные клетки Candida spp.
ДПК- двенадцатиперстная кишка
СОЖ-слизистая оболочка желудка
СОЛДПК-слизистая оболочка луковицы двенадцатиперстной кишки
СОПР – слизистая оболочка полости рта
СОР- слизистая оболочка прямой кишки
H.pylori - Helicobacter pylori
E.coli - Escherichia coli i
АНККИ- индекс активности неинвазивного кандидоза кишечника
КОЕ/г- колоний образующие единицы на 1 грамм фекалий
Sap 2 – secreted aspartyl protease
Hwp- hyphal wall protein
Alp – agglutinin-like protein
УПМ- условно-патогенные микроорганизмы

