Анатомо-физиологическая характеристика фоторегуляции морфогенеза проростков яровой пшеницы
На правах рукописи
Касаткин Михаил Юрьевич
АНАТОМО-ФИЗИОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА
ФОТОРЕГУЛЯЦИИ МОРФОГЕНЕЗА ПРОРОСТКОВ ЯРОВОЙ ПШЕНИЦЫ
03.00.05 - ботаника
Автореферат диссертации на соискание ученой степени
кандидата биологических наук
Саратов — 2007
Работа выполнена в Государственном образовательном
учреждении высшего профессионального образования
«Саратовский государственный университет им. Н.Г. Чернышевского»
на кафедре микробиологии и физиологии растений
| Научный руководитель: | доктор биологических наук, профессор Степанов Сергей Александрович |
| Официальные оппоненты: | доктор биологических наук, профессор Кашин Александр Степанович |
| кандидат биологических наук Калинина Алла Владимировна | |
| Ведущая организация: | ГОУ ВПО «Саратовский государственный аграрный университет им. Н.И. Вавилова» |
Защита состоится 25 мая 2007 г. в 10.00 часов на заседании диссертационного совета Д 212.243.13 при Государственном образовательном учреждении высшего профессионального образования «Саратовский государственный университет им. Н. Г. Чернышевского» по адресу: 410012, г. Саратов, ул. Астраханская, д. 83, e-mail: [email protected]
С диссертацией можно ознакомиться в Зональной научной библиотеке ГОУ ВПО «Саратовский государственный университет им. Н. Г. Чернышевского».
Автореферат разослан «20» апреля 2007 г.

Учёный секретарь
диссертационного совета С. А. Невский
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Выяснение принципов, лежащих в основе морфогенеза, является одной из фундаментальных проблем ботаники. Важнейшим морфогенетическим фактором внешней среды является свет (Iino, 1990; Briggs, Olney, 2001). Вопрос об основных фоторецепторных системах, воспринимающих действие максимально активных участков спектра и последующей реакции на данный фактор, имеет большое значение.
Фоторегуляторная система на начальных этапах онтогенеза представлена в основном фитохромом. Изучение фитохромной системы в настоящее время посвящено, в основном, выяснению общих принципов функционирования фоторегуляторной системы, представленной этим пигментом, в то время как ее распределение в растительных тканях и локализация световоспринимающих структур в органе стало новым и перспективным направлением в научных исследованиях (Федоренко, Савушкин, 2006; Mandoli, Briggs, 1982; Wang, Iino, 1997). Большинство предложенных моделей функционирования фоторегуляторных систем носят либо теоретический характер, либо существенно абстрагированы, и построены на основании данных опытов с различными систематическими группами растений (Deny, Roenneberg, 1997).
Для оценки морфогенетических эффектов действия света чаще используют апикальную часть колеоптиля злаков как систему чувствительную к интенсивности и качеству света (Lokhard, цит. по Кефели, 1973). При этом стремились выяснить первичные изменения, происходящие в апикальной структуре колеоптиля, последовательность физиологических и биохимических процессов, трансформирующих световой сигнал в морфогенетический эффект (Mandoli, Briggs, 1982). Наиболее удобной модельной системой для изучения фоторецепции и светопроводимости, их вклада в морфогенез растения являются проростки пшеницы.
Цель и задачи исследования. Основной целью работы являлось выявление анатомо-физиологических особенностей фоторегуляции морфогенеза проростков пшеницы. Для достижения поставленной цели решались следующие задачи:
1. Установить морфолого-анатомические особенности морфогенеза проростков пшеницы при наличии и отсутствии света.
2. Выявить специфику роста колеоптиля и эпикотиля при прорастании зерновок пшеницы на различной глубине почвенного слоя.
3. Определить оптические свойства колеоптиля и эпикотиля при наличии и отсутствии светового фактора.
4. Выявить влияние времени и порядка активации пигментных систем колеоптиля и эпикотиля на морфогенез проростка пшеницы.
5. Провести оценку видовых и сортовых особенностей анатомии эпикотиля пшеницы.
Научная новизна работы. Впервые показана cпецифичность ростовых процессов колеоптиля, эпикотиля и зародышевых листьев главной почки проростка в зависимости от действия светового фактора и механического давления почвы. В колеоптиле проростка пшеницы представляется возможным выделить с позиции его светопроводящей функции три зоны, различающихся анатомически и функционально: зоны восприятия, проведения и реализации поступающего света. Впервые показано, что светопроведение осуществляется двумя основными потоками — тканями проводящих пучков и тканями паренхимы. В онтогенезе проростка пшеницы выявлено изменение светопропускной способности колеоптиля. Установлено, что общее количество света, проходящего до апикальной меристемы этиолированного проростка, постоянно и не зависит от линейных размеров колеоптиля. Впервые представлена спектральная характеристика тканей колеоптиля и эпикотиля, показавшая наличие в них нескольких функционирующих пигментных систем.
При изучении видовых и сортовых особенностей эпикотиля показано большое разнообразие его анатомического строения и морфометрических параметров. Более консервативным органом по анатомическому строению у изученных видов и сортов является колеоптиль.
Теоретическое и практическое значение. Полученные сведения вносят вклад в изучение морфологии, анатомии и физиологии важнейшей сельскохозяйственной культуры – пшеницы. Эти данные могут быть использованы для теоретического исследования морфогенеза растений, а также в селекционных работах для оценки перспективности сортов. Проведенный анализ ското- и фотоморфогенеза проростков пшеницы открывает перспективы для выявления условий целенаправленной регуляции роста и развития пшеницы, в решении вопросов, связанных с механизмами фоторецепции света и реакцией на него эффекторных структур, коррелятивных взаимоотношений между органами на уровне целого растения.
Результаты исследований включены в курсы лекций по анатомии, физиологии растений. Они используются также при проведении лабораторных практикумов, выполнении курсовых и дипломных работ на биологическом факультете Саратовского государственного университета им. Н.Г. Чернышевского.
Основные положения, выносимые на защиту:
1. Условия прорастания зерновок пшеницы (наличие или отсутствие света, глубина посева семян) влияют на морфогенез колеоптиля, эпикотиля, первого – третьего зародышевых листьев.
2. Существуют различия оптических свойств колеоптиля и эпикотиля, обеспечивающие последовательность морфогенеза проростков пшеницы.
3. Наблюдаются видовые и сортовые различия анатомического строения эпикотиля.
Апробация работы. Основные результаты исследований представлены на: XXXV Международной научной студенческой конференции (апрель 1997 г., Новосибирск), Международной научной конференции (ноябрь 1997 г., Саратов), II(X) съезде русского ботанического общества (26-29 мая 1998 г., Санкт-Петербург), конфеpенции молодых ученых и аспиpантов по пpоблемам физиологии и биохимии pастений (Саpатов, 1998), V съезде общества физиологов растений России, (Пенза, 2003 г).
Публикации. По материалам диссертации опубликовано 14 работ.
Декларация личного участия автора. Автор лично провел полевые и лабораторные эксперименты, осуществил сбор объектов, провел морфометрические, анатомические и микроспектрофотометрические исследования. Обработка полученных данных, их интерпретация, оформление проведены автором самостоятельно. В совместных публикациях вклад автора составил 50-80%.
Структура и объем диссертации. Работа изложена на 169 страницах, состоит из введения, 6 глав, выводов и приложения. Список цитированной литературы включает 241 источника, из которых 99 иностранных авторов. Работа содержит 6 таблиц и 53 рисунков.
Содержание работы
Во введении обосновывается актуальность исследования, его практическая и теоретическая значимость; сформулирована основная цели, задачи и пути их реализации.
Глава 1. ФИЗИОЛОГИЧЕСКИЕ АСПЕКТЫ РОСТА И РАЗВИТИЯ ПРОРОСТКА ПШЕНИЦЫ ПОД ДЕЙСТВИЕМ ВНЕШНИХ ФАКТОРОВ
(обзор литературы)
В данной главе на основании анализа отечественной и зарубежной литературы рассматриваются вопросы морфологического и анатомического строения проростка пшеницы, фоторегуляции процессов органогенеза, оптических свойств тканей, особенности фотоморфогенеза злаков на этапе прорастания растений и влияние на их рост механических нагрузок. Особое внимание уделено вопросам светопроводимости растительных тканей и их роли в морфогенезе растений. Показана взаимосвязь механических нагрузок с действием светового фактора.
Глава 2. ОБЪЕКТЫ ИССЛЕДОВАНИЙ И МЕТОДЫ
Исследования проводились в лабораторных условиях, а также в полевых мелкоделяночных опытах селекционного севооборота НИИСХ Юго-Востока в течение ряда лет (1997-2000, 2002-2006 гг.). Объектом изучения являлись виды (T. durum, T. aestivum, T. dicoccum и T. spelta) и сорта яровой пшеницы (Лютесценс 62, Нададорес 63, Саратовская 29, Саратовская 36, Саратовская 52, Саратовская 56, Саратовская 40, Омский корунд, Мелянопус 69, Елизаветинская, Зарница Алтая, Безенчукский янтарь, Гордеиформе 432, Крассар, Золотая волна, НИК).
Морфометрическое изучение органов растений выполнено путем препарирования их и измерения исследуемых параметров с помощью окуляр-микрометра МБС-9. Объём выборки при статистической обработке каждой из исследуемых проб составлял 20 растений. Абсолютная скорость роста колеоптиля, эпикотиля и листьев определялась по формуле С=L2-L1/ t2-t1, где L2 и L1 длина исследуемого органа или его части в моменты времени t2 и t1 (Williams, 1975). Площадь пластинки первого листа проростков пшеницы определялась по формуле S=2/3Lh, где L — длина пластинки, h — ширина пластинки в средней части (Аникеев, Кутузов, 1961). Для определения анатомического строения колеоптиля и эпикотиля проростков указанных сортов пшеницы осуществляли их фиксирование в слабом растворе Навашина в течение 24-48 ч (Прозина, 1960). Число n=10. Поперечные и продольные срезы были приготовлены по общепринятой методике и окрашены гематоксилином Гейденгайна и альциановым синим (Дженсен, 1965).
Для исследования влияния механического давления на проростки пшеницы Саратовская 29 опыты проводились в специальной установке, представляющей собой ёмкость с почвой и специальным фиксатором, в который для создания влажной камеры помещались перевернутые пробирки. Давление создавалось прозрачными грузиками из органического стекла весом 2 и 4 г. Число n = 7-10.
Изучение оптических свойств колеоптиля проводилось в соответствии с методикой D.F. Mandoli, W.R. Briggs (1982) на специально сконструированной нами установке, состоящей из источника света, фиксирующего колеоптиль устройства, оптического волокна с диаметром светопроводящей жилы 600 мкм, бинокулярного микроскопа МБС–9, микроманипулятора, оптико-волоконного зонда и фотоэлектронного умножителя. Источником света служил осветитель ОИ-19 мощностью 100 Вт, образующий с системой линз и диафрагм устройство с фокусным расстоянием 13±1,1 мм, которое фокусировало световой поток непосредственно на одножильное оптическое волокно с диаметром светопроводящей жилы 600 мкм. Другой конец этого волокна был соединен с фиксирующим колеоптиль приспособлением, крепившимся на предметном столике бинокулярного микроскопа. Интенсивность прошедшего через ткани колеоптиля света определяли с помощью оптико-волоконного зонда, присоединенного к фотоэлектронному умножителю ФЭУ–68 со спектральной чувствительностью, лежащей в области 300–820 нм. Перемещение оптико-волоконного зонда осуществляли посредством микроманипулятора, фиксирующего свое положение в 3-х плоскостях. Контроль за перемещением оптико-волоконного зонда проводился наблюдением в бинокулярный микроскоп. Число n =5-7. Приготовление оптико-волоконного зонда осуществлялось согласно методике (Vogelmann, 1985, 1988). Основным объектом исследования являлся сорт Саратовская 29.
Исследование спектральных характеристик проводили по методике цитофотометрических исследований (Безрукова, Владимирская, 1982). Число повторностей каждого варианта опыта 5-7. Источником света служила галогеновая лампа накаливания мощностью 75 Вт. Пучок света большой степени монохроматичности (±2 нм) подавался на микроскоп МББ–1А. Для получения света с узкой длиной волны использовался монохроматор спектрофотометра SPEKOL 11. Системой диафрагм микроскопа и его конденсором пучок света, непосредственно освещающий препарат, центрировался относительно входного отверстия объектива. Визуальный контроль за перемещением препарата и регистрация прошедшего света осуществлялись с помощью бинокулярной насадки АУ–26. Регистрация интенсивности света, прошедшего через препарат, достигалась с помощью специального переходника. Отсчёт интенсивности света проводился по величине фототока на микроамперметре М93. Для увеличения чувствительности метода и уменьшения ошибок эксперимента, после нахождения и установки нужного участка препарата второй окуляр насадки закрывался светонепроницаемым колпачком. Для более точной дифференциации оптических свойств различных тканей проростка нами было внесено усовершенствование в стандартную цитофотометрическую установку: между фоточувствительной поверхностью ФЭУ и выходным отверстием окуляра помещалась изменяемая ирисовая диафрагма. Видимая область на препарате, ограниченная отверстием диафрагмы, юстировалась и контролировалась во время эксперимента линейкой во втором окуляре насадки.
Фотографии получены при помощи цифровой камеры-окуляра для микроскопа SCOPETEK, модель DСМ35. Морфометрические параметры анатомических структур на постоянных препаратах (линейные размеры и площадь) оценивались по их оцифрованным изображениям в графическом редакторе Gimp-2.2.13 для FreeBSD. Предварительно количество точек растра фотографии препарата, снятом при определённом разрешении, сопоставлялось с истинными размерами объект-микрометра.
Результаты исследований подвергались статистической обработке по Б.А. Доспехову (1985) и П.Ф. Рокицкому (1973) в табличном процессоре scalc пакета OpenOffice.org 2.1 и специализированного математического программного обеспечения Scilab-3.1.1 для операционной системы FreeBSD 6.1.
Глава 3. ФОТОМОРФОГЕНЕЗ ПРОРОСТКОВ ПШЕНИЦЫ
Анализ особенностей роста колеоптиля и эпикотиля проростков твёрдой (Мелянопус 69, НИК) и мягкой пшеницы (Саратовская 36, Саратовская 58) в полевых условиях указывает на различие по годам в динамике ростовых процессов этих органов. Тем не менее наблюдается определенная последовательность в росте колеоптиля и эпикотиля. В частности, выявлено, что активный рост эпикотиля, как правило, происходит в момент завершения роста колеоптиля. В это же время быстро растет пластинка первого листа и второго листа. Таким образом, как было показано ранее для Саратовской 36 (Степанов и др., 2005), выход колеоптиля на поверхность почвы не тормозит рост эпикотиля, как считают некоторые исследователи (Добрынин, 1969; Кумаков, 1980; Федоров, 1980; Митрополенко, 1984), а приводит к активации его роста.
Наблюдаемые различия в росте колеоптиля, эпикотиля, первого-третьего листьев проростков пшеницы исследуемых сортов в условиях вегетации 2004-05 годов, очевидно, связаны с разными агроклиматическими условиями, в том числе количеством и качеством света, механическим давлением почвы.
Как показали лабораторные исследования, рост колеоптиля чувствителен, с одной стороны, к интенсивности света, а с другой – к механическому давлению почвы. Размеры колеоптиля оказались в обратной зависимости от поступившего количества света. Выявлено, что на свету на поверхности почвы длина колеоптиля достигала 23 мм, тогда как в темноте его длина в конце опыта составляла 70 мм. Длина колеоптилей, выращенных в почве на свету с глубиной заделки семян 60 мм, по завершении их роста достигала 65 мм. Данный факт свидетельствует о том, что колеоптиль ингибируется по мере роста прошедшим через почву светом. Распределение света в почве происходит преимущественно в красных и дальне-красных лучах спектра (Мандоли, 1986). Резкое торможение роста колеоптиля начинается сразу по достижении им размеров 57-60 мм, т.е. в момент выхода проростка на поверхность почвы.
Чувствительность колеоптиля к механическому давлению почвы выявлена при сравнении проростков, растущих в полной темноте в почве и на её поверхности. До выхода колеоптиля на поверхность почвы его рост монотонно ускорялся и в итоге его линейные размеры были больше в сравнении с аналогичными, растущими в тех же условиях на поверхности. После выхода проростка из почвы скорость роста колеоптиля снижалась с последующим полным её прекращением в конце опыта.
Рост эпикотиля также различался по вариантам опыта. В условиях освещения при прорастании семян на поверхности почвы отмечено значительное ингибирование роста эпикотиля. Сравнение данных с вариантом проращивания семян на поверхности в полной темноте показывает, что главным ингибирующим фактором является свет: в условиях темноты линейные размеры эпикотиля достигали 6 мм, тогда как на свету они составляли 0,7 мм. В условиях прорастания в почве установлено, что в условиях темноты рост эпикотиля активируется через 120 ч после начала опыта, что совпадает с началом ингибирования роста колеоптиля. В итоге наблюдался вынос эпикотиля на поверхность почвы (30 мм выше её уровня). В условиях освещения рост эпикотиля отставал от его роста в условиях темноты и начинал ингибироваться при достижении размеров 60 мм. Таким образом, механические нагрузки почвы оказывают стимулирующее воздействие на рост эпикотиля, тогда как свет ингибирует его рост.
Доказательством действия механических нагрузок на эпикотиль служит его осевая деформация в условиях отсутствия тургорного давления, вызванная воздействием фиксатора на проростки с интактным колеоптилем и первым листом. Отмечены факты деформации эпикотиля проростков, выросших в полной темноте, находящихся в фазе развития, при котором первый лист еще на прорвал колеоптиль. При этом, участки тканей колеоптиля, вплотную примыкающие к эпикотилю, не деформировались, указывая на то, что проростки не испытывали никаких внешних механических давлений. Деформация апикальной части первого листа, испытывающей давление со стороны верхушки колеоптиля, в этих условиях показывает, что эпикотиль испытывает именно осевую нагрузку со стороны побеговой части, а не деформируется под действием внутренних остаточных напряжений на сжатие в своих тканях. Деформация этих участков в проростке пшеницы, при отсутствии тургорного давления, указывает на происходящие в них активные процессы роста растяжением и, как следствие, первичность строения клеточных стенок.
Глава 4. ВЛИЯНИЕ МЕХАНИЧЕСКИХ НАГРУЗОК
НА МОРФОГЕНЕЗ ПРОРОСТКА ПШЕНИЦЫ
На свету осевое механическое давление не влияет на рост колеоптиля — его размеры в этом варианте опыта не различаются в пределах достоверности результатов экспериментов: в этих условиях не наблюдался рост эпикотиля (табл. 1). Однако рост первого листа на свету значительно ингибируется механическим давлением груза. Ещё большее различие наблюдается по длине 2-го листа, который был примерно в 2 раза меньше при наличии механического давления груза по сравнению с контролем. Меньшее различие отмечено по длине 3-го и 4-го листьев контрольных и опытных проростков пшеницы. Длина 5-го листа у растений, испытывающих механическое давление груза, превышала длину 5-го листа контрольных растений.
Таблица 1
Действие механического давления груза на рост
колеоптиля и эпикотиля Саратовской 29
| Варианты опыта | Длина колеоптиля, мм | Длина эпикотиля, мм |
| Темнота, без нагрузки | 98,0±4,3 | 1,28±0,05 |
| Темнота, груз 2 г | 75,7±3,8* | 1,27±0,06 |
| Освещение, без нагрузки | 43,0±2,7 | 0 |
| Освещение, груз 2 г | 43,7±2,9 | 0 |
* — p 0,05 относительно контроля в темноте
Установлено, что в условиях темноты колеоптиль реагирует на механическое давление груза и его линейные размеры были меньше по сравнению с контрольными растениями. Однако длина эпикотилей была одинаковой как при механическом давлении груза, так и без него (табл. 1). Длина 1го листа контрольных растений в условиях темноты была незначительно больше длины 1-го листа опытных растений. Иная тенденция отмечена для остальных, 2-5 листьев проростка пшеницы. У опытных растений, испытывающих механическое давление груза, длина листьев была больше по сравнению с контрольными растениями. В частности, длина 5-го листа опытных растений была почти в 2 раза больше, чем у растений, испытывающих механическое давление груза. Таким образом, в условиях абсолютной темноты одним из основных информативных факторов внешней среды, оказывающих влияние на морфогенез проростков пшеницы, становится механическое давление почвы.
При наличии света колеоптиль и эпикотиль не реагируют на механическое давление груза массой 2-4 г (табл. 1). Рост 1-го листа сильно ускорялся на свету и замедлялся при наличии механического давления груза. Длина 2-5-го листьев проростков пшеницы при механическом давлении груза была одинаковой относительно контрольных растений. Таким образом, как свидетельствуют наши эксперименты, наблюдается взаимозаменяемость светового фактора и механического давления, которая проявляется во время роста растений в почве.
Глава 5. АНАТОМИЧЕСКИЕ ОСОБЕННОСТИ И
ОПТИЧЕСКИЕ СВОЙСТВА КОЛЕОПТИЛЯ И ЭПИКОТИЛЯ
ПРОРОСТКА ПШЕНИЦЫ
Морфогенетический эффект прорастающего семени определяется количеством и качеством поглощенного света. Поскольку основным световоспринимающим органом проростка пшеницы является колеоптиль, его анатомо-физиологические особенности будут определять специфику поглощения света. Распространение света внутри этого органа зависит от места оптического входа световых лучей и угла их наклона относительно продольной оси проростка. Латеральное освещение отрезка колеоптиля, лежащего ниже его апикальной части, узким пучком белого света, создаваемого диафрагмой с диаметром отверстия 50 мкм, позволяло регистрировать свечение сегмента колеоптиля шириной 1 мм. Максимальную яркость имел участок колеоптиля, непосредственно примыкавший к лучу, интенсивность освещения остальной его части уменьшалась. При этом условии поперечные срезы колеоптиля выше и ниже зоны освещения оставались темными, свидетельствуя об отсутствии распространения света через ткани колеоптиля в осевом направлении от места входа более чем на 1 мм. Таким образом, при угле падения световых лучей в 0![]() относительно нормали к поверхности колеоптиля, физиологическое действие света будет проявляться только в месте его входа в ткань. При увеличении угла падения возрастает доля света, распространяющегося по тканям колеоптиля. Максимальное количество света, проводимого в осевом направлении, регистрировалось на торцевом срезе колеоптиля при углах падения световых лучей 50–60о. Дальнейшее увеличение угла падения снижало интенсивность света, распространяющегося по тканям колеоптиля.
относительно нормали к поверхности колеоптиля, физиологическое действие света будет проявляться только в месте его входа в ткань. При увеличении угла падения возрастает доля света, распространяющегося по тканям колеоптиля. Максимальное количество света, проводимого в осевом направлении, регистрировалось на торцевом срезе колеоптиля при углах падения световых лучей 50–60о. Дальнейшее увеличение угла падения снижало интенсивность света, распространяющегося по тканям колеоптиля.
Наилучшее проведение света наблюдается при попадании его на верхушку колеоптиля, которая имеет вид эллипсоида, несколько сплюснутого в дорзо-вентральном направлении. Отсутствие межклетников и гомогенная с мелкими вакуолями цитоплазма клеток делает эту структуру оптически однородной. Благодаря этому при попадании света на верхушку уменьшение светового потока определяется лишь потерями на отражение от поверхности, но не рассеиванием внутри тканей колеоптиля. Кривизна поверхности верхушки такова, что при любом угле падения отражение света от поверхности не превышает 5%. При этом практически все лучи испытывают полное внутреннее отражение. Таким образом, форма верхушки обеспечивает поступление светового потока внутрь тканей с минимальными потерями. Радиус кривизны верхушки оптимален и для распределения светового потока в этой структуре.
Проведение света осуществляется клетками средней части колеоптиля, имеющих преимущественно осевое расположение. Светопроводящая зона поделена нами на три части: апикальную, среднюю и базальную. Апикальная и средняя части колеоптилей проростков, выросших на свету, содержат большое количество пигментов фотосинтетического аппарата. В базальной части пигментация при низкой интенсивности света, как правило, не наблюдается. У колеоптилей проростков, выращенных в полной темноте, эти же части светопроводящей зоны имеют большое количество каротиноидов.
Способностью проводить свет обладают как клетки проводящего пучка (рис. 1), так и клетки паренхимы, причем наибольшее светопроведение имеет проводящий пучок (табл. 2). Проведение света зависит от зоны и возраста колеоптиля. Интенсивность света, распространяющегося по тканям колеоптиля в осевом направлении, зависит от угла падения световых лучей. При угле падения 0о30о свет преимущественно распространяется по проводящим пучкам, при 48о70о — по паренхиме.

Рис. 1. Поперечный срез средней части проростка пшеницы Саратовская 29 при освещении среза с углом падения. = 10о, х 150
Оценка оводнённости тканей колеоптиля по вариантам опыта показала, что изменение светопроводимости может быть связано с содержанием воды в тканях. Снижение светопроводимости колеоптилей, выращенных на свету, после 72 ч проращивания совпадало с уменьшением их оводнённости. В условиях темноты оводнённость клеток и светопроведение монотонно возрастали.
Измерение светопроводимости тканей, без учета длины колеоптилей, не дает возможность проанализировать функционирование фоторегуляторной системы проростка. Расчеты количества света, распространяющегося до базальной части колеоптиля, показывают, что уменьшение светопроводимости не всегда приводит к снижению суммарной освещенности базальной части колеоптиля, где располагается фоторегуляторная система, контролируемая фитохромом. Суммарный световой поток, дошедший до базальной части 42–часовых колеоптилей растений, выросших на свету, выше, чем в темноте. Это связано с тем, что при меньшем коэффициенте поглощения у колеоптилей в темноте их длина больше. После 72 ч с момента прорыва зародышем семенной оболочки у колеоптилей этиолированных проростков увеличивается суммарное освещение базальной части, а у колеоптилей, выращенных на свету, начинает падать. Это обусловлено, в основном, уменьшением светопроводимости клеточных структур колеоптилей, растущих на свету, и увеличение светопроведения его тканей в условиях полной темноты. Следует отметить, что интенсивность распространяющегося по проводящему пучку света у растений, выращенных в темноте, практически не изменялась, тогда как суммарный световой поток, проводимый по паренхимным клеткам, вначале уменьшался, а затем увеличивался.
Таблица 2
Изменение коэффициента поглощения тканей колеоптиля
Саратовской 29 при различных условиях освещения
| Время, ч | Части колеоптиля | |||||
| апикальная | средняя | базальная | ||||
| проводящий пучок | паренхима | проводящий пучок | паренхима | проводящий пучок | паренхима | |
| Выращивание на свету | ||||||
| 48 | 2,61±0,12 | 2,99±0,17 | 2,55±0,06 | 2,88±0,15 | 2,0±0,10 | 2,40±0,15 |
| 72 | 1,02±0,15 | 1,50±0,20 | 1,27±0,08 | 1,27±0,05 | 0,84±0,07 | 1,64±0,15 |
| 96 | 1,22±0,35 | 1,17±0,10 | 1,40±0,05 | 1,47±0,06 | 1,04±0,06 | 1,57±0,12 |
| 120 | 1,40±0,22 | 1,40±0,30 | 1,60±0,12 | 1,90±0,11 | 1,20±0,11 | 2,00±0,21 |
| Выращивание в абсолютной темноте | ||||||
| 48 | 2,50±0,09 | 2,77±0,07 | 2,33±0,09 | 2,77±0,15 | 2,00±0,10 | 2,30±0,14 |
| 72 | 0,90±0,15 | 1,42±0,18 | 0,98±0,05 | 1,62±0,09 | 0,61±0,03 | 0,85±0,08 |
| 96 | 0,63±0,06 | 0,74±0,15 | 0,58±0,03 | 0,67±0,05 | 0,26±0,02 | 0,32±0,06 |
| 120 | 0,51±0,14 | 0,65±0,22 | 0,42±0,05 | 0,53±0,01 | 0,25±0,03 | 0,31±0,03 |
Таким образом, апикальная меристема проростка пшеницы настроена на определенное количество света. Светопроведение тканей связано с анатомо-физиологическими особенностями составляющих их клеток, что позволяет настраивать системы проростка на определенную интенсивность света. Поступление света на светочувствительные структуры колеоптиля уменьшает светопроведение его тканей. При отсутствии светового фактора система проростка настраивает проведение света на определенную его интенсивность. Изменение интенсивности проведенного светового потока у колеоптилей, выращенных в темноте, зависит только от линейных размеров, тогда как на свету — от способностей тканей проводить свет. Из этого следует, что в темноте колеоптиль является оптически активной системой, способной проводить свет.
На свету в эпикотилях отмечается наличие максимумов поглощения в синей области спектра — при 410, 450 и 480 нм (рис. 2), что указывает на содержание в них одной из форм криптохрома. В колеоптиле проростков в этих условиях также отмечается присутствие пигментов фотосинтетического аппарата — хлорофиллов, о чём свидетельствует наличие характерных максимумов поглощения при 430 и 680 нм. Фотосистемы эпикотиля и колеоптиля не перекрываются между собой по спектральным характеристикам: максимуму поглощения эпикотиля при 450 нм соответствует хорошо заметный минимум поглощения колеоптиля в этом участке спектра; в области 430 нм, наоборот, отмечен минимум поглощения у эпикотиля и максимум у колеоптиля.
Распределение спектров поглощения пигментными системами должно подчиняться правилу хроматической адаптации, установленному ранее у одноклеточных и многоклеточных водорослей (Deny, 1997).
В условиях темноты эпикотиль обнаруживает в синей области спектра присутствие тех же пигментов, о чём свидетельствует сохранение максимумов поглощения при 410 и 450 нм (рис. 3).
 Рис. 2. Спектральные характеристики тканей колеоптиля и эпикотиля пшеницы Саратовская 29 при прорастании на свету через 10 сут после посева
Рис. 2. Спектральные характеристики тканей колеоптиля и эпикотиля пшеницы Саратовская 29 при прорастании на свету через 10 сут после посева
Установленному максимуму поглощения на свету при 490 нм соответствует, по-видимому, максимум поглощения 480 нм в условиях темноты.
В этих условиях в тканях колеоптиля установлен ещё один слабо выраженный пик поглощения при 640 нм, который возможно связан с фитохромной системой проростка. Исследование спектральных характеристик тканей колеоптиля показало отсутствие какого-либо поглощения в видимой области спектра.

Рис. 3 Спектральные характеристики тканей колеоптиля и эпикотиля пшеницы сорта Саратовская 29 при прорастании в темноте через 10 сут после посева
Оптическая плотность тканей колеоптиля для всех участков спектра была одинаковой и составляла 1,0 ед. Для эпикотиля средняя оптическая плотность варьировала в пределах 3,0 ед. Это свидетельствует о том, что в темноте колеоптиль выполняет функцию светопроведения, тогда как эпикотиль повышает свою чувствительность к световому фактору за счёт увеличения концентрации пигментов в синей области спектра (оптическая плотность на свету при 450 нм 3,53, в темноте — 4,69 соответственно), выполняя функцию восприятия светового потока. На свету оптическая плотность колеоптиля была в два раза выше, что свидетельствует об оптической стабилизации им светового потока в этих условиях.
Глава 6. ВИДОВЫЕ И СОРТОВЫЕ РАЗЛИЧИЯ АНАТОМИИ
ЭПИКОТИЛЯ ПШЕНИЦЫ
Эпикотиль является структурой, связывающей зародышевую корневую систему и надземную часть побега пшеницы. В конкретных условиях освещения и механического давления почвы эпикотиль выносит главную почку эмбрионального побега зародыша зерновки в приповерхностный слой. В зоне Юго-Востока наиболее часто формирование определённой продуктивности сорта пшеницы связывают с развитием зародышевой корневой системой, так как рост узловых корней возможен только при наличии достаточной влаги в почве (Кумаков, 1980, 1985). Очевидно, что анатомические и морфологические особенности развития эпикотиля имеет существенное прикладное значение.
Изучение анатомических и морфологических особенностей развития эпикотиля показало наличие существенных различий между исследуемыми видами и сортами пшеницы. При сравнении видов T. dicoccum,T. durum, T. spelta, T. aestivum наблюдалось варьирование по следующим признакам: по длине эпикотиля — от 11,6 до 45,5 мм, общей площади— от 37,47-2 до 86,26-2 мм2, площади его коровой части — от 21,09-2 до 47,56-2 мм2, площади проводящей системы — от 12,53-2 до 44,04-2 мм2, площади паренхимы — от 1,82-2 до 12,73-2 мм2, по числу проводящих пучков коры – от 1,0 до 6,0 шт., по числу проводящих пучков центрального цилиндра – от 10, 0 до 26,0 шт., по диаметру пучков коры – от 2,71-2 до 6,51-2 мм2, по диаметру пучков центрального цилиндра – от 10,08-2 до 21,24-2 мм2 (рис.4,5; табл.3,4).
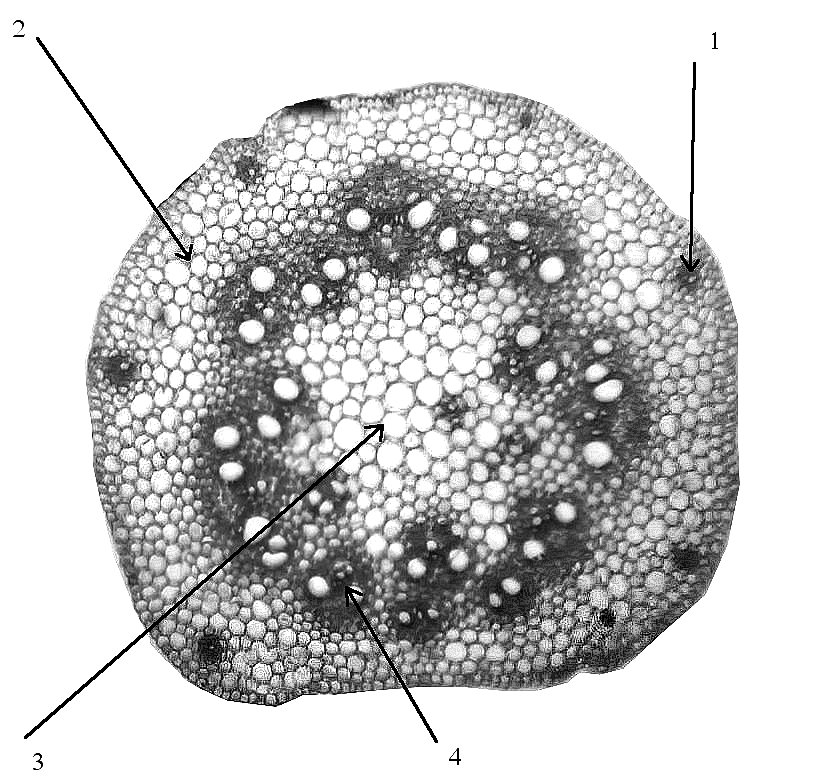
Рис. 4. Поперечный срез средней части эпикотиля пшеницы сорта Крассар, х 80: 1 — проводящий пучок коры; 2— кора; 3 — паренхима центрального цилиндра; 4 — проводящий пучок центрального цилиндра
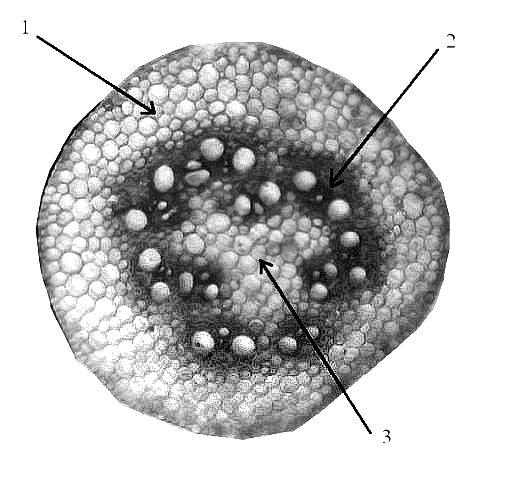
Рис. 5. Поперечный срез средней части эпикотиля пшеницы сорта Омский Корунд, х 80: 1— кора; 2 — проводящий пучок центрального цилиндра; 3 — паренхима центрального цилиндра
Максимальная площадь эпикотиля отмечена у сорта твердой пшеницы саратовской селекции НИК (97,05-2 мм2), немного меньшие значение развития данного признака выявлены у Саратовской 56 (86,26-2 мм2), Золотая волна (85,10 -2 мм2), К 24596 (74,57-2 мм2), Крассар (73,91-2 мм2), Саратовская 52 (71,18-2 мм2). Минимальная площадь эпикотиля свойственна К6252 (T. dicoccum), Саратовская 40, Омский корунд (T.durum). По площади коры максимальные значения установлены для НИК (T.durum), Саратовская 52 (T. aestivum), К24596 (T.spelta). Минимальные значения коровой части эпикотиля выявлены у К6252 (T.dicoccum), Саратовская 40, Омский корунд (T.durum), Лютесценс 62 (T. aestivum). Для твердой пшеницы установлена положительная корреляция (r =0,534) между площадью первого листа и площадью эпикотиля; для мягкой пшеницы r = -0,84. Выявлена положительная корреляция между площадью эпикотиля и площадью его коровой части для твердой (r = 0,899) и мягкой (r = 0,835) пшеницы.
Таблица 3
Видовые и сортовые особенности развития эпикотиля пшеницы
| Сорт | Общая площадь, мм210-2 | Площадь коры, мм210-2 | Площадь проводящей системы, мм210-2 | Площадь паренхимы, мм210-2 |
| T. dicoccum | ||||
| K6252 | 37,47±1,19 | 21,09±1,07 | 12,53±0,33 | 3,84±0,04 |
| T. durum | ||||
| Елизаветинская | 56,52±1,83 | 33,69±0,73* | 16,97±0,52* | 5,86±0,16* |
| Саратовская 40 | 44,96±1,44* | 22,81±0,81* | 18,62±0,44 | 3,52±0,11 |
| Гордеиформе 432 | 61,50±1,91* | 32,28±0,93 | 24,48±0,77* | 4,74±0,13* |
| Крассар | 73,91±2,20* | 33,31±0,82* | 32,94±0,65* | 7,67±0,18* |
| Золотая волна | 85,10±2,34* | 36,03±0,99* | 44,04±0,47* | 5,03±0,12* |
| Мелянопус 69 | 52,78±2,00 | 30,11±0,82 | 20,85±0,68 | 1,82±0,07 |
| Безенчукский янтарь | 61,12±1,75* | 32,53±0,77 | 26,00±0,80* | 2,59±0,08 |
| Омский корунд | 45,36±1,66* | *27,29±0,89 | 13,45±0,49* | 4,62±0,07* |
| Зарница Алтая | 58,11±1,98* | *33,59±1,11 | 19,93±0,56 | 4,59±0,08* |
| НИК | 97,05±2,54* | *47,56±1,35 | 38,56±0,79* | 10,93±0,23* |
| Среднее по виду | 63,64±1,65 | 32,92±0,73 | 25,58±0,70 | 5,14±0,08 |
| T. spelta | ||||
| K24596 | 74,57±2,33 | 40,79±1,54 | 27,13±0,96 | 6,65±2,09 |
| T. aestivum | ||||
| Саратовская 56 | 86,26±2,45** | 39,93±1,02** | 33,60±0,65** | 12,73±0,27** |
| Саратовская 36 | 66,01±1,97** | 34,91±0,98** | 20,89±0,54 | 10,21±0,22** |
| Саратовская 52 | 71,18±2,25** | 41,23±1,23** | 22,17±0,73 | 7,78±0,18 |
| Нададорес 63 | 58,55±1,88 | 30,41±0,85** | 21,35±0,55 | 6,79±0,12** |
| Лютесценс 62 | 57,38±1,49 | 26,88±0,68 | 22,80±0,62 | 7,70±0,17 |
| Среднее по виду | 64,48±2,04 | 33,60±0,77 | 22,92±0,59 | 7,95±0,13 |
* — p 0,05 относительно сорта Мелянопус 69
** — p 0,05 относительно сорта Лютесценс 62
Максимальная площадь проводящей системы эпикотиля отмечена у сортов твердой пшеницы Золотая волна, НИК. Минимальная площадь проводящей системы эпикотиля свойственна К6252 (T. dicoccum), Омский корунд, Елизаветинская, Саратовская 40, Зарница Алтая (T.durum). По площади паренхимы центрального цилиндра максимальные значения выявлены для Саратовской 56, Саратовская 36 (T. aestivum), НИК (T.durum). Установлена положительная корреляция между площадью эпикотиля и площадью пучков центрального цилиндра (r = 0,903).
Таблица 4
Видовые и сортовые особенности анатомии эпикотиля пшеницы
| Сорт | Число проводящих пучков коры | Число проводящих пучков центрального цилиндра | Диаметр проводящих пучков коры, мм210-2 | Диаметр проводящих пучков центрального цилиндра, мм210-2 |
| T. dicoccum | ||||
| K6252 | 1±0,1 | 14±0,2 | 2,71±0,09 | 10,08±0,20 |
| Твёрдая пшеница T. durum | ||||
| Елизаветинская | 1,0±0,1* | 14,0±0,3* | 4,94±0,21* | 12,74±0,27* |
| Саратовская 40 | 3,0±0,1* | 13,0±0,2* | 3,78±0,18 | 14,41±0,33 |
| Гордеиформе 432 | 4,0±0,1* | 16,0±0,4* | 4,21±0,20* | 13,95±0,47* |
| Крассар | 6,0±0,2* | 19,0±0,5* | 5,55±0,25* | 16,74±0,53 |
| Золотая волна | 6,0±0,2* | 26,0±0,7* | 6,51±0,27* | 21,24±0,59* |
| Мелянопус 69 | 5,0±0,1 | 15,0±0,5 | 3,53±0,19 | 15,67±0,44 |
| Безенчукский янтарь | 5,0±0,1* | 15,0±0,5* | 4,26±0,13* | 17,55±0,51* |
| Омский корунд | 2,0±0,1* | 10,0±0,4* | 3,27±0,12 | 17,84±0,49* |
| Зарница Алтая | 4,0±0,1* | 15,0±0,3* | 3,76±0,10 | 14,77±0,38 |
| НИК | 3,0±0,1* | 20,0±0,7* | 3,75±0,09 | 14,07±0,29 |
| Среднее по виду | 3,90±0,1 | 16,30±0,5 | 4,36±0,33 | 15,90±0,62 |
| T. spelta | ||||
| K24596 | 3,0±0,1 | 16,0±0,3 | 3,72±0,10 | 15,81±0,31 |
| Мягкая пшеница T. aestivum | ||||
| Саратовская 56 | 2,0±0,1** | 13,0±0,3** | 3,41±0,17 | 17,67±0,55** |
| Саратовская 36 | 1,0±0,1 | 10,0±0,2** | 4,96±0,19** | 13,05±0,28** |
| Саратовская 52 | 1,0±0,1 | 11,0±0,1** | 4,36±0,15** | 10,28±0,21** |
| Нададорес 63 | 4,0±0,1** | 13,0±0,2** | 4,81±0,13** | 15,35±0,34** |
| Лютесценс 62 | 1,0±0,1 | 18,0±0,3 | 3,10±0,11 | 15,97±0,24 |
| Среднее по виду | 1,8±0,1 | 13,0±0,3 | 4,13±0,18 | 11,28±0,18 |
* — p 0,05 относительно сорта Мелянопус 69
** — p 0,05 относительно сорта Лютесценс 62
Большее число пучков коры эпикотиля отмечено для сортов твердой пшеницы Крассар, Золотая волна, Мелянопус 69, Безенчукский янтарь. Меньшее их число было у Елизаветинской (T.durum), Лютесценс 62, Саратовская 36, Саратовская 52 (T. aestivum), К6252 (T.dicoccum). Большее число пучков центрального цилиндра свойственно сортам Золотая волна, НИК, Крассар (T. durum), Лютесценс 62(T. aestivum). У твердой пшеницы выявлена положительная корреляция между числом пучков центрального цилиндра и числом коровых пучков эпикотиля (r=0,512). Наблюдается корреляция между числом пучков и площадью: чем больше общая площадь эпикотиля, тем больше проводящих пучков содержит его центральный цилиндр (табл. 3,4).
Исключение составляют сорта Саратовская 52 и Саратовская 56 (T. aestivum), имеющие при довольно крупных размерах эпикотиля небольшое количество проводящих пучков центрального цилиндра. Большему числу проводящих пучков центрального цилиндра соответствует, как правило, и большее число проводящих пучков коры.
При изучении диаметра пучков центрального цилиндра установлено, что по этому показателю максимальные значения отмечаются у сорта Золотая волна (табл. 4). Чуть меньшие, но близкие значения выявлены у группы сортов, включающие НИК, Омский корунд, Безенчукский янтарь, Крассар (T. durum), Саратовская 56 (T. aestivum).
Проведённые исследования показали перспективность изучения анатомии и морфологии эпикотиля для определения зависимости его развития от внешних факторов с учётом видовых и сортовых особенностей. Некоторые анатомические признаки, в частности площадь эпикотиля, развитие проводящих тканей центрального цилиндра и коры, могут явиться маркёрными для определения устойчивости и потенциальной продуктивности сорта в данном регионе произрастания.
Таким образом, фоторегуляция морфогенеза проростков пшеницы осуществляется посредством последовательного включения компонентов системы: поступления света, его распространения, рецепции и реакции на свет. Изменение каждого из компонентов системы осуществляется в соответствии с анатомо-физиологическим особенностями колеоптиля и эпикотиля проростков пшеницы.
ВЫВОДЫ
1. Специфика ростовых процессов эпикотиля и колеоптиля пшеницы зависит от действия светового фактора и механических нагрузок. Установлено, что чувствительность к действию указанных факторов у этих органов неодинакова.
2. Колеоптиль является высокоспециализированной структурой, анатомически имеющей деление на зоны восприятия, проведения и рецепции света. Светопроведение осуществляется нижележащими от верхушки тканями проводящих пучков и паренхимы, образующих два потока, направленные в различные фоторецепторные центры проростка: главную почку и эпикотиль.
3. Наибольшее светопроведение в колеоптиле имеют проводящие пучки в первые несколько суток после прорастания. Дальнейший рост проростка в условиях недостаточного освещения приводит к преимущественному проведению светового потока паренхимными клетками колеоптиля.
4. Светопроведение колеоптиля определяется интенсивностью поступившего на верхушку света: чем больше количество света, тем меньше светопроведение. Общее количество света, проходящего до апикальной меристемы этиолированного проростка, постоянно и не зависит от линейных размеров колеоптиля.
5. Меристематические и активно растущие ткани адаптированы к определённой интенсивности светового потока. Изменениe количественных характеристик света, поступающего к главной почке проростка и эпикотиля, влияет на морфогенез проростка пшеницы.
6. Установлено наличие в колеоптиле и эпикотиле нескольких функционирующих пигментных систем. Специфика функционирования этих систем в изменяющихся условиях для колеоптиля и эпикотиля различается. В условиях полной темноты ткани колеоптиля настроены на максимальное светопроведение; в условиях освещения – на стабилизацию интенсивности света, проводимого по тканям колеоптиля. Эпикотиль характеризуется наличием в своих тканях фоторегуляторных пигментных систем, поглощающих в синей области спектра.
7. Установлены видовые и сортовые особенности морфологии и анатомии эпикотиля по следующим признакам развития: длине, общей площади, площади проводящей системы, паренхимы и коры, количеству и типу пучков центрального цилиндра и коры.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Касаткин М.Ю. Фоторецепторные системы как регуляторы морфогенетической изменчивости проростков пшеницы //Студент и научно–технический прогресс: XXXV Международная научная студенческая конференция (Новосибирск, 1997). Тез. докл. — Новосибирск: НГУ, 1997. — С. 93–94.
2. Касаткин М.Ю., Спивак В.А. Влияние света на рост зародышевых структур пшеницы //Развитие научного наследия академика Н.И. Вавилова: Международная научная конференция (Саратов, 1997). Тезисы докладов. — Саратов: СГСА, 1997, часть 1. — С. 226–227.
3. Спивак В.А., Касаткин М.Ю., Быховцев Б.Г. Анатомическая организация светопроводящих структур колеоптиля пшеницы //Проблемы ботаники на рубеже XX-XXI веков: II(X) съезд русского ботанического общества (Санкт-Петербург, 1998). Тез. докл. — С.–Петербург: БИН РАН, Т.1, 1998. — С. 76.
4. Касаткин М.Ю. Функциональная оpганизация светопpоводящих стpуктуp колеоптиля пшеницы //Мат-лы конф. молодых ученых и аспиpантов по пpоблемам физиологии и биохимии pастений. — Тез. докл. — Саpатов, 1998. — С. 19–20.
5. Касаткин М.Ю., Быховцев Б. Г. Светопроводимость тканей как фактор регуляции ростовых процессов колеоптиля пшеницы //Вопросы биологии, экологии, химии и методики обучения: Сборник научных статей. Вып. 4. Саратов: ЗАО «Сигма-плюс», 2001. — С. 76-79.
6*. Касаткин М.Ю., Быховцев Б. Г. Организация светопроводящих клеточных структур колеоптиля пшеницы //Вестник Башкирского университета. — 2001, N2(II). С. 76–78.
7. Yakovlev D. A., Kurchatkin S. Р., Pravdin A. В., Gurianov E. V., Kasatkin M.Y., Zimnyakov D.A. Polarization monitoring of structure and optical properties of the heterogeneous birefringent media: application in the study of liquid crystals and biological tissues //Proc. SPIE, Vol. 5067, Saratov Fall Meeting 2002: Laser Physics and Photonics, Spectroscopy, and Molecular Modeling III; Coherent Optics of Ordered and Random Media III. P. 64–72.
8. Касаткин М.Ю., Быховцев Б. Г. Взаимосвязь фоторецепторных систем в морфогенезе проростка пшеницы //Бюллетень Ботанического сада Саратовского государственного университета. — Саратов: Изд-во «Слово», 2002.– Вып.1. С. 130–132.
9. Касаткин М.Ю., Быховцев Б. Г. Оптические свойства колеоптиля пшеницы //Бюллетень Ботанического сада Саратовского государственного университета. — Саратов: «Научная книга», 2003.– Вып. 2. — С. 284–290.
10. Касаткин М.Ю., Быховцев Б.Г., Шохина Н.И. Онтогенетическая изменчивость оптических свойств листа амаранта //V Съезд об-ва физиологов растений России. Международная конф. «Физиология растений — основа фитобиотехнологии», Пенза, 2003, Тез. докл. — Пенза, 2003. — С. 47.
11. Быховцев Б.Г., Касаткин М.Ю. Свет и механические нагрузки как регуляторы органогенеза проростка пшеницы //V Съезд об-ва физиологов растений России. Международная конф. «Физиология растений — основа фитобиотехнологии», Пенза, 2003, Тез. докл. — Пенза, 2003. — С. 381.
12. Касаткин М.Ю., Степанов С.А., Быховцев Б. Г. Влияние света на рост колеоптиля и эпикотиля проростков пшеницы //Вопросы биологии, экологии, химии и методики обучения: Сб. научн. ст. Вып.8, Саратов: ООО «АВРОРА», 2005. — С. 121–123.
13. Коробко В.В., Степанов С.А., Касаткин М.Ю. Рост и развитие эпикотиля яровой пшеницы //Бюллетень Ботанического сада Саратовского государственного университета. — Саратов: Изд-во «Научная книга», 2005.— вып. 4. С. 238–243.
14. Спивак В.А., Быховцев Б.Г., Касаткин М.Ю. Малый практикум по экологической физиологии растений /Под ред. Г.В. Шляхтина: Учеб. пособие для студ., обучающихся по спец. 013500 «Биоэкология» и др. биол. спец.— Саратов: Изд-во Сарат. ун-та, 2006. — 132 с.
* — публикация в печатном издании перечня ВАК РФ
В заключении автор искренне благодарен всем, кто оказывал ему помощь и поддержку при выполнении работы. Особенно хочется поблагодарить сотрудников кафедры микробиологии и физиологии растений СГУ: Спивака В.А., Быховцева Б.Г., Кирилюка В.В.

