Электродные и электрорезистивные свойства халькогенидных стеклообразных сплавов систем as-ge-te, tl-ge-te, cu-as-te, cu-as-se в условиях их коррозии
На правах рукописи
АНТОНОВА Наталья Евгеньевна
ЭЛЕКТРОДНЫЕ И ЭЛЕКТРОРЕЗИСТИВНЫЕ СВОЙСТВА ХАЛЬКОГЕНИДНЫХ СТЕКЛООБРАЗНЫХ СПЛАВОВ СИСТЕМ As-Ge-Te, Tl-Ge-Te, Cu-As-Te, Cu-As-Se
В УСЛОВИЯХ ИХ КОРРОЗИИ
05.17.03 – технология электрохимических процессов
и защита от коррозии
Автореферат диссертации
на соискание ученой степени
кандидата химических наук
Калининград - 2007
Работа выполнена в Российском государственном университете
имени Иммануила Канта
| Научный руководитель: | доктор химических наук, профессор Фунтиков Валерий Алексеевич |
| Официальные оппоненты: | доктор химических наук, профессор Тверьянович Юрий Станиславович доктор технических наук, профессор Пискунов Евгений Михайлович |
| Ведущая организация: | Калининградский государственный технический университет |
Защита состоится « 06 » июля 2007 года в 1500 часов на заседании диссертационного совета К 212.084.08 при Российском государственном университете имени Иммануила Канта по адресу:
236040, г. Калининград, ул. Университетская, д. 2, ауд. 143.
Отзывы на автореферат направлять по адресу:
236040, г. Калининград, ул. Университетская, д. 2, Российский государственный университет имени Иммануила Канта, факультет биоэкологии, кафедра химии.
С диссертацией можно ознакомиться в научной библиотеке Российского государственного университета имени Иммануила Канта (236040 Калининград, ул. Университетская, д. 2).
Автореферат разослан « 05 » июня 2007 г.
Ученый секретарь
диссертационного совета Мямина А.А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Последние два десятилетия характеризуются интенсивным развитием в области исследования, создания и применения твердотельных электрохимических сенсоров, что связано как с применением новых чувствительных материалов для традиционных сенсоров, так и с созданием сенсоров на основе микроэлектронной технологии. Среди твердотельных сенсоров особый интерес представляют мембраны на основе халькогенидных кристаллических и стеклообразных сплавов полупроводниковой проводимости. Перспективность халькогенидных стекол для создания мембран электродов связана с особенностями строения и физико-химических, включая электрические, свойств этих материалов.
Разработка новых перспективных чувствительных сенсоров возможна лишь на основе систематического изучения свойств и строения разнообразных мембранных материалов в сочетании с их аналитическими характеристиками. Исследование стеклообразных материалов включает следующие направления: фундаментальное изучение объемных и поверхностных твердотельных характеристик, исследование электрохимических свойств стекол в растворах, а также механизма ионной и электронной чувствительности на фазовой границе твердое тело/раствор, применение разработанных сенсоров для различных целей: в экологическом мониторинге, лабораторном анализе, промышленном контроле, в частности, в гальванических цехах и т.д.
Однако в настоящее время электрохимическое и коррозионное поведение сенсоров на основе стеклообразных халькогенидных сплавов, а также механизм их функционирования все еще полностью не изучены, поэтому актуальным является получение сведений о механизме взаимодиффузии и коррозии сетки стекла, приводящих к изменению состава поверхностных слоев стекла.
В связи с этим в данной работе для исследования электродного поведения халькогенидных стеклообразных сплавов использована редоксметрия, поскольку реальные растворы обладают некоторым окислительно-восстановительным потенциалом, что может привести к возникновению коррозии электродов в процессе их эксплуатации. Систематического исследования в данном направлении не проводилось.
Цели и задачи исследования. Целью настоящей работы является комплексное исследование влияния процесса коррозионного модифицирования высокопроводящих халькогенидных стеклообразных сплавов на их электродные и резистивные характеристики в агрессивных средах.
В соответствии с поставленной целью были определены главные задачи:
- Выявление возможности протекания процесса коррозии в момент модификации поверхности электрода при его контакте со средой на основании анализа электрохимического поведения халькогенидных стекол и стеклокристаллов систем As-Ge-Te, Tl-Ge-Te, Cu-As-Te и Cu-As-Se в растворах, содержащих катионы-окислители, и в растворах различных редокс-систем.
- Установление закономерностей электродного поведения халькогенидных металлсодержащих стеклообразных сплавов в условиях их коррозии при взаимодействии с растворами окислительно-восстановительных систем [Fe(CN)6]3-/[Fe(CN)6]4-, С6H4O2/С6H4(OH)2, Fe3+/Fe2+, Cr2O72-/Cr3+ в широком диапазоне редокс-потенциалов.
- Исследование электродных и резистивных функций теллуридных и селенидных стеклообразных сплавов и процессов, связанных с коррозией этих материалов при взаимодействии образцов с растворами катионов-окислителей.
- Нахождение взаимосвязи между электродными и резистивными характеристиками халькогенидных полупроводниковых стеклообразных сплавов.
Объекты и методы исследования. В работе были использованы образцы стеклообразных и стеклокристаллических сплавов следующих систем: As-Ge-Te, Tl-Ge-Te, Cu-As-Te и Cu-As-Se. В качестве модельной была избрана теллуридная система As-Ge-Te, как наиболее изученная и хорошо отражающая свойства стекол трехкомпонентных систем, образованных с участием теллура. Металлы взаимодействуют с компонентами халькогенидных стекол и в виде соответствующих структурных единиц входят в ковалентноувязанную сетку стекла. Вследствие этого замена одного из компонентов в системе As-Ge-Te другим элементом должна приводить к изменению электрохимических характеристик стекла. Определенное сходство в положении областей стеклообразования наблюдается в системах Cu-As-Te и Cu-As-Se, поэтому также была исследована селенидная система Cu-As-Se.
В качестве экспериментальных методов использовались потенциометрия (редоксметрия, ионометрия) и резистометрия.
Научная новизна. Главные элементы новизны диссертации:
- Впервые предложено использовать потенциометрию стеклообразных материалов полупроводниковой проводимости в растворах редокс-систем для оценки их коррозионной стойкости и других особенностей.
- Впервые с помощью предложенного метода редоксметрии систематически исследованы электродные функции мембран на основе халькогенидных стеклообразных и стеклокристаллических образцов на примере систем As-Ge-Te, Tl-Ge-Te, Cu-As-Te и Cu-As-Se, а также исходных компонентов полупроводниковой чистоты в растворах редокс-систем различной природы: органической и неорганической, охватывающих широкий диапазон потенциалов.
- Впервые продемонстрирована зависимость сопротивления халькогенидных стеклообразных и стеклокристаллических образцов, погруженных в раствор электролита, от концентрации катионов-окислителей.
Практическая значимость работы:
- Использованные в работе методы исследования (потенциометрия и резистометрия) позволяют оценить коррозионную стойкость стеклообразных сплавов, а также установить механизмы процессов их взаимодействия с агрессивными средами.
- Полученные в работе результаты и изложенные в ней подходы могут быть использованы для рационального подбора материалов, используемых в качестве мембран ионоселективных электродов, необходимых для разработки технологических электрохимических процессов.
- Обнаруженный резистивный эффект может быть использован как для фундаментальных, так и для практических целей, например, при формировании датчиков для химического анализа, в гальванических производствах и т.д.
Положения диссертационной работы, выносимые на защиту:
- При взаимодействии стеклообразных и стеклокристаллических материалов систем As-Ge-Te, Tl-Ge-Te, Tl-Ge-Te, Cu-As-Te, Cu-As-Se и исходных компонентов As, Te, Ge, Cu с растворами редокс-систем [Fe(CN)6]3-/[Fe(CN)6]4-, С6H4O2/С6H4(OH)2, Fe3+/Fe2+, Cr2O72-/Cr3+ происходит модификация поверхности электродов, связанная с протеканием процесса окисления или восстановления в поверхностном слое.
- Найденные закономерности электрохимического поведения халькогенидных стеклообразных материалов систем As-Ge-Te, Tl-Ge-Te, Cu-As-Te и Cu-As-Se в растворах катионов-окислителей Cu2+ и Fe3+, а также в растворах редокс-систем: [Fe(CN)6]3-/[Fe(CN)6]4-, С6H4O2/С6H4(OH)2, Fe3+/Fe2+, Cr2O72-/Cr3+ могут быть использованы для оценки их коррозионных характеристик.
- Обосновано влияние механизма потенциалообразования на границе халькогенидное стекло – раствор на химическую стойкость образцов. По характеру отклонения электродного поведения полупроводниковых стекол и стеклокристаллов в растворах редокс-систем от редокс-потенциала среды можно оценить степень и механизм их коррозионной стойкости.
- Электрическое сопротивление халькогенидных полупроводниковых стеклообразных образцов подчиняется логарифмической зависимости от активной концентрации катионов меди Cu2+ в водных растворах, в которые погружаются халькогенидные резисты.
Апробация результатов работы. Основные положения и результаты работы были доложены и обсуждены на постоянных научных семинарах Калининградского государственного университета (Калининград, 2002), на XIII Международном симпозиуме по неорганическим стеклам ISNOG (Пардубице, Чехия, 2002), на Международной научной конференции, посвященной 90-летию высшего рыбохозяйственного образования в России «Инновации в науке и образовании - 2003» (Калининград, 2003), на V Всероссийской конференции по анализу объектов окружающей среды «Экоаналитика-2003» с международным участием (Санкт-Петербург, 2003), на конференции по некристаллическим неорганическим материалам «СONCIM 2003» (Бонн, Германия, 2003), на Международной научной конференции, посвященной 100-летию КГТУ «Инновации в науке и образовании - 2004» (Калининград, 2004), на конференции, посвященной памяти Норберта Крайдла NKMC-2004 (Тренчин, Словакия, 2004), на III-V международных конференциях молодых учёных и студентов «Актуальные проблемы современной науки». (Самара, 2002-2004), на 1-ом Международном форуме «Актуальные проблемы современной науки» (Самара, 2005).
Публикации. По материалам диссертации опубликовано 15 печатных работ.
Структура и объём диссертации. Диссертация состоит из введения, пяти глав, выводов и списка цитируемой литературы. Работа изложена на 140 страницах машинописного текста, включает 42 таблицы и 57 рисунков. Список литературы насчитывает 197 наименований отечественных и зарубежных авторов.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
Во введении дается обоснование актуальности темы диссертационной работы, сформулированы цели и задачи исследования, раскрыты научная новизна и практическая значимость полученных результатов, представлены основные положения, выносимые на защиту.
В первой главе проанализированы и систематизированы имеющиеся литературные данные, касающиеся проблемы электрохимического поведения металлсодержащих халькогенидных сплавов в водных растворах электролитов. Изложены основные представления о закономерностях стеклообразования исследуемых теллуридных и селенидной систем, рассмотрены и обобщены особенности химического и электрохимического растворения стеклообразных халькогенидных полупроводников.
Проведен сравнительный анализ кристаллических и стеклообразных халькогенидных электродов, из которого следует, что халькогенидные стеклообразные электроды обладают лучшими электрохимическими характеристиками, химически и механически более устойчивы.
Рассмотрены и обобщены современные представления о природе электрической проводимости стеклообразных полупроводников.
Во второй главе описаны объекты и методы исследования. Настоящая работа посвящена изучению электрохимических и коррозионных свойств высокопроводящих стекол трехкомпонентных систем.
С целью изучения электрохимических процессов, химической стойкости халькогенидных стеклообразных материалов, а также возможности практического использования в качестве электродов для потенциометрического анализа жидких сред было проведено исследование электродного поведения стеклообразных сплавов систем Ge-As-Te, Tl-Ge-Te, Cu-As-Te и Cu-As-Se в растворах редокс-систем: [Fe(CN)6]3-/[Fe(CN)6]4-, С6H4O2/С6H4(OH)2, Fe3+/Fe2+, Cr2O72-/Cr3+, а также в растворах, содержащих катионы Cu2+ и Fe3+. Данные окислительно-восстановительные системы и катионы-окислители наиболее широко распространены и доступны, что и обусловило их выбор.
В качестве объектов исследования в работе были использованы:
- стекла системы As-Ge-Te следующих составов: AsTeGe0,1, AsTeGe0,2, AsTe4Ge0,3;
- стекла системы Tl-Ge-Te составов: GeTlTe3,30, GeTlTe3,71, GeTlTe4,15, GeTlTe4,66, GeTlTe5,47, GeTlTe6,00;
- стекла системы Cu-As-Te составов: AsТe1,0Cu0,5, AsТe3,0Cu1,2, AsТe2,0Cu0,8, AsТe1,9Cu0,7, AsТe1,8Cu0,6, AsТe1,5Cu0,5, AsТe5,0Cu1,5, AsТe1,7Cu0,5, AsТe1,3Cu0,3, AsТe1,0Cu0,2;
- стекла системы Cu-As-Se составов: AsSe1,50Cu0,10, AsSe1,50Cu0,16, AsSe1,50Cu0,25, AsSe1,50Cu0,32, AsSe1,50Cu0,40, AsSe1,50Cu0,50, AsSe1,50Cu0,60; стеклокристаллы составов: AsSe1,50Cu0,80, AsSe1,50Cu1,00, AsSe1,50Cu1,20.
Из образцов халькогенидных стеклообразных сплавов изготавливались целиком твердофазные электроды.
Для потенциометрического анализа использовался измерительный прибор иономер ЭВ-74. В качестве электрода сравнения использовался хлорсеребряный электрод ЭВЛ-1МЗ с внутренним раствором сравнения - насыщенным раствором КС1 (х.ч.). Хлорсеребряный электрод и индикаторный электрод (халькогенидный электрод) погружали в раствор и фиксировали потенциал через каждую минуту до установления стационарного значения. Проводили три параллельных опыта во всех градуировочных растворах.
Растворы редокс-систем [Fe(CN)6]3-/[Fe(CN)6]4-, Fe3+/Fe2+ готовились с соотношением lg С(Ox)/C(Red) = -3, -2, -1, 0, 1, 2, 3. Растворы редокс-системы С6H4O2 /С6H4(OH)2 готовились с соотношением lg С(Ox)/C(Red) = -3, -2, -1, 0; растворы редокс-системы Cr2O72-/Cr3+ готовились с соотношением lg С(Ox)/C(Red) = -3,3; -2,3; -1,3; -0,3; 0,7; 1,7; 2,7.
По результатам эксперимента строились зависимости электродного потенциала кристаллических и стеклообразных материалов от логарифма отношения концентраций окисленной и восстановленной форм редокс-систем, а затем на основании полученных данных проводилось обсуждение.
В работе также исследовалась зависимость электродного потенциала халькогенидных стеклообразных электродов от логарифма концентрации ионов двухвалентной меди в сульфатной среде и трехвалентного железа в сульфатной среде при рН = 1,6. Постоянная ионная сила задавалась 0,5 М раствором сульфата натрия. Концентрация используемых стандартных растворов менялась от 10-6 до 10-1 М Сu2+ (Fе3+).
После выдержки электродов в течение 12 ч в 10-2 М растворе ( = 12 ч) либо без предварительной выдержки ( = 0 ч) исследовали их электродное поведение. По результатам эксперимента строились электродные функции в координатах E – lg C (Меn+).
Измерение сопротивления проводилось на воздухе, в дистиллированной воде и в стандартных растворах, содержащих ионы двухвалентной меди Cu2+. Образцы для измерения сопротивления представляли собой плоскопараллельные пластины, в которые внедрялись два твердых контакта, после чего провода с образцом помещались в стеклянную трубку и герметично заклеивались.
Сопротивление измерялось следующим образом: подготовленный образец халькогенидного стекла (ХС) с двумя твердыми контактами помещался в исследуемый раствор. Для интенсивного перемешивания раствора использовалась магнитная мешалка. Измерение сопротивления на постоянном токе осуществлялось с помощью цифрового комбинированного прибора Щ 43-13.
В третьей главе представлены результаты исследования электродного поведения стеклообразных сплавов систем As-Ge-Te, Tl-Ge-Te, Cu-As-Te, Cu-As-Se и исходных компонентов в растворах редокс-систем: [Fe(CN)6]3-/[Fe(CN)6]4-, С6H4O2/С6H4(OH)2, Fe3+/Fe2+, Cr2O72-/Cr3+, а также проведено сравнение электродных потенциалов халькогенидных сплавов и исходных простых веществ с потенциалами растворов редокс-систем, которые измерялись с помощью платинового электрода.
Полученные результаты свидетельствуют о том, что исследованные стеклообразные материалы и исходные компоненты ведут себя различным образом в зависимости от их состава и редокс-потенциала раствора.
На рис. 1-4 приведены электродные функции на примере стекол системы As-Ge-Te в растворах исследованных редокс-систем.
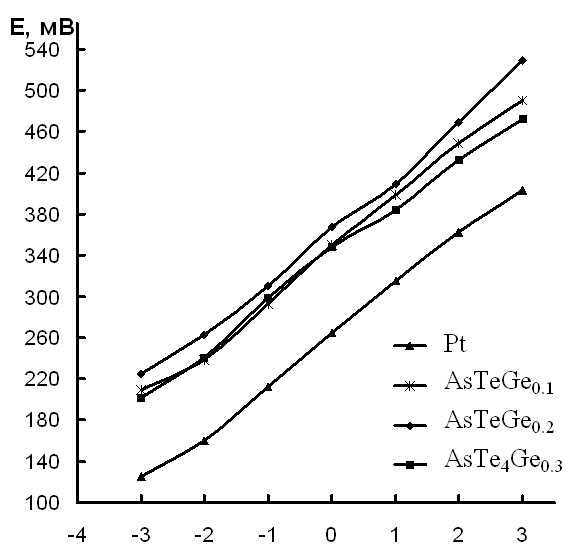
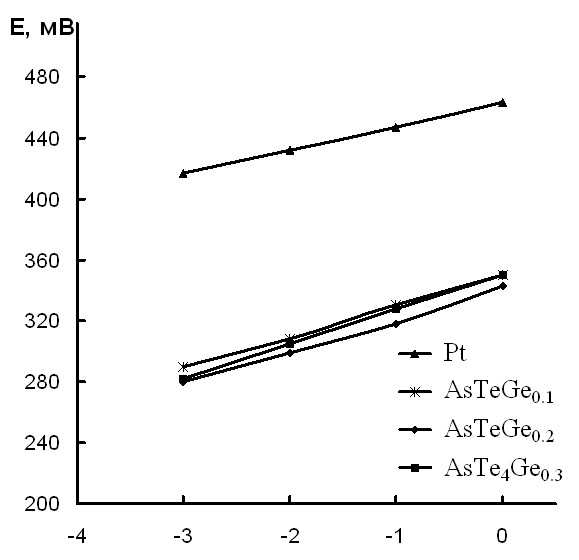
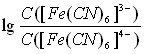
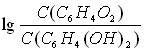
| Рис. 1. Электродные функции стекол системы As-Ge-Te в растворах редокс-системы [Fe(CN)6]3-/[Fe(CN)6]4- | Рис. 2. Электродные функции стекол системы As-Ge-Te в растворах редокс-системы С6H4O2/С6H4(OH)2 |

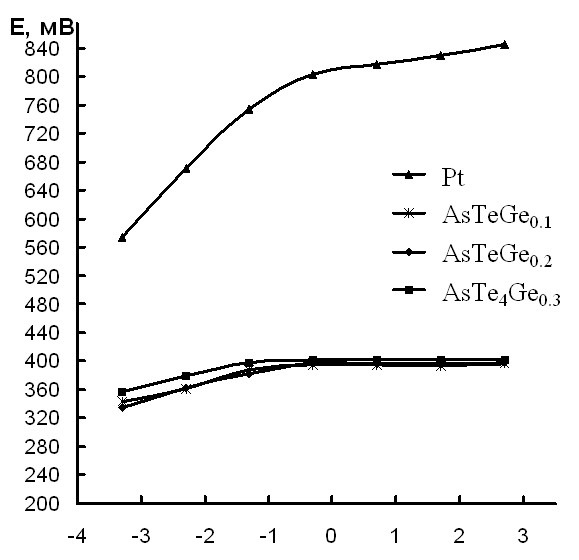
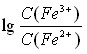
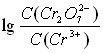
| Рис. 3. Электродные функции стекол системы As-Ge-Te в растворах редокс-системы Fe3+/Fe2+ | Рис. 4. Электродные функции стекол системы As-Ge-Te в растворах редокс-системы Cr2O72-/Cr3+ |
В системе с самым низким потенциалом на основе кровяных солей смешанные электродные потенциалы меди, германия, теллура, а так же стеклообразных сплавов систем Tl-Ge-Te, Cu-As-Te и Cu-As-Se более отрицательны, чем потенциал среды. Это указывает на то, что расходуется окисленная форма редокс-системы, а значит, в поверхностном слое соответствующих электродов идет процесс окисления.
Мышьяк и стекла системы As-Te-Ge ведут себя иначе. Их электродные потенциалы выше потенциала среды, что свидетельствует о доминировании процесса восстановления на их поверхности в связи с расходованием восстановленной формы редокс-системы.
При переходе в сферу более высоких потенциалов (С6H4O2/С6H4(OH)2, Fe3+/Fe2+, Cr2O72-/Cr3+) все исследованные объекты ведут себя сходным образом, а именно: вступают в реакцию с окисленной формой, и их потенциал уменьшается по сравнению с потенциалом среды.
Следовательно, при взаимодействии стеклообразных материалов с растворами редокс-систем происходит модификация поверхности электродов, связанная с протеканием процесса окисления или восстановления в поверхностном слое, а на основании наблюдаемого при этом отклонения потенциала от потенциала среды можно сделать выводы о том, какой процесс идет на поверхности электрода. То есть поведение халькогенидных стеклообразных электродов в растворах редокс-систем можно использовать для оценки их химической стойкости по отношению к окислителям и восстановителям.
Таким образом, впервые систематически изучены электродные функции стеклообразных полупроводниковых стекол в растворах редокс-систем и показана перспективность такого рода исследования для нестехиометрических сплавов. Установлено, что при взаимодействии халькогенидных стеклообразных сплавов с растворами редокс-систем протекают окислительно-восстановительные процессы и процессы электрохимической коррозии.
Исследованные объекты преимущественно вступают в реакцию с окисленной формой, поэтому следующим этапом работы стало исследование электродного поведения стеклообразных сплавов в растворах, содержащих катионы-окислители.
Четвертая глава содержит результаты исследования электродного поведения стеклообразных сплавов систем As-Ge-Te, Tl-Ge-Te, Cu-As-Te и Cu-As-Se в растворах, содержащих катионы-окислители Cu2+ и Fе3+.
Практически все исследованные ионоселективные электроды реагируют на присутствие в растворах ионов двухвалентной меди и трехвалентного железа.
Для объяснения механизма потенциалообразования халькогенидных стекломатериалов была использована модель измененного поверхностного слоя, предложенная Власовым Ю.Г., Бычковым Е.А., Легиным А.В., согласно которой на поверхности мембраны в результате взаимодействия с раствором, которое приводит к частичной деструкции сетки стекла и к изменению состава поверхности, образуется измененный поверхностный слой толщиной 100-200 нм, в котором облегчена миграция ионов.
При проведении эксперимента поверхность электрода предварительно очищалась, т.е. оголялся глубинный слой, поэтому фиксируемое возрастание Е(Э.Д.С.) указывает на химическую модификацию поверхности электродов в процессе измерения. После вымачивания сухих стекол топология и состав поверхности должны претерпевать существенные изменения, связанные с образованием поверхностного слоя. В этой связи интересным показалось исследовать поведение халькогенидных стеклообразных электродов при выдержке мембраны в растворе катиона-окислителя и без предварительной выдержки.
На рис. 5, 6 представлены типичные электродные функции на примере стеклообразных и стеклокристаллических сплавов системы Cu-As-Se в растворах, содержащих катионы Сu2+ и Fe3+ без предварительной выдержки ( = 0 ч). Электродные функции исследованных стеклообразных объектов для наглядности смещены друг относительно друга.
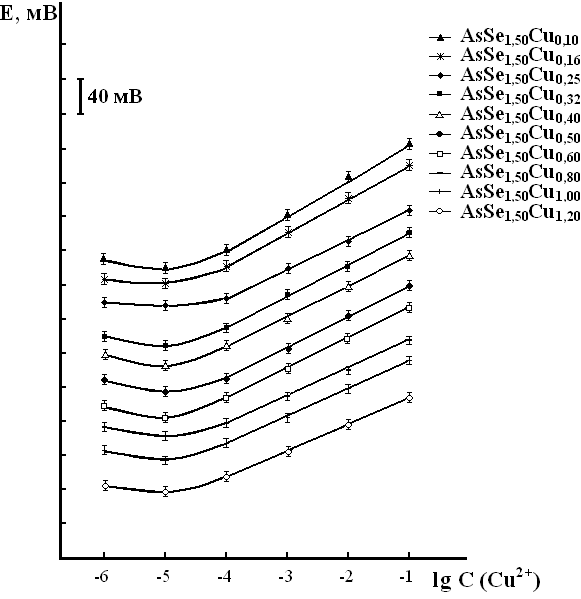
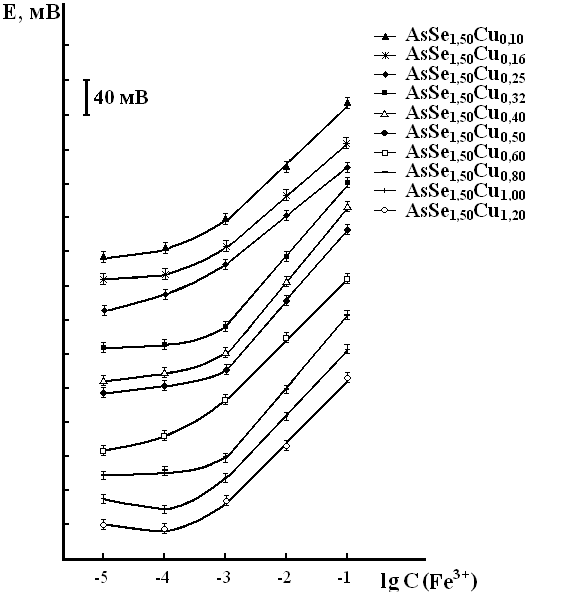
Рис. 5. Электродные функции стекол и Рис. 6. Электродные функции стекол и
стеклокристаллов системы Cu-As-Se в стеклокристаллов системы Cu-As-Se в
растворах, содержащих катионы Сu2+ растворах, содержащих катионы Fe3+
Электродные характеристики исследованных стеклообразных объектов представлены в таблицах 1, 2.
Таблица 1.
Угловые коэффициенты () электродных функций стеклообразных сплавов систем As-Ge-Te, Tl-Ge-Te, Cu-As-Te и Cu-As-Se в растворах, содержащих ионы Cu2+
| Система | = E/lg C (Cu2+), мВ | Е, мВ C (Cu2+ ) = 0,1 моль/л |
| As-Ge-Te | 56-61 | + (266 295 ± 6) |
| Tl-Ge-Te | 43-58 | + (217 252 ± 6) |
| Cu-As-Te | 25-42 | + (133 222 ± 4) |
| Cu-As-Se | 32-40 | + (217 282 ± 4) |
Таблица 2.
Угловые коэффициенты () электродных функций стеклообразных сплавов систем
As-Ge-Te, Tl-Ge-Te, Cu-As-Te и Cu-As-Se в растворах, содержащих ионы Fe3+
| Система | =E/lg C (Fe3+), мВ | Е, мВ C (Fe3+) = 0,1 моль/л |
| = 0 ч | ||
| As-Ge-Te | 53-63 | + (53 63 ± 6) |
| Tl-Ge-Te | 78-111 | + (78 111 ± 8) |
| Cu-As-Te | 56-66 | + (56 66 ± 7) |
| Cu-As-Se | 56-85 | + (56 85 ± 7) |
| = 12 ч | ||
| As-Ge-Te | 54-75 | + (54 75 ± 8) |
| Tl-Ge-Te | 66-102 | + (66 102 ± 9) |
| Cu-As-Te | 53-68 | + (53 68 ± 6) |
| Cu-As-Se | 50-62 | + (50 62 ± 7) |
Диапазон угловых коэффициентов () в растворах сульфата меди для систем As-Ge-Te и Tl-Ge-Te порядка 60 мВ свидетельствует об одноэлектронном окислительно-восстановительном механизме генерации межфазного скачка потенциала. Следовательно, у электродной поверхности при взаимодействии структурных фрагментов стекла с раствором сульфата меди формируются центры с восстановленной формой редокс-пары Cu+S(xc):
![]()
![]()
![]()
Исходя из литературной информации по ионометрии для халькогенидных стеклообразных полупроводников активность меди (I) в поверхностном слое мембраны постоянна, и уравнение для потенциала электрода при ![]() = const принимает следующий вид:
= const принимает следующий вид:

где ![]() - активность ионов двухвалентной меди
- активность ионов двухвалентной меди ![]() в растворе,
в растворе, ![]() - активность ионов одновалентной меди
- активность ионов одновалентной меди ![]() в измененном
в измененном
поверхностном слое халькогенидного стекла.
Диапазон угловых коэффициентов () в растворах, содержащих ионы Cu2+, для медьсодержащих систем Cu-As-Te и Cu-As-Se порядка 30 мВ свидетельствует о протекании ионообменного механизма потенциалообразования. Из этого следует, что в процессе модификации поверхности электрода в измененном поверхностном слое появляются центры с Cu2+S (xc), которые принимают участие в ионном обмене:
![]()
![]()
![]()
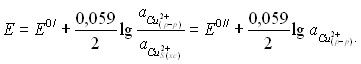
В растворах, содержащих ионы Fe3+, диапазоны угловых коэффициентов () для систем As-Ge-Te; Tl-Ge-Te; Cu-As-Te; Cu-As-Se порядка 60 мВ. Следовательно, предполагаемый механизм модификации и потенциалообразования электроннообменный. Полученные результаты с предварительной экспозицией образцов в растворе железа (III) и без вымачивания принципиально не отличаются. Это свидетельствует о том, что коррозионный процесс, связанный с образованием модифицированного слоя, происходит сразу в момент погружения электрода в раствор.
При взаимодействии электрода с раствором происходит окисление поверхности халькогенидного стекла, и на поверхности электрода адсорбируются восстановленные ионы Fe2+, которые могут образовывать труднорастворимые соединения, например, FeSe. Ионный обмен между поверхностью электрода и раствором происходит по реакции:
![]()
![]()
![]()
Активность железа (II) вблизи поверхности электрода считается постоянной, и уравнение для потенциала окислительно-восстановительного электрода при ![]() = const принимает следующий вид:
= const принимает следующий вид:
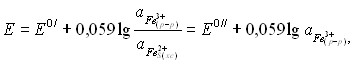
где ![]() - активность ионов трехвалентного железа
- активность ионов трехвалентного железа ![]() в растворе,
в растворе, ![]() - активность ионов двухвалентного железа
- активность ионов двухвалентного железа ![]() в измененном
в измененном
поверхностном слое халькогенидного стекла.
Таким образом, модификация поверхности стекломатериала имеет коррозионную природу и включает в себя частичную деструкцию сетки стекла, что в свою очередь приводит к изменению состава поверхности.
Благодаря этому потенциалообразование протекает по окислительно-восстановительному механизму, а химическое воздействие может быть локализовано на доступных для раствора электролита участках вследствие развития на них микротрещин.
Из приведенных данных следует, что анодноактивными на поверхности халькогенидных стекол являются наноструктуры, в которых доминируют халькогены, к которым и присоединяются восстановленные частицы окислителя.
Перенос заряда через мембрану (транспортные характеристики мембраны) также влияет на функционирование потенциометрических сенсоров, поэтому изучение электропроводности твердых материалов имеет большое значение. Халькогенидные стекла являются полупроводниками и обладают достаточно низким удельным сопротивлением, поэтому представилось интересным исследовать зависимость электрического сопротивления образцов халькогенидных стекол от концентрации катионов.
Пятая глава посвящена исследованию электрического сопротивления стеклообразных селенидных и теллуридных полупроводников в водных растворах, содержащих ионы Cu2+.
В основе потенциометрических методов лежит связь между электродным потенциалом индикаторного электрода и активной концентрацией ионов в растворе, базирующаяся на ионообменных или электроннообменных равновесиях между раствором и поверхностным слоем мембраны. Обменные взаимодействия между поверхностью индикаторного электрода и раствором должны проявляться не только на электродном потенциале, но и на поверхностном сопротивлении электрода. С целью наблюдения подобного явления для халькогенидных стеклообразных материалов было проведено исследование электрического сопротивления селенидных и теллуридных стеклообразных образцов, помещенных в растворы, содержащие катионы Cu2+.
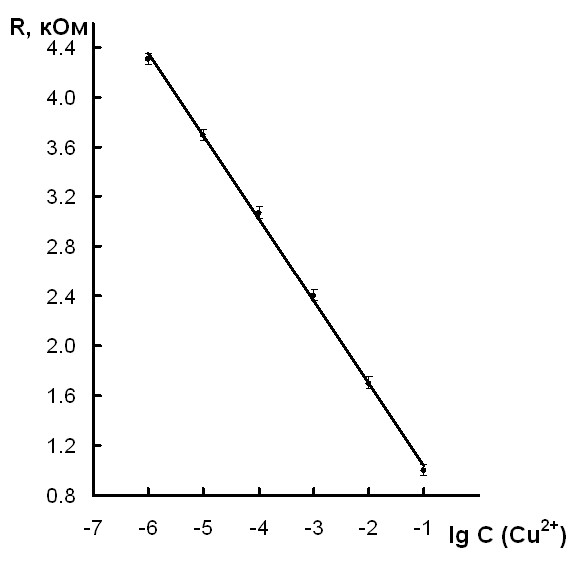
Результаты исследования зависимости сопротивления образцов системы Cu-As-Se от концентрации ионов меди Cu2+ в исследуемом растворе представлены в таблице 3, графически эти зависимости изображены на рис. 7 – 9.
Таблица 3.
Зависимость электрического сопротивления стекол и стеклокристаллов
системы Cu-As-Se от концентрации ионов меди Cu2+ в исследуемом растворе
| lg C (Cu2+) | R ± R, кОм | ||
| AsSe1,5Cu1,2 | AsSe1,5Cu1,0 | AsSe1,5Cu0,5 | |
| -1 | 1,00 ± 0,03 | 5,2 ± 0,1 | 99 ± 4 |
| -2 | 1,70 ± 0,02 | 13,3 ± 0,1 | 156 ± 3 |
| -3 | 2,48 ± 0,02 | 22,2 ± 0,1 | 245 ± 3 |
| -4 | 3,13 ± 0,02 | 30,3 ± 0,1 | 329 ± 4 |
| -5 | 3,69 ± 0,02 | 38,5 ± 0,1 | 422 ± 2 |
| -6 | 4,24 ± 0,02 | 45,1 ± 0,1 | 516 ± 2 |
| H 2 O | 4,64 ± 0,04 | 50,0 ± 0,1 | 575 ± 3 |
| Воздух | 5,27 ± 0,04 | 56,1 ± 0,1 | 685 ± 5 |

| Рис. 7. Зависимость электрического сопротивления стеклокристал-лического сплава состава AsSe1,5Cu1,2 от концентрации ионов меди Cu2+ в исследуемом растворе | Рис. 8. Зависимость электрического сопротивления стеклокристал-лического сплава состава AsSe1,5Cu1,0 от концентрации ионов меди Cu2+ в исследуемом растворе |
Были проведены попытки исследовать таким же образом теллуридные системы, а именно: GeTlTe4,15; Ge3Te17Cu0,5; AsTe1,74Cu0,48 (таблица 4). У стекол теллуридных систем наблюдается аналогичное уменьшение электрического сопротивления с увеличением концентрации ионов меди в исследуемом растворе, но из-за сильной коррозии теллуридных стекол наблюдается отклонение от линейной зависимости. Наиболее выраженная зависимость получена для стекол состава AsTe1,74Cu0,48 (рис. 10).
Таблица 4.
Зависимость электрического сопротивления стекол систем Ge-Tl-Te, Ge-Te-Cu,
As-Te-Cu от концентрации ионов меди Cu2+ в исследуемом растворе
| lg C (Cu2+) | R ± R, кОм | ||
| GeTlTe4,15 | Ge3Te17Cu0,5 | AsTe1,74Cu0,48 | |
| -1 | 1,97 ± 0,04 | 0,9 ± 0,1 | 4,50 ± 0,05 |
| -2 | 2,44 ± 0,03 | 2,2 ± 0,3 | 4,60 ± 0,06 |
| -3 | 7,01 ± 0,02 | 8,7 ± 0,4 | 4,73 ± 0,05 |
| -4 | 7,33 ± 0,03 | 34,9 ± 0,6 | 4,87 ± 0,04 |
| -5 | 7,08 ± 0,04 | 37,0 ± 0,7 | 5,00 ± 0,04 |
| -6 | 7,14 ± 0,02 | 35,0 ± 0,5 | 5,15 ± 0,03 |
| H 2 O | 8,16 ± 0,04 | 55,0 ± 0,9 | 5,46 ± 0,05 |
| Воздух | 9,27 ± 0,05 | 76,2 ± 0,9 | 6,43 ± 0,06 |
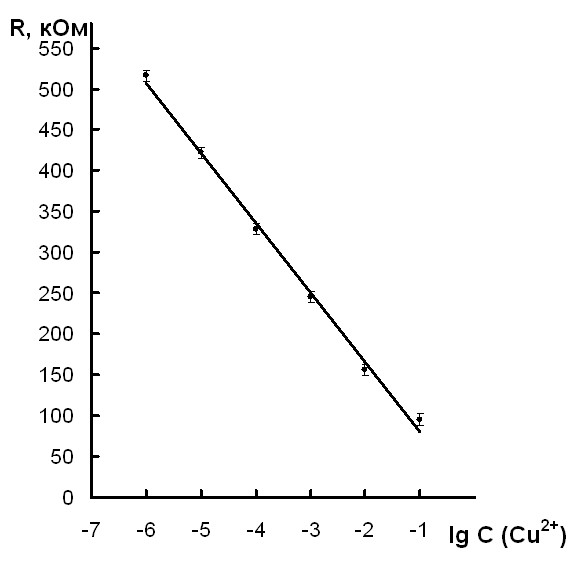
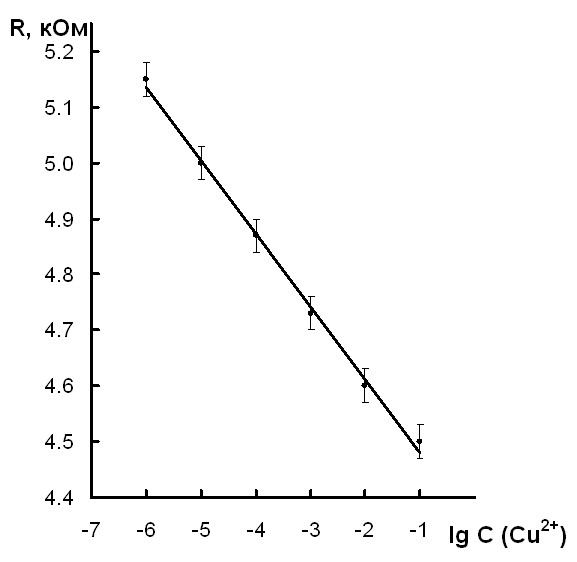
| Рис. 9. Зависимость электрического сопротивления стеклообразного сплава состава AsSe1,5Cu0,5 от концентрации ионов меди Cu2+ в исследуемом растворе | Рис. 10. Зависимость электрического сопротивления стеклообразного сплава состава AsTe1,74Cu0,48 от концентрации ионов меди Cu2+ в исследуемом растворе |
При исследовании в растворах сульфата меди электродного потенциала сплавов системы Cu-As-Se установлены практически линейные электродные функции, коррелирующие с концентрационной зависимостью электрического сопротивления этих же сплавов. В таблице 5 представлена взаимосвязь между величинами электродного потенциала Е, мВ и относительного электрического сопротивления стеклообразных сплавов Rn / R6 в растворах сульфата меди, где Rn - электрическое сопротивление (кОм) резиста в растворах, содержащих ионы двухвалентной меди, с концентрациями Cu2+ 10-n моль/л (n = 1, 2, 3, 4, 5, 6), R6 (кОм) - в растворе с концентрацией 10-6 моль/л. Графически взаимосвязь между величинами электродного потенциала и относительного электрического сопротивления стеклообразных сплавов системы Cu-As-Se в растворах сульфата меди представлена на рис. 11.
Таблица 5.
Взаимосвязь между величинами электродного потенциала Е, мВ и электрического сопротивления Rn / R6 стеклообразных сплавов системы Cu-As-Se в растворах,
содержащих катионы Cu2+
| AsSe1,5Cu1,2 | AsSe1,5Cu1,0 | AsSe1,5Cu0,5 | ||||
| lg C (Cu2+) | Rn / R6 | E, мВ | Rn / R6 | E, мВ | Rn / R6 | E, мВ |
| -1 | 0,24 | 217 | 0,12 | 230 | 0,10 | 257 |
| -2 | 0,40 | 185 | 0,29 | 197 | 0,22 | 222 |
| -3 | 0,58 | 153 | 0,49 | 163 | 0,41 | 183 |
| -4 | 0,74 | 123 | 0,67 | 133 | 0,61 | 150 |
| -5 | 0,87 | 106 | 0,85 | 113 | 0,80 | 133 |
| -6 | 1,00 | 113 | 1,00 | 125 | 1,00 | 147 |
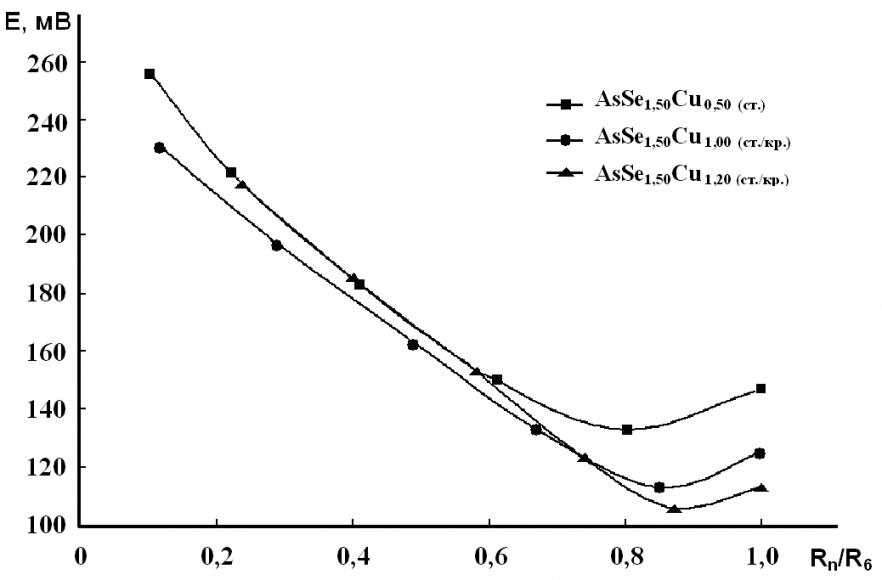
Рис. 11. Взаимосвязь между величинами электродного потенциала (Е, мВ) и относительного электрического сопротивления (Rn / R6) стеклообразных сплавов системы Cu-As-Se в растворах, содержащих катионы Cu2+
Сопротивление раствора создавалось практически постоянным. Изменение суммарной концентрации ионов, а, следовательно, и электропроводности, при переходе от первого раствора ко второму и т.д. пренебрежимо мало, кроме перехода между последними растворами, что подтверждается измерением электропроводности растворов. Удельная электропроводность растворов с концентрацией ионов меди 10-6, 10-5, 10-4, 10-3, 10-2, 10-1 моль/л, измеренная с помощью кондуктометра АНИОН 4120, равна соответственно 26,3; 26,4; 26,5; 33,7; 34,5; 37,8 мСм/см. На фоне такого незначительного изменения электропроводности и электрического сопротивления растворов изменение электрического сопротивления халькогенидных сплавов практически на порядок можно объяснить влиянием преимущественно сопротивления самого образца.
Электрическое сопротивление исследованных образцов, помещенных в стандартные растворы, приобретало стационарное значение в течение 10 - 55 мин, что свидетельствует об установлении химических равновесий на рабочей поверхности.
При взаимодействии халькогенидного стеклообразного образца с водным раствором сульфата меди происходит хемосорбция на поверхности стеклообразного резиста, которая приводит к существенной обратимой перестройке поверхностной сверхструктуры.
Таким образом, в неорганических системах, склонных к стеклообразованию, экспериментально и теоретически проанализирована проблема влияния микронеоднородного строения стеклообразных тел на их химическую стойкость и характер растворения в агрессивных средах.
Электродные свойства высокопроводящих халькогенидных стекол систем As-Ge-Te, Tl-Ge-Te, Cu-As-Te, Cu-As-Se и их взаимодействие с растворами различных редокс-систем и катионов-окислителей показали, что ионочувствительные центры образуются во фрагментах стекол на основе наноструктур, сформированных и обогащенных халькогенами, что связано с коррозией сетки стекла, приводящей к изменению состава поверхности стеклообразного материала. Поэтому на электродное поведение халькогенидных стекол оказывают влияние состав, структура и транспортные свойства мембран.
ОСНОВНЫЕ ВЫВОДЫ
1. Впервые систематически изучены электродные функции и электрическое сопротивление металлсодержащих полупроводниковых стекол в условиях их коррозии в агрессивных средах в широком диапазоне величин редокс-потенциала. Установлено влияние коррозионных процессов на электродные и резистивные характеристики халькогенидных стекол и стеклокристаллов.
2. Впервые исследованы электродные функции стекол систем Ge-As-Te, Tl-Ge-Te, Cu-As-Te, а также стекол и стеклокристаллов системы Cu-As-Se в растворах редокс-систем [Fe(CN)6]3-/[Fe(CN)6]4-, С6H4O2/С6H4(OH)2, Fe3+/Fe2+, Cr2O72-/Cr3+ в широком диапазоне редокс-потенциалов. Установлено, что отклонение электродных потенциалов изученных халькогенидных сплавов от потенциалов агрессивной окислительно-восстановительной среды связано с коррозионным селективным окислительно-восстановительным процессом, преимущественно с взаимодействием поверхности халькогенидов с окисленной формой редокс-системы.
3. Показано, что по характеру отклонения электродного потенциала стекол и стеклокристаллов в растворах редокс-систем в широком диапазоне потенциалов от редокс-потенциала среды можно оценить степень и механизм их коррозионной стойкости.
4. Проведено систематическое потенциометрическое изучение электродного поведения стекол систем Ge-As-Te, Tl-Ge-Te, Cu-As-Te, а также стекол и стеклокристаллов системы Cu-As-Se в растворах солей катионов-окислителей Cu2+ и Fe3+. Установлено, что ионометрические характеристики халькогенидных стеклообразных сплавов по отношению к указанным катионам обусловлены главным образом окислительно-восстановительным механизмом потенциалообразования после окислительной модификации мембран на основе стеклообразных сплавов, обусловленной коррозионными процессами.
5. Впервые установлен резистивный эффект в халькогенидных стеклах и стеклокристаллах, заключающийся в логарифмической зависимости электрического сопротивления полупроводниковых сплавов от активной концентрации катиона-окислителя в водных растворах, в которые погружаются халькогенидные резисты. Механизм установленного эффекта связан с коррозионной модификацией поверхности халькогенидного полупроводника. Резистивный эффект изучен на примере систем Cu-As-Se, Cu-As-Te, Cu-Ge-Te, Tl-Ge-Te в растворах, содержащих катионы Cu2+. Эффект наиболее четко проявляется у сплавов селенидной системы Cu-As-Se, которые наименее подвержены коррозии и у которых устанавливаются стационарные равновесия между частицами раствора и поверхностью халькогенида.
6. Впервые установлена взаимосвязь между электродными и резистивными функциями халькогенидных стекол, помещенных в растворы катионов-окислителей, связанная с одинаковой коррозионной природой модификации поверхности мембран электродов и резистов.
ОСНОВНОЕ СОДЕРЖАНИЕ ДИССЕРТАЦИИ ИЗЛОЖЕНО В СЛЕДУЮЩИХ РАБОТАХ:
- Фунтиков В.А., Антонова Н.Е. Электродное поведение стекол системы Ge-As-Te в водных растворах редокс-систем // Проблемы биологических и химических наук: Материалы постоянных научных семинаров. – Калининград: Изд-во КГУ, 2002. – С. 49-51.
- Funtikov V.A., Antonova N.E. The Potentiometric Method of an Estimation of Chemical stability of Chalcogenide Glass // Abstracts of Conference on Non-Crystalline Inorganic Materials (Synthesis, Structure, Modeling) «СONCIM 2003». – Bonn, 2003. – P. 120.
- Фунтиков В.А., Антонова Н.Е. Электродное поведение халькогенидных стекол в растворах редокс-систем на основе хинона и гидрохинона // Актуальные проблемы современной науки: Труды 4-й междунар. конф. молодых учёных и студентов. Естественные науки. Ч 9. Разд. «Химическая физика, физическая химия, физико-химический анализ». – Самара, 2003. – С. 103-104.
- Фунтиков В.А., Антонова Н.Е. Электродное поведение селенидных и теллуридных стекол в растворах редокс-систем неорганической и органической природы // Инновации в науке и образовании – 2003: Материалы Международной научной конференции, посвященной 90-летию высшего рыбохозяйственного образования в России. – Калининград: Изд-во КГТУ, 2003. – С. 390.
- Funtikov V.A., Antonova N.E. Electrode Behavior of Chalcogenide Glasses in Solutions of Organic and Inorganic Redox Systems // Proceedings of the Norbert Kreidl Memorial Conference (NKMC-2004) Glasstech. Ber. Glass Sci. Technol. 77 C. – Trencin, 2004. – P. 364-367.
- Фунтиков В.А., Антонова Н.Е. Редокс-потенциометрия халькогенидных стекол // Актуальные проблемы неорганической и аналитической химии: Межвуз. тематич. сб. науч. тр. / Под ред. В.А. Фунтикова. – Калининград: Изд-во РГУ им. И. Канта, 2005. – Вып. 1. – С. 43-47.
- Фунтиков В.А., Антонова Н.Е. Механизм влияния катионов Fe(III) на характеристики ионоселективных электродов на основе халькогенидов // Актуальные проблемы современной науки: Труды 3-й междунар. конф. молодых учёных и студентов. Естественные науки. Ч. 4-6. Секции: Физика. Химия. Науки о Земле. – Самара, 2002. – С. 96-97.
- Фунтиков В.А., Антонова Н.Е. Железоселективные электроды на основе модифицированных халькогенидных стекол для мониторинга окружающей водной среды // Экоаналитика-2003: Труды V Всероссийской конференции по анализу объектов окружающей среды – СПб., 2003. – С. 283.
- Funtikov V.A., Antonova N.E. Electrode Properties of Selenide and Telluride Glasses in Solutions of Copper And Iron Salts // Book of Extended Abstracts of ISNOG 13. – Pardubice, 2002. – P. 724-727.
- Фунтиков В.А., Антонова Н.Е. Ионорезистивный эффект в халькогенидных стеклах // Инновации в науке и образовании – 2004: Материалы Международной научной конференции, посвященной 100-летию КГТУ. – Калининград: Изд-во КГТУ, 2004. – С. 238-239.
- Фунтиков В.А., Антонова Н.Е. Ионорезистивный эффект в стеклах и стеклокристаллах системы медь-мышьяк-селен // Актуальные проблемы современной науки: Труды 5-й междунар. конф. молодых учёных и студентов. Естественные науки. Ч. 8: Химия. Физическая химия. – Самара, 2004. – С. 64-65.
- Фунтиков В.А., Антонова Н.Е., Юрченко О.В. Ионочувствительность резистов на основе селенидных и теллуридных стекол // Актуальные проблемы современной науки: Труды 1-го Междунар. форума. – Самара, 2005. – С. 103-104.
- Фунтиков В.А., Антонова Н.Е. Ионорезистивный эффект в халькогенидных стеклах и стеклокристаллах // Вестник РГУ им. И. Канта. – 2007. – Вып. 1. – С. 72-80.
Статьи в ведущих рецензируемых научных журналах, включенных
в перечень ВАК
- Фунтиков В.А., Антонова Н.Е. Ионорезистивный эффект в поверхностных слоях стекол и стеклокристаллов систем Cu-As-Se и Cu-As-Te // Физика и химия стекла. – 2007. – Т. 33. – № 2. – С. 117-122 (Funtikov V.A., Antonova N.E. Ion-Resistive Effect in Surface Layers of Glass and Glass-Ceramics in the Cu-As-Se and Cu-As-Te systems // Glass Physics and Chemistry. – 2007. – Vol. 33. – No. 2. – P. 183-186).
- Фунтиков В.А., Антонова Н.Е. Новый тип ионорезистивных датчиков для проведения химического экспресс-анализа растворов солей меди // Заводская лаборатория. – 2007. – № 5. – С. 28-29.
Антонова Наталья Евгеньевна
ЭЛЕКТРОДНЫЕ И ЭЛЕКТРОРЕЗИСТИВНЫЕ СВОЙСТВА ХАЛЬКОГЕНИДНЫХ СТЕКЛООБРАЗНЫХ СПЛАВОВ
СИСТЕМ As-Ge-Te, Tl-Ge-Te, Cu-As-Te, Cu-As-Se
В УСЛОВИЯХ ИХ КОРРОЗИИ
Автореферат
диссертации на соискание ученой степени
кандидата химических наук
Подписано в печать 01.06.2007 г. Формат 60х90 1/16.
Бумага для множительных аппаратов. Ризограф. Усл. печ. л. 1,5.
Уч.-изд. л. 1,0. Тираж 100 экз. Заказ.
Издательство
Российского государственного университета имени Иммануила Канта
236041, г. Калининград, ул. А. Невского, 14.

